
电化学专题训练
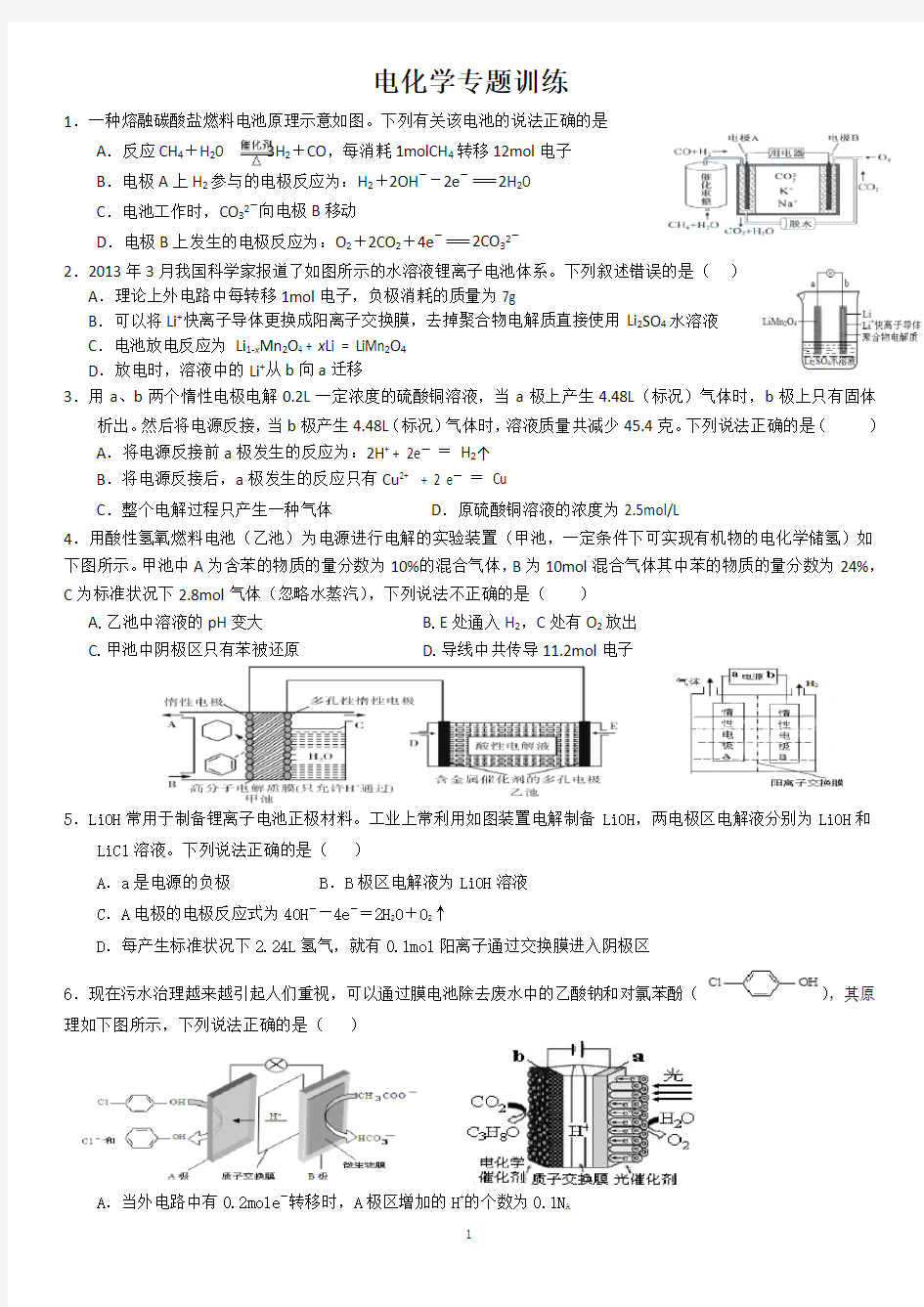
1.一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
A.反应CH4+H2O 3H2+CO,每消耗1molCH4转移12mol电子
B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
2.2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是()
A.理论上外电路中每转移1mol电子,负极消耗的质量为7g
B.可以将Li+快离子导体更换成阳离子交换膜,去掉聚合物电解质直接使用Li2SO4水溶液
C.电池放电反应为Li1-x Mn2O4 + x Li = LiMn2O4
D.放电时,溶液中的Li+从b向a迁移
3.用a、b两个惰性电极电解0.2L一定浓度的硫酸铜溶液,当a极上产生4.48L(标况)气体时,b极上只有固体析出。然后将电源反接,当b极产生4.48L(标况)气体时,溶液质量共减少45.4克。下列说法正确的是()A.将电源反接前a极发生的反应为:2H+ + 2e—=H2↑
B.将电源反接后,a极发生的反应只有Cu2+ + 2 e—=Cu
C.整个电解过程只产生一种气体D.原硫酸铜溶液的浓度为2.5mol/L
4.用酸性氢氧燃料电池(乙池)为电源进行电解的实验装置(甲池,一定条件下可实现有机物的电化学储氢)如下图所示。甲池中A为含苯的物质的量分数为10%的混合气体,B为10mol混合气体其中苯的物质的量分数为24%,C为标准状况下2.8mol气体(忽略水蒸汽),下列说法不正确的是()
A.乙池中溶液的pH变大
B.E处通入H2,C处有O2放出
C.甲池中阴极区只有苯被还原
D.导线中共传导11.2mol电子
5.LiOH常用于制备锂离子电池正极材料。工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法正确的是()
A.a是电源的负极 B.B极区电解液为LiOH溶液
C.A电极的电极反应式为4OH――4e-=2H2O+O2↑
D.每产生标准状况下2.24L氢气,就有0.1mol阳离子通过交换膜进入阴极区
6.现在污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚(),其原理如下图所示,下列说法正确的是()
A.当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.1N A
B.A极的电极反应式为+ e-=Cl-+
C.电流方向从B极沿导线经小灯泡流向A极 D.B为电池的正极,发生还原反应
7.某模拟“人工树叶”电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和C3H8O。下列说法错误的是( ) A.该装置将光能和电能转化为化学能
B.该装置工作时,H+从a极区向b极区迁移
C.每还原44 g CO2,理论上可生成33.6L O2
D.b电极的反应为:3CO2+18H++18e-=C3H8O+5H2O
8. 利用光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极, CO(NH2)2 中的氮元素显-3价)。
下列叙述中正确的是( )
A.工作时,A极的电极上CO(NH2)2 放电生成N2 反应为还原反应
B.工作时,B极的电极反应式为2H2O+ 2e-===2OH-+H2↑
C.N型半导体为正极,P型半导体为负极D.制氢装置溶液中电子流向:从B极流向A
9.金属锰在冶金工业和钢铁工业中均有重要作用。可用如图原理制备金属锰,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向。下列说法不正确
...的是
A.M是电源的负极
B.右侧气孔逸出的气体为O2
C.阳极发生氧化反应
D.电解槽中发生的总反应为MnSO4+2H2O MnO2+H2↑+H2SO4
10.(1)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应式
为;其中可循环使用的物质是。
(2)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如下图所示装置模拟上述过程,则Co2+在阳极的电极反应式为;除去甲醇的离子方程式为。
(3)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图所示(阳离子交换膜只允许阳离子透过)。通电后阳极的电极反应式为。请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因。
KOH
(4) 已知甲醇燃料电池的工作原理如图所示。该电池工作时, b 口通入的物质为___________,该电池正极的6.4 g 甲醇(CH 3OH )完全反应生成CO 2时,电子发生转移。
(5)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO 2零排放,其基本原理如图所示: ①上述生产过程的能量转化方式是 。
②上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO 和CO 2,电解质为熔融碳酸钠,阳极的电极反应式为2CO 32-
-4e -
=2CO 2↑+O 2↑,则阴极的电极反应式为 。
(6).含有乙酸钠和对氯苯酚的酸性废水,可利用微生物电池法除去,其原理如题11﹣2图所示
①B 是电池的______极(填“正”或“负”);
②酸性条件下,A 极的电极反应式为______________________________。
③设电极两边溶液分别为1L ,反应一段时间后,A 极区溶液的pH 从4变到1,此过程中处理的乙酸钠的质量为____g 。
(7)根据2CrO 42—
+2H +Cr 2O 72—
+H 2O ,设计右图装置(均为惰性电极)电解Na 2CrO 4溶液制取Na 2Cr 2O 7。Na 2Cr 2O 7中铬元素的化合价为 ,图中右侧电极连接电源的 极,其电极反应式为 。
(8)电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO 3-
的原理如下左图所示,电源正极为 (填“a”
或“b”);若总反应为4NO 3-
+4H +=5O 2↑+2N 2↑+2H 2O ,当阴极产生1mol 气体时,则阴极溶液的质量减轻 g 。
(二)高铁酸钾(K 2FeO 4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。
(9)一定条件下Fe(OH)3与KClO 在KOH 溶液中反应可制得K 2FeO 4,目前,人们针对K 2FeO 4的稳定性进行了大量的
探索,并取得了一定的进展。下列物质中有可能提高化合物K 2FeO 4水溶液稳定性的是 A .亚硫酸钠 B .KOH C .醋酸 D .Fe(NO 3)3
(10)从环境保护的角度看,制备K 2FeO 4较好的方法为电解法,其装置如上右图所示。电解过程中阳极的电极反应
式为 。
(11)镁/间二硝基苯电池工作时镁转变为氢氧化镁,间二硝基苯则转变为间二苯胺。间二硝基苯、间二苯胺的结构简式和镁/间二硝基苯电池的装置如下:
该电池放电时的总反应方程式为______________________。 (12)电化学降解NO 2-的原理如下图: ①电源的负极是 (填A 或B )阴极反应式为
。
②若电解过程中转移了6mol 电子,则膜两侧电解液的质量变化差()m m ?-?右左为
g 。
11 下图所示的四个容器中分别盛有不同的溶液,除a 、b 外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理
为:Pb+PbO 2+2H 2SO 4???→←???放充电
电
2PbSO 4+2H 2O ,其两个电极的电极材料分别为PbO 2和Pb 。闭合K ,发现g 电极附近的溶液先变红,20min 后,将K 断开,此时c .、.d .两极上产生的气体体积相同............;据此回答:
(1)a 电极的电极材料是
(填“PbO 2”或“Pb”)。 (2)丙装置中发生电解的总反应方程式为
。
(3)电解20min 时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量
是
。
(4)20min 后将乙装置与其他装置断开,然后在c 、d 两极间连接上灵敏电流计,发现电流计指针偏转,则此时
c 电极为
极,d 电极上发生反应的电极反应式为
。
(5)电解后取a mL 丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH 3COOH 溶液,当加入b mL CH 3COOH
溶液时,混合溶液的pH 恰好等于7(体积变化忽略不计)。已知CH 3COOH 的电离平衡常数为1.75×10-5,则a /b =
。
12.(1)二甲醚[CH 3OCH 3]燃料电池的工作原理如下图一所示。
① 电池正极的电极反应式为:
②电池在放电过程中,b 对应的电极周围溶液的pH 。(填“增大”、“减小”或“不变”) (2)以上述电池为电源,通过导线与图二电解池相连。
①X 、Y 为石墨,a 为2L 0.1mol KCl 溶液,写出电解总反应的离子方程式: ②X 、Y 分别为铜、银,a 为1L 0.2mol /L AgNO 3溶液,写出Y 电极反应式:
(3)室温时,按上述(2)①电解一段时间后,取25mL 上述电解后溶液,滴加0.4mol /L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①结合图三计算,上述电解过程中消耗二甲醚的质量为 。 ②若图三的B 点pH=7,则滴定终点在 区间(填“AB ”、“BC ”或“CD ”)。 ③C 点溶液中各离子浓度大小关系是