
表达重组包涵体蛋白的变性溶解及复性研究概述
高应瑞(译)
目前,由于基因组序列数据库的快速扩增,重组蛋白的规模化生产已经成为迫切需要。因此,通过基因重组生产蛋白质,必须考虑其蛋白特性和活性构象,以确定它们的生物学功能。如果蛋白质的功能以及其基因的生物学功能未知,无论该蛋白质是在天然结构或在非天然结构,都不能通过生物活性评估来对其进行评估。至今为止,有越来越多的异源重组蛋白成功得到表达。其中大肠埃希氏菌(大肠杆菌)是最常使用的表达系统。然而, 在大肠杆菌中异源表达外源基因往往会导致表达蛋白形成不溶性包涵体(IBS)。包涵体必须经过变性溶解及复性过程后才会恢复其蛋白的生物活性。包涵体复性过程的是一个非常复杂的过程,往往需要经过大量的反复试验才能确定其复性工艺参数。在无活性的包涵体到具有生物活性蛋白的过程中,有两个最重要的影响因素:即包涵体的变性与复性。包涵体蛋白的溶解必须使其蛋白肽链单分子进行分散并使最大程度减少蛋白质分子肽链内以及肽链之间的相互作用。溶剂的选择,如尿素,盐酸胍,或洗涤剂等,在包涵体溶解过程中起关键作用,蛋白质变性溶解之后进行复性。
包涵体蛋白溶解后,即可进行蛋白复性。蛋白复性过程不是单一反应,而蛋白的正确折叠与错误折叠和蛋白聚集的竞争过程。在蛋白复性的竞争过程中,蛋白的复性率主要取决于变性剂的最终浓度以及溶剂的条件。本文主要讨论的重点是复性工艺中对变性剂去除方式、溶剂、小分子添加剂以及工艺条件。
小分子添加剂的作用来自其在体内的功能定位。小分子添加剂能够在生物体缺水的情况下维持体内蛋白质的稳定性,因此被命名为渗透剂[1,2]。在另一个实例中,基因突变,蛋白的错误折叠常常导致蛋白的失活,从而导致机体生长的异常或某些细胞功能的异常。实验已证明在某些小分子添加剂的存在时,这些失活蛋白质能够恢复正常功能,而且细胞能够生长正常。由于小分子能够帮助蛋白质正确折叠,因此他们也被称为化学伴侣。许多小分子添加剂都是渗透剂和化学伴侣。因此,可以确定,无论在体外和体内某些小分子能有效地促进蛋白质的正确折叠及稳定蛋白质结构。
1.包涵体蛋白的变性溶解
尿素,盐酸胍,和强离子洗涤剂如N-月桂酰肌氨酸是最常用的溶解剂。在变性剂溶液中溶解包涵体已经是被公认的一种方法,但是很少有报道,在变性溶液中可能会形成一些低聚合物。在变性剂溶液中,由于变性剂离子的作用,在蛋白复合物之间产生强大的静电斥力,进而将包涵体分散为单分子结构。
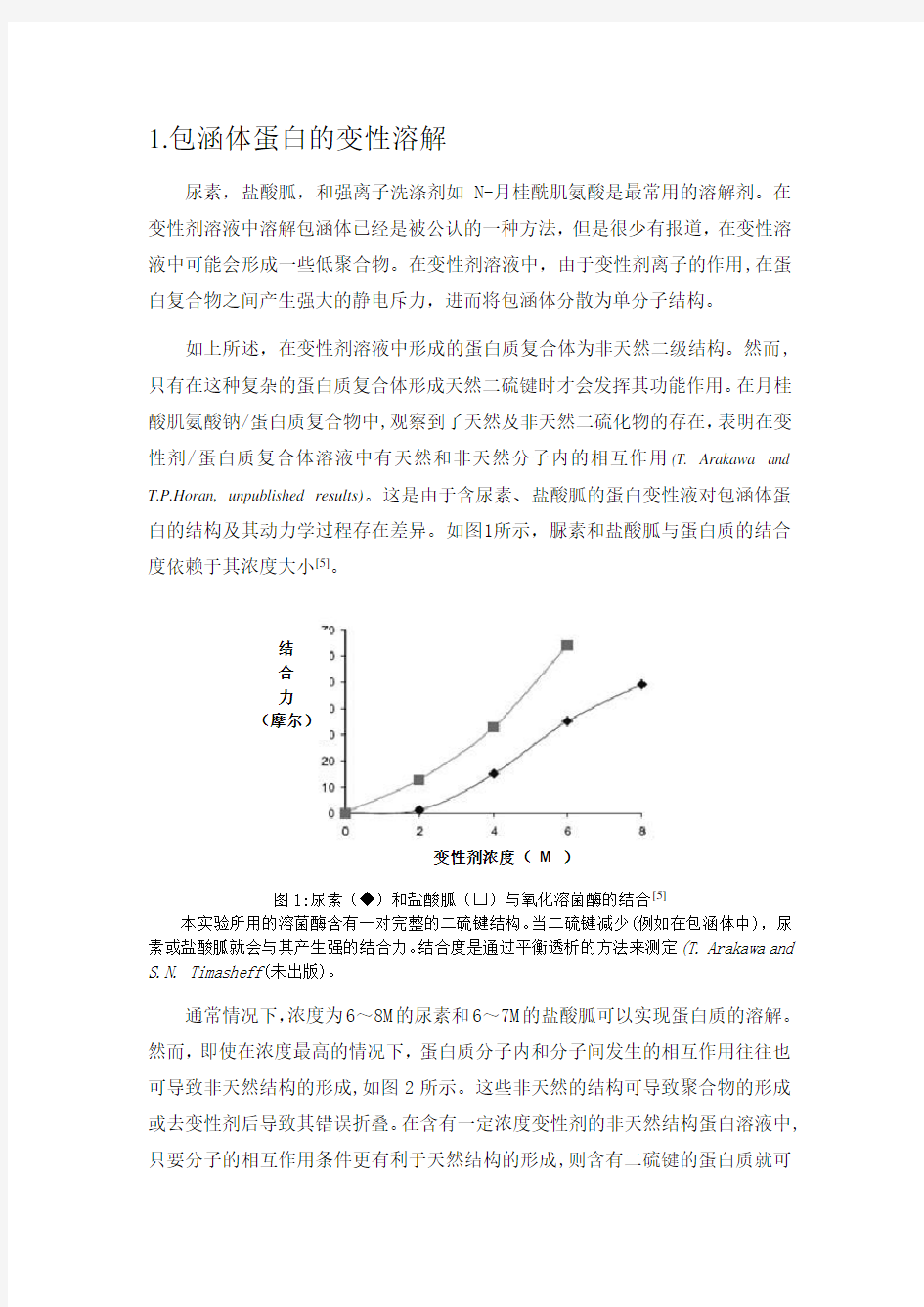
如上所述,在变性剂溶液中形成的蛋白质复合体为非天然二级结构。然而,只有在这种复杂的蛋白质复合体形成天然二硫键时才会发挥其功能作用。在月桂酸肌氨酸钠/蛋白质复合物中,观察到了天然及非天然二硫化物的存在,表明在变性剂/蛋白质复合体溶液中有天然和非天然分子内的相互作用(T. Arakawa and T.P.Horan, unpublished results)。这是由于含尿素、盐酸胍的蛋白变性液对包涵体蛋白的结构及其动力学过程存在差异。如图1所示,脲素和盐酸胍与蛋白质的结合度依赖于其浓度大小[5]。
结
合
力
(摩尔)
变性剂浓度(M )
图1:尿素(◆)和盐酸胍(□)与氧化溶菌酶的结合[5]
本实验所用的溶菌酶含有一对完整的二硫键结构。当二硫键减少(例如在包涵体中),尿素或盐酸胍就会与其产生强的结合力。结合度是通过平衡透析的方法来测定(T. Arakawa and S.N. Timasheff(未出版)。
通常情况下,浓度为6~8M的尿素和6~7M的盐酸胍可以实现蛋白质的溶解。然而,即使在浓度最高的情况下,蛋白质分子内和分子间发生的相互作用往往也可导致非天然结构的形成,如图2所示。这些非天然的结构可导致聚合物的形成或去变性剂后导致其错误折叠。在含有一定浓度变性剂的非天然结构蛋白溶液中,只要分子的相互作用条件更有利于天然结构的形成,则含有二硫键的蛋白质就可
以形成天然的二硫键结构。在变性剂含量降为中等浓度时(如图1所示),其(尿素和盐酸胍)与蛋白质的结合力也降低,因此,蛋白质分子开始重新折叠。因此,它有可能通过调节盐酸胍和尿素的浓度来调节其与蛋白的结合力,来提高蛋白的复性效率。这种情况不包括洗涤剂在内。洗涤剂与蛋白的结合力决定于其临界胶团浓度(CMC)的大小。这种胶团结合往往在临界胶团浓度之上,即变性非折叠蛋白溶解性好的条件下发生,而这种胶团结合不能或者很少能在临界胶团浓度之下,即蛋白溶解性差的条件下发生[6]。
天然构象
内部分子间的相互作用
分子间的相互作用
图2:非天然结构中分子内与分子间的相互作用[6]
图中所示(图上),天然状态模型的蛋白质有相互作用的螺旋结构(A和B)和彼此间隔较远的疏水区(C 和D)。这种螺旋结构的相互作用在非折叠状态时即消除,而非折叠状态下分子内部(图中右)及分子间(图中下)发生疏水区C和D之间的疏水相互作用。
这表明,只有在洗涤剂存在的条件下,蛋白复性过程才能发生,否则,去除洗涤剂后,蛋白质结构和溶解度又将形成原包涵体。
2.蛋白复性
复性过程是蛋白质构象从展开状态到折叠状态的变化过程。包涵体只能由强变性剂溶解,使其蛋白质成展开状态,其溶解程度主要取决于蛋白质本身及其所使用的变性剂类型。包涵体经过变性剂溶解后的蛋白质为高度可溶性。与纯化的蛋白复性研究不同,包涵体溶解蛋白含有蛋白表达系统产生的杂质,其可能干扰蛋白质的复性。因此,为了减少杂质对复性过程的干扰,可以先对该蛋白质进行纯化。
如图3所示,复性过程是蛋白质构象从展开状态到折叠状态的的变化过程。在高浓度变性剂条件下,蛋白质呈展开(无序)状态,高灵活性及高溶解性。在复性缓冲溶液中,蛋白质呈有序折叠状态,为刚性好,结构紧凑的构象。在理想的情况下,蛋白质分子从高浓度变性剂到复性缓冲溶液将使蛋白质复性,即蛋白质分子将有序折叠成为紧凑的结构。然而,这样一个剧烈的过程通常很难发生,因为条件的剧烈变化会导致其分子的错误折叠和聚集。一旦蛋白分子错误折叠或聚集,在没有变性剂存在的条件下,蛋白分子将不可能自行解聚以及重新折叠成天然构象。如图3所示,复性的关键在变性剂合适的浓度,当变性剂浓度足够低时,以迫使蛋白质分子解聚,并且解聚的蛋白分子溶液可以重新折叠为有序构象。蛋白复性过程中变性剂的最适浓度主要取决于蛋白质以及变性剂浓度的减少方式。
天然构象
折叠度
折叠状态:刚性好,结构紧凑的构象
展开状态:
无序性、高灵
活性、高溶解变性剂浓度
中间构象
图3:变性剂浓度对蛋白质的构象,灵活性,和溶解度的影响
以折叠程度为纵坐标,以变性剂浓度为横坐标作图。蛋白质溶液的物理性质主要在变性剂浓度的高低。
平衡展开研究已经证明了在变性剂条件下, 当变性剂浓度为某一浓度时会产生中间体结构(图4:I)。如图4所示,在复性过程中也会有这样的中间结构产生。但该中间结构不稳定且不易溶解,因此很容易产生错误折叠和聚集。因此, 为了保持中间体的溶解性和灵活性,使中间体更加有效折叠成更稳定的天然结构(N)显得尤为重要。在蛋白质复性过程中,蛋白是直接折叠为有活性构象还是经过中间结构再折叠为活性构象主要取决于对变性剂浓度的减少及小分子添加剂的添加量。
聚集错误折叠/聚集
图4:复性过程示意图。其中,U、I、N分别对应蛋白展开状态,中间结构和蛋白质有序折叠的天然状态含有二硫键的蛋白质即使在高浓度变性剂存在条件下也可以发生图5所示的构象的重新折叠。也就是说,该种条件下蛋白质分子仍然可以在展开状态和天然构象结构之间变化,并能形成天然的二硫键结构[U(SS)]。然而,在高浓度变性剂条件下天然二硫键形成的速率及概率大大降低。图5所示,无论是A组两种构象的转换还是B组三种构象的转变,在低浓度变性剂条件下都会加速蛋白质二硫键的形成。虽然低浓度变性剂将增加复性效率,但可能会迫使蛋白质错误折叠成非天然二硫键结构。一旦形成非天然二硫键结构,由于变性剂浓度太低,蛋白质构象不能重组,从而无法重新折叠为天然结构。
图5:蛋白折叠与二硫键的形成。A 与B 分别表示了二硫键的形成以及构象变化过程
天然二硫键是在一定的变性剂条件下形成,因此不能保证其天然构象的形成是通过移除变性剂来实现的。在天然二硫键的形成过程中,仍然有很大一部分蛋白质是展开状态,而且变性剂突然去除可能会导致错误构象的形成。因此,变性剂被去除的方式,可以影响复性效率。
下面我们讨论的是洗涤剂的作用差异性。如图6所示,洗涤剂与分子的胶团结合往往在临界胶团浓度之上发生,在临界胶团浓度之下为单分子之间的单一结合。在单分子间的结合条件下蛋白质极度不溶,而在洗涤剂与分子胶团结合条件下蛋白质为高度溶解[7]。
图6:强浓度洗涤剂N -团浓度之下则发生分子间的单分子结合
[7] 由于没有中间结构的形成,所以当蛋白质溶解在洗涤剂混合液中时没有二硫化物形成,因此不能通过降低洗涤剂浓度至临界胶团浓度之下来诱导折叠。复性,是一个由蛋白结构的中间体结构与活性和非活性结构之间的动态平衡过程,天然结
合
力 临界胶团浓度 洗涤剂的浓度 单分子间
单一结合 洗涤剂与分子的胶团结合
结构与错误折叠或蛋白聚集之间竞争。因此,最佳复性一方面要求变性蛋白崩溃而进行重新折叠,另一方面维持分子的溶解度和灵活性。这种平衡可以通过由两个不同的手段来实现。其一是变性剂浓度的减少方式。无论是是透析或稀释,任何过程都必须经过最佳适宜的变性浓度。变性剂移除的速率快慢与蛋白分子在适度变性浓度中存在的时间长短都决定了蛋白的折叠率和折叠中间体的灵活性、溶解度。此外,对其蛋白的正确折叠与错误折叠或聚集速率可以通过小分子添加剂进行控制。小分子添加剂,可以提高蛋白灵活性或溶解度。以下,我们分别描述了这两个参数,但在复性过程中,应结合这两个参数寻求最佳优化条件。首先,我们讨论减少变性浓度的各种方式。
2.1一步透析复性
在一定浓度的变性溶液中,变性蛋白样品在复性缓冲液中透析,从而达到降低变性剂浓度的目的。如图7-A所示,随着时间增加变性剂浓度逐渐减少,最后达到复性溶剂浓度。随着变性剂的浓度降低,折叠为到中间体和天然构象的速率增加。但同时错误折叠和蛋白聚集的速率也相应增大。特别是,由于变性剂从中浓度到低浓度变化过程中不足以维持展开状态或不足以使中间体维持溶解状态,因此,如果在该过程中折叠速率太低,蛋白聚合将会大大增强。在透析复性时,中间体结构可能会长期暴露于中间浓度变性剂中。此方法对处理在展开状态或中间体可溶的蛋白质成功几率更大。需要指出的是,虽然变性剂浓度降低,但由于盐酸胍或尿素的高渗透压,溶液体积会膨胀,从而使蛋白质浓度保持相对恒定。这意味着,在变性剂中蛋白的初始浓度是至关重要的。
2.2分步透析复性
该透析方法来降低变性剂浓度已成功应用于抗体蛋白的复性[8,9]。如图7B-1所示,首先将伸展状态的蛋白样品置于高浓度变性剂溶液中,然后置于中等浓度的变性剂缓冲液中(7B-2),最后置于低浓度变性剂缓冲液中(7B-3)。其与一步透析的区别在于每个变性剂浓度平衡的建立。然而,如图8所示,如果错误折叠或聚集率(kmis/agg)高于复性速率(kref)。那么这种方法将不起作用。但该方法有一个好处就是错误折叠或聚集的中间体在中间浓度的变性剂存在的条件下,可以重新进行复性,尤其是在一些含有二硫键的氧化型与还原型二硫结构的相互转
换过程中。在每个变性剂的浓度,折叠中间体都可能形成错误折叠或聚合。然而,中间浓度的变性剂可能会使蛋白分子转换为含有正确二硫键结构的天然构象。在高浓度变性剂平衡液中可能折叠为最稳定结构域。可能这个特殊的领域在高浓度变性剂环境下较低浓度更有利于其存在,同时在一步透析方法中,这种结构域不稳定,在复性中可能会导致错误折叠。
图7:透析复性。A 组:透析过程中变性剂浓度的变化。B 组:从高浓度的变性剂(1),通过中间浓度
(2),到低浓度(3)分步进行透析。C 组:在透析过程中,在透析袋中的变性蛋白在高变性剂浓度的溶剂中平衡。逐渐抽入复性缓冲溶剂,同时将透析液逐渐抽出。在复性透析过程中,变性剂浓度的溶剂将逐渐降低[10]
2.3梯度递减变性剂浓度透析
如图7-C 所示,为变性剂浓度递减的一步透析法[10]。在高浓度变性剂中的变性蛋白装入透析袋后置于变性剂溶液中,将透析液逐渐抽出,同时逐渐抽入复性缓冲液,透析过程中溶剂的泵出速率和复性液的泵入速率决定了变性剂浓度梯度减少。如果速度太快,它将类似于一步透析法,如果速度缓慢,它又类似于多变性剂
透析时间 泵
变
性
剂
浓
度 复性剂
复性剂
步透析法。
折叠增强剂
聚集抑制剂
错误折叠
聚集
图8:折叠和聚集。参数kref,kmis/Agg,Kex,分别表示复性率从I到N的复性速率,错误折叠或聚集速率,从错误折叠或聚合体到I中间体的反应速率,当错误聚集抑制剂减少了从I到错误折叠或聚集体形成速率时,折叠增强剂便能增强U到I和I到U的反应
2.4凝胶过滤交换法
凝胶过滤柱在复性缓冲液中平衡。将变性液中的展开状态的蛋白质上柱,用复性缓冲液进行洗脱。使用脱盐柱将使蛋白质与变性剂分离,而使用按蛋白质大小分离柱将分离得到不同片段大小的蛋白质。在一次透析复性过程中,变性剂浓度逐渐递减,同样,在凝胶过滤法中变性剂浓度也逐渐减少。如果展开结构或中间折叠结构转换为天然结构的速率慢于转换为错误折叠或聚集体的速率,那么随着变性剂浓度的逐渐降低错误折叠构象将没有足够的时间转换为天然结构。另外,长时间暴露在中间变性浓度可能会导致蛋白质聚集或错误折叠。与透析的区别在于在其蛋白在折叠过程中柱模型所处的环境不同。在能够防止蛋白错误折叠与聚集的中间变性剂浓度下的蛋白折叠过程中,凝胶柱可能通过氢键和疏水作用与蛋白相互作用。而且柱模型可以使蛋白分散,有效减少了蛋白聚集。该方法已经成功应用于盐酸胍溶解的人白介素-6(IL-6)的复性[11]。在这种情况下,溶解于盐酸胍中的IL-6首先被氧化形成正确的二硫键,然后通过G-25凝胶过滤柱在复性缓冲液平衡进行蛋白复性。这也证明正确二硫键的形成是复性的前提条件,但对IL-6来说还形成正确的二硫键还不足以成功复性。即使形成正确的二硫键后,优化盐酸胍去除方法对于天然结构的形成也是非常必要的。
2.5稀释法复性
高变性剂浓度蛋白质样品加入到大量的复性缓冲液中。稀释法没有经过中间变性剂浓度,因此展开蛋白在稀释过程中会迅速崩溃。所以,在稀释复性过程中有几个参数需要考虑。首先,如图9所示,在正常稀释法中,将在变性剂中的展开蛋白加入到复性液中时,蛋白质浓度与变性剂浓度都在增加,例如将6M 盐酸胍溶解的蛋白质溶液加入到复性缓冲液中稀释6倍后,复性缓冲液盐酸胍浓度从0M 变为1M 。如果没有低浓度变性剂浓度的存在,稀释至缓冲溶液后将迅速崩溃形成一些刚性结构,而不再能进行结构的转变以及不能转换为天然结构。因此,我们建议在最终应该含有一定浓度的变性剂,浓度的大小主要取决于蛋白复性后的稳定性。第二,对于低聚蛋白,在稀释复性的早期阶段,变性剂浓度几乎为0,蛋白质浓度较低。因此,缓慢稀释可能导致变性剂浓度与蛋白浓度的不足而不能进行很好的复性,蛋白会以较长时间的单体状态存在,因此,建议用快速稀释法。第三,如果为了避免蛋白的聚集要求以较低浓度,脉冲稀释法可能更适用。
图9:稀释复性。左边组中为一般稀释法。右侧组为反稀释法
2.6反稀释法复性
一般稀释法 反稀释法 终浓度 变
性
剂
浓
度 初始浓度
蛋白质浓度
初始浓度
终浓度
变
性 剂
浓
度 蛋白质浓度
反向稀释是将复性缓冲液加入到含有一定浓度变性剂的展开状态蛋白质溶液中,该情况下无论是变性剂和蛋白的浓度,都同时降低(图9:反向稀释)。与稀释法不同,在中间浓度变性剂中蛋白质浓度较高。这样的条件下会导致蛋白的聚集和沉淀。然而,如果在中间的变性剂浓度的条件下,中间结构为可溶和复性需要缓慢的结构重排,这个方法可能比较适用。
混合法复性
复性缓冲液与展开蛋白溶液以一定比例进行混合。该过程与稀释和反稀释不同,过程中,复性蛋白质和变性剂浓度保持不变。与稀释复性过程的蛋白折叠过程类似的,即在,混合也将导致蛋白质迅速崩溃形成一种中间结构。
变性剂浓度蛋白质浓度
混合
未折叠蛋白复性溶剂
混合器
收集容器
图10:混合复性。未折叠蛋白和复性缓冲液混合。例如,通过泵,以固定的比例混合。在恒定的比例混合,折叠过程中变性剂和蛋白含量保持恒定
2.7脉冲稀释法复性
稀释被分为相同的几个阶段,而不是连续的模式。在脉冲稀释中取变性蛋白质溶液平分为几组,每组加入至复性溶剂中开始复性,复性一定时间后再加入相同的变性蛋白溶液继续进行复性。该方法将有效避免在一步稀释复性中出现的高浓度的折叠中间体的聚集。该方法可能使用于展开或折叠蛋白中间体不发生聚集时的复性。
2.8固相复性
图11所示,在变性剂存在的情况下,变性蛋白首先与固体基质(如镍树脂或离子交换树脂)以非共价结合。然后变性剂浓度减少为初始复性液浓度。由于蛋白质分子与树脂结合,该过程中减少了展开蛋白的聚集和折叠中间体的形成。
图11:柱复性。在变性剂溶液中存在两种蛋白结合力。在A 类型中,展开蛋白与固体基质有两种结合力,一种为末端的His-tag ,另一种为多肽末端的氨基酸残基。这种多种的结合可能导致蛋白的错误折叠。
在B 类型中,非折叠蛋白仅仅通过His-tag 与固体基质进行结合,进行复性成为天然结构
如图11下面组所示,如果蛋白与固体基质以多价结合,蛋白质分子则不能进行蛋白的折叠过程。即使是单价结合,由于空间位阻或重要蛋白分子的结合位点,折叠可能会受到干扰。为了克服这个问题,复性进行下弱游离的条件下即蛋白可以与树脂进行可逆性结合条件下进行。
3 小分子物质助溶
错误折叠
复性剂 复性剂
正确折叠
变性剂
小分子物质(溶质)通常被添加到复性溶剂中,以协助蛋白折叠。在一般情况下,特别是通过稀释复性,复性溶剂中均含有低浓度的尿素或盐酸胍。这个浓度是足够低,以能保持高效复性,但高到足以维持折叠中间体的溶解度和灵活性。然而,仅有尿素或盐酸胍是不够的,共同的溶质往往是必不可少的。没有该小分子的存在,复性会产生不同程度的聚合或错误折叠。这种小分子物质可分为两种,一种为增强折叠,另一种为抑制聚集,见表1所示。
表1:小分子添加物的分类
分类溶质-作用模式蛋白稳定性的
影响蛋白内部相互作用
的影响
折叠增强剂蔗糖
硫酸铵
稳定性好增强
聚集抑制剂精氨酸
温和洗洁剂
稳定性适中减小
变性剂尿素
盐酸胍
强烈洗洁剂
不稳定减小
图8示意图很好的描述了小分子对该过程额影响。而这两种作用可能具有相互的排斥性,因为折叠的增强原则上增强了蛋白质之间的相互作用,而聚集的抑制则降低了蛋白之间的的相互作用。聚集的抑制减少了折叠中间体的结合而不影响复性过程的进行。它包括聚乙二醇[12],环糊精[13],精氨酸盐酸[14,15],脯氨酸[16-18]。与聚乙二醇和环糊精结合的折叠中间体为疏水区域。在这些小分子物质中,精氨酸是最常用的。然而,目前尚不清楚精氨酸如何降低折叠中间体的聚集。但它对蛋白质稳定性的影响已经很明确[19,20]。精氨酸既不是一种蛋白质稳定剂,也不增强蛋白的折叠。有许多极性小分子添加剂,可以提高蛋白质的稳定性,并
能在体内增强蛋白质的折叠。这些包括糖,多元醇,某些盐类,如硫酸铵和氯化镁,和某些氨基酸,如甘氨酸和丙氨酸。虽然这将提高蛋白质折叠成一个紧凑的结构,他们也可增强错误折叠和聚合。这些错误的结构可能是过于紧凑和刚性,无法使错误折叠的结构重新折叠为天然结构。
[1] P.H. Yancey, M.E. Clark, S.C. Hand, R.D. Bowlus, G.N.Somero. Living with water stress: evolution of osmolyte systems,Science, 1982, 217:1214~1222.
[2] G. Somero. Protons, osmolytes, and fitness of internal milieu forprotein function, Am. J. Physiol. 1986,251 :197~213.
[3] C.R. Brown, L.Q. Hong-Brown, J. Biwersi, A.S. Verkman, W.J.Welch. Chemical chaperones correct the mutant phenotype of thedF508 cystic fibrosis transmembrane conductance regulator protein. Cell Stress Chaperones 1996,1 : 117~125.
[4] E. De Bernardez Clark, E. Schwarz, R. Rudolph.Inhibition ofaggregation side reactions during in vitro protein folding.MethodsEnzymol. 1999,309: 217~236.
[5] B.K. Muralidhara, V. Prakash.Molten globule state of humanserum albumin.Curr. Sci. 2001,72:831~834.
[6] T. Arakawa, J. Philo, W.C. Kenney. Structure and solubility ofinterleukin-2 in sodium dodecyl sulfate. Int. J. Pept. Protein Res. 1994, 43:583~587.
[7] T. Arakawa, J. Philo, W.C. Kenney. Structure and solubility ofinterleukin-2 in sodium dodecyl sulfate. Int. J. Pept. Protein Res. 1994, 43:583~587.
[8]I. Kumagai, K. Tsumoto. Generation of novel functionalantibody molecules by in vitro selection system.TanpakushitsuKakusanKoso. 1998,43: 201~205.
[9] K. Tsumoto, K. Shinoki, H. Kondo, M. Uchikawa, T. Juji, I.Kumagai. Highly efficient recovery of functional single-chain Fvfragments from inclusion bodies overexpressed in Escherichia coliby controlled introduction of oxidizing reagents—application to a
human single-chain Fv fragment. J. Immunol. Methods ,1998,219:119~129.
[10] Y. Maeda, H. Koga, H. Yamada, T. Ueda, T. Imoto. Effectiverenaturation of reduced
lysozyme by gentle removal of urea.Protein Eng. 1995, 8: 201~205.
[11] D. Ejima, M. Watanabe, Y. Sato, M. Date, N. Yamada, Y.Takahara. High yield refolding and purification process forrecombinant human interleukin-6 expressed in Escherichia coli. Biotechnol.Bioeng. 1999,62 :301~310.
[12] J.L. Cleland, D.I.C. Wang.Cosolvent assisted protein refolding.Biotechnology.1990, 8: 1274~1278.
[13] N. Karuppiah, A. Sharma. Cyclodextrins as protein folding aids.Biochem.Biophys. R. 1995,211:60~66.
[14] D. Arora, N. Khanna. Method for increasing the yield of properlyfolded recombinant c interferon from inclusion bodies. J.Biotechnol. 1996 ,52: 127~133.
[15] M. Suenaga, H. Ohmae, S. Tsuji, T. Itoh, O. Nishimura. Renaturation of recombinant human neurotrophin-3 from inclusionbodies using a suppressor agent of aggregation. Biotechnol.Appl. Biochem. 1998,28:119~124.
[16] W.B. Ou, Y.D. Park, H.M. Zhou.Effect of osmolytes as foldingaids on creatine kinase refolding pathway. Int. J. Biochem. CellBiol. 2002,34:136~147.
[17] F. Meng, Y. Park, H. Zhou. Role of proline, glycerol, and heparinin protein folding aids during refolding of rabbit muscle creatinekinase.Int. J. Biochem. Cell Biol. 2001,33: 701~709.
[18] D. Samuel, T.K. Kumar, G. Ganesh, G. Jayaraman, P.W. Yang,M.M. Chang, V.O. Trivedi, S.L. Wang, K.C. Hwang, D.K.Chang, C. Yu. Proline inhibits aggregation during proteinrefolding.Protein Sci. 2000,9:344~352.
[19] ArakawaT, EjimaD, TsumotoK.SuppressionofProteininteractionsbyarginine:aProposed Mechanismofthearginineeffects.BiophysChem.2007.127(l~2):l~8.
[20] ArakawaT, KitaY, EjimaD. AggregationsuppressionofProteinsbyarginine during thermal unfolding.ProteinPeptLett.2006.13(9):921~927.
包涵体表达的蛋白的复性 摘要综述了包涵体形成、包涵体分离和溶解、包涵体折叠复性的方法、复性产率低下的主要因素以及通过分子伴侣、低分子量添加物等的应用而提高了蛋白质复性产率。 关键词包涵体蛋白质复性 Abstract Strategies for decreasing the formation of inclusion bodies, isolation and resolution of inclusion bodies, refolding of inclusion body proteins and the cause of decreased refolding yields were included. Renaturation yield of recombinant protein have been improved by using some additives, such as molecular chaperone, small molecules. Key words inclusion body , protein , renaturation 外源基因在大肠杆菌中的高表达常常导致包涵体的形成,虽然包涵体具有富集目标蛋白质、抗蛋白酶、对宿主毒性小等优点,但包涵体蛋白质的复性率一般都很低,而分子伴侣、低分子量添加物等在复性过程中的应用及新的复性方法的建立都大大提高了重组蛋白质复性产率。
一、包涵体: 包涵体的定义、组成与特性: 包涵体是指细菌表达的蛋白在细胞内凝集,形成无活性的固体颗粒。一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、内毒素、外膜蛋白ompC、ompF和ompA等,环状或缺口的质粒DNA,以及脂体、脂多糖等,大小为,具有很高的密度(约ml),无定形,呈非水溶性,只溶于变性剂如尿素、盐酸胍等。NMR 等新技术的应用表明包涵体具有一定量的二级结构,他们可能在复性的启动阶段中具有一定的作用。[1] 包涵体的形成: 主要因为在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子,或环境不适,无法形成正确的次级键等原因形成的。 1.2.1、基因工程菌的表达产率过高,超过了细菌正常的代谢水平,由于细菌的δ因子的蛋白水解能力达到饱和,使之表达产物积累起来。研究发现在低表达时很少形成包涵体,表达量越高越容易形成包涵体。原因可能是合成速度太快,以
蛋白的变性和复性
蛋白的变性和复性 变性:蛋白质的空间结构是体现生物功能的基础,蛋白质折叠则是形成空间结构的过程。蛋白质一级结构决定其高级结构的著名学说, 认为蛋白质折叠是受热力学因素控制的. 天然蛋白质处于能量最低(即热力学最稳定)的状态. 一般来说, 天然蛋白质的结构是相对稳定的, 结构的稳定性也是其保持生物个体功能和物种的相对稳定所要求的. 蛋白质担负着复杂的生化反应, 同时在生物合成以后, 蛋白质本身也经历着繁杂的生理过程. 蛋白质自翻译以后, 还需进行一系列的翻译后过程, 包括跨膜转运、修饰加工、折叠复性、生化反应、生物降解等. 这些过程似乎都伴随着蛋白质的结构转换, 不但受蛋白质肽链自身的热力学稳定性所控制, 而且还受动力学过程控制. 变性原因:蛋白质因受某些物理或化学因素的影响,分子的空间构象被破坏,从而导致其理化性质发生改变并失去原有的生物学活性的现象称为蛋白质的变性作用(denaturation)。变性作用并不引起蛋白质一级结构的破坏,而是二级结构以上的高级结构的破坏,变性后的蛋白质称为变性蛋白。 引起蛋白质变性的因素很多,物理因素有高温、紫外线、X-射线、超声波、高压、剧烈的搅拌、震荡等。化学因素有强酸、强碱、尿素、胍盐、去污剂、重金属盐(如Hg2+、Ag+、Pb2+等)三氯乙酸,浓乙醇等。不同蛋白质对各种因素的敏感程度不同。 蛋白质变性后许多性质都发生了改变,主要有以下几个方面: (一)生物活性丧失
蛋白质的生物活性是指蛋白质所具有的酶、激素、毒素、抗原与抗体、血红蛋白的载氧能力等生物学功能。生物活性丧失是蛋白质变性的主要特征。有时蛋白质的空间结构只有轻微变化即可引起生物活性的丧失。 (二)某些理化性质的改变 蛋白质变性后理化性质发生改变,如溶解度降低而产生沉淀,因为有些原来在分子内部的疏水基团由于结构松散而暴露出来,分子的不对称性增加,因此粘度增加,扩散系数降低。 (三)生物化学性质的改变 蛋白质变性后,分子结构松散,不能形成结晶,易被蛋白酶水解。蛋白质的变性作用主要是由于蛋白质分子内部的结构被破坏。天然蛋白质的空间结构是通过氢键等次级键维持的,而变性后次级键被破坏,蛋白质分子就从原来有序的卷曲的紧密结构变为无序的松散的伸展状结构(但一级结构并未改变)。所以,原来处于分子内部的疏水基团大量暴露在分子表面,而亲水基团在表面的分布则相对减少,至使蛋白质颗粒不能与水相溶而失去水膜,很容易引起分子间相互碰撞而聚集沉淀。 复性:如果变性条件剧烈持久,蛋白质的变性是不可逆的。如果变性条件不剧烈,这种变性作用是可逆的,说明蛋白质分子内部结构的变化不大。这时,如果除去变性因素,在适当条件下变性蛋白质可恢复其天然构象和生物活性,这种现象称为蛋白质的复性(renaturation)。 外源基因在大肠杆菌中的高表达常常导致包涵体的形成,虽然包涵体具有富集目标蛋白质、抗蛋白酶、对宿主毒性小等优点,但包涵体蛋白质的复性率一般都很低, 一般说来,蛋白质的复性效率在20%左右。
包涵体蛋白的纯化和复性 1.菌体的收集和破碎 用50 ml离心管分别收集诱导表达后的培养物,8000 rpm 4℃离心10 min。沉淀用适量的超声破菌缓冲液重悬。 【备注】超声破菌缓冲液(20 mmol/L Tris-HCl pH8.0、0.5 mol/L NaCl、1 mmol/L EDTA、1 mg/mL溶菌酶) 重悬后的菌液于冰浴中进行超声波破碎,其条件为:功率为300W,占空比50%,每个循环30 s,总时间20 min。破碎后的匀浆,4℃、12000 rpm离心15 min。分别取上清液和沉淀进行12% SDS-PAGE分析,确定目的蛋白是否以包涵体的形式表达。 2.包涵体的处理 洗涤:沉淀用适量的包涵体洗涤缓冲液重悬后,搅拌洗涤20~30 min,于4℃,12000 rpm离心15 min,弃去上清液。重复一次。再用适量的50 mmol/L Tris pH8.0溶液洗涤一遍(以去除残留的EDTA),于4℃12000 rpm离心15 min,弃去上清液。 【备注】包涵体洗涤缓冲液(20 mmol/L Tris-HCl pH 8.0,0.5 mol/L NaCl,2 mol/L尿素,2%Triton) 2%Triton X-100溶液:量取2mlTriton X-100(聚乙二醇辛基苯基醚)液,加M缓冲液98ml 即可。 溶解:沉淀用适量的包涵体溶解缓冲液重悬,室温搅拌5-6小时或过夜。12000 rpm 4℃离心15 min,收集上清液。 【备注】包涵体溶解缓冲液(20 mmol/L Tris-HCl pH 8.0,0.5 mol/L NaCl,8 mol/L尿素,0.2 mmol/L DTT或100 mmol/L β-巯基乙醇,2%Triton)
重组蛋白包含体的复性 [摘要]:重组蛋白在大肠杆菌中的高表达往往导致形成包含体。不可溶、无生物活性的包含体必须经过体外变复性才可得到生物活性蛋白。变复性实验是建立在蛋白质体外折叠机制的基础上的。近年来,随着对蛋白质折叠机制的认识,发展了不少促进蛋白折叠和二硫键氧化来提高活性蛋白产率的复性办法。 [关键词]:蛋白折叠、包含体、复性、二硫键形成 Abstract:Expression of recombinant proteins in Escherichia coli often results in the formation of insoluble inclusion bodies. Active protein can be recovered by solubilization of inclusion bodies followed by renaturation of the solubilized protein. The process of renaturation is established in the understanding to the mechanism of protein folding in vitro. In recent years, With the understanding of mechanisms of protein folding, many renaturation methods were developed, which can increase the yield of active proteins. Key word: protein folding、inclusion body 、renaturation 、the forming of disulfide bond 大肠杆菌表达系统以其操作简便,遗传背景清楚,大规模发酵成本低成为目前最常用的外源蛋白表达系统。它为许多具有药用和工业应用价值的真核生物蛋白质的获得提供了方便。但是,重组蛋白的高表达往往导致形成不溶的、没有生物活性的包含体(如人生长激素、人胰岛素和尿激酶)。 包含体的形成意味可溶性重组蛋白质的重大损失,必须经过体外变复性才能得到生物活性蛋白。如果能解决包含体的复性问题,它将是大量生产重组蛋白的最有效的途径之一。近年来对蛋白质折叠过程的深入研究使重组蛋白的体外复性取得了一系列的新进展。文章中,我们在蛋白质折叠机制的基础上,简述了重组蛋白体外复性的研究进展。 1. 蛋白质的体内折叠 细胞内的新生肽链的折叠是分阶段的,从相邻氨基酸的相互作用开始,多肽链的出现引起二级结构的形成,最后形成三级结构。Baldwin综述了蛋白质折叠起始的三种可能因素:疏水作用,二级结构及某些特殊作用力(如二硫键)[1]。实验证明,细胞内二硫键的形成速度要明显快于细胞外,而且在翻译结束之前二硫键也能够形成[2]。 近年来的一些研究表明,很多真核蛋白质的折叠和装配受到其他蛋白或酶的严格调控。在真核细胞中,蛋白可能与分子伴侣(chaperon)或折叠酶(foldase)共表达且表达量很低;也可能进行翻译后修饰分泌出去。现在已知的参与新生肽链折叠的蛋白有两类:一类是催化蛋白特定异构化的酶,限制蛋白质折叠的速度,如催化正确二硫键形成的二硫键异构酶(PDI蛋白)[3]、催化脯氨酸异构反应的脯氨酸顺反异构酶(PPI)[4]等,它们称为折叠酶,另一类辅助蛋白能与多肽链短暂暴露疏水区结合,从而防止不正确的聚集作用和错误的装配,称为分子伴侣。 重组蛋白在大肠杆菌中的折叠环境迥异于它们的天然环境--真核细胞。蛋白酶、氧化还原电位、PH和蛋白浓度等性质都不同[5],而且,原核细胞不具备糖基化的功能,也没有
目录 一、脲和盐酸胍在包涵体蛋白质纯化中的作用 二、包涵体变复性 三、包涵体洗涤纯化——7~10 四、包涵体提出、纯化和复性
一、
二、包涵体变复性 包涵体是指细菌表达的蛋白在细胞内凝集,形成无活性的固体颗粒。一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、内毒素、外膜蛋白ompC、ompF和ompA等,环状或缺口的质粒DNA,以及脂体、脂多糖等。 基本信息 中文名称 包涵体变复性 复性方法 稀释复性 原因 基因工程菌的表达产率过高 包涵体变性 破菌洗涤溶解 目录 1包涵体 2包涵体变性 3包涵体复性 包涵体是指细菌表达的蛋白在细胞内凝集,形成无活性的固体颗粒。一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、内毒素、外膜蛋白ompC、ompF和ompA等,环状或缺口的质粒DNA,以及脂体、脂多糖等,大小为0.5-1μm,具有很高的密度(约1.3mg/mL),无定形,呈非水溶性,只溶于变性剂如尿素、盐酸胍等。NMR等新技术的应用表明包涵体具有一定量的二级结构,他们可能在复性的启动阶段中具有一定的作用。 包涵体的形成原因 主要因为在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子,或环境不适,无法形成正确的次级键等原因形成的。 1.基因工程菌的表达产率过高,超过了细菌正常的代谢水平,由于细菌的δ因子的蛋白水解能力达到饱和,使之表达产物积累起来。研究发现在低表达时很少形成包涵体,表达量越高越容易形成包涵体。原因可能是合成速度太快,以至于没有足够的时间进行折叠,二硫键不能正确的配对,过多的蛋白间的非特异性结合,蛋白质无法达到足够的溶解度等。 2.重组蛋白的氨基酸组成:一般说含硫氨基酸越多越易形成包涵体,而脯氨酸的含量明显与包涵体的形成呈正相关。 3.重组蛋白所处的环境:发酵温度高或胞内pH接近蛋白的等电点时容易形成包涵体。 4.重组蛋白是大肠杆菌的异源蛋白,由于缺乏真核生物中翻译后修饰所需酶类和辅助因子,如折叠酶和分子伴侣等,致使中间体大量积累,容易形成包涵体沉淀。
我用透析法复性蛋白,但出现了好多沉淀,后面我要用Ni柱来纯化,我现在不知道复性后怎么 处理?把沉淀弃掉吗?谁来帮帮我吧! 我用透析法复性蛋白,但出现了好多沉淀,后面我要用Ni柱来纯化,我现在不知道复性后怎么 处理?把沉淀弃掉吗?谁来帮帮我吧! 首先,可以再多加一点透析液看看能否将之溶掉,这样可以减少由于免疫共沉淀的原因而与杂质一起沉淀的蛋白。 再次如果你的蛋白已经复性,并且能很好的溶解的话,那么沉淀要么是杂质,要么是不能复性的蛋白,我认为可以离心去除。 出现絮状沉淀是很正常的现象,因为透析本身就是一个复性的过程,那些出现絮状的沉淀就是一些不能够复性成为天然结构的一些目的蛋白和一些杂蛋白,而这些都是我们所不需要的。所以说出现絮状沉淀是正常的也是我们希望看到的。 至于出现沉淀的原因不外乎条件变化太剧烈了,建议不要让透析的条件变化太剧烈了,主要是PH的浓度的变化和样品中一些其他东西如尿素的浓度变化。 如果楼主透析样品中出现太多的沉淀,甚至于跑胶中基本没有带了,那么建议楼主换一种透析液来用,如用TGE也就是传说中的万金油来试试,我一直用的是这种透析液,效果很不错。TGE配法如下: 50mM Tris 0.5mM EDTA 50mM Nacl 5%或10%甘油 如果有条件加入1%的甘氨酸或精氨酸和谷胱甘肽会更好些。 沉淀可以拿来重溶,但是重溶的可行性不大,也就是重新溶解的可能性不大 谢谢您们的回答,我再试试.我还想问一下是先过柱后复性还是先复性后过柱那种方法好?我查资料怎么都不一样.还有我纯化的蛋白浓度比较底,能不能浓缩一下,我后面作免疫动物实验,怎样保存蛋白较好?包涵体能放多久不出现问题? 如透析液用TGE的话,一次透析,还是也要分步,要不要调PH或是浓度? 046 wrote: 谢谢您们的回答,我再试试.我还想问一下是先过柱后复性还是先复性后过柱那种方法好?我查资料怎么都不一样.还有我纯化的蛋白浓度比较底,能不能浓缩一下,我后面作免疫动物实验,怎样保存蛋白较好?包涵体能放多久不出现问题? 先过柱後复性。 蛋白浓度较低可以浓缩一下,浓缩方法有很多,简单一点的可以用PEG包埋,就是将蛋白
变复性的过程 E.coli 中表达的蛋白常常以包涵体的形式沉积于细胞内,表现为无活性的不溶性聚集物。 生产研究中为了得到较高的目的蛋白的表达量,通常会采用较强的启动子(如λPL 、T7 或串联启动子) ,使外源基因可在胞内获得高效表达,一般占细菌总蛋白的10 %~50 %. 然而胞内表达的最大问题是产物形成不溶性的包涵体,虽然这可为后续的分离纯化带来方便,但包涵体必须经过体外复性才有可能获得生物活性 .绝大部分高表达的重组蛋白质往往聚集成不溶的、无活性的包涵体形式, 极大地影响到后续的结构分析和活性研究工作, 开展对这些包涵体的复性工作已成为一个重要的研究方向。 包涵体是由蛋白质折叠中间体的聚集而形成的,任何影响中间体稳定的因素(如pH 值、离子强度、温度等) 都可导致包涵体的形成. 包涵体形成原因 1. 表达量过高,研究发现在低表达时很少形成包涵体,表达量越高越容易形成包涵体。原因可能是合成速度太快,以至于没有足够的时间进行折叠,二硫键不能正确配对,过多的蛋白间的非特异性结合,蛋白质无法达到足够的溶解度等。 2. 重组蛋白的氨基酸组成,一般说来含硫氨基酸越多越容易形成包涵体。 3. 重组蛋白所处的环境,发酵温度高或胞内pH接近蛋白的等电点时容易形成包涵体。 4. 重组蛋白是大肠杆菌的异源蛋白,由于缺少真核生物中翻译后修饰所需酶类,致使中间 体大量积累,容易形成包涵体沉淀。 5. 有报道认为,丰富的培养基有利于活性蛋白质的表达,当培养条件不佳时,容易形成包涵体。 蛋白复性的必要性 细胞中的生物学活性蛋白质常以可融性或分子复合物的形式存在,功能性的蛋白质总是折叠成特定的三维结构型。包涵体内的蛋白是非折叠状态的聚集体,不具有生物学活性,因此要获得具有生物学活性的蛋白质必须将包涵体溶解,释放出其中的蛋白质,并进行蛋白质的复性。复性过程是变性蛋白的重折叠过程。 对包涵体蛋白复性,应先对包涵体进行分离纯化及去折叠(即变性溶解) ,然后采用合适的复性方法促进变性,蛋白再折叠进而恢复活性. 一.包涵体的分离纯化 ①含包涵体的宿主菌细胞的破碎; ②将破碎液离心除去可溶蛋白(9000r 15min 4℃),获得包涵体; ③洗涤包涵体,以除去包涵体上粘附的杂质,如膜蛋白或核酸,应用洗涤液洗涤包涵体,通常用低浓度的变性剂,过高浓度的尿素或盐酸胍会使包涵体溶解,如2M尿素在50mM Tris pH7.0-8.5左右,1mM EDTA中洗涤,温和去垢剂TritonX-100等洗涤包涵体,然后离心(12000r 5min 4℃)取上清洗涤后包涵体的主要成分为聚合态的目的蛋白。
蛋白质变性机理 1、蛋白质介绍 2、蛋白质变性结果 1)活性丧失 蛋白质的生物活性是指蛋白质所具有的酶、激素、毒素、抗原与抗体、血红蛋白的载氧能力等生物学功能。生物活性丧失是蛋白质变性的主要特征。有时蛋白质的空间结构只要轻微变化即可引起生物活性的丧失。 2)某些理化性质的改变 蛋白质变性后理化性质发生改变,如溶解度降低而产生沉淀,因为有些原来在分子内部的疏水基团由于结构松散而暴露出来, 分子的不对称性增加,因此粘度增加,扩散系数降低 蛋白质分子凝聚从溶液中析出
3)生物化学性质的改变 蛋白质变性后,分子结构松散,不能形成结晶,易被蛋白酶水解。蛋白质的变性作用主要是由于蛋白质分子内部的结构被破坏。天然蛋白质的空间结构是通过氢键等次级键维持的,而变性后次级键被破坏,蛋白质分子就从原来有序的卷曲的紧密结构变为无序的松散的伸展状结构(但一级结构并未改变)。所以,原来处于分子内部的疏水基团大量暴露在分子表面,而亲水基团在表面的分布则相对减少,至使蛋白质颗粒不能与水相溶而失去水膜,很容易引起分子间相互碰撞而聚集沉淀。 4)致变因素 引起蛋白质变性的原因可分为物理和化学因素两类。物理因素可以是加热、加压、脱水、搅拌、振荡、紫外线照射、超声波的作用等;化学因素有强酸、强碱、尿素、重金属盐、十二烷基磺酸钠(SDS)等。在临床医学上,变性因素常被应用于消毒及灭菌。 反之,注意防止蛋白质变性就能有效地保存蛋白质制剂。蛋白质的变性很复杂,要判断变性是物理变化还是化学变化,要视是物理变化 加热、紫外线照射、剧烈振荡等物理方法使蛋白质变性,主要是破坏蛋白质分子中的氢键,在变化过程中也没有化学键的断裂和生成,没有新物质生成,因此是物理变化。 否则,鸡蛋煮熟后就不是蛋白质了。而我们知道,熟鸡蛋依然有营养价值,其中的蛋白质反而更易为人体消化系统所分解吸收。 5)复性
包涵体的复性总结 关于包涵体的复性是一个令人头疼的问题,已经成为生物制药的瓶颈,包涵体的复性前期准备工作尤为重要,关于包涵体的处理一般包括这么几步:菌体的破碎、包涵体的洗涤、溶解、复性以及纯化,实验内容比较庞杂、繁琐。 一、菌体的裂解 菌体的破碎方法很多:高速组织捣碎、玻璃匀浆器匀浆、超声波处理法、反复冻融法、化学处理法。无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,不同的菌体蛋白需要加入不同的抑制剂:二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使用这些条件时都要适合于目的物质的提取。 在实验室研究多采用超声波处理法和匀浆器匀浆法。 二、包涵体的洗涤 通常的洗涤方法一般是难以洗干净的,包涵体中主要含有重组蛋白,但也含有一些细菌成分,如一些外膜蛋白、质粒DNA和其它杂质。洗涤常用1%以下的中性去垢剂,如Tween、Triton、Lubel和NP40等加EDTA反复多次进行,因去垢剂洗涤能力随溶液离子强度升高而加强,在洗涤包涵体时可加50 mM NaCL。也可用低浓度的盐酸胍或尿素/中性去垢剂/EDTA/还原剂等洗去包涵体表面吸附的大部分不溶性杂蛋白。洗涤液pH以与工程菌生理条件相近为宜。根据不同的菌体选用与之相应的洗涤液,比如:2 M尿素+50mm Tris-HCl+0.2 mM NaCl +1%Triton x-100+2mmEDTA PH8.0,再用缓冲洗涤一次。此外,刚处理完的包含体好溶解,冷冻后难溶解,且溶解时间和比例都会加大。 三、包涵体的溶解 强的变性剂如尿素、盐酸胍,是通过离子间的相互作用,打断包涵体蛋白质分子内和分子间的各种化学键,使多肽伸展,SDS、正十六烷基三甲基铵氯化物等去垢剂,可以破坏蛋白内的疏水键,也可溶解一些包涵体蛋白质。另外,对于含有半胱氨酸的蛋白质,分离的包涵体中通常含有一些链间形成的二硫键和链内的非活性二硫键。还需加入还原剂,如巯基乙醇、二硫基苏糖醇(DTT),常用浓度2—10 mm。 另外,尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。它们对包涵体氢键有较强的可逆性变性作用,所需浓度尿素6—8M,盐酸胍5—6M。一般来讲,盐酸胍优于尿素,因为盐酸胍是较尿素强的变性剂,它能使尿素不能溶解的包涵体溶解,尿素的溶解度为70—90%,而且尿素分解的异氰酸盐能导致多肽链的自由氨基甲酰化,特别是在碱性pH值下长期保温时。但用尿素溶解具有不电离,呈中性,成本低,蛋白质复性后除去不会造成大量蛋白质沉淀以及溶解的包涵体可选用多种色谱法纯化等优点,故目前已被广泛采用。 四、包涵体的复性 包含体的复性是一个非常复杂的过程,除与蛋白质复性的过程控制相关外,还在很大程度上与蛋白质本身的性质有关,有些蛋白非常容易复性,在较宽松的条件
【专题讨论】超详细包涵体复性常见问题分析 包涵体复性常见问题分析1. 对于尿素和盐酸胍该怎么选择? 尿素和盐酸胍属中强度变性剂,易经透析和超滤除去。它们对包涵体氢键有较强的可逆性变性作用,所需浓度尿素8-10M,盐酸胍6-8M。尿素溶解包涵体较盐酸胍慢而弱,溶解度为70-90%,尿素在作用时间较长或温度较高时会裂解形成氰酸盐,对重组蛋白质的氨基进行共价修饰,但用尿素溶解具有不电离,呈中性,成本低,蛋白质复性后除去不会造成大量蛋白质沉淀以及溶解的包涵体可选用多种色谱法纯化等优点,故目前已被广泛采用。 盐酸胍溶解能力达95%以上,且溶解作用快而不造成重组蛋白质的共价修饰。但它也有成本高、在酸性条件下易产生沉淀、复性后除去可能造成大量蛋白质沉淀和对蛋白质离子交换色谱有干扰等缺点。 2. 怎样洗涤包涵体? 通常的洗涤方法一般是洗不干净的,可以先把包涵体用6M盐酸胍溶解充分,过滤除去未溶解的物质,注意留样跑电泳,然后用水稀释到4M,离心把沉淀和上清分别跑电泳,如此类推可以一直稀释到合适的浓度,可以找到一个合适去除杂质的办法,其实这就是梯度沉淀的方法,比通常的直接
洗脱效果好。 3. 8M尿素溶解的包涵体溶液应如何保存? 在4度放置半个月,都没什么问题。在室温放置超过48小时,可能会对目的蛋白有影响,因为尿素在碱性条件下可使一些氨基酸酰基化,所以早些处理BI溶液比较好。 4. 包涵体复性有什么原则? 低浓度,平缓梯度,低温。 5. 复性时的蛋白浓度是? 一般使用浓度为0.1-1mg/ml,太高的浓度容易形成聚体沉淀,太低的浓度不经济,而且很多蛋白在低浓度时不稳定,很容易变性。 6. 复性中蛋白析出是怎么回事?该怎么处理? 出现蛋白析出,肯定是条件变化太剧烈了。复性应该采取复性液浓度和PH值逐渐变化的方法,例如根据包涵体的溶液成分,每隔1个PH或浓度值配置一种溶液,逐步透析到正常。此外透析时必须浓度极低,条件温和,使蛋白质能够正确折叠。但是复性的比率应该很低。 若加变性剂尿素可加到2M,盐酸胍可加到1-1.5M; 另外可将甘油浓度增加,范围可在≤30%,且在复性样 品中也可加适量甘油。包涵体复性效率和检测复性是一个 非常复杂的过程,除与蛋白质复性的过程控制相关外,还很大程度上与蛋白质本身的性质有关,有些蛋白非常容易复性,
外源基因在大肠杆菌中的高表达常常导致包涵体的形成,虽然包涵体具有富集目标蛋白质、抗蛋白酶、对宿主毒性小等优点,但包涵体蛋白质的复性率一般都很低,而分子伴侣、低分子量添加物等在复性过程中的应用及新的复性方法的建立都大大提高了重组蛋白质复性产率。 一、包涵体: 1.1包涵体的定义、组成与特性: 包涵体是指细菌表达的蛋白在细胞内凝集,形成无活性的固体颗粒。一般含有50%以上的重组蛋白,其余为核糖体元件、RNA聚合酶、内毒素、外膜蛋白ompC、ompF和ompA等,环状或缺口的质粒DNA,以及脂体、脂多糖等,大小为0.5-1um,具有很高的密度(约1.3mg/ml),无定形,呈非水溶性,只溶于变性剂如尿素、盐酸胍等。NMR等新技术的应用表明包涵体具有一定量的二级结构,他们可能在复性的启动阶段中具有一定的作用。[1] 1.2包涵体的形成: 主要因为在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子,或环境不适,无法形成正确的次级键等原因形成的。 1.2.1、基因工程菌的表达产率过高,超过了细菌正常的代谢水平,由于细菌的δ因子的蛋白水解能力达到饱和,使之表达产物积累起来。研究发现在低表达时很少形成包涵体,表达量越高越容易形成包涵体。原因可能是合成速度太快,以至于没有足够的时间进行折叠,二硫键不能正确的配对,过多的蛋白间的非特异性结合,蛋白质无法达到足够的溶解度等。 1.2.2、重组蛋白的氨基酸组成:一般说含硫氨基酸越多越易形成包涵体,而脯氨酸的含量明显与包涵体的形成呈正相关。 1.2.3、重组蛋白所处的环境:发酵温度高或胞内pH接近蛋白的等电点时容易形成包涵体。 1.2.4、重组蛋白是大肠杆菌的异源蛋白,由于缺乏真核生物中翻译后修饰所需酶类和辅助因子,如折叠酶和分子伴侣等,致使中间体大量积累,容易形成包涵体沉淀。 1.2.5、蛋白质在合成之后,于中性pH或接近中性pH的环境下,其本身固有的溶解度对于包涵体的形成比较关键,即是说,有的表达产率很高,如Aspartase和Cyanase,表达产率达菌体蛋白的30%,也不形成包涵体,而以可溶形式出现。[2] 1.2.6、在细菌分泌的某个阶段,蛋白质分子间的离子键、疏水键或共价键等化学作用导致了包涵体的形成。 1.3包涵体破菌、分离、洗涤及溶解 1.3.1基因工程菌发酵液,经离心浓缩后,可用:机械破碎、超声破碎:单纯超声破碎,在小规模下且菌量较少的情况下效果较好,由于能量传递和局部产热等原因,很难用于大体积细胞悬液的破碎,这样部分未破碎细胞与包涵体混在一起,给后期纯化带来困难。因此,在较大规模纯化时先用溶菌酶破碎细菌的细胞膜,再结合超声破碎方法,可显著提高包涵体的纯度和回收率。以及化学方法破碎使细菌裂解,然后以5000-20000g 15min离心,可使大多数包涵体沉淀,与可溶性蛋白分离。 1.3.2洗涤:为了除去包涵体上粘附的杂质,如膜蛋白或核酸,应用洗涤液洗涤包涵体,通常用低浓度的变性剂,过高浓度的尿素或盐酸胍会使包涵体溶解,如2M尿素在50mM Tris pH7.0-8.5左右,1mM EDTA中洗涤。此外可以用温和去垢剂TritonX-100洗涤去除膜碎片和膜蛋白。[3] 1.3.3溶解:一般用强的变性剂如尿素(6-8M)、盐酸胍(GdnHCl 6M),通过离子间的相互作用,打断包涵体蛋白质分子内和分子间的各种化学键,使多肽伸展,一般来讲,盐酸胍优于尿素,因为盐酸胍是较尿素强的变性剂,它能使尿素不能溶解的包涵体溶解,而且尿素分解的异氰酸盐能导致多肽链的自由氨基甲酰化,特别是在碱性pH值下长期保温时。或用去垢剂,如SDS、正十六烷基三甲基铵氯化物、Sarkosyl等,可以破坏蛋白内的疏水键,也可溶解一些包涵体蛋白质。Kandula Suntha等人用TritonX-100来溶解Zymononas mobilis levansucrase包涵体蛋白。另外,
一、菌体的裂解 1、怎样裂解细菌? 细胞的破碎方法 1.高速组织捣碎:将材料配成稀糊状液,放置于筒内约1/3体积,盖紧筒盖,将调速器先拨至最慢处,开动开关后,逐步加速至所需速度。此法适用于动物内脏组织、植物肉质种子等。 2.玻璃匀浆器匀浆:先将剪碎的组织置于管中,再套入研杆来回研磨,上下移动,即可将细胞研碎,此法细胞破碎程度比高速组织捣碎机为高,适用于量少和动物脏器组织。 3.超声波处理法:用一定功率的超声波处理细胞悬液,使细胞急剧震荡破裂,此法多适用于微生物材料,用大肠杆菌制备各种酶,常选用50-100毫克菌体/毫升浓度,在1KG至10KG 频率下处理10-15分钟,此法的缺点是在处理过程会产生大量的热,应采取相应降温措施,时间以及超声间歇时间、超声时间可以自己调整,超声完全了菌液应该变清亮,如果不放心可以在显微镜下观察。对超声波及热敏感的蛋白和核酸应慎用。 4.反复冻融法:将细胞在-20度以下冰冻,室温融解,反复几次,由于细胞内冰粒形成和剩余细胞液的盐浓度增高引起溶胀,使细胞结构破碎。 5.化学处理法:有些动物细胞,例如肿瘤细胞可采用十二烷基磺酸钠(SDS)、去氧胆酸钠等细胞膜破坏,细菌细胞壁较厚,可采用溶菌酶处理效果更好,我用的浓度一般为1mg/ml。无论用哪一种方法破碎组织细胞,都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入二异丙基氟磷酸(DFP)可以抑制或减慢自溶作用;加入碘乙酸可以抑制那些活性中心需要有疏基的蛋白水解酶的活性,加入苯甲磺酰氟化物(PMSF)也能清除蛋白水解酶活力,但不是全部,而且应该在破碎的同时多加几次;另外,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。 这是标准配方: 裂解液:50mM Tris-HCl(pH8.5~9.0), 2mM EDTA, 100mM NaCl, 0.5% Triton X-100, 1mg/ml溶菌酶。(溶菌酶在这个pH范围内比较好发挥作用) 但我个人的经验是:如果你裂解细菌是为了提取蛋白的话,而且蛋白的分子量又小于20kd的话,尽量减少溶菌酶的用量,会引入溶菌酶这种杂蛋白.一般配60ml裂解液用药匙匙柄盛一点就够.判断裂解好坏的标准是,溶液很粘. protocol是10ml-50ml缓冲液(菌体洗涤液,裂解液等)/1g湿菌体. 如果只做一个鉴定,我觉得100-200ml菌就够了. 但凡超声,我都用60ml裂解液,因为我们的超声仪(现代分子生物学实验技术录象里的那种)很适合用100ml小烧杯,装60ml裂解液,这样能让超声头离液面不高不低,不会冒泡泡,也不会洒出来.菌多我就延长超声时间. 沉淀,也就是包涵体沉淀了,如果要上柱纯化,一定要先用4M尿素洗涤一下再用8M尿素溶解.如果不上柱,只是跑跑电泳,可以直接用8M尿素溶解以后,离心取上清,加入适量体积的loading buffer.loading buffer对于包涵体的溶解能力是较弱的. "取200微升菌液,离心后直接加上样buffer,100度3分钟后上样,然后SDSPAGE. 这个方法到底能不能溶解细菌中的包涵体? "
中国生物工程杂志 China B i otechnol ogy,2009,29(7):102~107 包涵体蛋白的分离和色谱法体外复性纯化研究进展 3 王 增1 马会勤1 张 文1 陈尚武 233 (1中国农业大学农学与生物技术学院 北京 100193 2中国农业大学食品科学与营养工程学院 北京 100083) 摘要 重组蛋白在大肠杆菌中表达多为无活性的包涵体形式,须经洗涤、溶解、复性后才能得到生物活性蛋白。综述了近年来包涵体蛋白分离纯化和复性技术研究进展,重点讨论了色谱法复性技术的应用,包括尺寸排阻色谱、亲和色谱、离子交换色谱、疏水相互作用色谱、固定化脂质体色谱、扩张床吸附色谱的进展情况。关键词 包涵体 纯化 色谱 复性 中图分类号 Q816 收稿日期:2008210220 修回日期:2009202219 3国家自然科学基金资助项目(30500347&30471212)33通讯作者,电子信箱:s wchen@cau .edu .cn 随着基因重组技术的发展及越来越多的功能基因被发现和克隆,蛋白质异源表达已被广泛应用。大肠杆菌因遗传背景清楚、成本低、操作简单,且能高效表达外源基因等特点,是基础研究、临床应用及工业生产蛋白和多肽的首选表达系统。然而,重组蛋白在大肠杆菌中表达经常形成无活性的不溶性聚集物即包涵体。包涵体的形成有一定的优势,如具有高蛋白密度、易分离、易于毒性蛋白和宿主细胞致死蛋白表达等特点 [1~3] 。因此,如何将包涵体蛋白转变为具有活性的可 溶蛋白是备受关注的问题。从包涵体中获得天然活性的重组蛋白一般包括三个步骤:包涵体的分离和洗涤、包涵体的溶解、包涵体蛋白的复性。本文综述了近年来包涵体蛋白分离纯化和色谱法复性技术研究进展,期望包涵体蛋白体外折叠这一难题早日解决。 1 包涵体的形成和分离 1.1 包涵体的形成 重组蛋白不论在原核细胞还是真核细胞中表达时,都可形成包涵体 [4] 。通常所说的包涵体是指重组 蛋白在大肠杆菌中高效表达时形成的无活性蛋白聚集体,一般含有50%以上重组蛋白,其余为核糖体组分、 RNA 聚合酶,外膜蛋白等杂蛋白,以及质粒DNA 、RNA 片断、脂质、肽聚糖、脂多糖等成分 [5,6] 。由于包涵体在 相差显微镜下为黑色斑点,所以也称为折射体 (Refractile body )[7]。 包涵体形成的原因主要有以下几点:⑴蛋白合成速度太快,以致于没有足够的时间进行折叠。蛋白折叠的动力学模型表明:蛋白质天然构象形成的速率取决于肽链的合成速率、折叠速率和聚集速率几个因素。中间体正确折叠是分子内的一级反应,而中间体的聚集是发生在分子间的二级或高级反应,因此,折叠中间体的浓度对聚集反应影响非常大 [8] ;⑵重组蛋白是大 肠杆菌的异源蛋白,由于缺少真核生物的翻译后修饰系统(如糖基化等),致使中间体大量积累,容易形成包涵体 [9] ;⑶培养条件不佳和重组蛋白所处的环境也可 导致包涵体形成,如发酵温度高,胞内pH 接近蛋白的等电点等 [10] ;⑷二硫键在蛋白折叠中有重要作用,而大 肠杆菌胞内的还原环境不利于二硫键的形成[2] ;⑸包 涵体不溶可能由于分子间无活性的β2片层含量高于天 然结构或盐沉淀蛋白 [11] 。 包涵体蛋白虽然不具有天然结构、没有活性,但在基因工程中生产重组蛋白,包涵体的形成有一定优势,主要表现在:⑴重组蛋白高水平表达,有时候可达细胞总蛋白的30% [2] ;⑵包涵体密度高(约1.3mg/m l ) [12] , 重组蛋白相对较纯,很容易与细胞成分分离,可减少后续纯化步骤;⑶包涵体结构致密,因而在一定程度上避免了大肠杆菌蛋白酶的降解;⑷易于毒性蛋白和膜蛋白表达 [3,8] ;⑸包涵体的形成降低了重组蛋白在胞质中 的浓度,有利于目的基因的进一步表达。基于这些特点,重组蛋白的包涵体表达已在商业化生产中得到广
重组包涵体蛋白质复性 邹平 基因工程技术的发展掀开了人类生命科学研究的崭新篇章,开辟了现代生物工业发展的新纪元。重组DNA技术为大规模生产目标蛋白质提供了可能,E.coli以其易于操作、遗传背景清楚、发酵成本低和蛋白表达水平高等优点,是生产重组蛋白的首选表达系统。但外源基因在E.coli中的高表达常常导致包涵体的形成,如何高效地复性包涵体蛋白是基因工程技术面临的一个难题。随着人类基因组计划的完成和蛋白组计划的实施,人们将会更多地面临这一问题的挑战。 一、包涵体蛋白 1、包涵体的形成 包涵体主要是因为在重组蛋白的表达过程中缺乏某些蛋白质折叠的辅助因子,而无法形成正确的次级键等原因形成的;也可能是外源基因合成速度太快,没有足够的时间进行折叠、二硫键不能正确的配对、过多的蛋白间的非特异性结合、蛋白质无法达到足够的溶解度等;重组蛋白质的一级结构也与包涵体形成有关,一般说含硫氨基酸越多越易形成包涵体,而脯氨酸的含量明显与包涵体的形成呈正相关;重组蛋白所处的环境不适,发酵温度高或胞内pH接近蛋白的等电点时易形成包涵体。 2、减少包涵体形成的策略 降低重组菌的生长温度,是减少包涵体形成的最常用的方法。低生长温度降低了无活性聚集体形成的速率和疏水相互作用;细菌生长缓慢溶氧水平低,也可减少包涵体的形成。 在培养重组菌中供给丰富的培养基,创造最佳培养条件,如供氧充足、合适pH等,以减少包涵体的形成。 添加可促进重组蛋白质可溶性表达的生长添加剂,增加细胞的渗透压。 在低的诱导剂条件下培养重组菌,减少重组蛋白表达量,也可减少包涵体的形成。 利用硫氧还蛋白融合表达或与目标蛋白共表达,得到可溶性目的蛋白。筛选合适的宿主菌,使表达的重组蛋白可溶。 3、包涵体破菌、分离、洗涤 常用高压匀化或机械、化学和酶相结合的方法破碎含包涵体的宿主菌细胞 ,再将破碎液通过低速离心或过滤除去可溶蛋白后获得包涵体。包涵体中除了目的蛋白外还含有脂类、脂多糖、核酸和杂蛋白等成分,而这些成分会影响包涵体蛋白的复性,故去折叠前应洗涤包涵体,以去除杂质。 4、包涵体的溶解去折叠 一般用强的变性剂如尿素、盐酸胍,通过离子间的相互作用,打断包涵体蛋白质分子内和分子间的各种化学键,使多肽伸展。盐酸胍优于尿素,因为盐酸胍是较尿素强的变性剂,
包涵体纯化蛋白复性的方法操作流程 返回:包涵体复性常见问题分析与解决 包涵体的纯化与复性总结 包涵体折叠复性的方法应具备以下几个特点:较高的活性蛋白质回收率;复性产物易于与错误折叠蛋白质分离;折叠复性后能够得到较高浓度的蛋白;折叠复性方法易于放大等。蛋白复性的过程通常分为以下几个步骤: 包涵体的洗涤 包涵体在溶解之前需要进行洗涤,包涵体中主要含有重组蛋白,但也有一些杂质,如一些外膜蛋白、质粒DNA等,这些杂质会与包涵体粘连在一起,可以通过洗涤去除大多数杂质,但无法将杂蛋白去除干净。 包涵体的洗涤通常选用浓度较低的变性剂,如2M尿素在50mM Tris,pH7、0-8、5,1mM EDTA中洗涤包涵体。此外可以用温与去垢剂TritonX-100洗涤去除膜碎片与膜蛋白。同时,因为去垢剂的洗涤能力会随溶液离子强度升高而加强,所以在洗涤包涵体时可加入低浓度的尿素或高浓度的NaCl,使包涵体的纯度达到50%以上。 包涵体的溶解 变性剂如尿素、盐酸胍,主要就是通过离子间的相互作用,打断包涵体蛋白分子间的各种化学键,使多肽延伸。盐酸胍就是较尿素强的变性剂,它能溶解尿素不溶的包涵体。SDS、正十六烷基三甲基铵氯化物、Sarkosyl等也可以破坏蛋白内的疏水键,溶解一些包涵体蛋白质。 另外,从某些含有半胱氨酸的蛋白质中分离出的包涵体,通常含有一些链间形成的二硫键与链内的非活性二硫键,这就还需加入还原剂,如巯基乙醇、二硫基苏糖醇(DTT)、二硫赤藓糖醇、半胱氨酸等。这种还原性试剂能够同半胱氨酸形成各种二硫化物中间体,也会被复性用的二硫化物置换试剂所取代。二硫键的形成与断裂就是可逆的,直到最有利的蛋白二硫键形成,这个平衡才会被破坏。 常用变性剂对比 尿素较盐酸胍慢而弱,溶解度为用尿素溶解具有不电离,呈中性,成
蛋白的变性和复性 变性:蛋白质的空间结构是体现生物功能的基础,蛋白质折叠则是形成空间结构的过程。蛋白质一级结构决定其高级结构的著名学说, 认为蛋白质折叠是受热力学因素控制的. 天然蛋白质处于能量最低(即热力学最稳定)的状态. 一般来说, 天然蛋白质的结构是相对稳定的, 结构的稳定性也是其保持生物个体功能和物种的相对稳定所要求的. 蛋白质担负着复杂的生化反应, 同时在生物合成以后, 蛋白质本身也经历着繁杂的生理过程. 蛋白质自翻译以后, 还需进行一系列的翻译后过程, 包括跨膜转运、修饰加工、折叠复性、生化反应、生物降解等. 这些过程似乎都伴随着蛋白质的结构转换, 不但受蛋白质肽链自身的热力学稳定性所控制, 而且还受动力学过程控制. 变性原因:蛋白质因受某些物理或化学因素的影响,分子的空间构象被破坏,从而导致其理化性质发生改变并失去原有的生物学活性的现象称为蛋白质的变性作用(denaturation)。变性作用并不引起蛋白质一级结构的破坏,而是二级结构以上的高级结构的破坏,变性后的蛋白质称为变性蛋白。
引起蛋白质变性的因素很多,物理因素有高温、紫外线、X-射线、超声波、高压、剧烈的搅拌、震荡等。化学因素有强酸、强碱、尿素、胍盐、去污剂、重金属盐(如Hg2+、Ag+、Pb2+等)三氯乙酸,浓乙醇等。不同蛋白质对各种因素的敏感程度不同。 蛋白质变性后许多性质都发生了改变,主要有以下几个方面: (一)生物活性丧失 蛋白质的生物活性是指蛋白质所具有的酶、激素、毒素、抗原与抗体、血红蛋白的载氧能力等生物学功能。生物活性丧失是蛋白质变性的主要特征。有时蛋白质的空间结构只有轻微变化即可引起生物活性的丧失。(二)某些理化性质的改变 蛋白质变性后理化性质发生改变,如溶解度降低而产生沉淀,因为有些原来在分子内部的疏水基团由于结构松散而暴露出来,分子的不对称性增加,因此粘度增加,扩散系数降低。 (三)生物化学性质的改变 蛋白质变性后,分子结构松散,不能形成结晶,易被蛋白酶水解。蛋白质的变性作用主要是由于蛋白质分子内部的结构被破坏。天然蛋白质的空间结构是通过氢键等次级键维持的,而变性后次级键被破坏,蛋白
蛋白质复性方法及其注意事项 蛋白前期准备 (1)查阅目标蛋白相关文献,了解其等电点,标签等注意点。 (2)如果目标蛋白易降解,可在纯化时加1-2mMDTT,全程低温,及时处理。(3)透析Buffer的选择可参考文献。 蛋白复性 包涵体:在某些生长条件下,大肠杆菌能积累某种特殊的生物大分子,它们致密地集聚在细胞内,或被膜包裹或形成无膜裸露结构,这种水不溶性的结构称为包涵体(Inclusion Bodies,IB)。 在E.coli中累积的重组蛋白会迅速地以包涵体形式被沉淀出来,这些包涵体蛋白是丧失生物活性的不可溶的错误折叠蛋白的聚集体。 包涵体的处理一般包括这么几步:包涵体的洗涤、溶解、纯化及复性。 如果过表达蛋白在包涵体中,那么通常有两个选择可以考虑:(1)退一步,优化表达条件;(2)接受包涵体并采取策略来将蛋白溶解以及复性。这里主要考虑第二种方案。 包涵体的洗涤 破碎细胞都会使细胞内蛋白质或核酸水解酶释放到溶液中,使大分子生物降解,导致天然物质量的减少,加入蛋白酶抑制剂等,还可通过选择pH、温度或离子强度等,使这些条件都要适合于目的物质的提取。 洗涤Buffer:50mM Tris-HCl(pH8.0), 2mM EDTA, 2mM DTT,150mM NaCl, 1% Triton X-100, 1mg/ml Leupeptin, 1mg/ml Pepstatin,1mM TCEP。 超声时用40-60ml裂解液,因为我们的超声仪很适合用100ml小烧杯,装 40-60ml裂解液,这样能让超声头离液面不高不低,不会洒出来.菌多就延长超声时间(全程冰浴)。 包涵体的溶解