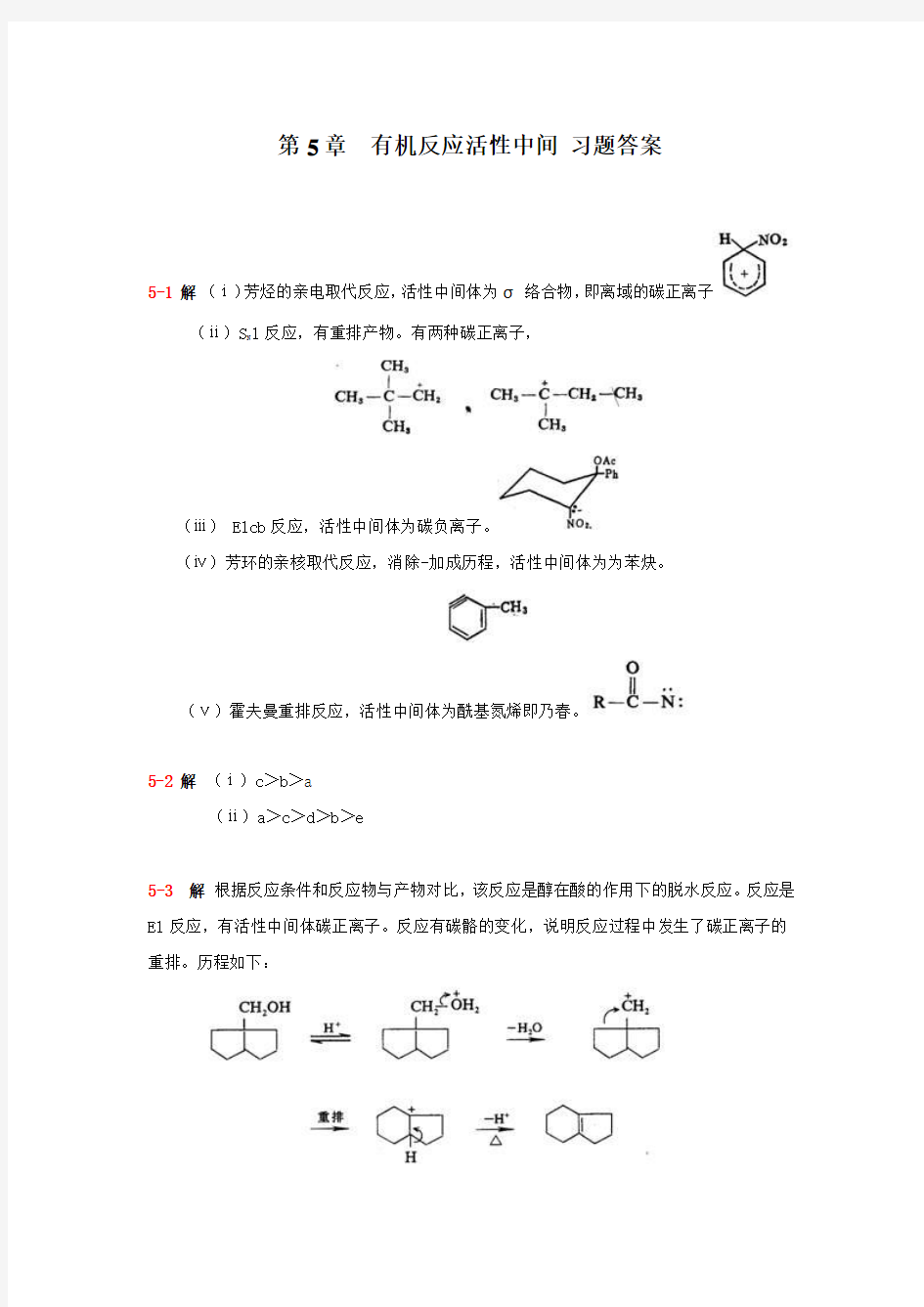

第5章有机反应活性中间习题答案
5-1 解(ⅰ)芳烃的亲电取代反应,活性中间体为σ络合物,即离域的碳正离子
1反应,有重排产物。有两种碳正离子,
(ⅱ)S
N
(ⅲ) E1cb反应,活性中间体为碳负离子。
(ⅳ)芳环的亲核取代反应,消除-加成历程,活性中间体为为苯炔。
(ⅴ)霍夫曼重排反应,活性中间体为酰基氮烯即乃春。
5-2解(ⅰ)c>b>a
(ⅱ)a>c>d>b>e
5-3 解根据反应条件和反应物与产物对比,该反应是醇在酸的作用下的脱水反应。反应是E1反应,有活性中间体碳正离子。反应有碳骼的变化,说明反应过程中发生了碳正离子的重排。历程如下:
5-4解(ⅰ)考察2-甲基吡啶和3-甲基吡啶的共轭碱,共轭碱稳定的,则碱性弱,其共轭酸的酸性则强。
2-甲基吡啶的α-H在强碱的作用下生成的碳负离子具有如下共振结构:
N的电负性比C大,负电荷在N上,共振式较稳定。
3-甲基吡啶的α-H在强碱的作用下生成的碳负离子具有如下共振结构:
所有共振式的负电荷都在C上。
上述分析说明2-甲基吡啶的α位的负离子比3-甲基吡啶的α位的负离子稳定,碱性弱,共轭酸的酸性则强。
(ⅱ)用杂化效应解释。中氧SP2杂化,是SP3杂化。SP2杂化S的成分较多,氧上的未共用电子对在SP2杂化轨道中,离核较近,氧对未共用电子对
的吸引力较大,未共用电子对质子的吸引力较小,酸性比
强。
5-5解
反应产物为:
反应历程:
3-甲基吡啶不能发生上面的反应。
5-6解(ⅰ)c>b>a>d
(ⅱ) b>c>a 它们的离解能分别是163.2kJ/mol 、200.8 kJ/mol、330.5 kJ/mol。5-7 解反应产物:
反应的可能历程:
5-8 解
(ⅰ)
(ⅱ)
5-9 解苯炔中的叁键碳原子仍为杂化状态,叁键的形成基本上不影响苯环中离域的π体系,苯环的稳定性保持不变,而新的“π键”是由两个杂化轨道,在环平面内,侧面交盖而形成很弱的键,如(1)所示。这样的结构是与苯炔高度的化学活性一致的,也是经物理方法所证实的。在(2)中,两个叁键碳原子处于SP杂化状态,各以一个SP杂化轨道交盖形成一个σ键,又各以两个P轨道交盖形成两个π键,一个π键垂直于苯环平面,另一个π键平行于苯环平面。这样的碳-碳叁键是线型结构,键角180O。叁键碳原子的SP
杂化轨道与环中其它碳原子的杂化轨道交盖成键时张力太大,而且也破坏了苯环的结构。显然这种结构是不大可能的。
5-10
解(ⅰ)苯炔的亲核加成,产物为
(ⅱ),苯炔的亲电加成,产物为
(ⅲ)苯炔的环加成,产物为
化学反应热的计算 练习与解析 1.(2006山东潍坊高三模拟,13)下列说法或表示方法中正确的是( ) A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 B.氢气的燃烧热为285.8 kJ ·mol -1,则氢气燃烧的热化学方程式为:2H 2(g)+O 2(g)====2H 2O(l) ΔH =285.8 kJ ·mol -1 C.Ba(OH)2·8H 2O(s)+2NH 4Cl(s) ====BaCl 2(s)+2NH 3(g)+10H 2O(l) ΔH <0 D.已知中和热为57.3 kJ ·mol -1,若将含0.5 mol H 2SO 4的浓溶液与含1 mol NaOH 的溶液混合,放出的热量要大于57.3 kJ 思路解析:硫磺变成硫蒸气需要吸收热量;在101 kPa 时,1 mol 物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热;Ba(OH)2·8H 2O 固体与NH 4Cl 固体反应是吸热反应,则ΔH>0;H 2SO 4的浓溶液与NaOH 溶液混合时要放热。 答案:D 2.已知299 K 时,合成氨反应N 2(g )+3H 2(g) ====2NH 3(g) ΔH=-92.0 kJ ·mol -1,将此温度下的0.1 mol N 2和0.3 mol H 2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)( ) A.一定小于92.0 kJ B.一定大于92.0 kJ C.一定等于92.0 kJ D.无法确定 思路解析:反应热是指反应完全进行时放出或吸收的热量,可逆反应是不能进行到底的,因此可逆反应放出或吸收的热量一定小于反应热。 答案:A 3.100 g 碳燃烧所得气体中,CO 占 31体积,CO 2占32体积,且C(s)+ 21O 2(g)====CO(g) ΔH=-110.35 kJ ·mol -1,CO(g)+ 21O 2(g)====CO 2(g) ΔH=-282.57 kJ ·mol -1。与这些碳完全燃烧相比较,损失的热量是( ) A.392.92 kJ B.2 489.44 kJ C.784.92 kJ D.3 274.3 kJ 思路解析:100 g 碳燃烧所得气体中CO 的物质的量为3 1121001??-mol g g ,这些物质的量CO 完全燃烧放出的能量为31121001??-mol g g ×282.57 kJ · mol -1=784.92 kJ 。 答案:C 4.氢气(H 2)、一氧化碳(CO)、辛烷(C 8H 18)、甲烷(CH 4)的热化学方程式分别为( ) H 2(g)+ 2 1O 2(g)====H 2O(l) ΔH =-285.8 kJ ·mol -1 CO(g)+ 2 1O 2(g) ====CO 2(g) ΔH =-283.0 kJ ·mol -1 C 8H 18(l)+ 225O 2(g) ====8CO 2(g)+9H 2O(l) ΔH=-5 518 kJ ·mol -1 CH 4(g)+2O 2(g) ====CO 2(g)+2H 2O(l) ΔH=-890.3 kJ ·mol -1 相同质量的H 2、CO 、C 8H 18、CH 4完全燃烧时,放出热量最少的是( ) A.H 2(g) B.CO(g) C.C 8H 18(l) D.CH 4(g)
表面活性剂作业题答案 第一章绪论 1.表面活性剂的结构特点及分类方法。 答:表面活性剂的分子结构包括长链疏水基团和亲水性离子基团或极性基团两个部分。 由于它的分子中既有亲油基又有亲水基,所以,也称双亲化合物 表面活性剂一般按离子的类型分类,即表面活性剂溶于水时,凡能离解成离子的叫做离 子型表面活性剂,凡不能离解成离子的叫做非离子型表面活性剂。而离子型表面活性剂按其 在水中生成的表面活性离子种类,又可分为阴离子、阳离子和两性离子表面活性剂三大类。 此外还有一些特殊类型的表面活性剂,如元素表面活性剂、高分子表面活性剂和生物表面活 性剂等。 2.请解释表面张力、表面活性剂、临界胶束浓度、浊点、Krafft点等概念。 表面张力是指垂直通过液体表面上任一单位长度、与液体面相切的,收缩表面的力。 表面活性剂是指在加入很少量时就能显著降低溶液的表面张力,改变体系界面状态,从 而产生润湿、乳化、起泡、增溶等一系列作用,以达到实际应用要求的物质。 表面活性剂在水溶液中形成胶团的最低浓度,称为临界胶团浓度或临界胶束 浓度。 浊点(C. P值):非离子表面活性剂的溶解度随温度升高而降低,溶液由澄清变混浊时 的温度即浊点。 临界溶解温度(krafft点):离子型表面活性剂的溶解度随温度的升高而增加,当温度 增加到一定值时,溶液突然由浑浊变澄清,此时所对应的温度成为离子型表面活性剂的临界 溶解温度。 3.表面活性剂有哪些基本作用?请分别作出解释。 1)润湿作用:表面活性剂能够降低气-液和固-液界面张力,使接触角变小,增大液体对固体表面的润湿的这种作用。 2)乳化作用:表面活性剂能使互不相溶的两种液体形成具有一定稳定性的乳状液的这种作用。 3)分散作用:表面活性剂能使固体粒子分割成极细的微粒而分散悬浮在溶液中的这种作用,叫作分散作用。 4)起泡作用:含表面活性剂的水溶液在搅拌时会产生许多气泡,由于气体比液体的密 度小,液体中的气泡会很快上升到液面,形成气泡聚集物(即泡沫),而纯水不会产生 此种现象,表面活性剂的这种作用叫发泡作用。 5)增溶作用:表面活性剂在溶液中形成胶束后,能使不溶或微溶于水的有机化合物溶 解度显著增加的这种作用称作表面活性剂的增溶作用。 6)洗涤去污作用:洗涤去污作用实际上是由于表面活性剂能够吸附在固液界面上,降 低表面张力并在水溶液中形成胶团,从而产生的润湿、渗透、乳化、分散等各种作用的 综合效果。
第一章习题 1.作图表示出立方晶系(1 2 3)、(0 -1 -2)、(4 2 1)等晶面和[-1 0 2]、[-2 1 1]、[3 4 6] 等晶向 3.某晶体的原子位于正方晶格的节点上,其晶格常数a=b≠c, c=2/3a。今有一晶面在X、Y、Z坐标轴上的截距分别是5个原子间距,2个原子间距和3个原子间距,求该晶面的晶面参数。 解:设X方向的截距为5a,Y方向的截距为2a,则Z方向截距为3c=3X2a/3=2a,取截距的倒数,分别为 1/5a,1/2a,1/2a 化为最小简单整数分别为2,5,5 故该晶面的晶面指数为(2 5 5) 4.体心立方晶格的晶格常数为a,试求出(1 0 0)、(1 1 0)、(1 1 1)晶面的晶面间距,并指出面间距最大的晶面 解:(1 0 0)面间距为a/2,(1 1 0)面间距为√2a/2,(1 1 1)面
间距为√3a/3 三个晶面晶面中面间距最大的晶面为(1 1 0) 7.证明理想密排六方晶胞中的轴比c/a=1.633 证明:理想密排六方晶格配位数为12,即晶胞上底面中心原子与其下面的3个位于晶胞内的原子相切,成正四面体,如图所示 则OD=c/2,AB=BC=CA=CD=a 因△ABC是等边三角形,所以有OC=2/3CE 由于(BC)2=(CE)2+(BE)2 则 有(CD)2=(OC)2+(1/2c)2,即 因此c/a=√8/3=1.633 8.试证明面心立方晶格的八面体间隙半径为r=0.414R 解:面心立方八面体间隙半径r=a/2-√2a/4=0.146a 面心立方原子半径R=√2a/4,则a=4R/√2,代入上式有
1-3《化学反应热的计算》课时练 双基练习 1.在一定温度下,CO 和CH 4燃烧的热化学方程式分别为 2CO(g)+O 2(g)===2CO 2(g) ΔH =-566 kJ/mol CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(l) ΔH =-890 kJ/mol 1 molCO 和3 mol CH 4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( ) A .2 912 kJ B .2 953 kJ C .3 236 kJ D .3 867 kJ ? 解析:由热化学方程式可知,2 molCO 燃烧可放出566 kJ 热量,则1 mol CO 完全燃烧释放283 kJ 热量,同理3 mol CH 4释放3×890 kJ =2 670 kJ 热量,所以1 mol CO 和3 mol CH 4完全燃烧共释放热量为2 953 kJ 。 答案:B 2.已知A(g)+B(g)===C(g) ΔH 1,D(g)+B(g)===E(g) ΔH 2,且ΔH 1<ΔH 2,若A 和D 的混合气体1 mol 完全与B 反应,反应热为ΔH 3,则A 和D 的物质的量之比为( ) 解析:设1 mol 混合气体中含A x mol ,D y mol , 则有????? x +y =1ΔH 1x +ΔH 2y =ΔH 3,解得????? x =ΔH 2-ΔH 3ΔH 2-ΔH 1y =ΔH 3 -ΔH 1ΔH 2-ΔH 1 故x y =ΔH 2-ΔH 3ΔH 3-ΔH 1 。B 选项正确。
《 答案:B 3.已知25℃、101 kPa条件下: (1)4Al(s)+3O2(g)===2Al2O3(s)ΔH=-2 kJ/mol (2)4Al(s)+2O3(g)===2Al2O3(s)ΔH=-3 kJ/mol 由此得出的正确结论是() A.等质量的O2比O3能量低,由O2变O3为吸热反应 B.等质量的O2比O3能量低,由O2变O3为放热反应 C.O3比O2稳定,由O2变O3为吸热反应 ` D.O2比O3稳定,由O2变O3为放热反应 解析:(2)-(1)得:2O3(g)===3O2(g)ΔH=-kJ/mol,可知等质量的O2能量低。 答案:A 4.管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为: 2H2(g)+O2(g)===2H2O(l)ΔH=-kJ/mol 2CO(g)+O2(g)===2CO2(g)ΔH=-566 kJ/mol CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-kJ/mol 当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的天然气,理论上所获得的热值,前者大约是后者的多少倍() | A.B. C.D. 解析:由热化学方程式可得1 mol H2、CO燃烧放出的热量约为283 kJ~kJ;1 mol CH4燃烧放出的热量为kJ,两者之比约为,故答案为D。
陕西国防工业职业技术学院 课时授课计划 课程名称:高聚物生产技术任课教师:杨博授课顺序:第讲 教研室主任签名年月日
陕西国防工业职业技术学院教案专用稿纸 第二节缩聚反应与逐步加聚反应的工业实施聚酯是制造聚酯纤维、涂料、薄膜及工程塑料的原料,是由饱和的二元酸和二元醇通过缩聚反应制得的一类线型高分子缩聚物。这类缩聚物大分子中各个链接都是以酯基(-COO-)相连的,所以称为聚酯。以聚酯为基础制得的纤维称为涤纶(的确良),是三大合成纤维之一,是最主要的纤维。 一、聚酯的生产 聚对苯二甲酸乙二醇酯(PET)的生产工艺 (一)主要原料 (二)聚酯的生产工艺 1.聚酯的合成工艺路线 2.聚对苯二甲酸乙二醇酯的生产工艺 3.聚酯的纺丝:熔融纺丝 (三)聚酯的结构、性能和用途 二、聚酰胺-66,聚酰胺-1010的生产 聚酰胺纤维是以聚酰胺为基础制得的纤维,商品名是锦纶、尼龙,简称PA。它是三大合成纤维之一,也是制造薄膜及工程塑料的原料,是由饱和的二元酸与二元胺通过缩聚反应制得的一类线性高分子缩聚物。常见的聚酰胺有PA-6、PA-11、PA-12、PA-66、PA-610、PA-612、PA-1010等,其中PA-6和PA-66的产量最大,约占聚酰胺产量的90%。 聚酰胺的共同特点:大分子中的各链节间都是以酰胺基相连。 (一)聚酰胺-66的生产 聚酰胺-66是己二酸与己二胺的缩聚物是最早实现工业化生产的聚酰胺品种,也是产量最大的聚酰胺。 1.主要原料 (1)己二酸(2)己二胺 2.生产原理 3.生产工艺 4.聚酰胺的纺丝 5.聚酰胺-66的结构、性能及用途
聚酰胺的纺丝采用直接熔融纺丝和间接熔融纺丝。 熔融纺丝主要包括纺丝和纤维的后加工两个基本操作过程 (二)聚酰胺-1010的生产 聚酰胺-1010学名聚癸二酰癸二胺,俗称尼龙1010,简称PA-1010,是我国利用蓖麻油为主要原料的独特尼龙品种。结构式:H-[-NH(CH2)10NHCO(CH2)8CO-]n-OH 1.主要原料 (1)癸二酸(2)癸二胺 2.生产原理 方程式? 3.生产工艺 4.聚酰胺-1010的结构、性能与用途 酚醛树脂是酚类化合物与醛类化合物在酸性或碱性条件下,经缩聚反应而制得的一类聚合物的统称。其中以苯酚和甲醛为单体缩聚的酚醛树脂最为常用,简称为PF,是第一个工业化生产的树脂品种。以酚醛树脂为主要成分并添加大量其他助剂而制得的制品称为酚醛塑料。 三、酚醛树脂的生产 1.主要原料 (1)苯酚俗称石炭酸(2)甲醛 2.酚醛树脂的生产原理 3.酚醛树脂生产工艺 4.酚醛树脂结构、性能和用途 四、聚氨酯的生产 聚氨酯为大分子链中含有氨酯型重复结构单元的一类聚合物,全称为聚氨基甲酸酯,简称PU或PUR。它是由多异氰酸酯与聚醚型或聚酯型多羟基化合物在一定比例下反应的产物。一般分为热塑性和热固性两大类;或分为弹性体和泡沫塑料两大类。 1.主要原料 (1)异氰酸酯 (2)多氰基化合物 2.聚氨酯泡沫塑料的生产工艺 3.聚氨酯的结构、性能及用途
第一章金属及合金的晶体结构 一、名词解释: 1.晶体:原子(分子、离子或原子集团)在三维空间做有规则的周期性重复排列的物质。2.非晶体:指原子呈不规则排列的固态物质。 3.晶格:一个能反映原子排列规律的空间格架。 4.晶胞:构成晶格的最基本单元。 5.单晶体:只有一个晶粒组成的晶体。 6.多晶体:由许多取向不同,形状和大小甚至成分不同的单晶体(晶粒)通过晶界结合在一起的聚合体。 7.晶界:晶粒和晶粒之间的界面。 8.合金:是以一种金属为基础,加入其他金属或非金属,经过熔合而获得的具有金属特性的材料。 9.组元:组成合金最基本的、独立的物质称为组元。 10.相:金属中具有同一化学成分、同一晶格形式并以界面分开的各个均匀组成部分称为相。 11.组织:用肉眼观察到或借助于放大镜、显微镜观察到的相的形态及分布的图象统称为组织。 12.固溶体:合金组元通过溶解形成成分和性能均匀的、结构上与组元之一相同的固相。 二、填空题: 1.晶体与非晶体的根本区别在于原子(分子、离子或原子集团)是否在三维空间做有规则的周期性重复排列。 2.常见金属的晶体结构有体心立方晶格、面心立方晶格、密排六方晶格三种。 3.实际金属的晶体缺陷有点缺陷、线缺陷、面缺陷、体缺陷。 4.根据溶质原子在溶剂晶格中占据的位置不同,固溶体可分为置换固溶体和间隙固溶体两种。 5.置换固溶体按照溶解度不同,又分为无限固溶体和有限固溶体。 6.合金相的种类繁多,根据相的晶体结构特点可将其分为固溶体和金属化合物两种。7.同非金属相比,金属的主要特征是良好的导电性、导热性,良好的塑性,不透明,有光泽,正的电阻温度系数。 8.金属晶体中最主要的面缺陷是晶界和亚晶界。
化学反应热效应练习题 精选 https://www.doczj.com/doc/f16324566.html,work Information Technology Company.2020YEAR
化学反应热效应练习题 1、下列说法不正确的是() A.化学反应可分为吸热反应和放热反应 B.化学反应的实质是旧键的断裂与新键的生成 C.化学反应中的能量变化都是以热能的形式表现出来 D.放热反应发生时不需加热 2.下列说法正确的是 A.化学反应中的能量变化,通常表现为热量的变化 B.反应物的总能量高于生成物的总能量时发生吸热反应 C.Ba(OH)2·8H2O与NH4Cl 的反应是放热反应 D.木炭在氧气中的燃烧是吸热反应 3.下列说法正确的是 A.若氢气和氧气化合是放热反应,则水电解生成氢气和氧气是吸热反应 B.需要加热才能进行的反应是吸热反应 C.反应放出热量的多少与反应物的质量和状态无关 D.对放热反应A+B→C+D ,A、B的能量总和大于C、D的能量总和 4.下列反应属于放热反应的是 A.氢气还原氧化铜 B.NH4Cl晶体和Ba(OH)2 ·8H2O混合搅拌 C.氢氧化钾和硫酸中和 D.碳酸钙高温分解成氧化钙和二氧化碳 5.下列说法错误的是 A.化学键的断裂和形成是化学反应中能量变化的主要原因 B.放热反应和吸热反应决定于反应物的总能量与生成物的总能量的相对大小 C.化学反应中能量变化,通常主要表现为热量的变化------放热或者吸热 D.凡经加热而发生的化学反应都是吸热反应 6.下列变化属于吸热反应的是: ①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰 A.①④ B.②③ C.①④⑤ D.②④ 7.下列反应过程一定吸收能量的是 A.化合反应 B.加成反应 C.分子解离为原子 D.原子组成分子 8.下列过程需要吸热的是 A.O2→O+O B.H+Cl→HCl C.CaO+H2O=Ca(OH)2 D.浓硫酸稀释 9.下列关于能量转换的认识中不正确的是 A.电解水生成氢气和氧气时,电能转变成化学能 B.白炽灯工作时电能全部转化成光能 C.绿色植物光合作用过程中太阳能转变成化学能 D. 煤燃烧时化学能主要转变成热能 10.下列说法不正确的是
中药药剂学Z次作业答案 The document was prepared on January 2, 2021
《中药药剂学Z》 您本学期选择了“中药药剂学Z”说明:本次作业的知识点为:1-24,总分为120分,您的得分为120分 A型题:请从备选答案中选取一个最佳答案 1.热原的性质不包括:[1分] E.水不溶性 2.咀嚼片、口含片宜选用的稀释剂是:[1分] E.甘露醇 3.薄荷水制备时加入滑石粉的目的是:[1分] E.分散 4.炉甘石洗剂属于:[1分] C.混悬液 5.益母草膏属于:[1分] C.煎膏剂 6.采用蒸馏法制备注射用水是利用热原的:[1分] B.不挥发性 7.紫外线杀菌力最强的波长是:[1分] 8.水蜜丸的溶散时限为:[1分] 小时 9.加入冰糖、黄酒在胶剂制备中的操作过程为:[1分] E.浓缩收胶 10..片剂包糖衣的工序中,对于有引湿性、易溶性或酸性药物的片剂,需要:[1分] A.隔离层 11.下列错误论述胶囊剂的是:[1分] A.胶囊剂只能用于口服 12.需检查融变时限的是:[1分] A.栓剂 13.采用滴制法制备的是:[1分] B.软胶囊 14.提高中药制剂稳定性的方法不包括:[1分] B.采用GMP厂房生产 15.采用凝聚法制备微囊时,加入甲醛的目的是:[1分] D.固化剂 16.下列不属于肠溶衣材料的是:[1分] B.丙烯酸树脂Ⅳ号 17.麝香宜采用下列那种粉碎方式:[1分] D.加液研磨法 18.薄荷水为:[1分] B.真溶液 19.采用升法制备的是:[1分] C.红升丹 20.滴眼剂的制备流程为:[1分] A.药物+附加剂-溶解-滤过-灭菌-无菌分装-质检-包装 21.药物的重量与同体积基质重量之比,这一概念指的是:[1分] A.置换价 22.属于亲水胶体的是:[1分] A.高分子溶液 23.藿香正气水属于:[1分] B.酊剂 24.又称升华干燥的方法是:[1分] C.冷冻干燥 25.不能作为片剂糖衣物料的是:[1分] B.丙烯酸树脂IV号 26.水丸的制备方法为:[1分] B.泛制法 27.无菌、无热原是对下列哪个剂型的要求:[1分] A.注射剂 28.醇溶液调PH法可驱除:[1分] A.鞣质
1、判断下列说法正误,并说明原因。 (1)马氏体是硬而脆的相。 (2)过冷奥氏体的冷却速度大于Vk时,则冷速越大,所得马氏体的硬度越高。(3)钢中的合金元素含量越高,其淬火后的硬度也越高。 (4)本质细晶粒钢的晶粒总是比本质粗晶粒钢的晶粒细。 (5)同种钢材在同样的加热条件下,总是水冷的比油冷的淬透性好,小件的比大件的淬透性好。 2、马氏体组织有哪几种基本类型他们的形成条件、晶体结构、组织形态、性能有何特点?马氏体的硬度与含碳量关系如何? 3、说明共析碳钢C曲线各个区、各条线的物理意义并指出影响C曲线形状和位置的主要因素。 4、淬透性与淬硬层深度两者有何联系和区别影响钢淬透性的因素有哪些影响钢制零件淬硬层深度的因素有哪些? 5、用20钢进行表面淬火和用45钢进行渗碳处理是否合适?为什么? 6、一批45钢零件进行热处理时,不慎将淬火件和调质件弄混,如何区分开?为什么? 7、将两个T12钢小试样分别加热到780℃和860℃,保温后以大于临界冷却速度的速度冷却至室温,试回答问题,并说明原因。 (1)哪个温度淬火后马氏体晶粒粗大? (2)哪个温度加热淬火后马氏体含碳量较多? (3)哪个淬火后残余奥氏体量多? (4)哪个淬火后末溶碳化物量多? (5)哪个淬火适合?为什么? 8、分别用45钢和15钢制造机床齿轮,要求齿表面具有高的硬度和耐磨性,心部具有良好的韧性.安排工艺路线,热处理工序目的及使用状态下的组织。 5-3、判断下列说法正误,并说明原因。 解:1.马氏体是硬而脆的相。错,马氏体是硬的相,渗碳体才是脆的相; 2.过冷奥氏体的冷却速度大于Vk时,则冷速越大,所得马氏体的硬度越高。错,马氏体硬度取决于含碳量,与冷却速度无关。 3.钢中的合金元素含碳量越高,其淬火后的硬度也越高。错,合金元素对淬透性的影响大,但对硬度影响小 4.本质细晶粒钢的晶粒总是比本质粗晶粒钢的晶粒细。错,晶粒的大小与加
化学反应与热效应练习题 一、选择题(每题只有1个正确答案) 1、今有如下三个热化学方程式:() H2(g)+1/2O2(g)=H2O(g);△H=a kJ/mol H2(g)+1/2O2(g)=H2O(l);△H=b kJ/mol 2H2(g)+O2(g)=2H2O(l);△H=c kJ/mol 关于它们的下列表述,正确的是 A. 它们都是吸热反应 B. a、b和c均为正值 C. 反应热的关系:a=b D. 反应热的关系:2b=c 2、已知:H2(g)+F2(g)2HF(g)+270kJ,下列说法正确的是( ) A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量 B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ C.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量 D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ 3、白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的 能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P=O ckJ·mol—1、O=O dkJ·mol—1。 根据图示的分子结构和有关数据估算该反应的△H,其中正确的是()A.(6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 C.(4c+12b-4a-5d)kJ·mol—1 D.(4a+5d-4c-12b)kJ·mol—1 4、已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、 -1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( ) A.-44.2kJ·mol-1B.+44.2kJ·mlo-1 C.-330kJ·mol-1D.+330kJ·mlo-1 5、化学反应N2+3H2=2NH3的能量变化如题13图所示,该反应的热化学方程式 是( ) A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1 B.N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1 C.1 2 N2(g)+ 3 2 H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1 D.1 2 N2(g)+ 3 2 H2(g)=NH3(g); △H=(a+b)kJ·mol-1 6、下列关于热化学反应的描述中正确的是( )
阳离子表面活性剂的合成 ●1、胺盐型 ●高级伯、仲、叔胺与酸中和便成为胺盐 ●伯胺盐R-NH2HCl ●仲胺盐R-NH(CH3)HCl ●叔胺盐R-N(CH3)2HCl ● ●常用的酸有盐酸、甲酸、乙酸、氢溴酸、硫酸等 1.1、高级伯胺的制取( RCH2NH2) 常用高级伯胺的合成方法:脂肪酸法和高级醇法。 脂肪酸法:以RCOOH为起点 ●高级醇法:以ROH为起点 1.1.1脂肪酸法 脂肪酸与氨在0.4~0. 6MPa、300~320℃下反应生成脂肪酸酯. RCOOH+NH3=RCONH2+H2O 然后用铝土矿石作催化剂,进行高温催化脱水,得到脂肪腈: RCONH=RCN+ H2O 脂肪腈用金属镍作催化剂,加氢还原,可得到伯胺、仲胺和叔胺 RCN+2H2=RCH2NH2 2RCN+4H2=(RCH2)2 NH+NH3 3RCN+6H2=(RCH2)3 N+2NH3 再加入一种合适的添加剂(氢氧化钾或氢氧化钠)即能抑制仲胺的生成。 ●工业生产上的反应压力2.94~6.87MPa、温度为120~150℃。如果碱的用量达到0.5%反应可在1. 22~1. 42MPa下进行。如果需制取不饱和碳链的脂肪胺(如十八烯胺),则氢化反应可在有氨饱和的醇中进行。脂肪酸、氨和氢直接在催化剂上反应制取胺的新工艺如下:RCOOH+2H2+NH3→RCH2NH2+ H2O 1.1. 2.脂肪醇法 脂肪醇和氨在380℃-400℃和12.16~17.23MPa下反应可制得: ●ROH+NH3→RNH2 +H2O ●高碳醇与氨在氢气和催化剂存在下,也能发生上述反应,使用催化剂,可将反应温度和压力降至150 ℃和10.13MPa。伯胺大量用于浮游选矿剂和纤维柔软剂。如C8- C18伯胺,椰子油、棉子油,牛脂等制得的混合伯胺以及它们的醋酸盐均为优良浮选剂。用作纤维柔软剂的伯胺结构复杂些,多为含酰胺键的亚乙基多胺化合物。 1.2、高级仲胺的制取 仲胺盐阳离子的合成方法主要有如下几种。 1.2.1.脂肪醇法 高碳醇和氨在镍、铅等催化剂存在下生成仲胺。 2ROH+NH3→R2NH+ H2O 1.2.2.脂肪腈法 首先,将脂肪腈在低温下转化为伯胺,然后在铜铬催化剂存在下脱氨,得到仲胺。 RNH2 →R2NH + NH3 1.2.3卤代烷法 卤代烷和氨在密封的反应器中反应.主要产物为仲胺。仲胺盐的价值相对于伯胺尤其是叔胺而言,明显低些。市售产品主要是高级卤代烷与乙醇胺或高级胺与环氧乙烷的反应产物,品种较少。 1.3、高级叔胺的制取 叔胺盐是胺盐型阳离子表面活性剂中的一个大类,用途较广。叔胺又是制取季铵盐的主要原料。其合成方法及原料路线有许多,应用较多的有如下几种。 1.31.伯胺与环氧乙烷或环氧丙烷反应制叔胺 这—方法是工业上制取叔胺的重要方法。应用很广,反应式如下: CH2CH2OHRNH2+2CH2— CH2→RN O CH2CH2OH 在碱性催化剂存在下可进一步反应,生成聚醚链,如下式所示: (CH2CH2O)pH RN (CH2CH2O)pH 分子中随聚氧乙烯含量增加,产物的非离子性质也增加;但在水中的溶解度却不随pH值的变化而改变,并且具有较好的表面活性。有人称其为阳离子进行非离子化的产品。 1.3.2.脂肪酸与低级胺反应制取叔胺 由这类叔胺制得的胺盐成本较低,性能较好,大都用作纤维柔软整理剂。例如,硬脂酸和三乙醇胺加热缩合酯化,形成叔胺,再用甲酸中和,生成索罗明A型阳离子表面活性剂。 用硬脂酸和氨基乙醇胺或二亚乙基三胺加热缩合后再与尿素作用,经醋酸中和后,可制得优良的纤维柔软剂阿柯维尔A,分子式如下: 1.3.3.非对称高级叔胺的制取 非对称叔胺是合成季铵盐的中间体。通常它是由一个C8以上长碳链和两个短碳链(如甲基、乙基、苄基等)构成。其合成路线有以下几条。
第1章金属的结构与结晶 一、填空: 1、原子呈无序堆积状态的物体叫,原子呈有序、有规则排列的物体称为。一般固态金属都属于。 2、在晶体中由一系列原子组成的平面,称为。通过两个或两个以上原子中心的直线,可代表晶格空间排列的的直线,称为。 3、常见的金属晶格类型有、和三种。铬属于晶格,铜属于晶格,锌属于晶格。 4、金属晶体结构的缺陷主要有、、、、、和 等。晶体缺陷的存在都会造成,使增大,从而使金属的提高。 5、金属的结晶是指由原子排列的转变为原子排列的过程。 6、纯金属的冷却曲线是用法测定的。冷却曲线的纵坐标表示,横坐标表示。 7、与之差称为过冷度。过冷度的大小与有关, 越快,金属的实际结晶温度越,过冷度也就越大。 8、金属的结晶过程是由和两个基本过程组成的。 9、细化晶粒的根本途径是控制结晶时的及。 10、金属在下,随温度的改变,由转变为的现象称为
同素异构转变。 二、判断: 1、金属材料的力学性能差异是由其内部组织结构所决定的。() 2、非晶体具有各向同性的特点。() 3、体心立方晶格的原子位于立方体的八个顶角及立方体六个平面的中心。() 4、金属的实际结晶温度均低于理论结晶温度。() 5、金属结晶时过冷度越大,结晶后晶粒越粗。() 6、一般说,晶粒越细小,金属材料的力学性能越好。() 7、多晶体中各晶粒的位向是完全相同的。() 8、单晶体具有各向异性的特点。() 9、在任何情况下,铁及其合金都是体心立方晶格。() 10、同素异构转变过程也遵循晶核形成与晶核长大的规律。() 11、金属发生同素异构转变时要放出热量,转变是在恒温下进行的。() 三、选择 1、α—Fe是具有()晶格的铁。 A、体心立方 B、面心立方 C、密排六方 2、纯铁在1450℃时为()晶格,在1000℃时为()晶格,在600℃时为 ()晶格。A、体心立方 B、面心立方 C、密排六方 3、纯铁在700℃时称为(),在1000℃时称为(),在1500℃时称为()。
高考反应热的计算真题汇 编 Final revision on November 26, 2020
2017、2016年高考卷反应热的计算真题(word高清版含答案) 1.(2017全国新课标I卷28题) 28.(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为 ________________、______________,制得等量H 2 所需能量较少的是 _____________。 2.(2017全国新课标II卷27题) 27.(1)正丁烷(C 4H 10 )脱氢制1-丁烯(C 4 H 8 )的热化学方程式如下: ①C 4H 10 (g)=C 4 H 8 (g)+H 2 (g)ΔH1 已知:②C 4H 10 (g)+1 2 O 2 (g)=C 4 H 8 (g)+H 2 O(g)ΔH2=?119kJ·mol1 ③H 2(g)+1 2 O 2 (g)=H 2 O(g)ΔH3=?242kJ·mol1 反应①的ΔH1为________kJ·mol1。 3.(2017全国新课标III卷7题) 7.化学与生活密切相关。下列说法错误的是 A.PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物 B.绿色化学要求从源头上消除或减少生产活动对环境的污染C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放D.天然气和液化石油气是我国目前推广使用的清洁燃料 4.(2017全国新课标III卷28题) 28.(3)已知:As(s)+3 2 H 2 (g)+2O 2 (g)=H 3 AsO 4 (s)ΔH1 H 2(g)+ 1 2 O 2 (g)=H 2 O(l)ΔH2 2As(s)+5 2 O 2 (g)=As 2 O 5 (s)ΔH3 则反应As 2O 5 (s)+3H 2 O(l)=2H 3 AsO 4 (s)的ΔH=_________。 5.(2017天津卷7题)
染整工艺原理课后作业 题答案 WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】
课后习题: 1水处理主要方法: 石灰—纯碱法,离子交换法,软水剂添加法 2简述精炼液的组成及各部分的作用? (1)烧碱(NaoH)煮练剂使果胶中的酯键水机,部分含氮物质蛋白质分子中的酰胺键水解,还能使蜡状物质中的脂肪酸类物质发生皂化而溶解 (3)硅酸钠吸附煮练液中的铁质,防止织物上产生锈斑,吸附煮练液中已分解的杂质,防止再次产生锈斑 (4)亚硫酸氢钠:有利于棉籽壳的去除,木质素→木质素磺酸→木质素磺酸钠,还原剂防止棉织物在高温带碱的情况下被空气氧化而脆损 (5)磷酸三钠作为软水剂 3试设计一种纯棉织物连续平幅退浆,精炼工艺 4在精炼工艺中,主要加入哪些表面活性剂?试述它们的作用原理。 5作为良好的润湿剂,洗涤剂,乳化剂,应具有怎样的化学结构?为什么? 6试从润湿方程来说明精炼的原布为什么不能被水润湿? 7原布检验包含哪些内容? 原布检验→翻布→打印→缝头 (1)物理指标:幅宽,重量,纱支,密度,强力等(规格) (2)外观疵点:如缺经,断纬,跳纱,棉结等(品质) (3)普通棉织物:抽查10%左右; (4)毛织物:全部检验; 8简述棉织物碱退浆,酶退浆原理。加工工艺条件? 碱退浆的原理: 1)在热碱的作用下浆料会发生溶胀,从凝胶状态变成溶胶状态而与纤维的粘着变松,容易洗落下来。
酶退浆的原理: 酶是一类具有特殊催化能力的蛋白质,对某些物质的分解有特定的催化作用。淀粉酶 能催化淀粉大分子链发生水解而生成分子量较小、粘度较低、溶解度较高的一些低分 (1)漂白后的织物经1g/L烧碱溶液沸煮1小时后、织物强力大幅度下降的现象被称 为潜在损伤。 (2)原因:主要是由于葡萄糖的升环所致 (3)通过测定织物的煮练强力来快速测定潜在损伤 10简述精炼效果的评定方法? 毛效:煮练效果的评定一般用毛效指标来判定,即30分钟内水沿织物向上爬升的高度(CM)。棉机织物要求毛效在8CM以上;棉针织物要求毛效在12CM以上 11NaClO漂白为什么不在中性或酸性条件下漂白? ①酸性条件下,但Cl2逸出,污染环境 ②中性条件,fibre损伤最严重,此时氧化纤维素羧基多,对纤维的损伤程度较大。 所以选择pH9—10漂白,尽管漂白速度慢一些,但通过延长t可达到目的。 12简述NaClO漂白原理及其特点。并以连续轧漂为例,制定其具体的漂白工艺阐述其 工艺参数选择的条件。 Naclo漂白的特点是:1)价格较低,漂白工艺及设备也比较简单; 2)在漂白过程中因产生对人体有害的毒气,同时又存在环 境污染的问题,因此其应用受到了一定的限制; 3)主要用于棉织物漂白,尤其是低级棉的漂白,不能用于 蛋白质纤维的漂白。 漂白原理是:天然色素的结构特征:分子中含有较长的共轭双键。.Naclo具有较强的 氧化能力,为弱酸强碱盐,在水中能发生水解,溶液呈碱性:.Naclo+H 2 O→HOCl+NaOH, HOCl可按下式进一步电离:HOCl→OCl+ -H,HOCl漂白有效成分:OCl-,HOCl,Cl 2 在 漂白过程中会发生各种形式的分解,这些分解物能使色素中的部分双键饱和,从而达 到消色漂白的目的,同时也能使纤维素遭到氧化,而导致强力下降。 工艺流程:水洗→浸轧漂液→堆置→水洗→酸洗→堆置→水洗→脱氯→水洗。 漂白液的PH为:温度为20-35min,通常采用室温工艺 有效氯浓度:2-5g∕L, 时间30-60min。 13H 2O 2 漂白时为什么要加入稳定剂并阐述Na2CO3在漂白过程中的作用及原理? 加入原因:H2O2在漂白过程中除了对天然色素有破坏作用外,同时也会使纤维素纤维氧化而受损,因此在漂白过程中要有效的控制双氧水的分解速率,通常在漂液中要加入一定的稳定剂如硅酸钠等。硅酸钠的稳定原理:可能是由于漂液中的硅酸钠
《钢的热处理》习题与思考题参考答案 (一)填空题 1.板条状马氏体具有高的强度、硬度及一定的塑性与韧性。 2.淬火钢低温回火后的组织是 M回(+碳化物+Ar),其目的是使钢具有高的强度和硬度;中温回火后的组织是 T回,一般用于高σ e 的结构件;高温回火后的组织是S回,用于要求足够高的强度、硬度及高的塑性、韧性的零件。 3.马氏体按其组织形态主要分为板条状马氏体和片状马氏体两种。 4.珠光体按层片间距的大小又可分为珠光体、索氏体和托氏体。 5.钢的淬透性越高,则临界冷却却速度越低;其C曲线的位置越右移。 6.钢球化退火的主要目的是降低硬度,改善切削性能和为淬火做组织准备;它主要适用于过共析(高碳钢)钢。 7.淬火钢进行回火的目的是消除内应力,稳定尺寸;改善塑性与韧性;使强度、硬度与塑性和韧性合理配合。 8.T8钢低温回火温度一般不超过 250℃,回火组织为 M回+碳化物+Ar ,其硬度大致不低于 58HRC 。(二)判断题 1.随奥氏体中碳含量的增高,马氏体转变后,其中片状马氏体减小,板条状马氏增多。(×) 2.马氏体是碳在a-Fe中所形成的过饱和间隙固溶体。当发生奥氏体向马氏体的转变时,体积发生收缩。(×) 3.高合金钢既具有良好的淬透性,又具有良好的淬硬性。(×) 4.低碳钢为了改善切削加工性,常用正火代替退火工艺。(√) 5.淬火、低温回火后能保证钢件有高的弹性极限和屈服强度、并有很好韧性,它常应用于处理各类弹簧。(×) 6.经加工硬化了的金属材料,为了基本恢复材料的原有性能,常进行再结晶退火处理。(√) (三)选择题 1.钢经调质处理后所获得的组织的是 B 。 A.淬火马氏体 B.回火索氏体 C.回火屈氏体 D.索氏体 2.若钢中加入合金元素能使C曲线右移,则将使淬透性 A 。 A.提高 B.降低 C.不改变 D.对小试样提高,对大试样则降代 3.为消除碳素工具钢中的网状渗碳体而进行正火,其加热温度是 A 。 A.Accm+(30~50)℃ B.Accm-(30~50)℃ C.Ac1+(30~50)℃ D.Ac1-(30~50)℃ 4.钢丝在冷拉过程中必须经 B 退火。 A.扩散退火 B.去应力退火 C.再结晶退火 D.重结晶退火 5.工件焊接后应进行 B 。A.重结晶退火 B.去应力退火 C.再结晶退火 D.扩散退火 6.某钢的淬透性为J,其含义是 C 。 A.15钢的硬度为40HRC B.40钢的硬度为15HRC C.该钢离试样末端15mm处硬度为40HRC D.该钢离试样末端40mm处硬度为15HRC (四)指出下列钢件的热处理工艺,说明获得的组织和大致的硬度: ① 45钢的小轴(要求综合机械性能好); 答:调质处理(淬火+高温回火);回火索氏体;25~35HRC。 ② 60钢簧; 答:淬火+中温回火;回火托氏体;35~45HRC。 ③ T12钢锉刀。答:淬火+低温回火;回火马氏体+渗碳体+残余奥氏体;58~62HRC。
2017、2016年高考卷反应热的计算真题(word高清版含答案) 1.(2017全国新课标I卷28题) 28.(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为 ________________、______________,制得等量H2所需能量较少的是 _____________。 2.(2017全国新课标II卷27题) 27.(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下: ①C4H10(g)= C4H8(g)+H2(g) ΔH1 O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1已知:②C4H10(g)+1 2 O2(g)= H2O(g) ΔH3=242kJ·mol1 ③H2(g)+ 1 2 反应①的ΔH1为________kJ·mol1。 3.(2017全国新课标III卷7题) 7. 化学与生活密切相关。下列说法错误的是 A.是指粒径不大于μm的可吸入悬浮颗粒物 B.绿色化学要求从源头上消除或减少生产活动对环境的污染 C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 D.天然气和液化石油气是我国目前推广使用的清洁燃料 4.(2017全国新课标III卷28题) H2(g)+2O2(g)=H3AsO4(s) ΔH1 28.(3)已知:As(s)+3 2 O2(g)=H2O(l) ΔH2 H2(g)+1 2
2As(s)+5 O2(g) =As2O5(s) ΔH3 2 则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =_________。 5.(2017天津卷7题) 7. (3)mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·x H2O的液态化合物,放热kJ,该反应的热化学方程式为___ _____ __。 6.(2017北京卷26题) 26.(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。 已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+ kJ·mol-1 2C(s)+O2(g)=2CO(g) ΔH2= kJ·mol-1 ①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:________ _________。 ②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:____________ ___。 7.(2017江苏卷单科8题) 8.通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确 ...的是 ①C(s) + H 2O(g)CO(g) + H2 (g) ΔH1 = a kJ·mol-1 ②CO(g) + H 2O(g)CO2 (g) + H2 (g) ΔH 2 = b kJ·mol-1 ③CO 2 (g) + 3H2 (g)CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol-1 ④2CH 3OH(g)CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol-1
怎样认识加聚反应和缩聚反应 加聚反应是加成聚合反应的简称,是指以不饱和烃或含不饱和键的物质为单体,通过不饱和键的加成,聚合成高聚物的反应。例如,乙烯加聚成聚乙烯,是在适当的温度、压强和催化剂存在的条件下,乙烯分子中的双键会断裂其中的一个键,发生加成反应,使乙烯分子里的碳原子结合成为很长的键。 CH2=CH2+CH2=CH2+CH2=CH2+……→ —CH2—CH2—CH2—CH2—CH2…… 这个反应可以用方程式表示为: 反应的产物是聚乙烯,它是一种相对分子质量很大的化合物,其分子组成可以表示为(C2H4)n。 加聚反应根据参加反应的单体种类,又分为均聚反应和共聚反应。仅由一种单体发生的加聚反应叫做均聚反应,合成聚乙烯的反应就是均聚反应。由两种以上单体共同参加的聚合反应叫共聚反应。例如,合成丁苯橡胶的反应即为共聚反应。这个反应可用下式表示: 加聚反应的特点是: (1)单体必须是含有双键等不饱和键的化合物。例如,氯乙烯、丙烯腈等含不饱和键的物质,在一定条件下,都可以发生加聚反应。 (2)加聚反应发生在不饱和键上。 (3)发生加聚反应的过程中,没有副产物产生,得高聚物的化学组成跟 (4)加聚反应生成的高聚物相对分子质量为单体整数倍。 缩聚反应是缩合聚合反应的简称,是指单体之间相互作用生成高分子,同时还生成小分子(如水、氨、卤化氢等)的聚合反应。例如合成酚醛树脂的反应就是缩聚反应。合成酚醛树脂通常是以苯酚和甲醛为原料,在催化剂作用下,经缩聚反应而得到。 缩聚反应根据参加反应的单体种数又分为共缩聚和均缩聚,由不同种单体参加的缩聚反应称为共缩聚。如酚醛树脂的合成反应就是共缩聚,它是由苯酚和甲醛两种物质为单体的。由同种单体进行的缩聚反应称为均缩聚。如氨基酸聚合成多肽的缩聚反应就属均缩聚。 缩聚反应的特点是:(1)单体不一定含有不饱和键,但必须含有两个或两个以上的反应基团(如—OH、—COOH、—NH2、—X等) (2)缩聚反应的结果,不仅生成高聚物,而且还有副产物分子生成。 (3)所得高分子化合物的化学组成跟单体的化学组成不同。由上可见,加聚反应和缩聚反应的单体结构、反应机理、产物的化学组成都是截然不同的。