
实验四定量PCR扩增
姓名:李宗翰专业:环境工程学号:1432999 同组人姓名:刘雪飞
一、实验目的
复习定量PCR原理,熟悉绝对定量的操作流程
二、实验原理
实时荧光定量PCR是在PCR反应体系中加入荧光基团,利用荧光信号累积实时监测整PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。在PCR扩增的指数时期,模板的Ct 值和该模板的起始拷贝数存在线性关系,通过Ct值和标准曲线的分析对起始模板进行定量分析
三、实验仪器及材料
real time PCR仪(ABI7500, RotorGene 3000),微量移液器,Tip头,0.2ml光学薄壁管,8联PCR管,1.5ml离心管,SYBR Mix,引物及108 copy/ul 标准品
四、实验步骤
1、标准样品稀释:取4个1.5ml的离心管,写上标记107,106, 105, 104,向每管加入90μl ddH2O,取10μl 108copy/ul 的标样加入到107管中,充分混匀后,从管中取10μl 107copy/ul的液体到106管中。按上述操作依次稀释,得到5个倍数的标准样品。注意,每次稀释都要换Tip头。
2、配制预混液:取119μl ddH2O、7μl引物4204f、7μl引物4448r和7μl Rox 到装有175μl SYBR Mix液的1.5ml离心管中,混匀。
3、分装预混液:取7个小离心管,分别标记108、107、106、105、10
4、UNK (未知样)、NTC(阴性对照)。向其中分别加入42μl预混液和4.7μl模板(1-5号加标样、6号加未知样、7号加等量ddH2O),混匀。
4、戴上手套取两个8联管,并排放置管架上。分别取上述样品20μl至第1-7管中(第8管空出),每个样品两个重复,共14个样品。将加好样的8联管振荡。
5、设置分析仪参数如下:95℃3min;95℃15s+60℃40s为一个循环,循环次数40,融解曲线温度范围60~95℃。振荡好的样品进机进行PCR扩增。
6、扩增后利用软件分析C T值及未知样的定量结果。
五、实验结果与讨论
1、实验结果如何?试分析。答:实验结果及分析如下。(1)、实验具体数据见下表
Well Task CтCт Mean Cт SD Quantity Quantity
Mean Quantity SD
Ct
Threshold
A1 STANDARD 8.2488 8.2527 0.0055 100000000 0.0712 A2 STANDARD 8.2565 8.2527 0.0055 100000000 0.0712 B1 STANDARD 11.3893 11.6598 0.3825 10000000 0.0712 B2 STANDARD 11.9303 11.6598 0.3825 10000000 0.0712 C1 STANDARD 15.3292 14.9668 0.5126 1000000 0.0712 C2 STANDARD 14.6043 14.9668 0.5126 1000000 0.0712 D1 STANDARD 19.4912 19.3080 0.2590 100000 0.0712 D2 STANDARD 19.1249 19.3080 0.2590 100000 0.0712 E1 STANDARD 22.5385 22.4196 0.1681 10000 0.0712 E2 STANDARD 22.3007 22.4196 0.1681 10000 0.0712 F1 UNKNOWN 8.9370 8.9691 0.0454 ******** 58302584 1695285.625 0.0712 F2 UNKNOWN 9.0012 8.9691 0.0454 ******** 58302584 1695285.625 0.0712 G1 NTC 32.5329 0.0712 G2 NTC 32.9549 0.0712 其中,A-E为标准样品,F为位置样品,G为阴性对照。每个样品做两个平行。
通过软件分析,由标准曲线得到的未知样品的定量结果约为5.83×107。
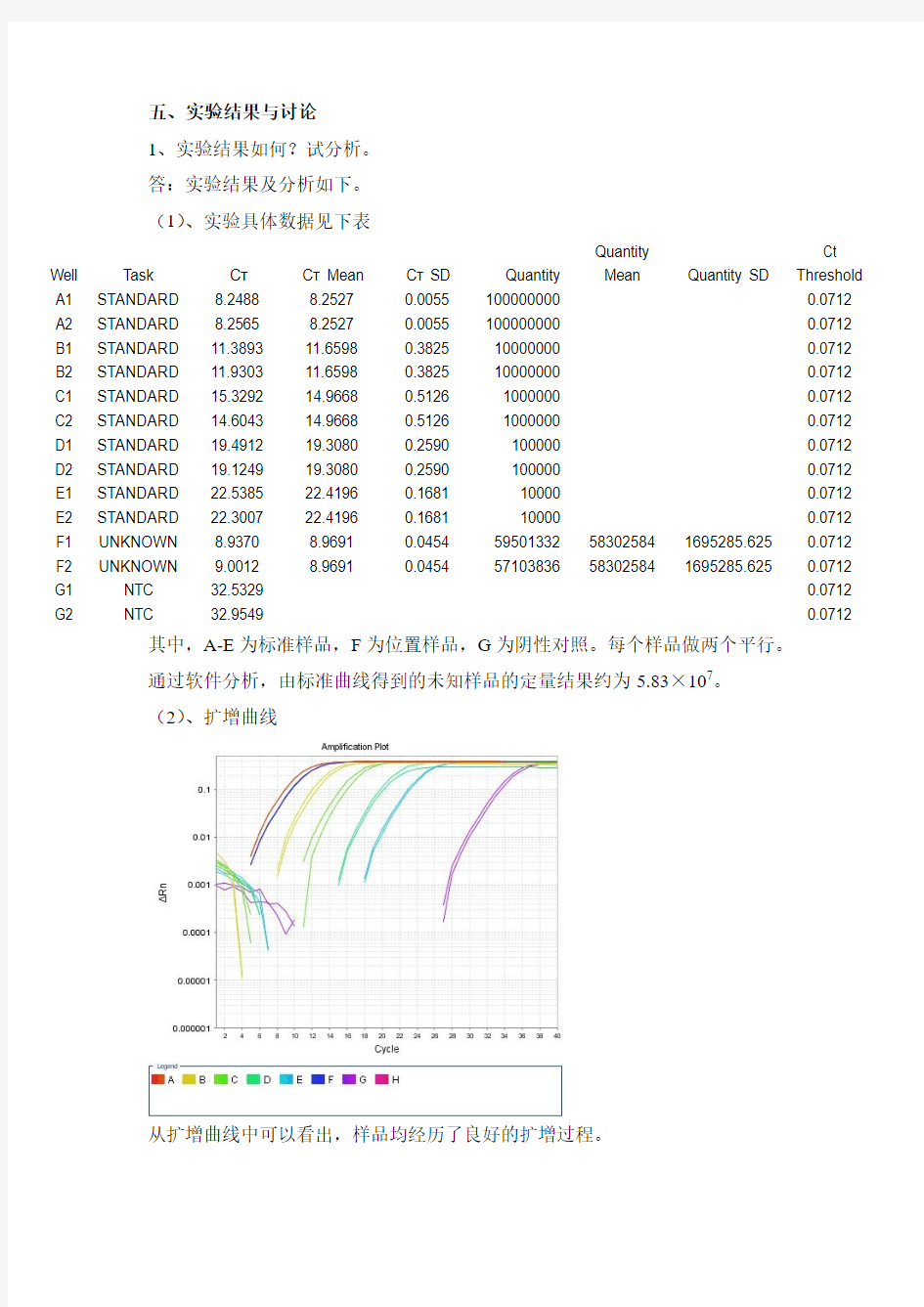
(2)、扩增曲线
从扩增曲线中可以看出,样品均经历了良好的扩增过程。
(3)、标准曲线
从标准曲线中可以看出,R2值较好,标准曲线可以使用。但扩增效率一般。其中106和107的两个平行样的CT偏差较大,这一现象可以从(1)表中看出,其SD分别为0.5126和0.3825,相比其他点较大,一般认为SD大于0.5不理想。(4)、融解曲线
图中,可以看出每条曲线均为单峰且在一个合理的温度范围内(82~86℃),所以扩增是正常的,不存在非特异性扩增。
2、实验过程中需要注意些什么细节?
答:(1)、操作过程中尽量不要说话,以避免污染;
(2)、用微量移液器加样品时应保证枪头深入液面以下,这样样品不会留在管壁上;
(3)、不能在定量PCR管做标记,裸手不可以接触定量PCR管,操作时应戴手套。
(4)、8联定量PCR管加完样后,可先将盖子放上,等放到振荡机上再把盖子盖紧。
3、通过这个实验你有什么收获?这个实验对你今后开展相关实验研究是否有帮助?
答:通过实验我加深了对定量PCR的理论认识,熟悉了实时荧光定量PCR的操作流程。这一实验对我今后研究环境问题的微生物活动方面是有帮助的。
六、思考题
如果你自己的试验过程中,发现扩增效率是0.76、1.52或0.99, 实验结果能用吗?如果结果不能用,请说明原因,怎么样改变实验来解决这个问题?
答:扩增效率的有效值分两个范围,宽范围在0.8-1.2之间,窄范围在0.9-1.1之间。如题,若实验得到的扩增效率为0.76或1.52,均在宽范围之外吗,则说明扩增不太理想,数据不能直接用。可以通过删除某些偏差较大的点来提高扩增效率,若还不行,则需要重新实验。若扩增效率为0.99,则表明扩增较好,结果可以使用。
在实验中,可以使用购买特定公司配好的mix溶液,来提高扩增效率。若扩增效率太低,可能存在非特异性扩增,应排查一下反应体系,根据融解曲线是否单峰,并结合扩增曲线CT值进行综合分析。