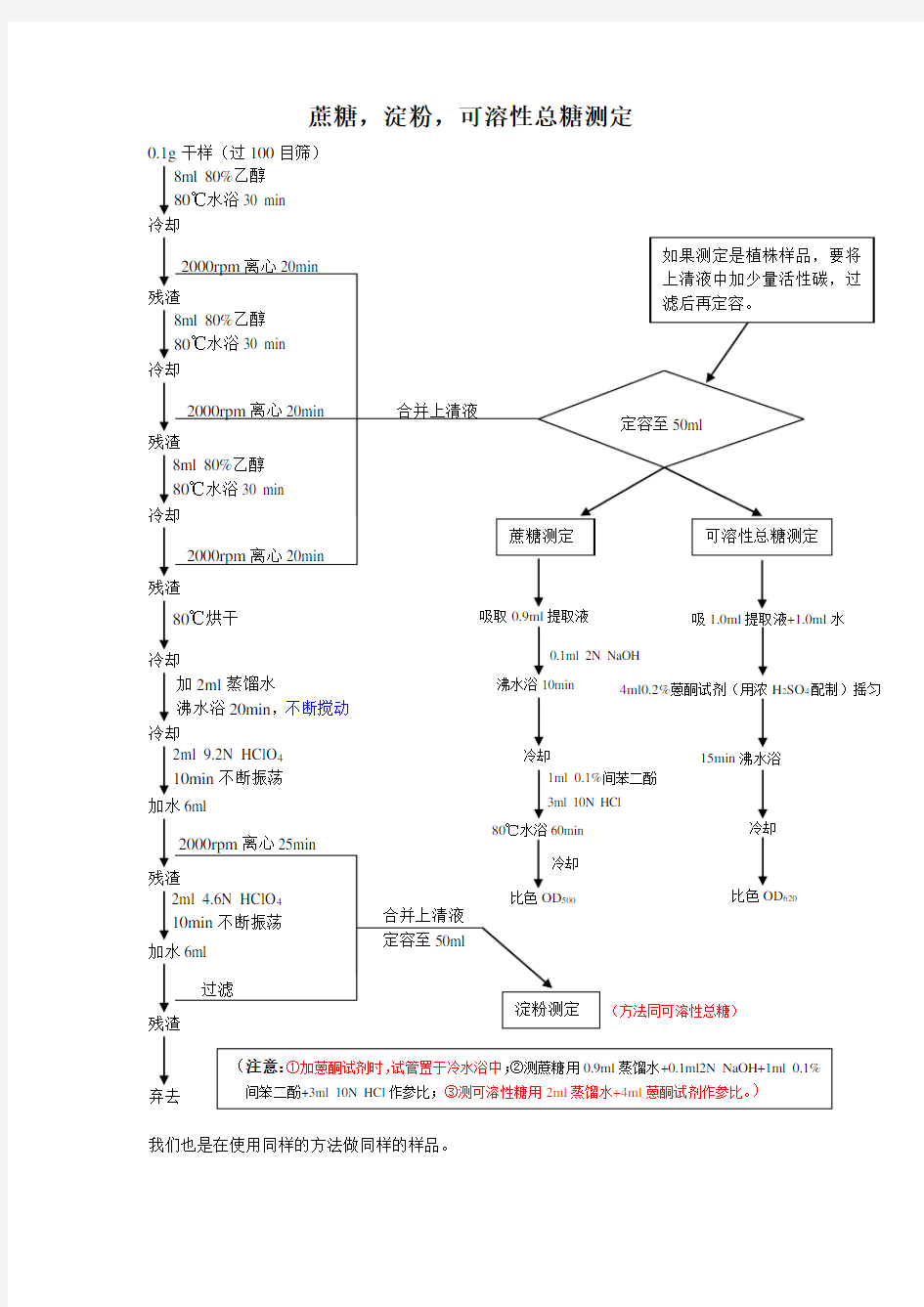
蔗糖,淀粉,可溶性总糖测定
0.1g 干样(过100目筛) 冷却
冷却
冷却
加水6ml
弃去
我们也是在使用同样的方法做同样的样品。
沸水浴10min
冷却 提取液4ml0.2%蒽酮试剂(用浓H 2SO 4配制)摇匀
15min 沸水浴 冷却 比色OD 620 0.1ml 2N NaOH
1ml 0.1%间苯二酚 3ml 10N HCl (方法同可溶性总糖)
加2ml 蒸馏水
沸水浴20min ,不断搅动
2ml 9.2N HClO 4
10min 不断振荡
8ml 80%乙醇 80℃水浴30 min
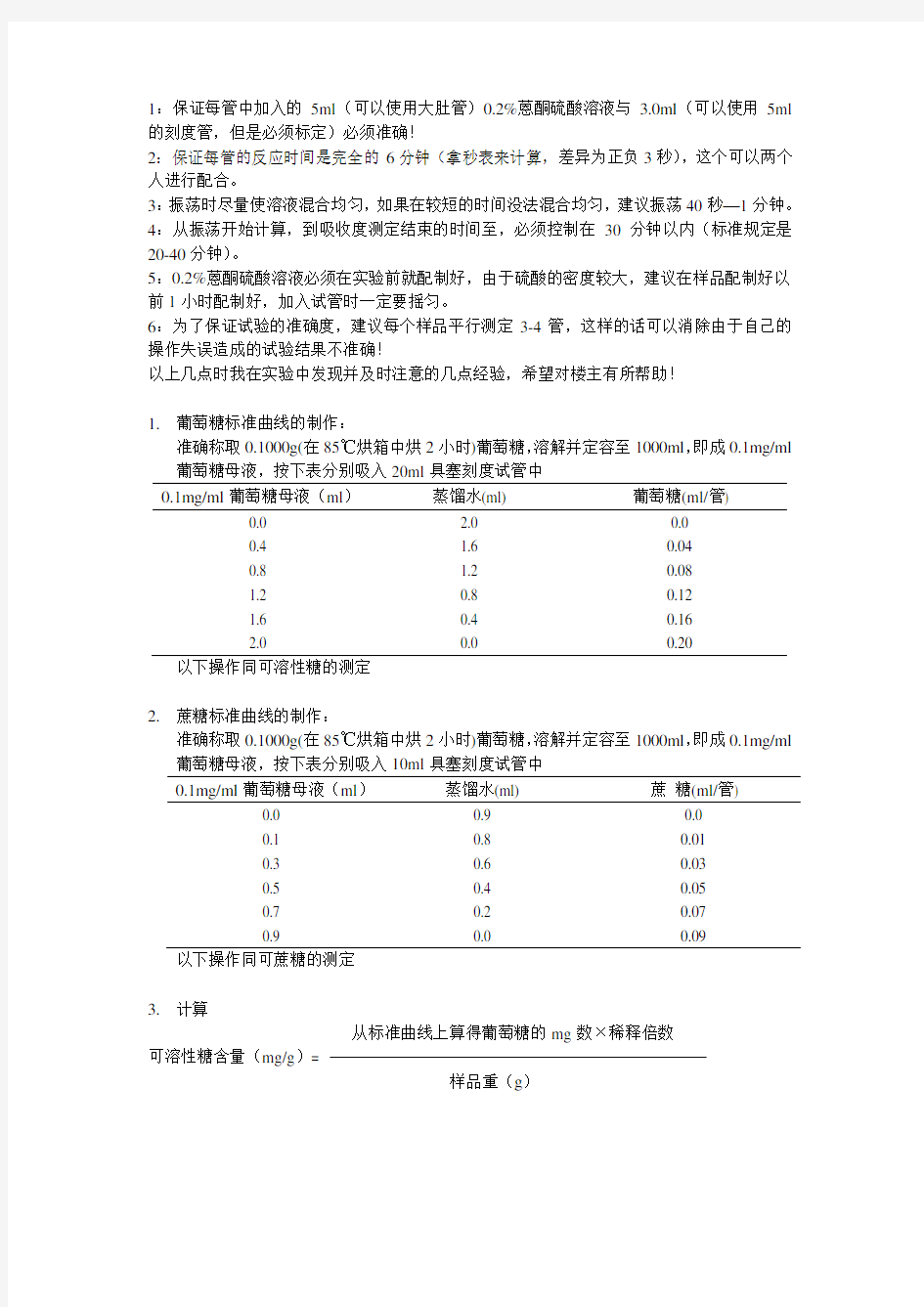
1:保证每管中加入的5ml(可以使用大肚管)0.2%蒽酮硫酸溶液与3.0ml(可以使用5ml 的刻度管,但是必须标定)必须准确!
2:保证每管的反应时间是完全的6分钟(拿秒表来计算,差异为正负3秒),这个可以两个人进行配合。
3:振荡时尽量使溶液混合均匀,如果在较短的时间没法混合均匀,建议振荡40秒—1分钟。4:从振荡开始计算,到吸收度测定结束的时间至,必须控制在30分钟以内(标准规定是20-40分钟)。
5:0.2%蒽酮硫酸溶液必须在实验前就配制好,由于硫酸的密度较大,建议在样品配制好以前1小时配制好,加入试管时一定要摇匀。
6:为了保证试验的准确度,建议每个样品平行测定3-4管,这样的话可以消除由于自己的操作失误造成的试验结果不准确!
以上几点时我在实验中发现并及时注意的几点经验,希望对楼主有所帮助!
1.葡萄糖标准曲线的制作:
准确称取0.1000g(在85℃烘箱中烘2小时)葡萄糖,溶解并定容至1000ml,即成0.1mg/ml 葡萄糖母液,按下表分别吸入20ml具塞刻度试管中
0.1mg/ml葡萄糖母液(ml)蒸馏水(ml) 葡萄糖(ml/管)
0.0 2.0 0.0
0.4 1.6 0.04
0.8 1.2 0.08
1.2 0.8 0.12
1.6 0.4 0.16
2.0 0.0 0.20
以下操作同可溶性糖的测定
2.蔗糖标准曲线的制作:
准确称取0.1000g(在85℃烘箱中烘2小时)葡萄糖,溶解并定容至1000ml,即成0.1mg/ml 葡萄糖母液,按下表分别吸入10ml具塞刻度试管中
0.1mg/ml葡萄糖母液(ml)蒸馏水(ml) 蔗糖(ml/管)
0.0 0.9 0.0
0.1 0.8 0.01
0.3 0.6 0.03
0.5 0.4 0.05
0.7 0.2 0.07
0.9 0.0 0.09
以下操作同可蔗糖的测定
3.计算
从标准曲线上算得葡萄糖的mg数×稀释倍数
可溶性糖含量(mg/g)=
样品重(g)
从标准曲线上算得蔗糖的mg数×稀释倍数
蔗糖含量(mg/g)=
样品重(g)
从标准曲线上算得葡萄糖的mg数×稀释倍数×0.9 淀粉含量(mg/g)=
样品重(g)
实验24 植物组织中可溶性糖与淀粉的测定
植物体内的碳素营养状况以及农产品的品质性状,常以可溶性糖和淀粉的含量作为重要指标,本实验学习几种定量测定可溶性糖和淀粉的方法。
一、苯酚法测定可溶性糖
【原理】
植物体内的可溶性糖主要指能溶于水及乙醇的单糖和寡聚糖。苯酚法测定可溶性糖的原理是:糖在浓硫酸作用下,脱水生成的糠醛或羟甲基糠醛能与苯酚缩合成一种橙红色化合物,在10~100μg范围内其颜色深浅与糖的含量成正比,且在485nm波长下有最大吸收峰,故可用比色法在此波长下测定。苯酚法可用于甲基化的糖、戊糖和多聚糖的测定,方法简单,灵敏度高,基本不受蛋白质存在的影响,并且产生的颜色稳定160min以上。
【仪器与用具】
分光光度计;电炉;铝锅;20ml刻度试管;刻度吸管5ml 1支,1ml 2支;记号笔;吸水纸适量。
【试剂】
1.90%苯酚溶液称取90g苯酚(AR),加蒸馏水10ml溶解,在室温下可保存数月;
2.9%苯酚溶液取3ml 90%苯酚溶液,加蒸馏水至30ml,现配现用;
3.浓硫酸(比重1.84);
4.1%蔗糖标准液将分析纯蔗糖在80℃下烘至恒重,精确称取1.000g。加少量水溶解,移入100ml容量瓶中,加入0.5ml浓硫酸,用蒸馏水定容至刻度;
5.100μg/ml蔗糖标准液精确吸取1%蔗糖标准液1ml加入100ml容量瓶中,加水定容。
【方法】
1.标准曲线的制作
取20ml刻度试管11支,从0~10分别编号,按表24-1加入溶液和水。
表24-1 各试管加溶液和水的量
然后按顺序向试管内加入1ml 9%苯酚溶液,摇匀,再从管液正面快速加入5ml浓硫酸,摇匀。比色液总体积为8ml,在恒温下放置30min,显色。然后以空白为参比,在485nm波长下比色测定,以糖含量为横坐标,光密为纵坐标,绘制标准曲线,求出标准直线方程。
2.可溶性糖的提取
取新鲜植物叶片,擦净表面污物,剪碎混匀,称取0.10~0.30g,共3份,或干材料。分别放入3支刻度试管中,加入5~10ml蒸馏水,塑料薄膜封口,于沸水中提取30min(提取2次),提取液过滤入25ml容量瓶中,反复冲洗试管及残渣,定容至刻度。
3.测定吸取0.5ml样品液于试管中(重复2次),加蒸馏水1.5ml,同制作标准曲线的步骤,按顺序分别加入苯酚,浓硫酸溶液,显色并测定光密度。由标准线性方程求出糖的量,按下式计算测试样品中糖含量。
可溶性糖含量(mg/g)=
式中C-标准方程求得糖量(μg);
a-吸取样品液体积(ml);
V-提取液量(ml);
n -稀释倍数;
W-组织重量(g)。
二、蒽酮法测定可溶性糖
【原理】
糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色深浅与糖含量成正比,故可用于糖的定量。
该法的特点是几乎可测定所有的碳水化合物,不但可测定戊糖与已糖,且可测所有寡糖类和多糖类,包括淀粉、纤维素等(因为反应液中的浓硫酸可把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值,但在测定水溶性碳水化合物时,则应注意切勿将样品的末溶解残渣加入反应液中,不然会因为细胞壁中的纤维、半纤维素等与蒽酮试剂发生反应而增加了测定误差。此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时则可避免此种误差。
糖类与蒽酮反应生成的有色物质在可见光区的吸收峰为630nm,故在此波长下进行比
色。
【仪器与用具】
同方法一。
【试剂】
1.蒽酮乙酸乙酯试剂:取分析纯蒽酮1g,溶于50ml乙酸乙酯中,贮于棕色瓶中,在黑暗中可保存数星期,如有结晶析出,可微热溶解。
2.浓硫酸(比重1.84)。
【方法】
1.标准曲线的制作
按方法一标准曲线的制作方法加入标准的蔗糖溶液,然后按顺序向试管中加入0.5ml蒽酮乙酸乙酯试剂和5ml浓硫酸,充分振荡,立即将试管放入沸水浴中,逐管均准确保温1min,取出后自然冷却至室温,以空白作参比,在630nm波长下测其光密度,以光密度为纵坐标,以糖含量为横坐标,绘制标准曲线,并求出标准线性方程。
2.可溶性糖的提取同方法一第二步。
3.显色测定吸取样品提取液0.5ml于20ml刻度试管中(重复2次),加蒸馏水1.5ml,以下步骤与标准曲线测定相同,测定样品的光密度。
4.计算可溶性糖的含量,计算公式同方法一。
三、3,5-二硝基水杨酸比色法测定还原糖
【原理】
3,5-二硝基水杨酸溶液与还原糖(各种单糖和麦芽糖)溶液共热后被还原成棕红色的氨基化合物,在一定范围内,还原糖的量和棕红色物的颜色深浅呈一定比例关系。在540nm波长下测定棕红色物质的消光度值,查标准曲线,便可求出样品中还原糖的含量。
【仪器与用具】
25ml血糖管或刻度试管;大离心管或玻璃漏斗;100ml烧杯;100ml三角瓶;100ml容量瓶;刻度吸管1ml、2ml、10ml;沸水浴;离心机(过滤法不用此设备);电子天平;分光光度计。
【试剂】
(1)1mg/ml葡萄糖标准液:准确称取100mg分析纯葡萄糖(预先在80℃烘至恒重),置于小烧杯中,用少量蒸馏水溶解后,定量转移到100ml的容量瓶中,以蒸馏水定容至刻度,摇匀,冰箱中保存备用。
(2)3,5-二硝基水杨酸试剂:6.3g 3,5-二硝基水杨酸和262ml 2mol/L NaOH溶液,加到500ml含有185g酒石酸钾钠的热水溶液中,再加5g结晶酚和5g亚硫酸钠,搅拌溶解。冷却后加蒸馏水定容至1000ml,贮于棕色瓶中备用。
【方法】
1.制作葡萄糖标准曲线
取7支具有25ml刻度的血糖管或刻度试管,编号,按表24-2所示的量,精确加入浓度为1mg/ml的葡萄糖标准液和3,5-二硝基水杨酸试剂。
将各管摇匀,在沸水浴中加热5min,取出后立即放入盛有冷水的烧杯中冷却至室温,再以蒸馏水定容至25ml刻度处,用橡皮塞塞住管口,颠倒混匀(如用大试管,则向每管加入21.5ml蒸馏水,混匀)。在540nm波长下,用0号管调零,分别读取1~6号管的消光值。以消光值为纵坐标,葡萄糖mg为横坐标,绘制标准曲线,求得直线方程。
表24-2 各试管加溶液和试剂的量
2.样品中还原糖的测定
(1)样品中还原糖的提取:准确称取3g食用面粉,放在100ml的烧杯中,先以少量蒸馏水调成糊状,然后加50ml蒸馏水,搅匀,置于50℃恒温水浴中保温20min,使还原糖浸出。离心或过滤,用20ml蒸馏水洗残渣,再离心或过滤,将两次离心的上清液或滤液全部收集在100ml的容量瓶中,用蒸馏水定容至刻度,混匀,作为还原糖待测液。
(2)显色和比色:取3支25ml刻度试管,编号,分别加入还原糖待测液2ml,3,5-二硝基水杨酸试剂1.5ml,其余操作均与制作标准曲线相同,测定各管的消光值。分别在标准曲线上查出相应还原糖mg数,按下式计算还原糖百分含量:
还原糖(%)=
式中C-标准曲线方程求得的还原糖mg数;
V-提取液的体积(ml);
a-显色时吸取样品液体积(ml);
W-样品重(g)。
四、淀粉含量的测定
【原理】
淀粉是由葡萄糖残基组成的多糖,在酸性条件下加热使其水解成葡萄糖,然后在浓硫酸的作用下,使单糖脱水生成糠醛类化合物,利用苯酚或蒽酮试剂与糠醛化合物的显色反应,即可进行比色测定。
【仪器与用具】
电子天平;容量瓶:100ml×4,50ml×2;漏斗;小试管若干支;电炉;刻度吸管0.5ml×1,2.0ml×3,5ml×4;分光光度计;记号笔。
【试剂】
(1)浓硫酸(比重1.84);
(2)9.2mol/L HClO4;
(3)2%蒽酮试剂:同蒽酮法(或9%苯酚,同方法一);
(4)淀粉标准液:准确称取100mg纯淀粉,放入100ml容量瓶中,加60~70ml热蒸馏水,放入沸水浴中煮沸0.5h,冷却后加蒸馏水稀释至刻度,则每ml含淀粉1mg,吸取此液5.0ml,加蒸馏水稀释至50ml,即为每ml含淀粉100μg的标准液。
【方法】
1.标准曲线制作
取小试管11支从0~10编号,按表24-3加入溶液和蒸馏水。
以下步骤按苯酚法或蒽酮法均可,见方法一或方法二,绘制相应的标准曲线。
表24-3 各试管加入标准液和蒸馏水量
2.样品提取
将提取可溶性糖以后的残渣,移入50ml容量瓶中,加20ml热蒸馏水,放入沸水浴中煮沸15min,再加入9.2mol/L高氯酸2ml提取15min,冷却后,混匀,用滤纸过滤,并用蒸馏水定容(或以2500r/min离心10min)。
3.测定可采用苯酚法或蒽酮显色法测定。
按下式计算淀粉的含量。淀粉水解时,在单糖残基上加了1分子水,因而计算时所得的糖量乘以0.9才为扣除加入水量后的实际淀粉含量。
淀粉含量(%)=
式中C-标准曲线查得的淀粉含量(μg);
V-提取液总量(ml);
a-显色时取液量(ml);
W-样品重(g)。
注:淀粉水解完全度试验样品测定中可同时作1份用于淀粉水解完全度检验的样品,在酸解过滤后,将其残渣加上2ml水,搅拌均匀,吸2滴于白瓷盘上,加2滴I2-KI溶液,显微镜下观察,若出现紫蓝色颗粒,证明水解不完全,其正式测试样品需再加高氯酸水解,直至不出现蓝紫色为止。
【思考题】
1.简述苯酚法与蒽酮法测定可溶性糖的基本原理。
2.干扰可溶性糖测定的主要因素有哪些?怎样避免?
九植物组织中可溶性糖含量的测定 一.实验目的 学习可溶性糖测定的蒽酮比色法 二.实验原理 植物在个体发育的各个时期,代谢活动也发生相应的变化,碳水化合物的代谢也不例外其含量也随之发生变化。了解可溶性糖含量的变化,在生理上和实践上都有重要的意义。本实验采用蒽酮比色法测定可溶性糖的含量。糖在硫酸的作用下生成糠醛,糠醛再与蒽酮作用,形成一种绿色的络合物.在低浓度时,625nm 的OD值与糖含量成正相关。该实验方法简便,但没有专一性,对于绝大部分的碳水化合物都能与蒽酮反应,产生颜色。 三.实验用品 721型分光光度计分析天平研钵恒温水浴锅烧杯刻度试管大试管活性炭移液管漏斗酒精(80%) 葡萄糖标准溶液:称取已在80℃烘箱中烘至恒重葡萄糖100mg,配制成 500mL溶液,即得每mL含糖为200μg的标准溶液。 蒽酮试剂:称取1g经过纯化的蒽酮,溶解于1000mL稀硫酸中即得。稀硫酸溶液由760mL浓硫酸(比重1.84)稀释成1000mL而成。四.实验步骤 1.可溶性糖的提取 称取0.5g的新鲜植物(青菜)叶片,于研钵中加80%酒精4ml,仔细研磨成匀浆,倒入离心管内,置于80℃水浴中不断搅拌30min,离心10分钟(5000转/min),收集上清液于10ml的刻度试管中,其残渣加2ml80%酒精重复提1
次,合并上清液。在上清液中加0.5g活性炭,80℃水浴脱色30min,定容至10ml,过滤后取滤液(稀释10倍或20倍后)测定。 2.显色及比色 吸取上述糖提取液1mL,放入一干洁的试管中,加蒽酮试剂5mL混合之,于沸水浴中煮沸10分钟,取出冷却,然后于分光光度计上进行测定,波长为625nm,测得吸光度。从标准曲线上查得滤液中得糖含量(或经直线回归公式计算),然后再行计算样品中含糖百分数。 3.绘制标准曲线 取标准葡萄糖溶液将其稀释成一系列不同浓度的溶液,浓度分别为每mL含糖0、5、10、20、40、60、80μg。按上述方法分别测得其吸光度,然后绘制A625-糖浓度曲线,或进行直线回归求得直线方程。 试剂(ml) 管号 1 2 3 4 5 6 葡萄糖标准液0 0.05 0.1 0.2 0.3 0.4 80%酒精 1.0 0.95 0.9 0.8 0.7 0.6 蒽酮-硫酸试剂 5 5 5 5 5 5 葡萄糖浓度(ug/ml) 0 10 20 40 60 80 4.计算样品中含糖量% 设V为植物样品稀释后的体积(m L) C为提取液的含糖量(μg/ m L) W为植物组织鲜重(g) 则得计算式如下:
引言 可溶性糖包括葡萄糖、果糖、蔗糖等单糖和双糖,是植物品质的重要构成性状之一,尤其是以果实为目的产品的植物,可溶性糖与酸的含量及其配比是影响果实风味品质的重要因素。对于鲜食品种,一般来讲,高糖中酸,风味浓,品质优;低糖中酸,风味淡,品质差。因此,可溶性糖的定量研究对植物的品质育种、储藏、加工特性等具有重要意义。而且可溶性糖广泛存在于植物的根、茎块和种子中,是人体热量的最最主要来源,具有较高的营养价值。本文重点介绍蒽酮比色法、铜还原碘量法、费林试剂法、原子吸收法、气相色谱法、液相色谱-蒸发光散射法,及连续流动法这几种实验如何定量测定可溶性糖含量。
1 蒽酮比色法 1.1 原理 糖在硫酸作用下生成糠醛,糠醛再与蒽酮作用形成绿色络合物,颜色的深浅与糖含量有关。在625 nm波长下的OD值与糖含量成正比。由于蒽酮试剂与糖反应的呈色强度随时间变化,故必须在反应后立即在同一时间内比色。 1.2 仪器与材料 1.2.1实验仪器 分光光度计,电炉,铝锅,电子天平,20ml刻度试管,刻度吸管5ml 1支、1ml 2支,漏斗。1.2.2实验试剂 (1)蒽酮乙酸乙酯试剂:取分析纯蒽酮1g,溶于50ml乙酸乙酯中,贮于棕色瓶中,在黑暗中可保存数星期,如有结晶析出,可微热溶解。 (2)浓硫酸(比重1.84)。 1.2.3实验材料 植物叶片。 1.3 实验方法 1.3.1标准曲线的制作 取20ml刻度试管11支,从0~10分别编号,按表24-1加入溶液和水。 表1 各试管加溶液和水的量 管号 0 1、2 3、4 5、6 7、8 9、10 100μg/ml蔗糖液 0 0.2 0.4 0.6 0.8 1.0 (ml) 水(ml) 2.0 1.8 1.6 1.4 1.2 1.0 蔗糖量(μg) 0 20 40 60 80 100 然后按顺序向试管内加入1ml 9%苯酚溶液,摇匀,再从管液正面快速加入5ml浓硫酸,摇匀。比色液总体积为8ml,在恒温下放置30min,显色。然后以空白为参比,在485nm 波长下比色测定,以糖含量为横坐标,光密为纵坐标,绘制标准曲线,求出标准直线方程。按表1加入标准的蔗糖溶液,然后按顺序向试管中加入0.5ml蒽酮乙酸乙酯试剂和5ml浓硫酸,充分振荡,立即将试管放入沸水浴中,逐管均准确保温1min,取出后自然冷却至室温,以空白作参比,在630nm波长下测其光密度,以光密度为纵坐标,以糖含量为横坐标,绘制标准曲线,并求出标准线性方程。 1.3.2可溶性糖的提取 取新鲜植物叶片,擦净表面污物,剪碎混匀,称取0.10~0.30g,共3份,或干材料。
实验八甘蔗汁中总糖及蔗糖含量的测定(费林法) 一、原理 蔗糖的测定常以还原糖的测定为基础,样品经前处理后,加入稀盐酸,在加热条件下使蔗糖水解转化为还原糖,再以斐林试剂法测定试样水解后的总还原糖量(即食品中的总糖)及水解前的还原糖量(食品原有的还原糖),两者之差再乘以校正系数0.95即为蔗糖量。 二、操作步骤: 1、样品处理 准确吸取10.00mL甘蔗汁移入100m L容量瓶中。缓慢加入5mL乙酸锌溶液及5mL10.6%亚铁氰化钾溶液,加水至刻度,混匀,静置后过滤,弃去初滤液,收集滤液,即样品处理液。 2、标定碱性酒石酸铜溶液(费林试剂): (1)准确吸取5.00mL碱性酒石酸铜甲液及5.00mL乙液,置于150mL锥形瓶中。 (2)加水10mL,加入玻璃珠数粒。 (3)从滴定管滴加约9mL葡萄糖(转化糖)标准溶液,2min内加热至沸,趁沸以每两秒1滴的速度继续滴加葡萄糖标准溶液,直至溶液蓝色刚好褪去,记录消耗葡萄糖标准溶的总体积。 (4)同时平行操作三份,取其平均值。 3、水解前样品中还原糖含量的测定: 取样品处理液,按还原糖法测定水解前的还原糖含量。(同实验七) 4、样品总糖量的测定: (1)吸取10.00mL样品处理液置于100mL容量瓶中。 (2)加入6mol/L 盐酸5mL,在68~70℃水浴加热15min。 (3)迅速冷却后加2滴指示剂,用20% NaOH中和(甲基红指示剂:溶液颜色由红变黄;酚酞指示剂:由无色变浅粉红色),加水至刻度,混匀,按还原糖法测定水解后的总还原糖含量。(同实验七)
三、实验记录及处理: 碱性酒石酸铜溶液的标定 10ml碱性酒石酸铜溶液相当于葡萄糖(转化糖)的质量mg。 葡萄糖标准溶液蔗糖标准溶液(转化糖) 标准溶液浓度 ρ,mg/ml 标定所耗标液的 体积V,ml 1 2 3 平均 1 2 3 平均 10mL碱性酒石酸 铜相当于葡萄糖 (转化糖)的质 量F,mg 公式:F1= ρ1× V1公式:F2 = ρ2× V2/0.95 食品中还原糖含量测定 水解前(试样原有还原糖)水解后(总糖) 试样量,ml 稀释过程 试样定容总体 积V,ml 样液预测总消 耗量V0,ml 样液正式滴定 总消耗量V1 ,ml 1 2 3 平均值 1 2 3 平均值 测得还原糖含 量,% 公式: 样品中还原糖 含量R1,% 总糖含量R2,% (以转化糖计) 蔗糖的含量,% 公式:蔗糖% = (R2-R1)×0.95 100 1000 V V m F % 计) 还原糖(以葡萄糖 1 ? ? ? = 或转化糖
蔗糖、可溶性总糖和淀粉联合测定 一、原理 CH2O+蒽酮试剂——蓝绿色物质,在含糖5-80μg显色稳定,重现性好,在620nm下测定消光值。稀碱与糖溶液共热时,可破坏还原糖,而蔗糖不被破坏;淀粉经酸水解后与蒽酮试剂显色。 注意:硫酸含水量、反应温度、显色时间均影响显色度,测定时应严格控制反应条件,使显色温度和时间与做标准曲线时一致。 二、仪器与试剂 仪器:分析天平(0.001g)、分光光度计、水浴锅、离心机(4000转/分)、离心管(10ml)、移液管(1、2、5、10ml)、容量瓶(50、100、1000ml)、试管 试剂:(1)蒽酮试剂:84ml浓硫酸+16ml蒸馏水=88%硫酸;0.15g蒽酮溶于100ml 88%硫酸(现配现用,棕色瓶中冷藏室内可存3-5天) (2)30%KOH:称取30g KOH,溶解后定容至100ml (3)9.2N高氯酸:741ml 12.4N的高氯酸定容至1000ml (4)标准蔗糖、葡萄糖溶液(1mg/ml):取分析纯0.1000g溶于蒸馏水定容至100ml 三、测定步骤 1、茎、叶、柄中的可溶性总糖和淀粉提取 (1)准确称取烘干样品0.1000g置10ml离心管中,加蒸馏水6-7ml,置沸水浴中加热提取20分钟,取出冷却,离心5-10分钟(4000r/min),转移上清液于50ml容量瓶中,同样方法重复提取两次,合并上清液于50ml容量瓶中,定容至刻度,摇匀(此为A液,供蔗糖和可溶性总糖测定)。 (2)向沉淀中加水4ml,加入2ml 9.2N高氯酸,沸水浴中提取20分钟;取出冷却,离心5-10分钟,其上清液转移于50ml容量瓶。再向沉淀中加水5ml,加入1ml9.2N高氯酸,沸水浴中提取20分钟;取出冷却,离心5-10分钟,其上清液转移于50ml容量瓶。然后用水洗沉淀1-2次,全部转移于容量瓶中,并定容至刻度,摇匀(此为B液,供淀粉测定)。 2、块根中的可溶性总糖和淀粉提取 (1)准确称取烘干样品0.1000g置10ml离心管中,加乙醇(80%)5ml,置80℃水浴中加热提取20分钟,取出冷却,离心5-10分钟(4000r/min),转移上清液于50ml容量瓶中,同样方法重复提取两次,合并上清液于50ml容量瓶中,定容至刻度,摇匀(此为A液,供蔗糖和可溶性总糖测定)。 (2)向沉淀中加水4ml,加入2ml 9.2N高氯酸,沸水浴中提取20分钟;取出冷却,离心5-10分钟,其上清液转移于50ml容量瓶。再向沉淀中加水5ml,加入1ml9.2N高氯酸,沸水浴中提取20分钟;取出冷却,离心5-10分钟,其上清液转移于50ml容量瓶。然后用水洗沉淀1-2次,全部转移于容量瓶中,并定容至刻度,摇匀(此为B液,供淀粉测定)。
三乙胺含量的测定
三乙胺含量的测定 参考标准(方法):GB/T23964 1.实验原理 用毛细管柱气相色谱法分离和定量测定,从而得到三乙胺、乙胺、二乙胺和乙醇的质量分数。 2.适用范围 适用于工业三乙胺含量的测定。 3.试剂 3.1氢气:体积分数≥99.99% 3.2空气:不含腐蚀性杂质,使用前脱油、脱水 3.3氮气:体积分数≥99.99% 4.仪器 4.1自动进样器:带1μL进样针 4.2毛细管柱:SE-30,30m×0.53mm×7.0μm 4.3气相色谱仪:Aglient7890A,带FID检测器 5.测定步骤 5.1气相检测条件 5.1.1炉温:60℃ 5.1.2进样口温度:280℃ 5.1.3检测器温度:280℃ 5.1.4氮气:恒流,5.9ml/min,分流比50:1 5.1.5进样量:1μL 5.2峰的确定 用同样的操作条件分析已知的参考标准混合样品。以其保留时间来确认样品峰。
6.计算及结果表示 采用面积归一法定量计算各组分的质量分数。 7.允许差 两次平行测定的三乙胺含量的绝对差值不大于0.1%,杂质含量的绝对差值不大于0.02%。 8.注意事项 无 三乙胺中水分含量的测定 参考标准(方法):GB/T23964 1实验原理 样品中水分与电解液中的碘和二氧化硫发生定量反应,反应式为: I2+SO2+H2O→2HI+SO3 2I—-2e=I2 参加反应的碘分子数等于水的分子数,而电解生成的碘与所消耗的电量成正比。根据法拉第定律,用测量消耗的电量得出水的量。 2试适用范围 适用三乙胺中水分含量的测定 3.试剂 电解液:默克专用试剂 4.仪器 4.1卡尔费林水分测定仪:瑞士万通 4.2天平:精确至0.0001g 4.3微量进样器:50μL 5.测定步骤
Ⅳ、植物组织中可溶性糖含量的测定(蒽酮法) 一、目的 掌握蒽酮法测定糖的原理和技术。 二、原理 糖类(包括单糖、双糖、寡糖)在浓硫酸存在下,脱水生成糠醛或羟甲基糠醛,然后蒽酮与糠醛或羟甲基糠醛经脱水缩合,生成蓝绿色的糠醛衍生物,颜色深浅与糖浓度成正相关。其反应式如下: 显色反应与反应温度、加热时间、反应系统中水和硫酸比例有关。本实验通过控制反应系统中水和硫酸比例,利用硫酸与水发生水合作用释放的热能,使反应系统自行升温而达到显色效果免去外加热步骤。 蒽酮法具有很高灵敏度,适用于糖的微量测定,且试剂简单,操作简便,因而得到普遍应用。 三、材料、仪器设备及试剂 1.材料:烘干材料粉末(过筛100目)或剪碎混匀鲜样品。 2.仪器设备: 分光光度计;电子分析天平;水浴锅;100ml容量瓶;试管;漏斗;剪刀;移液管;洗耳球等。 3.试剂及配制: 蒽酮试剂:称取蒽酮200mg溶于100ml浓硫酸中。该试剂不能久贮,宜用前配制。 100μg·ml-1 蔗糖标准母液:准确称取蔗糖100mg于烧杯加少量水溶解后,洗入 100ml容量瓶中定容至刻度。 四、实验步骤 1.蔗糖标准曲线制作 1.1取6支试管,编号,按下表配制每管含量为0~100μg蔗糖标准液 加入表中试剂后,向各管沿管壁迅速加入蒽酮试剂6.5ml,并立即摇动使混合均匀,置试管架上室温下显色,冷却后倒入比色杯,以0号管作空白对照,在620nm波长处,以多点校准总量法,制作标准曲线。 2.样品提取 称取干样品粉末100mg或剪碎混匀的鲜样品1g,放入试管中,加入蒸馏水10ml,置于沸水浴中提取20min,冷却后过滤入100ml容量瓶中,以热水冲洗残渣2~3次,一并滤入容量瓶中,待冷至室温,定容至刻度,即为样品待测液。 3.糖含量测定 吸取待测液0.2ml(含糖量30~80μg),加入试管中,再加蒸馏水2.3ml,摇匀。随后沿试管壁迅速加入蒽酮试剂6.5ml,立刻摇动混合均匀,置于试管架上显色,冷却至室温后,以空白管作对照,在620nm波长处,按多点校准定量法测定待测管中提取液糖含量。 五、结果计算
植物组织中可溶性糖含量的测定 在作物的碳素营养中,作为营养物质主要是指可溶性糖和淀粉。它们在营养中的作用主要有: 合成纤维素组成细胞壁;转化并组成其他有机物如核苷酸、核酸等;分解产物是其他许多有机物合成的原料,如糖在呼吸过程中形成的有机酸,可作为NH 3的受体而转化为氨基酸;糖类作为呼吸基质,为作物的各种合成过程和各种生命活动提供了所需的能量。由于碳水化合物具有这些重要的作用,所以是营养中最基本的物质,也是需要量最多的一类。 Ⅰ蒽酮法测定可溶性糖 一、原理 糖在浓硫酸作用下,可经脱水反应生成糠醛或羟甲基糠醛,生成的糠醛或羟甲基糠醛可与蒽酮反应生成蓝绿色糠醛衍生物,在一定范围内,颜色的深浅与糖的含量成正比,故可用于糖的定量测定。 该法的特点是几乎可以测定所有的碳水化合物,不但可以测定戊糖与己糖含量,而且可以测所有寡糖类和多糖类,其中包括淀粉、纤维素等(因为反应液中的浓硫酸可以把多糖水解成单糖而发生反应),所以用蒽酮法测出的碳水化合物含量,实际上是溶液中全部可溶性碳水化合物总量。在没有必要细致划分各种碳水化合物的情况下,用蒽酮法可以一次测出总量,省去许多麻烦,因此,有特殊的应用价值。但在测定水溶性碳水化合物时,则应注意切勿将样品的未溶解残渣加入反应液中,不然会因为细胞壁中的纤维素、半纤维素等与蒽酮试剂发生反应而增加了测定误差。此外,不同的糖类与蒽酮试剂的显色深度不同,果糖显色最深,葡萄糖次之,半乳糖、甘露糖较浅,五碳糖显色更浅,故测定糖的混合物时,常因不同糖类的比例不同造成误差,但测定单一糖类时,则可避免此种误差。 糖类与蒽酮反应生成的有色物质在可见光区的吸收峰为620 nm,故在此波长下进行比色。 二、实验材料、试剂与仪器设备
(1)试剂: 葡萄糖标准液:称取80℃烘至衡重的葡萄糖100mg,用蒸馏水定容至100mL,测定还原糖时不用稀释,测定总糖时再稀释10倍,即100μg/ml。 蒽酮试剂:蒽酮100mg溶于100ml稀硫酸(76ml浓硫酸加30ml水中),贮于棕色瓶内冰箱保存,可使用2~3周。 3,5—二硝基水杨酸试剂:1g3,5—二硝基水杨酸,溶于20mL2mol/LNaOH溶液中,加50mL 蒸馏水,再加30g酒石酸甲钠,溶解后用蒸馏水定容至100mL。 盖紧瓶塞,勿使CO2进入。若溶液浑浊可过滤后使用。 (2)样品提取: 称取研碎样品0.5~1g放入刻度试管中,加入5~10mL蒸馏水(用80%乙醇更好),在80℃水浴中30min,3500转离心10min,上清液转入25ml容量瓶,洗净掺杂并定溶至刻度,该提取液用于测定还原糖和可溶性总糖。 (3)还原糖的测定 ○1测定还原糖的标准曲线: 试剂 1 2 3 4 5 6 7 1mg/ml葡萄糖标液 0 0.2 0.4 0.6 0.8 1.0 1.2 (ml) 蒸馏水(ml) 2.0 1.8 1.6 1.4 1.2 1.0 0 3,5—二硝基水杨酸 2 2 2 2 2 2 2 (ml) 各试管摇匀,在沸水浴中加热5分钟,取出后立即放入冷水中,加蒸馏水定容至20mL,混匀。以1号管为空白调零,在540nm波长下比色。以吸光度为纵坐标,葡萄糖含量为横坐标,绘制标准曲线。葡萄糖含量按顺序分别为0、0.2、0.4、0.6、0.8、1.0、1.2,单位mg。○2样品中还原糖含量的测定 吸取可溶性糖提取液2mL,置刻度试管中,加入2mL3,5—二硝基水杨酸试剂,与标准曲线同法测定。 ○3计算:还原糖含量=CV t/WV s×100%; 式中,C:从标准曲线上查得样品中还原糖含量(mg);V t:样品中提取液总体积(mL);V s:测定时取样体积(mL);W:样品重(mg)。注意样品重是mg (4)可溶性总糖测定 ○1总糖标准曲线: 试剂 1 2 3 4 5 6 100μg/ml葡萄糖标液 0 0.2 0.4 0.6 0.8 1.0 (ml) 蒸馏水(ml) 2.0 1.8 1.6 1.4 1.2 1.0 蒽酮硫酸试剂(ml) 5 5 5 5 5 5 加蒽酮试剂时试管最好放在冷水中,并沿管壁加入,待全部加完后再混匀。将以上试管同时放入100℃水浴中准确加热10min,取出后冷却至室温后在620nm波长下测定吸光度。以吸光度为纵坐标,糖溶液浓度为横坐标,绘制标准曲线。糖溶液浓度按顺序分别为:0、20、40、60、80、100,单位μg ○2样品测定: 取提取液适当稀释(10~50倍)后取2mL测定,方法同标准曲线测定。 ○3计算结果: 可溶性总糖含量= CV t n/WV s1000×100%; 式中,C:从标准曲线上查得样品中葡萄糖含量(μg);V t:样品中提取液总体积(mL);n::测定时取样体积(mL);W:样品重(mg);1000是换算系数。注意样品重是稀释倍数;V s mg
实验方案 一、实验目的 通过实验,掌握测定萝卜品质的方法 (一)萝卜外部形态的测定 1、实验材料 取鲜样3个∕小区 直尺、蒸馏水、笔、记录本、吸水纸 2、实验方法 .用自来水将各组萝卜洗净后,再用蒸馏水洗涤,擦干表面水分.每个小区取3个重复,用电子天平称量每株的鲜重,用直尺测量植株的茎长、茎粗、叶长,取平均值作为指标值 实验(二) 植物体内可溶性糖含量的测定(蒽酮法) 一、实验目的 了解蒽酮法测定可溶性糖含量的原理;掌握分光光度计的使用二、实验原理 糖类物质是构成植物体的重要组成成分之一,也是新陈代谢的主要原料和贮存物质。不同载培条件,不同成熟度都可以影响水果、蔬菜中糖类的含量。因此对水果、蔬菜中可溶性糖的测定,可以了解和鉴定水果、蔬菜品质的高低。 蒽酮比色定糖法是一个快速而方便的定糖方法,在强酸性条件下,蒽酮可以与游离的或多糖中存在的己糖、戊糖及己糖醛酸(还原性和非还原性)作用生成蓝绿色的糖醛衍生物,其颜色的深浅与糖的含量在一定范围内成正比。蒽酮也可以和其他一些糖类发生反应,但显现的颜色不同。当存在含有较多色氨酸的蛋白质时,反应不稳定,呈现红色。上述特定的糖类物质,反应较稳定。该法特点:灵敏度高,测定量少,快速方便。 三、材料、仪器及试剂
1.材料:植物种子、白菜叶、柑桔 2.仪器:分光光度计;恒温水箱;20ml具塞刻度试管(3支)漏斗;100ml容量瓶;刻度试管;试管架;剪刀;研钵 3.试剂 (1)200μg/ml标准葡萄糖:AR级葡萄糖100mg,蒸馏水溶解,定容至500ml。 (2)蒽酮试剂:1g蒽酮,用乙酸乙酯溶解,定容至50ml,棕色瓶避光处贮藏; (3)浓硫酸 四、实验方法 1.葡萄糖标准曲线的制作 取6支20ml具寒试管,编号,按下表数据配制一系列不同浓度的标准葡萄糖溶液。在每管中均加入0.5ml蒽酮试剂,再缓慢地加入5ml 浓H2SO4,摇匀后,打开试管塞,置沸水浴中煮沸10分钟,取出冷却至室温,在620nm波长下比色,测各管溶液的光密度值(OD),以标 2. 称取1克白菜叶,剪碎,置于研钵中,加入少量蒸馏水,研磨成匀浆,然后转入20ml刻度试管中,用10ml蒸馏水分次洗涤研钵,洗液一并转入刻度试管中。置沸水浴中加盖煮沸10分钟,冷却后过滤,滤液收集于100ml容量瓶中,用蒸馏水定容至刻度,摇匀备用。 3.糖含量测定 用移液管吸收1ml提取液于20ml具塞刻度试管中,加1ml水和0.5ml蒽酮试剂。再缓慢加入5ml浓H2SO4(注意:浓硫酸遇水会产生大量的热!),盖上试管塞后,轻轻摇匀,再置沸水浴中10分钟(比色空白用2ml蒸馏水与0.5ml蒽酮试剂混合,并一同于沸水浴保温10分钟)。冷却至室温后,在波长620nm下比色,记录光密度值。查标准曲线上得知对应的葡萄糖含量(μg)。 五、结果计算 样品含糖量(g/100g鲜重)=查表所得糖含量(μg)×稀释倍数×100/样品重(g)×106 六、注意事项
植物可溶性糖(soluble sugar)测定:蒽酮比色法 糖在硫酸的作用下生成糠醛,糠醛再与蒽酮作用,形成一种绿色的络合物。在低浓度时,625nm的OD值与糖含量成正相关。该实验方法简便,但没有专一性,对于绝大部分的碳水化合物都能与蒽酮反应,产生颜色。 实验用品 721型分光光度计,分析天平,研钵,恒温水浴锅,烧杯,刻度试管,大试管,移液管,漏斗,玻璃棒,试管架,吸耳球,滤纸 试剂:活性炭,酒精(80%) 葡萄糖标准溶液:称取已在80℃烘箱中烘至恒重葡萄糖100mg,配制成500mL溶液,即得每mL含糖为200μg的标准溶液。 蒽酮试剂:称取1g经过纯化的蒽酮,溶解于1000mL稀硫酸中即得。稀硫酸溶液由760mL 浓硫酸(比重1.84)稀释成1000mL而成。 实验步骤 1.可溶性糖的提取:称取0.5g的新鲜植物叶片,于研钵中加80%酒精4ml,仔细研磨成匀浆,倒入离心管内,置于80℃水浴中不断搅拌30min,离心10分钟(5000转/min),收集上清液于10ml的刻度试管中,其残渣加2ml80%酒精重复提1次,合并上清液。在上清液中加0.5g活性炭,80℃水浴脱色30min,定容至10ml,过滤后取滤液(稀释10倍或20倍后)测定。 2.显色及比色:吸取上述糖提取液1mL,放入一干洁的试管中,加蒽酮试剂5mL混合之,于沸水浴中煮沸10分钟,取出冷却,然后于分光光度计上进行测定,波长为625nm,测得吸光度。从标准曲线上查得滤液中得糖含量(或经直线回归公式计算),然后再行计算样品中含糖百分数。 3.绘制标准曲线:取标准葡萄糖溶液将其稀释成一系列不同浓度的溶液,浓度分别为每mL含糖0、30、60、90、120、150、180μg。按上述方法分别测得其吸光度,然后绘制A625-糖浓度曲线,或进行直线回归求得直线方程。 试剂(ml) 管号 1 2 3 4 5 6 7 葡萄糖标准液 0 0.15 0.3 0.45 0.6 0.75 0.9 80%酒精 1.0 0.85 0.7 0.55 0.4 0.25 0.1 蒽酮-硫酸试剂 5 5 5 5 5 5 5 葡萄糖浓度(ul/ml) 0 30 60 90 120 150 180 样品中含糖量%:设V为植物样品稀释后的体积(m L);C为提取液的含糖量(μg/ m L);W为植物组织鲜重(g) 可溶性糖含量%=( C×V)/(W×106) ×100% 可溶性糖(SS) 含量的测定: 根据赵世杰[20 ] 的方法。准确称取一定量新鲜叶片置于预冷的研钵内,加入5 mL 10 %三氯乙酸(TCA) ,于冰浴中研磨匀浆以4000 r/ min 离心10 min。吸取上清液2 mL(对照加2 mL 蒸馏水) ,加入2 mL 0.6 % TBA (用10 % TCA 配置) ,混匀物于沸水浴上反应15 min ,迅速冷却后再离心。取上清液于450 nm 波长处测定光密度。可溶性糖的浓度(mmol/ L) = 11.7D450 ,然后进一步换算成叶片可溶性糖含量,单位为μmol/ g ,FW。
检测技术规范与标准方法 编号:HXSW/QC-001 修订:第 1 版第2次修改 还原糖和总糖的测定—3,5-二硝基水杨酸比色法起草:杨晓君日期:2013.10.27 批准:刘永垒日期:2014年1月17日 1 目的 建立统一的发酵液中还原糖和总糖的定性检测方法,确保检验方法的一致性、科学性和准确性 2 范围 适用于微生物中心实验室实验、生产发酵液中还原糖和总糖的检验 3 责任者 发酵工艺实验员负责检验 4 正文 4.1 原理 还原糖是指含有自由醛基或酮基、具有还原性的糖类。黄色的3,5-二硝基水杨酸(DNS)试剂与还原糖在碱性条件下共热后,自身被还原为棕红色的3-氨基-5-硝基水杨酸。在一定范围内,反应液里棕红色的深浅与还原糖的含量成正比,在波长为540nm处测定溶液的吸光度,查对标准曲线并计算,便可求得样品中还原糖的含量。 不具还原性的部分双糖或多糖经酸水解后可彻底分解为具有还原性的单糖。通过对样品中的总糖进行酸水解,测定水解后还原糖含量,可计算出样品的含量含量。由于多糖水解为单糖时,每断裂一个糖苷键需加入一分子水,所以在计算多糖含量时应乘以系数0.9。 4.2 仪器和试剂 4.2.1 仪器 分光光度计、电热恒温水浴锅、试管及试管架、容量瓶、移液器、量筒。 4.2.2 试剂 4.2.2.1 1mg/ml葡萄糖标准液 准确称取80℃烘至恒重的分析纯葡萄糖100mg,置于小烧杯中,加少量蒸馏水溶解后,转移到100ml容量瓶中,用蒸馏水定容至100ml,混匀,4℃冰箱中保存备用。 4.2.2.2 DNS 试剂(3,5-二硝基水杨酸) 将6.3g DNS和262ml 2mol/LNaOH溶液,加到500ml含有185g酒石酸钾钠的热水溶液中,再加5g重蒸酚和5g亚硫酸钠,搅拌溶解,冷却后加蒸馏水定容至1000ml,贮于棕色瓶中,7-10天后使用。
实验十二胰岛素、肾上腺素对血糖浓度的影响 血糖是指血液中糖,由于正常人血液中糖主要是葡萄糖,所以一般认为,血糖是指血液中的葡萄糖。正常人空腹血糖浓度为4.4~6.7mmol/L(80~ 120mg/100ml)。 血糖是糖在体内的运输形式。全身各组织都从血液中摄取葡萄糖以氧化供能,特别是脑、肾、红细胞、视网膜等组织合成糖原能力极低,几乎没有糖原贮存,必须不断由血液供应葡萄糖。当血糖下降到一定程度时,就会严重妨碍脑等组织的能量代射,从而影响它们的功能。所以维持血糖浓度的相对恒定有着重要的临床意义。 血糖浓度的调节 血糖浓度能维持相对恒定是由于机体内存在一整套高效率的调节机制,精细地控制着血糖的来源与去路,使之达到动态平衡。 神经系统的调节作用 神经系统对血糖浓度的调节作用主要通过下丘脑和自主神经系统对所控制激素的分泌,后者再通过影响血糖来源与去路关键酶的活性来实现。神经系统的调节最终通过细胞水平的调节来达到目的。 下丘脑一方面通过内脏神经作用于肾上腺髓质,刺激肾上腺素的分泌;另
一方面也作用于胰岛α-细胞,使其分泌胰高血糖素;同时还可以直接作用于肝。三方面共同作用的结果是使肝细胞的磷酸化酶活化,使糖原分解加速;糖异生关键酶的活性增加,糖异生作用增加,从而使血糖浓度升高。 下丘脑还可通过兴奋迷走神经,使胰腺β-细胞分泌胰岛素,同时还可直接作用于肝,使肝细胞内糖原合成酶活化,促进肝糖原的合成;此外还抑制糖异生途径,促进糖的氧化和转化,总体上使血糖的去路增加,来源减少,最终达到使血糖浓度降低的目的。 激素 使血糖浓度降低的激素 :胰岛素 使血糖浓度升高的激素:胰高血糖素、肾上腺素、肾上腺皮质激素、生长素、甲状腺素 它们对血糖的调节主要是通过对糖代谢各主要途径的影响来实现的。 在激素发挥调节血糖浓度的作用中,最重要的是胰岛素和胰高血糖素。肾上腺素在应激时发挥作用,而肾上腺皮质激素、生长激素、甲状腺素等都可影响血糖水平,但在生理性调节中仅居次要地位。 胰岛素 使肌肉和脂肪组织细胞膜对葡萄糖的通透性增加,利于血糖进入这些组织进行代谢。 诱导葡萄糖激酶、磷酸果糖激酶和丙酮酸激酶的合成,加速细胞内葡萄糖的分解利用。 通过使细胞内cAMP含量减少,激活糖原合成酶和丙酮酸脱氢酶系,抑制磷酸化酶和糖异生关键酶等,使糖原合成增加,糖的氧化利用、糖转变为脂肪的反应增加,血糖去路增快;使糖原分解和糖异生减少或受抑制,使血糖来源减少,最终使血糖浓度降低。 胰高血糖素 主要通过提高靶细胞内cAMP含量达到调节血糖浓度的目的。细胞内的cAMP 可激活依赖cAMP的蛋白激酶,后者通过酶蛋白的共价修饰改变细胞内酶的活性,即激活糖原分解和糖异生的关键酶,抑制糖原合成和糖氧化的关键酶,使血糖升高。 肾上腺素
实验二十一可溶性总糖的测定(蒽酮比色法) 一、目的 掌握蒽酮法测定可溶性糖含量的原理和方法。 二、原理强酸可使糖类脱水生成糠醛,生成的糠醛或羟甲基糖醛与蒽酮脱水缩合,形成糠醛的衍生物,呈蓝绿色,该物质在620 nm 处有最大吸收. 在10 -100ug 范围内其颜色的深浅与可溶性糖含量成正比。 这一方法有很高的灵敏度,糖含量在30ug 左右就能进行测定,所以可做为微量测糖之用。一般样品少的情况下,采用这一方法比较合适。 三、仪器、试剂和材料 1 . 仪器 (1)分光光度计 (2 )电子顶载天平 (3 )三角瓶:50m1 X 1 (4 )大试管:9 支 (5)试管架,试管夹 (6 )漏斗,漏斗架 (7 )容量瓶:50rnl X 2 (8 )刻度吸管:1m1X3 ,2m1X1 ,5mlX1 (9 )水浴锅 2 . 试剂 (1)葡萄糖标准液:l00ug/ml (2 )浓硫酸 (3)蒽酮试剂:0.2g 蒽酮溶于100 ml 浓H2SO4 中当日配制使用。 3 . 材料小麦分蘖节。 四、操作步骤 1. 葡萄糖标准曲线的制作
取7支大试管,按下表数据配制一系列不同浓度的葡萄糖溶液: 在每支试管中立即加入蒽酮试剂 4.0m1 ,迅速浸于冰水浴中冷却,各管加完后一起浸于沸水浴中,管口加盖玻璃球,以防蒸发。自水浴重新煮沸起,准确煮沸lOmin 取出,用流水冷却,室温放置10min ,在620 nm波长下比色。以标准葡萄糖含量(ug)作横坐标,以吸光值作纵坐标,作岀标准曲线。 2. 植物样品中可溶性糖的提取 将小麦分蘖节剪碎至2mm以下,准确称取lg,放入50m1三角瓶中,加沸水25m1,在水浴中加盖煮沸10min,冷却后过滤,滤液收集在50m1容量瓶中,定容至刻度。吸取提取液2m1,置另一50m1容量瓶 中,以蒸馏水稀释定容,摇匀测定。 3 .测定 吸取lml已稀释的提取液于大试管中,加入 4.0ml蒽酮试剂,以下操作同标准曲线制作。比色波长 620nm,记录吸光度,在标准曲线上查出葡萄糖的含量(ug )。 查表所得糖含量(ug )乂稀释倍数 五、结果处理 查表所得糖含量Cug)乂稀释倍数心 植物样品含糖壘(%)=: 样品重(町xm% X10° 六、注意事项 1 .该显色反应非常灵敏,溶液中切勿混入纸屑及尘埃。 2 . H 2 SO 4 要用高纯度的。 3. 不同糖类与蒽酮的显色有差异,稳定性也不同。加热、比色时间应严格掌握。 七、思考题 1.用水提取的糖类有哪些? 2 . 制作标准曲线时应注意哪些问题?
蔗糖的测定方法 1.原理样品经除去蛋白质后,蔗糖经盐酸水解转化为还原糖,再按还原糖测定。水解前后还原糖的差值为蔗糖含量。 2.适用范围GB5009.8-85。本方法适合于所有食物样品蔗糖的检测。 3.仪器(1)滴定管(2)25ml古式坩埚或G4垂融坩埚(3)真空泵(4)水浴锅 4.试剂除特殊说明外,实验用水为蒸馏水,试剂为分析纯。 4.1 6 mol/L盐酸:量取50ml盐酸加水稀释至100 ml。 4.2 甲基红指示剂:称取10mg甲基红,用100ml乙醇溶解。 4.3 5 mol/L氢氧化钠溶液:称取20g氢氧化钠加水溶解并稀释至100ml。 4.4 碱性酒石酸铜甲液:称取34.639g 硫酸铜(CuSO4·5H2O),加适量水溶解,加0.5ml硫酸,再加水稀释至500ml,用精制石棉过滤。 4.5 碱性酒石酸铜乙液:称取173g酒石酸钾钠与50g氢氧化钠,加适量水溶解,并稀释至500ml,用精制石棉过滤,贮存于橡胶塞玻
璃瓶中。 4.6 精制石棉:取石棉先用3mol/L盐酸浸泡2~3天,用水洗净,再加2.5mol/L氢氧化钠溶液浸泡2~3天,倾去溶液,再用热碱性酒石酸铜已液浸泡数小时,用水洗净。再以3 mol/L 盐酸浸泡数小时,以水洗至不呈酸性。然后加水振摇,使成微细的浆状软县委,用水浸泡并贮存于玻璃瓶中,即可用做填充古式坩埚用。 4.7 0.1000mol/L高锰酸钾标准溶液。 4.8 1mol/L氢氧化钠溶液:称取4g 氢氧化钠,加水溶解并稀释至100ml。 4.9 硫酸铁溶液:称取50g硫酸铁,加入200ml水溶解后,慢慢加入100ml硫酸,冷却后加水稀释至1L。 4.10 3mol/L盐酸:量取30ml盐酸,加水稀释至120ml。 5.操作方法5.1样品处理:5.1.1乳类、乳制品及含蛋白质的食品:称取约0.5~2 g固体样品(吸取2~10 ml液体样品),置于250 ml容量瓶中,加50 ml 水,摇匀。加入10 ml碱性酒石酸铜甲液及4 ml1mol/L氢氧化钠溶液,加水至刻度,混匀。静置30min,用干燥滤纸过滤,弃去初滤液,滤液备用。 5.1.2酒精性饮料:吸取100 ml样品,置于蒸发皿中,用1 mol/L 氢氧化钠溶液中和至中性,在水浴上蒸发至原体积1/4后,移入250 ml容量瓶中。加50 ml水,混匀。以下按5.1.1自"加10ml碱
一、抗氧化酶活性测定(APX、GPX、SOD、CAT、Pro)参考《在同一提取系统 中同时测定5种抗氧化酶活性》 1、注意事项:在本提取系统中同时测定抗坏血酸专一性过氧化物酶(APX)、愈 创木酚过氧化物酶(GPX)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、可溶性蛋白共5个指标;所有操作过程必须在冰浴中完成,降低保护酶活性的损失;称量药品时可稍稍过量。 2、提取液及反应准备液配置:以下溶液1-7d内可用,4℃保存。 1mol/L HCl(100ml):8.333ml浓HCl定容至100ml。 750mM(750mmol/L) H 2O 2 (100ml):7.570mL 30%H 2 O 2 定容至100ml。 500mM H 2O 2 (100ml):5.0464mL 30%H 2 O 2 定容至100ml。 10mM H 2O 2 (100ml):2mL 500mM H 2 O 2 定容至100ml。 (1)配置500ml提取液所需试剂药品如下: 蒸馏水溶解后(终体积为450ml左右),0.1mM的HCl和NaOH调节pH至7.0,然后定容至500ml。 (2)500ml A液配置所需试剂药品如下: 蒸馏水溶解后(终体积为450ml左右),0.1mM的HCl和NaOH调节pH至7.8,然后定容至500ml。 (3)500ml B液配置所需试剂药品如下:
蒸馏水溶解后(终体积为450ml左右),0.1mM的HCl和NaOH调节pH至7.0,然后定容至500ml。 3、GPX反应液配置(100ml):现用现配,24h内有效。 反应液:111ul愈创木酚用5ml乙醇溶解后加入1ml 500mM H 2O 2 ,用B液定 容至100ml。 4、APX反应液配置(100ml):现用现配,24h内有效。 反应液:1ml 10mM H 2O 2 用B液定容至100ml; 30mM AsA:0.52836gAsA用B液定容至100ml。 5、SOD反应液配置(100ml):现用现配,24h内有效。 反应液:0.0082gNBT和0.1995g蛋氨酸(甲硫氨酸)用A液定容至100ml。 0.1mM 核黄素溶液:0.00376gVB2用A液定容至100ml。 6、CAT反应液配置(100ml): 直接使用B液即可。 7、可溶性蛋白反应液: G-250考马斯亮蓝:100mg考马斯亮蓝溶于50ml90%(V/V)乙醇,加入85% (质量浓度)H 3PO 4 100ml,再用蒸馏水定容至1000ml,常温下保存1个月。 8、样品提取 用长镊子取小麦整株地上部位迅速固定成长2-3cm的棒状并放入液氮中,直至取样过程结束后带回实验室-80℃下贮藏。 提取时,从液氮中取出样品,待液氮挥发干净后迅速称量然后放入预冷的研钵中磨碎后加入5ml提取液进一步充分研磨至匀浆,转移至10ml具塞刻度试管中,并分2次冲洗,3000r/min离心15min后上清液定容至10ml,取2ml离心管(每个重复2个)加入2ml上清液后12000r/min、4℃离心20min,4℃保存(2天内有效)。
植物体内可溶性糖和可溶性蛋白含量的测定 摘要:目的通过标准曲线的绘制,测定白菜、芹菜、菠菜中可溶性蛋白和可溶性糖的含量,了解可溶性糖和可溶性蛋白的测定方法。方法分别用蒽酮法和考马斯亮蓝染色法来测定植物体内可溶性糖和可溶性蛋白的含量。结论 关键词:白菜;芹菜;菠菜;可溶性蛋白含量;可溶性糖含量;蒽酮法;考马斯亮蓝染色法 1 引言 植物体内的可溶性糖和可溶性蛋白含量是重要的生理生化指标。 在作物的碳素营养中,作为营养物质主要是指可溶性糖和淀粉。它们在营养中的作用主要有:合成纤维素组成细胞壁;转化并组成其他有机物如核苷酸、核酸等;分解产物是其他许多有机物合成的原料,如糖在呼吸过程中形成的有机酸,可作为NH 3 的受体而转化为氨基酸;糖类作为呼吸基质,为作物的各种合成过程和各种生命活动提供了所需的能量。由于碳水化合物具有这些重要的作用,所以是营养中最基本的物质,也是需要量最多的一类。 可溶性蛋白是植物体内氮素存在的主要形式,其含量的多少与植物的代谢和衰老有密切的关系,同时它与植物体维持渗透压抗脱水也有很大关系。 白菜是十字花科芸薹属叶用蔬菜,味道鲜美可口,营养丰富,素有“菜中之王”的美称,为广大群众所喜爱。芹菜属伞形科植物,富含蛋白质、碳水化合物、胡萝卜素、B族维生素、钙、磷、铁、钠等,同时,具有有平肝清热,祛风利湿,清肠利便、润肺止咳、降低血压、健脑镇静的功效。菠菜藜科一年生草本植物,菠菜含有丰富的维他命A、维他命C及矿物质,它对各种贫血症和糖尿病、肺结核、高血压、风火赤眼等诸多疾病可起辅助治疗作用。 2 材料与方法 2.1 植物体内可溶性糖含量的测定 2.1.1材料 新鲜的白菜、芹菜、菠菜叶片(剪碎后各取0.5—1.0g) 2.1.2试剂 葡萄糖标准溶液(200ug/ml)、蒽酮试剂 2.1.3仪器设备 分光光度计;分析天平;恒温水浴;试管;三角瓶;移液管;剪刀;玻璃棒;滤纸;研钵 2.1.4测定方法 样品中可溶性糖的提取:称取剪碎混匀的新鲜样品0.5 ~1.0 g (或干样粉5~100 mg ),放入大试管中,加入15 ml 蒸馏水,在沸水浴中煮沸20 min,取出冷却,过滤入100 ml 容量瓶中,用蒸馏水冲洗残渣数次,定容至刻度。 标准曲线制作:取6 支大试管,从0~5分别编号,按下表加入各试剂。 试剂管号 0 1 2 3 4 5 200ug/ml葡萄糖标准溶液(ml)0 0.2 0.4 0.6 0.8 1.0 蒸馏水(ml) 1.0 0.8 0.6 0.4 0.2 0 蒽酮试剂(ml) 5.0 5.0 5.0 5.0 5.0 5.0 葡萄糖量(ug)0 20 40 60 80 100
蔗糖的测定方法 1.原理 样品经除去蛋白质后,蔗糖经盐酸水解转化为还原糖,再按还原糖测定。水解前后还原糖的差值为蔗糖含量。 2.适用范围 GB5009.8-85。本方法适合于所有食物样品蔗糖的检测。 3.仪器 (1)滴定管 (2)25ml古式坩埚或G4垂融坩埚 (3)真空泵 (4)水浴锅 4.试剂 除特殊说明外,实验用水为蒸馏水,试剂为分析纯。 4.1 6 mol/L盐酸:量取50ml盐酸加水稀释至100 ml。 4.2 甲基红指示剂:称取10mg甲基红,用100ml乙醇溶解。 4.3 5 mol/L氢氧化钠溶液:称取20g氢氧化钠加水溶解并稀释至100ml。 4.4 碱性酒石酸铜甲液:称取34.639g 硫酸铜(CuSO4·5H2O),加适量水溶解,加0.5ml 硫酸,再加水稀释至500ml,用精制石棉过滤。 4.5 碱性酒石酸铜乙液:称取173g酒石酸钾钠与50g氢氧化钠,加适量水溶解,并稀释至500ml,用精制石棉过滤,贮存于橡胶塞玻璃瓶中。 4.6 精制石棉:取石棉先用3mol/L盐酸浸泡2~3天,用水洗净,再加2.5mol/L氢氧化钠溶液浸泡2~3天,倾去溶液,再用热碱性酒石酸铜已液浸泡数小时,用水洗净。再以3 mol/L 盐酸浸泡数小时,以水洗至不呈酸性。然后加水振摇,使成微细的浆状软县委,用水浸泡并贮存于玻璃瓶中,即可用做填充古式坩埚用。 4.7 0.1000mol/L高锰酸钾标准溶液。 4.8 1mol/L氢氧化钠溶液:称取4g 氢氧化钠,加水溶解并稀释至100ml。 4.9 硫酸铁溶液:称取50g硫酸铁,加入200ml水溶解后,慢慢加入100ml硫酸,冷却后加水稀释至1L。 4.10 3mol/L盐酸:量取30ml盐酸,加水稀释至120ml。 5.操作方法 5.1样品处理: 5.1.1乳类、乳制品及含蛋白质的食品:称取约0.5~2 g固体样品(吸取2~10 ml液体样品),置于250 ml容量瓶中,加50 ml水,摇匀。加入10 ml碱性酒石酸铜甲液及4 ml1mol/L氢氧化钠溶液,加水至刻度,混匀。静置30min,用干燥滤纸过滤,弃去初滤液,滤液备用。