第九章周环反应习题答案
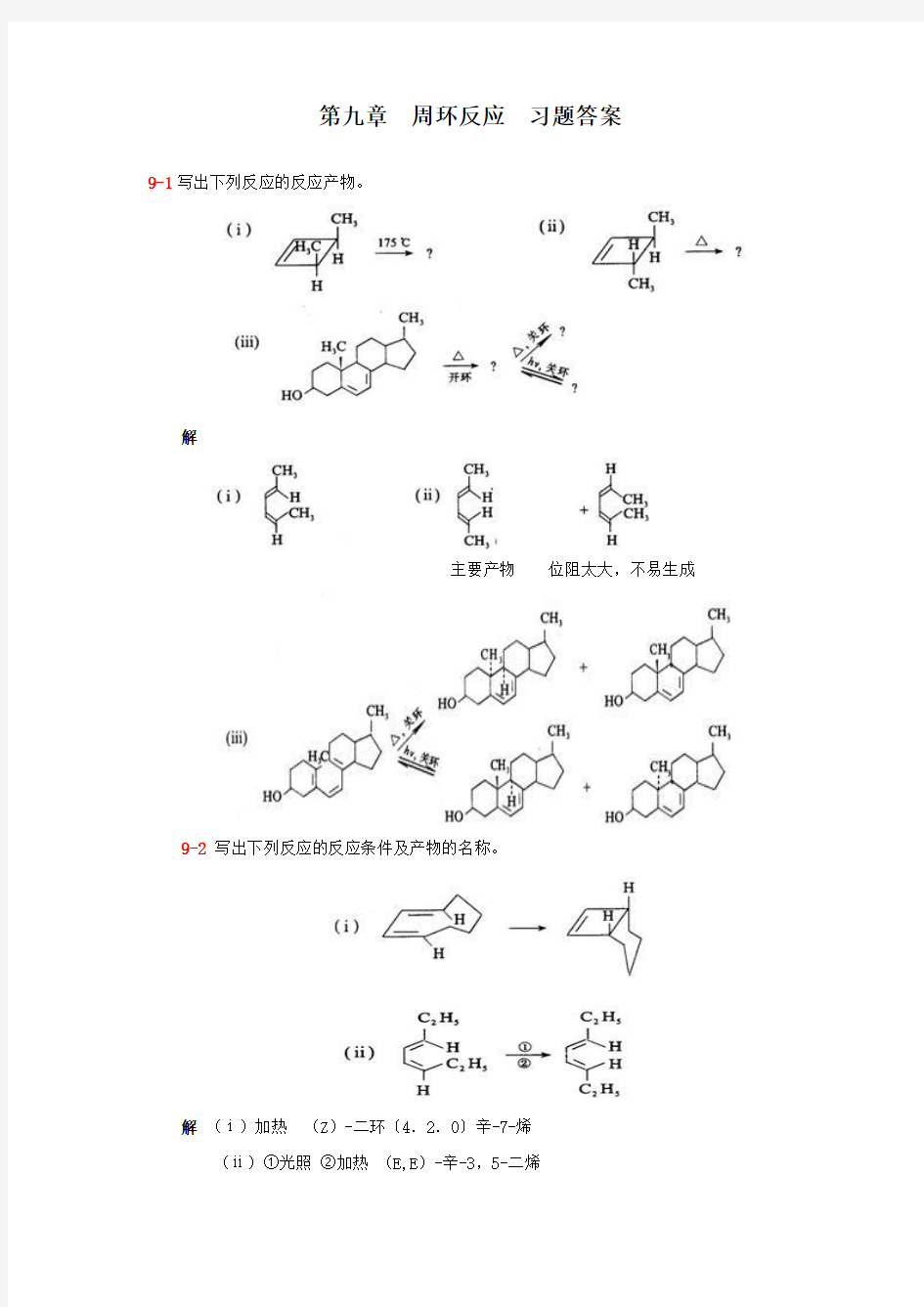
9-1写出下列反应的反应产物。
解
主要产物位阻太大,不易生成
9-2写出下列反应的反应条件及产物的名称。
解(ⅰ)加热(Z)-二环〔4.2.0〕辛-7-烯
(ⅱ)①光照②加热(E,E)-辛-3,5-二烯
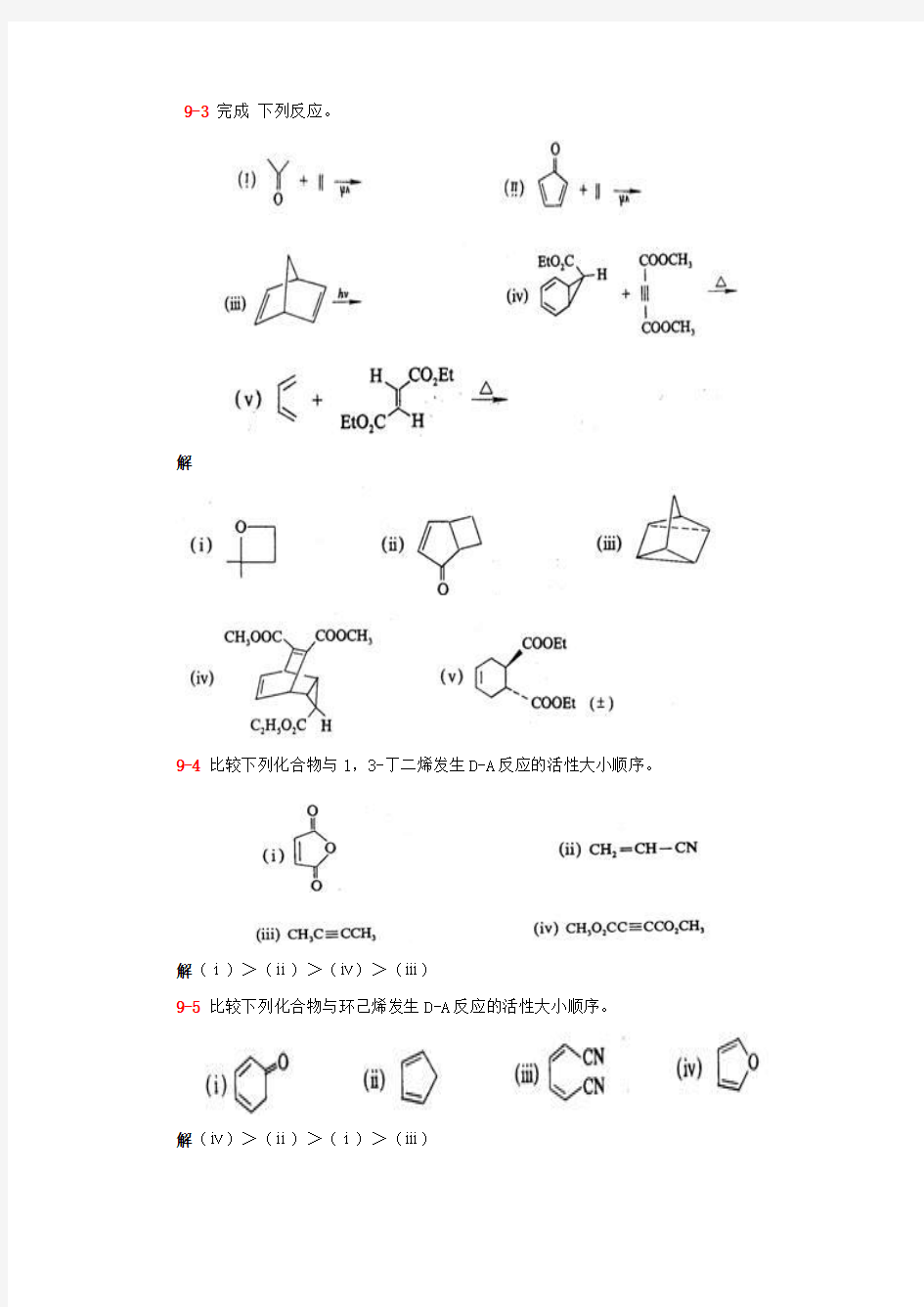
9-3完成下列反应。
解
9-4比较下列化合物与1,3-丁二烯发生D-A反应的活性大小顺序。
解(ⅰ)>(ⅱ)>(ⅳ)>(ⅲ)
9-5比较下列化合物与环己烯发生D-A反应的活性大小顺序。
解(ⅳ)>(ⅱ)>(ⅰ)>(ⅲ)
9-6写出下面反应的反应产物,用前线轨道理论予以解释。
解反应产物:
反应物是取代的单烯烃,光照下发生〔2+2〕环加成反应。激发态下的前线轨道:
激发态时的HOMO 基态时的LUMO
对称性相合,可生成三种产物。
9-7写出下面反应的反应产物,用前线轨道理论予以解释为什么得此产物。
解反应产物:
戊二烯基正离子的π分子轨道和在基态时的电子排布如下:
9-8用前线轨道理论分析下列反应是在加热下还是光照下发生。
解(ⅰ)反应须在光照下进行。
基态电子的排布丁二烯的π分子轨道丁二烯的π分子轨道激发态电子的排布根据前线轨道理论,环加成反应在光照下进行,必须是一分子的激发态的HOMO与另一分子的基态的LUMO相作用,由上图可以看出它们的对称性是相合的。
(ⅱ)反应须在加热下进行。
基态电子的排布丁二烯的π分子轨道烯丙基正离子π分子轨道基态电子的排布
根据前线轨道理论,环加成反应在加热下进行,必须是一分子的基态的HOMO与另一分子的基态的LUMO相作用,由上图可以看出它们的对称性是相合的。
9-9完成下列反应。
解
9-10解释下列实验事实。
旋光体
90% 10%
解
ee椅形过渡态(E,E)90%
aa椅形过渡态(Z,Z)10%
船形过渡态(Z,E)极少
船形过渡态能量高,(Z,E)产物极少;ee椅形过渡态能量低, 90%的产物为E,E异构体。
9-11回答下面反应的有关问题:(ⅰ)反应属于什么类型?(ⅱ)反应通过什么过渡态完成的?(ⅲ)写出详细的反应过程,并阐明产物为什么具有式中的构型。
解(ⅰ)反应是〔3,3〕σ移位反应,克莱森重排。
(ⅱ)反应是通过椅型过渡态完成的。
(ⅲ)反应的详细过程如下:
9-12环丁烯开环生成1,3-丁二烯是1,3-丁二烯关环反应的逆反应,这一对可逆反应的能级相关图是否相同?为什么?根据能级相关图判断在加热时环丁烯通过什么方式开环?在光照时环丁烯通过什么方式开环?
解顺旋以c2 轴为对称要素。
1,3-丁二烯环丁烯
基态时顺旋,对称性允许
对旋以m2面为对称要素
1,3-丁二烯环丁烯
基态时对旋,对称性禁阻
上图是1,3-丁二烯关环形成环丁烯的能级相关图,环丁烯开环形成1,3-丁二烯的能级相关图与此图相同,只是将反应物看作产物,产物看作反应物即可。电环化反应是可逆反应,根据微观可逆性原理,可逆反应是途径相同、方向相反的反应。
9-13写出反应产物,应用芳香过渡态理论解释此电环化反应。
解反应产物:
开环反应对旋时的过渡态开环反应顺旋时的过渡态
过渡态经0次变号,是休克尔体系过渡态经1次变号,是莫比乌斯体系反应是在光照下进行的,过渡态必须是反芳香性的。反应体系有6个π电子,属于4n+2体系,4n+2电子数只有在莫比乌斯体系才是反芳香性的。所以反应是经过莫比乌斯过渡态进行,即顺旋开环,产物是(Z,Z,E)-1,3,5-己三烯。
9-14完成下列周环反应的反应式,指出反应类型和反应方式。
(ⅰ)
(ⅱ)
(ⅲ)
(ⅳ)
(ⅴ)
解
(ⅰ)
电环合反应,6电子,对旋
(ⅱ)
电环化开环反应,4电子,顺旋电环合反应,6电子,对旋
(ⅲ)
电环化开环反应,4电子,顺旋电环合反应,4电子,对旋(ⅳ)
环加成反应的逆反应,〔4+2〕(ⅴ)
C〔1,3〕同面移位,移位碳构型翻转
9-15完成下列合成。
(ⅰ)用合成
(ⅱ)用合成
(ⅲ)从C6H5CH=CHCH2Cl和C6H5O –合成
(ⅳ)以环戊二烯和顺丁烯二酸酐为原料,合成环戊烷-1,2,3,4-四羧酸。
解(ⅰ)
5-氰基二环〔2.2.2〕辛-2-烯
(ⅱ)
〔Z,Z〕-7甲基-7-乙氧基二环〔2.2.2〕辛-2,5-二烯(ⅲ)
(ⅳ)
环戊烷-1,2,3,4-四羧酸
第九章周环反应(协同反应) 协同反应——(1)此类反应中无产生离子或自由基等中间活性体 (2)不受催化剂或溶剂的影响 (3)键的生成和断裂在一步中完成 (4)可在热和光照下反应 (5)立体专一性反应 由于反应的过渡态是一环状结构,所以也称为周环反应。 周环反应是以轨道对称守恒原理为基础的,由Woodward提出。 第一节分子轨道对称守恒定律 1、术语: 以乙烯分子为例: 2 1反键轨道 成键轨道 分子轨道 用波函数来表示: 对乙烯分子π轨道来说,它有一个对称因素:为面对称(成键轨道S),而对反键轨道来说是反对称(A) C1 对称:Symmetry波函数的数学符号相同,S 面:对映关系 轴:转180° 反对称:Antisymmetry波函数的数学符号相反,A 轴C1:二个碳原子的连线 轴C2:两个平面乙烯面与m平面的交线 节点:将符号相同的波函数相连与C1轴的交点 乙烯的π型分子轨道、节点数和对称性总结为: 反键轨道 成键轨道 轨道节点数对称性2 1 1 m C2 A S S A 节面 节点的物理意义:(1)节点越多,说明该轨道的能级越高不安定因素 (2)节点处的电子密度等于零 对Ψ1来说:是π电子的最高占有分子轨道(HOMO)high occupied molecule orbit *不是说满轨道,只要有一个也是占有 最高占有轨道的电子束缚得最松弛,具有给电子的性质,最易激发到最低空轨道,因此这二个轨道为Ψ2是最低的空分子轨道(LUMO)low unoccupied molecule orbit 前线轨道
(前沿轨道)对电子的亲和力较强,具有接受电子的性质 丁二烯的分子轨道及其对称性: 节点数 对称性 m C 2 3210 A S S A A S S A 4321 己三烯的分子轨道及其对称性 4 321 65 节点数 对称性 m C 2 543210 A S S A A S S A A S S A 当最高轨道HOMO 的电子受到光的吸收光子的能量发生跃迁,到最低空轨道时,那时该轨道就变成HOMO 了 基态:未激发的HOMO 激发态:激发的HOMO ,相当于LUMO 第二节 电子反应中的轨道对称守恒原理 电环反应中的两种反应形式: 1、热化学:是反应物分子处于基态所发生的反应 HOMO 2、光化学: 激发态所发生的反应 LUMO 一、丁二烯和环丁烯的电环反应 h γ γLUMO HOMO
. 化学反应工程试卷及答案 一、填空题(共25分,每空1分) 1.化学反应工程学不仅研究化学反应速率与反应条件之间的关系, 即 ,而且着重研究传递过程对 的影响,研究不同类型反应器的特点及其与化学反应结果之间的关系。 2.反应器按型式来分类可以分为管式反应器、 和 。 3.对于反应D C B A 432+=+,反应物A 的消耗速率表达式为 ;反应产物C 的生成速率表达式为: 。 4.反应器设计计算所涉及的基础方程式就是动力学方程式、 和 。 5.间歇釜反应器中进行如下反应: P A → (1) 1 1n A A C k r = 1E S A → (2) 22n A A C k r = 2E 在Ao C 和反应时间保持不变下,降低反应温度,釜液中S p C C /增大,表明活化能1E 与2E 的相对大小为 ;在温度和反应时间保持不变下,增高反应浓度,釜液中S p C C /增大,表明反应级数1n 、2n 的相对大小为 。 6.单位时间内由颗粒外表面传递至气相主体的热量可由牛顿冷却定律表达,其表数学表达式为 。 7.全混流反应器稳定的定常态操作点的判据为 、 。 8.对催化剂性能影响最大的物理性质主要是 、 和孔体积分布。 9.复合反应包括三个基本反应类型,即并列反应、平行反应和_____________。 10.在停留时间相同的物料之间的均匀化过程,称之为 。而停留时间不同的物料之间的均匀化过程,称之为 。 11.对于反应级数0
化学离子反应 一.选择题 1.已知某酸性溶液中含有Ba2+、Mg2+,则下述离子组中能与上述离子共存的是()A.CO32-、Cl-B.NO3-、Cl-C.NO3-、SO42-D.OH-、NO3- 2.在强碱性溶液中,下列各组离子能大量共存的是() A.Na+、K+、CO32-、Cl-B.Cu2+、Na+、NO3-、SO42- C.Na+、K+、HCO3-、Cl-D.Mg2+、Na+、NO3-、Cl- 3.一种无色溶液中加入BaCl2溶液,生成不溶于硝酸的白色沉淀,则该溶液中() A.一定含有SO42-B.一定含有CO32-C.一定含Ag+D.可能含有SO42-,也可能含有Ag+ 4.下列可以大量共存且溶液是无色的离子组是() A.H+,Na+,NO3-,MnO4-B.Fe2+,Mg2+,Cl-,SO42- C.H+,K+,OH-,NO3-D.NO3-,SO42-,K+,Mg2+ 5.巳知某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是()A.Al3+、CH3COO-、Cl-B.Mg2+、Ba2+、Br- C.Mg2+、Cl-、I-D.Na+、NH4+、Cl- 6.下列电离方程式中,错误的是() A.NaHCO3 == Na++HCO3-B.H2SO4 == 2H++SO42-C.NaHS==Na++H++S2- D.NaHSO4==Na++H++SO42- 7.下列物质的水溶液能导电,但属于非电解质的是() A.HClO B.Cl2C.NaHCO3D.CO2 8.能用H++OH-=H2O表示的是() A.NaOH溶液和CO2的反应B.Ba(OH)2溶液和稀H2SO4的反应 C.NaOH溶液和盐酸反应D.氨水和稀H2SO4的反应 9. 不能用离子方程式:CO32-+2H+=H2O+CO2↑来表示的反应是() A.BaCO3+HCl B.K2CO3+H2SO4C.Na2CO3+HNO3D.(NH4)2CO3+HCl 10.下列反应完成后没有沉淀的是() A.BaCl2溶液与Na2CO3溶液加足量稀CH3COOH B.Ba(OH)2溶液与KNO3溶液加足量稀H2SO4 C.AgNO3溶液与Na2CO3溶液加足量稀HCl D.AgNO3溶液与FeCl3溶液加足量稀HNO3 11.下列离子方程式书写正确的是() A.碳酸钙与盐酸反应:CO32-+2H+==CO2↑+H2O B.硫酸和氯化钡溶液反应:Ba2++SO42-==BaSO4↓ C.氢氧化钠和硫酸反应:2OH-+H2SO4==SO42—+2H2O D.铁钉放入硫酸铜溶液中:Fe+3Cu2+==2Fe3++3Cu 二.填空题(写出下列反应的离子方程式) 12.铜片溶于稀硝酸:13.氯气被氢氧化钠溶液吸收:14.亚硫酸钠溶液加入溴水中:
绪论. 1、化学反应工程是一门研究()的科学。(化学反应的工程问题) 2.()和()一起,构成了化学反应工程的核心。〔三传;反应动力学〕 3.不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称( )。(数学模型) 4.化学反应和反应器的分类方法很多,按反应系统涉及的相态分类,分为:()和()。 5.化学反应和反应器的分类方法很多,按操作方法分为()操作、()操作和()操作。 6.化学反应和反应器的分类方法很多,按传热条件分为()、()和()。 选择1. ( ) “三传一反”是化学反应工程的基础,其中所谓的一反是指。 A 化学反应 B 反应工程 C 反应热力学 D 反应动力学, 2. ( ) “三传一反”是化学反应工程的基础,下列不属于三传的是。A能量传递B质量传连C 热量传递D 动量传递 3. ()按反应器的型式来分类,高径比大于30的为 A.管式反应器B槽式反应器C塔式反应器D釜式反应器 三、判断 1.物理过程不会改变化学反应过程的动力学规律,即化学反应速率与温度浓度之间的关系并不因为物理过程的存在而发生变化。() 2.流体流动、传质、传热过程不会影响实际反应的温度和参与反应的各组分浓度在时间、空间上的分布,最终影响反应结果。() 四、简答 1.利用数学模型解决化学反应工程问题的步骤? 第一章均相单一反应动力学和理想反应器 1.均相反应是指()。
2.如果反应体系中多于一个反应物,在定义转化率时,关键组分A 的选取原则是( )。 3. 当计量方程中计算系数的代数和等于零时,这种反应称为( ) ,否则称为( ) . 4. 化学反应速率式为β αB A C A C C K r =-,如用浓度表示的速率常数为C K ,用压力表示的速率常数P K 则 C K =( )P K . 5. 活化能的大小直接反映了( )对温度的敏感程度. 6.化学反应动力学方程有多种形式。对于均相反应,方程多数可以写成( )或( )。 7.对于反应器的开发根据( )来选择合适的反应器,结合( )和( )两方面特性来确定操作方式和优化操作条件。 8.物料在反应器的混合,依据停留时间分为( )( )。 9.按返混情况的不同,理想流动反应器可分为( )、( )、( )。 10.在设计和分析反应器时,经常涉及( )、( )、( )、( )四个量。其中定义为反应器有效容积V R 与流体特征体积流率V 0之比值为( )。 二、选择 1.其定义为反应器有效容积V R 与流体特征体积流率V 0之比值的量为( ) A 反应时间t r B 停留时间t C 空间时间τ D 空间速度S V 2. 下列那一项不属于间歇反应器中的非反应时间( ) A 投料时间 B 放料时间 C 清洗时间 D 搅拌时间 3.化学反应222222NO H N H O +?+,其中化学反应计量系数为+2的是哪种物质( ) A.NO B.H2 C.N2 D.H2O 4对于一非恒容均相化学反应B A B A αα?,反应组分A 的化学反应速率 A r -= ( ) A .Vdt dn r A A -=- B. Vdt dn r A A =- C. dt dC r A A =- D.dt dC r B A =- 5.对于反应aA + bB 一pP +sS ,则=p r ( )(-A r )
周环反应精选题及其解 1. 预测下列化合物电环化时产物的结构: 解 说明: 我们以本题为例来探讨一下如何运用前线轨道理论,以及如何对反应加以正确的分析、写出合理的产物。题(1)是电环化反应。在反应条件下,反应物A有开环和关环两种反应 1 途径。关环反应的π电子数由反应物决定,为4π电子体系;开环反应的π电子数由产物决定为6π电子体系。关环反应产物B 极不稳定(中间的四元环的两支σ键互为反式),说明形成该产物的过渡态的能量极高,反应不能进行。因此,该反应经对旋开环形成产物C 。若要验证一下答案的正确性,可将化合物C 在同样条件下的关环产物写出,如果写出的产物是A,说明答案是正确的。因为,由A 到C 和由C 到A 的变化的过渡态是一样的。 2. 用前线轨道理论解释17-1(1)的产物的正确性。 (1) H CH 3H CH 3 (2) (3) H 3H 3 hν (1) (2) (3) H H H CH 3 H CH 3 H CH 3 H CH 3 (5) CH 3 H CH 3 H (4) (4) (5) 3 3 (1) H H H H 看成4π电子体系 A B 对旋开环 C
解 先画出化合物C 的π分子轨道如下:前线轨道分别为最高占有轨道HOMO 和最低空轨道LUMO 。电环化反应轨道对称性取决于最高占有轨道的对称性。 如用下图表示A 由到B 的关环反应的过渡态,可以看出标记为a 的那支碳碳键需跨面形成,这对小环化合物是不可能的。 2 3. 预测下列化合物环加成时产物的结构: LUMO HOMO C 的HOMO 对旋 A O + (1) H 3C CHO + (2)
化学反应工程试题答案 一、单选题:(共60 小题,每题0.5分) 1、化学反应工程是研究如下问题的学科:(A ) A、化学反应器工程问题 B、化工单元操作 C、反应器特性 D、传递特性 2、化学反应工程研究的对象是:(A) A、化学反应器 B、单元操作 C、化工流程 D、化学工艺 3、连续操作的反应器的独立变量为(C) A、浓度 B、反应时间 C、反应器体积大小 4、理想混合的间歇反应器的独立变量为(B) A、反应速率 B、反应时间 C、反应空间 5、连续操作的理想混合流反应器的独立变量是:(C) A、反应物浓度 B、反应时间 C、反应空间 6、间歇操作的反应器所具有的特点包括:(A) A、参数随时间变化 B、参数随空间变化 C、累积量为零 D、累积量不为零 7、在对理想的全混流反应器进行物料衡算时,下面哪些量为零:(D) A、流入量 B、流出量 C、反应量 D、累积量 8、在对定常态操作的反应器进行物料衡算时,下面哪些量为零:(D) A、流入量 B、流出量 C、反应量 D、累积量 9、稳定的定常态操作点符合如下条件:(A) A、移热速率大于放热速率 B、移热速率小于放热速率 C、移热速率等于放热速率 10、若CSTR 的某一操作点是稳定的定常态操作点,则该操作状态具有的特点是:(C) A、移热速率大于放热速率 B、移热速率小于放热速率 C、移热速率等于放热速率 11、在CSTR 中进行一级不可逆反应,最多可以有几个定常态操作点?(D) A、0 B、1 C、2 D、3 E、4 12、对于反应级数大于零的反应,下述情况哪种容积效果最高?(C)
A、单釜CSTR B、多釜CSTR C、PFR
第十七章 周环反应 1. 推测下列化合物的电环时产物的方法。 (1) (2) H H H 3C CH 3 H H H 3C CH 3 (3) (4) (5) C 3H H C 3H H 答案: (2) H H CH 3CH 3 (3) H H CH 3CH 3 对旋 hv (4) (5) CH 3 H CH 3H 3 3 3 2.推测下列化合物的环加成时产物的结构: (1) + O O (2) R + X (3) +O (4) N C + N -Pb Ph + C C Ph Ph H H
答案: + O O (1) O O (2) R + X R X + (3) + O (主)( 次) O (4) N C + N -Ph Ph + Ph Ph N N Ph Ph Ph Ph 3.马来酸酐和环庚三烯反应的产物如下,请说明这个产物的合理性。 + O O O O O O H H H H 答案: O O O H H
4.说明下列反应过程所需的条件: (1) H H H (2) 答案: H H H H (2) 5.说明下列反应从反应物到产物的过程: R H D D ? D H D R 答案:
D H D R 1,3 H D D R 1,3 6.自选原料通过环加成反应合成下列化合物。 O (1) O CHO (2) 答案: O O (1) O CHO (2) + O O O + O 7.加热下列化合物会发生什么样的变化? R (2) 答案:
R (2) 8.下面的反应按光化学进行时,反应产物可得到哪一种(Ⅰ或Ⅱ)? (1) hv 或 (2) hv 或 II I I I 答案: (1) hv (2) hv I I I 对旋 9.通过怎样的过程和条件,下列反应能得到给出的结果。 Ph Ph 答案:
(化学)化学离子反应练习题及答案及解析 一、高中化学离子反应 1.某白色粉末由两种物质组成,为鉴别其成分进行如下实验: ①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解; ②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。 该白色粉末可能为 A.NaHCO3、Al(OH)3B.AgCl、NaHCO3C.Na2SO3、BaCO3 D.Na2CO3、CuSO4 【答案】C 【解析】 【详解】 A. NaHCO3、Al(OH)3中加入足量稀硫酸有气泡产生,生成硫酸钠、硫酸铝、二氧化碳和水,最终无固体存在,A项错误; B.AgCl不溶于酸,固体不能全部溶解,B项错误; C.亚硫酸钠和碳酸钡溶于水,碳酸钡不溶于水使部分固体不溶解,加入稀盐酸,碳酸钡与盐酸反应生成氯化钡、二氧化碳和水,固体全部溶解,再将样品加入足量稀硫酸,稀硫酸和碳酸钡反应生成硫酸钡沉淀和二氧化碳和水,符合题意,C项正确; D. Na2CO3、CuSO4中加热足量稀硫酸,振荡后无固体存在,D项错误; 答案选C。 2.下列反应的离子方程式正确的是 A.大理石溶于醋酸溶液中:CaCO3+2H+===Ca2++CO2↑+H2O B.往硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-===BaSO4↓+Cu(OH)2↓C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+ D.铁与稀盐酸反应:2Fe+6H+===2Fe3++3H2↑ 【答案】B 【解析】 【分析】 离子方程式的书写错误,常见的有电荷不守恒、原子不守恒、反应产物写错、该拆的没拆、不该拆的拆了、反应没写全等等。 【详解】 A.醋酸是弱酸,不能拆,A错误; B.同时生成了两种沉淀,B正确; C.两边电荷不守恒,C错误; D.铁与稀盐酸反应,应该生成Fe2+,D错误; 答案选B。 3.向含有FeBr2溶液中通入一定量的Cl2(还原性:Fe2+>Br-),表示该反应的离子方程式肯
反应工程期末考试试题集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
化学反应过程 简答填空名词解释 1.任何化工生产,从原料到产品都可以概括为原料预处理,化学反应过程和产物 的后处理三个组成部分,而化学反应过程是整个化工生产的核心。 2.工业反应器中对反应结果产生影响的主要物理过程是:1,由物料的不均匀混合 和停留时间不同引起的传质过程;2,由化学反应的热效应产生的传热过程; 3,多相催化反应中在催化剂微孔内的扩散与传热过程。 3.化学反应和反应器的分类:1.按反应系统设计的相态分类分为:○1均相反应, 包括气相均相反应和液相均相反应;○2非均相反应,包括气-固相、气-液相、液-固相、气-液-固相反应。2.按操作方式分类分为:间歇操作,连续操作和半连续操作。3.按反应器型式来分类分为:管式反应器,槽式反应器和塔式反应器。4.按传热条件分为:等温反应器,绝热反应器和非等温绝热反应器。化学反应工程的基本研究方法是数学模型法。 4.反应速率:单位反应体系内反应程度随时间的变化率。 5.反应动力学方程:定量描述反应速率与影响反应速率因素之间的关系式。 6.半衰期:反应转化率从0变成50%所需时间称为该反应的半衰期。 7.建立动力学方程的方法有:积分法、微分法、最小方差分析法。 8.反应器开发的三个任务:○1根据化学反应动力学特性来选择合适的反应器型 式;○2结合动力学和反应器两方面特性来确定操作方式和优化操作条件;○3根据给定的产量对反应装置进行设计计算,确定反应器的几何尺寸并进行评价。 9.反应器设计计算所涉及的基础方程式就是动力学方程式、物料衡算方程式和热 量衡算方程式。
《化学反应工程》期末考试试题A 卷参考答案 一、填空(每空3分,共24分) 1、在轴向分散模型中,模型的唯一参数彼克莱准数愈大轴向返混程度就 愈小 。 2、气体在固体表面上的吸附中物理吸附是靠__分子引力__结合的,而化学吸附是靠__化学键__结合的。 3、在等温活塞流反应器中进行一级均相反应,反应器体积不变,进口浓度C A0从1mol/L 增加到2mol/L ,如果出口转化率不变,则进料体积流量V 0必须 不变 ; 4、活化能的大小直接反映了___反应速率 _____对温度的敏感程度。 5、对于等温下进行串联反应S P A k k ?→??→? 21,在达到相同转化率的情况下,平推流反应器的效果 优于 全混流反应器。 6、用阶跃示踪法测停留时间分布时,通入示踪物5秒后测得F(t)=0.8,这说明通过该反应器的流体中80%的停留时间为 小于等于5秒 ,20%停留时间为 大于5秒 。 二、选择题(每题3分,共24分) 1、对于反应级数n >0的不可逆等温反应,为降低反应器容积,应选用__A 。 A. 平推流反应器 B. 全混流反应器 C. 循环操作的平推流反应器 D. 全混流串接平推流反应器 2、全混流反应器停留时间分布特征值方差2θσ为 B 。 A 、0 B 、1 C 、t D 、∞ 3、气相反应2423CO H CH H O +?+,进料时无惰性气体,CO 与2H 以1∶2摩尔比进料,则膨胀因子c o δ= A 。 A . -2 B. -1 C. 1 D. 2 4.反应级数n= C 时微观流体和宏观流体具有相同的反应结果。 A. 0 B. 0.5 C. 1 D. 2 5、对于单一反应组分的平行反应((A S A P →→主),副),其瞬间收率A ?随A C 增大而单调下降,则最适合的反应器为 A 。 A.全混流反应器 B. 全混流串接平推流反应器 C. 多釜串联全混流反应器 D. 平推流反应器 6. 阶跃示踪法测定停留时间分布对应曲线为 B 。 A. E (t )曲线 B. F (t )曲线 C. I (t )曲线 D. y (t )曲线 7、反应物A 的水溶液在等温全混流反应器中进行两级反应,出口转化率为0.4,若改为等体积的活塞流反应器中进行,则出口转化率为 C 。
离子反应 1.下列反应的离子方程式书写正确的是[ ] A.铁屑溶于足量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O B.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O C.过氧化钠固体与水反应:2O22—+2H2O → 4OH-+O2↑ D.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-===2I2+2H2O 2.下列离子方程式书写正确的是【】 A.向碳酸氢钙溶液中加入足量氨水: Ca2++2HCO3-+2OH-=== CaCO3↓+CO32-+2H2O B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-===2I2+2H2O C.次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O=2HClO+SO32- D.高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛: 6MnO4—+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH—+10H2O 3.在含有大量Na+和NO3-的溶液中,能大量共存的离子组是【】 A.H+ Fe3+ ClO-Cl-B.H+ NH4+ Fe2+ Br- C.Ag+ K+ CO32-SO42-D.K+ AlO2-Cl- OH- 4.下列离子方程式书写正确的是【】 A.向饱和NaHCO3溶液中通入过量SO2:SO2+HCO3-=CO2+HSO3- B.NaHS水解:HS-+H2O H3O++S2- C.向苯酚钠溶液中通人少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- D.NH4Al(SO4)2溶液中加入过量Ba(OH)2溶液: Al3++2SO42—+2Ba2++4OH—=AlO2—+2BaSO4↓+2H2O 5.下列各组离子在相应的条件下一定能大量共存的是【】 A.在碱性溶液中:CO32-、K+、C1-、Na+ B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- C.在c(H+)/c(OH-)==1×1013的溶液中:NH4+、Ca2+、C1-、K+ D.在中性溶液中:Fe3+、C1-、NO3-、A13+ 6.下列反应的离子方程式书写正确的是[ ] A.铁屑溶于足量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O B.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O C.金属钠溶于足量水中:Na+2H2O=Na++H2↑+2OH- D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- 7.下列离子方程式中正确的是【】 A.用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO—+H2O C.用氢氧化钡溶液中和硫酸氢铵溶液:H++SO42-+Ba2++OH-= H2O+BaSO4↓ D.向NaHCO3溶液中加入过量Ca(OH)2溶液2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32- 8.某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,
离子方程式练习题 一判断下列离子方程式是否正确。 1.下列离子方程式正确的是() A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全: Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+ H2O B.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2 C.硫氢化钠水解HS-+H 2O H2S↑+OH- D.用石墨作电极电解AlCI3溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- 2. 下列离子方程式书写正确的是( ) A.次氯酸钙溶液中通入足量SO2:Ca2++C1O—+SO2+H2O=CaSO4+C1—+2H+ B.等体积、等浓度的硫酸铁溶液与氢氧化钡溶液混合 Fe3++SO42—+Ba2++3OH—=Fe(OH)3↓+BaSO4↓ C.醋酸铵溶于水:CH 3COO—+NH4++H2O CH3COOH+ NH3·H2O D.Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O 3. 下列反应的离子方程式错误的是() A.氯化铝溶液中加入过量的氨水:Al3+ + 4NH3?H2O == AlO2- + 4NH4+ + 2H2O B.用氨水吸收过量的二氧化硫NH3?H2O + SO2 == NH4+ + HSO3- C.向苯酚钠溶液中通入少量的二氧化碳C6H5O- + CO2+ H2O == C6H5OH+ CO32- D.次氯酸钙溶液中通入过量的二氧化碳ClO- + CO2 + H2O == HCO3- + HClO 4. 下列离子方程式错误的是() A. 等物质的量氨气通入到稀磷酸溶液中NH3+H3PO4=NH4++H2PO4- B. Ba(OH)2溶液与H2SO4溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+ 2H2O C FeCl3溶液中通入H2S气体:2Fe3++S2-=2Fe2++S↓ D. FeCl3溶液中加入过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ 5. 下了离子方程式不正确的是() A 硫酸铝溶液中加入过量氢氧化钠:Al3++4OH-=AlO2-+2H2O B. 把少量的氯气通入到FeI2的溶液中2I-+CI2=I2+2CI-. C. 氟气通入氯化钠溶液中:F2+2Cl-=2F-+Cl2 D 偏铝酸钠溶液中滴入过量盐酸:AlO2-+4H+=Al3++2H2O 6. 下列结合实验现象的反应方程式正确的是() A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1- C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2=2Na2CO3+O2 D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O 二:书写下列离子方程式: (1)Cl2通入NaOH溶液中:; (2)CuSO4溶液与K2S溶液混合:; (3)Al2O3与NaOH溶液:; (4)Fe3O4溶于硝酸:; (5)Na2SiO3溶液中通入过量的CO2:; (6)小苏打与醋酸反应:; (7)3mL0.4mol/L的Ba(OH)2溶液中滴入12mL0.2mol/L的H3PO4: ;
化环09030904反应工程复习大纲 一. 填空题 1.化学反应速率可以表为前提是▁▁▁▁。(反应体积恒定 考点:反应速率的定义,恒容) 2.化学反应过程按操作方法分为_______、_______、_______操作。(间歇操作、连续操作、半间歇操作)(理解连续与间歇) 3. 对于反应,则_______。()(考点:反应物和产物的速率之比等于其化学计量系数之比) 4化学反应速率式为,用浓度表示的速率常数为,假定符合理想气体状态方程,如用压力表示的速率常数,则=_______。()(以浓度表示的速率常数与分压速率常数的换算关系) 5在构成反应机理的诸个基元反应中,如果有一个基元反应的速率较之其他基元反应慢得多,该步骤的反应速率即代表整个反应的速率,其他基元反应可视为处于_______。(拟平衡态) (考点:理解拟平衡态、速率控制步骤的定义,用于推导非基元反应动力学) 6如果平行反应均为一级不可逆反应,若>,提高选择性应_______。(提高温度)(考点:主反应活化能大于副反应活化能,升温提高选择性,反之则反,还应注意主反应级数高于副反应级数时应采用高浓度操作,对应应该采用什么样的加料方式或什么类型的反应器?) 7一级连串反应在平推流反应器中,为提高目的产物P的收率,应 ______。(降低)(考点:提高连串反应选择性的途径,还包括间歇反应釜中的最佳反应时间和连续反应器的体积(OR空时OR停留时间)问题) 8气体在固体表面上的吸附中物理吸附是靠_______结合的,而化学吸附是靠_______结合的。物理吸附的吸附热要_______化学吸附热,物理吸附是_______分子层吸附,而化学吸附是_______分子层吸附(范德华力、化学键力、小于、多、单)(考点:比较物理和化学吸附的区别,包括结合力)吸附层数,吸附热等区别) 9气体在固体表面上发生吸附时,描述在一定温度下气体饱和吸附量与吸附压力(或吸附物质在相中浓度)的关系式称为_______。(吸附等温方程)(吸附等温式的定义,注意是饱和吸附量) 10.在轴扩散模型中,彼克莱准数_______,()Pe很大时,即扩散系数相对非常小,反应器中物料的流动形态接近______。(平推流或活塞
《化学反应工程》试题库 一、填空题 1. 质量传递、热量传递、动量传递和和化学反应称为三传一 反? 2. 物料衡算和能量衡算的一般表达式为输入-输出二累 积_____________ 。 3. 着眼组分A 转化率X A的定义式为 X A=( n A—n A)/ _____________ 。 4. 总反应级数不可能大于£—。 5. 反应速率-r A=kC A C B的单位为kmol/(m3? h).速率常数k的因次为 nV(kmol ? h ) 。 6. 反应速率-r A=kC A的单位为kmol/kg ? h.速率常数k的因次为mVkg ? h 。 7. 反应速率.kc A/2的单位为mol/L ? s.速率常数k的因次为 (mol) 1/2? L-1/2? s 。 8. 反应速率常数k与温度T的关系为lnk 10000 102.其活化能为 T mol 。 9. 某反应在500K时的反应速率常数k是400K时的103倍.则600K
时的反应速率常数k时是400K时的10 5倍。 10. 某反应在450C时的反应速率是400C时的10倍.则该反应的活化 能为(设浓度不变)mol 。 11. 非等分子反应2SO+Q==2SQ的膨胀因子sq等于________ 。 12. 非等分子反应N2+3H2==2NH的膨胀因子H2等于-2/3 。 13. 反应N b+3H2==2NH中(& )= 1/3 (仏)二1/2 扁3 14. 在平推流反应器中进行等温一级不可逆反应.反应物初浓度为G°. 转化率为X A.当反应器体积增大到n倍时.反应物A的出口浓度为 C A0(1-X A)n . 转化率为1-(1- X A”。 15. 在全混流反应器中进行等温一级不可逆反应.反应物初浓度为C A0. 转化率为X A.当反应器体积增大到n倍时.反应物A的出口浓度为 匚些.转化率为nxA—。 1 (n 1)X A 1 (n 1)X A 16. 反应活化能E越大.反应速率对温度越敏感。 17. 对于特定的活化能.温度越低温度对反应速率的影响越大。 18. 某平行反应主副产物分别为P和S选择性S的定义为(n P-g)/ (n s- n s0)
第十七章 周环反应 我们学过了离子型反应、游离基反应。这些反应过程是分步进行的,首先形成正离子、负·或游离基。然后再完成反应。但在某些情况下,反应并不是按照这种机理进行的,如下面的例子: 例1. 33175℃ CH 3 H CH 3 H 顺-3,4-二甲基环丁烯在加热时生成(Z ,E )-2,4-已二烯,纯度达99.995%,立体取向极高。按照常理,(E ,E )式应该更加稳定,此反应中为什么不形成更稳定的(E ,E )产物? 例2 △ C 6H 5 H C 6H 5 H 6H 5H 5 用较大的苯基取代了原来的甲基,但产物的立体选择性仍高达99%,也不生成更稳定的(E ,E )产物,这什么? 例3. 2CH 32CH 3 CO 2CH 3 H CO 2CH 3 H 120℃10min 该例中,取代基的电性发生了改变,为什么也不生成更稳定的(E ,E )产物? 上述问题通过取代基的立体效应都不能说明。1965年,伍德沃德和霍夫曼提出协同反应中轨道对称性守恒原则,并根据这一原则预测协同反应能否进行及其立体化学特征,即在有些反应中起关键作用的是轨道的对称性。伍德沃德和霍夫曼和工作是近代有机化学中的重大成果之一。此后,日本科学家福井谦一提出了前线轨道理论,为此霍夫曼和福井谦一共同获得了1981年诺贝尔化学奖。 有机反应可归纳为两大类: 一类是通过活泼中间体,如碳正离子、负离子、游离基进行的反应; 另一类是通过一个环状过渡态完成的,反应过程中键 的形成和断裂是协同进行的,称为周环反应。 周环反应包括三种类型:电环化反应,环加成反应和σ迁移反应。 周环反应有以下重要特征: ⑴反应在加热或光照条件下进行,很少受溶剂极性、酸碱催化剂、游离基引发剂 的影响。 ⑵ 反应过程中旧键的断裂和新键的形成是同时进行的,即反应是按协同方式进行的,形成了一个环状过渡态。所以在反应的过程中,没有离子或游离基形成。
离子方程式练习题含答 案 集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)
离子方程式练习 题 一判断下列离子方程式是否正确。 1.下列离子方程式正确的是 ( ) A .向Ba(OH)2溶液中滴加NH 4HSO 4溶液至刚好沉淀完全: Ba 2++2OH -+NH 4++H ++SO 42- =BaSO 4↓+NH 3·H 2O+ H 2O B .H 218O 中投入Na 2O 2固体:2H 218O +2O 22-=4OH -+18 O 2 C .硫氢化钠水解 HS -+H 2O H 2S ↑+OH - D .用石墨作电极电解AlCI 3溶液:2Cl -+2H 2O Cl 2↑+H 2↑+2OH - 2. 下列离子方程式书写正确的是 ( ) A .次氯酸钙溶液中通入足量SO 2:Ca 2++C1O —+SO 2+H 2O=CaSO 4+C1—+2H + B .等体积、等浓度的硫酸铁溶液与氢氧化钡溶液混合 Fe 3++SO 42—+Ba 2++3OH —=Fe (OH )3↓+BaSO 4↓ C .醋酸铵溶于水:CH 3COO —+NH 4++H 2O CH 3COOH+ NH 3·H 2O D .Ca(HCO 3)2溶液与过量NaOH 溶液反应: Ca 2++HCO 3-+OH -=CaCO 3↓+H 2O 3. 下列反应的离子方程式错误的是( ) A . 氯化铝溶液中加入过量的氨水:Al 3+ + 4NH 3?H 2O == AlO 2- + 4NH 4+ + 2H 2O B . 用氨水吸收过量的二氧化硫 NH 3?H 2O + SO 2 == NH 4+ + HSO 3- C . 向苯酚钠溶液中通入少量的二氧化碳 C 6H 5O - + CO 2 + H 2O == C 6H 5OH+ CO 32- D . 次氯酸钙溶液中通入过量的二氧化碳 ClO - + CO 2 + H 2O == HCO 3- + HClO 4. 下列离子方程式错误的是( ) A. 等物质的量氨气通入到稀磷酸溶液中 NH 3+H 3PO 4=NH 4++H 2PO 4- B. Ba(OH)2溶液与H 2SO 4溶液反应: Ba 2++2OH -+2H ++SO 42-=BaSO 4↓+ 2H 2O C FeCl 3溶液中通入H 2S 气体: 2Fe 3++S 2-=2Fe 2++S ↓ D. FeCl 3溶液中加入过量氨水: Fe 3++3NH 3·H 2O=Fe (OH )3↓+3NH 4+ 5. 下了离子方程式不正确的是( ) A 硫酸铝溶液中加入过量氢氧化钠: Al 3++4OH -=AlO 2-+2H 2O B. 把少量的氯气通入到 FeI 2 的溶液中 2I -+CI 2=I 2+2CI -. C. 氟气通入氯化钠溶液中: F 2+2Cl -=2F -+Cl 2 D 偏铝酸钠溶液中滴入过量盐酸: AlO 2-+4H +=Al 3++2H 2O 6. 下列结合实验现象的反应方程式正确的是( ) A .切开的金属Na 暴露在空气中,光亮表面逐渐变暗2Na+O 2=Na 2O 2 B .向AgC1悬浊液中滴加Na 2S 溶液,白色沉淀变成黑色2AgC1+S 2-=Ag 2S ↓+2C1- C .Na 2O 2在潮湿的空气中放置一段时间,变成白色粘稠物2Na 2O 2=2Na 2CO 3+O 2 D .向NaHCO 3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO 3-+Ca 2++2OH -=CaCO 3↓+CO 32-+2H 2O 二:书写下列离子方程式:
一、填空(40分) (1)气相反应A+3B→2C,则δ= δ= 。ΒA dC A?r?,前提是(2)反应速率常数有时可以表为。A dt (3)空间速度是指 ___________ , 空间时间是指 __________。 (4)反应具有最佳温度曲线, 最佳温度曲线是指 __________ 。 4.0克/cm5)多孔性球形颗粒10克,半径1cm,系由密度为(孔隙率3的材料制成。 则其孔容积V= ,θ= g 。假密度ρ= 2?0.218?,如果采用扩散模型,则)已知某非理想流动反应器其停留时间分布的方差 (6?Pe=_______,如果采用多级全混流模型,则m=_______ (7)催化剂微孔内的气体扩散有____扩散,____扩散、____扩散、 及____扩散等多种形式。。 L r?2C AL A C1mol/L, ,进料反应进行至,(8)复合反应=A02C2r?M AM x?0.5, s = 时。如果该反应在在固体催化剂中进行时,由瞬时选择性LA。于内扩散的影响,选择性会t?E(t)dt?F(?)?F(0)?)(9,,。 0. (10)内扩散效率因子ζ和Thiele模数Φ的数值通常有如下关系: 外扩散和化学动力学控制时ζ1,Φ值较; 内扩散强烈影响时ζ1,Φ值较。 (11)CO中温变换反应器属于固定床里的反应器。固定床按气体流动方向, 可以分为和反应器。 492-=/s, =1.5×1012)某一级不可逆的气液反应过程,已知k=10mm/s,D(LL则当k 时,该反应属于快反应,反应区主要在,工业上可选用 反应器或反应器;当k 时,该反应属于慢反应,这时反应区主 要在,工业上可选用或反应器。 L2r?1.0CC BAL L 13AB为主产物,则适+(,)对于平行反应2r?2.0CC M BAA CC 的要求是宜的操作条件对和。BA (14)返混是指
化学高中化学离子反应练习题一、高中化学离子反应 1.下列各反应对应的离子方程式正确的是() 2溶液中加入少量的32+-3- 332-2O A.向 Ca(OH)NaHCO 溶液: Ca +2OH +2HCO =CaCO↓ +CO +2H -1的 Ba(OH) 溶液中通入2+-- B.向 100mL0.12mol L·20.02molCO2: Ba +3OH +2CO2=HCO3 +BaCO3↓ +H2O C.硫酸氢钠与氢氧化钡溶液反应后+42-2+-42 pH 恰好为 7:H +SO+Ba +OH =BaSO↓+H O 23-1稀盐酸: OH-32- D.向含 0.1molNaOH 和 0.1molNa CO 的溶液中加入 1L0.4mol L·+CO +22 +3H =CO ↑ +2H O 【答案】 D 【解析】 【分析】 【详解】 A.根据定少为一的原则,将NaHCO3的系数定为1,则向 Ca(OH)2溶液中加入少量的NaHCO3溶液,离子反应方程式应为:Ca2++OH-+HCO3-=CaCO3↓ +H2 O, A 选项错误; B.先算出 Ba(OH)2的物质的量为 0.012mol ,而 CO2的物质的量为0.02mol ,二者的物质的量为 3:5,按照 3:5的化学计量比来写方程式:3Ba2+-23-32 +6OH +5CO =4HCO+BaCO↓+H O, B 选项错误; C.硫酸氢钠与氢氧化钡溶液反应后pH 恰好为 7,因此二者按2:1 的系数来反应: +42-2+-42 2H +SO+Ba +OH =BaSO↓+2H O,C 选项错误; D.首先三者的物质的量之比为1:1:4 ,稀盐酸先和烧碱中和,过量的稀盐酸再和纯碱反 应,据此离子反应方程式为:OH-32-+22 +CO+3H =CO ↑+2H O, D 选项正确; 答案选 D。 【点睛】 本题考查了离子方程式的书写,侧重考查反应物用量不同发生反应不同的离子反应,题目 难度较大,注意反应的顺序,尤其是某一种反应物过量时的后续反应。 2.下列实验与对应示意图的关系正确的是() A.向 NaAlO2溶液中逐滴滴加盐酸至过量 B.向 AlCl3溶液中逐滴滴加氨水至过量