
第26卷 第3期
2007年 5月环 境 化 学ENV I RONME NT AL CHE M I ST RY Vol .26,No .3May 2007
2006年8月18日收稿.
3948项目(2005202)和湖南省教育厅产业化推广项目(湘教发20032101)资助.33通讯联系人:E 2mail:wuxiaofu530911@vi p 11631co m
固液相离子吸附体系中吸附剂浓度效应与
Lang m u i r 方程的适用性
3赵 芳1 吴晓芙133 张艳丽1 黄中子2
(1 中南林业科技大学理学院,株洲,412006;2 上海工程技术大学化学化工学院,上海,201600)
摘 要 以蛭石吸附Zn 2+和Cd 2+为例,探讨Lang muir 方程在固液相离子吸附体系中的适用性,结果表明:传统吸附等温线随吸附剂浓度W 0增大而下降,吸附量q e 不仅仅由液相平衡浓度C e 所决定,而是C e 和W 0两个变量的函数;以Lang muir 方程的线性形式对实验数据进行拟合,在给定吸附剂浓度水平下的实验数据与Lang muir 方程拟合的相关性很好,但方程中的两个参数随吸附剂浓度增大而降低而且差异显著,表明Lang 2muir 方程仅适用于给定吸附剂浓度的体系,采用单一参数的Lang muir 方程难以准确描述试验检测范围内Zn 2+和Cd 2+
的吸附规律.关键词 吸附剂浓度效应,Lang muir 方程,锌,镉,蛭石.
常用来描述固2液体系中吸附行为的理论模型有Lang muir 及Freundlich 方程,其中应用最为广泛的是Lang muir 方程[1],方程中的两个参数吸附容量q m 与平衡常数K L 物理意义明确,许多研究中常用
Lang muir 方程的线性形式估算这两个参数,用来比较和描述不同吸附体系的吸附特性[2,3],探讨吸附
过程中的相关热力学问题
[3,4].但是,很多试验结果都显示Lang muir 方程的两个参数存在不稳定的现象,不同的研究者对此给出了种种不同的解释[5—7]. 本文以蛭石吸附Zn 2+和Cd 2+为例,从吸附剂浓度效应的角度对Lang muir 方程在固液相离子吸附
体系中的适用性进行探讨.
1 实验部分
天然矿物蛭石使用前过筛,取20—40目颗粒,用蒸馏水反复洗涤后,置于烘箱中于100—105℃烘干,放入干燥器中备用.
准确称量一定量的蛭石放入250m l 具塞磨口锥形瓶中,分别加入100100m l 浓度为50,100,200,300和500mg ?l -1的锌或镉溶液,于水浴恒温振荡器中振荡,过滤,测定滤液中锌和镉的含量.
预试验结果表明:蛭石对Zn 2+和Cd 2+的吸附大约在8h 即已趋于平衡,为确保达到平衡,等温吸
附实验均采用振荡24h,再静置8h 后过滤.
单位吸附剂的平衡吸附量用下式计算:
q e =(C 0-C e )/W 0=C 0/W 0-C e /W 0(1)
式中,C 0和C e 分别为吸附前后溶液中金属离子的质量浓度(mg ?l
-1);W 0为溶液中吸附剂的浓度(g ?l -1).
2 结果与讨论
211 Lang muir 等温吸附曲线
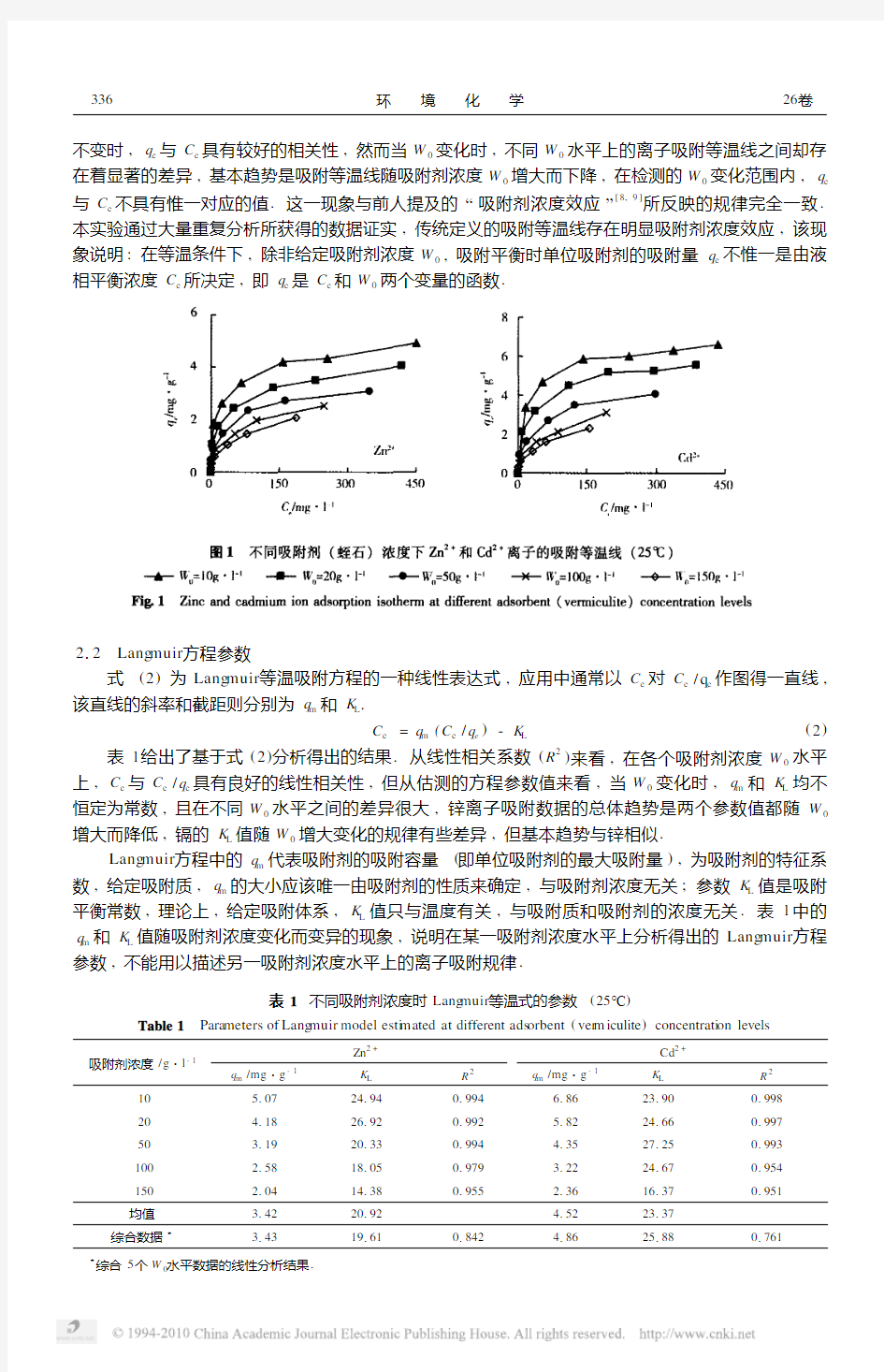
图1分别给出了Zn 2+和Cd 2+离子在5个吸附剂浓度(W 0)水平上的q e 2C e 等温吸附曲线.从图1
可以看到,在每一个W 0水平上,锌和镉离子的等温吸附曲线基本符合Lang muir 吸附理论,即当W 0
336 环 境 化 学26卷不变时,q e 与C e 具有较好的相关性,然而当W 0变化时,不同W 0水平上的离子吸附等温线之间却存在着显著的差异,基本趋势是吸附等温线随吸附剂浓度W 0增大而下降,在检测的W 0变化范围内,q e 与C e 不具有惟一对应的值.这一现象与前人提及的“吸附剂浓度效应”[8,9]
所反映的规律完全一致.本实验通过大量重复分析所获得的数据证实,传统定义的吸附等温线存在明显吸附剂浓度效应,该现象说明:在等温条件下,除非给定吸附剂浓度W 0,吸附平衡时单位吸附剂的吸附量q e 不惟一是由液相平衡浓度C e 所决定,即q e 是C e 和W 0两个变量的函数.
212 Lang muir 方程参数
式(2)为Lang muir 等温吸附方程的一种线性表达式,应用中通常以C e 对C e /q e 作图得一直线,该直线的斜率和截距则分别为q m 和K L .
C e =q m (C e /q e )-K L (2)
表1给出了基于式(2)分析得出的结果.从线性相关系数(R 2)来看,在各个吸附剂浓度W 0水平
上,C e 与C e /q e 具有良好的线性相关性,但从估测的方程参数值来看,当W 0变化时,q m 和K L 均不恒定为常数,且在不同W 0水平之间的差异很大,锌离子吸附数据的总体趋势是两个参数值都随W 0增大而降低,镉的K L 值随W 0增大变化的规律有些差异,但基本趋势与锌相似.
Lang muir 方程中的q m 代表吸附剂的吸附容量(即单位吸附剂的最大吸附量),为吸附剂的特征系数,给定吸附质,q m 的大小应该唯一由吸附剂的性质来确定,与吸附剂浓度无关;参数K L 值是吸附平衡常数,理论上,给定吸附体系,K L 值只与温度有关,与吸附质和吸附剂的浓度无关.表1中的q m 和K L 值随吸附剂浓度变化而变异的现象,说明在某一吸附剂浓度水平上分析得出的Lang muir 方程参数,不能用以描述另一吸附剂浓度水平上的离子吸附规律.
表1 不同吸附剂浓度时Lang muir 等温式的参数(25℃)
Table 1 Para meters of Lang muir model esti m ated at different ads orbent (ver m iculite )concentrati on levels
吸附剂浓度/g ?l
-1Zn 2+Cd 2+q m /mg ?g -1K L R 2q m /mg ?g -1K L R 210
510724194019946186231900199820
411826192019925182241660199750
3119201330199441352712501993100
21581810501979312224167019541502104
141380195521361613701951均值3142
20192415223137综合数据33143191610184241862518801761
3综合5个W 0水平数据的线性分析结果.
3期赵芳等:固液相离子吸附体系中吸附剂浓度效应与Lang muir 方程的适用性
337 人们习惯将q m 值作为反映吸附剂吸附能力的特征参数
[2,3],并用K L 的倒数值来计算吸附过程的焓、熵与Gibbs 自由能变[3,4],然而,表1的数据表明,除非规定一个吸附剂浓度水平作为标准,基于Lang muir 方程参数进行吸附剂吸附能力表征与吸附过程的热力学计算均可能导致错误的结论.213 Lang muir 方程线性趋势分析
基于式(2)对给定吸附剂浓度或给定吸附质浓度的实验数据做出的线性趋势分析,可以进一步说明Lang muir 方程仅适用于描述给定吸附剂浓度时的离子吸附规律.如表1所示:当给定吸附剂浓
度W 0时,C e 与C e /q e 在检测的C 0范围内保持着良好的线性关系,线性相关系数R 2均大于0195;而
表2则显示:当给定吸附质浓度C 0而改变吸附剂浓度W 0时,C e 与C e /q e 的线性关系很差,这充分反映了W 0变化对Lang muir 等温吸附曲线的影响.图2给出的是综合5个W 0水平数据的线性趋势线.从图中可更加直观地看出,尽管综合数据的线性相关系数R 2大于017,但总体上数据点发散,各点与趋势线间的差异显著.由锌离子吸附综合数据分析得出的q m 和K L 值分别为3143和19161,由镉离子吸附综合数据分析得出的q m 和K L 值分别为4186和25188,这与不同W 0水平上测出的参数的平均值相近(见表1).显然,若用综合数据测出的q m 和K L 值来预测不同W 0水平吸附体系的q e 值,必然会产生不同程度的误差,而误差值将随W 0变化范围增大而增大.Lang muir [1]在检测其建立的吸附模型时也曾指出,由于吸附机制与过程的复杂性,不同吸附体系的吸附规律很难用单一方程来描述.
表2 给定起始离子浓度C 0水平上Lang muir 等温方程线性趋势分析(25℃)
Table 2 L inear correlati on analysis based on linear f or m of Lang muir is other m at given initial i on concentrati on C 0level 起始离子浓度
Zn 2+/mg ?l -1Cd 2+/mg ?l -150
10020030050100200300R 201842
01741015100158401575015770135701053
图2 综合数据的Lang muir 等温方程线性趋势分析(25℃)
F i g 12 L inear correlati on analysis of i on ads or p ti on based on linear for m of Lang muir is other m using combined data
obtained at five ads orbent concentrati on W 0levels
214 吸附剂浓度效应原因分析
由吸附剂浓度效应引起的传统定义的平衡常数呈现不稳定性曾被归结为多种原因,由于液固相之间的电化学势差是液相中的离子吸附自发反应的驱动力,因此,溶液的pH 值和离子强度被看作影响
离子吸附反应至关重要的因子[10,11].然而值得提及的是,尽管在许多报道的试验中严格地控制了体
系的pH 值和离子强度,试验结果里仍然观察到明显的等温吸附曲线随吸附剂浓度增大而降低的现
象[8,9],这在一定程度上说明,体系pH 值和离子强度在吸附过程中的变化不是产生吸附剂浓度效应和导致平衡吸附常数不稳定的本质原因.
基于物质守恒原理建立的式(1)是实际测试中计算平衡吸附量的基础式,该式含有三个“吸附质与吸附剂比值”变量:q e ,C 0/W 0与C e /W 0,其中,C 0与W 0为给定比值,C e 为测定值.由式(1)可知:当给定C 0/W 0比值,另两个变量q e 与C e /W 0必然具有惟一的对应关系.在给定C 0/W 0下,q e 与C e /W 0具有惟一的对应关系,则q e 就不可能与C e 具有惟一的对应关系,或者说,只有进一步给定W 0,q e 才与C e 具有惟一对应的值.值得说明的是,给定C 0/W 0比值不等于给定W 0,例如,给定C 0/W 0=1,C 0与
338
环 境 化 学26卷W0可取任意值,只要两者相等即可.我们认为“在等温条件下,固液相离子吸附体系中单位吸附剂的
平衡吸附量q
e 不惟一由液相平衡浓度C
e
所决定,而是C
e
和W
两个变量的函数”.
3 结论
(1)蛭石吸附Zn2+和Cd2+的过程中存在显著的吸附浓度效应,吸附等温线随吸附剂浓度W
增
大而下降,单位吸附剂的平衡吸附量q
e 不惟一由液相平衡浓度C
e
所决定,而是C
e
和W
的函数.
(2)给定吸附剂浓度水平下的实验数据与Lang muir方程拟合的相关性很好,但两个参数随吸附剂浓度的不同而差异显著,表明单一参数的Lang muir方程难以准确描述吸附体系的特性,用估测的Lang muir方程参数来表征不同吸附剂的吸附能力或进行吸附热力学研究可能会导致较大的误差.
参 考 文 献
[1] Lang muir I,The Ads or p ti on of Gases on Plane Surfaces of Glass,M ica,and Platinum1J1Am1Che m1Soc1,1918,40∶1361—1403
[2] 张爱茜,刘伟,吴海锁等,酿酒酵母对Cu2+生物吸附机制的研究1环境化学,2005,24(6)∶675—677
[3] 何建玲,新型吸附树脂对苯乙酸的吸附热力学研究1离子交换与吸附,2004,20(2)∶131—137
[4] 魏瑞霞,陈金龙,陈连龙等,22噻吩乙酸在三种不同树脂上的吸附热力学和动力学研究.高等学校化学学报,2004,25(11)∶
2095—2098
[5] 孙卫玲,倪晋仁,兰格缪尔等温式的适用性分析———以黄土吸持铜离子为例1环境化学,2002,21(1)∶37—44
[6] Tao Zuyi,Chu Tai w ei,On the App licability of the Lang muir Equati on t o Esti m ati on of Ads or p ti on Equilibrium Constants on a Powdered
Solid fr om Aqueous Soluti on1Journal of Colloid and Interface Science,2000,231∶8—12
[7] Harter R D,Baker D E,App licati ons and M isapp licati ons of the Lang muir Equati on t o Soil Ads or p ti on Phenomena1Soil Sci1Soc1Am1
J1,1977,41∶1077—1080
[8] Voice T C,W eberW J,Sorbent Concentrati on Effects in L iquid/Solid Partiti oning1J1Environ1Sci1Technol1,1985,19∶789—796
[9] Pan G,L iss P S,Kr o m M D,Particle Concentrati on Effect and Ads or pti on Reversibility1Colloids and Surface A,1999,151∶127—133
[10] Greathouse J A,Cygan R T,Molecular Dyna m ics Si m ulati on of U ranyl(V I)Ads or p ti on Equilibria ont o an ExternalMont m orill onite Sur2
face1Physical Che m istry Che m ical Physics,2005,7∶3580—3586
[11] Hao X,Sp iekerW A,Regalbut o J R,A Further Si m p lificati on of the Revised Physical Ads or p ti on(RP A)Model1J1Colloid Interface
Sci1,2003,267∶259—264
ADS ORBENT EFFECT AN D APP L I CABI L I T Y OF LANG M UI R EQUATI ON FO R D ESCR I B I NG I O N AD S O RPT I O N I N L I QU I D/S OL I D S Y STE M S
ZHAO Fang1 WU X iao2fu1 ZHAN G Yan2li1 HUAN G Zhong2zi2
(1 Central South University of Forestry&Technol ogy,Zhuzhou,412006,China;
2 Shanghai University of Engineering Science,Shanghai,201600,China)
ABSTRACT
Experi m ents of Zn2+and Cd2+ads or p ti ons on ver m iculite were conducted t o test the app licability of Lang muir equati on f or describing i on ads or p ti on in liquid/s olid syste m s1The results showed that the traditi onally defined equilibrium ads or p ti on is other m decreased with increasing ads orbent concentrati on W0, indicating that the equilibriu m i on ads or p ti on density q e is not a single functi on of the equilibriu m i on concentrati on in liquid phase C e but a functi on of both C e and W01The Lang muir equati on was f ound t o fit the experi m ental data well for both Zn2+and Cd2+only at given ads orbent concentrati on levels1The defined equati on para meters varied significantly with a general trend t owards decrease with increasing ads orbent concentrati on1The p resent findings suggest that unless the ads orbent concentrati on is kep t constant,a single Lang muir2type equati on can not be app lied t o describe Zn2+and Cd2+ads or p ti on in the liquid/s olid syste m1 Keywords:ads orbent effect,Lang muir equati on,Zn2+,Cd2+,ver m iculite.
高考化学离子反应方程式的常见出题陷阱【】:对高三生而言,应及时了解、掌握高考备考知识,只有这样,才能提前做好准备。小编为您推荐高考化学离子反应方程式的常见出题陷阱,希望对您有助! 高考化学离子反应方程式的常见出题陷阱如下: 离子反应方程式的常见出题陷阱有以下几个方面: 1、弱电解质不能拆。如碳酸钙与醋酸反应: CaCO3+H+=Ca2++H2O+CO2就是非常典型的错误。但是不仅如此,我们还应该知道其他常见的不能拆的弱电解质,如HF 、HClO等。 2、电荷不守恒。如氯化铁跟铜反应:Fe3++Cu=Fe2++Cu2+是比较明显的电荷不守恒的方程式,此类一般较易找出。 3、反应事实,尤其是碰到强氧化剂时。如向次氯酸钙溶液通入SO2:Ca2++2ClO+SO2+H2O= CaSO3+2HClO就是没有考虑ClO的强氧化性会生成CaSO4,从而导致错误。 4、遗落。硫酸铜溶液跟氢氧化钡溶液反应: Ba2++SO42-=BaSO4就属于缺项。 5、配比。如稀硫酸与氢氧化钡反应:H+ + OH- + SO42-+Ba2+ = BaSO4+H2O错在H+和SO42-,以及OH-和Ba2+的比例应该始终是2:1。 6、分步。如多元弱酸的电离以及弱酸盐的水解等。 7、普通过量CO2 、SO2 、H2S问题。即在通常情况下,过
量CO2和NaOH反应生成的是NaHCO3而不是Na2CO3。SO2 、H2S也是同样的道理。 8、反应方程式与量无关。这种情况会出现于Al3+与过量氨水反应,AlO2-与过量CO2 反应,苯酚和CO2 反应等。9、酸式盐的过量少量。比如区别Ca(HCO3)2与过量、少量NaOH溶液反应的异同实质。 以上几点是离子反应题中最常出现的错误类型归纳,熟悉这些之后,做这类题目便可信手拈来,不易再误入陷阱。【总结】:高考化学离子反应方程式的常见出题陷阱为大家介绍完了,希望大家在高三期间好好复习,为高考做准备,大家加油。 更多精彩内容推荐: 名师解读:高考化学备考五大误区 高三化学无机方程式应考技巧
一、写出下列反应的离子方程式:(过程自己在草稿纸上写) 1 铁与稀硫酸 2 铜与硝酸银 3 氧化铁与盐酸 4 碳酸钠与盐酸 5 碳酸氢钠与稀盐酸 6 醋酸与氢氧化钠 7 氢氧化钡与盐酸 二、按要求写出下列反应的离子方程式 1 少量二氧化碳与氢氧化钠反应 2 过量二氧化碳与氢氧化钠反应 3 少量二氧化碳与澄清石灰水反应 4 硫酸氢钠与氢氧化钡恰好中和 5 过量碳酸氢钠与氢氧化钡反应 6 硫酸氢钠与碳酸氢钠反应 三、将下列反应改写成离子方程式:(提示,有个别不是离子反应或写不出离子方程式,请判断)(1)2Na2O2+2H2O=4NaOH+O2↑ (2)Cl2+H2O=HCl+HClO (3)2F2+2H2O=4HF+O2 (4)2KMnO4+16HCl =2KCl +2MnCl2+5Cl2↑+8H2O (5)KClO3 + 6HCl =KCl + 3Cl2 + 3H2O (6) C +2H2SO4(浓)CO2↑+2SO2↑+2H2O
四、选择填空 3.将BaCl 2溶液分别滴入到K 2SO 4、稀H 2SO 4溶液中,均有 产生,它们的离子方程式是 ,说明离子方程式不仅表示一定物质间的 ,而且表示了 离子反应。 4.将一小块金属钠投入到FeCl 3溶液中,此时观察到的现象是 ,有关反应的离子方程式是 。 二、选择题 5.下列物质的水溶液能导电而本身不是电解质的是 ( ) A .氨气 B .硫酸 C .二氧化碳 D .硫酸钠 6.下列电离方程式正确的是 ( ) A .2424-++=SO Mg MgSO B .-++=222)(OH Ba OH Ba C .-++=24334232)(SO Al SO Al D .- ++=32232)(NO Ca NO Ca 7.下列离子方程式书写正确的是 ( ) A .碳酸钙与盐酸反应 CO 32-+2H +=CO 2↑+H 2O B .硫酸和氯化钡溶液反应 Ba 2++SO 42-=BaSO 4↓ C .氢氧化钡和硫酸反应 OH -+H +=H 2O D .铁钉放入硫酸铜溶液中 Fe+3Cu 2+=2Fe 3++3Cu 8.下列离子反应方程式正确的是 ( ) A .钠和水的反应: Na+2H 2O ══Na ++ 2OH -+H 2↑ B .碳酸钠溶液与稀盐酸反应: CO 32-+2H +══CO 2↑-+ H 2O ↑ C .钠与足量稀盐酸反应: 2Na+2H +══2Na ++H 2↑ D .小苏打溶液与烧碱溶液反应: NaHCO 3+OH -══Na ++ CO 32-+H 2O 9.不能用H ++OH -=H 2O 表示的反应是 ( ) A .盐酸与氢氧化钾溶液反应 B .稀硫酸与氢氧化钡溶液反应 C .稀硝酸与氢氧化钠溶液反应 D .碳酸与氢氧化钠溶液反应 10.在下列化学方程式中,不能用离子方程式Ba 2++SO 42-==BaSO 4↓表示的是 ( ) A 、Ba(NO 3)2+H 2SO 4==BaSO 4↓+2HNO 3 B 、BaCl 2+Na 2SO 4==BaSO 4↓+2NaCl C 、Ba(OH)2+H 2SO 4==BaSO 4↓+2H 2O D 、BaCl 2+H 2SO 4==BaSO 4↓+2HCl
离子反应 1.下列反应的离子方程式书写正确的是[ ] A.铁屑溶于足量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O B.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O C.过氧化钠固体与水反应:2O22—+2H2O → 4OH-+O2↑ D.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-===2I2+2H2O 2.下列离子方程式书写正确的是【】 A.向碳酸氢钙溶液中加入足量氨水: Ca2++2HCO3-+2OH-=== CaCO3↓+CO32-+2H2O B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-===2I2+2H2O C.次氯酸钠溶液中通入二氧化硫气体:2ClO-+SO2+H2O=2HClO+SO32- D.高锰酸钾与乙醇制备Mn3O4纳米粉体,同时生成乙醛: 6MnO4—+13CH3CH2OH→2Mn3O4+13CH3CHO+6OH—+10H2O 3.在含有大量Na+和NO3-的溶液中,能大量共存的离子组是【】 A.H+ Fe3+ ClO-Cl-B.H+ NH4+ Fe2+ Br- C.Ag+ K+ CO32-SO42-D.K+ AlO2-Cl- OH- 4.下列离子方程式书写正确的是【】 A.向饱和NaHCO3溶液中通入过量SO2:SO2+HCO3-=CO2+HSO3- B.NaHS水解:HS-+H2O H3O++S2- C.向苯酚钠溶液中通人少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- D.NH4Al(SO4)2溶液中加入过量Ba(OH)2溶液: Al3++2SO42—+2Ba2++4OH—=AlO2—+2BaSO4↓+2H2O 5.下列各组离子在相应的条件下一定能大量共存的是【】 A.在碱性溶液中:CO32-、K+、C1-、Na+ B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42- C.在c(H+)/c(OH-)==1×1013的溶液中:NH4+、Ca2+、C1-、K+ D.在中性溶液中:Fe3+、C1-、NO3-、A13+ 6.下列反应的离子方程式书写正确的是[ ] A.铁屑溶于足量稀硝酸:Fe+4H++NO3-=Fe3++NO↑+2H2O B.碳酸氢钙溶液中加入足量烧碱溶液:HCO3-+OH-=CO32-+H2O C.金属钠溶于足量水中:Na+2H2O=Na++H2↑+2OH- D.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- 7.下列离子方程式中正确的是【】 A.用氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+ B.用烧碱溶液吸收氯气:Cl2+2OH-=Cl-+ClO—+H2O C.用氢氧化钡溶液中和硫酸氢铵溶液:H++SO42-+Ba2++OH-= H2O+BaSO4↓ D.向NaHCO3溶液中加入过量Ca(OH)2溶液2HCO3-+Ca2++2OH-=2H2O+CaCO3↓+CO32- 8.某无色溶液中可能含有Na+、K+、Fe3+、NH4+、Cu2+、SO42-、SO32-、CO32-、Cl-、Br- 这几种离子中的若干种,
离子反应规律和离子方程式书写 1 基本概念 离子反应:在溶液(或熔化态)中有离子参与或有离子生成的化学反应统称离子反应。它包括有离子参与或有离子生成的氧化还原反应和非氧化还原反应两大类。 2 强电解质和弱电解质 在溶液中(或熔化状态)本身能发生电离的化合物叫电解质,不能发生电离的化合物叫非电解质。在溶液中能全部电离成离子的电解质叫强电解质,它包括大多数的盐类、强酸和强碱。;在溶液中只有部分电离为离子的电解质叫弱电解质,它包括弱酸(H2SO3、HF、HClO)以及弱碱(NH3?H2O)等。 2 离子反应规律(仅讨论非氧化还原反应的离子反应) 复分解反应发生的条件 对于复分解反应而言,有下列三种物质之一生成的反应就能进行完全:①更难溶物质;②更难电离的物质;③气态物质。简言之,复分解反应的方向总是朝着有利于某种离子浓度减少的一方进行。 沉淀的生成及转化 常见难溶物有:①酸:H2SiO3 ;②碱:Mg(OH)2 、Al(OH)3、Cu(OH)2、Fe(OH)3等;③盐:AgCl、 AgBr、AgI、BaCO3、BaSO4、Ca3(PO4)2等。 常见弱电解质有:①弱酸:HF、H2CO3、HClO、CH3COOH等;②弱碱:NH3?H2O;③其它:H2O、C6H5OH 等 (3) 气态物质生成 常见气态物有:SO2、CO2、NH3、H2S 等 3 离子方程式的书写 3.1.1 离子方程式书写方法步骤—“写拆删查“ 以次氯酸钠溶液中通入二氧化碳为例 第一步“写“ 2NaClO + CO2 + H2O = 2HClO + Na2CO3 第二步“拆“ 2Na+ + 2ClO- + CO2 + H2O = 2HClO + 2Na+ + CO32- 第三步“删“ 2ClO- + CO2 + H2O = 2HClO + CO32- 第四步“查“查原子个数、离子电荷是否配平 [说明] ①原则上说,电解质要不要拆分改写为离子形式,应以物质客观存在的形式为依据。若化合物主要以离子形式存在,则应“拆”为离子形式表示;若化合物主要以“分子”形式存在,则不能“拆”,而仍应以“分子”形式表示。如浓H2SO4应以分子式表示,稀H2SO4则应“拆”为离子式(2H+ 和SO42- )表示。
离子方程式练习题 一判断下列离子方程式是否正确。 1.下列离子方程式正确的是() A.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全: Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+ H2O B.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2 C.硫氢化钠水解HS-+H 2O H2S↑+OH- D.用石墨作电极电解AlCI3溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- 2. 下列离子方程式书写正确的是( ) A.次氯酸钙溶液中通入足量SO2:Ca2++C1O—+SO2+H2O=CaSO4+C1—+2H+ B.等体积、等浓度的硫酸铁溶液与氢氧化钡溶液混合 Fe3++SO42—+Ba2++3OH—=Fe(OH)3↓+BaSO4↓ C.醋酸铵溶于水:CH 3COO—+NH4++H2O CH3COOH+ NH3·H2O D.Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O 3. 下列反应的离子方程式错误的是() A.氯化铝溶液中加入过量的氨水:Al3+ + 4NH3?H2O == AlO2- + 4NH4+ + 2H2O B.用氨水吸收过量的二氧化硫NH3?H2O + SO2 == NH4+ + HSO3- C.向苯酚钠溶液中通入少量的二氧化碳C6H5O- + CO2+ H2O == C6H5OH+ CO32- D.次氯酸钙溶液中通入过量的二氧化碳ClO- + CO2 + H2O == HCO3- + HClO 4. 下列离子方程式错误的是() A. 等物质的量氨气通入到稀磷酸溶液中NH3+H3PO4=NH4++H2PO4- B. Ba(OH)2溶液与H2SO4溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+ 2H2O C FeCl3溶液中通入H2S气体:2Fe3++S2-=2Fe2++S↓ D. FeCl3溶液中加入过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ 5. 下了离子方程式不正确的是() A 硫酸铝溶液中加入过量氢氧化钠:Al3++4OH-=AlO2-+2H2O B. 把少量的氯气通入到FeI2的溶液中2I-+CI2=I2+2CI-. C. 氟气通入氯化钠溶液中:F2+2Cl-=2F-+Cl2 D 偏铝酸钠溶液中滴入过量盐酸:AlO2-+4H+=Al3++2H2O 6. 下列结合实验现象的反应方程式正确的是() A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1- C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2=2Na2CO3+O2 D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O 二:书写下列离子方程式: (1)Cl2通入NaOH溶液中:; (2)CuSO4溶液与K2S溶液混合:; (3)Al2O3与NaOH溶液:; (4)Fe3O4溶于硝酸:; (5)Na2SiO3溶液中通入过量的CO2:; (6)小苏打与醋酸反应:; (7)3mL0.4mol/L的Ba(OH)2溶液中滴入12mL0.2mol/L的H3PO4: ;
1-2 离子反应与离子共存习题 一、选择题:每小题只有一个选项正确. 1.下列反应的离子方程式不正确的是( ) A .向烧碱溶液中滴加少量氯化铝溶液O 2H AlO 4OH Al 223+=+--+ B .物质的量相等的溴化亚铁跟氯气反应-+-+++=++4Cl Br 2Fe 2Cl 2Br 2Fe 2322 C .硫化钾晶体溶于水O 2H S 22+-S H 2OH 2+- D .向碳酸钠溶液中滴加过量的稀硫酸O H CO 2H CO 2223+↑=++- 2.某无色透明的溶液,在pH =0和pH =14的条件下都能大量共存的是( ) A .+2Fe + K -24SO -3 NO B .+2Mg +4NH -24SO -Cl C .+Na + K -24SO -3 NO D .+2Ba +Na -4MnO -24SO 3.下列离子方程式书写正确的是( ) A .碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液 - --+++↓=++23 2332CO O 2H CaCO 2OH 2HCO Ca B .碳酸钠溶液中加入等物质的量的乙酸 --++↑=+COO 2CH O H CO COOH 2CH CO 322323 C .2)Ca(ClO 溶液中通入过量的二氧化硫气体2HClO CaS O S O O H 2ClO Ca 3222+↑=+++-+ D .用碳棒作电极电解氯化钠饱和溶液 4.下列离子反应方程式正确的是( ) A .小苏打溶液中加入过量石灰水 O 2H CO CaCO 2OH Ca 2HCO 223323++↓=++- -+- B .氯化铝溶液中加入过量氨水 +++↓=+?432333NH Al(OH)O H 3NH Al C .氯化亚铁溶液中通入氯气 -+++=+2Cl Fe Cl Fe 322 D .苛性钾溶液中加入稀醋酸 O H OH H 2=+-+ 5.下列反应的离子方程式书写正确的是( ) A .金属钠跟水反应: ↑+++-+22H 2OH Na O 2H Na B .向偏铝酸钠溶液中加入少量硫酸氢钠溶液 ↓=+++ -322)Al(OH O H H AlO C .澄清石灰水中滴入少量的NaHCO 3溶液O 2H CO CaCO 2HCO 2OH Ca 223332++↓=++---+ D .浓盐酸跟二氧化锰混合共热 ↑+++++-+22222Cl O 2H Mn Δ 4Cl 4H MnO 二、选择题:每小题有一个或二个选项符合题意. 6.下列各组离子,在所给条件下能够大量共存的是( ) A .pH =0的溶液中,+ 3Fe 、+2Mg 、-Cl 、- 24SO B .水电离出的1 8 L mol 101][H --+ ??=的溶液中,+ K 、- 3HCO 、- Cl 、- 2S C .使pH 试纸显深蓝色的溶液中,+ 2Cu 、+3Fe 、- 3NO 、- 24SO D .在3AlCl 溶液中+ Na 、-2AlO 、- 24SO 、- 3NO 7.下列离子方程式的书写正确的是( ) A .过量二氧化碳通入偏铝酸钠溶液中: - -+↓=++33222HCO Al(OH)AlO O 2H CO B .在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合 O 2H NH S O 2OH HS O NH 232334+↑+=++- --+ C .氯气通入冷的烧碱溶液中: O H ClO 3Cl 2OH 2Cl 22++=+- -- D .硫酸氢钠溶液中加入碳酸氢钠溶液:O H CO HCO H 223+↑=+-+
高中化学方程式 1、向氢氧化钠溶液中通入少量CO2: 2NaOH + CO2 ==== Na2CO3+ H2O 离子方程式:CO2+ 2OH- CO32-+ H2O 2、在标准状况下过量CO2通入NaOH溶液中:CO2+NaOH NaHCO3 离子方程式:CO2+ OH- HCO3- 3、烧碱溶液中通入过量二氧化硫: NaOH +SO2==NaHSO3 离子方程式:OH- +SO2 HSO3- 4、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2 离子方程式:CO2+ OH- HCO3- 5、氨水中通入少量二氧化碳: 2NH3?H2O+CO2== (NH4)2 CO3+ H2O 离子方程式:2NH3?H2O+CO2== 2NH4++2H2O 6、用碳酸钠溶液吸收少量二氧化硫: Na2CO3+ SO2 Na2SO3+ CO2↑ 离子方程式:CO32-+ SO2 SO32-+ CO2↑ 7、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3 离子方程式:CO32-+ CO2 +H2O══HCO3- 8、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:Pb(Ac)2+H2S=PbS↓+2HAc 离子方程式:Pb(Ac)2+H2S=PbS↓+2HAc 9、苯酚钠溶液中通入少量二氧化碳: CO2+H2O+C6H5ONa→C6H5OH+ NaHCO3 离子方程式:CO2+H2O+C6H5O-→C6H5OH+ HCO3- 10、氯化铁溶液中通入碘化氢气体: 2FeCl3+2 HI 2Fe Cl2+ I2+2 H Cl 离子方程式:2Fe3++2 H++2I- 2Fe 2++ I2+2 H+ 11、硫酸铁的酸性溶液中通入足量硫化氢:Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4离子方程式:2Fe3++ H2S== 2Fe 2++ S↓+2 H+ 12、少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2SO4+ 2HCl+H2SO4离子方程式:2ClO- +2SO2+ 2H2O══SO42-+ 2Cl-+2 H++SO42-13、氯气通入水中:Cl2+H2O HCl+HclO 离子方程式:Cl2+H2O H++Cl-+HClO 14、氟气通入水中:2F2+2H2O 4HF+O2↑ 离子方程式:2F2+2H2O 4HF+O2↑
离子共存练习题 班级姓名学号1.下列物质中,属于强电解质的是 A.NaOH B.CH3COOH C.H2O D.CO2 2.下列各组离子在水溶液中能大量共存的是 A、Ca2+、Mg2+、Cl-、NO3- B、Al3+、K+、SO42-、OH- C、Fe2+、Na+、SO42-、S2- D、Na+、H+、CO32-、SO42- 3.下列各组离子在强碱性溶液中可以大量共存的是 A、Ca2+、K+、CO32-、Cl- B、Na+、K+、Al02-、CO32- C、Na+、Mg2+、NO3-、SO42- D、Na+、Al3+、NO3-、Cl- 4.在强酸性溶液中,可以大量共存的离子组是 A.Na+、K+、CH3COO—、Cl—B.Ba2+、Na+、CO32—、NO3— C.Na+、Ag+、SO42—、Cl—D.Al3+、Fe3+、NO3—、SO42— 5.在PH=2的溶液中,可以大量共存的离子组是 A.Na+、NH4+、S2—、Cl—B.Ca2+、Na+、HCO3—、NO3— C.Al3+、Fe3+、SCN—、Cl-D.Cu2+、Fe2+、SO42—、Br— 6.下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是 A.Na+、H+、CO32-、Cl-B.H+、Fe2+、Cl-、NO3- C.Na+、Al3+、OH-、Cl-D.NH4+、H+、OH-、NO3- 7.属于无色透明,且在水溶液中能大量共存的一组离子是 A. Al3+、Mg2+、SO42—、Cl- B. Fe3+、Cu2+、SCN-、SO42- C.Na+、H+C6H5O-、MnO4-、D.Fe3+、Al3+、AlO2-、NO3- 8.常温下在C(H+)=1×10-13mol/L的溶液中能大量存在的离子是 A.CO32-B.HCO3-C.Al3+D.NH4+ 9.下列各组离于在溶液中既可以大量共存,且加入氨水后也不产生沉淀的是 A. Na+、Ba2+、Cl-、SO42- B .K+、AlO2-、NO3-、OH- C. H+、NH4+、Al3+、SO42- D. H+ 、Na+、Cl-、F- 10.下列离子方程式中,能正确反映CH3COOH与NaOH反应的是 A、CH 3COOH+NaOH CH3COONa+H2O B、H+ + OH- = H2O C、C H3COOH + OH- == CH3COO- + H2O D、CH3COO-+H++OH-== CH3COO-+H2O 11.下列离子方程式正确的是 A.澄清的石灰水与稀盐酸反应Ca(OH)2 + 2H+ === Ca2+ + 2H2O B.钠与水的反应Na + 2H2O === Na+ +2OH-+ H2↑ C.铜片插入硝酸银溶液中Cu + Ag+ === Cu2+ + Ag D.大理石溶于醋酸的反应CaCO3 + 2CH3COOH === Ca2+ + 2CH3COO- +CO2↑+ H2O 12.能正确表达下列离子反应方程式的是
第二节离子反应 Ⅰ.学习重点: 1.掌握电解质(强电解质和弱电解质)的含义 2.掌握离子反应和离子方程式的含义 3. 掌握离子反应发生的条件和离子方程式的书写方法 Ⅱ.学习难点: 离子方程式的书写方法 Ⅲ.书写离子方程式易出现的错误分析 强弱电解质不分,易溶与难溶不分 例1.氢氧化铁与盐酸反应OH-+H+=H2O (错) 应为:Fe(OH)3+3H+=Fe3++3H2O (正确) 例2.石灰石与盐酸反应CO32-+2H+=CO2↑+H2O (错) 应为:CaCO3+2H+=Ca2++CO2↑+H2O (正确) 例3.纯碱与醋酸反应CO32-+2H+=CO2↑+H2O (错) 应为:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O(正确)2.没有注意反应事实 例1.铁和稀硫酸反应2Fe+6H+=2Fe3++3H2↑(错) 应为:Fe+2H+=Fe2++H2↑(正确)
3.没有遵守质量守恒和电荷守恒 例1.金属钠和水反应Na+2H2O=Na2OH+H2↑(错) 应为:2Na+2H2O=2Na++2OH-+H2↑(正确) 例2.铁粉放入硫酸铁溶液中Fe+Fe3+=2Fe2+(错) 应为:Fe+2Fe3+=3Fe2+(正确) 4.系数化简时的错误 例:硫酸与氢氧化钡溶液的反应H++SO42-+OH-+Ba2+=BaSO4↓+H2O (错) 应为:2H++SO42-+2OH-+Ba2+=BaSO4↓+H2O (正确) 5.漏写离子 将上一题写成Ba2++SO42-=BaSO4↓(错) 6.没有参加反应的离子没有删除 例:氯化钠和硝酸银溶液反应Na++Cl-+Ag++NO3-=AgCl ↓+Na++NO3-(错) 应为:Cl+Ag+=AgCl↓ 7.不是溶液中的反应写出了离子方程式 例:氯化钠固体和浓硫酸加强热制氯化氨H++Cl-强热 HCl↑(错) 该反应没有离子方程式
高中最新最全的离子反应方程式大全 A开头Al 2Al + 6H+ == 2Al3+ + 3H2↑ 2Al + 2OH- + 2H2O == 2AlO2- + 3H2↑ Al3+ + 3H2O Al(OH)3 + 3H+Al3+ + 3OH- == Al(OH)3↓ Al3+ + 4OH- == AlO2- + 2H2O 3Al3+ + 10OH-== 2Al(OH)3↓ + AlO2- + 2H2O(当n(AlCl3)/n(NaOH)= 3 :10时) Al3+ + 3NH3.H2O == Al(OH)3↓+ 3NH4+2Al3+ + 3CO32- + 3H2O == 2Al(OH)3↓ + 3CO2↑ Al3+ + 3HCO3- == Al(OH)3↓ + 3CO2↑ Al3+ + 3HS- + 3H2O == Al(OH)3↓ + 3H2S↑ 2Al3+ + 3S2- + 6H2O == 2Al(OH)3↓ + 3H2S↑ Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓ 2Al3+ + 3SiO32-== Al2(SiO3)2↓ AlO 2- + 2H2O Al(OH)3 + OH-AlO2- + H+ + H2O == Al(OH)3↓ AlO2- + 4H+ == Al3+ + 2H2O 9AlO2- + 30H+== 2Al(OH)3↓ + 7Al3+ + 12H2O(当n(NaAlO2)/n(HCl)= 3 :10时) 3AlO2- + Fe3+ + 6H2O == Fe(OH)3↓+ 3Al(OH)3↓ AlO2- + NH4+ +H2O == Al(OH)3↓ + NH3↑ AlO2- + HCO3- + H2O == Al(OH)3↓+ CO32- 2AlO2- + CO2 + 3H2O ==2 Al(OH)3↓+ CO32-AlO2- + CO2 + 2H2O == Al(OH)3↓+ HCO3- Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3 + 2OH- == 2AlO2- + H2O Al(OH)3 + 3H+ == Al3+ + 2H2O Al(OH)3 + 2OH- == AlO2- + 2H2O Ag Ag+ + H2O AgOH + H+Ag+ + NH3.H2O == AgOH↓+ NH4+; Ag+ + 2NH3.H2O == [Ag(NH3)2]++ H2O Ag+ + Cl-== AgCl↓ Ag+ + Br-== AgBr↓ Ag+ + I-== AgI↓
下列反应是离子反应的写出离子方程式, 如不是离子反应写出化学方程式 1、氯化钠溶液滴加硝酸银溶液 2、钠与水反应 3、钠与硫酸铜溶液 4、过氧化钠与水反应 5、碳酸氢盐溶液与强酸溶液混合 6、碳酸氢盐溶液与醋酸溶液混合 7、氢氧化钙溶液与碳酸氢镁反应 8、向碳酸氢钙溶液中加入过量的氢氧化钠 9、向碳酸氢钙溶液中加入少量的氢氧化钠 10、澄清石灰水与少量小苏打溶液混合 11、澄清石灰水通入少量CO2 12、澄清石灰水通入过量CO2 13、碳酸氢钠溶液与少量石灰水反应 14、碳酸氢钠溶液与过量石灰水反应 15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合 16、碳酸钠溶液与盐酸反应 17、向氢氧化钠溶液中通入少量的CO2 18、过量的CO2通入氢氧化钠溶液中 19、碳酸氢铵溶液中加入过量氢氧化钠溶液
20、碳酸钙与盐酸反应 21、碳酸钙与醋酸反应 22、澄清石灰水与稀盐酸反应 23、磷酸溶液与少量澄清石灰水 24、磷酸溶液与过量澄清石灰水 25、碳酸镁溶于强酸 26、硫酸镁溶液跟氢氧化钡溶液反应 27、硫酸溶液跟氢氧化钡溶液反应 28、硫酸氢钠溶液与氢氧化钡反应至中性 29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀 30、硫酸铝溶液中加入过量氢氧化钡溶液 31、氢氧化镁与稀硫酸反应 32、铝跟氢氧化钠溶液反应 33、物质的量之比为1:1NaAl合金置于水中 34、氧化铝溶于强碱溶液 35、氧化铝溶于强酸溶液 36、氢氧化铝与氢氧化钠溶液 37、氢氧化铝与盐酸溶液反应 38、硫酸铝溶液与碳酸氢钠溶液 39、硫酸铝溶液与碳酸钠溶液
40、氯化铝溶液中加入过量氨水 41、明矾溶液加热水解生成沉淀 42、氯化铝溶液与偏铝酸钠溶液 43、偏铝酸钠溶液中加入氯化铁溶液 44、偏铝酸钠溶液中加入少量盐酸 45、偏铝酸钠溶液中加入过量盐酸 46、偏铝酸钠溶液中加入氯化铵溶液 47、金属铁溶于盐酸中 48、铁粉与氯化铁溶液反应 49、铜与氯化铁溶液反应 50、硫化亚铁与盐酸反应 51、硫化钠与盐酸反应 52、硫化钠溶液中加入溴水 53、氯化亚铁溶液中通入氯气 54、向硫酸铁的酸性溶液中通入足量的H2S 55、氯化铁溶液中滴加少量硫化钠溶液 56、硫化钠溶液中滴加少量氯化铁溶液 57、氯化铁溶液中滴加少量碘化钾溶液 58、氯化铁溶液与氢氧化钠溶液反应 59、氯化铁溶液跟过量氨水反应 60、氯化铁溶液与硫氰化钾溶液
化学高中化学离子反应练习题一、高中化学离子反应 1.下列各反应对应的离子方程式正确的是() 2溶液中加入少量的32+-3- 332-2O A.向 Ca(OH)NaHCO 溶液: Ca +2OH +2HCO =CaCO↓ +CO +2H -1的 Ba(OH) 溶液中通入2+-- B.向 100mL0.12mol L·20.02molCO2: Ba +3OH +2CO2=HCO3 +BaCO3↓ +H2O C.硫酸氢钠与氢氧化钡溶液反应后+42-2+-42 pH 恰好为 7:H +SO+Ba +OH =BaSO↓+H O 23-1稀盐酸: OH-32- D.向含 0.1molNaOH 和 0.1molNa CO 的溶液中加入 1L0.4mol L·+CO +22 +3H =CO ↑ +2H O 【答案】 D 【解析】 【分析】 【详解】 A.根据定少为一的原则,将NaHCO3的系数定为1,则向 Ca(OH)2溶液中加入少量的NaHCO3溶液,离子反应方程式应为:Ca2++OH-+HCO3-=CaCO3↓ +H2 O, A 选项错误; B.先算出 Ba(OH)2的物质的量为 0.012mol ,而 CO2的物质的量为0.02mol ,二者的物质的量为 3:5,按照 3:5的化学计量比来写方程式:3Ba2+-23-32 +6OH +5CO =4HCO+BaCO↓+H O, B 选项错误; C.硫酸氢钠与氢氧化钡溶液反应后pH 恰好为 7,因此二者按2:1 的系数来反应: +42-2+-42 2H +SO+Ba +OH =BaSO↓+2H O,C 选项错误; D.首先三者的物质的量之比为1:1:4 ,稀盐酸先和烧碱中和,过量的稀盐酸再和纯碱反 应,据此离子反应方程式为:OH-32-+22 +CO+3H =CO ↑+2H O, D 选项正确; 答案选 D。 【点睛】 本题考查了离子方程式的书写,侧重考查反应物用量不同发生反应不同的离子反应,题目 难度较大,注意反应的顺序,尤其是某一种反应物过量时的后续反应。 2.下列实验与对应示意图的关系正确的是() A.向 NaAlO2溶液中逐滴滴加盐酸至过量 B.向 AlCl3溶液中逐滴滴加氨水至过量
初中常见离子符号、化学式和化学方程式(初二部分) 常见的离子符号 常见的金属离子: 1、带一个单位正电荷的 锂离子:Li+钾离子:K+钠离子:Na+银离子:Ag+ 亚铜离子:Cu+ 2、带两个单位正电荷的 钙离子:Ca2+镁离子:Mg2+钡离子:Ba2+ 锌离子:Zn2+亚铁离子:Fe2+铜离子:Cu2+ 3、带三个单位正电荷的 铁离子:Fe3+ 铝离子:Al3+ 常见的非金属离子: 1、带一个单位负电荷的 氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I— 2、带两个单位负电荷的 硫离子:S2—氧离子O2— 3、带一个单位正电荷的 氢离子:H+ 常见的原子团:(也叫酸根离子,NH4+除外) 硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子ClO3— 磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4— 碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32— 锰酸根离子:MnO42— 铵根离子:NH4+ 说明: 带正电荷的叫阳离子(如金属离子)带负电荷的叫阴离子(如常见的非金属离子和常见的原子团。H+和NH4+除外。) 1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。 2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。例如,硫离子S2—中S的化合价为—2 3、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是 +的整体化合价是+1,这其组成元素所表现化合价的代数和。例如,铵根离子NH 4 是由于其中N显—3价,H显+1价决定的。 常用化合价口诀: 一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。 负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
离子方程式练习 姓名:___________班级:___________成绩:___________ 一、单选题 1.下列指定反应的离子方程式正确的是 A. 电解熔融NaCl:2Cl-+2H2O 2OH-+Cl2↑+H2↑ B. 用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O C. Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2 D. 金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ 2.下列反应的离子方程式表示正确的是 A. 用足量的氨水处理工业制硫酸的尾气:SO2+2NH3?H2O=2NH4++SO32-+H2O B. 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ C. 漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO D. NH4HCO3溶液中加足量的Ba(OH)2溶液:NH4++ HCO3-+2OH-===CO32-+ NH3?H2O +H2O 3.下列化学反应的离子方程式正确的是( ) A. 用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑ B. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO C. 在稀氨水中通入过量CO2:NH3·H2O+CO2===NH4++HCO3- D. 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-===CaSO4↓+H2O 4.下列离子方程式书写正确的是 A. 碘化亚铁中通入过量氯气:2Fe2++ 2I-+ 2Cl2= 2Fe3++ I2+ 4Cl- B. 碳酸钠溶液中通入过量氯气:CO32-+Cl2 = CO2↑+Cl-+ClO- C. NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2+ +OH-=BaSO4↓+H2O D. 金属钠投入硫酸镁溶液中:2Na + 2H2O + Mg2+ = 2Na+ + H2↑ + Mg(OH)2↓ 5.下列反应的离了方程式正确的是 A. 碳酸钙与盐酸的反应:CO32-+2H+=CO2↑+H2O B. 硫酸溶液与氢氧化钡溶液的反应: H++OH-=H2O C. 硝酸银与氯化钠溶液的反应:AgNO3+Cl-=AgCl↓+NO3- D. 铝与硫酸铜溶液的反应:2Al+3Cu2+=2A13++3Cu 6.下列表示对应化学反应的离子方程式正确的是
化学必修1离子反应习题 一选择题 1、下列电离方程式错误的是() A NaHCO3 ====Na++H++CO32― B NaHSO4 ====Na++H++SO42― C MgCl2 ====Mg2++2Cl― D B a(O H)2 =====Ba2++2OH― 2、离子方程式CO32-+ 2H+ = H2O + CO2↑中的CO32-代表的物质可以是() A、CaCO3 B、NaHCO3 C、Na2CO3 D、BaCO3 3、下列化学方程式中,不能用离子方程式Ba2++SO42―====BaSO4↓ A.Ba(NO3)2+H2SO4==BaSO4↓+2HNO3 B.BaCl2+Na2SO4==BaSO4↓+2NaCl C.BaCO3+H2SO4==BaSO4↓+H2O+CO2↑ D.BaCl2+H2SO4==BaSO4↓+2HCl 4.下列各组离子反应可用H++OH-H2O表示的是() A.氢氧化钡和硫酸B.氢氧化铁和盐酸C.硝酸和氢氧化钠D.硫酸氢钠和氢氧化钠 5、下列离子方程式,书写正确的是() A、盐酸与碳酸钡反应CO32-+2H+==CO2↑+H2O B、硫酸铜溶液中滴加氢氧化钡溶液Ba2++2OH-+Cu2++SO42-==BaSO4↓+Cu(OH)2↓ C、硝酸银溶液中加入铜粉Ag++Cu==Cu2++Ag↓ D、铁与稀盐酸反应2Fe+6H+==2Fe3++3H2↑ 6、下列离子方程式书写正确的是() A、氧化铜与盐酸反应O2―+2H+====H2O B、碳酸氢钠溶于盐酸:HCO3-+ H+ = H2O + CO2↑ C、硫酸氢钠溶液与NaOH溶液混合:HSO4-+ OH-= H2O + SO42- D、石灰石溶于硝酸:CO32-+ 2H+ = H2O + CO2↑ 7.下列反应的离子方程式中,正确的是() A.向硝酸银溶液中加盐酸Ag++C1-AgCl↓ B.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+Ca2++2H2O+2CO2↑ C.盐酸跟氢氧化镁反应:H++OH-H2O D.碳酸镁跟硫酸反应:MgCO3+2H+Mg2++H2O+CO2↑ 8.下列离子方程式中,正确的 是 A.碳酸氢钙溶液与盐酸反应Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ B稀盐酸和碳酸钙反应 CO32- + 2H+ = CO2↑ + H2O C碳酸钠溶液与醋酸反应CO32-+ 2H+ = CO2↑+ H2O D大理石溶于醋酸的反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O 9.下列反应的离子方程式中,正确的是() A、氢氧化钡溶液和稀硫酸Ba2++OH-+H++SO42-=BaSO4↓+2H2O B、氯化铁溶液中加铁粉2Fe3+ + Fe = 3Fe2+ C、过量CO2通入NaOH溶液中CO2 + 2OH-= CO32-+ H2O D、少量CO2通入NaOH溶液中CO2 + OH-= HCO3-+ H2O 10.下列离子方程式中,正确的是 A、氨气通入醋酸CH3COOH + NH3 = CH3COO-+NH4+ B.碳酸氢镁溶液中加过量石灰水Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓C、澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O D、稀硫酸滴在铜片上:Cu+2H+==Cu2++H2↑ 11.下列各组中的离子,能在溶液中大量共存的是()
高中化学常见离子方程式 1、硝酸银与盐酸及可溶性盐酸盐溶液:Ag ++Cl -=AgCl ↓ 2、钠与水反应:2Na+2H 2O=2Na ++2OH –+H 2↑ 3、钠与硫酸铜溶液:2Na+2H 2O+Cu 2+=2Na ++Cu(OH)2↓+H 2↑ 4、过氧化钠与水反应:2Na 2O+2H 2O=4Na ++4OH –+O 2↑ 5、碳酸氢盐溶液与强酸溶液混合:HCO 3-+H +=CO 2↑+H 2O 6、碳酸氢盐溶液与醋酸溶液混合:HCO 3-+CH 3COOH=CO 2↑+H 2O+CH 3COO - 7、氢氧化钙溶液与碳酸氢镁反应: Ca 2++2OH -+2HCO 3-+Mg 2+=Mg(OH)2↓+CaCO 3↓ 8、向碳酸氢钙溶液中加入过量的氢氧化钠: 2HCO 3-+Ca 2++2OH –=CaCO 3↓+2H 2O+CO 32– 9、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca 2++HCO 3-+OH – =CaCO 3↓+H 2O 10、澄清石灰水与少量小苏打溶液混合:Ca 2++OH –+HCO 3-=CaCO 3↓+H 2O 11、澄清石灰水通入少量CO 2:Ca 2++2OH –+CO 3=CaCO 3↓+H 2O 12、澄清石灰水通入过量CO 2:OH –+CO 2=HCO 3- 13、酸氢钠溶液与少量石灰水反应:Ca 2++2OH –+2HCO 3-=CaCO 3↓+CO 32– +2H 2O 14、碳酸氢钠溶液与过量石灰水反应:HCO 3-+OH –+Ca 2+=CaCO 3↓+H 2O 15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合: Ba 2++2OH –+NH 4++HCO 3-=BaCO 3↓+H 2O+NH 3?H 2O 16、碳酸钠溶液与盐酸反应:CO 32–+H +=HCO 3- 或CO 32–+2H +=CO 2↑+H 2O 17、向氢氧化钠溶液中通入少量的CO 2:CO 2+2OH –=CO 32–+H 2O 18、过量的CO 2通入氢氧化钠溶液中:CO 2+OH –=HCO 3- 19、碳酸氢铵溶液中加入过量氢氧化钠溶液: NH 4++HCO 3-+2OH –=NH 3↑+CO 32–+2H 2O 20、碳酸钙与盐酸反应:CaCO 3+2H +=Ca 2++CO 2↑+H 2O 21、碳酸钙与醋酸反应:CaCO 3+2CH 3COOH=Ca 2++2CH 3COO -+CO 2↑+H 2O 22、澄清石灰水与稀盐酸反应:H ++OH –=H2O 23、磷酸溶液与少量澄清石灰水:H 3PO 4+OH –=H 2O+H2PO4– 24、磷酸溶液与过量澄清石灰水:2H 3PO 4+3Ca 2++6OH –=Ca 3(PO 4)2↓+6H 2O 25、碳酸镁溶于强酸:MgCO 3+2H +=Mg 2++CO 2↑+H 2O 26、硫酸镁溶液跟氢氧化钡溶液反应: Ba 2++2OH –+Mg 2++SO 42–=BaSO 4↓+Mg(OH)2↓ 27、硫酸溶液跟氢氧化钡溶液反应:Ba 2++2OH –+2H ++SO 42–=BaSO 4↓+2H 2O 28、硫酸氢钠溶液与氢氧化钡反应至中性:2H ++SO 42–+2OH –+Ba 2+=2H 2O+BaSO 4↓ 29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀: H ++SO 42–+OH –+Ba 2+=BaSO 4↓+H 2O 30、硫酸铝溶液中加入过量氢氧化钡溶液: 2Al 3++3SO 42–+8OH –+3Ba 2+=3BaSO 4↓+2AlO 2–+4H 2O 31、氢氧化镁与稀硫酸反应:Mg(OH)2+2H +=Mg 2++2H 2O 32、铝跟氢氧化钠溶液反应:2Al+2OH –+2H 2O=2AlO 2–+3H 2↑ 33、物质的量之比为1:1NaAl 合金置于水中:Na+Al+2H 2O=Na ++AlO 2–+2H 2↑ 34、氧化铝溶于强碱溶液:Al 2O 3+2OH –=2AlO 2–+H 2O 35、氧化铝溶于强酸溶液:Al 2O 3+6H +=2Al 3++3H 2O