
放射性核素在分析化学方面的应用
摘要:目前已发现的放射性核素有近2000种,其来源大致有:天然存在、反应堆生产、从辐照过的核燃料中提取、加速器生产、其他来源。放射性核素在医学、农学、生物学、化学等诸多领域都有广泛应用,本文主要介绍放射性核素在分析化学领域的应用。
1.放射分析方法的分类
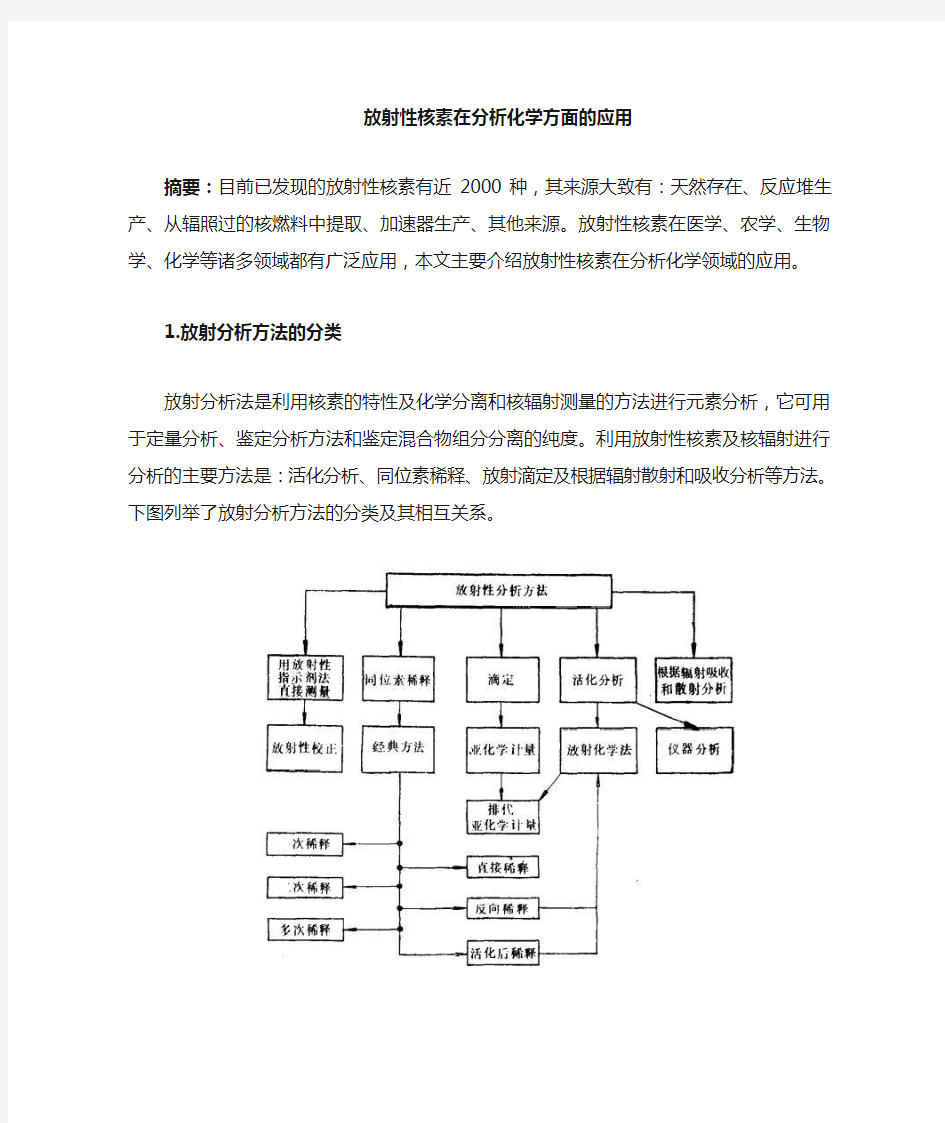
放射分析法是利用核素的特性及化学分离和核辐射测量的方法进行元素分析,它可用于定量分析、鉴定分析方法和鉴定混合物组分分离的纯度。利用放射性核素及核辐射进行分析的主要方法是:活化分析、同位素稀释、放射滴定及根据辐射散射和吸收分析等方法。下图列举了放射分析方法的分类及其相互关系。
由于讲义中对同位素稀释法已经有了详尽的讲解,因此本文将不再作介绍。另外,限于篇幅原因对于根据辐射散射和吸收分析也不再介绍。
2.用放射性指示剂直接测量
埃林别尔格建立了用放射性试剂直接测定化学元素的方法,并用来分析沿的天然放射性同位素。该法是基于待测元素的离子能与放射性试剂选择性地生成易与其余化合物分离的物质,如生成沉淀或气体,或生成能用萃取法、色谱法分离的物质。我们以用放射性试剂沉淀待测元素为例。试剂的比放射性应是已知的。可用两种方法进行测定。第一种方法是向溶液小加入过量的沉淀剂(试剂)后,分离沉淀并测定其放射性J1(脉冲数/分)。待测元素量m x(克当量)按下式计算
式中:S m一质量比放射性[脉冲数/(分·克当量)]。
第二种方法是用过量的放射性试剂从待分析的溶液进行沉淀,放射性试刑的体积和待分析溶液体积分别为v1和v2(毫升)。沉淀后测定1毫升滤液的放射性J2,待测元素的量按下式计算
式中:S v——放射性试剂单位体积的放射性[脉冲数/(分·毫升)],m a和m b——试剂在沉淀前所取量和沉淀后剩余量(克当量)。
3.放射滴定
放射滴定和用放射性试剂直接测定化学元素的第二种方法相似。该法是基于待测离子与试剂(滴定液)生成微溶的或易被萃取的化合物。根据加入试剂后溶液的放射性变化作为指
示剂。试剂、待测离子或两种物质都用放射性同位素标记。下面以AgNO3--NaCl和
AgNO3--NaBr体系为例对该法进行说明,以110Ag、82Br为指示剂。滴定曲线如图所示:
通式: AB+CD=AD↓+BC
滴定曲线的形状取决于放射性指示剂是滴定剂还是滴定溶液。
(1)如果被滴定的物质A*B具有放射性,而滴定剂C D是非放射性的,且生成沉淀A*D,则在等当点后所测溶液的放射性变为恒定,仅取决于沉淀的溶解度。(见图中曲线1)先测原始溶液的放射性活度为A0,然后加入B1毫升非放射性滴定剂,沉淀后测得溶液的放
射性活度为A1,达等当点所需试剂的量为C0,根据三角形A0C0’A1及a1A1A 0相似的比例关系,可求得
所以,已知A0,A1及B1可求得C0,进而可求得未知液的浓度。
(2)若被滴定物A B是非放射性的,滴定剂CD*具有放射性,则等当点前溶液的放射性是恒定的,不很大,仅取决于化合物AD*的溶解度。在等当点之后,溶液的放射性随滴定剂的继续加入而增加,曲线形状如下图
此时,可假设先加入了过量的滴定剂B2毫升,测得溶液一的放射性活度为A2,然后再加入滴定剂,使总量等于B3,而溶液的放射性活度为A3,根据相似三角形a3C1’B3’与a2C1’B2’,并假设达等当点所需滴定剂的量为C1,则有:
由此可解得:
(3)如果A*B和CD鲁这两种物质都具有放射性,则在等当点之前,溶液的放射性首先逐渐减少,而在等当点之后又逐渐增加。等当点滴定剂所用量可采用(1)或(2)的方法求得。
4.活化分析
活化分析法是把原来没有放射性或其放射性不易被测量的样品经过特定粒子的照射,使样品中被测核素发生核反应,并变成具有特征放射性的产物,然后对其放射性进行鉴定和测量。最初,这种方法主要用来测定半导体材料等高纯物质中的微量和超微量元素。现在在医学、地球化学、地质化学、宇宙化学、环境化学等方面都有广泛的应用。随着小型反应堆、加速器、中子发生器等专用设备的发展,活化分析法也将得到迅速发展。
活化分析主要分两步进行:
(1)活化将稳定核素或某些不适宜于直接进行射线测量的放射性核素的样品,经中子或质子、氘核、口粒子、γ光子等照射而发生核反应,使样品核素转化为适宜于射线测量的放射性核素。
(2)分析通过测量活化后放射性核素的射线能量(或半衰期)、放射性活度来进行定性、定
量分析。活化后,样品可直接用仪器进行测定的称为非破坏性活化分析,也叫做仪器活化分析;样品须用化学分离方法分离再配合仪器进行测量的则称为破坏性活化分析,也叫做放射化学活化分析。
根据诱发核反应的辐射,可以把活化分析分为三种类型:(1)中子活化分析(NAA);(2) 带电粒子活化分析(CPAA);(3)光子活化分析(PAA)。其中以中子活化分析应用的最早、最多活化分析基于核反应中产生的放射性核,其放射性活度由下式给出
A t=?σN(1-e-0.693t/T1/2)
上式的物理意义为,在粒子流中活化某种靶核时,在t时刻得到的生成核素的放射性活度与粒子注量率,?核反应截面σ和靶核数目N成正比,与照射时间t成指数关系。在活化分析中,一般照射后并不立即进行放射性测量,而是让放射性样品“冷却”(即衰变)一段时间,于是,在照射结束后t’时刻的放射性活度A’t为
靶核数目N=6.02×1023θW/M,θ为靶核的天然丰度,W为靶元素的质量,M为靶元素的相对原子质量,6.02×1023为阿伏伽德罗常数,将N值代入上式得
上式就是活化分析中最基本的活化方程式。
4.1中子活化分析
中子活化分析使用的中子活化源有三种:反应堆中子源、加速器中子源、同位素中子源。反应堆中子源的优点是,热中子通量高,对多数元素活化截面大,反应道单纯,中子通量的空间均匀性和时间恒定性好,探测极限较低,选择性较好,精密度和准确度高,适用的物质种类广,样品量范围较宽,同时具有非破坏性多元素同时分析能力,故反应堆中子活化分析(ReNAA)一直是活化分析的主流。
中子活化分析主要包括热中子活化分析、超热中子活化分析、快中子活化分析、放射化学中子活化分析、瞬发γ中子活化分析,另外近年来将传统的活化分析方法与物理、化学或生物分离技术相结合,还发展起了分子—中子活化分析,并在微量元素与蛋白、多糖和核酸等生物大分子的结合和作用以及各种环境体系中微量元素化学种态等方面取得了许多令人瞩目的成果。
4.2带电粒子活化分析
带电粒子活化分析(CPAA)是选择适当的带电粒子照射待分析的样品,使其中一个活几个稳定核素产生核反应,生成放射性核素,测量放射性核素的性质和活度,可以对样品中的元素进行定性、定量分析。
带电粒子要与靶核碰撞发生核反应,必须克服核的库仑势垒,为此必须用加速器等设备加速带电粒子。对带一个单位电荷的入射粒子(如质子),除与极轻的核起反应只需约100 keV 左右的能量之外,一般均需具有几兆电子伏的能量。对于Z为92的铀核,则入射质子能量需高达15 MeV才能发生核反应。
4.3光子活化分析
光子活化分析(PAA)基于由高能γ光子轰击靶核而引起的光核反应,发生的情况随γ光子的能量和靶核的原子序数而变。光子能量在15~20 MeV时,主要是(γ,n)反应。其他可利用的反应包括(γ,p)、(γ,2n)和(γ,α)。用于PAA的光子源通常都来自电子加速器产生的韧致辐射。
活化分析法的优点很多,它的灵敏度高,适用于周期表中几乎所有的元素,对其中大部
分元素的探测极限可达10-9克左右;可同时测定一个样品中的几种到几十种元素;采用非破坏性分析,样品经分析后仍保持原样;可避免试剂引起的沾污;可鉴别一种元素的同位素;方法快速、简便,且可实行自动化分析等。但它也存在某些缺点,如通常只能测定核素的量而不能测定化合物的量;辐照源设备昂贵,不易普及等。
参考文献:
[1] 张寿华,张亦忠. 放射化学. 北京:原子能出版社. 1983. 344~346
[2] (匈)福尔迪阿克. 放射性同位素的工业应用. 北京市:原子能出版社1992.187~196.
225~230
[3] 罗文宗. 放射化学分析. 分析化学丛书1988. 09. 第六、八、十一章
[4] (苏)涅斯米杨诺夫. 放射化学. 北京:原子能出版社. 1985. 335~342
[5] 谢式南. 放射化学基础. 青岛:青岛海洋大学出版社. 1990. 133~135
[6] 张志勇,柴之芳. 分子活化分析. 核技术. 2003.26(10).736~740
[7] 王祥云,刘元方. 核化学与放射化学. 北京市:北京大学出版社. 2007. 340~345
[8] 李梅,牟婉君. 反应堆中子活化分析应用进展. 分析仪器. 2009.4. 5~7
[9] 侯小林. 活化分析分析实验室. 1997.16(1)101~107
[10]张天梅. 新核素研究中的放射化学分析方法及其意义. 化学通报1997年第1期
基础化学实验I (下) 基本知识问答 1指出下列情况中各会引起什么误差?如果是系统误差应采取什么方法避免? 答:(1)砝码被腐蚀:系统误差中的仪器误差,通过校正仪器消除。 (2) 在重量分析中被测组分沉淀不完全:系统误差中的方法误差,通过对比试验消除。 (3) 天平两臂不等长:系统误差中的仪器误差,通过校正仪器消除。 (4) 容量瓶和移液管不配套:系统误差中的仪器误差,通过校正仪器消除。 (5) 试剂中含有微量被测组分:系统误差中的试剂误差,通过做空白试验消除。 (6) 读取滴定管读数时最后一位数字估测不准:偶然误差。 (7) 某人对终点颜色的观察偏深或偏浅:系统误差中的主观误差,通过严格训练,提高操作水平。 (8) 天平的零点稍有变动:偶然误差。 (9) 移液管移液后管尖残留量稍有不同:偶然误差。 (10) 灼烧SiO2沉淀时温度不到1000C :系统误差中的方法误差,通过对比试验消除。2系统误差产生的原因有哪些,如何消除测定过程中的系统误差? 答:系统误差产生的原因有方法误差、试剂误差、仪器误差和主观误差。方法误差可 通过对比试验进行消除;试剂误差可通过空白试验进行消除;仪器误差可以通过校正仪器来消除;通过严格的训练,提高操作水平予以避免。 3准确度和精密度有何区别?如何理解二者的关系?怎样衡量准确度与精密度? 答:精密度表示分析结果的再现性,而准确度则表示分析结果的可靠性。精密度高不一 定准确度高,而准确度高,必然需要精密度也高。精密度是保证准确度的先决条件,精密度 低,说明测定结果不可靠,也就失去了衡量准确度的前提。准确度的高低用误差来衡量;精密度的高低用偏差来衡量。 4某分析天平的称量误差为土0.2mg,如果称取试样的质量为0.0500g,相对误差是多少?如果称量 1.000g时,相对误差又是多少?这些数值说明什么问题? 答:称取试样的质量为0.0500g,相对误差为: E 0.0002 100% 0.4% 0.0500 称取试样的质量为1.000g,相对误差为: E 0.0002 100% 0.02% 1.000 这些数值说明对同一仪器来说,所称质量越大,相对误差越小,准确度越高。 5滴定管的读数误差为土0.02mL ,如果滴定用去标准滴定溶液 2.50mL ,读数的相对误差是多少?如果滴定时用去25.00mL ,相对误差又是多少?相对误差的不同说明什么问题? 0.02 答:滴定用去标准滴定溶液2.50mL,相对误差为:E1 100% °8% 2.50 0.02 滴定用去标准滴定溶液25.00mL ,相对误差为:E2 亦亦100% °.08%这说明使用滴定管时,滴定所用体积越大,相对误差越小,准确度越高。 6 化验室常用的普通试剂和指示剂溶液通常采用何种浓度表示方式?如何配制? 答:普通试剂和指示剂溶液常采用质量浓度表示。有的指示剂用量较少,可以质量浓度的分倍数表示。由于它们对浓度的准确度要求不高,所以配制十分方便,称取一定量的物质,放入烧杯中以适量溶剂溶
核化学和放射化学 20世纪上半叶,从发现放射性元素、核裂变、人工放射性,到核反应堆的建立,核爆炸的毁灭性破坏等,核化学和放射化学一直是十分活跃和开创性的前沿领域。但到了后半个世纪,由于核电站和核武器发展的需要,核化学和放射化学转向以生产和处理核燃中心,自身的科学研究和新的发现相对减少。放射性同位素和核技术在分析化学、生命科学、环境科学、医学等方面紧密结合,使其应用和交叉研究蓬勃发展起来。从目前的动向看,核化学和放射化学主线大体有如下几方面。 (1)超重元素“稳定岛” 能找到吗? 20世纪60年,Myers和Nilssdn等核物理学家从核内存在着核子壳层和幻数的理论模型出发,提出了超重元素存在 "稳定岛"的学说,即在核质子数Z=114和中子数N=186的幻数附近,有一些超重原子核特别稳定,其寿命可能长达若干年甚至1015年,这些长寿命的超重元素构成了一个“稳定岛"。在这一学说吸引下,近30多年来无数核科学家通过各种方法从自然界和核反应中去寻找这个梦寐以求的境地—稳定岛。至1999年6月,世界上三个大实验室,美国的LawrenceBerkeley实验室(LBL),德国的Darmstadt重离子研究会 (GSI)和位于俄罗斯的Dubna联合核子研究所 (JINR),分别用重粒子轰击的方法合成了重元素114、116和118,但由于加速器流强不够和反应截面在10-12靶,所以只获得了极少几个原子,有关证实研究已在重覆进行。这意味超重元素“稳定岛"将有可能存在。可以设想21世纪重粒子器的流强增大,使产生超重元素的原子数目大增,再加上分离、探测药物,主要用于多种疾病的体外诊断和体内治疗,还可在分子水平上研究体内的功能和代谢。21世纪将在单光子断层扫描仪 (SPECT)药物方面有新的突破;将会用放射性标记的放免活性和专一性极”人抗人”单克隆抗体作为生物导弹,定向杀死癌细胞;而中枢神经系统显像将推动脑化学和脑科学的发展。 (3)核分析技术将以其高灵敏度等优点向纵深发展放射性示踪技术和核分析技术始终因其灵敏度很高的优点在各个领域中得到广泛的应用。核分析方法未来将在分析化学中大有作为,如物种分析(speciation),分子活化分析,生物-加速器质谱学 (bio-accelerator mass spectrometry,Bio-AMS),粒子激发X-射线发射 (particle induced X一ray emission,PIXE)包括扫描质子微探针 (scanning proton microprobe,SPM)、"-粒子质子X-射线谱仪(alpha proton X一ray spectrometer,APXS)等各种新型结构和功能的分析仪器将为未来人类认识大自然提供有利的武器。
分析化学在现实生活中的应用我们的生活离不开物质。如何让物质能更加美好我们的生活呢?掌握一点化学知识其实是非常实用的方法。无论是生产、生活,还是环境保护、能源与资源的利用、医药卫生与人体健康等与化学有着广泛的关系。因此,生活中有许多化 学知识需要我们去认识。 “民以食为天”,我们先来看看吃里的化学吧。 油条是我国传统的早餐食品之一,它的历史非常悠久。当大家吃着香脆可口的油条时,是否会想到油条制作过程中的化学知识呢? 先来看看油条的制作过程:首先是发面,用鲜酵母或老面(酵面)与面粉一起加水揉和,使面团发酵到一定程度后,再加入适量纯碱、食盐和明矾进行揉和,然后切成厚1厘米,长10厘米左右的条状物,把每两条上下叠好,用窄木条在中间压一下,旋转后拉长放入热油锅里去炸,便成了一根香、脆的油条。 在发酵过程中,由于酵母菌在面团里繁殖分泌酵素(主要是分糖化酶和酒化酶),使一小部分淀粉变成葡萄糖,又由葡萄糖变成乙醇,并产生二氧化碳气体。同时,还会产生一些有机酸类,这些有机酸与乙醇作用生成有香味的酯类。反应产生的二氧化碳气体使面团产生许多小孔并且膨胀起来。有机酸的存在,就会使面团有酸味,加入纯碱,就是要把多余的有机酸中和掉,并能产生二氧化碳气体,使面团进一步膨胀起来;同时,纯碱溶于水发生水解,后经热油锅一炸,由于有二氧化碳生成,使炸出的油条更加疏松。 从上面的反应中,也许大家会担心,在制作油条时不是使用了氢氧化钠吗?含有如此强碱的油条,吃起来怎么会可口呢?然而其巧奥妙之处也在于此。当面团里出现游离的氢氧化钠时,原料中的明矾就立即跟它发生了反应,使游离的氢氧化钠经成了氢氧化铝。氢氧化铝的凝胶液或干燥凝胶,在医疗上用作抗酸药,能中和胃酸、保护溃疡面,用于治疗胃酸过多症、胃溃疡和十二指肠溃疡等。常见的治
分析天平的称量练习 1.如何表示天平的灵敏度?一般分析实验实所用的电光天平的灵敏度以多少为宜?灵敏度太低或太高有什么不好? 答:天平的灵敏度就是天平能够察觉出两盘载重质量差的能力,可以表示天平盘上增加1mg所引起的指针在读数标牌上偏移的格数。天平的灵敏度一般以指针偏移2~3格/mg为宜,灵敏度过低将使称量误差增加,过高则指针摆动厉害而影响称量结果。 2.什么是天平的零点和平衡点?电光天平的零点应怎样调节?如果偏离太大,又应该怎样调节? 答:零点:天平没有载重情况时,天平的零刻度与投影屏上的标线相重合的点。平衡点:天平有载重情况时,两边载重相等时,天平静止的那点。天平零点的调节:用金属拉杆调节,如果不行则用平衡螺丝调节。偏大时则用平衡螺丝调节。 3.为什么天平梁没有托住以前,绝对不许把任何东西放入盘上或从盘上取下? 答:没有托住以前,天平的整个重量由三个玛瑙刀口支撑,如果把东西放入盘上或从盘上取下则会磨损刀口,影响天平的灵敏度。 4.减量法的称量是怎样进行的?增量法的称量是怎样进行的?它们各有什么优缺点?宜在何种情况下采用? 答:递减法:先称出(称量瓶+试样)倒出前的质量,再称出(称量瓶+试样)倒出后的质量相减,得出倒出试样的质量。增量法:先称出容器的质量,在像天平中缓慢加入试样直到达到所需的质量。递减法操作复杂,适用于大部分物品;增加法适用于不易挥发,不吸水以及不易和空气中的氧气,二氧化碳发生反应的物质。 5.电子天平的“去皮”称量是怎样进行的? 答:打开天平门,将相应的容器放入天平的称量盘中,关上天平门,待读数稳定后按下“TARE”键,使显示为0,然后再向容器中加减药品,再次称量所得的数据就是容器中增减药品的质量。 6. 在实验中记录称量数据应准至几位? 答:应准确至小数点后四位即0.1mg。 7.本实验中要求称量偏差不大于0.4mg,为什么? 答:因为每次称量会有±0.1 mg的误差,所以实验中m1-m2会有±0.2 mg的误差,m3-m2也会有±0.2 mg故要求称量偏差不大于0.4mg。(注:我们书上只要求小于0.5 mg)s酸 碱标准液的配制和浓度比较 一.注意事项: 1.配完溶液应立即贴上标签注明试剂名称,配置日期,配制者姓名并留一空位以备填入此溶液的准确浓度。 2. 体积读数要读至小数点后两位。 3.滴定速度:不要成流水线。 4.近终点时,半滴操作和洗瓶冲洗。 二、思考题 1.滴定管、移液管在装入标准液前为何需要用滴定剂和要移取的溶液润洗几次?滴定中使用的锥形瓶或烧杯是否需要干燥?是否也要用标准液润洗?为什么? 答:为了让滴定管内的溶液的浓度与原来配制的溶液的浓度相同,以防加入的标准液被稀释。不需要。不要用标准液润洗,因为倾入烧杯或锥形瓶中的基准物的物质的量是固定的,润洗则会增加基准物的量,影响到实验结果。
核化学与放射化学复习知识 放射化学的特点 1、放射性:在涉及放化操作的整个过程中,放射性一直存在,放射性核素一直按固有的速率衰变,并释放出带电粒子或射线。这是放射化学最重要的特点。 2、不稳定性:由于放射性物质总是在不断地衰变,由一种物质转变为另一种或多种物质,使研究体系的组成不断发生变化。这就要求相应的快化学研究方法。 3、低浓度性 1896年,放射性的发现,贝克勒尔 1934年,人工放射性的发现,小居里夫妇 1939年,铀的裂变,哈尔 同位素:质子数相同、中子数不同的两个或多个核素 同质异能素:处于不同的能量状态且其寿命可以用仪器测量的同一种原子核 同中子异核素:中子数N相同而质子数Z不同的核素 同质异位素:质量数A相同而质子数Z不同的核素 β稳定线:稳定核素几乎全部位于一条光滑曲线或该曲线两侧 质子滴线:位于β稳定线上侧,其上元素最后一个质子结合能为0 中子滴线:位于β稳定线下侧,其上元素最后一个中子结合能为0 核的电荷分布半径小于核物质的分布半径说明,核表面的中子比质子要多,原子核仿佛有一层中子皮 质量亏损:组成原子核的Z个质子和(A-Z)个中子的质量和与该原子核的质量m(Z,A)之差称为质量亏损 以原子质量单位表示的原子质量M(Z,A)与原子核的质量数A之差称为质量过剩 原子核的结合能:由Z个质子和N个中子结合成质量数为A=Z+N的原子核时,所释放的能量称为该原子核的结合能 将结合能B( Z,A)除以核子数A,所得的商ε 平衡分离过程:依靠达到平衡的两相中,所需组分和不需要组分的含量比的差别 速率控制过程:依靠所需组分和不需要组分传递速率的不同,造成两相中所需组分和不需要组分含量比的差别 分离因数:表征两相中所需组分A和不需组分B含量比差别的一个系数 回收率:表示样品经过分离后,回收组分的完全程度 富集系数:所需组分A和不需组分B的回收率之比 放射性核素纯度,指在含有某种特定放射性核素的物质中,该核素的放射性活度对物质中总放射性活度的比值 放射化学纯度指在一种放射性样品中,以某种特定的化学形态存在的放射性核素占总的该放射性核素的百分数 比移值:某斑点或窄条的中心移动距离与流动相移动距离之比 载体:加入的常量的稳定核素 反载体:加入的一定量可能沾污核素的稳定同位素 同离子效应:沉淀的溶解度会因有共同离子的过量存在而减少 盐效应:当在溶液中加入不是太过量的同离子,而是加入并非构成沉淀的其他离子时,也会使溶解度增加 共沉淀分离法:利用溶液中某一常量组分(载体)形成沉淀时,将共存于溶液中的某一或若干微量组分一起沉淀下来的方法。共沉淀的机制主要有形成混晶、表面吸附和形成化合物等
分析化学实验基础知识及解答(1).doc 分析化学实验基础知识及解答(1) 考生:考试总分:100分考生选择题总得分: 一、单选题(每题1分,共50题) 1.在配位滴定中,要准确滴定M离子而N离子不干扰须满足lgKMY-lgKNY ≥5( B )。 A.对 B.错 2.在实验室常用的玻璃仪器中,可以直接加热的仪器是( C ) A.量筒和烧杯 B.容量瓶和烧杯 C.锥形瓶和烧杯 D.容量瓶和锥形瓶 3.使用分析天平进行称量过程中,加、减砝码或取、放物体时,应把天平梁托起,这是为了( B ) A.程量快速 B.减少玛瑙刀的磨损 C.防止天平盘的摆动 D.减少天平梁的弯曲 4.化学分析实验室常用的标准物质中,基准物质的准确度具有国内最高水平,主要用于评价标准方法、作仲裁分析的标准( B )。 A.对 B.错 5.酸碱质子理论认为:凡是能给出质子的物质就是酸,凡是能接受质子的物质就是碱( A )。 A.对 B.错 6.下列四个数据中修改为四位有效数字后为0.7314的是( C ): A.0.73146 B.0.731349 C.0.73145 D.0.731451
7.配制碘溶液时应先将碘溶于较浓的KI溶液中,再加水稀释( A )。 A.对 B.错 8.砝码使用一定时期(一般为一年)后,应对其质量进行校准( A )。 A.对 B.错 9.所谓终点误差是由于操作者终点判断失误或操作不熟练而引起的( B )。 A.对 B.错 10.某溶液主要含有Ca2+、Mg2+及少量Fe3+、Al3+今在PH=10的加入三乙醇胺,以EDTA 滴定,用铬黑T为指示剂,则测出的是( C )。 A.Mg2+量 B.Ca2+量 C.Ca2+、Mg2+总量 D.Ca2+、Mg2+、Fe3+、Al3+总量 11.配制EDTA标准溶液用自来水,在直接滴定中将使测定结果( A ) A.偏大 B.偏小 C.不影响 D.大小不确定 12.浓度≤1μg/ml的标准溶液可以保存几天后继续使用( B )。 A.对 B.错 13.配制HCl标准溶液宜取的试剂规格是( A )。 A.HCl(AR) B.HCl(GR) C.HCl(LR) D.HCl(CP) 14.在实验室中浓碱溶液应贮存在聚乙烯塑料瓶中( A )。 A.对 B.错 15.滴定管中装入溶液或放出溶液后即可读数,并应使滴定管保持垂直状态( B )。 A.对 B.错
化学计量学在分析化学中的应用 倪永年编著 科学出版社 索书号:54.6/24 馆藏号:022604 内容介绍: 本书根据作者多年来在化学计量学领域中的教学实践与科学研究的经验,对化学计量学的一些基本理论及原理进行了深入浅出的阐述,并对化学计量学在分析化学中的实际应用作了较详细的叙述和介绍。 本书共分12章,内容包括统计基础、化学实验设计与优化方法、分析信号处理、多元校正分析、因子分析及相关技术、化学模式识别、人工神经网络及遗传算法等常用的化学计量学方法的原理,以及化学计量学在电分析化学、动力学分析、电位滴定分析及分光光度分析中的应用。 本书的目的是使读者阅读之后能更好地掌握化学计量学的基础知识,并有更多的机会应用化学计量学方法来解决科研和教学中的实际问题。 本书目录: 第一章化学计量学的历史、现状及教学 1.1 化学计量学的主要内容及方法 1.2 化学计量学的教学 参考文献 第二章统计基础 2.1 分析质量判据和统计检验 2.2 显著性检验 2.3 一元校正和相关性分析 2.4 检测限 附表A2 统计中常用临界值分布表 参考文献 第三章化学试验设计与优化方法 3.1 正交试验设计 3.2 均匀试验设计 3.3 析因设计 3.4 单纯形优化法 3.5 响应曲面设计 附表A3 常用正交设计表和均匀设计表 参考文献 第四章分析信号处理 4.1 分析信号的卡尔曼滤波 4.2 分析信号的平滑和求导 4.3 分析信号的Hadamard变换 4.4 傅里叶变换 4.5 小波变换 参考文献 第五章多元校正分析 5.1 多元线性回归
5.2 多元非线性回归 5.3 岭回归 5.4 多元线性回归法用于多组分分析 5.5 通用标准加入法 5.6 主成分分析 5.7 主成分回归 5.8 偏最小二乘法 5.9 三维主成分分析 参考文献 第六章因子分析及其相关技术 6.1 概述 6.2 因子旋转 6.3 方差最大旋转 6.4 目标转换因子分析法用于因子旋转 6.5 基于曲线分辨的方法 6.6 迭代目标转换因子分析法 6.7 渐进因子分析 6.8 固定窗口渐进因子分析 6.9 启发渐进特征投影法 6.10 广义秩消失因子分析法 6.11 残差双线性分解法 参考文献 第七章化学模式识别 7.1 聚类分析 7.2 相似系数和距离 7.3 测量数据预处理和特征选取 7.4 聚类分析算法 7.5 基于主成分分析的投影判别法 7.6 有管理模式识别 参考文献 第八章人工神经网络及遗传算法 8.1 神经元 8.2 线性学习机和感知器网络 8.3 多层向前网络 8.4 MLF网络的训练和测试 8.5 其他网络函数 8.6 人工神经网络在化学领域中的应用 8.7 遗传算法 8.8 遗传算法在分析化学中应用 参考文献 第九章电分析化学 9.1 化学计量学在无机离子测定中的应用9.2 化学计量学在有机电分析化学中的应用参考文献
1.如果氢氧化钠标准溶液在保存过程中吸收了空气中的二氧化碳用此标准溶液滴定同一种盐酸溶液时可用甲基橙和酚酞为指示剂有何区别为什么 答:吸收二氧化碳,溶液中有碳酸钠. 如果以 甲基橙为指示剂 ,反应产物为氯化钠,应该没有影响. 如果以酚酞为指示剂 ,反应产物为碳酸氢钠,相当于有一部分氢氧化钠没有参与反应,消耗的氢氧化钙体积变大,结果偏大. 2.草酸,柠檬酸,酒石酸等有机多元酸能否用NaoH溶液滴定 答:看你要滴总酸还是分步滴定了.总酸肯定能滴,分步滴定的话要看这些酸的几个解离常数之间有没有差10的三次方以上. 3.Na2C2O4能否作为酸碱滴定的基准物质 答:不行.Na2C2O4在水中溶解度很大,不易获得组分固定的晶体(都会带有数量不定的结晶水) 4.若以氢氧化钠溶液滴定盐酸溶液,属于那类滴定?咋选择指示剂 答:酸碱滴定,指示剂可以选择酚酞,甲基橙,甲基红等。从实际操作的角度,一般选择甲基橙 5.测定醋酸含量时,所用的蒸馏水不能含二氧化碳,为什么? 答:测定醋酸含量时,所用的蒸馏水不能含有二氧化碳,否则会溶于水中生成碳酸,将同时被滴定. 1. 在中和标准钙溶液中的盐酸时,能否用酚酞代替甲基红来指示?为什么? 答:不能。在缓冲剂NH3-NH4Cl环境下,pH=10,酚酞显红色,会干扰EBT由红色变为蓝色时的终点观察。而甲基红此时显黄色,可以被红色和蓝色掩盖,不会影响终点观察。 2. 简述Mg—EDTA提高终点敏锐度的原理 答:这是因为:测定钙(镁)等离子时,常用铬黑T(EBT)作指示剂,而Ca2+与EBT的反应显色不如Mg2+与EBT的反应显色敏锐(变色易观察)。所以测定时,常加入Mg2+-EDTA,这样,在含Ca2+的溶液中加了Mg2+-EDTA后,由于Ca2+-EDTA的稳定性比Mg2+-EDTA强,所以,Mg2+-EDTA中的微量Mg2+能被Ca2+取代出来,而Mg2+与铬黑T的稳定性又大于Ca2+与铬黑T的,所以,最终是Mg2+与铬黑T显色了,终点时,就变成了Mg2+与铬黑T 之间的变色了,更敏锐了。 3. 滴定为什么要在缓冲溶液中进行? 答:控制PH,避免其他离子的影响,指示剂显色也与PH有关。 自来水硬度的测定 1. 本实验中最好采用哪种基准物质来标定EDTA,为什么? 答:用碳酸钙,水硬度的分析是指水中钙镁的总量,基准物质与被测物质一致,相同的分析
1、放射性:在涉及放化操作的整个过程中,放射性一直存在,放射性核素一直按固有的速率衰变,并释放出带电粒子或射线。这是放射化学最重要的特点。 2、不稳定性:由于放射性物质总是在不断地衰变,由一种物质转变为另一种或多种物质,使研究体系的组成不断发生变化。这就要求相应的快化学研究方法。 3、低浓度性 1896年,放射性的发现,贝克勒尔 1934年,人工放射性的发现,小居里夫妇 1939年,铀的裂变,哈尔 同位素:质子数相同、中子数不同的两个或多个核素 同质异能素:处于不同的能量状态且其寿命可以用仪器测量的同一种原子核 同中子异核素:中子数N相同而质子数Z不同的核素 同质异位素:质量数A相同而质子数Z不同的核素 β稳定线:稳定核素几乎全部位于一条光滑曲线或该曲线两侧 质子滴线:位于β稳定线上侧,其上元素最后一个质子结合能为0 中子滴线:位于β稳定线下侧,其上元素最后一个中子结合能为0 核的电荷分布半径小于核物质的分布半径说明,核表面的中子比质子要多,原子核仿佛有一层中子皮 质量亏损:组成原子核的Z个质子和(A-Z)个中子的质量和与该原子核的质量m(Z,A)之差称为质量亏损 以原子质量单位表示的原子质量M(Z,A)与原子核的质量数A之差称为质量过剩 原子核的结合能:由Z个质子和N个中子结合成质量数为A=Z+N的原子核时,所释放的能量称为该原子核的结合能 将结合能B( Z,A)除以核子数A,所得的商ε 平衡分离过程:依靠达到平衡的两相中,所需组分和不需要组分的含量比的差别 速率控制过程:依靠所需组分和不需要组分传递速率的不同,造成两相中所需组分和不需要组分含量比的差别 分离因数:表征两相中所需组分A和不需组分B含量比差别的一个系数 回收率:表示样品经过分离后,回收组分的完全程度 富集系数:所需组分A和不需组分B的回收率之比 放射性核素纯度,指在含有某种特定放射性核素的物质中,该核素的放射性活度对物质中总放射性活度的比值 放射化学纯度指在一种放射性样品中,以某种特定的化学形态存在的放射性核素占总的该放射性核素的百分数 比移值:某斑点或窄条的中心移动距离与流动相移动距离之比 载体:加入的常量的稳定核素 反载体:加入的一定量可能沾污核素的稳定同位素 同离子效应:沉淀的溶解度会因有共同离子的过量存在而减少 盐效应:当在溶液中加入不是太过量的同离子,而是加入并非构成沉淀的其他离子时,也会使溶解度增加 共沉淀分离法:利用溶液中某一常量组分(载体)形成沉淀时,将共存于溶液中的某一或若干微量组分一起沉淀下来的方法。共沉淀的机制主要有形成混晶、表面吸附和形成化合物等共沉淀的公式各因数的含义记一下
分析化学在生产、生活和科研中的应用例子1、测定三聚氰胺在乳制品中的含量 方法:高效液相色谱法测定原料乳与乳制品中三聚氰胺含量。 原理:用三氯乙酸溶液 - 乙腈提取试样,经阳离子交换固相萃取柱净化后,用高效液相色 谱测定,外标法定量。 试剂与材料:甲醇、乙腈、 25%~28%的氨水、三氯乙酸、柠檬酸、辛烷磺酸钠、甲醇水 溶液(含 50mL甲醇和 50mL水)、三氯乙酸溶液( 1%)、氨化甲醇溶液( 5%)、离子对试剂缓冲液(由柠檬酸和辛烷磺酸钠配制)、三聚氰胺标准(CAS108-78-01,纯度>99.0%)、三聚氰胺标准储备液( 1mg/mL)。所有试剂均为分析纯,水为 GB/T 6682 规定的 一级水。阳离子交换固相萃取柱、定性滤纸、海砂、微孔滤膜、氮气(纯度≥ 99.999%) 仪器和设备:高效液相色谱( HPLC)仪、分析天平、离心机、超声波水浴器、固相萃取 装置、氮气吹干仪、涡旋混合器、 50mL具塞塑料离心管、研钵。、 样品处理 提取:液态奶、奶粉、酸奶、冰淇淋和奶糖等。称取 2g(精确至 0.01g)试样于 50mL具塞 塑料离心管中,加入 15mL三氯乙酸溶液和 5mL乙腈,超声提取 10min,再振荡提取 10min 后,以不低于 4000r/min 离心 10min。上清液经三氯乙酸溶液润湿的滤纸过滤后,用三氯乙酸溶液定容至 25mL,移取 5mL滤液,加入 5mL水混匀后做待净化液。②奶酪、奶油和巧克力等。 称取 2g(精确至 0.01g)试样于研钵中,加入适量海砂(试样质量的 4 倍~ 6 倍)研磨成干 粉状,转移至 50mL具塞塑料离心管中,用 15mL三氯乙酸溶液分数次清洗研钵,清洗液转 入离心管中,再往离心管中加入 5mL乙腈,超声提取10min,再振荡提取 10min 后,以不低 于 4000r/min 离心 10min。上清液经三氯乙酸溶液润湿的滤纸过滤后,用三氯乙酸溶液定容 至 25mL,移取 5mL滤液,加入 5mL水混匀后做待净化液。若样品中脂肪含量较高,可以 用三氯乙酸溶液饱和的正己烷液 - 液分配除脂后再用 SPE柱净化。 净化:将待净化液转移至固相萃取柱中。依次用 3mL水和 3mL甲醇洗涤,抽至近干 后,用6mL氨化甲醇溶液洗脱。整个固相萃取过程流速不超过 1mL/min。洗脱液于 50℃下 用氮气吹干,残留物(相当于 0.4g 样品)用1mL流动相定容,涡旋混合1min,过微孔滤膜后,供HPLC测定。 高效液相色谱测定:用流动相将三聚氰胺标准储备液逐级稀释得到的浓度为 0.8 、2、20、40、80μg/mL的标准工作液,浓度由低到高进样检测,以峰面积 -浓度作图,得到标准曲线回归 方程。定量测定待测样液中三聚氰胺的响应值应在标准曲线线性范围内,超过线性范围则应 稀释后再进样分析。空白实验除不称取样品外,均按上述测定条件和步骤进行。本方法的 定量限为 2mg/kg。在添加浓度 2mg/kg~10mg/kg 浓度范围内,回收率在 80%~110%之间, 相对标准偏差小于 10%。在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术 平均值的 10%。 2、测定硫化氢在空气中的含量 方法:吸光光度法 原理:硫化氢被碱性锌氨络盐溶液吸收后,在酸性溶液中释放出硫离子,在三氯化铁存 在下,与对氨基二甲基苯胺生成亚甲基蓝。其颜色深浅与硫离子含量成正比例进行比色定
思考题汇总盐酸溶液的配制与标定 1.标定盐酸溶液浓度除了用Na 2CO 3 以外,还可以用哪几种基准物质为什么HCl 标准溶液配制后,一般要经过标定 答:可用硼酸。因为盐酸是瓶装的,在量取的时候是用量取一定体积的盐酸,所以浓度无法确定,一定要经过基准物质标定。 2.用Na 2CO 3 标定HCl溶液时,为什么可用甲基橙作指示剂能否改用酚酞作指示 剂 答:用酸性溶液滴定碱性溶液时,如盐酸滴氢氧化钠溶液,滴定突跃区间是(~),终点是酸性的所以选甲基橙(颜色由黄色到橙色(PH≈)。不能改用酚酞,因为不利于滴定重点的观察。 3.盛放Na 2CO 3 的锥形瓶是否需要预先烘干加入的水量是否需要准确 答:不需要烘干,加入的水不需要准确,加水只是起到溶解碳酸钠的作用而已,无需定量。 4.第一份滴定完成后,如滴定管中剩下的滴定溶液还足够做第二份滴定时,是否可以不再添加滴定溶液而继续往下滴定第二份为什么 答:不可以,滴定误差主要来源与读数误差,这样的操作方法会出现4次读数,比正常的方法多了两次读数误差。 混合碱的滴定 1、测定某一混合碱样品时,若分别出现V1
第页 共5页 1 南华大学2006–2007学年度第一学期 普通化学与放射化学 课程试卷(A/B 卷、05级矿资专业) 一、填空题:(每空 1.5 分,共 30 分) 1 Q V =△U 的应用条件是 封闭系统 ; dv=0 ;w , =0 ; 2 在温度T 和压力p 时理想气体反应:(1)2H 2O (g )=2H 2(g )+O 2(g ) K 1θ (2)CO 2(g )=CO (g )+1/2O 2(g ) K 2θ 则反应:(3)CO (g )+H 2O (g )= CO 2(g )+H 2(g 的 K 3θ 应为 32K K θθ= 。 4放射化学的特点 放射性 、不稳定性 、 低浓度和微量 5某一核素在裂变过程中产生的几率,称为 裂变产额 。 6锰原子的核外电子排布式为 1s 22s 22p 63s 23p 63d 54s 2 ,价电子构型为 3d 54s 2 。 7超导电性是指当温度降到接近 绝对零度(0K ) 时,许多金属的导电性会突然变得接近 无限大 的性质。 8府蚀电池中,极化使阳极的电极电势 增大 ,阴极的电极电势 减小 ,腐蚀速率 减慢 。 9按材料的化学成分和特性可将材料分 金属材料、 非金属材料、 高分子材料、 复合材料、 生物医学材料 。 二、选择题:(每题 1 分,共 15 分) 1.下列符号中,不属于状态函数的是(D ) (A)T (B)P (C)U (D)Q 2.下列物质的△f H m θ 不等于零的是( D) (A) Fe (s) (B) C (石墨) (C) Ne (g) (D)Cl 2 (1) 3.在下列几种反应条件的改变中,不能引起反应速率常数变化的是( C ) (A) 改变反应体系的温度 (B) 改变反应体系所使用的催化剂
4.7 配位滴定方式及其应用 在配位滴定中,采用不同的滴定方式,不仅可以扩大配位滴定的应用范围,而且可以提高配位滴定的选择性。 4. 7. 1直接滴定法 这种方法是用EDTA 标准溶液直接滴定待测金属离子。采用直接滴定法必须满足下列条件: ①被测粒子浓度M c 及其与EDTA 形成的配合物的条件稳定常数MY K '的乘积应满足准确滴定的要求,即lgc MY K '≥6。 ②被测离子与EDTA 的配位反应速率快。 ③应有变色敏锐的指示剂,且不发生封闭现象。 ④被测离子在滴定条件下,不会发生水解和沉淀反应。 直接滴定法操作简单,一般情况下引入的误差较少,因此只要条件允许,应尽可能采用直接滴定法。表4-6列出了EDTA 直接滴定一些金属离子的条件。 表4-6 EDTA 直接滴定的一些金属离子 金属离子 pH 指示剂 其他条件 +3i B 1 XO 3HNO +3Fe 2 磺基水杨酸 50~60℃ +2Cu 2.5~10 PAN 加乙醇或加热 8 紫脲酸铵 +2n Z 、+2d C 、+ 2Pb 和稀土元素 5.5 XO 9~10 EBT +2Pb 以酒石酸为辅助配 位剂 +2Ni 9~10 紫脲酸铵 氨性缓冲溶液,50~60℃ +2Mg 10 EBT +2Ca 12~13 钙指示剂 例如水硬度的测定就是直接滴定法的应用。水的总硬度是指水中钙、镁离子的含量,由镁离子形成的硬度称为镁硬,由钙离子形成的硬度称为钙硬测定方法如下:现在pH ≈10的氨缓冲溶液中以EBT 为指示剂,用EDTA 测定,测得的是+2Ca 、+ 2Mg 的总量,另取同样 试液加入NaOH 调节pH >12,此时此时+ 2Mg 以2)(OH Mg 沉淀形式被掩蔽, 用钙指示剂,
分析化学实验思考题答案
实验二滴定分析基本操作练习 1.HCl和NaOH标准溶液能否用直接配制法配制?为什么? 由于NaOH固体易吸收空气中的CO2和水分,浓HCl的浓度不确定,固配制HCl和NaOH 标准溶液时不能用直接法。 2.配制酸碱标准溶液时,为什么用量筒量取HCl,用台秤称取NaOH(S)、而不用吸量管和分析天平? 因吸量管用于标准量取需不同体积的量器,分析天平是用于准确称取一定量的精密衡量仪器。而HCl的浓度不定, NaOH易吸收CO2和水分,所以只需要用量筒量取,用台秤称取NaOH即可。 3.标准溶液装入滴定管之前,为什么要用该溶液润洗滴定管2~3次?而锥形瓶是否也需用该溶液润洗或烘干,为什么? 为了避免装入后的标准溶液被稀释,所以应用该标准溶液润洗滴管2~3次。而锥形瓶中有水也不会影响被测物质量的变化,所以锥形瓶不需先用标准溶液润洗或烘干。 4.滴定至临近终点时加入半滴的操作是怎样进行的? 加入半滴的操作是:将酸式滴定管的旋塞稍稍转动或碱式滴定管的乳胶管稍微松动,使半滴溶液悬于管口,将锥形瓶内壁与管口接触,使液滴流出,并用洗瓶以纯水冲下。 实验三 NaOH和HCl标准溶液的标定 1.如何计算称取基准物邻苯二甲酸氢钾或Na2CO3的质量范围?称得太多或太少对标定有何影响? 在滴定分析中,为了减少滴定管的读数误差,一般消耗标准溶液的体积应在20—25ml 之间,称取基准物的大约质量应由下式求得: 如果基准物质称得太多,所配制的标准溶液较浓,则由一滴或半滴过量所造成的误差就较大。称取基准物质的量也不能太少,因为每一份基准物质都要经过二次称量,如果每次有±0.1mg的误差,则每份就可能有±0.2mg的误差。因此,称取基准物质的量不应少于0.2000g,这样才能使称量的相对误差大于1‰。 2.溶解基准物质时加入20~30ml水,是用量筒量取,还是用移液管移取?为什么?因为这时所加的水只是溶解基准物质,而不会影响基准物质的量。因此加入的水不需要非常准确。所以可以用量筒量取。 3.如果基准物未烘干,将使标准溶液浓度的标定结果偏高还是偏低? 如果基准物质未烘干,将使标准溶液浓度的标定结果偏高。 4.用NaOH标准溶液标定HCl溶液浓度时,以酚酞作指示剂,用NaOH滴定HCl,若NaOH 溶液因贮存不当吸收了CO2,问对测定结果有何影响? 用NaOH标准溶液标定HCl溶液浓度时,以酚酞作为指示剂,用NaOH滴定HCl,若NaOH 溶液因贮存不当吸收了CO2,而形成Na2CO3,使NaOH溶液浓度降低,在滴定过程中虽然其中的Na2CO3按一定量的关系与HCl定量反应,但终点酚酞变色时还有一部分NaHCO3末反应,所以使测定结果偏高。 实验四铵盐中氮含量的测定(甲醛法)
核化学与放射化学复习文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
名词解释部分(4*5’) 载体:是以适当的数量载带某种微量物质共同参与某化学或物理过程的另一种物质,载体与被载带物具有相同的化学行为,最终能与放射性物质一起被分离出来; 同位素载体:稳定同位素的可溶性盐类作载体,分离89Sr 、90Sr 用SrCl 2;137Cs 用CsCl ,131I 用127I ,3H 用1H 等; 非同位素载体:没有稳定同位素的放射性核素,应用化学性质相似的稳定元素的盐类作载体,分离226Ra 加入Ba ,147Pm-Nd(NO 3)3;99Tc-NH 4ReO 4。 反载体:指在分离过程中,为了减少一种放射性核素对其他放射性核素的污染而加入的该种放射性核素的同位素载体。 同位素反载体:如,在分离90Sr 时,容易受到144Ce 的污染,去污因数仅为13,但若加入一定量的稳定同位素Ce( Ⅲ)作为反载体后,去污因数可提高到9000 用MnO 2从95Zr-95Nb 体系中吸附95Nb 时,加入稳定的Zr ; 非同位素反载体:如,在分析239Pu 的裂变产物时,239Np 对分离出的裂变产物会产生污染,加入与Np 价态相同的Ce(Ⅳ)盐作为反载体,可明显降低Np 的污染 核素:具有相同的质子数Z 、相同的中子数N 、处于相同的能量状态且寿命可测的一类原子。 同位素:质子数相同、中子数不同的两个或多个核素。 同质异能素:处于不同的能量状态且其寿命可以用仪器测量的同一种原子核。
同质异位素:质量数相同、质子数不同的核素。 同中子异荷素:中子数相同、质子数不同的核素。等超额中子素:核中超额中子数(N-Z)相同的核素。 镜像素:若两个核素的Z、N和A之间存在关系是Z 1=N 2 , Z 2 = N 1 ,A 1 =A 2 。 电离:具有一定动能的带电粒子与原子的轨道电子发生库仑作用时,把本身的部分能量传递给轨道电子如果轨道电子获得的动能足以克服原子核的束缚,逃出原子壳层而成为自由电子,这样过程叫电离。 轫致辐射:入射带电粒子与原子核之间的库仑力作用,使入射带电粒子的速度和方向发生变化,伴随着发射电磁辐射。 加速器:是一种用人工方法获得快速带电离子束的大型试验装置,是研究原子核物理和化学、认识物质深层次结构的重要工具; 粒子加速器的结构: 粒子源,用以提供所需加速的粒子,如:电子、正电子、质子、反质子以及重离子等等。 真空加速室,其中有一定形态的加速电场,并且为了使粒子在不受空气分子散射的条件下加速,整个系统放在真空度极高的真空室内。 导引、聚焦系统,用一定形态的电磁场来引导并约束被加速的粒子束,使之沿预定轨道接受电场的加速 束流输运与分析系统,由真空管道,电磁透镜、弯转磁铁和电磁场分析器等组成,用来在粒子源与加速器之间或加速器与靶室之间输运并分析带电粒子束
分析化学实验基本知识 注:由于在一级、二级纯度的水中,难于测定真实的pH值,因此,对一级水、二级水的pH 值范围不做规定;由于在一级水的纯度下,难于测定可氧化物质和蒸发残渣,对其限量不做规定,可用其他条件和制备方法来保证一级水的质量。 1.1.1 蒸馏水 通过蒸馏方法、除去水中非挥发性杂质而得到的纯水称为蒸馏水。同是蒸馏所得纯水,其中含有的杂质种类和含量也不同。用玻璃蒸馏器蒸馏所得的水含有Na+和SiO2-等离子;而用铜蒸馏器所制得的纯水则可能含有Cu+离子。 1.1.2 去离子水
利用离子交换剂去除水中的阳离子和阴离子杂质所得的纯水,称之为离子交换水或“去离子水”。未进行处理的去离子水可能含有微生物和有机物杂质,使用时应注意。 1.1.3 纯水质量的检验 纯水的质量检验指标很多,分析化学实验室主要对实验用水的电阻率、酸碱度、钙镁离子、氯离子的含量等进行检测。 1.电阻率:选用适合测定纯水的电导率仪 (最小量程为0.02μS·cm-1)测定(见表1.1)。 2.酸碱度:要求pH值为6~7。检验方法如下: ① 简易法: 取2支试管,各加待测水样10 ml,其中一支加入2滴甲基红指示剂应不显红色;另一支试管加5滴0.1% 溴麝香草酚蓝(溴百里酚蓝)不显蓝色为合要求。 ② 仪器法: 用酸度计测量与大气相平衡的纯水的pH值,在6~7为合格。 3.钙镁离子:取50 ml待测水样,加入pH=10的氨水-氯化铵缓冲液1 ml和少许铬黑T(EBT)指示剂,不显红色(应显纯蓝色)。 4.氯离子:取10 ml待测水样,用2滴1 mol·L-1HNO3酸化,然后加入2滴10 g·L-1 AgNO3溶液,摇匀后不浑浊为合要求。 化学分析法中,除络合滴定必须用去离子水外,其它方法均可采用蒸馏水。分析实验用的纯水必须注意保持纯净、避免污染。通常采用以聚乙烯为材料制成的容器盛载实验用纯水。 1.2 常用试剂的规格及试剂的使用和保存 分析化学实验中所用试剂的质量,直接影响分析结果的准确性,因此应根据所做试验的具体情况,如分析方法的灵敏度与选择性,分析对象的含量及对分析结果准确度的要求等,合理选择相应级别的试剂,在既能保证实验正常进行的同时,又可避免不必要的浪费。另外试剂应合理保存,避免沾污和变质。 1.2.1 化学试剂的分类
实验四铵盐中氮含量的测定(甲醛法) 思考题: 1.铵盐中氮的测定为何不采用NaOH 直接滴定法? +的K a=5.6 ×10-10,其Ck a<10-8,酸性太弱,所以不能用NaOH 直接滴定。 答:因NH 4 2. 为什么中和甲醛试剂中的甲酸以酚酞作指示剂;而中和铵盐试样中的游离酸则以甲 基红作指示剂? 答:甲醛试剂中的甲酸以酚酞为指示剂用NaOH 可完全将甲酸中和,若以甲基红为指示 剂,用NaOH 滴定,指示剂变为红色时,溶液的pH 值为 4.4,而甲酸不能完全中和。铵盐 试样中的游离酸若以酚酞为指示剂,用NaOH 溶液滴定至粉红色时,铵盐就有少部分被滴 定,使测定结果偏高。 3.NH 4HCO 3 中含氮量的测定,能否用甲醛法? 答:NH4HCO3 中含氮量的测定不能用甲醛法, 因用NaOH溶液滴定时,HCO 3 - 中的H+同时被滴定,所以不能用甲醛法测定。 实验五混合碱的分析(双指示剂法) 思考题: 1.用双指示剂法测定混合碱组成的方法原理是什么? 答:测混合碱试液,可选用酚酞和甲基橙两种指示剂。以HCl 标准溶液连续滴定。滴定的方法原理可图解如下: 2.采用双指示剂法测定混合碱,判断下列五种情况下,混合碱的组成? 1
(1)V1=0 V 2>0(2)V1>0 V2=0(3)V1>V 2(4)V 1 放射化学基础习题答案 第一章 绪论 答案 (略) 第二章 放射性物质 1. 现在的天然中,摩尔比率238U :235U=138:1,238U 的衰变常数为×10-10年-1,235U 的衰变常数为×10-10年-1.问(a) 在二十亿(2×109)年以前,238U 与235U 的比率是多少(b)二十亿年来有多少分数的238U 和235U 残存至今 解一: 0t N N e λ-= 23523802380235238238235235 13827:11t t t t N N e e N N e e λλλλ----==?= 保存至今的分数即 t e λ- 则 238 U : ≈ 235 U :≈解二: 二十亿年内238U 经过了 9 10 2100.44ln 21.5410-?=?个半衰期 235 U 经过了 9 10 210 2.82ln 29.7610-?=?个半衰期 保存到今的分数: 0.30.44 23810 0.74f -?== 0.3 2.82235100.14f -?== 二十亿年前比率 235238238235 13827:11t t U e U e λλ--=?= 2. 把1cm 3的溶液输入人的血液,此溶液中含有放射性I o =2000秒-1的24Na ,过5小时后取出1cm 3的血液,其放射性为I=16分-1。设24Na 的半衰期为15小时,试确定人体中血液的体积。(答:60升) 解: 5小时衰变后活度: 1 ln 2515 020001587.4t I I e e λ-- ?-==?=秒 人体稀释后 1587.416 60 V = (1min=60s ) 5953600060V ml ml L ∴=≈= 3. 239Np 的半衰期是天,239Pu 的半衰期是24000年。问1分钟内在1微克的(a) 239Np ,(b) 239Pu 中有多少个原子 发生衰变(答: (a)×1011; (b)×109) 解: 6 23150110 6.02310 2.519710239 N -?= ??≈?个原子