
青蒿素的发现,提取及一系列发展应用
1.时代背景:时代背景.mp4
世界上影响人数最多的疾病并非现在深受关注的艾滋病,而是一种堪称“历史悠久”的疾病——疟疾,也就是俗称的“打摆子”,同时,它也是当今除艾滋病外,上升趋势最为显著的一种传染病,每年2~3亿人感染此病,200多万人死亡。19世纪从南美洲金鸡纳树皮中得到的奎宁曾成为最有效的药物,治愈了众多的疟疾患者。20世纪第二次世界大战后模仿奎宁基本结构而合成的一批新药如氯喹、伯喹也曾救治过无数的病人。但是20世纪60年代出现抗药性疟原虫后,以往常用的抗疟药(如氯喹、磺胺、奎宁等)的效果便不复存在,以至于造成了无药可医的局面,特别在东南亚、非洲地区情况更为严重。青蒿素类药物的出现以其副作用低且不易产生抗药性而被誉为“治疗疟疾的最大希望”。
2.什么是青蒿素时代背景.mp4
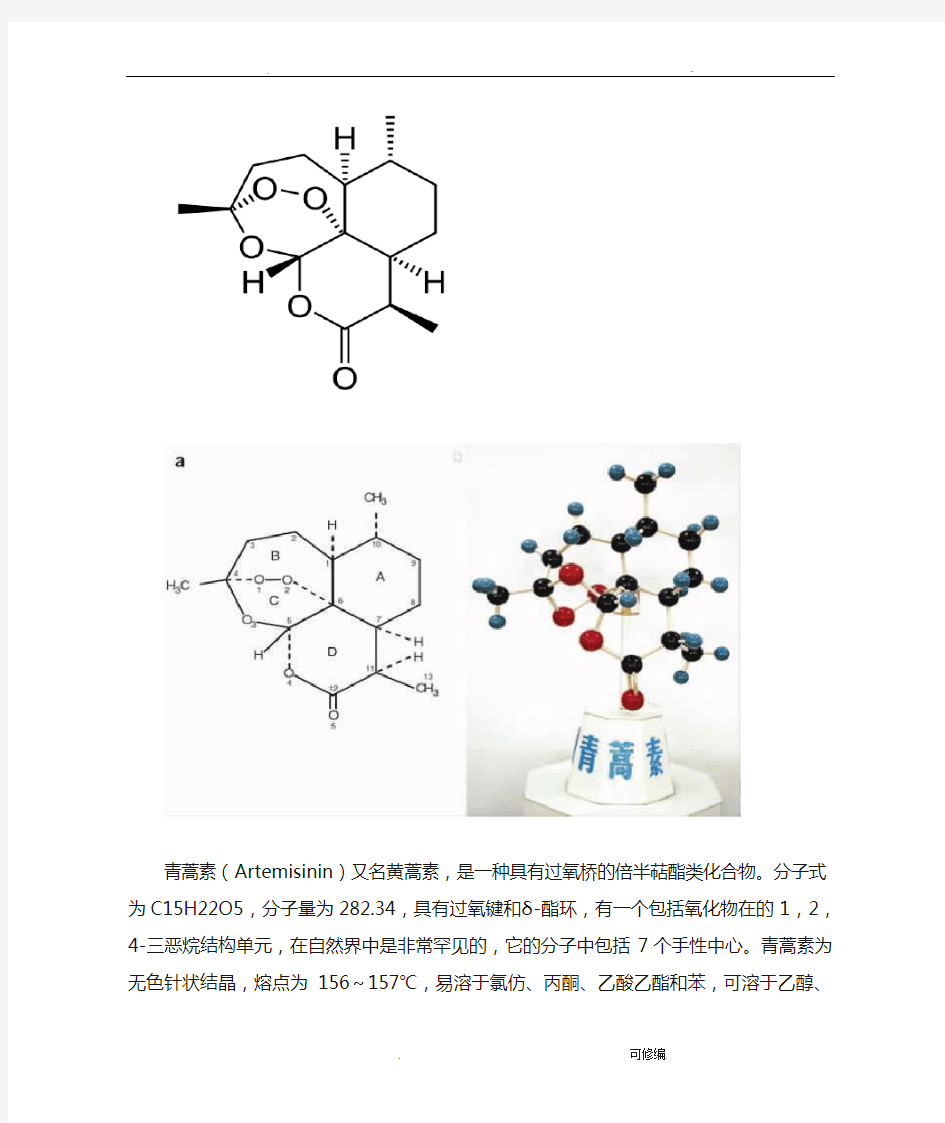
◆分子式为C15H22O5,分子量282.33,组分含量:C 63.81%,H 7.85%,O 28.33%。
◆无色针状晶体,味苦。
◆在丙酮、醋酸乙酯、氯仿、苯及冰醋酸中易溶,在乙醇和甲醇、乙醚及石油醚中可溶解,在水中几乎不溶。
青蒿素(Artemisinin)又名黄蒿素,是一种具有过氧桥的倍半萜酯类化合物。分子式为C15H22O5,分子量为282.34,具有过氧键和δ-酯环,有一个包括氧化物在的1,2,4-三恶烷结构单元,在自然界中是非常罕见的,它的分子中包括7个手性中心。青蒿素为无色针状结晶,熔点为156~157℃,易溶于氯仿、丙酮、乙酸乙酯和苯,可
溶于乙醇、乙醚,微溶于冷石油醚,几乎不溶于水。因其具有特殊的过氧基团,对热不稳易受湿、热和还原性物质的影响而分解。
3.为什么要选用青蒿治疗疟疾?
疟疾是一个非常古老的疾病。我们的先人对它还是有一定办法的。在晋代洪所著的《肘后备急方》中就有关于疟疾的治疗方药,原文如下:青蒿一握,以水二升渍,绞取汁,尽服之。意思是,用一把青蒿,以二升的水浸渍以后,绞扭青蒿,取得药汁,然后一次服尽。可别小看这几句话,它说明,我们的古人对于青蒿截疟已经有了很深入的认识。
4.验证青蒿素对疟疾的治疗效果实验:
为什么在实验室里青蒿的提取物不能很有效地抑制疟疾呢?是提取方法有问题?还是做实验的老鼠有问题?
“青蒿一握,以水二升渍,绞取汁,尽服之”为什么这和中药常用的高温煎熬法不同?原来古人用的是青蒿鲜汁!温度!这两者的差别是温度!很有可能在高温的情况下,青蒿的有效成分就被破坏掉了。改用沸点较低的乙醚进行实验,她在60摄氏度下制取青蒿提取物。接下来在实验室里,青蒿提取物对疟原虫的抑制率达到了100%!
5.其实青蒿素是从黄花蒿中提取而来,为什么命名为青蒿素?
在植物学畴里,青蒿和黄花蒿是同属菊科的两种植物,此后定名的青蒿素其实存在于黄花蒿中,青蒿中反倒没有。而在中医药领域,青蒿和黄花蒿却被统称为青蒿。
中药研究所提取“青蒿素Ⅱ”晶体并将其命名为青蒿素时间最早,但省药物研究所改进了提取方法,采用“溶剂汽油法”大幅提高了提取效率,并且确定了优质黄花蒿产地,“523任务”后续进行的动物药理毒性试验和临床试验研究,用的其实都是“黄蒿素”。青蒿素命名的“青黄之争”,成了一场纠缠不清的“文字官司”。直到1978年,“523”项目科研成果鉴定会上,按中药用药习惯,将中药青蒿抗疟成分定名为青蒿素。
但争议并未止歇,以至于2000年版的《中国药典》中还在为此做着修正:将中药青蒿原植物只保留黄花蒿一种。
6.青蒿素的提取:
青蒿素虽然已经可以人工全合成,但其成本很高,无法工业化生产。目前,青蒿素的主要来源仍然是从植物黄花蒿中提取分离。黄花蒿分布较广,但由于产地的不同,所含青蒿素的差异极大(0.1%-1.3%)其中仅有部分产地(、、XX、等地)的黄花蒿具有工业价值。青蒿素原料药的90%来自中国。
最早用乙醚提取:高温会破坏青蒿中的有效成分,随即另辟蹊径采用低沸点溶剂乙醚进行实验。以萃取原理为基础,挥发
油主要采用水蒸汽蒸馏提取,减压蒸馏分离,其工艺为:投料—加水—蒸馏—冷却—油水分离—精油;非挥发性成分主要采用有机溶剂提取,柱层析及重结晶分离,基本工艺为:干燥—破碎—浸泡、萃取(反复进行)—浓缩提取液—粗品—精制。
目前从黄花蒿中提取分离青蒿素的方法主要有:超临界二氧化碳提取法[2]
丙酮-硅胶柱层析法[3]
低沸汽油-超短粗型球状扩空硅胶过滤柱层析法[4]
稀乙醇渗漉-连续萃取法[5]
微波提取法[6 ,7]
石油醚-超声波提取法[8]
乙醚冷浸法[9] 最早使用方法
溶剂汽油提取-浓缩-结晶法[10]
Vonwiller的甲醇-乙醇-乙醚提取法[11]
Paniego的新鲜组织甲苯提取法[12]
Elsohly等的正己烷-乙腈法[13]
其中溶剂汽油提取-浓缩-结晶法操作简便、成本低廉、是大多数提取生产厂家广泛采用的方法。
7.青蒿素对疟疾的作用机制:
摘要青蒿素是中国自主研制的抗疟良药, 高效、低毒, 许多基于青蒿素研发的衍生物具有良好的抗疟效果, 近年来已
成为抗疟的一线药物, 受到世界医疗卫生界的充分肯定. 虽然青蒿素作用机制青蒿素结构奇特, 抑疟效果显著, 但40 年来其生物作用机制之谜一直未被彻底破解.针对血红素青蒿素类药物的作用机制, 提出了不同的假说, 如血红素参与青蒿素的激活并被烷基化从线粒体而起到抑疟作用, 线粒体参与青蒿素的激活和作用过程, 某些特定的蛋白是青蒿素作用靶点等. 除抑疟外, 青蒿素类药物在杀灭其他种类寄生虫、抑制某些癌症细胞以及抗病毒、治疗类风湿等方面也有一定作用. 下面将对青蒿素类药物作用机制的研究进行综述及展望, 包括抗疟疾过程中的药物激活、作用靶点
破解青蒿素作用机制不仅可以加深人们对这种
药物的认识, 而且对于其正确使用, 如增效、防止抗疟株的产生, 以及新型抗疟药物的设计都有重要意义.目前提出的青蒿素作用机制假说基本涉及两个方面: 青蒿素的激活和青蒿素的作用靶点.
青蒿素的激活:
(1) 铁参与青蒿素的激活. 青蒿素抗疟研究中,铁是大家关注的焦点之一. 目前, 一种比较普遍的观点是青蒿素的激活是通过含铁的途径进行的. 通过监测青蒿素产生自由基的过程认为, 铁在青蒿素抗疟过程中发挥了重要作用. 通过电子顺磁共振技术(EPR)及捕获剂DMPO 进一步揭示了二者之间的关系,失去铁离子的参与,青蒿素的作用效率大大降低
(2) 血红素(heme)参与青蒿素的激活:
有体外实验发现, 将青蒿素与不同形式的铁, 包括
血红素、二价铁离子、脱氧的和氧化的血红蛋白在相
同的条件下进行反应, 血红素与青蒿素反应的效率
远高于其他含铁分子[12], 表明血红素对于激活青蒿
素起关键作用. 疟原虫寄生于血红细胞中, 血红素来
源丰富. 目前, 究竟是自由铁还是血红素的铁激活青蒿素还存在争议(3) 线粒体参与青蒿素的激活及其他观点
青蒿素类药物的作用靶点:
嵌入在青蒿素倍半烯萜酯骨架中的双氧桥对青蒿素抗疟有着至关重要的作用是进行机制研究的最初线索, 而自由基的生成与双氧桥的断裂有着密切的关系.
(1) 血红素的烷基化. 不少研究认为, 血红素既是激活青蒿素类药物的裂解还原激活剂, 又是其发挥作用的重要靶标, 青蒿素对血红素的修饰、烷基化是杀灭疟原虫的原因. 早期的血红素模型中青蒿素的作用机制与奎宁相仿, 都是作用于液泡, 通过影响血红素的脱毒来抑制青蒿素. 这一观点有一些相关实验支持
(2) 蛋白靶点理论. 青蒿素的一个鲜明特点就是对疟原虫有强烈的特异性而对人不产生副作用, 这使得人们推测青蒿素可能会在疟原虫体特异激活, 或者疟原虫体存在着对青蒿素的特异性靶标. 对于大部分药物来说, 都存在着较为专一和特异的靶标
(3)线粒体模型学说疟原虫的生长需要相关线粒体的参与
其他学说
8.青蒿素及其衍生物的发展:
?青蒿素具有水溶性差、热稳定性差的缺点,制成片剂因其难溶性,生物利用度低,且体代快。而纳米青蒿素的水溶性好,制成针剂后可进行静脉注射,将极提高药效,减少用药量,扩大应用围。
?青蒿素由于存在近期复燃性高、在油中和水中的溶解度低以及难以制成合适的剂型等不足,需对其结构进行改造,以期在保持青蒿素优良药理作用基础上开发新药,进一步改善和提高药效。而合成青蒿素衍生物蒿甲醚、蒿乙醚、青蒿琥酯、双氧青蒿素等克服了青蒿素复燃率高的弊病。
蒿甲醚
其抗疟作用为青蒿素的10至20倍,目前其开发成功的剂型蒿甲醚注射液为主要含蒿甲醚的无色或淡黄色澄清灭菌油溶液。
蒿乙醚
抗疟作用稍逊于蒿甲醚,且蒿乙醚的生产不如蒿甲醚更经济实用。
双氢青蒿素
?比青蒿素有更强的抗疟作用,它由青蒿素经硼氢化钾还原而获得。
9.青蒿素及其衍生物的其他药理作用:
抗病原微生物:本品煎剂对表皮葡萄球炎、卡他球菌、炭疽杆菌、白喉杆菌有较强的抑制作用
抗白血病:青蒿酸衍生物对白血病P388细胞有明显的抑制作用,青蒿β衍生物亦有此作用。
抗肿瘤:
体和体外实验证实, 青蒿素及其衍生物对多种人类和动物肿瘤细胞均具有毒性作用, 包括黑色素瘤细胞、肾癌细胞、中枢神经系统肿瘤细胞、肺癌细胞等。而且同一种衍生物对不同类型肿瘤细胞的作用强度不同, 具有选择性。在一项体外抗肿瘤实验中发现, 青蒿琥酯对肠道肿瘤细胞和白血病细胞
的抑制作用较强,而对肺小细胞癌细胞的杀伤作用较弱。不同衍
生物的抗肿瘤活性有所不同,具有选择性,推测其原因可能是来源于它们的亲脂性不同。其抗癌活性与化合物的构象、靶蛋白的差异相关。
2 .1 诱导肿瘤细胞凋亡
Yamachika 等[ 13] 系统比较了青蒿素和常规化疗药5-氟尿嘧啶(5-FU)对口腔癌细胞IHGK 的影响,发现青蒿素不同于5-FU 对细胞的直接杀伤作用, 其主要作用是诱导肿瘤细胞凋亡。Singh 等[ 14] 报道青蒿素可以诱导类人淋巴母细胞Molt-4 细胞凋亡, 而不是坏死。而且在铁转运蛋白的协助下,青蒿素的诱导凋亡作用更显著。青蒿素衍生物青蒿琥酯不但能抑制人肝癌细胞H22 和BEL-7402 的增殖,而且能诱导肿瘤细胞凋亡。进一步研究发现, 诱导的凋亡与Bcl-2 基因、PA 基因表达下调和bax 蛋白表达升高相关。Efferth 等[ 15] 分析了青蒿素对55 种人肿瘤细胞相关基因的影响,这些基因包括药物抵抗基因、DNA 损伤与修复基因、
凋亡调控基因、增殖相关基因、原癌基因、肿瘤抑制基因和细胞因子基因。最近Disbrow 等[ 16] 的研究表明,两种青蒿素衍生物二氢青蒿素和青蒿琥酯均对人类乳头瘤病毒的宫颈上皮细胞具有毒性作用;对狗口腔乳头瘤病毒诱导的口腔癌形成也具有抑制作用。进一步发现这种疏水性的药物可以自由穿透上皮细胞表面, 从而诱导线粒体半胱天冬酶表达进而启动细胞凋亡, 而且这一凋亡过程是P53 蛋白非依赖性的, 表明青蒿素及其衍生物可以用来预防和逆转病毒介导的肿瘤病变。
2 .2 二价铁离子介导的细胞毒作用
青蒿素及其衍生物的抗肿瘤作用机制目前还不完全清楚。但大量证据显示, 青蒿素的抗肿瘤作用机制与其抗疟机制十分相似。研究表明, 二价铁和铁转运蛋白在红细胞和肿瘤细胞中的含量较正常细胞高。处于对数生长期的细胞对二价铁离子的吸收逐步增加,而肿瘤细胞铁离子的吸收与肿瘤细胞增殖呈正相关。二价铁参与了青蒿素的抗疟作用, 同样也可能介导了青蒿素对肿瘤细胞的毒性作用。首先, 铁传递蛋白及硫酸氨基乙酸亚铁能显著增加青蒿素等衍生物的细胞毒性作用,对两种肿瘤细胞CCRF-CEM 和U373 的细胞毒性与单用青蒿素比较增加了 1 .3~1 .5倍,但对正常人外周血单个核细胞没有影响, 可能原因是外周血单个核细胞膜上转铁蛋白受体表达量不足肿瘤细胞的1 .3%。将外源性的铁转运蛋白和青蒿素共价耦联后, 再与肿瘤细胞孵育可以大
大提高青蒿素杀伤肿瘤细胞的效率。其次,铁转运蛋白可以增加青蒿素对耐药肺癌细胞株H69VP 的杀伤作用, 而不是非耐药细胞株H69 。此外, 肿瘤细胞不仅仅高表达铁转运蛋白, 而且高表达转铁蛋白受体。转铁蛋白受体介导了细胞对铁离子的吸收和利用过程;抗转铁蛋白受体单克隆抗体RVS10 能逆转铁转运蛋白协同青蒿素杀伤CCRF-CEM 和U373 细胞的作用[ 18] 。McCarty 等[ 19] 的研究表明, 抗血管生成药物治疗会上调肿瘤细胞低氧诱导因子1(HIF-1) 的表达,这加重了肿瘤治疗的负担, 因为HIF-1 表达与耐药相关,并增加转铁蛋白受体表达。但这恰恰扩大了青蒿素治疗耐受性肿瘤的空间。
2 .
3 氧自由基介导的细胞毒作用
已经发现亚铁离子的氧化还原特性可以增加肿瘤细胞对过氧化氢的敏感性,而肿瘤细胞一旦缺少细胞铁,就变得对过氧化氢不敏感性。以前认为, 过氧化氢和青蒿琥酯都可以产生ROS 和自由基。对过氧化氢抵抗的肿瘤细胞同样对青蒿琥酯不敏感。因此, 推测与青蒿素杀死疟原虫的机制类似, 肿瘤细胞的二价铁可以催化青蒿素类物质的过氧桥裂解, 产生大量以青蒿素炭原子为中心的自由基和ROS 。自由基破坏了肿瘤细胞膜即导致细胞物质外漏, 从而杀死肿瘤细胞[ 20] 。
2 .4 抑制血管生成
Wartenberg 等[ 21] 报道青蒿素可以抑制正常小鼠胚胎血管生成,并增加血管通透性,同时下调HIF-1 、血管皮生长因子(VEGF)和基质金属蛋白酶2(MMP-2)的表达。而自由基清除剂如维生素E 可以逆转青蒿素的抗血管生成作用。这些结果表明青蒿素的抗血管生成作用与其产生的自由基密切相关。在对肿瘤血管生成的研究中, Chen 等[ 22] 报道了二氢青蒿素和青蒿素均可抑制人脐静脉皮细胞(HUVE)的增殖、迁移和管状形成。进一步研究发现,另一衍生物青蒿琥酯能显著降低人卵巢肿瘤细胞HO-8910 异体移植的小鼠肿瘤组织微血管密度(LVD), 对肿瘤细胞、HUVE 的VEGF 及其受体血管皮生长因子受体1(VEGFR-1)的表达均具有抑制作用。其中对VEGFR-2 的抑制率可达到80 %;而青蒿琥酯和二氢青蒿素及合成的青蒿素衍生物在绒毛膜尿囊膜血管新生模型中也具有相似的作用,但它们的作用强度有所不同。
2 .5 增加放化疗敏感性
研究还发现,青蒿素及其衍生物不仅能单独作用于肿瘤细胞, 而且与5-FU 、吡柔比星、阿霉素等抗肿瘤药物具有协同抗肿瘤作用。Kim 等[ 23] 最近发现, 二氢青蒿素可增加神经胶质瘤细胞U373MG 的放射敏感性,其机制可能与青蒿素增加ROS 生成及抑制谷胱苷肽转移酶(GST)的表达相关。最近, 美盛顿大学的Singh 又发现二氢青蒿素可以与另一抗炎物质丁酸具有协同抗肿瘤作用。丁酸是大肠细菌群合成的短链、具有抗炎作用的脂肪酸,对
正常结肠上皮细胞具有营养作用。将20 μmol?L -1 的二氢青蒿素和1 mmol?L -1 的丁酸与Molt-4 共孵育24 h 几乎可以杀死所有的肿瘤细胞,而20 μmol?L -1 的二氢青蒿素和1 mmol?L -1 的丁酸对肿瘤细胞的杀伤率分别为40 %和32 %[24] 。同时发现药物诱导的凋亡明显增强。
10.开发植物界以外的青蒿素的新药源
青蒿素的药源主要取自野生黄花蒿和人工栽培的黄花蒿, 但前者受地理环境与季节限制, 而且天然资源逐趋匮乏;后者种植占地大, 耗力费时, 加以植株易变异, 产量不够稳定, 因此迫切需要开拓青蒿素的新药源,酉阳享有“世界青蒿之乡”的美誉,是世界上最主要的青蒿生产基地,也是全球青蒿素高含量的富集区,平均青蒿素含量高达8‰,全球八成的原料青蒿产于酉阳。
3.1 化学合成
1986 年, 中国科学院有机化学研究所许
杏祥等[16] 以R(+)2 香草醛为原料, 经13~14 个步
骤完成了青蒿素的化学合成. 近年来, 青蒿素分
子的全合成研究虽已取得不少进展, 但距商品问
世尚有待时日.
3.2 生物合成
青蒿素的生物合成包括3 条途径[3] : 1)添加生
物合成的前体以提高青蒿素的含量;2)调控参与
青蒿素合成的关键酶活性, 或激活该酶的控制基
因;3) 采用基因工程技术进行生产. 有机化
学所汪猷、黄敬坚等[17, 18] 探索了由[22 14 C]2MVA(甲基二羟戊酸)为前体合成青蒿酸, 继而生物合成青
蒿素与青蒿素B 的过程. 2011 年Farhi 等[19] 另辟
蹊径, 成功创建了甲羟戊酸-青蒿素的基因工程途
径, 从烟草生产青蒿素.
◆生物合成:愈伤组织诱导丛生芽、发根培养、组合生物合成等
青蒿素的含量受地理环境、采集时期、采集部位、气温和施肥等因素的影响。黄花蒿广泛分布在中国的各省市,不同产地青蒿素含量差异显著,最高可达干重的1% —2% 。为获得最大的青蒿素产量,钟风林等[8 ]对不同生长期的青蒿素含量变化进行考察,认为黄花蒿的采集期在生长盛期至花蕾期之前,此时的青蒿素含量最高,营养体重量大,而且采集的时间以晴天中午12时及下午16时为宜,一天中在这期间采收青蒿素含量最高,这与光强有利于青蒿
素的产生和大量积累理论相一致。在黄花蒿植株和枝条上的叶片中,青蒿素含量均呈下部、中部、上部依次递增的规律。因此,黄花蒿植物的上部和枝条上部的叶片应首选入药,其次为中部,最后才是下部。不同的干燥方法对青蒿素的产量也有一定的影响,比较晒干、阴干和60℃烘干三种方法,以自然晒干的效果最好,比阴干的样品含量高23. 76% 。
在人工栽培中稍加肥料,黄花蒿植株高大,青蒿素的含量较野生的略高, 且嫩叶比老叶的含量高。福泰[9 ]在人工控制的环境中栽培黄花蒿,在黄花蒿生长的基本条件得到满足的情况下,生长环境中的营养物质的含量与生长基质对青蒿素含量没有影响,而高温和短距离光照可促使青蒿素含量成倍增加。Elhag 等[ 10]筛选高产的黄花蒿植株时,发现青蒿的含量高的植株具有长的节间,茁壮的茎杆,伸展开的枝条和茂密的叶。Liersch等[11 ]对筛选的青蒿品种811喷洒植物激素chlo rmequat,结果植株的青蒿素含量比对照高30% 。虽然青蒿素主要来自于天然采集的野生植株和人工栽培青蒿,但天然野生青蒿受地理环境和季节的限制以及资源的日益匮乏, 难以获得持续的发展。人工栽培占地大,耗时耗力,且植株易变异,也使得产量难以保证,因而开发新的青蒿素来源途径具有重要的实际意义。
11.青蒿素及其衍生物的展望:
青蒿素产业的发展需要各方面共同促进。通过遗
传改造快速获得高青蒿素含量的植株将是高产黄花蒿育种的主要方向;土壤中肥料的多少对青蒿素含量的影响不大,但外界环境的刺激能显著改变青蒿素含量,特定条件下青蒿素含量的变化将是黄花蒿高产栽培技术的重要研究方向;由于青蒿素在黄花蒿中含量很低,在提取青蒿素时大量废料的产生不可避免,这也是青蒿素生产成本一直较高的原因之一,对废料的再利用将有利于节约生产成本;青蒿素的质量控制要从源头开始,黄花蒿的栽培地应选择在土壤与周边环境良好的地区,并加强田问管理,多施用有机肥改善土壤条件,选择绿色生物农药,而溶剂残留问题可以通过优化现有工艺、严格规生产或使用新型技术进行控制。
青蒿素产业的发展也离不开相关功能和产品的研究开发。结合市场需求,青蒿素低成本生产及其新功能的挖掘与利用将是黄花蒿青蒿素开发利用的发展趋势。青蒿素在黄花蒿中含量很低,在人工大规模化学合成还无法实现的情况下,使得青蒿素的开发利用受到极大限制。虽然采用工程菌辅助发酵完成青蒿素体
外生物合成是一个有效解决原料难题的方法,但要达到一步式直接生物合成青蒿素,还需要更多的探索。由于青蒿素的天然产物提取生产成本很高,能否从根本上解决原料中青蒿素含量低的问题,已经成为制约我国青蒿素天然产物提取行业发展的重要瓶颈。由此可见,选育高青蒿素含量的优良品种至关重要。相对于传统育种方法后代遗传性状不稳定、育种所需年限长、工作量大的缺点,基因工程育种能定向进行遗传改造,大大缩短育种年限,且效果
明显。青蒿素的生物合成是一系列复杂的反应过程,有多种中间产物和多条分支途径,这也是青蒿素生物产量低的根本原因。要促进青蒿素的积累,“开源”与“截流”是两大重要策略。通过过表达技术促进主干流的积累与反义RN A技术抑制支流的消耗来共同促进青蒿素的生物合成,最终获得高青蒿素含量的黄花蒿植株是目前也是将来研究的热点
青蒿素类药是我国科学家利用传统中草药自主研制的抗疟特效药。1995 年蒿甲醚率先载入国际药典,这是我国研制的新药首次得到国际认可。至今已有5 个抗疟类药物(青蒿素、蒿甲醚、复方蒿甲醚、青蒿琥酯、双氢青蒿素)9 种剂型在世界各国销售。青蒿素类药物价格低廉,有广谱抗癌性,药理作用广,毒副作用少。其作用机制独特,可以逆转肿瘤细胞的多药耐药,并与新碱、多柔比星、甲氨蝶呤等传统抗癌化疗药起到协同、增效的效果。但是,在国际抗疟药市场上,青蒿素类药物尚占不到1%的份额。主要原因是青蒿素原料缺乏,目前尚未找到合适的人工合成工艺。并且,青蒿素在体半衰期短,因此服用
次数多,复发率高(约为1O%)。青蒿素类药物有广阔的前景,国外已经掀起了青蒿素及其衍生物的开发与应用的研究热潮。
.中国青蒿素产业仅在原料种植、提取价值环节具有绝对优势,而在产品开发和市场营销价值环节处于劣势。我国青蒿素产业拥有完整的青蒿素产业链(青蒿素的产业链及价值链
如图3 所示),并在青蒿种植、青蒿素提取这两个价值环节占有
绝大部分市场份额,控制着全球80%以上的青蒿素原料资源。青蒿素的成药主要有蒿甲醚、青蒿琥酯、双氢青蒿素(科泰新)和复方蒿甲醚等四种产品。
中国青蒿素产业位于青蒿素全球价值链的低价值环节,获利能力远低于西方跨国公司。虽然我国拥有全球80%以上的青蒿素资源,在青蒿素产业全球价值链中在青蒿种植价值环节、青蒿素加工提炼价值环节占有绝对优势,但是这两个环节的获利能力很低,因为出售原料与出售产品之间的利润相差20 多倍。中国青蒿素产业在青蒿素全球价值链上只有“话语权”,没有“治理权”。跨国公司凭借强大的产业资本和商业资本,拥有了青蒿素产业的技术优势、研究与开发优势、品牌优势、市场营销优势。针对全球需求旺盛的抗疟药市场,通过全球采购和O E M 等生产方式组织起跨国商品流通网络,控制了除原材料种植、提炼之外的全部环节。使青蒿素的全球价值链呈现出兼具生产者驱动和采购者驱动的中间型特征。跨国公司已经占据了全球
青蒿素产业的核心价值环节,而这些高附加值的价值环节一般就是全球价值链上的战略环节。跨国公司正是通过这些战略环节,控制了青蒿素产业的全球价值链。