酸、碱、盐知识点归纳
一、常见的酸和碱
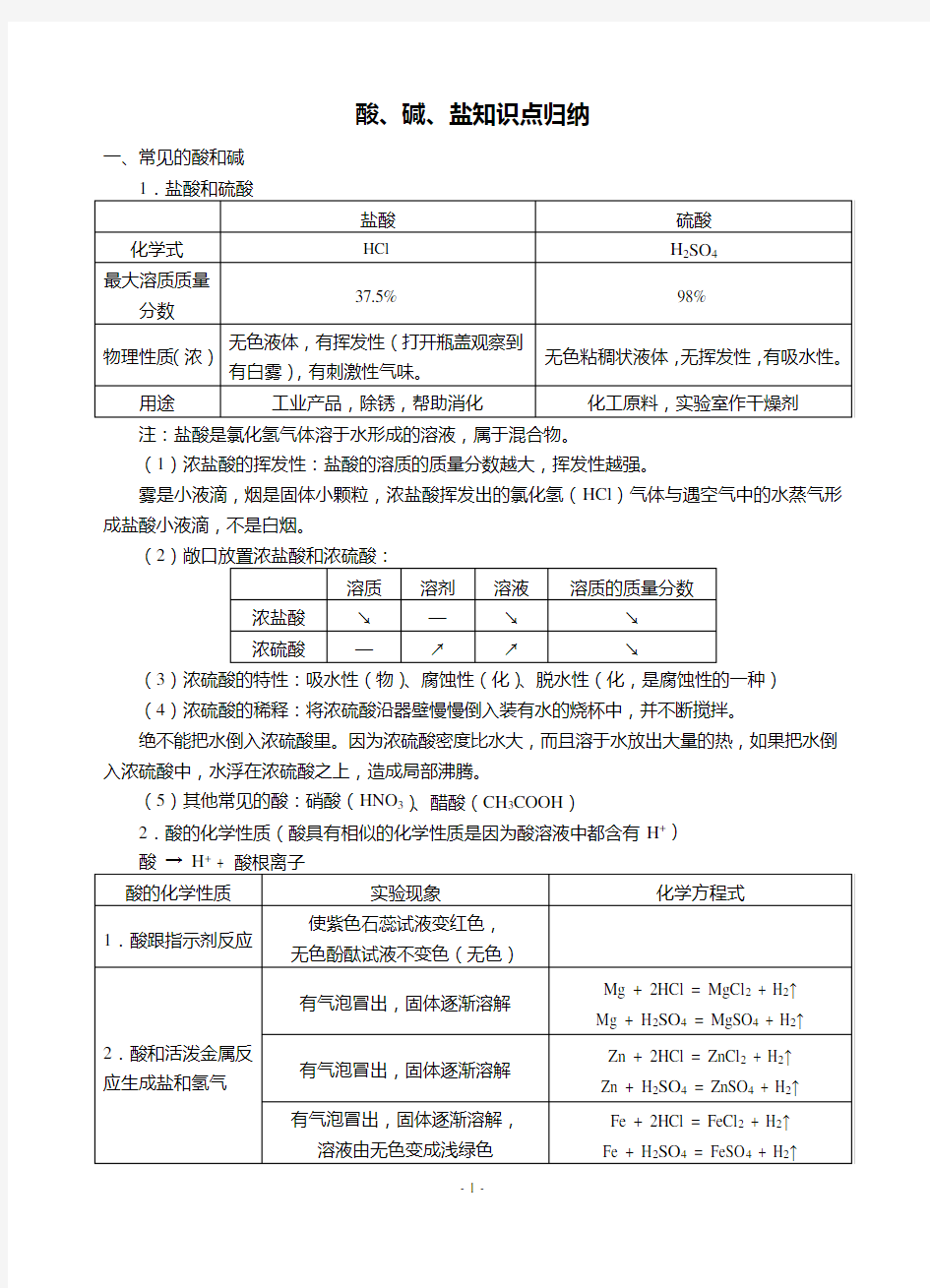
注:盐酸是氯化氢气体溶于水形成的溶液,属于混合物。
(1)浓盐酸的挥发性:盐酸的溶质的质量分数越大,挥发性越强。
雾是小液滴,烟是固体小颗粒,浓盐酸挥发出的氯化氢(HCl )气体与遇空气中的水蒸气形成盐酸小液滴,不是白烟。
(2(3)浓硫酸的特性:吸水性(物)、腐蚀性(化)、脱水性(化,是腐蚀性的一种) (4)浓硫酸的稀释:将浓硫酸沿器壁慢慢倒入装有水的烧杯中,并不断搅拌。
绝不能把水倒入浓硫酸里。因为浓硫酸密度比水大,而且溶于水放出大量的热,如果把水倒入浓硫酸中,水浮在浓硫酸之上,造成局部沸腾。
(5)其他常见的酸:硝酸(HNO 3)、醋酸(CH 3COOH )
2.酸的化学性质(酸具有相似的化学性质是因为酸溶液中都含有H +)
+
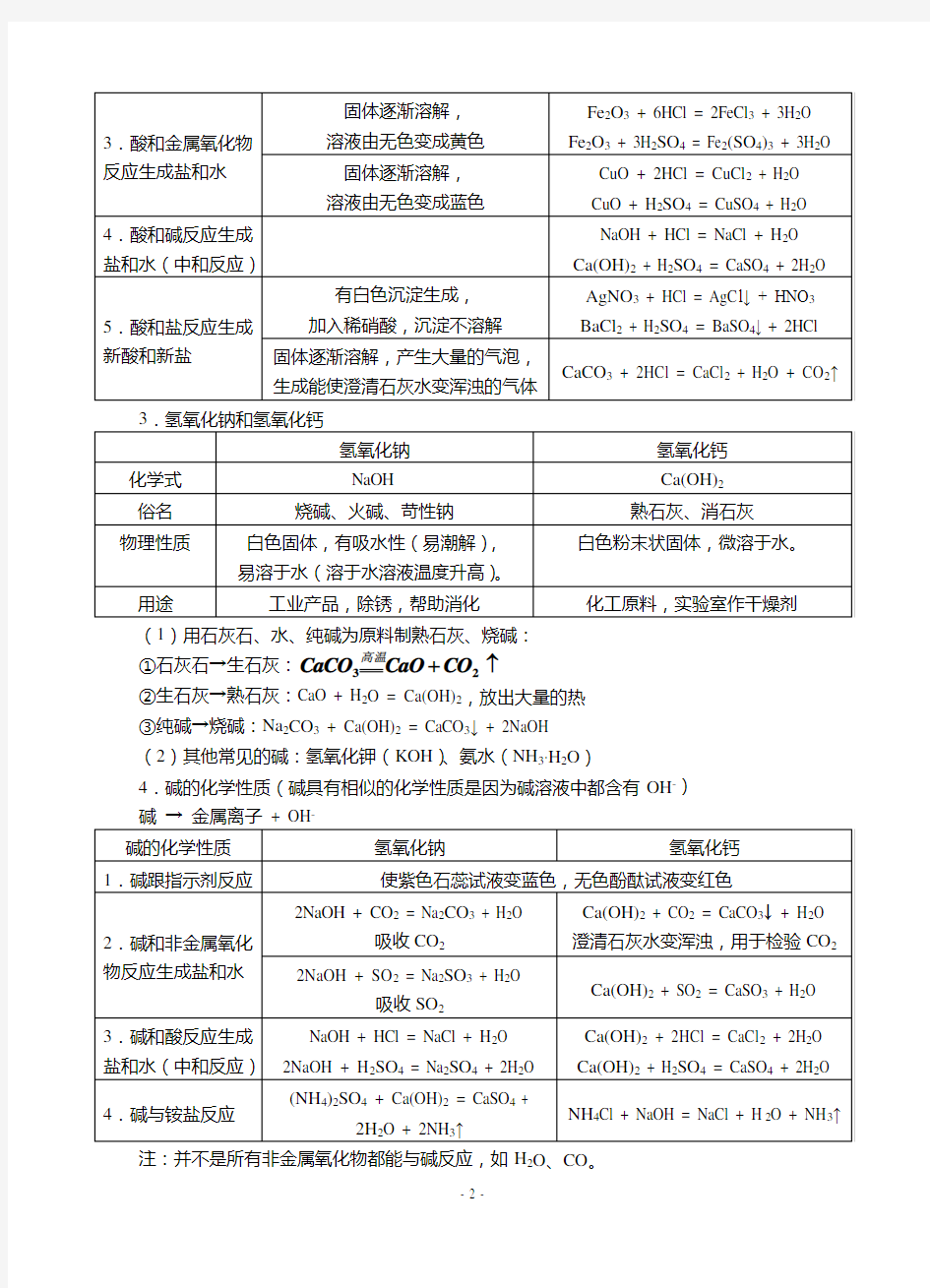
(1)用石灰石、水、纯碱为原料制熟石灰、烧碱: ①石灰石→生石灰:↑+2
3
CO
CaO CaCO
高温
②生石灰→熟石灰:CaO + H 2O = Ca(OH)2,放出大量的热 ③纯碱→烧碱:Na 2CO 3 + Ca(OH)2 = CaCO 3↓ + 2NaOH (2)其他常见的碱:氢氧化钾(KOH )、氨水(NH 3·H 2O )
4.碱的化学性质(碱具有相似的化学性质是因为碱溶液中都含有OH -
)
-注:并不是所有非金属氧化物都能与碱反应,如H 2O 、CO 。
5.浓硫酸、氢氧化钠事故的处理:
(1)浓硫酸:立即用大量的水冲洗,并涂上3%~5%的碳酸氢钠溶液;
(2)氢氧化钠:用较多的水冲洗,并涂上硼酸溶液。
6.常见的干燥剂:
(1)浓硫酸:因能与NH3反应,所以不能用于干燥NH3
(2)氢氧化钠固体:因能与CO2、SO2等反应,所以不能用于干燥CO2、SO2
(3)生石灰:吸收水分,食品的干燥剂,CaO + H2O = Ca(OH)2
(4)铁粉:吸收氧气、水蒸气,抗氧化剂,食品的保鲜剂
7.氢氧化钠固体为什么要密封保存?
(1)氢氧化钠易吸收空气中的水而潮解;
(2)氢氧化钠易吸收空气中的二氧化碳而变质,2NaOH + CO2 = Na2CO3 + H2O
8.中和反应:酸和碱作用生成盐和水的反应。
(1)NaOH + HCl = NaCl + H2O该反应无明显现象,为了便于观察,在NaOH溶液中滴几滴无色酚酞,溶液呈红色,再逐滴滴加稀盐酸,红色逐渐消失,证明NaOH与盐酸发生了反应。
(2)中和反应关键是“酸和碱之间的反应”。
Fe2O3 + 6HCl = 2FeCl3 + 3H2O,CuO + H2SO4 = CuSO4 + H2O,2NaOH + CO2 = Na2CO3 + H2O 以上反应虽然有盐和水生成,但都不是中和反应。
所以说:有盐和水生成的反应不一定是中和反应。
二、酸碱性和酸碱度
1.酸碱性:酸性、碱性、中性。注意:呈酸性不等于一定是酸、呈碱性不等于一定是碱。如纯碱不是碱,但其水溶液呈碱性,pH>7。
2.酸碱度:溶液酸碱性的强弱程度。用pH表示,范围:0~14。
(1)pH = 7 时,溶液呈中性;滴入紫色石蕊试液不变色,滴入无色酚酞溶液不变色;
(2)pH < 7 时,溶液呈酸性;pH越小,酸性越强,越接近7,酸性越弱;滴入紫色石蕊试液变红色,滴入无色酚酞溶液不变色;
(3)pH > 7 时,溶液呈碱性,pH越大,碱性越强,越接近7,碱性越弱;滴入紫色石蕊试液变蓝色,滴入无色酚酞溶液变红色。
3.一些pH变化的图像
4.pH试纸的使用注意事项:
(1)广泛pH试纸只能精确到整数;
(2)不能把pH试纸直接浸入待测液中,以免污染待测液;
(3)能不能事先湿润pH试纸?不能,这样做相当于把待测液稀释了。
若将pH试纸先润湿,对实验结果有什么影响?如果为酸性溶液,则pH偏大;若为碱性溶液,则pH偏小;若为中性溶液,则不影响。
5.雨水的pH:因溶有CO2,生成碳酸:H2O + CO2 = H2CO3,所以正常的雨水呈酸性,pH 约为5.6,若pH < 5.6,则为酸雨。
三、常见的盐(盐→金属离子+ 酸根离子)
1.氯化钠(化学式:NaCl)
(1)俗名:食盐
(2)用途:生理盐水(0.9%)、调味品、消融公路积雪(降低水的熔点)
3.碳酸盐的化学性质
注:①因为Na2CO3、NaHCO3与盐酸反应过快,不便于收集,因此不能用于实验室制取CO2。
②能够治疗胃酸过多的物质:MgO、Mg(OH)2、CaCO3、NaHCO3、Al(OH)3。
四、复分解反应
1.复分解反应的特点:
(1)反应物和生成物都是化合物;(2)反应物之间一定要互相交换成分。
注:①酸、碱、盐之间的反应都是复分解反应,金属氧化物与酸的反应是复分解反应;
②非金属氧化物与碱的反应不是复分解反应,如:2NaOH + CO2 = Na2CO3 + H2O。
2.复分解反应的条件:
(1)两种反应物必须都是可溶的!但难溶于水的金属氧化物、难溶性碱、难溶性的碳酸盐
(2)生成物中有沉淀或水或气体。
常见碱、盐溶解性规律:
①钾钠铵钡钙碱可溶,
②钾钠铵硝酸盐可溶,③盐酸盐不溶氯化银,④硫酸盐不溶硫酸钡,⑤碳酸盐只记钾钠铵。
五、粗盐提纯:粗盐因含CaCl2、MgCl2等杂质而容易潮解。
1.步骤:溶解、过滤、蒸发、计算产率
3.能够用溶解、过滤、蒸发的步骤提纯的混合物由可溶和难溶物质组成。
4.产率评价:
(1)偏低:①过滤时,盛粗盐水烧杯内有残留液体;②蒸发皿、玻璃棒上留有食盐;③蒸发时没有用玻璃棒搅拌,液滴飞溅;④没有分次溶解粗盐;
(2)偏高:蒸发不充分,精盐中含水分较多。
六、化肥简介
1.化肥的分类:氮肥、磷肥、钾肥、复合肥
2.化肥的作用:氮肥→叶、磷肥→根、钾肥→茎。
3.化肥的简易鉴别:
(1)物理方法:
①看:只有氨水是液态的化肥;一般磷肥不是白色晶体;
②闻:有氨臭味的是碳酸氢铵;
③溶:氮肥、钾肥都溶于水,磷肥大部分不溶于水或部分溶于水;铵态氮肥(NH4+)溶于水时,溶液温度降低。
(2)化学方法:
加熟石灰研磨,铵态氮肥能放出具有刺激性气味的气体(有氨臭味的气体)。
七、物质的检验和鉴别
2.为什么要加入稀HNO 3酸化? 为了避免CO 32-的干扰。Na 2CO 3、K 2CO 3等可溶性碳酸盐也能与AgNO 3 、Ba(NO 3)2溶液反应生成白色沉淀,现象与Cl -
、
SO 42-的相同,影响Cl -、SO 42-的检验。加入稀HNO 3酸化后,Ag 2CO 3、BaCO 3等沉淀会溶解,但AgCl 、BaSO 4沉淀不溶解。
3.某未知溶液中SO 42-、Cl -检验的方法:先检验并除去SO 42-、后检验Cl -。 (1)取样,先加入Ba(NO 3)2溶液和稀硝酸,若有白色沉淀生成,证明含有SO 42-
。
(2)过滤(1)所得混合物,在滤液中滴加AgNO 3溶液,若有白色沉淀生成,证明含有Cl -。 注:①若先加AgNO 3溶液,Ag +与SO 42-结合生成的Ag 2SO 4是微溶物,也可能沉淀下来。影响Cl -的检验。所以必须先检验并除去SO 42-,才检验Cl -
。
②检验SO 42-只能用Ba(NO 3)2溶液,不能用BaCl 2、Ba(OH)2溶液,以免Ag +的干扰。 4.NaOH 变质的检验
(1)NaOH 变质的反应:2NaOH + CO 2 = Na 2CO 3 + H 2O
注:①NaOH 与Na 2CO 3都能与稀盐酸反应,根据中和反应优先进行原则,稀盐酸先与NaOH 反应,再与Na 2CO 3反应。如果加入的稀盐酸不足,可能检验不出Na 2CO 3的存在。
②澄清石灰水、Ba(OH)2溶液、可溶性的钙盐、钡盐都能达到目的,若有白色沉淀生成,则证明NaOH 已经变质。
注:③加入可溶性钙盐、钡盐到不再产生沉淀为止。不能用稀盐酸和澄清石灰水、Ba(OH)2
溶液来除去Na 2CO 3,以免影响NaOH 的检验。NaOH + HCl = NaCl + H 2O ,中和反应优先,消耗NaOH ;Na 2CO 3 + Ca(OH)
2 = CaCO 3↓ + 2NaOH ,生成NaOH 。
5.CaO 变质的检验
(1)CaO 长期露置在空气中变质:CaO + H 2O = Ca(OH)2,Ca(OH)2 + CO 2 = CaCO 3 + H 2O
6.Ca(OH)2变质的检验
(1)Ca(OH)2变质的反应:Ca(OH)2 + CO 2 = CaCO 3 + H 2O (因为是固体,所以不用“↓”);
八、需要熟记的物质的(色、味、类别)
1.常见有刺激性气味的气体:SO 2、HCl 、NH 3 2.常见的有颜色固体
(1)黑色固体主要有:炭粉(
C )、铁粉(Fe )、CuO 、MnO 2、Fe 3O 4; (2)红色固体单质:Cu 、红磷;红色固体化合物:Fe 2O 3; (3)有色沉淀:蓝色沉淀Cu(OH)2,红褐色沉淀Fe(OH)3; (4)暗紫色固体:高锰酸钾 3.有色的溶液
(1)蓝色溶液(含有Cu 2+):CuSO 4、CuCl 2、Cu(NO 3)2。(可溶性铜盐溶液) (2)浅绿色溶液(含有Fe 2+
):FeSO 4、FeCl 2、Fe(NO 3)2。(可溶性亚铁盐溶液)
(3)黄色溶液(含有Fe 3+):Fe 2(SO 4)3、FeCl 3、Fe(NO 3)3。(可溶性铁盐溶液) 九、单质、氧化物、酸、碱、盐之间的转化关系
纵向转化:
(1)金属单质 + O 2 → 金属氧化物
MgO O Mg 222=+、322234O Al O Al =+、CuO O Cu 222?
+
(2)金属氧化物(可溶)+ H 2O → 碱(可溶) ()22OH
Ca O H CaO =+、NaOH O H O Na 222=+
(3)碱(难溶)→ 金属氧化物(难溶) + H 2O
()O H CuO
OH
Cu 22+?
(4)酸 + 碱 → 盐 + H 2O O H NaCl HCl NaOH 2+=+
(5)非金属单质 + O 2 → 非金属氧化物
22
2CO O C 点燃
+、22
2SO O S 点燃
+、522
254O P O P 点燃
+
(6)非金属氧化物(易溶)+ H 2O → 酸(易溶)
322
2CO H CO O H =+
(7)酸(易挥发) → 非金属氧化物 + H 2O
↑+=2
23
2CO
O H CO
H
注:从纵向来看,金属单质→金属氧化物→碱→盐,其中金属元素相同,如:Ca → CaO → Ca(OH)2 → CaCO 3;非金属单质→非金属氧化物→(含氧)酸→盐,其中非金属元素相同,如:C → CO 2 → H 2CO 3 → Na 2CO 3。
横向转化:
(8)金属单质 + 非金属单质 → (无氧酸)盐
NaCl Cl
Na 222
点燃+
(9)金属氧化物 + 非金属氧化物 → (含氧酸)盐【不考】 (10)(含氧酸)盐 → 金属氧化物 + 非金属氧化物 ↑+2
3
CO
CaO CaCO
高温
(11)盐(可溶) + 盐(可溶) → 盐 + 盐
3
3
NaNO
AgCl NaCl AgNO
+↓=+、NaCl BaSO
BaCl
SO Na 24
2
42+↓=+
交叉转化:
(12)金属氧化物 + 酸 → 盐 + H 2O O H CuSO
SO H CuO 24
42+=+、O H FeCl
HCl O Fe 23
32326+=+
(13)非金属氧化物 + 碱 → 盐 + H 2O
O H CO
Na CO
NaOH 23
22
2+=+、()O H CaCO
CO
OH
Ca 23
2
2
+↓=+
(14)酸 + 盐 → 新酸 + 新盐
↑++=+2
22
3
2CO
O H CaCl HCl CaCO
、3
3
HNO
AgCl HCl AgNO
+↓=+
(15)碱 + 盐 → 新碱 + 新盐
()NaOH CaCO
OH
Ca CO
Na 23
2
3
2+↓=+、↑++=+3
24NH
O H NaOH NaOH Cl NH
(16)(活泼)金属 + 酸 → 盐 + H 2
↑+=+24
42H ZnSO SO H Zn
(17)金属 + 盐 → 新盐 + 新金属
()Ag NO
Cu AgNO
Cu 222
3
3
+=+
1.以上17条规律的应用: ①可知某物质的性质;
②可知某物质的制法,如:(4)、(8)、(9)、(11)~(17)为盐的10种制取方法 ③可知各类物质间的相互关系。
以上规律是各物质间转化的一般规律,具体到某些物质有些规律要具体分析,未必均能适用。 2.反应规律和反应类型的关系:
①属化合反应的:(1)、(2)、(5)、(6)、(8)、(9) ②属分解反应的:(3)、(7)、(10) ③属置换反应的:(16)、(17)
④属复分解反应:(4)、(11)、(12)、(14)、(15) 规律(13)不属于任何一种基本反应类型,
初中化学中不属于任何一种基本反应类型的反应有: 非金属氧化物 + 碱 → 盐 + H 2O ;
O H CO
O CH
22
2
4
22++点燃
;
O H CO
O OH H C 22
2
52323++点燃
;
2CO Cu CO CuO ++?