
高中化学学习材料
第一学期高二年级第一次月考化学试卷
本试卷分为第一卷(选择题)和第二卷(非选择题)两部分,共100分,测试时间90分钟请将第一卷的答案涂在答题卡上。
可能用到的原子量:H:1;LI:7;Be:9;B:11;C:12;N:14;O:16;F:19;Na:23;Mg:24;Al:27;Si:28;P:31;S:32;Cl:35.5;K:19;Ca:40;Mn:55;Fe:56;Cu:64;Zn:65;Br:80;I:127
第I卷(选择题,共60分)
一、选择题(本题包括20个小题,每题3分,共60分。每题只有一个选项符合题意)
1、在相同温度和压强下,将32g硫分别在纯氧中和空气中完全燃烧,令前者热效应为△H1,后者热效应为△H2,则关于△H1和△H2的相对大小正确的是()
A、△H1=△H2
B、△H1>△H2
C、△H1<△H2
D、无法判断
2、根据热化学方程式:S(l)+O2(g) SO2(g); △H=-293.23kJ/mol分析下列说法中正确的是()
A、S(s)+O2(g) SO2(g),反应放出的热量大于293.23kJ/mol
B、S(g)+O2(g) SO2(g),反应放出的热量小于293.23kJ/mol
C、1mol SO2的键能的总和小于1mol硫和1mol氧气的键能之和
D、1mol SO2的键能的总和大于1mol硫和1mol氧气的键能之和
3、在25°C、101kPa下,1g甲醇燃烧生成CO2和液态水放热22.68kJ,下列热化学方程式正确的()
A、CH3OH(l)+3/2O2=CO2(g)+2H2O(l);△H =+725.8kJ/mol
B、2CH3OH(l)+3O2=2CO2(g)+4H2O(l);△H =-1452kJ/mol
C、2CH3OH(l)+3O2=2CO2(g)+4H2O(l);△H =-725.8kJ/mol
D、2CH3OH(l)+3O2=2CO2(g)+4H2O(l);△H =+1452kJ/mol
4、 100ml 浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢
气总量,可采用的方法是
A.加入少量浓盐酸
B.加入几滴氯化铜溶液
C.加入适量蒸馏水
D.加入适量的氯化钠溶液
5、下列关于电解法精炼粗铜的叙述中正确
..的是()
A、精铜板作阴极,纯铜片作阳极,CuSO4溶液作电解液
B、电解时,阴极发生氧化反应,则阴极发生的反应为: Cu2+ +2e— Cu
C、粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥
D、电解铜的纯度可达99.95%~99.98%
6、若在铜片上镀银时,下列叙述正确的是()
①将铜片接在电源的正极上②将银片接在电源的正极上③在铜上发生的反应是:Ag++e— Ag ④在银片上发生的反应是:4OH—-4e— O2↑+2H2O ⑤需用硫酸铜溶液为电镀液⑥需用硝酸银溶液为电镀液
A、①③⑥
B、②③⑥
C、①④⑤
D、②③④⑥
7、有一电解池中X,Y分别是直流电源的两极,通电后发现a极(连X)板质量增加,b极(连Y)板处有无色无臭气体放出,符合这一情况的是附表中的()
附表可供选择的极板、电极和溶液组
组合a极板b极板X电极Z溶液
A 锌石墨负极CuSO4
B 石墨石墨负极NaOH
C 银铁正极AgNO3
D 铜石墨负极CuCl2
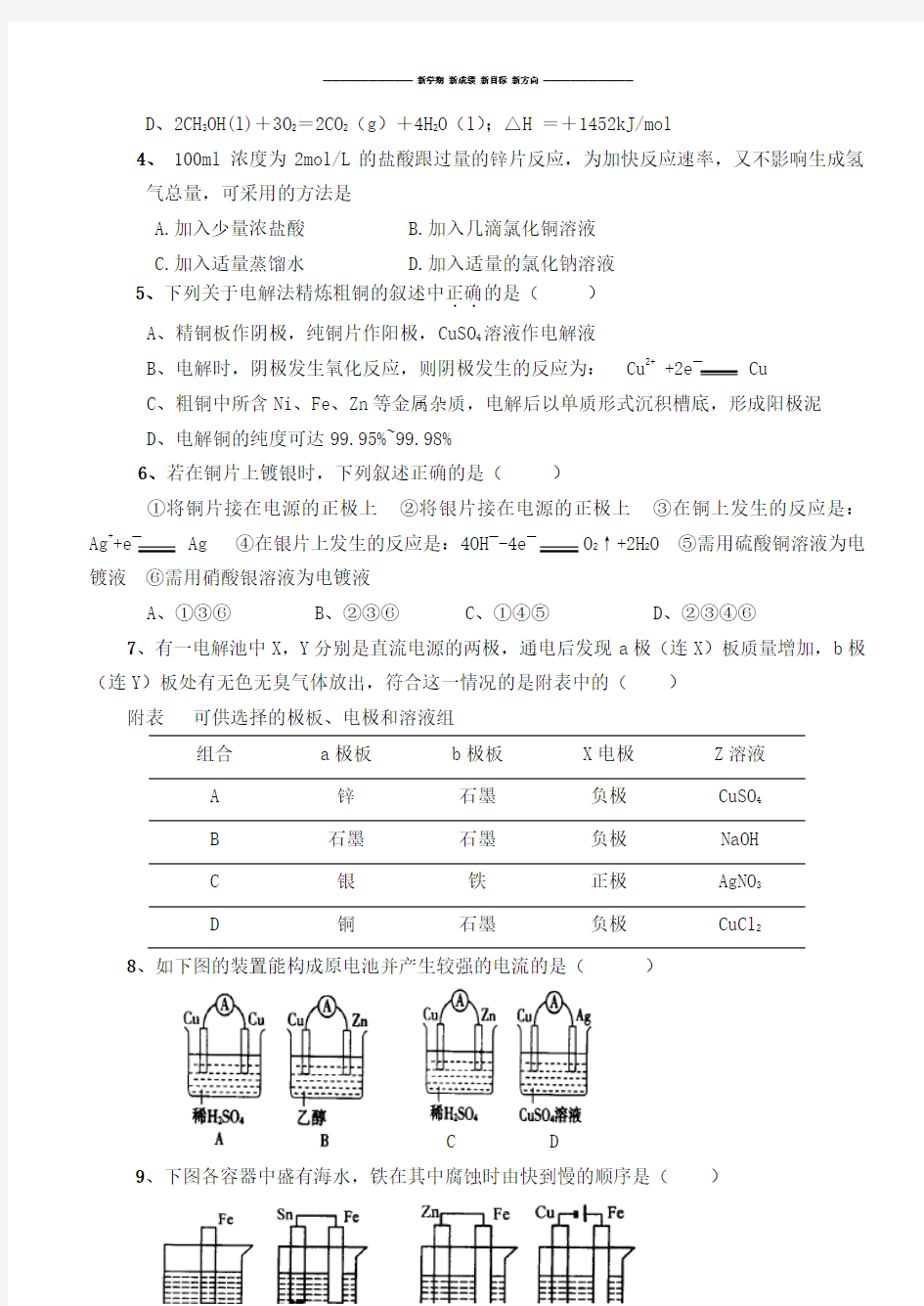
8、如下图的装置能构成原电池并产生较强的电流的是()
C D
9、下图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是()
A 、(4)>(2)>(1)>(3)
B 、(2)>(1)>(3)>(4)
C 、(4)>(2)>(3)>(1)
D 、(3)>(2)>(4)>(1)
10、某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl 2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A 、a 为正极,b 为负极;NaClO 和NaCl
B 、a 为负极,b 为正极;NaClO 和NaCl
C 、a 为阳极,b 为阴极;HClO 和NaCl
D 、a 为阴极,b 为阳极;HClO 和NaCl
11、右图是电解CuCl 2溶液的装置,其中c 、d 为石墨电极。则下列有关的判断正确的是( ) A 、a 为负极、b 为正极
B 、a 为阳极、b 为阴极
C 、电解过程中,d 电极质量增加
D 、电解过程中,氯离子浓度不变 12、以下现象与电化腐蚀无关的是( ) A 、黄铜(铜锌)制作的铜锣不易产生铜绿
B 、生铁比纯铁易生锈
C 、铁质器件附有铜质配件,在接触处易生铁锈
D 、银质奖牌久置后表面变暗
13、关于金属腐蚀的如下各叙述中,正确的是( )
A 、金属被腐蚀的本质是:M+nH 2O=M(OH)n +
2
n
H 2↑ B 、马口铁(锡铁)镀层破损后被腐蚀时,首先是镀层被氧化 C 、金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀 D 、常温下,置于空气中的金属主要发生化学腐蚀
14、有甲、乙、丙、丁四种金属。将甲、乙用导线相连放入稀H 2SO 4中可以看到乙慢慢地溶解,而甲的表面有气体逸出。把丁放到乙的硝酸盐溶液中后,丁的表面覆盖一层乙的单质。用石墨电极电解含相同物质的量浓度的甲和丙两种金属的盐溶液,丙的单质先析出。将甲放入稀
盐酸中有H 2析出。已知四种金属中有一种是铜。根据以上实验判断铜是( )
A 、甲
B 、乙
C 、丙
D 、丁
15.如图所示装置中,a 、b 都是惰性电极,通电一段时间后,b 极附近溶液呈红色,则下列说法正确的是( ) A .x 是正极,y 是负极,CuSO 4溶液的pH 逐渐减小 B .x 是正极,y 是负极,CuSO 4溶液的pH 保持不变 C .x 是负极,y 是正极,CuSO 4溶液的pH 逐渐减小
D .x 是负极,y 是正极,CuSO 4溶液的pH 保持不变 16.已知25℃、101kPa 条件下:
4Al(s)+3O 2(g) 2Al 2O 3(s);△H=-2834.9kJ ·mol -1
4Al(s)+2O 3(g) 2Al 2O 3(s);△H=-3119.1kJ ·mol -1 由此得出的正确结论是( )
A .等质量的O 2比O 3能量低,由O 2变O 3为吸热反应
B .等质量的O 2比O 3能量低,由O 2变O 3为放热反应
C .O 3比O 2稳定,由O 2变O 3为吸热反应
D .O 2比O 3稳定,由O 2变O 3为放热反应
17、化学反应可视为旧键断裂和新键形成的过程。共价键的键能是原子间形成1mol 共价键(或其逆过程)时释放(或吸收)的能量。已知H —H 键的键能为436kJ ·mol -1
,Cl —Cl 键的键能为243kJ ·mol -1
,H —Cl 键的键能为431kJ ·mol -1
,则H 2(g )+Cl 2(g ) 2HCl (g )的反应热(△H )等于( )
A .183kJ ·mol -1
B .-183kJ ·mol
-1
C .-862kJ ·mol -1
D .862kJ ·mol
-1
18.将反应Zn+Br 2=ZnBr 2设计成蓄电池,则下列有关说法不正确...的是( ) A .电解质溶液不可以用强酸 B .放电时,负极的电极反应式为:Zn -2e -
=Zn 2+
C .电解质溶液肯定不能用强碱
D .充电时,阳极的电极反应式为:Zn 2+
+2e -=Zn
19.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。
其电池反应为:2CH 3OH + 3O 2 + 4OH — 2CO 32—
+ 6H 2O ,则下列说法错误的是( ) A.放电时CH 3OH 参与反应的电极为正极
B.充电时电解质溶液的pH 逐渐增大 C .充电时每生成1 mol CH 3OH 转移6 mol 电子
D .放电时负极的电极反应为:CH 3OH -6e - +8OH - = CO 32—
+ 6H 2O
放电 充电
20.固体氧化物燃料电池是由美国西屋(West-inghouse )
公司研制开发的。它以固体氧化锆一氧化钇为电解质, 这种固体电解质在高温下允许氧离子(O 2-
)在其间 通过。该电池的工作原理如右图所示,其中多孔电极 a 、b 均不参与电极反应。下列判断正确的是( )
A .有O 2放电的a 极为电池的负极
B .有H 2放电的b 极为电池的正极
C .a 极对应的电极反应为O 2+2H 2O +4e -
=4OH -
D .该电池的总反应方程式为2H 2+O 22H 2O
高二年级第一次月考化学试卷
(答题卷)
一、选择题(每小题有一个正确答案,每小题3分,共60分) 第二卷(非选择题,共40分)
二、填空题(共40分)
21.(10分)如图为相互串联的甲乙两个电解池,请回答: (1)甲池若为用电解精炼铜的装置,A 极是______,材料是___ _,电极反应为___________ ___,
B 极是___ __,材料是__ __,电极反应为______ ________, 电解质溶液为_________。
(3)若甲槽阴极增重12.8g ,则乙槽阴极放出气体在标准状
况下的体积为_________。
(4)若乙槽剩余液体为400mL ,则电解后得到碱液的物质的
量浓度为__________ 。
题号 1 2 3 4 5 6 7 8 9 10 答案
题号 11 12 13 14 15 16 17 18 19 20 答案
A
B Fe C
甲 乙 NaCl 溶液
班级 姓名 学号 考场号
密 封 线 内 不 得 答 题
22.(12分)如下图(a)为持续电解稀BaCl2水溶液的装置(以铂为电极,A为电流表),电解一段时间后,从图(b)1小时起将CO2连续通入电解液中,请在图(b)中完成实验(a)中电流对时间的变化关系图,并回答有关问题。
(1)完成实验(a)中电流对时间的变化关系图。
(2)电解时F极发生反应,电极反应式为;
E极发生反应,电极反应式为;
电解总方程式为。
(3)电解池中产生的现象:
①
②
③。
23.(10分)2003年10月15日,我国成功发射“神舟五号”载人飞船。这标志着我国在航天领域的重大突破:
(1)肼(N2H4)是发射航天飞船常用的高能燃料。一般将液太N2O4作为火箭的推进剂。已知1mol液态肼与足量液态N2O4完全反应放出QkJ的热量,产物是对环境无害的氮气和水蒸气。写出该反应的热化学方程式。但实际发射过程中会看到有大量红色的烟雾,除了该反应可能产生少量NO外,产生此现象的原因可能是。
(2)实际上,最理想的燃烧热大,体积小,本身毒性小、安全的固态氢,目前人们还不能制得固态氢,因为。
(3)新型无机材料在航天工业中也有广泛应用。如飞船表面覆盖有一种耐高温的氮化硅陶瓷,该物质中各原子均满足最外层8电子结构,则氮化硅的化学式为。
(4)飞船上的能量主要来自于太阳能和燃料电池。常用的燃料电池是氢氧燃料电池,已知负极的反应式为:2H2-4e—+4OH 4H2O,正极的反应式为。
24:(8分)(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N
和水蒸气, 已知
2
Δ1= +67.7kj/mol
N2(g)+2O2(g)=2NO2(g),H
Δ2 = —534kj/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g),H
Δ3= —484kj/mol
2H2(g) +O2(g) =2H2O(g), H
试写出N2H4与 NO2反应的热化学方程式。
(2) 1 g丙烷和1 g丁烷完全燃烧,放出的热量都是50 kJ,设若某石油液化气由丙烷和丁烷组成。其质量分数分别为80%和20%。
(1)它们燃烧的热化学方程式分别为:_____________________ ____,
。
(2)有一质量为0.80 kg,容积为4.0L的铝壶,将一壶20℃的水烧开需消耗石油液化气 kg. [假设热量利用率为60%,水的比热为+4.2kJ/(kg·℃),铝的比热为
0.88kJ/(kg·℃)]
B C B B D B A C A B C D C C A A B D A D
21、((1)阴极(1分)纯铜(1分)Cu2++2e–== Cu(1分)阳极(1分),粗铜(1分)Cu–2e –== Cu2+(1分),CuSO
-1(2分)
4溶液(1分)。(3)4.48L(1分)(4)1mol·L
22\答案:(12分)(1)(1分)
(2)氧化(1分)2Cl-2e—、=Cl2↑;(1分)还原(1分)2H++2e—=H2↑(1分)
BaCl2+2H2O= Cl2↑+H2↑+ Ba(OH)2 ;(1分)
(3)①通CO2时先产生白色沉淀,后又溶解完全;②F极放出黄绿色气体,E极放出无色气体;③E极附近溶液变为红色(每空2分)
23.解析:(1)热化学方程式注意注明物质的聚集状态,放出热量焓变为负,吸收热量焓变为正,以及焓变的大小与计量数成正比。N2O4存在可逆反应:N2O4 2NO2,部分N2O4转化为NO2 。
(2)H2熔、沸点很低,制备时需要极高的压强。
(3)各原子均满足最外层8电子结构,则Si与四个N形成四条共价键,N与三个Si形成三条共价键,化学式为Si3N4 。
(4)由负极的反应式可知电解液为强碱,正极反应式:O2+4e-+2H2O=4OH-。正极生成了OH-pH 相对较大。
23答案:(10分)(1)N 2O 4(l )+2N 2H 4(l )=3N 2(g )+4H 2O (g );△H=-2QkJ/mol (2分)部分N 2O 4转化为NO 2(2分)
(2)因为制备时需要极高的压强(其它合理答案均给分)(2分) (3)Si 3N 4(2分) (4)O 2+4e -+2H 2O=4OH -
(2分)
24、2N 2H 4(g)+2NO 2(g)=3N 2(g)+4H 2O(g) ΔH =–1135.7 kJ ·mol -1
(2分)
(1))(4)(3)(5)(22283g O H g CO g O g H C +?→?
+ △H=-2200 kJ/mol )(10)(8)(13)(2222104g O H g CO g O g H C +?→?+ △H=-2900 kJ/mol
(2)0.056kg