
植物组织中叶绿素含量测定
(无机及分析化学实验II-设计性实验)
一、实验目的
1.设计用分光光度计测定植物组织中的叶绿素
2. 学习利用文献资料设计研究方案
3. 掌握分光光度计测定植物组织中的叶绿素的原理与方法
二、原理:
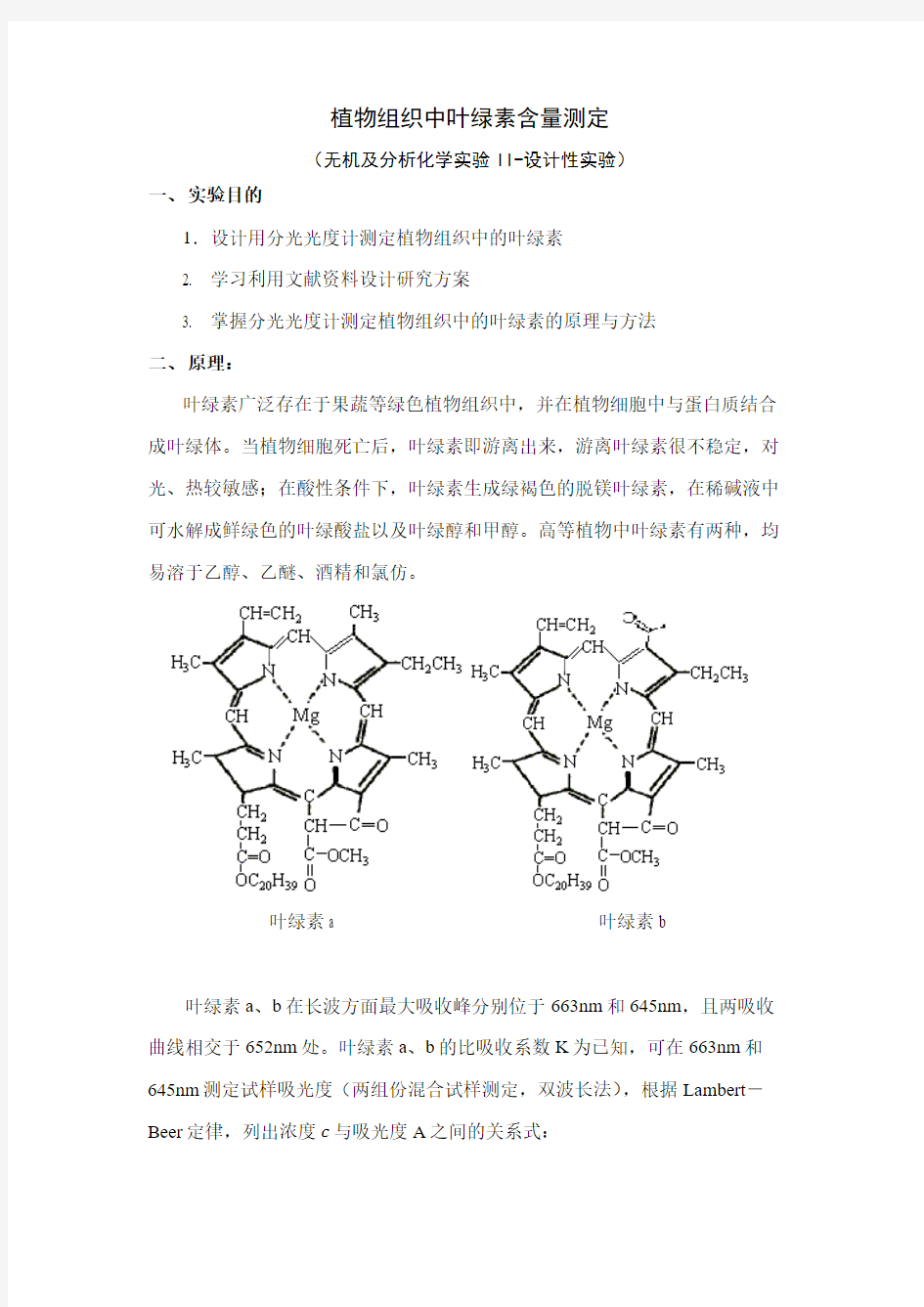
叶绿素广泛存在于果蔬等绿色植物组织中,并在植物细胞中与蛋白质结合成叶绿体。当植物细胞死亡后,叶绿素即游离出来,游离叶绿素很不稳定,对光、热较敏感;在酸性条件下,叶绿素生成绿褐色的脱镁叶绿素,在稀碱液中可水解成鲜绿色的叶绿酸盐以及叶绿醇和甲醇。高等植物中叶绿素有两种,均易溶于乙醇、乙醚、酒精和氯仿。
叶绿素a 叶绿素b
叶绿素a、b在长波方面最大吸收峰分别位于663nm和645nm,且两吸收曲线相交于652nm处。叶绿素a、b的比吸收系数K为已知,可在663nm和645nm测定试样吸光度(两组份混合试样测定,双波长法),根据Lambert-Beer定律,列出浓度c与吸光度A之间的关系式:
A663=82.04c a+9.27c b (1)
A645=16.75c a+45.6c b (2)
(1)、(2)式中的A663、A645为叶绿素溶液在波长663nm和645nm时的吸光度度。
c a、c b为叶绿素a、b的浓度,单位为g/L。
82.04、9.27为叶绿素a、b在波长663nm时的比吸收系数
16.75、45.6为叶绿素a、b在波长645nm时的比吸收系数。
解方程式(1)(2),则得经验公式:
c a=12.7 A663-2.69 A645 (3)
c b=22.9 A645-4.68 A663 (4)
c T=(c a + c b)=20.2 A645+8.02 A663...... (5)
此时,c T为总叶绿素浓度,c a、c b为叶绿素a、b的浓度,单位为mg/L ,利用上面(3)(4)(5)式,即可以计算a、b总叶绿素的浓度。
仪器:分光光度计、电子天平、棕色容量瓶(如使用白玻容量瓶,可用报纸遮光)、小漏斗、滤纸
试剂:95%乙醇
三、实验步骤
1、试材的采集
采集新鲜植株叶片(或含叶绿素的其他组织),夹于双层报纸中,风干(不能置于太阳光下晒)。将风干材料处理成细小颗粒,装入封口塑料袋,避光保存。
2、待测液的制备
(1)叶绿素的浸提
精密称定风干后的样品(约0.1g)于20mL 95%乙醇中,在室温浸提36-48h。
(2)叶绿素浸提液定容
提取液过滤到50mL棕色容量瓶(如使用白玻容量瓶,可用报纸遮光),用95%
乙醇定容至50mL ,摇匀,置于暗处备用待测。 3、测量吸光度
取1cm 的比色皿,注入上述叶绿素酒精溶液,用95%乙醇为参比液,1cm 的比色皿为吸收池,分别在663nm 和645nm 波长测吸光度,每一波长读三次数,取平均值带入公式计算。如吸光度大于0.8,按倍数准确稀释(稀释倍数为n ),尽量使吸光度的测量值在0.2-0.8范围内。 4、结果计算
用测得的吸光度 A 663、 A 645,代入(3)式计算溶液中叶绿素a 的含量;代入(4)式中计算得到叶绿素b 的含量,代入(5)式计算得到叶绿素总含量。 计算植株中叶绿素含量时,需要考虑稀释因子。 数据记录及处理: 表1
表2
17周星期一、星期二(全天开放)采集新鲜树叶并把样品带到实验室来领塑料密封的试管,然后称量0.1g 新鲜样品用研钵磨碎,并用少量酒精洗涤并转移到塑料密封试管,稀释到50mL 的刻度,带回家避光保存,并于星期三,星期四(全天开放)带到实验室测定吸光度,并计算浓度含量,交实验报告批改后登记成绩。
-1
T mg L (mL)10001000100%
T c V w m ??=
?样
()
植物叶绿素类胡萝卜素测定方法 叶绿素、类胡萝卜素含量的测定 一、原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A,αCL式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 二、材料、仪器设备及试剂 (一)材料:新鲜(或烘干)的植物叶片。 (二)仪器设备:1)分光光度计;2)电子顶载天平(感量0.01g);3)研钵;4)棕色容量瓶; 5)小漏斗;6)定量滤纸;7)吸水纸; 8)擦境纸;9)滴管。 (三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉。暗中2h,0.5g,25ml 三、实验步骤 1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀。
2)将取好的样品放入25ml容量瓶中,加混合浸提液(无水乙醇:丙酮 =5:5)20ml,放在黑暗条件下,浸泡至叶片发白,用浸提试剂定容至25ml,摇匀备用。 3)把叶绿体色素提取液倒入1cm光径的比色皿内,以浸提试剂为空白测定吸光度。选择波长663 646 和470nm。 四、实验结果计算 叶绿素a的浓度 = 12.21 , OD– 2.81 , OD 633 646 叶绿素b的浓度 = 20.13 , OD– 5.03, OD646663 类胡萝卜素浓度=(1000A-3.27C-104C)?229 单位 mg/L 470ab C(mg/L)*提取液总量(ml) 叶绿体色素含量(mg/g)= ____________________________ 烟叶重量(g)*1000 注意事项:操作避光研磨时间短些
叶绿素含量的测定 一、原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 二、材料、仪器设备及试剂 (一)材料:新鲜(或烘干)的植物叶片。 (二)仪器设备:1)分光光度计;2)电子顶载天平(感量0.01g);3)研钵;4)棕色容量瓶; 5)小漏斗;6)定量滤纸;7)吸水纸; 8)擦境纸;9)滴管。 (三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉。暗中2h,0.5g,25ml 三、实验步骤 1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀。 2)称取剪碎的新鲜样品 0.2g ,共3份,分别放入研钵中,加少量石英砂和碳酸钙粉及2~3ml 95%乙醇,研成均浆,再加乙醇10ml,继续研磨至组织变白。静置3~5m 3)取滤纸1张,置漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗中,过滤到25ml棕色容量瓶中,用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。 4)用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入容量瓶中。直至滤纸和残渣中无绿色为止。最后用乙醇定容至25ml,摇匀。 5)把叶绿体色素提取液倒入光径1cm的比色杯内,以95%乙醇为空白,在波长663nm 和645nm下测定吸光度。在波长663nm、645nm下或652nm测定吸光度。 四、实验结果计算 叶绿素a的含量 = 12.7 ? OD 663 – 2.69 ? OD 645 叶绿素a的含量 = 22.9 ? OD 645 – 4.86 ? OD 663 叶绿素a、b的总含量 = 8.02 ? OD 663 + 20.20 ? OD 645
% 100Wf d -f ?鲜重干重鲜重W W % 100d d -f ?W W W 干重干重鲜重植物组织含水量的测定 【实验目的】 1.了解含水量的表示方法; 2.了解绝对含水量和相对含水量的区别 3.掌握植物组织鲜重干重的测量方法 【实验原理】 植物组织的含水量是反映植物组织水分生理状况的重要指标,其直接影响植物的生长、气孔状况,光合功能及作物产量。在环境胁迫情况下,植物组织的含水量也是反映植物受胁迫程度的重要指标之一。水分含量测定也是农作物产品的品质检定和判断其是否适于贮藏的重要标准。所以,植物组织含水量的测定在植物生理学研究及农业生产中具有重要的理论和实践意义。 植物组织含水量的表示方法常以鲜重、干重、相对含水量(或称饱和含水量)来表示。 其中相对含水量可作为比较植物保水能力及推算需水程度的指标。 分别测量植物组织的鲜重Wf ,干重Wd ,饱和鲜重Wt ,依据以下公式可以分别算出植物组织的鲜重含水量,干重含水量,以及相对含水量。 鲜重含水量= 干重含水量= 相对含水量=% 100Wf -Wt d -f ?鲜重饱和鲜重干重鲜重W W 【实验材料】 蜀葵花瓣 【实验步骤】 1.将新采的蜀葵花瓣,称取6 份 0.5 g (Wf ) ,迅速剪成小块。 2.3份分别于120℃烘箱中烘考1~1.5 h ,然后称此时的干重(Wd )。 3.3份分别放入蒸馏水中浸泡70 min ,当达到恒重时称此时的重量(Wt ) 利用所得到的数据:Wf ,Wd ,Wt 分别计算出鲜重含水量,干重含水量,相对含水量 注意事项: 1.测量干重时,先测出称量瓶的重量W ,在测出称量瓶与花瓣重量的总和Wf 与Wd 。放入瓶中以后,花瓣不再取出。烘烤一个小时后取出冷却至室温,称量,再放入烘箱中烘烤10分钟,取出冷却至室温,再次称量。重复以上步骤,直至总重量恒重。 2.放入蒸馏水浸泡的花瓣,可以用吸水纸将其覆盖在水中。另取两片花瓣同样的方式浸泡在水中。70min 后称量两片对照物花瓣,其恒重可作为实验材料也恒重的标志。 【实验结果】 蜀葵花瓣的含水量测定数据记录如下:
实验报告 植物生理学及实验(甲)实验类型:课程 名称:实验名称:叶绿体色素的提取、分离、理化性质和叶 绿素含量的测定姓名:专业:学 号:指导老师:同组学生姓名: 实验日期:实验地点: 二、实验内容和原理一、实验目的和要求装 四、操作方法与实验步骤三、主要仪器设备订 六、实验结果与分析五、实验数据记录和处理 七、讨论、心得一、实验目的和要求、掌握植物中叶绿体色素的分离和 性质鉴定、定量分析的原理和方法。1 和b的方法及其计算。a2、熟悉在 未经分离的叶绿体色素溶液中测定叶绿素二、实验内容和原理以青菜为 材料,提取和分离叶绿体色素并进行理化性质测定和叶绿素含量分析。 原理如下:80%的乙醇或95%叶绿素和类胡萝卜素均不溶于水而溶于有机溶剂,1、常用的丙酮提取。、皂化反应。叶绿素是二羧酸酯,与强碱反应, 形成绿色的可溶性叶绿素2. 盐,就可与有机溶剂中的类胡萝卜素分开。- COOCHCOO3 Mg + 2KOH C32H30ON4Mg + 2KOH +CH3OH
HONC43230+C20H39OH 、3H+可依次被在酸性或加温条件下,叶-COOCOOCH39 20 绿素卟啉环中的Mg++取代反应。Mg2+, Cu2+ 取代Cu++取代形成褐色的去镁叶绿素和绿色的铜代叶绿素。(H+和H+ ) 取代(Zn2+) 绿色褐色 、叶绿素受光激发,可发出红色荧光,反射光下可见红色荧光。4645其中叶绿素吸收红光和兰紫光,红光区可用于定量分析,5、定量分析。 652可直接用于总量分析。663用于定量叶绿素a,b及总量,而和C最大吸收光谱不同的两个组分的混合液,它们的浓度根据朗伯-比尔定律, *k+C*kOD=Ca*k与吸光值之间有如下的关系: OD=Ca*k+C b2 1g/L和b的80查阅文献得,2b1 b1a1a2b时,比吸收系%丙酮溶液,当浓度为 叶绿素a 值如下。数k k 比吸收系数波长/nm b 叶绿素a 叶绿素 9.27 82.04 663 45.60 645 16.75
叶绿素含量的测定 一.实验原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。 根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL.式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。 如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。就是吸光度的加和性。如欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 植物叶绿素含量测定----丙酮提取法 高等植物光合作用过程中利用的光能是通过叶绿体色素(光合色素)吸收的。叶绿体色素由叶绿素a、叶绿素b、胡萝卜素和叶黄素组成。叶绿体色素的提取、分离和测定是研究它们的特性以及在光合中作用的第一步。叶片叶绿素含量与光合作用密切相关,是反眏叶片生理状态的重要指标。在植物光合生理、发育生理和抗性生理研究中经常需要测定叶绿素含量。叶绿素含量也是指导作物栽培生产和选育作物品种的重要指标。 ● 叶绿素不溶于水,溶于有机溶剂,可用多种有机溶剂,如丙酮、乙醇或二甲基亚砜等研磨提取或浸泡提取。叶绿色素在特定提取溶液中对特定波长的光有最大吸收,用分光光度计测定在该波长下叶绿素溶液的吸光度(也称为光密度),再根据叶绿素在该波长下的吸收系数即可计算叶绿素含量。 ●利用分光光计测定叶绿素含量的依据是Lambert-Beer定律,即当一束单色光通过溶液时,溶液的吸光度与溶液的浓度和液层厚度的乘积成正比。其数学表达式为: ●A=Kbc 式中:A为吸光度;K为吸光系数;b为溶液的厚度;c为溶液浓度。 ●叶绿素a、b的丙酮溶液在可见光范围内的最大吸收峰分别位于663、645nm处。叶绿素a 和b在663nm处的吸光系数(当溶液厚度为1cm,叶绿素浓度为g·L-1时的吸光度)分别为82.04和9.27;在645nm处的吸光系数分别为16.75和45.60。根据Lambert-Beer定律,叶绿素溶液在663nm和645nm处的吸光度(A663和A645)与溶液中叶绿素a、b和总浓度(a+b)(Ca、Cb 、Ca十b,单位为g·L-1),的关系可分别用下列方程式表示: ●A663=82.04C a+9.27C b (1) ●A645=16.76C a+45.60C b(2) ●C a=12.7 A663—2.59 A645(3) ●C b=22.9 A645—4.67 A663 (4) ●C a十b=20.3 A645—8.04 A663 (5) ●
叶绿素含量的测定 一、原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。 根据朗伯—比尔定律,某有色溶液的吸光度A 与其中溶质浓度C 和液层厚度L 成正比,即A =αCL 式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm 时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。 如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a 、b 和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A ,并根据叶绿素a 、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a 、b 时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 已知叶绿素a 、叶绿素b 的80%丙酮溶液在红外区的最大吸收峰分别位于663、645nm 处。已知在波长663nm 下叶绿素a 、叶绿素b 在该溶液中的吸光系数的分别为82.04和9.27;在波长645nm 处的吸光系数分别为16.75和45.60。根据加和性原则列出以下关系式: A663=82.04Ca+9.27Cb (1) A645=16.76Ca+45.60Cb (2) 式(1) (2)A 663nm 和A645nm 为叶绿素溶液在663nm 和645nm 处的吸光度,C a C b 分别为叶绿素a 、叶绿素b 的浓度,以mg/L 为单位。 解方程(1) (2)组得 C a =12.72 A 663—2.59 A 645 (3) C b =22.88 A 645—4.67 A 663 (4) 将C a +C b 相加即得叶绿素总量C T C T = C a 十C b =20.29A 645—8.05 A 663 (5) 从公式(3)、(4)、(5)可以看出,,就可计算出提取液中的叶绿素a 、b 浓度另外,由于叶绿素a 叶绿素b 在652nm 的吸收峰相交,两者有相同的吸光系数(均为30.5),也可以在此波长下测定一次吸光度(A 652)而求出叶绿素a 、叶绿素 b 总量 所测定材料的单位面积或单位重量的叶绿素含量可按下式进行计算: C T = 5 .341000 652 A (6) 有叶绿素存在的条件下,用分光光度法可同时测出溶液中类胡萝卜素的含量。Licht-enthaler 等对Arnon 进行了修正,提出了 80%丙酮提取液中3种色素含量的计算公式: C a =12.21A 663—2.59 A 646 (7)
叶绿素a测定复习试题 一、填空题 1.叶绿素a的测定方法有和,环境监测(生物)技术规范中规定用。 答:分光光度法;荧光光度法;分光光度法; 2.地表水环境质量标准(GHZB1-1999)中,对控制湖泊水库富营养化的特定项目之一叶绿素a作了明确规定:Ⅰ类水质的标准值为,Ⅱ类水质的标准值为,Ⅲ类水质的标准值为,Ⅳ类水质的标准值为,Ⅴ类水质的标准值为。 答:≤0.001mg/L;≤0.004mg/L;≤0.01mg/L;≤0.03mg/L;≤0.065mg/L。 3.进行生物样品污染物测定的样品处理可概括为二个过程:第一步是将样品 、、;第二步是将前一步处理过的样品 以消除干扰,提高被测组分的浓度。 答:分离;纯化;浓缩;分解消化或提取。 4.经丙酮浸取含有叶绿素a的溶液,以溶液为参比,在波长、 、、下测定吸光度。在波长测定丙酮溶液的空白值。丙酮溶液空白值应不大于。 答:丙酮;663nm;645nm;630nm;750nm;0.05。 5.经离心后的样品上清液,在750nm处测定吸光度,用以校正提取液的,当测定用1cm比色皿,吸光度超过时,提取液应。答:浊度;0.005;重新离心。 二、问答题 1. 控制叶绿素a指标值的意义是什么? 答:叶绿素a是反映水体富营养化的一个重要指标。控制叶绿素a就在于控制富营养化和藻类生物量,从而揭示湖库富营养化发生的内在实质。
2. 叶绿素a的涵义是什么? 答:指水中藻类具有光合色素的叶绿素。 3.什么叫富营养化? 答:营养物质特别是含氮和磷的化合物,在淡水或盐水中的富集。富营养化加速了藻类和较高等植物的生长。 4.评定水质富营养化的几种类型标准是什么? 答:参照国际经济合作与发展组织(OECD)规定和关于评定湖泊富营养化状态的叶绿素a划分标准:以≥78μg/L为重富营养型;11—78μg/L为富营养型;3.0—11μg/L为中营养型;<3.0μg/L为贫营养型。 5.用于叶绿素a测定的水样应如何保存? 答:每升水样加1%碳酸镁悬浊液1ml,以防止酸化引起色素溶解。如不能立即测定,则应在低温(0—4℃)避光保存。 6.叶绿素a测定方法的原理是什么? 答:原理是:以丙酮溶液提取浮游植物色素,浸取液经过滤离心后,依次在663、645、630nm波长下测定吸光度,按Jettrey—Humphrey方程式计算,可得出叶绿素a的含量。 7.一般用于测定叶绿素a的样品采集多少量较合适? 答:通常采样体积可根据水中叶绿素a含量的高低来确定,一般可采取1.5—2升。按浮游植物采样方法,湖泊、水库采样500毫升,池塘300毫升,按海洋监测方法规定,海水采取2—5升。 8.什么叫中营养水? 答:天然发生的,或由于营养累积形成的中等营养状态的水,及介于贫营养和富营养之间的水。 9.什么叫贫营养水? 答:贫营养物且含高浓度腐殖质的水。
土壤水份和植物组织含水量的测定 实验的目的与要求: 通过对植物和土壤水分的测定来学习和使用烘干法水分测定仪,掌握实验和实习的技巧,了解一定的实习的规则! 通过对实习数据的比较,以及结合自身的知识来分析土壤和植物组织含水量的关系,了解水分对植物生长的影响,了解土壤中水分对植物生长的影响。 结合生态学的知识来分析土壤和植物含水量受整个生态系统的影响。 实验的主要内容: 记录实验地的周围环境的各种生态环境因素,如温度,风向,湿度。 测量土壤和植物组织含水量值,在不同的环境下测量对比,同一环境下不同物种的值。 记录实验测量的数据值,分析得出结论。 实习的主要工具: 1.烘干法水分测定仪(LSH-100A型): 最大秤量:100g 实际标尺分度值:1mg 准确度级别:2级 水分测量允许误差:±0.2%(样品≥2克) 水分含量测定可读性:0.01% 测量水分范围:0~100% 加热源:卤素灯(环型400W) 温控精度:±1℃ 加热温度设定:室温~160℃(以1℃调整) 时间设定:0~180min(以1min调整) 测量方法:手动、自动 操作温度范围:10~30℃ 电源及功耗:AC220V±22V 50Hz 420W 秤盘尺寸:¢100mm 外壳尺寸:360mm×250mm×270mm 净重:7kg 实验用剪刀、小袋子 实验原理: 首先对同一环境下的不同生长情况的高山榕进行水分的测定,记录数据并比较,然后对不同环境下的不同株池杉进行水分的测定,在数据中得出结论。用烘干法测定仪进行含水量的测定,使用小塑料袋来装实验品以防止植物叶子和土壤水分的蒸发。 实验的步骤: 首先进行样本的采样,在学校的马路边分别进行不同生长情况高山榕叶子的取样,然后再树下进行土壤的取样。在昭阳湖旁不同地方生长情况相同的池杉的叶子和土壤的进行取样。将取来的样品装入袋中,并做好标签。 预热烘干法测定仪后,将取来的样品放入烘干仪中保持5-8分钟,待屏幕中的数值稳定后进行数据的记录。 对数据进行整理分析和讨论,得出结论。 实验的结果:
植物组织中叶绿素含量测定 (无机及分析化学实验II-设计性实验) 一、实验目的 1.设计用分光光度计测定植物组织中的叶绿素 2. 学习利用文献资料设计研究方案 3. 掌握分光光度计测定植物组织中的叶绿素的原理与方法 二、原理: 叶绿素广泛存在于果蔬等绿色植物组织中,并在植物细胞中与蛋白质结合 成叶绿体。当植物细胞死亡后,叶绿素即游离出来,游离叶绿素很不稳定,对 光、热较敏感;在酸性条件下,叶绿素生成绿褐色的脱镁叶绿素,在稀碱液中 可水解成鲜绿色的叶绿酸盐以及叶绿醇和甲醇。高等植物中叶绿素有两种,均 易溶于乙醇、乙醚、酒精和氯仿。 叶绿素a 叶绿素b 叶绿素a、b在长波方面最大吸收峰分别位于663nm和645nm,且两吸 收曲线相交于652nm处。叶绿素a、b的比吸收系数K为已知,可在663nm和 645nm测定试样吸光度(两组份混合试样测定,双波长法),根据Lambert-
Beer定律,列出浓度c与吸光度A之间的关系式: A 663 =82.04c a+9.27c b (1) A 645 =16.75c a+45.6c b (2) (1)、(2)式中的A 663、A 645 为叶绿素溶液在波长663nm和645nm时的吸光度 度。 c a 、c b为叶绿素a、b的浓度,单位为g/L。 82.04、9.27为叶绿素a、b在波长663nm时的比吸收系数16.75、45.6为叶绿素a、b在波长645nm时的比吸收系数。解方程式(1)(2),则得经验公式: c a =12.7 A 663 -2.69 A 645 (3) c b =22.9 A 645 -4.68 A 663 (4) c T =(c a + c b)=20.2 A645+8.02 A663...... (5) 此时,c T为总叶绿素浓度,c a、c b为叶绿素a、b的浓度,单位为mg/L ,利用上面(3)(4)(5)式,即可以计算a、b总叶绿素的浓度。 仪器:分光光度计、电子天平、棕色容量瓶(如使用白玻容量瓶,可用报纸遮光)、小漏斗、滤纸 试剂:95%乙醇 三、实验步骤 1、试材的采集 采集新鲜植株叶片(或含叶绿素的其他组织),夹于双层报纸中,风干(不能置于太阳光下晒)。将风干材料处理成细小颗粒,装入封口塑料袋,避光保存。 2、待测液的制备 (1)叶绿素的浸提 精密称定风干后的样品(约0.1g)于20mL 95%乙醇中,在室温浸提36-48h。 (2)叶绿素浸提液定容
植物叶片中叶绿素含量测定----丙酮提取法 1、原理 叶绿素a、b在长波的最大吸收峰分别在663nm、645nm,据Lamber-Beer 定律,可得浓度C与光密度D间的关系式: D663= + D645= + (浓度单位:g/mL) 叶绿素a的浓度:Ca= – 叶绿素b的浓度:Cb= –D663 总叶绿素的浓度:Ct = + (浓度单位:mg/L) 2、试剂与材料 试剂: 丙酮、石英砂、碳酸钙 材料: 新鲜叶片。 仪器与器皿: 分光光度计、天平、剪刀、研钵、移液管、漏斗、大试管 3、实验步骤 称叶用丙酮研磨 ↓ 匀浆过滤(用80%丙酮洗研钵及残渣,合并滤液) ↓ 滤液用80%丙酮定容至25mL ↓ 适当稀释后测A645、A663 取样:称取剪碎的叶片(提供的样品即为剪碎后冻于-80℃的叶片)放入研钵中。注意取样时要避开大的叶脉。 研磨提取:向研钵中加入80%丙酮,以及少许(约)CaCO3 (中和酸性,防止叶绿素酯酶分解叶绿素) 和石英砂,研磨成匀浆,再加入3ml 80%丙酮,继续研磨至组织变白,在暗处静止3~5min后,用一层干滤纸过滤到25ml容量瓶中,用滴管吸取80%丙酮将研钵洗净,清洗液也要过滤到容量瓶中,并用80%丙酮沿滤纸的周围洗脱色素,待滤纸和残渣全部变白后,用80%丙酮定容至刻度。 读取吸光度:取厚度为lcm的洁净比色皿,注意不要用手接触比色皿的光面,先用少量色素提取液清洗2~3次,注意清洗时要使清洗液接触比色皿内壁的所有部分,然后将色素提取液倒入比色皿中,液面高度约为比色皿高度的4/5,将撒在比色皿外面的溶液用滤纸吸掉(注意不能擦),再用擦镜纸擦干擦净。将比色
叶绿素含量测定方法---丙酮法 由于微藻的生长周期比较复杂,包括无性繁殖阶段和有性繁殖阶段,其在不同阶段的生理形态不同,有时藻细胞会聚集在一起,以片状或团状形式存在,在显微镜下难以确定其所包含的细胞数量。 藻细胞中叶绿素的含量(特别是叶绿素a的含量)通常随与细胞的生长呈较好的线性关系,因此可通过测定藻细胞中叶绿素含量变化来反映微藻的生长情况。叶绿素测定采用丙酮研磨提取法。 取适量藻液于10 mL离心管中在4000 rpm转速下离心10 min,弃去上清液,藻泥中加入适量的100 %的丙酮。采用丙酮提取法时在试管研磨器中冰浴研磨5 min,4000 rpm离心后,上清液转入10 mL容量瓶中。按上述方法对藻体沉淀进行萃取,直至藻体沉淀呈白色为止。定容后,采用722S型可见分光光度计分别测定645 nm和663 nm下萃取液的吸光值,叶绿素含量用以下公式进行计算(Amon,1949): 叶绿素a含量用以下公式进行计算: Chlorophyll a (mg/L) = (12.7×A663 nm-2.69×A645 nm)×稀释倍数 叶绿素b含量用以下公式进行计算: Chlorophyll b (mg/L) = (22.9×A645 nm-4.64×A663 nm)×稀释倍数 叶绿素总含量用以下公式进行计算: Chlorophyll a+b (mg/L) = (20.2×A645 nm+8.02×A663 nm)×稀释倍数 由于丙酮的沸点较低,较高温度下挥发很快。此外,叶绿素稳定性较差,见光易分解,因此,本实验中叶绿素的提取和测定均在低温黑暗条件下进行,以减少提取过程中的损失。 叶绿素提取方法 提取液:本试验用DMSO/80%丙酮(l/2,v/v)提取的叶绿素,谭桂英周百成底栖绿藻叶绿素的二甲基亚砜提取和测定法* 海洋与湖沼 1987 18(3)295--300. 一、直接浸提法: 1、准确量取10ml藻液,加到15ml离心管中,放在台式离心机离心,3500r/min (根据不同的藻选择不同那个的离心转速)离心5min倒上清;留藻泥。随后在盛有藻泥的离心管中加入蒸馏水,与藻泥混匀后再次离心,目的是除去藻细胞表面的盐份,此清洗过程重复三次。 2、往藻泥中加二甲基亚砜3.33ml,65℃水浴9h,20h; 3、然后离心,将上清转移到10ml棕色瓶中, 4、添加6.67ml80%丙酮到离心管中,混匀,离心,再将上清转移到10ml棕色瓶中。 5、定容,待测。
植物水分、干物质和粗灰分的测定 植物水分、干物质和粗灰分的测定 植物水分和干物质的测定 植物体由水和干物质两部分组成。含水量多少是反映植物生理状态和成熟度的一个指标,含水量过高,植株易徒长倒伏;而过低又易调萎。植物需要有适宜的含水量才能生长健壮。在研究土壤、施肥、栽培和气候等因子对植物生长发育影响和光合利用率等问题时,一般要测定植株的水分和干物质积累状况。新鲜植物体一般含水量为70~95%,叶片含水量较高,又以幼叶为最高;茎秆含水量较少,种子含水量更少,一般为5~15%。新鲜植物体除去水分的剩余部分即为于物质,它包括有机质和矿物质两部分。其中有机质占植物干物质的90~95%,矿物质为5~10%。 水分含量测定也是农作物产品的品质检定和判断其是否适于贮藏的 重要标准。在植物成分分析中,都是以全干样品为基础来计算各成分的质量百分含量。因为新鲜样品的含水量变化很大,风干样品的含水量也会受环境湿度和温度的影响而变动,只有用全干样作计算(干基),各成分含量的数值才比较稳定。 水分的测定方法 测定植物水分的方法很多,应根据植物样品成分的性质、对分析精度的要求和实验室设备条件等情况适当选择。常用的方法有常压恒温干燥法、减压干燥法和蒸馏法,其中用得最多的常压恒温干燥法准确度较高,适用于不含易热解和易挥发成分的样品,被认为是测定水分的
标准方法;但对于幼嫩植物组织和含糖、干性油或挥发性油的样品则不适用。减压干燥法,运用于含易热解成分的样品;但含有挥发性油的样品也不适用,蒸馏法,适用于含有挥发油和干性油的样品,更适用于含水较多的样品,如水果和蔬菜等。其他如红外干燥法、冷冻干燥法、微波衰减法、中子法、卡尔·费休法等都要有特定仪器设备,不易推广使用。 常压恒温干燥法 方法原理将植物样品置于100~105°C烘箱中烘干,由样品的烘干失重(即为水分重)计算水分的含量。此法适用于不含有易热解和易挥发成分的植物样品。 植物样品在高温烘干过程中,可能有部分易焦化、分解和挥发的成分损失而使水分测定产生正误差;也有可能因水分未完全驱除(或在冷却、称量时吸湿)或有部分油脂等被氧化增重而产生负误差。但在严格控制操作条件下,该法仍是测定植物水分的标准方法。 操作步骤: 1.风干植物样品水分的测定取洁净铝盒,打开盒盖,放人100~105°C烘箱中烘30min,取出,盖好,移人盛有硅胶的干燥器中冷至室温(约需30min),立即迅速称重。再烘30min,称重,两次称重之差小于1mg可算作达恒重(m0)。 将粉碎(1mm)、混匀的风干植物样品约3g,平铺在已达恒重的铝盒中,准确称量后(m1),将盖子放在盒底下,移人已预热至约115°C 的烘箱中,关好箱门,调整温度在100~105°C,烘4~5h。取出,
植物生理学实验报告实验题目:叶绿素含量的测定 姓名 班级 学号
一、实验原理和目的 根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比。叶绿素(丙酮)在652nm(混合)、663nm、645nm有最大吸收峰。 叶绿素(95%乙醇)在665nm、649nm,类胡萝卜素在470nm有最大吸收峰,根据在分光光度计下测定的吸光度,求得叶绿素的含量 二、实验器具和步骤 植物材料:女贞 实验器具:分光光度计;电子天平;研钵;试管;小漏斗;滤纸;吸水纸;移液管;量筒;剪刀 试剂:95%乙醇(或80%丙酮);石英砂;碳酸钙粉 步骤:1.称取剪碎的新鲜样品0.1g 左右,放入研钵中,加少量石英砂和碳酸钙粉及3~5ml 95%乙醇,研成均浆,继续研磨至组织变白。静置3~5min 2. 取滤纸1张,置漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗中,过滤到10ml试管中,用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。 3.用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入漏斗中。直至滤纸和残渣中无绿色为止。最后用乙醇定容至10 ml ,摇匀 4. 把叶绿体色素提取液倒入光径1cm的比色杯内。以95%乙醇为空白,在波长665nm、649nm、470nm下测定吸光度 5. 计算公式: 叶绿素的含量(mg/g)= (浓度×提取液体积×稀释倍数)/样品鲜重。 Ca=13.95A665-6.88A649; Cb=24.96A649-7.32A665 C类=(1000A470-2.05Ca-114.8Cb)/245 单位:mg/L 三、实验数据和作业
2、计算叶绿素含量 计算公式: 叶绿素的含量(mg/g)= (浓度×提取液体积×稀释倍数)/样品鲜重。 Ca=13.95A665-6.88A649; Cb=24.96A649-7.32A665 C类=(1000A470-2.05Ca-114.8Cb)/245 单位:mg/L 由上面的公式进行代入计算,有: Ca=13.95*1.820-6.88*0.953=18.83236 Cb=24.96*0.953-7.32*1.820=10.46448 C类=(1000*1.948-2.05*18.83236-114.8*10.46448)/245=2.8901 则:叶绿素含量=(29.29684*10*0.001*1)/0.1=2.9297 四、数据分析 实验中可能清洗研钵和滤纸不是特别干净可能造成误差 五、思考题 为什么提取叶绿素时干材料一定要用80%的丙酮,而新鲜的材料可以用无水丙酮提取?答:因为叶绿素存在于叶绿体内囊体上与其上的蛋白质组成色素蛋白复合体,要 分离叶绿素和蛋白质必须有水,叶绿素的头部为极性的,有亲水性
土壤水份和植物组织含水量的测定 一.实验的目的与要求: 通过对植物和土壤水分的测定来学习和使用烘干法水分测定仪,掌握实验和实习的技巧,了解一定的实习的规则! 通过对实习数据的比较,以及结合自身的知识来分析土壤和植物组织含水量的关系,了解水分对植物生长的影响,了解 土壤中水分对植物生长的影响。 结合生态学的知识来分析土壤和植物含水量受整个生态系统的影响。 二.实验的主要内容: 1.记录实验地的周围环境的各种生态环境因素,如温度,风向,湿度。 2.测量土壤和植物组织含水量值,在不同的环境下测量对比,同一环境下不同物种的值。 3.记录实验测量的数据值,分析得出结论。 三.实习的主要工具: 1.烘干法水分测定仪(LSH-100A型): 最大秤量:100g 实际标尺分度值:1mg 准确度级别:2级 水分测量允许误差:±0.2%(样品≥2克) 水分含量测定可读性:0.01%
测量水分范围:0~100% 加热源:卤素灯(环型400W) 温控精度:±1℃ 加热温度设定:室温~160℃(以1℃调整) 时间设定:0~180min(以1min调整) 测量方法:手动、自动 操作温度范围:10~30℃ 电源及功耗:AC220V±22V 50Hz 420W 秤盘尺寸:¢100mm 外壳尺寸:360mm×250mm×270mm 净重:7kg 实验用剪刀、小袋子 四.实验原理: 首先对同一环境下的不同生长情况的高山榕进行水分的测定,记录数据并比较,然后对不同环境下的不同株池杉进行水分的测定,在数据中得出结论。用烘干法测定仪进行含水量的测定,使用小塑料袋来装实验品以防止植物叶子和土壤水分的蒸发。 五.实验的步骤: 1.首先进行样本的采样,在学校的马路边分别进行不同生 长情况高山榕叶子的取样,然后再树下进行土壤的取样。 在昭阳湖旁不同地方生长情况相同的池杉的叶子和土壤 的进行取样。
植物生理学实验报告 实验题目:叶绿素含量的测定 姓名 班级 学号 一、实验原理和目的 根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比。 叶绿素(丙酮)在652nm(混合)、663nm、645nm有最大吸收峰。 叶绿素(95%乙醇)在665nm、649nm,类胡萝卜素在470nm有最大吸收峰,根据在分光光度计下测定的吸光度,求得叶绿素的含量 二、实验器具和步骤 植物材料:女贞 实验器具:分光光度计;电子天平;研钵;试管;小漏斗;滤纸;吸水纸;移液管;量筒;剪刀 试剂:95%乙醇(或80%丙酮);石英砂;碳酸钙粉 步骤:1.称取剪碎的新鲜样品左右,放入研钵中,加少量石英砂和碳酸钙粉及3~5ml 95%乙醇,研成均浆,继续研磨至组织变白。静置3~5min 2. 取滤纸1张,置漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗中,过滤到10ml试管中,用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。 3.用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入漏斗中。直至滤纸和残渣中无绿色为止。最后用乙醇定容至10 ml ,摇匀 4. 把叶绿体色素提取液倒入光径1cm的比色杯内。以95%乙醇为空白,在波长665nm、649nm、470nm下测定吸光度 5. 计算公式: 叶绿素的含量(mg/g)= (浓度×提取液体积×稀释倍数)/样品鲜重。 Ca=-; Cb=- C类= 单位:mg/L 三、实验数据和作业 2、计算叶绿素含量 计算公式: 叶绿素的含量(mg/g)= (浓度×提取液体积×稀释倍数)/样品鲜重。 Ca=-; Cb=- C类= 单位:mg/L 由上面的公式进行代入计算,有: Ca=* Cb=* C类=(1000*)/245= 则:叶绿素含量=(*10**1)/= 四、数据分析
实验报告 植物体叶绿素含量的测定 摘要:本实验采用分光光度法,利用95%乙醇提取菠菜叶片中和番茄叶片中叶绿 体色素,叶绿素a ,叶绿素b 和类胡萝卜素最大吸收峰的波长分别是665nm 、649nm 和470nm 。根据分光光度计测定的吸光度值,从而计算出乙醇提取液中叶绿体色素含量。 实验原理:利用95%乙醇提取叶绿体色素,叶绿素a ,叶绿素b 和类胡萝卜素最 大吸收峰的波长分别是665nm 、649nm 和470nm 。 根据分光光度计测定的吸光度值,可以计算出乙醇提取液中叶绿体色 素含量。 实验目的:掌握分光光度计法对叶绿素a 、叶绿素b 、叶绿素总浓度和类胡萝卜 素总浓度测定和计算的方法。 实验材料: 生物材料:菠菜叶片0.25g ,自己培养的全素番茄苗叶片0.2g ,缺磷 番茄苗叶片0.2g ; 试剂:95%乙醇、石英砂、碳酸钙; 仪器:分光光度计、电子天平、研钵、漏斗、玻璃棒、小烧杯、10ml 量筒、50ml 容量瓶、剪刀、滤纸、滴管。 实验步骤: 1.叶绿体色素的提取 取新鲜菠菜叶片0.25g ,擦干,去中脉,剪碎放入研钵,加入少许 石英砂和CaCO 3,再加入95%乙醇3ml,研磨成匀浆,再加95%乙醇 10ml ,静置10min ,用漏斗滤去残渣,用乙醇反复冲洗研钵、残渣 至无色;用容量瓶定容至50ml 。 2.吸光度的测定 取光径1cm 比色杯,注入上述叶绿素提取液,以95%乙醇注入另 一同样的比色杯内作为空白对照,在波长665、649、和470nm 下 测定吸光度。 3.结果计算 依据下列计算公式,分别计算出叶绿素a 、B 的浓度及其叶绿素总 浓度和类胡萝卜素的浓度。 C a (叶绿素a )=13.95A 665 – 6.8A 649 C b (叶绿素b )=24.96A 649 – 7.32A 665 C T (叶绿素)=C a +C b =18.16A 649 + 6.63A 665 C x.c (类胡萝卜素)=(1000A 470 – 2.05C a -114.8C b )/248 叶绿体色素含量 = ) 样品鲜重(稀释倍数)提取液体积()色素浓度(g /mg ??L L 实验结果: 菠菜叶片提取液吸光值:
一、实验目的 1.了解植物组织中叶绿素的分布及性质。 2.掌握测定叶绿素含量的原理和方法。 二、实验原理 叶绿素广泛存在于果蔬等绿色植物组织中,并在植物细胞中与蛋白质结合成叶绿体。当植物细胞死亡后,叶绿素即游离出来,游离叶绿素很不稳定,对光、热较敏感;在酸性条件下叶绿素生成绿褐色的脱镁叶绿素,在稀碱液中可水解成鲜绿色的叶绿酸盐以及叶绿醇和甲醇。高等植物中叶绿素有两种:叶绿素a 和b ,两者均易溶于乙醇、乙醚、丙酮和氯仿。 叶绿素的含量测定方法有多种,其中主要有: 1.原子吸收光谱法:通过测定镁元素的含量,进而间接计算叶绿素的含量。 2.分光光度法:利用分光光度计测定叶绿素提取液在最大吸收波长下的吸光值,即可用朗伯—比尔定律计算出提取液中各色素的含量。 叶绿素a 和叶绿素b 在645nm 和663nm 处有最大吸收,且两吸收曲线相交于652nm 处。因此测定 提取液在645nm 、663nm 、652nm 波长下的吸光值,并根据经验公式可分别计算出叶绿素a 、叶绿素b 和总叶绿素的含量。 三、仪器、原料和试剂 仪器 分光光度计、电子顶载天平(感量0.01g)、研钵、棕色容量瓶、小漏斗、定量滤纸、吸水纸、擦境纸、滴管。 原料 新鲜(或烘干)的植物叶片 试剂 1. 96%乙醇(或80%丙酮) 2. 石英砂 3. 碳酸钙粉 四、操作步骤 取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,去除中脉剪碎。称取剪碎的新鲜样品2g ,放入研钵中,加少量石英砂和碳酸钙粉及3mL95%乙醇,研成均浆,再加乙醇10mL ,继续研磨至组织变白。静置3~5min 。 取滤纸1张置于漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗,滤液流至100mL 棕色容量瓶中;用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。 用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入容量瓶中。直至滤纸和残渣中无绿色为止。最后用乙醇定容至100mL ,摇匀。 取叶绿体色素提取液在波长665nm 、645nm 和652nm 下测定吸光度,以95%乙醇为空白对照。 五、计算 按照实验原理中提供的经验公式,分别计算植物材料中叶绿素a 、b 和总叶绿素的含量 叶绿素a= (12.7 A 665 -2.69 A 645)× W V ?1000 叶绿素b=(12.7 A 645 - 2.69A 665)× W V ?1000 总叶绿素a=(20.0A 645 + 8.02 A 665 )× W V ?1000 或总叶绿素a= W V A ??10005.34652
实验二十叶绿素含量的测定 叶绿素的含量与植物光合作用及氮素营养有密切的关系,在科学施肥、育种及植物病理研究上常有测定的需要。 方法Ⅰ 一、目的 掌握叶绿素含量测定的基本原理和方法。 二、原理 叶绿素与其他显色物质一样,在溶液中如液层厚度不变则其吸光度与它的浓度成一定的比例关系。已知叶绿素a 、b在652 nm波长处有相同的比吸收系数(均为34.5)。因此,在此波长下测定叶绿素溶液的吸光度,即可计算出叶绿素a 、b的总量。 三、材料、仪器设备及试剂 1. 材料:菠菜叶;芥菜叶或其他植物叶片。 2. 仪器设备:电子分析天平;分光光度计;漏斗;25ml容量瓶;剪刀;滤纸;玻棒等。 3. 试剂:95﹪乙醇、石英砂、碳酸钙粉。 四、实验步骤 1. 叶绿素的提取 称取植物鲜叶0.20g(可视叶片叶绿素含量增减用量),剪碎放入研钵中,加少量碳酸钙粉和石英砂及3~5ml95﹪乙醇研成匀浆,再加约10ml 95﹪乙醇稀释研磨后,用滤纸过滤入25ml 容量瓶中,然后用95﹪乙醇滴洗研磨及滤纸至无绿色为止,最后定容至刻度,摇匀,即得叶绿素提取液。 2. 测定 取光径为1cm的比色杯,倒入叶绿素提取液距杯口1cm处,以95﹪乙醇为空白对照,在652 nm波长下读取吸光度(A)值。 五、计算 将测得的吸光度A652值代入公式(1), 即可求得提取液中叶绿素浓度。所得结果再代入公式(2),即可得出样品中叶绿素含量(mg ·g-1Fw)。 A652 C ( mg .ml-1 ) = ———— (1) 34.5 公式中:C —叶绿素(a 和b )的总浓度( mg ·ml-1 )
A652—表示在652nm 波长下测得叶绿素提取液的吸光度 34.5为叶绿素a和b混合溶液在652nm波长的比吸收系数(比色杯光径为1cm, 样 品浓度为1g·L-1时的吸光度)。 C(mg.ml-1)×提取液总量(ml)叶绿素含量(mg .g-1Fw)= ———————————————— (2) 样品鲜重(g) 方法Ⅱ 一、目的 掌握叶绿素a、b含量测定的基本原理和方法。 二、原理 叶绿素a、b分别在663nm和645nm波长处有最大的吸收峰,同时在该波长处叶绿素a.、b的比吸收系数K为已知,我们即可以根据Lambert-Beer定律,列出浓度C与吸光度A之间的关系式: A663 = 82.04 C a + 9.27C b……………………( 1 ) A645 = 16.75 C a + 45.6C b……………………( 2 ) (1)、(2)式中的A663. A645为叶绿素溶液在波长663nm和645nm时测得的吸光度。 C a、、C b为叶绿素a 、b的浓度,单位为mg·L-1。 82.04 、9.27为叶绿素a 、b在波长663nm下的比吸收系数。 16.75 、45.6为叶绿素a 、b在波长645nm下的比吸收系数。 解(1)、(2 )式联立方程,得: C a=12.70 A663– 2.69 A645……………………( 3 ) C b=22.9 A645– 4.68 A663……………………( 4 ) C T =C a + C b= 20.21 A645 + 8.02A663……………………( 5 ) C a、C b为叶绿素a 、b的浓度, C T为总叶绿素浓度,单位:(mg ·L-1),.利用上面( 3 )、(4)、(5)式可以分别计算出叶绿素a 、b及总叶绿素浓度。 三、材料、仪器设备及试剂 1. 材料:菠菜叶、芥菜叶或其他植物叶片 2. 仪器设备:电子分析天平;分光光度计;恒温水浴锅;25ml刻度试管;剪刀;试管; 试管架;玻棒等。 3. 试剂:80﹪乙醇。 四、实验步骤 1. 叶绿素的提取