
2021年江西省南昌市南昌县高考化学质检试卷
1.化学与人类生活密切相关。下列说法正确的是(()
A. “司南之杓(勺),投之于地,其柢(柄)指南”。司南中“杓”所用材质为Fe2O3
B. 我国发射的“嫦娥五号”卫星使用了碳纤维,碳纤维是一种新型的有机高分子材料
C. “驼铃古道丝绸路,胡马犹闻唐汉风”。“丝绸”的主要成分是天然纤维素
D. “地沟油”经加工处理后制成肥皂,可以提高资源的利用率
2.下列现象或操作一定与物质的化学性质有关的是()
A. 焰色反应
B. 石油分馏
C. 煤干馏
D. 海水晒盐
3.下列化学用语表达正确的是()
A. 次氯酸的电子式:
B. 肼(N2H4)的结构式:NH2?NH2
C. 中子数为1的氢原子:?11H
D. CO2的比例模型:
4.下列说法不正确的是()
A. 可以用氨水鉴别AlCl3溶液和AgNO3溶液
B. 可以用溴水除去己烷中的己烯
C. 苯酚钠溶液中滴加FeCl3溶液,先产生红褐色沉淀,随后变为紫色溶液
D. 乙醇在浓硫酸催化下加热到170℃,将生成的气体先通过氢氧化钠溶液,再通入酸性KMnO4溶液中,
溶液褪色,说明有乙烯生成
5.下列解释事实或实验现象正确的是()
A. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+=Ca2++CO2↑+H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3?=Fe3++NO↑+2H2O
C. 硫酸酸化的KI?淀粉溶液久置后变蓝:4I?+O2+4H+=2I2+2H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO?+H2O=CaSO3↓+2HClO
6.山道年蒿中提取出一种具有明显抗癌活性的有机物X,其结构简式如图所
示。下列有关说法正确的是()
A. 该物质的分子式为C10H14O2
B. 该物质所有的碳原子可能共平面
C. 该物质的一氯代物共有7种
D. 该物质能发生加成、取代、氧化、消去、还原等反应
7.一定条件下,在密闭容器中进行如下可逆反应:S2Cl2(1)+Cl2(g)?2SCl2(1)△H=?61.16kJ?mol?1。
下列说法错误的是()
A. 增大压强,平衡常数不变
B. 达到平衡时,单位时间消耗n molS2Cl2的同时也生成n molCl2
C. 达到平衡时,若升高温度,氯气的百分含量减少
D. 加入氯气,平衡向正反应方向移动,S2Cl2的转化率增大,氯气的转化率降低
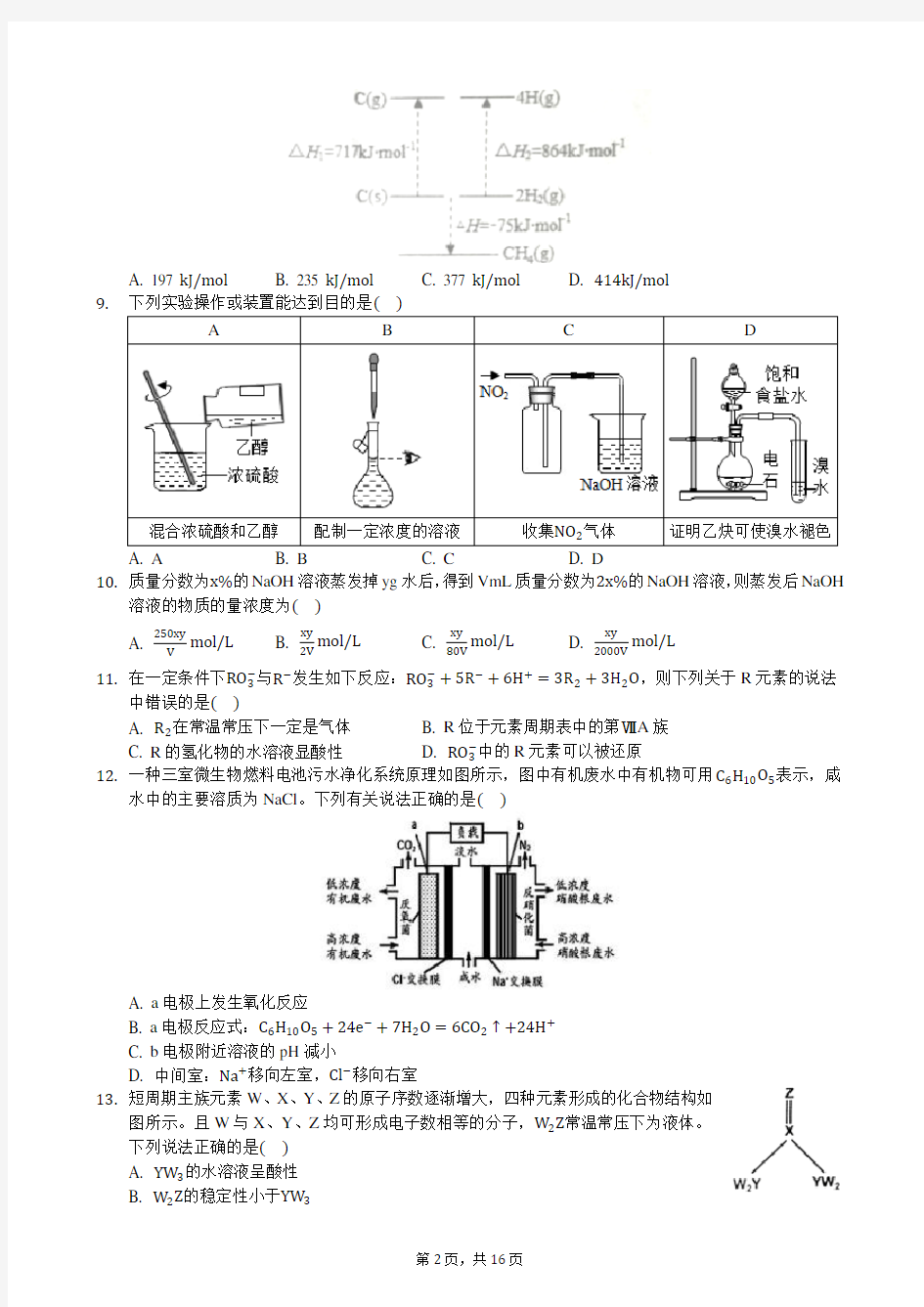
8.根据图中的能量关系,可求得C?H的键能为()
A. 197 kJ/mol
B. 235 kJ/mol
C. 377 kJ/mol
D. 414kJ/mol
9.
A B C D
混合浓硫酸和乙醇配制一定浓度的溶液收集NO2气体证明乙炔可使溴水褪色
A B C D
10.质量分数为x%的NaOH溶液蒸发掉yg水后,得到VmL质量分数为2x%的NaOH溶液,则蒸发后NaOH
溶液的物质的量浓度为()
A. 250xy
V mol/L B. xy
2V
mol/L C. xy
80V
mol/L D. xy
2000V
mol/L
11.在一定条件下RO3?与R?发生如下反应:RO3?+5R?+6H+=3R2+3H2O,则下列关于R元素的说法
中错误的是()
A. R2在常温常压下一定是气体
B. R位于元素周期表中的第ⅦA族
C. R的氢化物的水溶液显酸性
D. RO3?中的R元素可以被还原
12.一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示,咸
水中的主要溶质为NaCl。下列有关说法正确的是()
A. a电极上发生氧化反应
B. a电极反应式:C6H10O5+24e?+7H2O=6CO2↑+24H+
C. b电极附近溶液的pH减小
D. 中间室:Na+移向左室,Cl?移向右室
13.短周期主族元素W、X、Y、Z的原子序数逐渐增大,四种元素形成的化合物结构如
图所示。且W与X、Y、Z均可形成电子数相等的分子,W2Z常温常压下为液体。
下列说法正确的是()
A. YW3的水溶液呈酸性
B. W2Z的稳定性小于YW3
C. YCl3分子中Y原子不是稳定的8电子结构
D. Y元素的最高价氧化物对应的水化物为强酸
14.下列有关实验、现象、及结论等叙述正确的有()
①向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀,X可能是NH3
②将稀硫酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:S>Si
③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中可能含有S2O32?
④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中定含有Fe2+
⑤向饱和NaHCO3溶液中滴加硼酸,无气泡产生,酸性:硼酸>碳酸
⑥取少量Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
A. ①②③
B. ①③⑤
C. ②④⑥
D. ④⑤⑥
15.一定条件下,将4.32g铜和铁的混合物溶于30mL一定浓度的热硝酸中,恰好完全反应,得到NO和NO2
的混合气体0.08mol,且所得溶液不能使酸性高锰酸钾溶液褪色。向反应后的溶液中加入1mol/L的NaOH溶液,当金属离子恰好全部沉淀时得到7.04g沉淀。该硝酸的浓度为()
A. 2.4mol/L
B. 5.3mol/L
C. 6.0mol/L
D. 8.0mol/L
16.常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=?lgc(OH?)]与离子浓度变化的关系如图
所示。下列叙述正确的是()
A. 曲线N表示pOH与lg c(H2X)
两者的变化关系
c(HX?)
B. NaHX溶液中c(X2?)>c(H2X)
C. 常温下,Na2X的第一步水解常数K h1=1.0×10?4
D. 当混合溶液呈中性时,c(Na+)=c(HX?)+2c(X2?)
17.(1)下列物质中,属于强电解质的是______ (填序号,下同):属于非电解质______ 。
①氨气;②氨水;③盐酸;④醋酸;⑤硫酸钡;⑥氯化银;⑦氯化钠;⑧二氧化碳;⑨醋酸铵;⑩氢
气。
(2)已知FeS饱和溶液中存在下列关系:FeS(s)?Fe2+(aq)+S2?(aq),c(Fe2+)?c(S2?)=K sp。
常温下K sp=1.0×10?16。又知FeS饱和溶液中c(H+)与c(S2?)之间存在以下限量关系:c2(H+)?c(S2?)=1.0×10?22,为了使溶液中c(Fe2+)达到1mol?L?1,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为______ 。
(3)能作为氯、溴、碘元素非金属性递变规律判断依据的是______ 。(填序号)
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI溶液的酸性
(4)工业上,通过如下转化可制得KClO3晶体:NaCl溶液溶液晶体
①写出反应Ⅰ的总化学方程式:______
②过程Ⅱ中能析出KClO3晶体而无其他晶体析出的原因是______ 。
18.二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂。常温下二氧化氯为黄绿色气体,其熔点为
?59.5℃,沸点为11.0℃,极易溶于水,不与水反应。若温度过高,二氧化氯的水溶液可能会发生爆炸。
某研究性学习小组拟用如图所示装置制取并收集ClO2。(加热和夹持装置均省略)
(1)在圆底烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,在60~80℃之
间反应生成ClO2、CO2和一种硫酸盐,该反应的化学方程式为______ 。
(2)反应开始后,可以观察到圆底烧瓶内的现象是______ 。
(3)装置B的作用是______ 。
(4)实验过程中装置D中的溶液里除生成Na2CO3外,还生成物质的量之比为1:1的另外两种盐,一种
为NaClO3,另一种为______ 。
(5)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了
下列实验:
步骤1:量取ClO2溶液20mL,稀释成100mL试样,量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,振荡后,静置片刻;
步骤3:加入指示剂X,用cmol?L?1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液V2mL。
已知:2ClO2+8H++10I?=5I2+2Cl?+4H2O;2Na2S2O2+I2=Na2S2O6+2NaI
请回答下列问题
①配制100mL步骤3中所需的Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还需要______ 。(填仪器名称)
②步骤3中滴定终点的现象为______ 。
③原ClO2溶液的浓度为______ g?L?1。(用含字母的代数式表示)
19.氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取
Cu2O的工艺流程如图。
pH
Fe(OH)2Fe(OH)3Cu(OH)2
开始沉淀7.5 2.7 4.8
完全沉淀9.0 3.7 6.4
______ 。
(2)若试剂X是H2O2溶液,写出相应反应的化学方程式为______ 。
(3)加入试剂Y调pH时,pH的调控范围是______ 。
(4)写出用N2H4制备Cu2O的离子方程式为______ ,操作X包括______ 、洗涤、烘干,其中烘干时
要隔绝空气,其目的是______ 。
20.乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左
右气相裂解法生产。
(l)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为______ 。
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=?890.3kJ/mol;C2H2(g)+2.5O2(g)=
2CO2(g)+H2O(l)△H2=?1299.6kJ/mol;2H2(g)+O2(g)=2H2O(l)△H3=?571.6kJ/mol。则甲烷气相裂解反应:2CH4(g)=C2H2(g)+3H2(g)的△H=______ kJ/mol。
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
①T1℃时,向1L恒容密闭容器中充入0.3mol CH4只发生反应2CH4(g)?C2H4(g)+2H2(g),达到平衡
时,测得c(C2H4)=c(CH4).该反应的△H______ 0(填“>”或“<”),CH4的平衡转化率为______ .
上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L?s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1______ T2。(填“>”或“<”)
②列式计算反应2CH4(g)=C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=______ 。(用平衡分
压代替平衡浓度计算,lg0.05=?1.3)
21.某酯W是一种疗效明显的血管扩张剂,一种合成流程如图。
回答下列问题:
(1)E中含碳官能团的名称是______ 。
(2)C→D的反应类型是______ 。
(3)能测定H分子中所含化学键和官能团种类的仪器名称是______ 。
(4)写出F→G的化学方程式为______ 。
(5)R是E的同分异构体,R同时具备下列条件的结构有______ 种。
①遇氯化铁溶液发生显色反应;
②能发生水解反应和银镜反应。
(6)以乙醛为原料合成环酯。设计合成路线(其他试剂自选)______ 。
答案和解析
1.【答案】D
【解析】解:A.Fe2O3没有磁性,Fe3O4具有磁性,则司南中“杓”所用材质为Fe3O4,故A错误;
B.碳纤维是碳的一种单质,属于无机物,不是新型的有机高分子材料,故B错误;
C.“丝绸”是由蚕丝制造而成,蚕丝是天然蛋白质,则“丝绸”的主要成分是天然蛋白质,不是纤维素,故C错误;
D.地沟油成分是油脂,在碱性条件下水解生成硬脂酸钠,硬脂酸钠用作肥皂,则“地沟油”制成肥皂,可以提高资源的利用率,故D正确;
故选:D。
A.Fe3O4具有磁性,俗名磁性氧化铁;
B.碳纤维是碳的一种单质;
C.“丝绸”的主要成分是天然蛋白质;
D.地沟油成分是油脂,属于酯类,碱性条件下能发生水解反应。
本题考查化学在生产、生活、社会、科技等领域的应用,涉及物质组成、性质与用途,明确物质的性质是解题关键,注意对相关知识的积累,题目难度不大。
2.【答案】C
【解析】解:A.焰色反应是金属元素的物理性质,故A错误;
B.石油分馏是控制温度范围,分离混合物的石油加工过程,为物理变化,故B错误;
C.煤的干馏是隔绝空气加强热,发生了复杂的化学反应过程,为化学变化,故C正确;
D.海水晒盐是利用太阳光照射,蒸发水得到氯化钠晶体,无新物质生成,为物理变化,故D错误;
故选:C。
化学性质是变化过程中生成新物质的变化,变化过程中无新物质生成的为物理变化,据此分析判断。
本题考查化学实验方案的评价,题目难度不大,明确常见元素及其化合物性质为解答关键,注意掌握常见物质分离与鉴别方法,试题培养了学生的分析能力及化学实验能力。
3.【答案】A
【解析】解:A.HClO的中心原子为O,O原子分别与H原子和Cl原子共用电子形成共价键,其电子式为,故A正确;
B.肼(N2H4)为共价化合物,分子中含有4个N?H键和1个N?N键,其结构式为,故B错
误;
C.中子数为1的氢原子的质量数为1+1=2,该原子可以表示为?12H,故C错误;
D.CO2为共价化合物,C的原子半径大于O原子,则CO2的比例模型为,故D错误;
故选:A。
A.HClO中O原子分别与H原子和Cl原子形成共价键;
B.肼分子中含有4个N?H键和1个N?N键;
质量数=质子数+中子数,元素符号左上角为质量数、左下角为质子数;
D.二氧化碳分子中,碳原子的原子半径大于氧原子。
本题考查常见化学用语的表示方法,涉及电子式、结构式、比例模型、核素表示法等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的分析能力及规范答题能力,题目难度中等。
【解析】解:A.AlCl3溶液与AgNO3溶液分别与氨水混合的现象为:白色沉淀、先生成白色沉淀后溶解,现象不同可鉴别,故A正确;
B.溴水与己烯加成后,生成物溶于己烷,则不能除杂,应选蒸馏法,故B错误;
C.FeCl3溶液水解显酸性,与苯酚钠反应生成苯酚,且促进水解生成氢氧化铁红褐色沉淀,苯酚遇氯化铁发生显色反应,则苯酚钠溶液中滴加FeCl3溶液,先产生红褐色沉淀,随后变为紫色溶液,故C正确;
D.先通过氢氧化钠溶液可除去二氧化硫、乙醇等,生成的乙烯可被高锰酸钾氧化,则酸性KMnO4溶液褪色,说明有乙烯生成,故D正确;
故选:B。
A.AlCl3溶液与AgNO3溶液分别与氨水混合的现象为:白色沉淀、先生成白色沉淀后溶解;
B.溴水与己烯加成后,生成物溶于己烷;
C.FeCl3溶液水解显酸性,与苯酚钠反应生成苯酚,且苯酚遇氯化铁发生显色反应;
D.先通过氢氧化钠溶液可除去二氧化硫、乙醇等,生成的乙烯可被高锰酸钾氧化。
本题考查了化学实验方案的评价,为高频考点,把握物质的性质、物质的鉴别、除杂质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
5.【答案】C
【解析】解:A.水垢上滴入CH3COOH溶液有气泡产生,发生反应为:CaCO3+2CH3COOH=Ca2++H2O+ CO2↑+2CH3COO?,故A错误;
B.铁和稀硝酸反应制得浅绿色溶液,正确的离子方程式为:3Fe+8H++2NO3?=3Fe2++2NO↑+4H2O,故B错误;
C.硫酸酸化的KI?淀粉溶液久置后变蓝,离子方程式为:4I?+O2+4H+=2I2+2H2O,故C正确;
D.次氯酸根会将二氧化硫氧化成硫酸根离子,生成的沉淀为硫酸钙,少量SO2通入漂白粉溶液中的离子反应为:SO2+H2O+Ca2++3ClO?=CaSO4↓+2HClO+Cl?,若SO2过量的离子方程式为:2SO2+2H2O+ Ca2++2ClO?=CaSO4↓+2Cl?+SO42?+4H+,故D错误;
故选:C。
A.醋酸为弱酸,不能拆开;
B.反应制得浅绿色溶液,应该生成亚铁离子;
C.酸性条件下碘离子易被氧气氧化成碘单质;
D.次氯酸能够氧化亚硫酸钙。
本题考查离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等,D为易错点,试题侧重考查学生的规范答题能力。
6.【答案】C
【解析】解:A.由结构可知分子式为C10H16O2,故A错误;
B.含甲基、亚甲基、次甲基均为四面体结构,所有碳原子不能共面,故B错误;
C.分子中含7种H,则该物质的一氯代物共有7种,故C正确;
D.含碳碳双键可发生加成、氧化、还原反应,含甲基可发生取代反应,不能发生消去反应,故D错误;
故选:C。
由结构可知分子式,分子中含碳碳双键、过氧键,且含甲基、亚甲基、次甲基均为四面体结构,分子中含7种H,结合烯烃的性质来解答。
本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度中等。
【解析】解:A.平衡常数随温度变化,增大压强平衡常数不变,故A错误;
B.单位时间里消耗 n mol S2Cl2的需要消耗n molCl2,而同时生成n molCl2,则Cl2的生成与消耗的物质的量相同,反应处于平衡状态,故B正确;
C.该反应正反应是放热反应,升高温度平衡向逆反应移动,但只有氯气为气体,氯气的百分含量不变,故C错误;
D.加入氯气,平衡向正反应方向移动,S2Cl2的转化率增大,氯气的转化率降低,故D正确;
故选:C。
A.化学平衡常数只受温度影响;
B.消耗 n mol S2Cl2的需要消耗n molCl2,而同时生成n molCl2,则Cl2的生成与消耗的物质的量相同;
C.只有氯气为气体,其含量不变;
D.加入氯气,平衡向正反应方向移动,氯气的转化率降低。
本题考查化学平衡常数、化学平衡状态的判断、影响平衡移动的因素等,C选项中注意物质的聚集状态,侧重考查学生的分析能力,注意把握外界条件对平衡移动的影响。
8.【答案】D
【解析】解:由能量关系图,C(s)键能为717kJ?mol?1,H2键能为(864÷2)kJ?mol?1=432kJ?mol?1,C(s)+ 2H2(g)=CH4(g)△H=?75kJ?mol?1,
设C?H的键能为x,则反应热△H=反应物总键能?生成物总键能=(717kJ?mol?1+432kJ?mol?1×2)?4x=?75kJ?mol?1,解得x=414kJ?mol?1,
故选:D。
由能量关系图,C(s)键能为717kJ?mol?1,H2键能为(864÷2)kJ?mol?1=432kJ?mol?1,C(s)+2H2(g)= CH4(g)△H=?75kJ?mol?1,根据反应热△H=反应物总键能?生成物总键能计算C?H的键能。
本题考查反应热与焓变的计算,为高频考点,把握反应热与物质键能之间的计算关系即可解答,注意根据分子结构推断化合物分子中化学键的数目,题目难度中等。
9.【答案】B
【解析】
【分析】
本题考查化学实验方案评价,涉及气体收集、溶液配制、气体检验等知识点,明确化学反应原理、元素化合物性质、实验规则是解本题关键,D为解答易错点。
【解答】
A.配制溶液时,密度大的溶液倒入密度小的溶液,混合浓硫酸和乙醇相当于浓硫酸的稀释,应该将浓硫酸倒入乙醇中并不断搅拌,故A错误;
B.定容时眼睛应该与凹液面最低处相切,图象符合,故B正确;
C.二氧化氮密度大于空气,应该采用向上排空气法收集,所以导气管应该遵循“长进短出”原则,故C错误;
D.得到的乙炔中含有硫化氢等气体,硫化氢等气体也能使溴水褪色,应该先将得到的气体通入硫酸铜溶液除去杂质,然后将得到的气体通入溴水检验乙炔,故D错误;
故选:B。
10.【答案】B
【解析】解:设原NaOH溶液的质量为mg,则蒸发前溶液中溶质NaOH的质量为:mx%g;蒸发掉yg水后,NaOH溶液的质量分数为2x%,溶质质量为(m?y)2x%g,根据蒸发前后溶质质量不变得到:mx%=
(m?y)2x%;解得m=2y,所以NaOH的质量为2yx%,物质的量为2yx%g
40g/mol =1
20
yx%mol,根据物质的量
浓度的计算公式:c(NaOH)=n(NaOH)
V aq
=
1
20
yx%mol
VmL
1000mL/L
=xy
2V
mol/L。
故选:B。
设原溶液的质量为mg,蒸发前后溶质质量不变,可以求出m,进一步求出n(NaOH),又蒸发后溶液的体积为VmL,根据物质的量浓度计算公式,可以求出结果。
本题考查溶液中的有关计算,涉及到溶质的质量与溶液的质量及溶质质量分数之间的关系,物质的量与物质的质量之间的关系;物质的量浓度与物质的物质的量及溶液的体积之间的关系。属于基本知识,基础知识,题目难度不大,但计算过程中需要细心,防止出错。
11.【答案】A
【解析】解:A.R2在常温常压下不一定是气体,可能是液体或固体,如溴、碘,故A错误;
B.由分析可知,R位于元素周期表中的第ⅦA族,故B正确;
C.R位于第ⅦA族,其氢化物的水溶液都呈酸性,故C正确;
D.RO3?中的R化合价处于中间价态,既有氧化性又有还原性,可以被还原,故D正确;
故选:A。
RO3?+5R?+6H+=3R2+3H2O中R元素化合价由+5价、?1价变为0价,则R的最低负价是?1价,则最高正价是+7价,该元素位于第VⅡA族,其最外层有7个电子,该元素有正化合价,说明R元素是除F元素外的卤素,据此分析解答。
本题考查原子结构和元素性质、氧化还原反应,题目难度不大,侧重考查元素在周期表中的位置及元素性质、以及氧化还原反应的有关概念,正确判断元素位置是解本题关键,注意不能根据RO3?中R化合价判断族序数,为易错点。
12.【答案】A
【解析】解:该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3?+10e?+12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5?24e?+7H2O=6CO2↑+24H+,
A.该原电池中,硝酸根离子得电子发生还原反应,则左边装置中电极a是负极发生氧化反应,故A正确;
B.左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5?24e?+7H2O=6CO2↑+24H+,故B错误;
C.右边装置中电极b是正极,电极反应式为2NO3?+10e?+12H+=N2↑+6H2O,氢离子参加反应导致溶液酸性减小,溶液的pH增大,故C错误;
D.放电时,电解质溶液中阳离子Na+移向正极右室,阴离子Cl?移向负极室左室,故D错误;
故选:A。
该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b是正极,电极反应式为2NO3?+10e?+ 12H+=N2↑+6H2O,左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6H10O5?24e?+7H2O=6CO2↑+24H+,据此分析解答。
本题考查化学电源新型电池,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握。
13.【答案】D
【解析】解:由上述分析可知,W为H,X为C,Y为N,Z为O元素,
A.YW3为NH3,NH3的水溶液呈碱性,故A错误;
B.非金属性O>N,则最简单氢化物的稳定性:H2O>NH3,故B错误;
C.YCl3为NCl3,Y(N)原子最外层电子数为5+3=8,满足8电子稳定结构,故C错误;
D.Y元素的最高价氧化物对应的水化物为硝酸,硝酸为一元强酸,故D正确;
故选:D。
短周期主族元素W、X、Y、Z的原子序数逐渐增大,W2Z常温常压下为液体,W2Z为H2O,则W为H、Z 为O;W与X、Y、Z均可形成电子数相等的分子,均为10电子微粒或18电子微粒,结合原子序数及X 在化合物中形成4个共价键,则X为C元素,Y的原子序数在X、Z之间,Y为N,以此来解答。
本题考查原子结构与元素周期律,为高频考点,把握元素化合物知识、化学键来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
14.【答案】A
【解析】解:①白色沉淀可能为硫酸钡或亚硫酸钡,若白色沉淀为亚硫酸钡,则X可能是NH3,故正确;
②发生强酸制弱酸的反应,可知硫酸的酸性大于硅酸的酸性,则非金属性:S>Si,故正确;
③S2O32?在酸性溶液中发生氧化还原反应生成S、二氧化硫,由操作和现象可知溶液中可能含有S2O32?,故正确;
④检验亚铁离子应先加KSCN无现象排除铁离子的干扰,然后加氯水观察是否变红可检验亚铁离子,操作不合理,故错误;
⑤饱和NaHCO3溶液中滴加硼酸,无气泡产生,可知碳酸的酸性强,则酸性:硼酸<碳酸,故错误;
⑥酸性溶液中亚铁离子、硝酸根离子发生氧化还原反应,应溶于水直接加KSCN溶液检验是否变质,故错误;
故选:A。
①白色沉淀可能为硫酸钡或亚硫酸钡;
②发生强酸制弱酸的反应,可知硫酸的酸性大于硅酸的酸性;
③S2O32?在酸性溶液中发生氧化还原反应生成S、二氧化硫;
④检验亚铁离子应先加KSCN无现象排除铁离子的干扰;
⑤饱和NaHCO3溶液中滴加硼酸,无气泡产生,可知碳酸的酸性强;
⑥酸性溶液中亚铁离子、硝酸根离子发生氧化还原反应。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、离子检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
15.【答案】D
【解析】解:铜和铁的混合物溶一定浓度的热硝酸中,恰好完全反应,且所得溶液不能使酸性高锰酸钾溶液褪色,说明反应后溶液中溶质为Fe(NO3)3、Cu(NO3)2,溶液中再加入NaOH溶液,反应生成Fe(OH)3、
=0.16mol,Cu(OH)2沉淀,反应消耗氢氧根离子质量为:7.04g?4.32g=2.72g,其物质的量为: 2.72g
17g/mol
根据电荷守恒可知,反应后溶液中硝酸根与消耗的氢氧根离子物质的量相等,由N原子守恒可知HNO3的
=8mol/L,
总物质的量为:0.08mol+0.16mol=0.24mol,则硝酸的浓度为:0.24mol
0.03L
故选:D。
铜和铁的混合物溶一定浓度的热硝酸中,恰好完全反应,且所得溶液不能使酸性高锰酸钾溶液褪色,说明反应后溶液中溶质为Fe(NO3)3、Cu(NO3)2,向反应后的溶液中加入NaOH溶液,反应生成Fe(OH)3、Cu(OH)2沉淀,根据电荷守恒可知,反应后溶液中硝酸根与消耗的氢氧根离子物质的量相等,而消耗氢氧根离子质量=氢氧化物的质量?金属的质量,可得反应消耗的氢氧根的物质的量,再利用N原子守恒计算HNO3的总物质的量,进而计算硝酸浓度。
本题考查混合物的有关计算,题目难度中等,注意掌握守恒思想在化学计算中的应用方法,避免了过程法的繁琐,试题培养了学生的分析能力及化学计算能力。
16.【答案】C
【解析】解:A.K h1=c(HX ?)?c(OH ?)
c(X 2?),则lg c(HX ?)c(X 2?)=lg K
h1c(OH ?)=lgK h1?lgc(OH ?),当横坐标为0时,lgK h1=lgc(OH ?),即K h1=c(OH ?)=10?pOH ;同理lg c(H 2X)
c(HX ?)=lgK h2?lgc(OH ?),当横坐标为0时,lgK h2=lgc(OH ?),即K h2=c(OH ?)=10?pOH ,K h1>K h2,所以横坐标为0时,纵坐标数值大的曲线表示pOH 与lg c(H 2X)
c(HX ?)两者的变化关系,即曲线M 表示pOH 与lg c(H 2X)c(HX ?)两者的变化关系,故A 错误;
B.根据图知,横坐标为0时,K h1=c(OH ?)=10?pOH =10?4、K h2=c(OH ?)=10?pOH =10?9,K a2=K
w K h1=10?14
10=10?10 C.根据图知,横坐标为0时,K h1=c(OH ?)=10?pOH =1.0×10?4,故C 正确; D.混合溶液呈中性时,c(H +)=c(OH ?),溶液中存在c(Na +)+c(H +)=c(OH ?)+c(HX ?)+2c(X 2?)+c(Cl ?),所以存在c(Na +)>c(HX ?)+2c(X 2?),故D 错误; 故选:C 。 A.K h1=c(HX ?)?c(OH ?) c(X 2?),则lg c(HX ?)c(X 2?)=lg K h1c(OH ?)=lgK h1?lgc(OH ?),当横坐标为0时,lgK h1=lgc(OH ?),即K h1=c(OH ?)=10?pOH ; 同理lg c(H 2X)c(HX ?)=lgK h2?lgc(OH ?),当横坐标为0时,lgK h2=lgc(OH ?),即K h2=c(OH ?)=10?pOH ,K h1>K h2,所以横坐标为0时,纵坐标数值大的曲线表示pOH 与lg c(H 2X)c(HX )两者的变化关系; B.根据图知,横坐标为0时,K h1=c(OH ?)=10?pOH =10?4、K h2=c(OH ?)=10?pOH =10?9,K a2=K w K h1,根据HX ?电离和水解平衡常数相对大小判断溶液中c(X 2?)、(H 2X)相对大小; C.根据图知,横坐标为0时,K h1=c(OH ?)=10?pOH ; D.混合溶液呈中性时,c(H +)=c(OH ?),溶液中存在c(Na +)+c(H +)=c(OH ?)+c(HX ?)+2c(X 2?)+c(Cl ?)。 本题考查混合溶液定性判断,侧重考查图象分析判断及计算能力,正确判断曲线与微粒成分关系、水解平衡常数计算方法、水解平衡常数与电离平衡常数关系是解本题关键,A 为解答难点,注意D 中易漏掉阴离子Cl ?而导致错误判断。 17.【答案】⑤⑥⑦⑨ ①⑧ 3 bc NaCl +3H 2O ??通电 NaClO 3+3H 2↑ 室温下KClO 3在水中的溶解度明显 小于其它晶体 【解析】解:(1)⑤硫酸钡、⑥氯化银、⑦氯化钠碳、⑨醋酸铵在溶液中完全电离,属于强电解质,①氨气、⑧二氧化碳在溶液中自身不能电离,属于非电解质,②氨水,③盐酸都是混合物,⑩氢气是单质,既不是电解质也不是非电解质,④醋酸为弱电解质, 故答案为:⑤⑥⑦⑨;①⑧; (2)溶液中c(S 2?)=K sp c(F e 2+)=1×10?161mol/L =1×10?16mol/L ,c 2(H +)?c(S 2?)=1.0×10?22,则c(H +)=√1×10?22 1×10mol ?L ?1=1×10?3mol ?L ?1,pH =3, 故答案为:3; (3)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关, 故答案为:bc ; (4)①电解时, 阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气,所以反应方程式为:NaCl +3H 2O ??通电? ?NaClO 3+3H 2↑, 故答案为:NaCl +3H 2O ? ?通电 NaClO 3+3H 2↑; ②相同温度下, 溶解度小的物质先析出,室温下KClO 3在水中的溶解度明显小于其它晶体,所以先析出KClO 3, 故答案为:室温下KClO 3在水中的溶解度明显小于其它晶体。 (1)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,能全部电离的电解质是强电解质,只有部分电离的电解质是弱电解质; (2)硫化亚铁的溶度积常数和亚铁离子浓度计算硫离子浓度,再根据氢硫酸的电离平衡常数计算氢离子浓度,最后利用pH 计算公式计算溶液的pH ; (3)同一主族元素,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强; (4)工业上,通过如下转化可制得KClO 3晶体NaCl 溶液溶液晶体, ①电解时,阳极上氯离子放电生成氯酸根离子、阴极上氢离子放电生成氢气; ②相同温度下,溶解度小的物质先析出。 本题以卤族元素为载体考查物质的性质与应用,为高频考点,侧重考查学生的分析能力,题目涉及溶度积常数计算、非金属强弱的判断方法等知识点,根据物质的性质、原子结构结合元素周期律等知识点来分析解答,题目难度中等。 18.【答案】H 2C 2O 4+2KClO 3+H 2SO 4??60℃?80℃?K 2SO 4+2ClO 2↑+2CO 2↑+2H 2O 溶液中有气泡逸出,圆底烧瓶内产生黄绿色气体 将ClO 2冷凝并收集 NaClO 2 100mL 容量瓶 滴入最后一滴Na 2S 2O 3溶液,溶液蓝色褪去,且半分钟内不恢复 135cV 2 2V 1 【解析】解:(1)由草酸、氯酸钾和硫酸在60℃~80℃之间生成ClO 2、CO 2和一种硫酸钾,反应为: H 2C 2O 4+2KClO 3+H 2SO 4??60℃?80℃?K 2SO 4+2ClO 2↑+2CO 2↑+2H 2O , 故答案为:H 2C 2O 4+2KClO 3+H 2SO 4??60℃?80℃?K 2SO 4+2ClO 2↑+2CO 2↑+2H 2O ; (2)常温下二氧化氯为黄绿色气体,则加热后圆底烧瓶中可以观察到有气泡逸出,并产生黄绿色气体, 故答案为:溶液中有气泡逸出,圆底烧瓶内产生黄绿色气体; (3)二氧化氯熔沸点较低,利用B 装置中冰水降温,可使ClO 2冷凝并收集, 故答案为:将ClO 2冷凝并收集; (4)NaOH 吸收ClO 2尾气,生成物质的量之比为1:1的两种阴离子,一种为NaClO 3,氯元素从+4价升高为+5 价,氧化还原反应电子守恒规律,另一种离子中Cl 元素化合价降低,且应从+4价降为+3价,即为NaClO 2, 故答案为:NaClO 2; (5)①配制100mL 步骤3中所需的Na 2S 2O 3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需要100mL 容量瓶, 故答案为:100mL 容量瓶; ②滴定终点,碘完全反应,则现象为滴入最后一滴Na 2S 2O 3溶液,溶液蓝色褪去,且半分钟内不恢复, 故答案为:滴入最后一滴Na 2S 2O 3溶液,溶液蓝色褪去,且半分钟内不恢复; ③有碘单质生成,用淀粉做指示剂;二氧化硫和碘单质的反应中,根据电子守恒,得到:2ClO 2~5I 2,结合反应2Na 2S 2O 3+I 2=Na 2S 4O 6+2NaI ,得到关系式:2ClO 2~5I 2~10Na 2S 2O 3; 设原ClO 2溶液的浓度为x , 2ClO 2~~~~5I 2~~~10Na 2S 2O 3 2mol 10mol 2×10?2×x×V 1×10?3 10?1 1×10?3cV 2mol x =cV 2V 1mol/L =135cV 2 2V 1g/L , 故答案为:135cV 2 2V 1。 A 装置由草酸、氯酸钾和硫酸制二氧化氯(ClO 2):H 2C 2O 4+2KClO 3+H 2SO 4??60℃?80℃?K 2SO 4+2ClO 2↑ +2CO 2↑+2H 2O ,B 装置冷凝并收集产品ClO 2,C 装置防倒吸,D 装置吸收多余的ClO 2,防止污染空气; (1)由草酸、氯酸钾和硫酸在60℃~80℃之间生成ClO 2、CO 2和硫酸钾,据此书写; (2)圆底烧瓶内发生反应生成的二氧化氯为黄绿色气体; (3)二氧化氯为黄绿色气体,沸点为11.0℃,易液化; (4)NaOH 吸收ClO 2尾气,生成物质的量之比为1:1的两种阴离子,一种为NaClO 3,根据氧化还原反应电子守恒规律判断另一种盐; (5)有碘单质生成,用淀粉做指示剂;根据元素守恒结合反应得到关系式2ClO 2~5I 2~10Na 2S 2O 3计算c(ClO 2)。 本题考查制备实验的设计,需要把握住流程的过程,找到解决问题的突破口,运用基本知识、结合最终要得到的产品来解决,要将教材所学到的基本知识应用到实际解决问题中去,要求基础知识掌握牢固,同时又能将基础知识应用实际应用中。 19.【答案】SO 2 Fe(OH)3 2Fe 2++2H ++H 2O 2=2Fe 3++2H 2O 3.7~4.8 4CuSO 4+N 2H 4+ 8OH ???90℃?2Cu 2O ↓+N 2↑+4SO 42?+6H 2O 过滤 防止生成的 Cu 2O 被空气氧化 【解析】解:(1)焙烧时发生反应:2CuFeS 2+4O 2? ?高温 Cu 2S +3SO 2+2FeO 、Cu 2S +2O 2? ?高温 2CuO +SO 2, 炉气中的有害气体成分是SO 2;加入试剂Y 调节pH 为3.7~4.8沉淀Fe 3+,过滤分离出料渣II 为Fe(OH)3, 故答案为:SO 2;Fe(OH)3; (2)若试剂X 是H 2O 2溶液,将Fe 2+氧化为Fe 3+,离子反应为:2Fe 2++2H ++H 2O 2=2Fe 3++2H 2O , 故答案为:2Fe 2++2H ++H 2O 2=2Fe 3++2H 2O ; (3)由表中数据可知,使铁离子转化为沉淀,而铜离子不能沉淀,则加入试剂Y 调pH 时,pH 的调控范围是3.7~4.8, 故答案为:3.7~4.8; (4)用N 2H 4制备Cu 2O 的离子方程式为:4CuSO 4+N 2H 4+8OH ???90℃?2Cu 2O ↓+N 2↑+4SO 42?+6H 2O ,操作X 包括过滤、洗涤、隔绝空气烘干,Cu 2O 具有较强的还原性,在加热条件下易被空气氧化,故烘干过程要隔绝空气, 故答案为:4CuSO 4+N 2H 4+8OH ? ??90℃?2Cu 2O ↓+N 2↑+4SO 42?+6H 2O ;过滤;防止生成的Cu 2O 被空气氧化。 预处理后与氧气焙烧发生2CuFeS 2+4O 2? ?高温 Cu 2S +3SO 2+2FeO 、Cu 2S +2O 2? ?高温 2CuO +SO 2,部分FeO 被氧化为Fe 2O 3,炉气中的有害气体成分是SO 2,加入稀硫酸溶解金属氧化物,得到含有Cu 2+、Fe 2+、Fe 3+的酸性溶液,加入试剂X 将Fe 2+氧化为Fe 3+,加入试剂Y 调节pH 为3.7~4.8沉淀Fe 3+,过滤分离出料渣 II为Fe(OH)3,将滤液用KOH、N2H4还原发生反应:4CuSO4+N2H4+8KOH??90℃?2Cu2O↓+N2↑+4K2SO4+ 6H2O,操作X为过滤、洗涤、隔绝空气烘干,制得Cu2O。 本题考查物质的制备实验,为高频考点,关键是对工艺流程的理解,注意掌握元素化合物知识、物质的分离提纯方法与操作,意在考查学生综合分析问题的能力。 20.【答案】CaC2+2H2O=Ca(OH)2+C2H2↑+376.4>66.7%>5×104 【解析】解:(1)CaC2与水反应生成氢氧化钙和乙炔,反应的化学方程式为CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑; (2)ⅠCH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=?890.3kJ/mol ⅡC2H2(g)+2.5O2(g)=2CO2(g)+H2O(l)△H2=?1299.6kJ/mol Ⅱ2H2(g)+O2(g)=2H2O(l)△H3=?571.6kJ/mol 得2CH4(g)=C2H2(g)+3H2(g)△H=(?890.3kJ/mol)×2?(?1299.6kJ/ 根据盖斯定律Ⅰ×2?Ⅱ?Ⅲ×3 2 mol)?(?571.6kJ/mol)×3 =+376.4kJ/mol, 2 故答案为:+376.4; (3)①由图可知,随着温度升高,CH4的分压减小,C2H4和H2(g)的分压增大,说明平衡正向移动,该反应为吸热反应,△H>0;设甲烷的转化浓度为2x, 2CH4(g)=C2H2(g)+3H2(g) 起始c(mol/L)0.300 转化c(mol/L) 2x x 3x 平衡c(mol/L)0.3?2x x 3x ×100%≈66.7%;改 c(C2H4)=c(CH4),则x=0.3?2x,解得x=0.1mol/L,甲烷的转化率为2×0.1mol/L 0.3mol/L 变温度至T2℃,CH4以0.01mol/(L?s)的平均速率增多,说明平衡逆向移动,该反应是吸热反应,即温度应为降低,则T1>T2, 故答案为:>;66.7%;>; =②根据图中数据,A点温度时,p(C2H2)=0.05Pa,p(H2)=104Pa,p(CH4)=103Pa,K=p(C2H2)?p3(H2) p2(CH4) 0.05Pa×(104Pa)3 =5×104(Pa)2, (103Pa)2 故答案为:5×104。 (1)CaC2与水反应生成氢氧化钙和乙炔; (2)ⅠCH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=?890.3kJ/mol ⅡC2H2(g)+2.5O2(g)=2CO2(g)+H2O(l)△H2=?1299.6kJ/mol Ⅱ2H2(g)+O2(g)=2H2O(l)△H3=?571.6kJ/mol 得2CH4(g)=C2H2(g)+3H2(g); 根据盖斯定律Ⅰ×2?Ⅱ?Ⅲ×3 2 (3)①由图可知,随着温度升高,CH4的分压减小,C2H4和H2(g)的分压增大,说明平衡正向移动;根据题目数据,设甲烷的转化浓度,列化学平衡三段式,利用c(C2H4)=c(CH4)解答;改变温度至T2℃,CH4以 0.01mol/(L?s)的平均速率增多,说明平衡逆向移动; ②根据图中数据,结合K=p(C2H2)?p3(H2) 计算。 p(CH4) 本题综合考查化学知识,侧重考查学生分析能力和计算能力,题目涉及化学方程式的书写、反应热的计算、化学平衡的移动以及化学平衡的计算,根据题目数据结合盖斯定律、勒夏特列原理、化学平衡三段式解答, 此题难度大。 21.【答案】羧基加成反应红外光谱仪 等13 【解析】解:(1)中含碳官能团的名称是羧基, 故答案为:羧基; (2)化合物C与HCN发生加成生成化合物D,C→D的反应类型是加成反应, 故答案为:加成反应; (3)能测定H分子中所含化学键和官能团种类的仪器名称是红外光谱仪, 故答案为:红外光谱仪; (4)由化合物G逆推出化合物F,F与溴化氢发生加成反应生成G,F为环烯烃,G发生水解反应生成H,F 为或,F→G的化学方程式:, 故答案为:; (5)依题意,R分子中羟基直接连在苯环,含有甲酸酯基; 分两种情况:第一种情况,苯环上只含2个取代基,?OH,?CH2OOCH共有邻、间、对3种结构; 第二种情况,苯环上含有3个取代基:?OH、?CH3、?OOCH,而?OH、?CH3有邻、间、对3种位置结构,对应的?OOCH分别有4种、4种、2种位置结构,共有10种结构,综上所述,R有符合条件的结构13种,故答案为:13; (6)以乙醛为原料合成环酯,可由CH3CH(OH)COOH发生酯化反应得到,乙醛和HCN发生C 生成D类型的反应得到CH3CH(OH)CN,CH3CH(OH)CN水解生成CH3CH(OH)COOH,其合成路线为 , 故答案为:。 由A的分子式、B的结构简式知,A发生取代反应生成B,则A为,B发生水解反应生成二醇,二醇脱水生成醛,化合物C与HCN发生加成生成化合物D,D水解生成化合物E;由化合物G逆推出化 合物F,F与溴化氢发生加成反应生成G,F为环烯烃,G发生水解反应生成H,则F为或,H为,E和H发生酯化生成W为; (6)以乙醛为原料合成环酯,可由CH3CH(OH)COOH发生酯化反应得到,乙醛和HCN发生C 生成D类型的反应得到CH3CH(OH)CN,CH3CH(OH)CN水解生成CH3CH(OH)COOH。 本题考查有机物推断和合成,侧重考查对比、分析、判断及知识综合应用能力,明确官能团及其性质关系、物质之间转化关系并正确推断各物质结构简式是解本题关键,易错点是同分异构体种类判断,题目难度中等。