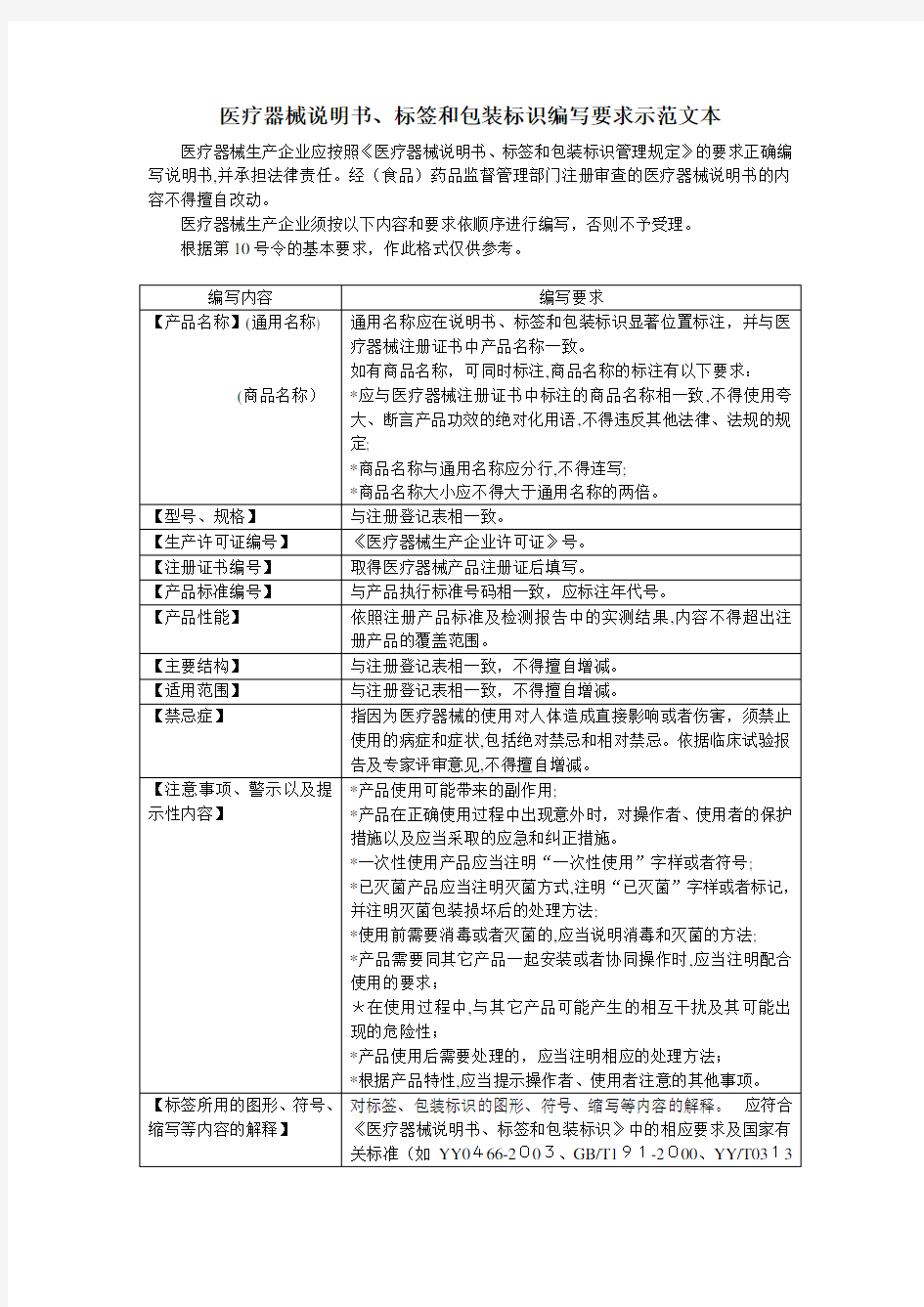

医疗器械说明书、标签和包装标识编写要求示范文本
医疗器械生产企业应按照《医疗器械说明书、标签和包装标识管理规定》的要求正确编写说明书,并承担法律责任。经(食品)药品监督管理部门注册审查的医疗器械说明书的内容不得擅自改动。
医疗器械生产企业须按以下内容和要求依顺序进行编写,否则不予受理。
根据第10号令的基本要求,作此格式仅供参考。
1、凡在中华人民共和国境内销售、使用的医疗器械应当按照本规定要求附有说明书、标签
和包装标识。简单易用的产品,按照国家食品药品监督管理局的规定,可以省略说明书、标签和包装标识三项中的某一项或者某两项。
2、医疗器械说明书是指由生产企业制作并随产品提供给用户的,能够涵盖该产品安全有效
基本信息并用以指导正确安装、调试、操作、使用、维护、保养的技术文件。其内容应当真实、完整、准确、科学,并与产品特性相一致。医疗器械企业应当对说明书内容的真实性、完整性负责,不得以任何形式欺骗和误导消费者。
3、医疗器械说明书、标签和包装标识内容应使用语言文字工作委员会公布的规范化汉字,
可以附加其他文种。
4、说明书不得含有下列内容:
①表示功效的断言或者保证:如“疗效最佳”、“保证治愈”、“包治”、“根治”、“即刻见效”
“完全无毒副作用”等;
②绝对化语言和表示:如“最高技术”、“最科学”、“最先进”、“最佳”等。
③说明“治愈率或者有效率的”;
④与其它企业产品的功效和安全性相比较的;
⑤含有“保险公司保险”、“无效退款”等承诺性语言的;
⑥利用任何单位或者个人的名义、形象作证明或者推荐的;
⑦含有使人感到已经患有某种疾病,或者使人误解不使用该医疗器械会患某种疾病或者加
重病情的表述的;
⑧法律、法规规定禁止的其他内容。
三、医疗器械说明书变更要求。
医疗器械注册证书中型号、规格、生产地址、产品标准、产品性能结构及组成、产品适用范围发生变更的,应按照《医疗器械注册管理办法》的规定履行重新注册手续后,变更医疗器械说明书的相关内容。
生产企业变更企业名称、产品名称、商品名称文字性改变、产品型号、规格文字性改变以及产品标准的名称或者代号文字性改变、生产企业注册地址变更和生产地址文字性改变的,应按照《医疗器械注册管理办法》的规定履行变更注册手续后,变更医疗器械说明书的相关内容。
生产企业变更经注册审查的医疗器械说明书的内容,不涉及产品技术性变化的,生产企业应当提交相关文件,办理相应书面告知手续后,变更医疗器械说明书的相关内容。