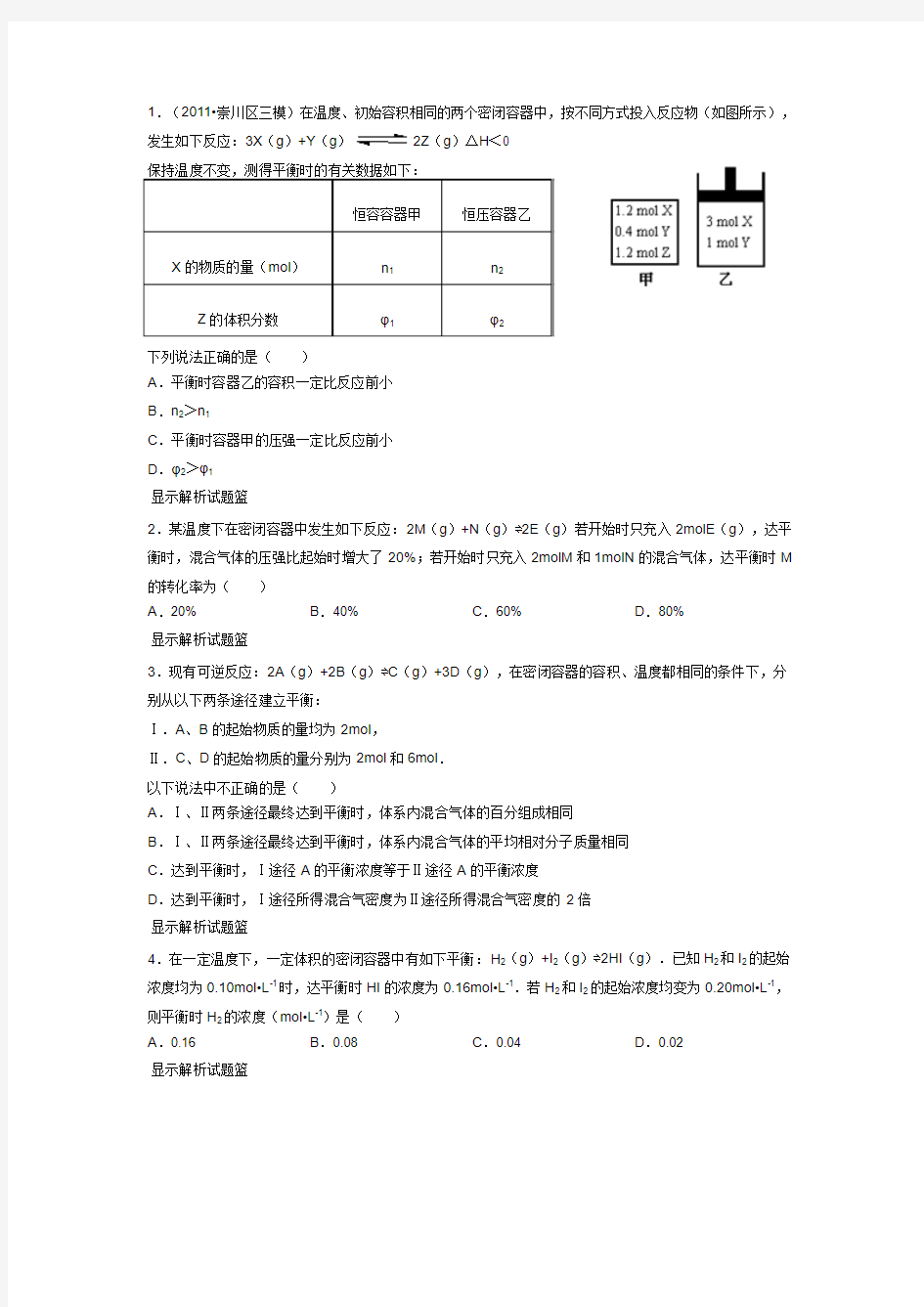
1.(2011?崇川区三模)在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)2Z(g)△H<0
下列说法正确的是()
A.平衡时容器乙的容积一定比反应前小
B.n2>n1
C.平衡时容器甲的压强一定比反应前小
D.φ2>φ1
显示解析试题篮
2.某温度下在密闭容器中发生如下反应:2M(g)+N(g)?2E(g)若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M 的转化率为()
A.20% B.40% C.60% D.80%
显示解析试题篮
3.现有可逆反应:2A(g)+2B(g)?C(g)+3D(g),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:
Ⅰ.A、B的起始物质的量均为2mol,
Ⅱ.C、D的起始物质的量分别为2mol和6mol.
以下说法中不正确的是()
A.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的平均相对分子质量相同
C.达到平衡时,Ⅰ途径A的平衡浓度等于Ⅱ途径A的平衡浓度
D.达到平衡时,Ⅰ途径所得混合气密度为Ⅱ途径所得混合气密度的2倍
显示解析试题篮
4.在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)?2HI(g).已知H2和I2的起始浓度均为0.10mol?L-1时,达平衡时HI的浓度为0.16mol?L-1.若H2和I2的起始浓度均变为0.20mol?L-1,则平衡时H2的浓度(mol?L-1)是()
A.0.16 B.0.08 C.0.04 D.0.02
显示解析试题篮
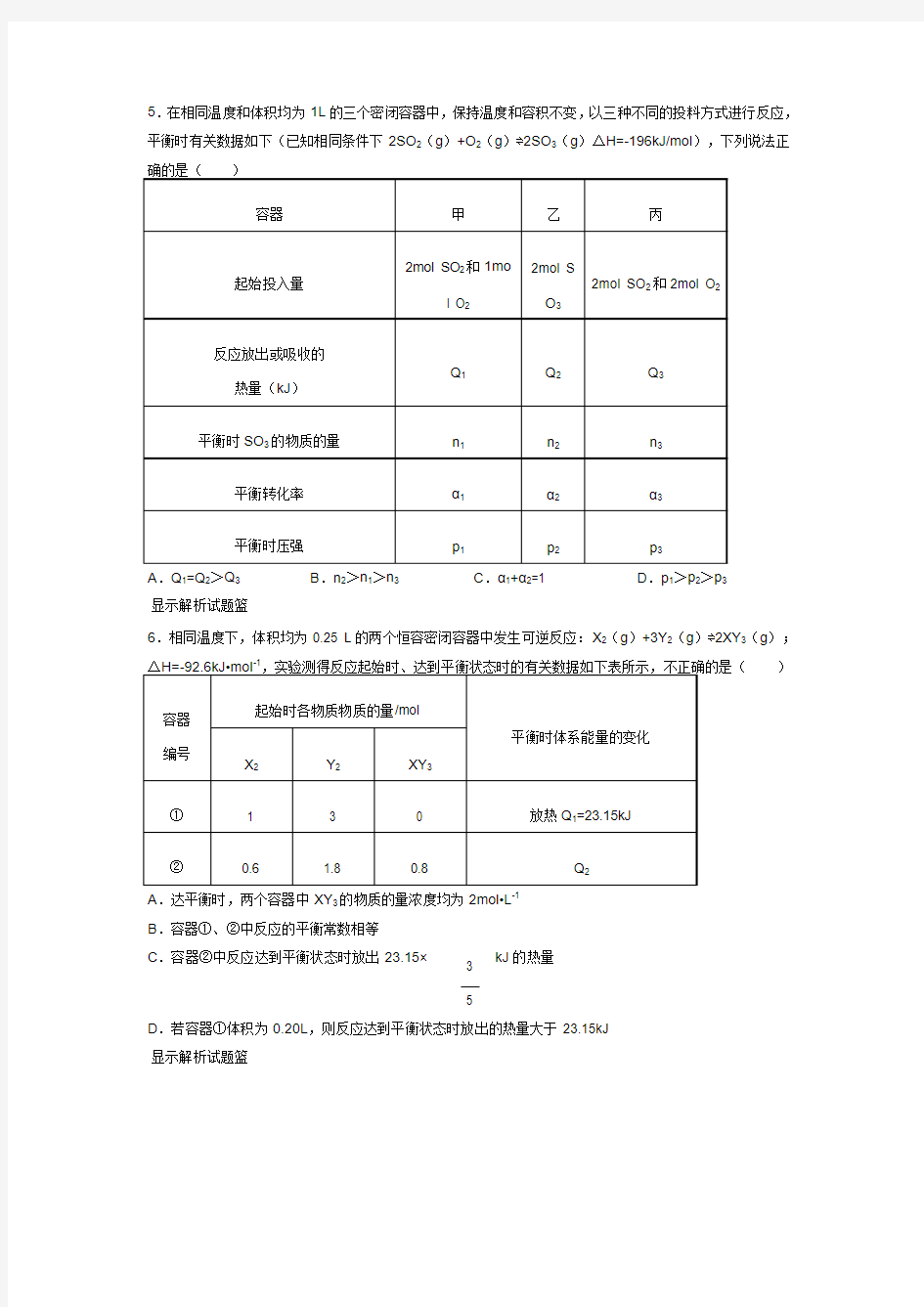
5.在相同温度和体积均为1L 的三个密闭容器中,保持温度和容积不变,以三种不同的投料方式进行反应,平衡时有关数据如下(已知相同条件下2SO 2(g )+O 2(g )?2SO 3(g )△H=-196kJ/mol ),下列说法正
A .Q 1=Q 2>Q 3
B .n 2>n 1>n 3
C .α1+α2=1
D .p 1>p 2>p 3
显示解析试题篮
6.相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:X 2(g )+3Y 2(g )?2XY 3(g );-1 )
A .达平衡时,两个容器中XY 3的物质的量浓度均为2mol?L -1
B .容器①、②中反应的平衡常数相等
C .容器②中反应达到平衡状态时放出23.15×
kJ 的热量
3
5
D .若容器①体积为0.20L ,则反应达到平衡状态时放出的热量大于23.15kJ 显示解析试题篮
7.在相同温度和压强下,对反应CO2(g)+H2(g)?CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,
上述四种情况达到平衡后,n(CO)的大小顺序是()
A.丁>乙>丙=甲B.乙>丁>甲>丙
C.乙=丁>丙=甲D.丁>丙>乙>甲
显示解析试题篮
8.当温度不变的情况下,有反应:2A(g)+2B(g)?C(g)+3D(g),△H<0.现将2mol A和2mol B 充入体积为V的甲容器,将2mol C和6mol D充入乙容器并使乙容器在反应开始前体积为2V(如图1).关于两容器中反应的说法正确的是()
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组分的体积百分组成相同,混合气体的平均相对分子质量也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
D.在甲容器中再充入2molA和2molB,平衡后甲容器中物质C的浓度是乙容器中物质C的浓度的3倍显示解析试题篮
9.向甲乙两个容积均为1L 的恒容容器中,分别充入2mol A 、4molB 和1molA 、2molB .相同条件下,发生下列反应:A (g )+2B (g )
xC (g )△H <0.测得两容器c (A )随时间t 的变化如图所示,下列说法正确的是( )
A .x 可能等于3
B .向平衡后的乙容器中充入氦气可使A 的转化率降低
C .将乙容器单独升温,c (A )可达到0.78mol/L
D .若向甲容器中再充入2molA 、4molB ,平衡时甲容器中c (A )大于1.56mol/L 显示解析试题篮
10.向容积相同的甲、乙密闭容器中投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
-1
下列说法正确的是( ) A .c 1=c 2
B .a+b=1
C .p 1>p 2
D .α1+α2>1
11.在密闭容器中,加入3mol A和1mol B,一定条件下发生反应3A(g)+B(g)?2C(g)+D(g),
达平衡时,测得C的浓度为w mol/L,若保持体积和温度不变,重新按下列配比作起始物质,达到平衡时,
C的浓度仍然为w mol/L的是()
A.6mol A+2mol B
B.1.5mol A+0.5mol B+1mol C+0.5mol D
C.3mol A+1mol B+2mol C+1mol D
D.4mol C+1mol D
12.已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1.在相同温度和体积均为1L的四个密闭容
A.a<2b:e>2f B.a=c:e=g
C.a>d:e>h D.c+98.3e=196.6
13.将3mol A和1mol B混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,
发生了如下反应:3A(g)+B(g)?2C(g)+D(g),达到平衡时C的浓度为wmol/L保持温度和压强
不变,按下列四种配比充入容器P中,平衡后C的浓度仍为wmol/L的是()
A.6mol A+2mol B B.3mol A+1mol B+2mol C
C.2mol C+1mol B+1mol D D.1mol C+2mol D
14.在一个容积固定不变的密闭容器中进行反应:2A (g)+B (g)?3C (g)+D (s),已知将2mol A
和1mol B充入该容器中,反应在某温度下达到平衡时,C的物质的量为w mol,C在平衡混合气体中的体积分数为n%.
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是(选择序号).
A、体系压强不再变化
B、v正A=v逆B
C、体系的密度不再变化
D、混合气体的平均相对分子质量不再变化
(2)如果用下列情况的配比作起始物,在同样的容器和温度下达到平衡,结果:C的物质的量为2w mol,
C在平衡混合气体中的体积分数仍为n%的是
A、4mol A+2mol B+3mol C
B、1mol A+1mol B+3mol C+1mol D
C、6mol C+4mol D
D、2mol A+1mol B+3mol C+2mol D
E、6mol A+3mol B+1mol D
(3)此反应的v-t图象如甲图,若其他条件不变,只是在反应
前加入合适的催化剂,则其v-t图象如乙图,请用“=、<、>”
填空:①a1a2;②两图中阴影部分面积:甲乙.
16.Ⅰ某温度下,密闭容器中充入1mol N2和3mol H2,使之反应合成NH3,平衡后,测得NH3的体积分数为w,如果温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为w,N2、H2、NH3的物质的量分别用x、y、z表示.
)2Z
)dD
(1)压强从4×105Pa增加到6×105Pa时,平衡向(填“正”或“逆”)方向移动,理由是
(2)压强从10×105Pa增加到20×105Pa时,平衡向(填“正”或“逆”)方向移动.
15.(2014?葫芦岛一模)甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、髙效等优良的性能.
(1 )CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g)+3H2(g)=CH3OH(g)+H20(g)△H=-49.0kJ?mol-1
2CH3OH(g)=CH30CH3(g)+H20(g)△H=-23.5kJ?mol-1
则CO2与H2反应合成二甲醚的热化学方程式为
①比较该时刻正、逆反应速率的大小:v(正)v(逆)(填“>”“<”或“=”)
②若加入甲醇后经10min反应达到平横,则平衡后c(CH3OH)= ,该时间内反应速率v(CH3OCH3)
下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是
A.v正(H2)=2v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
E.容器的压强不变
②下列说法正确的是
A、c1=c2
B、Q1=Q2
C、K1=K2
D、a2+a3<100%
③如图表示该反应的反应速率v和时间t的关系图:
各阶段的平衡常数如下表所示:
K4、K5、K6、K7之间的关系为
(用“>”、“<”或“=”连接).反应物的转化率最大的一段时间是.