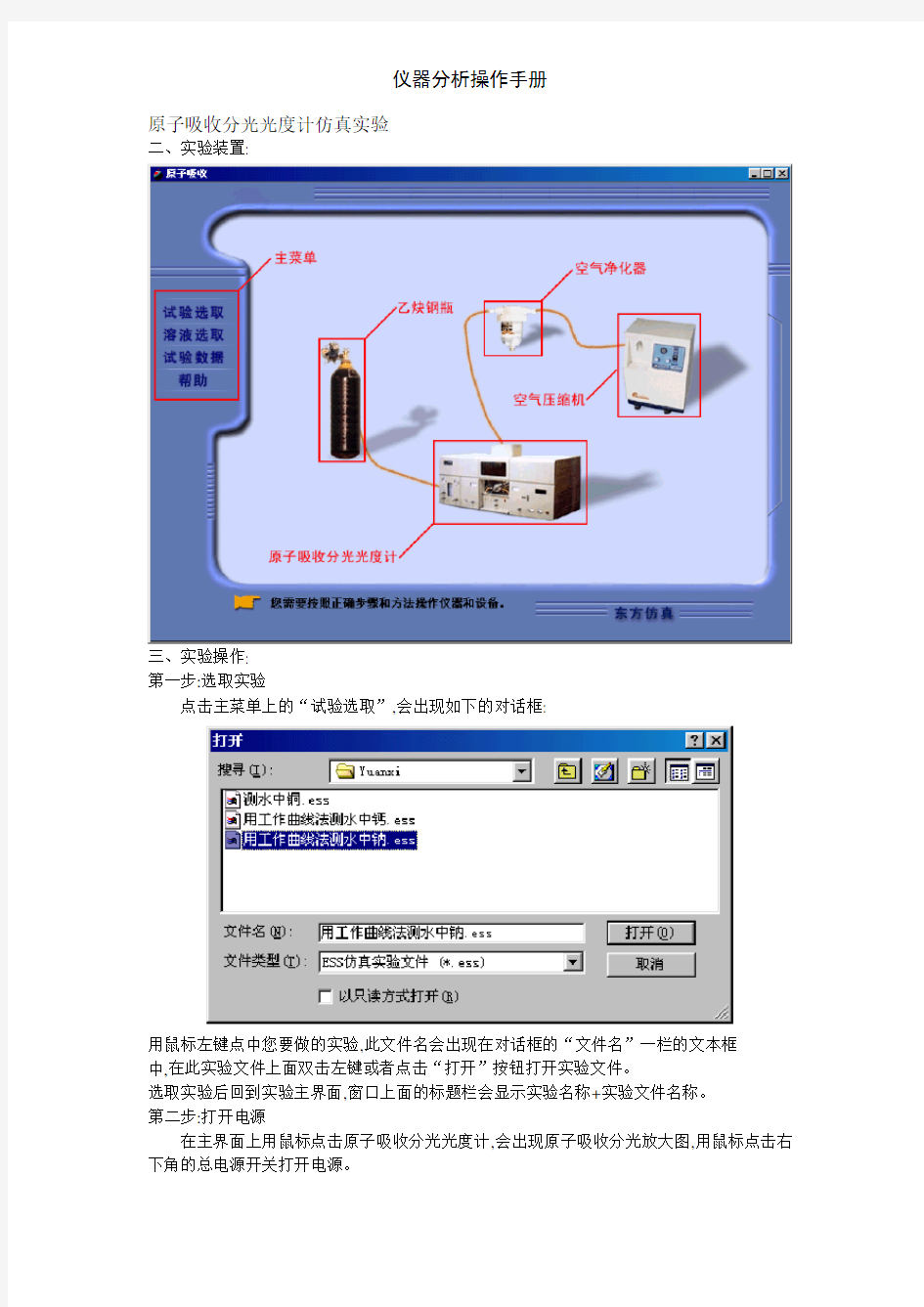

原子吸收分光光度计仿真实验
二、实验装置:
三、实验操作:
第一步:选取实验
点击主菜单上的“试验选取”,会出现如下的对话框:
用鼠标左键点中您要做的实验,此文件名会出现在对话框的“文件名”一栏的文本框
中,在此实验文件上面双击左键或者点击“打开”按钮打开实验文件。
选取实验后回到实验主界面,窗口上面的标题栏会显示实验名称+实验文件名称。
第二步:打开电源
在主界面上用鼠标点击原子吸收分光光度计,会出现原子吸收分光放大图,用鼠标点击右下角的总电源开关打开电源。
第三步:打开空气压缩机电源开关
打开原子吸收分光光度计的总电源开关后,用鼠标点击窗口右下角的“返回”按钮回到主界面,然后点击空气压缩机,会出现空气压缩机窗口,如图所示:用鼠标点击空气压缩机电源开关打开电源,电源上面的指示灯会亮起来。
打开电源开关后,关闭空气压缩机的窗口回到主界面。
第四步:选择阴极灯
回到主界面后,点击原子吸收分光光度计出现原子吸收分光光度计放大图,用鼠标点击左上的阴极灯箱,会出现阴极灯窗口。
做实验时要根据待测元素的不同选择相应的元素灯。用鼠标左键点击左上角的阴极灯的种类,会出现阴极灯选择画面:
用鼠标左键点击要选的阴极灯,然后点击阴极灯电源开关接通电源,灯被点亮。关闭此窗口回到原子吸收分光光度计画面,然后进行下一步。
第五步:粗调节阴极的灯电流
点击原子吸收分光光度计上的阴极灯电流指示位置,会出现阴极灯电流调节窗口:
在调节旋钮上点击鼠标左键增大电流,点击右键减小电流。根据实验要求,调节电流再8~11mA之间。然后关闭电流表调节窗口,回到原子吸收分光光度计画面。
第六步:波长扫描
用鼠标点击原子吸收分光光度计右下的波长扫描按钮,左边白色的按钮就是在一定范围内自动从大到小扫描,灰色按钮就是在一定范围内自动从小到大扫描,系统会自动扫描找到最合适的波长。
第七步:调节多功能面板
用鼠标点击原子吸收分光光度计右上的多功能面板,出现多功能面板的放大图。
多功能面板上的调节旋钮用鼠标左键点击逆时针旋转,用鼠标右键点击顺时针旋转。调节“方式”到“调整”档,然后关闭多功能面板窗口回到原子吸收分光光度计画面。
第八步:调节阴极灯位置
用鼠标步左键点击原子吸收分光光度计右下的能量表,会出现能量表的放大图,用鼠标点中能量表窗口的蓝色标题栏,然后按住左键移动鼠标,窗口就会跟随鼠标的轨迹移动,按照此方法把能量表窗口移动到屏幕靠边上的位置。然后用鼠标点击原子吸收分光光度计的阴极灯箱,出现阴极灯调节窗口。此时应调节窗口的位置,使得在调节阴极灯位置的时候可以瞧到能量仪表。
《仪器分析》课程教学大纲 课程编号:190142110 课程类型:必修课 英文名称:Instrumental Analysis 课程类型:基础方向课 学时:64学时讲课学时:60学时 学分:4学分 适用对象:环境科学专业、化学专业 先修课程:无机化学、分析化学、有机化学、高等数学、计算机 执笔人:刁春鹏审定人:张金萍 一、课程的性质、目的与任务以及对先开课要求 仪器分析是化学学科的一个重要分支,它是以物质的物理和物理化学性质为基础建立起来的一种分析方法。利用较特殊的仪器,对物质进行定性分析,定量分析,形态分析及结构分析。它具有测定快速、灵敏、准确和自动化程度高等特点,它是分析化学的发展方向。 仪器分析是化学专业必修的基础课程之一。仪器分析的主要任务是介绍常用的主要仪器分析方法,介绍这些分析方法的基本原理、基本概念和典型仪器的结构与性质,利用这些仪器完成定性、定量、定结构的分析任务,为今后开展科学研究和更好的指导工农业生产打下牢固的基础。 仪器分析是建立在无机化学、分析化学、有机化学、高等数学、物理学及计算机基础上的后续课程,它为后续课和今后的科研工作打下扎实的理论基础和操作技能。它是许多学科进行科学研究不可缺少的重要测试手段,并在提高人才素质和实现现代化的进程中,发挥着越来越重要的作用。 二、教学重点与难点 本课程重点介绍光谱、电化学和色谱三大块和质谱法的内容。 掌握常用仪器分析方法的基本原理、基本知识和基本技能。如:紫外-可见吸收光谱法,红外吸收光谱法,分子发光分析法,原子发射光谱法原子吸收光谱法,电位分析法,极谱分析法,色谱分析法,核磁共振波谱法和质谱分析法等。 了解仪器的结构及常用仪器的主要组成部分,学会使用一些仪器。 要求学生初步具有根据分析的目的、要求和各种仪器分析方法的特点、应用范围,选择适宜的分析方法以解决分析化学问题的能力。了解一些仪器分析方法和技能在实际中的应用,为后续课的学习及今后科学研究打下一定的基础。 三、与其他课程关系 仪器分析是建立在无机化学、分析化学、有机化学、高等数学、物理学及计算机基础上的后续课程,用到先修课的一些基础知识。 四、教学内容、学时分配及基本要求 第1章绪论 学时:2
第二章 电化学分析法 6.计算[OH –] = 0.05 mol/L ,p(O2)=1.0×103 Pa 时,氧电极的电极电势,已知O2 +2H2O+4e= 4OH –,φθ=0.40 V 。 解:根据能斯特方程 ()ln (Re )RT a Ox nF a d θ??=+ 代入数据计算得?=0.438V 7. 试从有关电对的电极电势,如?θ(Sn2+/Sn )、?θ(Sn4+/Sn2+)及?θ(O2/H2O ),说明为什么常在SnCl2溶液加入少量纯锡粒以防止Sn2+被空气中的氧所氧化? 答:?θ值较大的电对中的氧化态物质能和?θ值较小的电对中的还原态物质反应。所以在SnCl2溶液加入少量纯锡粒以防止Sn2+被空气中的氧所氧化\ 11. 下述电池中溶液,pH = 9.18时,测得电动势为0.418 V ,若换一个未知溶液,测得电动势为0.312 V ,计算未知溶液的pH 值 玻璃电极)(H x s a a 或+饱和甘汞电极 答:根据pH 的实用定义公式:F /RT .E E 3032s x pHs pHx -+=, 代入数据得PH=7.39 12. 将ClO4-离子选择性电极插入50.00 mL 某高氯酸盐待测溶液,与饱和甘汞电极(为负极)组成电池,测得电动势为358.7 mV ;加入 1.00 mL 、0.0500 mol /L NaClO4标准溶液后,电动势变成346.1 mV 。求待测溶液中ClO4-浓度。 答:根据 /0.059(101)s s x n E x c V c V ±?=-,代入数据 Cx=1.50?10-3mol/L 第五章 气相色谱分析法 6.当下述参数改变时: (1)增大分配比,(2) 流动相速度增加, (3)减小相比, (4) 提高柱温,是否会使色谱峰变窄?为什么? 答:(1)保留时间延长,峰形变宽; (2)保留时间缩短,峰形变窄; (3)保留时间延长,峰形变宽; (4)保留时间缩短,峰形变窄。 11. 分析某种试样时,两个组分的相对保留值r21=1.11, 柱的有效塔板高度H=1mm ,需要多长的色谱柱才能完全分离? 解:根据公式 2121212111(()r r R r r --= 得L=3.67 m
大学几乎所有学科的课本答案 ! 任明嘉的日志 经济金融 [PDF格式]《会计学原理》同步练习题答案 [Word格式]《成本会计》习题及答案(自学推荐,23页) [Word格式]《成本会计》配套习题集参考答案 [Word格式]《实用成本会计》习题答案 [Word格式]《会计电算化》教材习题答案(09年) [JPG格式]会计从业《基础会计》课后答案 [Word格式]《现代西方经济学(微观经济学)》笔记与课后习题详解(第3版,宋承先)[Word格式]《宏观经济学》习题答案(第七版,多恩布什) [Word格式]《国际贸易》课后习题答案(海闻P.林德特王新奎) [PDF格式]《西方经济学》习题答案(第三版,高鸿业)可直接打印 [Word格式]《金融工程》课后题答案(郑振龙版) [Word格式]《宏观经济学》课后答案(布兰查德版) [JPG格式]《投资学》课后习题答案(英文版,牛逼版) [PDF格式]《投资学》课后习题答案(博迪,第四版) [Word格式]《微观经济学》课后答案(高鸿业版) [Word格式]《公司理财》课后答案(英文版,第六版)
[Word格式]《国际经济学》教师手册及课后习题答案(克鲁格曼,第六版) [Word格式]《金融市场学》课后习题答案(张亦春,郑振龙,第二版)[PDF格式]《金融市场学》电子书(张亦春,郑振龙,第二版) [Word格式]《微观经济学》课后答案(平狄克版) [Word格式]《中级财务会计》习题答案(第二版,刘永泽) [PDF格式]《国际经济学》习题答案(萨尔瓦多,英文版) [JPG格式]《宏观经济学》课后答案(曼昆,中文版) [PDF格式]《宏观经济学》答案(曼昆,第五版,英文版)pdf格式 [Word格式]《技术经济学概论》(第二版)习题答案 [Word格式]曼昆《经济学原理》课后习题解答 [PDF格式]西方经济学(高鸿业版)教材详细答案 [Word格式]完整的英文原版曼昆宏观、微观经济学答案 [Word格式]《金融市场学》课后答案(郑振龙版) 化学物理 [Word格式]《固体物理》习题解答(方俊鑫版) [Word格式]《简明结构化学》课后习题答案(第三版,夏少武) [Word格式]《生物化学》复习资料大全(3套试卷及答案+各章习题集)[PDF格式]《光学教程》习题答案(第四版,姚启钧原著) [Word格式]《流体力学》实验分析答案(浙工大版) [Word格式]《高分子化学》课后习题答案(第四版,潘祖仁主编)
《仪器分析》课程教学大纲 (Instrumental Analysis) 【课程代码】024601102【课程修习类型】必修(平台课程) 【开课学院】材料与化学化工学院【适用专业】化学 【学分数】3 【学时数】总学时48学时 【建议修读学期】二秋【先修课程】无机化学、物理、高等数学、 分析化学、有机化学 一、课程说明 1.课程介绍(中、英文) 仪器分析是化学专业的专业核心课,应化及制药工程专业的专业选修课之一。它是研究物质的化学组成、结构和状态的分析测试方法,也是其它学科取得化学信息的研究手段,在许多领域发挥着重要的作用。课程涉及的知识面广且综合性强,包括各种现代仪器分析方法的物理和化学的原理、特点、仪器的结构原理、定性定量分析原理、方法及其应用范围。本课程主要讲解原子发射光谱、原子吸收光谱、分子发光分析法、电位分析法、电解库仑分析法、伏安与极谱法、气相色谱、液相色谱及毛细管电泳等分析方法。 通过本课程的学习,使学生能够基本掌握主要仪器分析方法的原理及应用领域,掌握应用合适的方法进行实际样品分析,并解决相应分析化学问题的能力。 仪器分析在工业、农业、环境、医药、健康、食品及科学研究等方方面面都有着广泛的应用。掌握各种仪器分析方法,不仅有利于学生提高化学及相关学科的学习和研究能力,而且能更快更好地与社会接轨,提高他们的就业竞争力。因此,仪器分析课程在化学及相关专业的人才培养过程中起到承前启后的作用。 Brief Introduction of Instrumental Analysis Instrumental analysis is one of core courses in chemical majors. It is not only an analytical test method for studying chemical composition, state and structure of matter, but also a research method of obtaining chemical information in other science. Instrumental analysis is an important analytical detection means that plays an important role in a lot of field. The course of Instrumental analysis involves a wide range of knowledge with strong comprehensive, including physical and chemical principle, the characteristics, structure principle, qualitative and quantitative analysis principle and its application scope of all kinds of modern instrumental analysis methods. The course explains basic principle ,instrumental operation and application principle of atomic emission spectroscopy, atomic absorption spectroscopy, molecular luminescence analysis, potentiometric analysis, electrolytic analysis, coulometry, voltammetry and polarography, gas chromatography and liquid chromatography, etc. The purpose of this course is to help the students to understand the basic principle of the various instrumental analysis methods and know where they can be applied. Help the students to gain the abilities of choosing an appropriate method to analyze actual sample as well as solving the problems encountered in the process of analysis.
2016级成人高等教育中医学院本科班 《仪器分析》作业 班级: 姓名: 学号: 第一章绪论 1.仪器分析的特点。 2.仪器分析方法的类型。 3.学习仪器分析的方法。 第二章光谱分析法概论 一、名词解释 电磁辐射电磁波谱原子吸收光谱光谱法 二、简答题 1.简述光学分析法的三个过程。 2.光的波粒二相性基本参数 3.光谱区中紫外、可见、红外对应的波长范围? 4.光谱法的仪器由哪几部分组成?它们的作用是什么? 三、计算题 1.计算 (1) 2500cm-1波数的波长(nm) (2) Na 588-995nm相应的能量(eV) (3) 670. 7nm Li线的频率(Hz) 2.计算下列各种跃迁所需的能量范围(eV)及相应的波长范围 (1)原子内层电子跃迁 (2)原子外层电子跃迁 (3)分子的电子跃迁 (4)分子振动能级跃迁 (5)分子转动能级跃迁
3.阐述为什么原子光谱为线光谱,分子光谱为带光谱。如果说原子光谱谱线强度分布也是峰状的,对吗?为什么? 第三章紫外-可见分光光度法 1.名词解释 透光率吸光系数(摩尔吸光系数、百分吸光系数)发色团和助色团吸收曲线标准曲线末端吸收试剂空白 2.物质对光的吸收程度可用哪几种符号表示,各代表什么含义? 3.什么是朗伯-比尔定律?其物理意义是什么? 4.简述导致偏离朗伯-比尔定律的原因。 5.什么是吸收曲线?制作吸收曲线的目的是什么? 6.在分光光度法中,为什么要控制溶液的透光率读数范围在20%?65%之间?若T超出上述范围,应采取何种措施? 7.简述紫外-可见分光光度计的主要部件及基本功能。 8.每100mL中含有0.701mg溶质的溶液,在1cm吸收池中测得的透光率为40.0%,试计算: (1)此溶液的吸光度。 (2)如果此溶液的浓度为0.420mg/100mL,其吸光度和百分透光率各是多少? 第四章红外分光光度法 1.分子吸收红外光发生能级跃迁,必须满足的条件是什么? 2.何为红外非活性振动? 3.下列化合物能否用红外吸收光谱区别,为什么? —CH2COOCH3—COOC2H5 4.由茵陈篙分离出来的精油,其分子式为C12H10,UV EtOH λ239nm(ε537), max 253nm(ε340),红外光谱见课本P81,是解析其结构。 5.影响谱带位置的因素有哪些?
2010级环境工程工程硕士高玉春学号:MP1025005 环境催化作业: 环境催化 1. 环境催化的概述 1.1环境催化的定义 环境催化至今都没有明确的定义,,给出其定义有一定的困难,但是根据一些专家的理解,环境催化应该包括认为的环境催化和自然界中自发的环境催化[1,2],认为的环境催化内容仅限于在以下的过程中研究和使用的催化科学和技术:消除已经产生的污染物;减少能源转化过程中有害物质的产生;将废物转化为有用之物。自发的环境催化可以将整个地球大气层看成一个光和热的反应器,因限于研究和地球表面以及大气颗粒物有关的非均相大气化学中的界面催化过程[3]。 1.2环境与催化 中国以及世界上其他国家颁布的环境保护法规对环境一词的界定有所不同,《中华人民共和国环境保护法》把环境定义为:影响人类生存和发展的各种天然的和经过人工改造的自然因素的总体,包括大气,水,海洋,土地,矿藏,森林,草原,野生动物,自然保护区,风景名胜,城市和乡村等[4]。事实上,人类生存的环境是十分庞大而复杂的的系统,包括自然环境和社会环境。 化学反应物要想发生化学反应,必须使其化学键发生改变,改变或者断裂化学键需要一定的能量支持,能使化学键发生改变所需要的最低能量阈值称之为活化能,而催化剂通过降低化学反应物的活化能而使化学反应更易进行,且大大提高反应速率[5]。 催化的概念是1836年由瑞典化学家Berzelius提出来的,催化科学和技术取得了很大的进步,成为现在工业文明的重要基石之一[6],80%以上的化学工业涉及及催化技术,发达国家的GDP的20%至30%来源于催化技术直接和间接的贡献。 2.室内空气催化净化 2.1室内空气净化的起因
浅谈对仪器分析这门课的认识 摘要:不论是大气污染还是水质污染,都要求采用先进的测定技术对环境介质中污染物的浓度进行准确定位和评价。例如,在了解酸雨程度时,适宜采用离子色谱法;氟氯烃类气体和有机农药的测定,不但需要高难度的采样和预处理技术,还需要采用气相色谱法或气质联用技术( GC -MS) 进行测定;如上所述,在大气污染、水质污染这两个领域中,各类污染物质均需要相应的分析方法。因此仪器分析这门课的学习是相当重要的。 关键词:大气污染、水污染、仪器分析 仪器分析这门课是我向往已久的课程,因为在上学期通过学习环境监测以及做一些专业基础实验,我对化学分析仪器已经产生了浓厚的兴趣,所以很是向往仪器分析这门课。另一方面,对于环境工程专业的我们来说,学好仪器分析这门课对我们来说尤为重要,因为环境质量的不断恶化使得人们对环境质量的关注上升到更高的层次。环境质量监测需要应对更大数量的样品和更快的分析速度,因此现代化的检测方法成为环境监测的必由之路。所以光谱法、色谱法、色-质联用技术、电感耦合等离子体质谱法及流动分析等仪器分析技术在环境监测中尤为重要【1】。但当我真正开始学习这门课的时候,才发现仪器分析并没有想象中的那么简单。因为《仪器分析》的各章节之间联系不够紧密,知识琐碎,仪器结构复杂,原理抽象,涉及面广。例如对于气相色谱仪这一仪器来说,虽然书上介绍的很详细,老师讲解的也很细致,但听完之后对于它的整个气路流程还是不是很清楚,简单通过听课或者看书很难达到记忆深刻的目的。所以自己课下也会找到一些适合自己的方法来学习。 1善于总结。 对于仪器分析这门课,虽然它的知识点很琐碎,各章节之间联系也不是很紧密,但每门课学习结束后的总结是我必做的一件事情,因为不仅加深了我的记忆,还能够通过总结比较拓宽我的知识广度和深度。例如对于仪器分析中的原子吸收光谱法与原子发射光谱法来说,自己就在课下做了一些总结,并且总结的同时也会通过过程图来进行记忆。 图1 笔记总结图2 原子吸收仪示意图 1.1原子吸收光谱法 (1)原子吸收光谱法以测量待测元素的气态基态原子外层电子对其特征谱线的吸收作
1.是否能用普通电位计或伏特计测量参比电极和pH玻璃电极所组成电池的电动势?简述原因。 答:不能。因为玻璃电极的内阻(50MΩ~500MΩ)很高,若采用普通电位计或伏特计测量其电位,会引起较大的测量误差。用普通电位计或伏特计测量玻璃电极所组成电池的电动势时,若检流计的灵敏度为10-9A(测量中有10-9A电流通过),玻璃电极的内阻108Ω,当这微小电流流经电极时,由于电压降所引起的电动势测量误差可达:△E=IV=10-9×108=0.1V,它相当于1.7个pH单位的误差。因此不能用普通电位计或伏特计测量参比电极和pH玻璃电极所组成电池的电动势。 2.已知=0.10,若试样溶液中F-浓度为1.0×10-2mol/L时,允许测定误差为 5%,问溶液允许的最大pH(以浓度代替活度计算)为多少? 解:离子电极选择性误差用下式表示和计算: 即: -离子选择电极插入50.00ml某高氯酸盐待测溶液,与饱和甘汞电极(为3.将一支ClO 4 负极)组成电池。25℃时测得电动势为358.7mV,加入1.00ml NaClO 标准溶液 4 -浓度。 (0.0500mol/L)后,电动势变成346.1mV。求待测溶液中ClO 4 解: -为阴离子,但该离子选择电极为电池的正极,因此S为负值。注意:此题中虽然ClO 4 4. 用离子选择电极校正曲线法进行定量分析有什么优点?需注意什么问题?使用TISAB有何作用? 答:离子选择电极校正曲线法进行定量分析的优点是适用于大批量的样品分析。定量分析中应注意实验条件的一致,特别是待测液和标准溶液系列的离子强度须保持一致。使用TISAB的作用为:①保持待测液和标准溶液系列的总离子强度及活度系数恒定;② 维持溶液在适宜的pH范围内,满足离子电极的要求;③掩蔽干扰离子。
2(C)、3(D) 、5(B)、7 (C)、8(D)、9(C)、 10(D)、12(C)、13(A)、15(A) 、16(D)、18(B)、19(A)、20 (A)、21(A)、22 (C)、23 (A)、24 (A)、25(C) 、30(D)、32 (C)、33(A)、34(D)、36 (C)、37(C)、41(A )、44(C)、45( D) 1、共振(吸收)线。 2、不会改善 3、自吸 4、各种元素的原子核外层电子基态与激发态之间的能级差( E)大小不同,受 激跃迁时,不同的原子都有其特征的光谱线及线组;2~3条。 5、高频发生器、等离子炬管、雾化器; 稳定性好、基体效应小、线性范围宽、检出限低、应用范围广、自吸效应 小、准确度高。 6、Li的670.785nm的原子线;Be的313.042的一级离子线。 7、元素光谱图中的铁光谱线为波长标尺,可为查找谱线时作对照用。 8、第一激发态, 基态. 9、分辨率色散率 11、分析线或分析线对有背景干扰扣除背景 14、铁谱比较法标准试样光谱比较法
15、谱线波长标尺来判断待测元素的分析线 1、答:因为谱线强度I不仅与元素的浓度有关,还受到许多因素的影响,采用内标法 可消除操作条件变动等大部分因素带来的影响,提高准确度。 可作内标法分析线对的要求是: 1.两谱线的激发电位相同或接近。 2.波长尽可能接近,无自吸。 3.两谱线的强度不应相差太大。 4.两谱线应不受其它谱线干扰。 3、答:当某一元素的谱线射出弧层时,由于弧层外部的同类冷原子对此辐射产生吸收,使得光强与原子的浓度不呈正比关系,这种现象称为自吸。 5、答:原子线:原子被激发所发射的谱线。 离子线:离子被激发所发射的谱线。 灵敏线:一些激发电位低的谱线,它的发光强度大。 分析线:分析过程中所使用的谱线,也即确定某一元素是否存在的谱线。 分析线对:定量分析中的分析线对由分析线与内标线组成。从被测元素中选一根谱线作为分析线,从内标元素中选一条谱线作为内标线,以它们的相对强度比lg R作工作曲线,使光源强度对谱线强度影响得到补偿。 6、答:最后线: 元素含量减少而最后消失的谱线。
课程编号: 《仪器分析及实验》课程教学大纲 (Teaching Outline of Instrumental Analysis and Experiments) 总学时:96 学分:2+1.5 一、课程简介 1、课程性质:专业必修 2、开课学期:第4学期 3、适用专业:化学(师范)、应用化学 4、课程修读条件:学习本课程前应先学习无机化学、有机化学、分析化学、分析化学实验和普通物理等课程。 5、课程教学目的: 仪器分析是通过测量物质的物理或物理化学性质来确定某些化学组成、含量及化学结构的一类分析方法。它具有实验性强和应用性强的特点,随着科学技术的发展,其应用日益广泛,它在化学学科中的地位越来越重要。通过教学,应使学生: (1)掌握有关的仪器分析方法的基本原理、方法特点; (2)掌握有关的仪器的工作原理和构造; (3)掌握有关节仪器分析的定性、定量分析方法。 二、教学基本要求或建议: 通过本课程的学习,要求学生掌握仪器分析方法的基本原理和方法特点,掌握一些简单分析仪器的操 作方法,了解并初步掌握一些大型分析仪器的操作方法,并初步具有分析问题和解决问题的能力。 三、内容纲目及标准: (一)理论部分 学时数(42) 绪论 [教学目的] 通过绪论教学,使学生初步了解仪器分析方法特点、方法分类和发展概况,并使学生对仪器分 析感兴趣。 [教学重点与难点]各种仪器分析方法 第一节仪器分析和化学分析 1、化学分析 2、仪器分析 第二节仪器分析方法 1、光分析法 2、电化学分析法 3、色谱分析法 4、其它仪器分析法 第三节仪器发展概况 第一章电磁辐射基础
[教学目的] 初步了解电磁辐射,电磁波谱的基本概念,正确理解原子光谱和分子光谱,熟悉射光谱、吸光谱、荧光光谱和曼散射,并对上述概念加以对比和区分。 [教学重点与难点]电磁辐射的基本性质,原子光谱与分子光谱,发射光谱与吸收光谱。 第一节电磁辐射的基本性质 1、电磁辐射 2、光的二象性 3、辐射能参数 4、辐射能的特性 第二节原子光谱与分子光谱 1、原子光谱 2、分子光谱 第三节光分析法的分类 1、光谱法 2、非光谱法 第二章原子发射光谱 [教学目的] 掌握发射光谱法(AES)基本原理,影响谱线强度的因素;谱线强度与组分浓度的关系、定性、定量分析方法。理解内标法原理,了解AES仪器的组成及各部伯的作用。 [教学重点与难点]AES方法原理,定性定量分析方法,仪器结构及各部分的功能。 第一节方法原理 1、原子光谱的产生 2、谱线强度 3、谱线的自吸和自蚀 第二节仪器装置 1、光源 2、分光原件 3、检测器 第三节分析方法 1、光谱定性分析 2、光谱半定量分析 3、光谱定量分析 第三章原子吸收光谱法与原子荧光光谱法 [教学目的] 掌握原子吸收光谱法(AAS)基本原理AAS分析中的干扰及消除,定量分析方法。理解发积分吸收与峰值吸收,仪器构造及各部分的功能。 [教学重点与难点]AAS、AFS方法原理,AAS定量分析方法,AAS光度计的构造及各部件的功能。 第一节概述 第二节原子吸收分光光度法基本原理 1、基态原子与激发态原子的关系 2、原子吸收线的宽度
第十二章 【12.5】 如果要用电解的方法从含1.00×10-2mol/L Ag +,2.00mol/L Cu 2+的溶液中,使Ag+完全析出(浓度达到10-6mol/L)而与Cu 2+完全分离。铂阴极的电位应控制在什么数值上?(VS.SCE,不考虑超电位) 【解】先算Cu 的 起始析出电位: Ag 的 起始析出电位: ∵ Ag 的析出电位比Cu 的析出电位正 ∴ Ag 应当先析出 当 时,可视为全部析出 铂阴极的电位应控制在0.203V 上,才能够完全把Cu2+ 和Ag+分离 【12.6】 (5)若电解液体积为100mL ,电流维持在0.500A 。问需要电解多长时间铅离子浓度才减小到 0.01mol/L ? 【解】(1)阳极: 4OH - ﹣4e - →2H 2O+O 2 Ea θ =1.23V 阴极:Pb 2++2e - → Pb Ec θ =﹣ 0.126V ()220.059,lg 0.3462 Cu Cu Cu Cu v ??Θ++ ??=+ =??(,)0.059lg[]0.681Ag Ag Ag Ag v ??Θ++=+=6[]10/Ag mol l +-=3 3 -63 SCE =0.799+0.059lg10=0.445v 0.445v-0.242v=0.203v ????'=-=
Ea=1.23+(0.0592/4)×4×lg10﹣5=0.934V Ec=﹣0.126+(0.0592/2)×lg0.2=﹣0.147V E=Ec﹣Ea=﹣1.081V (2)IR=0.5×0.8=0.4V (3)U=Ea+ηa﹣(Ec+ηc)+iR=2.25V (4)阴极电位变为:﹣0.1852 同理:U=0.934+0.1852+0.77+0.4=2.29V (5)t=Q/I=nzF/I=(0.200-0.01)×0.1×2×96487/0.500=7.33×103S 【12.7】 【12.8】用库仑滴定法测定某有机一元酸的摩尔质量,溶解 0.0231g纯净试样于乙醇与水的混合溶剂中, 以电解产生的 OH-进行滴定,用酚酞作指示剂,通过0.0427A 的恒定电流,经6min42s到达终点,试计算此有机酸的摩尔质量。【解】 m=(M/Fn)×it t=402s;i=0.0427;m=0.0231g;F=96485;n=1 解得 M = 129.8g/mol
《仪器分析》课程标准 (供2009级药物分析技术专业用) 第一部分前言 一、课程背景 药学高等职业教育肩负着培养面向药学生产、建设、服务和管理一线需要的高技能人才的使命,为了适应新形势下高职药学专业教育改革和发展的需要,进一步提高教学水平和办学质量,在学院领导和教务处的大力支持下,我系根据高等职业院校课程建设必须贯彻“以服务为宗旨,以就业为导向,走产学结合发展道路”以专业建设为龙头,加快课程改革和强化特色的要求,于2006年12月开始组织高职高专药品类专业(包括药学、药品经营与管理、药物制剂技术、生物制药技术专业)的教学计划(草稿)和课程标准的编制工作,为了进一步完善教学计划,编写好课程标准,我们在岗位调研和深入部分校企合作单位征求意见的基础上,先后召开了药学专业的改革与发展研讨会和组织系教学指导委员会全体成员进行了多次专题讨论,为了了解和学习国内同类专业的课程建设情况和经验,我系先后派出8名教师参加卫生部教材办组织的新一轮全国高职高专药品类专业教学大纲和教材的编写工作。通过学习、调研和讨论,我们在总结多年药学专业教改实践经验的基础上,突破以学科设置专业课程的传统模式,初步形成“针对专业岗位对毕业生的知识、能力和素质要求构建体现‘四化’特色的复合型药学应用性人才培养课程体系”的共识。 1.教育理念职业化人才培养方案以市场需求为导向,贯穿“工学结合”的教育理念。以培养“一专多能的复合型药学应用性人才”为目标。 2.培养方向动态化课程体系应体现“以宽口径平台支撑多个就业方向”特色,充分体现在统一基础知识平台上进行分流培养的原则;体现“以人为本”,有利于学生的个性化培养的原则。为学生发现自己兴趣与潜能,及时调整学习方向,适应社会需求动态变化提供可能。 3.课程体系模块化突破传统“三段式”课程模式,设计适合复合型药学应用性人才培养特点的六个课程模块,从分析学生专业岗位能力入手,在确定岗位目标的基础上,根据岗位能力的确定和分解,明确岗位课程。 4.知识体系综合化课程目标和课程标准应根据高职教育规律、特点和多个岗位需求,体现对专业相关知识的综合性要求,在专业理论知识和技术原理方面、前沿技术了解和掌握程度方面,复合型人才的知识和能力体现方面都要有明确的要求,以便及时适应药学行业技术不断升级和高新技术转化迅速的特点。 二、课程性质 1.仪器分析法包括物理分析法和物理化学分析法,具有灵敏、快速、准确的特点,应用非常广泛。按照测量过程中所观测的性质分类,仪器分析法可分为电化学分析法、一般光学分析法、光谱分析法、色谱分析法、质谱分析法等。近几年来,电子技术、计算机技术和激光技术的发展,推动了仪器分析方法的快
第2章气相色谱分析 一.选择题 1.在气相色谱分析中, 用于定性分析的参数是( A ) A 保留值 B 峰面积 C 分离度 D 半峰宽 2. 在气相色谱分析中, 用于定量分析的参数是( D ) A 保留时间 B 保留体积 C 半峰宽 D 峰面积 3. 使用热导池检测器时, 应选用下列哪种气体作载气, 其效果最好?( A ) A H2 B He C Ar D N2 4. 热导池检测器是一种( A ) A 浓度型检测器 B 质量型检测器 C 只对含碳、氢的有机化合物有响应的检测器 D 只对含硫、磷化合物有响应的检测器 5. 使用氢火焰离子化检测器, 选用下列哪种气体作载气最合适?( D ) A H2 B He C Ar D N2 6、色谱法分离混合物的可能性决定于试样混合物在固定相中( D )的差别。 A. 沸点差, B. 温度差, C. 吸光度, D. 分配系数。 7、选择固定液时,一般根据( C )原则。 A. 沸点高低, B. 熔点高低, C. 相似相溶, D. 化学稳定性。 8、相对保留值是指某组分2与某组分1的(A )。 A. 调整保留值之比, B. 死时间之比, C. 保留时间之比, D. 保留体积之比。 9、气相色谱定量分析时( B )要求进样量特别准确。 A.内标法; B.外标法; C.面积归一法。 10、理论塔板数反映了( D )。 A.分离度; B. 分配系数;C.保留值;D.柱的效能。 11、下列气相色谱仪的检测器中,属于质量型检测器的是( B ) A.热导池和氢焰离子化检测器; B.火焰光度和氢焰离子化检测器; C.热导池和电子捕获检测器;D.火焰光度和电子捕获检测器。 12、在气-液色谱中,为了改变色谱柱的选择性,主要可进行如下哪种(些)操作?(D ) A. 改变固定相的种类 B. 改变载气的种类和流速 C. 改变色谱柱的柱温 D. (A)、(B)和(C) 13、进行色谱分析时,进样时间过长会导致半峰宽( B )。 A. 没有变化, B. 变宽, C. 变窄, D. 不成线性 14、在气液色谱中,色谱柱的使用上限温度取决于( D ) A.样品中沸点最高组分的沸点, B.样品中各组分沸点的平均值。 C.固定液的沸点。 D.固定液的最高使用温度 15、分配系数与下列哪些因素有关( D ) A.与温度有关; B.与柱压有关; C.与气、液相体积有关; D.与组分、固定液的热力学性质有关。
. 仪器分析课程标准 1、前言 1.1课程定位 仪器分析是工业分析与检验专业必修的一门专业核心课程,其主要包括了分光度分析法和气相色谱,液相色谱法分析法等基本分析方法,其主要功能是使学生通过具体的仪器使用项目化学习,掌握这些仪器的正确和规范使用,达到能使用这些设备完成具体的分析任务的目的。本课程应在 《分析基本操作技术》课程之后与《理化常数检验》、《工业分析》同时开设,以强化学生对化学检验的理解和应用。 1.2设计思路 仪器分析是工业分析与检验专业的一门核心课程。其主要任务是介绍常用的主要仪器分析方法,介绍这些分析方法的基本原理、基本概念和典型仪器的结构与性质,利用这些仪器完成定性、定量分析的任务,为后续课程的学习打下良好的基础,为分析检验工作保驾护航。 通过该课程的学习,使学生具备初步独立进行定量分析的能力,其目标是培养学生具备从事工业分析及与分析化学检验相关的基本职业能力,达到中级化学检验工职业资格证书中相关技术考核的基本要求。 本课程标准的设计思路从工作任务、知识要求与技能要求三个维度对课程内容进行规划与设计,将知识基本和技能要求融入工作任务。本标准分为主要六大部分内容:电化学分析、紫外可见分析、原子吸收分析、红外光谱分析、气相色谱分析、高效液相色谱分析。知识与技能内容则依据工作任务完成的需要进行确定。分析过程中尤其注意了整个内容的完整性,以及知识与技能的相关性。在对知识与技能的描述上也力求详细与准确。技能及其学习要求采取了“能做……”的形式进行描述,知识及其学习要求则采取了“能描述……”和“能理解……”的形式进行描述,即区分了两个学习层次,“描述”指学生能熟练识记知识点,“理解”指学生把握知识点的内涵及及其关系。 本课程是以实验为主体的课程,教学过程主要以实验形式进行,并把技能所要求的理论知识融入其中。课程主要在实验室完成学习内容,通过课程项目化教学形式来完成课程。根据中等职业学校生源的文化基础特征和就业方向,以及就业单位的岗位需求,把原来理论教学为主、实践教学为辅的教学模式转化为项目化教学,以实践技能的培养为主,以理论知识指导实践,在实践中强化、. .
1.就是否能用普通电位计或伏特计测量参比电极与pH玻璃电极所组成电池的电动势?简述原因。 答:不能。因为玻璃电极的内阻(50MΩ~500MΩ)很高,若采用普通电位计或伏特计测量其电位,会引起较大的测量误差。用普通电位计或伏特计测量玻璃电极所组成电池的电动势时,若检流计的灵敏度为10-9A(测量中有10-9A电流通过),玻璃电极的内阻108Ω,当这微小电流流经电极时,由于电压降所引起的电动势测量误差可 达:△E=IV=10-9×108=0、1V,它相当于1、7个pH单位的误差。因此不能用普通电位计或伏特计测量参比电极与pH玻璃电极所组成电池的电动势。 2.已知=0、10,若试样溶液中F-浓度为1、 0×10-2mol/L时,允许测定误差为5%,问溶液允许的最大pH(以浓度代替活度计算)为多少? 解:离子电极选择性误差用下式表示与计算:
即: -离子选择电极插入50、00ml某高氯酸盐待测溶液,与饱与甘汞电极(为3.将一支ClO 4
负极)组成电池。25℃时测得电动势为358、7mV,加入1、00ml NaClO 标准溶液(0、 4 -浓度。 0500mol/L)后,电动势变成346、1mV。求待测溶液中ClO 4 解: -为阴离子,但该离子选择电极为电池的正极,因此S为负值。注意:此题中虽然ClO 4 4、用离子选择电极校正曲线法进行定量分析有什么优点?需注意什么问题?使用TISAB有何作用? 答:离子选择电极校正曲线法进行定量分析的优点就是适用于大批量的样品分析。定量分析中应注意实验条件的一致,特别就是待测液与标准溶液系列的离子强度须保持一致。使用TISAB的作用为: ①保持待测液与标准溶液系列的总离子强度及活度系数恒定;② 维持溶液在适宜的pH范围内,满足离子电极的要求;③掩蔽干扰离子。 5、某pH值的标度每改变一个pH单位,相当于电位的改变为60mV,用响应斜率为53mV/pH的玻璃电极来测定pH为5、00的溶液,分别用pH2、00及pH4、00的标准缓冲溶液来标定,测定结果的绝对误差各为多少?由此,可得出什么结论? 解:用pH2、00标准缓冲溶液标定时: ΔE =53×(5、00-2、00)=159(mV) 实际测到的pH为: 2、00+2、65=4、65pH
专业:生物工程姓名:潘红波学号:1025004350 3、何谓元素的共振线、灵敏线、最后线、分析线?它们之间有何联系? 答:共振线由激发态直接跃迁至基态所辐射的谱线。 灵敏线各元素谱线中最容易激发或激发电位较低的谱线。 最后线当样品中某元素的含量逐渐减少时,最后消失的谱线。 分析线在被测元素的谱线中选则作为分析用的一条谱线。 一般选择灵敏线或最后线作为分析线,一个元素在含量低时的最后线是该元素的最灵敏线,含量高时则存在自吸干扰。 4、何谓自吸收?它对光谱分析有什么影响? 答:发光层四周的蒸气原子,一般比中心原子处于较低能级,因而当辐射能通过这段路程时,将为其自身的原子所吸收,而使谱线中心强度减弱,这种现象称为自吸收。 谱线自吸效应的存在,特别当元素含量高时,常使谱线强度减弱,严重时,谱线中央消失,成为双线的形状。 5、光谱定性分析的基本原理是什么?进行光谱定性分析时可以有哪几种方法?说明各个方法的基本原理和适用场合。 答:由于各种元素原子结构不同,在光源的激发作用下,可以产生许多按一定波长次序排列的谱线组—特征谱线,其波长是由每种元素的原子性质所决定的。通过检查谱片上有无特征谱线的出现来确定元素的存在。 比较法:将试样与已知的欲鉴定元素的化合物相同的条件下并列摄
谱,然后将所得到的光谱图进行比较,以确定某元素是否存在。此方法简便,只适用于试样中指定组分的定性鉴定。 铁谱法:将试样与纯铁并列摄谱,与元素标准光谱图进行比较。适用于测定复杂组分的光谱定性全分析。 7、光谱分析中元素标准光谱图起什么作用? 答:在定性分析时,只要在映谱仪上观察所得谱片,使元素标准光谱图上的铁光谱谱线与谱片上摄取的铁谱线相重合,如果试样中未知元素的谱线与标准光谱图中已标明的某元素谱线出现的位置相重合,则该元素就有可能存在。 8、光谱定量分析的依据是什么?为什么采用内标?简述内标法的原理。内标元素和分析线对应具备哪些条件?为什么? 答:根据被测试样光谱中欲测元素的谱线强度来确定元素浓度。两者之间有经验式: b ac I = 取对数得 a c b I lg lg lg += 此曲线在一定浓度范围内为一直线。 使用内标法可以使谱线强度由于光源波动而引起的的变化得到补偿。原理:在被测元素的谱线中选一条线作为分析线,在基体元素的谱线中选一条与分析线匀称的谱线作为内标线,这两条谱线组成分析线对。分析线与内标线的绝对强度的比值成为相对强度,内标法就是借测量分析线对的相对强度来进行定量分析的。 内标元素和分析线对应具备的条件: (1)原来试样内应不含或仅含有极少量所加内标元素。若试样主要成分的含量较恒定,有时也可用此基体元素作为内标元素。
仪器分析课程标准 1、前言 1.1课程定位 仪器分析是工业分析与检验专业必修的一门专业核心课程,其主要包括了分光度分析法和气相色谱,液相色谱法分析法等基本分析方法,其主要功能是使学生通过具体的仪器使用项目化学习,掌握这些仪器的正确和规范使用,达到能使用这些设备完成具体的分析任务的目的。本课程应在《分析基本操作技术》课程之后与《理化常数检验》、《工业分析》同时开设,以强化学生对化学检验的理解和应用。 1.2设计思路 仪器分析是工业分析与检验专业的一门核心课程。其主要任务是介绍常用的主要仪器分析方法,介绍这些分析方法的基本原理、基本概念和典型仪器的结构与性质,利用这些仪器完成定性、定量分析的任务,为后续课程的学习打下良好的基础,为分析检验工作保驾护航。 通过该课程的学习,使学生具备初步独立进行定量分析的能力,其目标是培养学生具备从事工业分析及与分析化学检验相关的基本职业能力,达到中级化学检验工职业资格证书中相关技术考核的基本要求。 本课程标准的设计思路从工作任务、知识要求与技能要求三个维度对课程内容进行规划与设计,将知识基本和技能要求融入工作任务。本标准分为主要六大部分内容:电化学分析、紫外可见分析、原子吸收分析、红外光谱分析、气相色谱分析、高效液相色谱分析。知识与技能内容则依据工作任务完成的需要进行确定。分析过程中尤其注意了整个内容的完整性,以及知识与技能的相关性。在对知识与技能的描述上也力求详细与准确。技能及其学习要求采取了“能做……”的形式进行描述,知识及其学习要求则采取了“能描述……”和“能理解……”的形式进行描述,即区分了两个学习层次,“描述”指学生能熟练识记知识点,“理解”指学生把握知识点的内涵及及其关系。 本课程是以实验为主体的课程,教学过程主要以实验形式进行,并把技能所要求的理论知识融入其中。课程主要在实验室完成学习内容,通过课程项目化教学形式来完成课程。根据中等职业学校生源的文化基础特征和就业方向,以及就业单位的岗位需求,把原来理论教学为主、实践教学为辅的教学模式转化为项目化教学,以实践技能的培养为主,以理论知识指导实践,在实践中强化、
第七章 原子吸收光谱法 基本要求:掌握以下基本概念:共振线、特征谱线、锐线光源、吸收线轮廓、通带、 积分吸收、峰值吸收、灵敏度和检出限, 掌握原子吸收的测量、AAS 的定量关系及定量方法, 了解AAS 中的干扰及火焰法的条件选择, 通过和火焰法比较,了解石墨炉法的特点。 重点:有关方法和仪器的基本术语。 难点:AAS 的定量原理,火焰法的条件选择。 参考学时:4学时 部分习题解答 10、用标准加入法测定一无机试样溶液中镉的浓度。各试液在加入镉标准溶液后,用水稀释至50mL ,测得其吸光度如下表所示。求镉的浓度。 解:设镉的浓度为c x μg/ml 加入镉标的浓度c 0分别为:c 0 = 0, A x = 0.042 2.050 10 11=?=c μg/ml A 1 = 0.080 4.050 10 22=?=c μg/ml A 2 = 0.116 8.050 10 43=?= c μg/ml A 3 = 0.190
按标准加入法作图得:c x = 0.22 μg/ml 11、用原子吸收光谱法测定自来水中镁的含量(用mg ·L -1表示)。取一系列镁标准溶液(1μg ·mL -1)及自来水水样于50mL 容量瓶中,分别加入5%锶盐溶液2mL 后,用蒸馏水稀释至刻度。然后与蒸馏水交替喷雾测定其吸光度,其数据如下表所示。计算自来水中镁的含量。 解:吸光度(A )—标准溶液含镁量(μg )的标准曲线线性回归得 x y ?0484.00427.0?+= γ=0.9999 将A=0.135代入得自来水样中含镁量为1.91μg。 ∴ 自来水中镁的含量为 095.020 91 .1=μg ·mL -1 即 0.095mg ·mL -1 12、某原子吸收分光光度计倒线色散率为1nm/mm ,狭缝宽度分别为0.1mm, 0.2mm, 1.0mm ,问对应的通带分别是多少? 解:W = D ·S 已知:D = 1nm/mm, S 1 = 0.1mm, S 2 = 0.2mm, S 3 = 1.0mm 通带:W 1 = D ·S 1 = 1×0.1 = 0.1nm W 2 = D ·S 2 = 1×0.2 = 0.2nm W 3 = D ·S 3 = 1×1.0 = 1.0nm