
DOI: 10.1002/adma.200500786
量子点在生物和生物医学的研究:进展与现状挑战
By Jesse M. Klostranec and Warren C. W. Chan*
纳米材料和生物医学材料相结合,产生了新一代的技术,深刻地影响了生物和生物医学研究。量子点是这种混合研究领域的一个原型,由于有着独特的可调谐的光学性质,故引起了很多研究者的兴趣。本文中,我们将介绍它的历史,发展,光学及电学特性,以及在生物学和医学上的应用。一个关于量子点在这个领域的讨论和展望以及其评估在这篇文章中将会被探讨。
1.简介
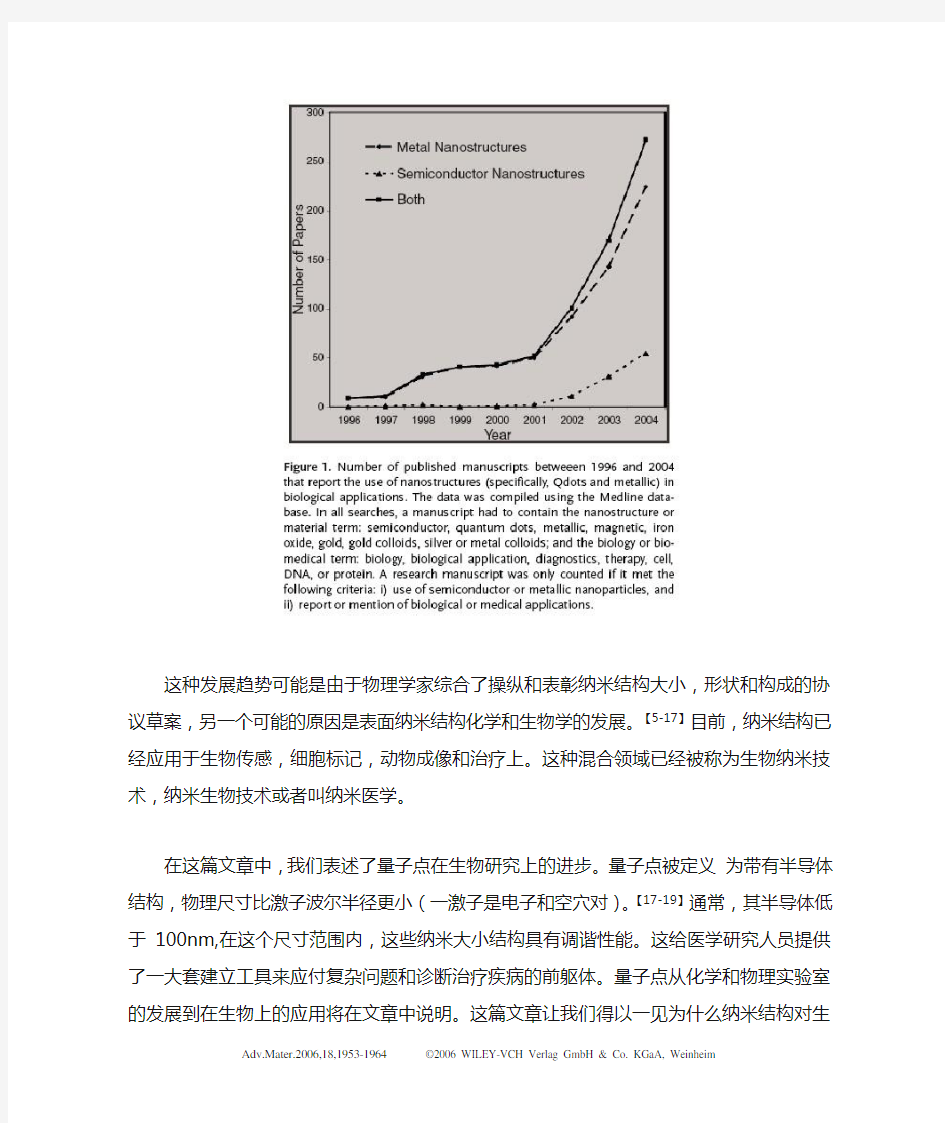
最近胶体纳米结构与生物和医学的研究进展使人们激动异常。【1-4】图1显示了在过去十年,发表的纳米结构在生物学中的应用的报道数量呈指数上升;数据
使用Medline(一种检索系统)获得。
这种发展趋势可能是由于物理学家综合了操纵和表彰纳米结构大小,形状和构成的协议草案,另一个可能的原因是表面纳米结构化学和生物学的发展。【5-17】目前,纳米结构已经应用于生物传感,细胞标记,动物成像和治疗上。这种混合领域已经被称为生物纳米技术,纳米生物技术或者叫纳米医学。
在这篇文章中,我们表述了量子点在生物研究上的进步。量子点被定义为带有半导体结构,物理尺寸比激子波尔半径更小(一激子是电子和空穴对)。【17-19】通常,其半导体低于100nm,在这个尺寸范围内,这些纳米大小结构具有调谐性能。这给医学研究人员提供了一大套建立工具来应付复杂问题和诊断治疗疾病的前躯体。量子点从化学和物理实验室的发展到在生物上的应用将在文章中说明。这篇文章让我们得以一见为什么纳米结构对生物医学研究是一种重要的工具。具体来说,本文介绍了量子点设计的最新进展和应用,同时我们也详述了目前阻碍量子点在生物医学成为主流应用的方面。我们参考了几篇关于量子点在生物上应用的优秀文章,让读者对具体的某些方面有更多的了解。【3,20-24】
2.量子点的合成和表面改性应用于生物医学研究
在20世纪70年代和80年代初,了解光物理半导体的特性对计算机和电子应用有重要作用。理论认为,物理性质在一个中间尺寸范围(在单个原子和原子团之间)能够按照大小和性状变化来调整。【25-28】20世纪80年代的研究主要集中在合成半导体纳米结构,现在被称为量子点(Qdots).量子点是零维的电子系统,它的性质取决于电子的空间。在电子和计算机应用领域,这样一个系统可以让工程师来合成一套使得计算机芯片运行速度更快,体积更小,或者提高发光效率的纳米设备。第一套合成胶体量子点的方法是由Henglein【27】和Rossetti等人【28】发明的,他们使用镉和硫盐在一种缓冲溶液中获得了CdS 量子点.在80年代末和90年代初,研究人员通过观察不同反应条件(如溶剂,PH值,盐,温度等)对量子点的形态和光学属性的影响,试图去改善它们的整体光学性质(如改善颗粒单分散性和调整大小)。【29-31】这些早期的基础研究对现代量子点研究提供了导向,Marry【6】等人开发了一种有机合成过程。然而,这种使用金属盐和有机稳定剂的“绿色”的方法已经开始得到普及。【32-34】目前,仅有两个合成程序(或者两个程序间有轻微的变化)来生产获取期望量子点特性(例如:高量子产率,减少荧光发射,对人有较好兼容性,对光致发光有较好的稳定性)的生物医学研究和应用。
对有机合成CdSe 量子点系统,双甲基镉和硒开始以特定的比例(通常摩尔
比 1.4:1.0)溶解在有机溶剂三正辛基
要使用生物量子点,用ZnS或者CdS覆盖CdSe 量子点是非常重要的。ZnS或者CdS提高量子点荧光量子产率并且保护他们不被光氧化(这也是最大限度的减少毒性并且加强耐光性)。【8,9,37-40】为了生产一个ZnS覆盖层,一种方法是将dietylzinc和hexamethyldisilathiane在CdSe 量子点获得特定大小后缓慢滴入反应容器。低温缓慢滴入阻止ZnS 量子点的成核。Zns覆盖壳的厚度根据注入反应容器的dimethylzinc和hexamethyldisilathiane的量来控制。ZnS外壳比CdSe有更大的带隙,消除核心的表面缺陷。此外,ZnS和CdSe有类似的键长可以减少晶体晶格应变和外延增长。图片2为CdSe/ZnS-Capped core/壳的示意图,以及他们的透射电子和光学荧光显微镜图像。
即使随着合成技术的进步,获得生物医学上可用的量子点仍然是一项技术活;每次合成的量子点有着不同的光学质量。从一个合成的到接下来的一个,研究人员可能会得到不同量子产率和荧光光谱的量子点.因此,很多研究机构继续研究有机协调剂的影响(例如,phosopholipids和aminoalkanes),温度对提
高量子点重复性合成的作用。【6,37,41-43】即使是微流体技术已经被用来合成量子点;它能精确操纵调节剂,可以调剂试剂浓度和温度。【44,45】
那么,在合成量子点时,还需要作什么改善呢?其中一个量子点研究的目标是制备大量量子点(>1g),具有高量子效率(100%)和狭窄的荧光全半高度(<30nm)。另外,有人试图制备合金量子点,它的光线性能通过组成来微调而不是通过大小和形状,掺杂量子点,有多种属性,如,光学性能,磁学性能。【46-49】这些方法合成的非极性和不溶性的量子点在水溶剂里,因此,他们与生物系统不相容。由于协调剂,合成后的量子点是疏水的。因此,在量子点在生物上使用之前必须在它上面加上个极性的表面。已经开发了集中方法(见图3),但是这些技术似乎都不理想。理想的涂料应该满足A)防止在长期储存中絮凝,B)有效地转化为水溶性的有机量子点,C)维持量子点量子荧光产率,D)保持10nm的大小。目前的涂料都不符合这些要求。
目前的策略是接到涂层上或者化学交换或者疏水亲水相互作用。Alivisatos 和Nie以及他们的同事是第一批使用化学交换修改量子点的表面化学特性的人。在化学交换法,双功能分子,如巯基酸(甲基丙烯酸 MAA),绑定一个金属原子在量子点表面。【14,15】溶液中有过量的官能团分子,巯基(MAA中的)与膦氧化物(TOPO中的)结合,绑定到金属原子上。如果双功能分子中还有极性官能团是是相反的巯基功能团,量子点将变得高度极性并且易溶于水溶剂。不幸的是,这
种ishude缺点是迅速絮凝和荧光量子减少量子点的产量。Libchaber和Wu以及他们的同事是第一批使用疏水亲水相互作用来制得水溶性量子点的.【50,50】用这种方法,双亲分子,如1,2-dipalmitoyl-sn-glycero-
3-phosphoethanolamine-N-[methoxy(poly(ethylene glycol))-
2000],与TOPO微粒在量子点表面通过疏水疏水相互作用。双亲分子可以交联,以防止从表面解吸。量子点由于突起的官能团变为极性。这种技术的缺点是该方法程序复杂,涂层成本高,增加量子点的整体尺寸。
对于大多数生物医学应用,附上biorecognition分子(如 oligonucleotides <寡核苷酸>,抗体,多肽)在量子点表面是必须的。在量子点表面涂层分子(除
).这了改善极性)的另一个目的是在表面附上生物相容性的基团(-COOH,-NH
3
些官能团允许biorecognition分子和量子点通过普通的EDC(1 -乙基- 3 -(3 -二甲丙基)碳二亚胺)相互交联。【15,51】在这个反应中,在量子点表面的羧酸官能团能够与蛋白质或者寡核苷酸成键。一个酰胺键连接两个实体,量子点-蛋白质-EDC。这种技术的一个缺陷是如果这种结合体没得到最优配置,中间的EDC结合可能导致聚合。因此,一些组织已经开发其他战略来包覆bilrecohnition分子在量子点上面。例如,Akerman使用化学交换法,量子点表面的MAA通过化学平衡使用巯基肽交换。【52】Mattoussi等使用氨基酸序列(通过静电相互作用)适配器链接蛋白质到量子点表面。【53,54】另外,量子点公司销售涂层量子点,streptavidin-biltin<链霉-生物素>作为量子点和biorecognitionde 链接桥分子。光学性质和尺寸应该在每一步都进行观察,即从量子点修改表面分子涂层到耦合biorecognition。如果对这两个因素无法描述,可能导致他们在生物医学实验中的使用和效果产生重大影响。
3.量子点的光学性质
量子点的光学性质可以说是基于传统的半导体物理和量子力学。在半导体系统,能带叫化合价,导带存在;两个能带的能量差别叫带隙能量。当半导体是光学的或者电气状态时,静态电子(电子位于价带)在半导体矩阵内变得可移动(电子位于导带)。当它移动后,一个电子留下一个空洞,过了一段时间(称为lifetime,≈20ns),电子和空穴结合。在某些情况下,电子和空穴复合导致量子点以每秒8*106 个的速率发射光量子(假设量子是30%吸收率)。能引起电子成为自由电子的能量依靠bandgap energy<能量带隙>;bandgap energy与量子点的大小,形状和成分有关。这种依赖是由于量子限域效应,仅仅在当纳米结构
大小为激子波尔半径时有序。【55,56】图片4显示了不同大小量子点在手持紫外线灯激发下的荧光发射。
由于荧光广泛应用于细胞,组织和动物研究,这种可调节的发射吸引着许多生物医学研究人员。
量子点的其他极具生物医学吸引力的性质包括,他们不断吸收(这允许不同的量子点激发仅仅使用统一单色波长),20ns的荧光寿命(这允许量子点用时间分辨生物成像),对光致漂白具有稳定性(这允许将量子点应用于生物事件监测,跟踪,如蛋白质【57】),大斯托克斯位移【58】(这可防止光谱串扰,提高检测信号),固有亮度(这允许单量子点成像)。表1比较了量子点与有机荧光团的光学性质。由于有几篇有效的评论文章,提供这些光学特性的完整说明,我们提供给有兴趣的读者这些文章。【17-19,59-62】
Alivisatos,Nie,和他们的同事令人信服地描述量子点有机荧光在生物医学研究中应用中的许多光学优势。【14,15,63】当时,生物环境和涂层分子对量子点的光学性能还没有进行描述,或者说甚至没有了解。Hines和Guyot-Sionnest报告说,环境并不会影响ZnS包覆的CdSe 量子点荧光性能。【8】然而,生物环境比有机溶剂复杂得多;因此,在生物上使用量子点导致的某些并发症的理解,由于缺乏分子,biorecognition分子,盐浓度,PH值和温度怎么影响量子点的光学性能而受到限制。这些条件能影响量子点的荧光信号。例如,我们观察到量子点表面在室温条件下会变得越来越明亮。【64】Silver和Ou报道量子点通过光催化,然后缓慢漂白,然后进入细胞内吞囊泡中会非常明显的变明亮。【65】很多生物医学实验,如果要预测光学性质的改变,需要在不同的生物环境中实验。探针的光学释放用于生物事件定量分析检测,一些不确定因素(不能标准化)可能导致错误的结果。
最后,我们要提到间歇闪烁量子点行为。【66-68】量子点的闪烁行为,可能会阻碍他们在生物检测和单分子利用跟踪研究,因为当相机检测不到量子点信号时,他们是在一个黑暗状态(或关闭状态)。量子点关闭信号范围可从1毫秒到1秒,对于批量测量,这可能不是一个问题,因为相机采集时间可能比关闭时间量子点更长。如果是一个单分子的生物事件问题研究,如果生物事件发生的频率比闪烁
的关闭时间更快,那么这将成为一个问题。然而,许多生物事件(如,受体配体络合)长于1秒。【69】Dahan等人没有报告与单甘氨酸受体(与量子点标记)动力学活动的活神经元膜图像的任何问题。【70】
4.在体外应用量子点
我们在介绍量子点之前必须提前克服一些生物应用的主流的挑战,由于其优越的属性,量子点最初视为潜在的光学探针,以取代有机荧光团的生物应用。然而,由于某些限制(如涂膜后的粒子的大小,使他们在一起工作的困难),七年后,该领域的许多研究人员才得出这样的结论,量子点更有可能在许多应用中,以补充现有的有机荧光,而不是取代它们。不过,一个丰富多样的量子点的生物应用报告已经被证实,其中有些在图5有所描绘。到目前为止,研究人员已经证实了的细胞标记量子点使用,【51,58,71-73】如跟踪细胞迁移,【74,75】流式细胞仪,【76,78】原位杂交,【74,79】全动物造影剂,【80,81】病原体检测,【82,83】基因组和蛋白质组的检测,【84,85】荧光共振能量转移(FRET)传感器荧光,【86,87】高通量筛选的生物分子。应用表明,这些都证明了量子点可以广泛作为实用工具。【84,88】
在不久的将来,我们预测量子点将在系统的生物学研究中产生重大影响。我们在生物学上的一个重点是说明和描绘生物分子网络,它可以指示细胞的功能和活力。这将影响到许多研究领域,从分子诊断学到组织工程再到分子生物学。在
这个领域,我们缺少一个实时的和作为标准的可行的生物分子分析工具。在这些领域中,量子点和其他纳米结构将会起到重要的作用;主要原因是:量子点和蛋白质有大小相似和可调排放的特点。在细胞中,量子点可以用颜色标记生物分子,而且由于他们的亮度和光化学稳定性,使得他们能够成像并且能监测很长一段时间。量子点的运动模式能够表征生物分子的活动。图像分析可以显示彼此的:(1)分子间相互作用,(2)相互作用的持续时间(3)分子组装率
系统生物学的研究发现结合量子点也能导致分子诊断学的改善。多个分子的血清,细胞或组织(标记)由于量子点颜色排放检测可提高诊断效率,因为一个诊断的解释将以多个目标为基础。该分子诊断当前国家依靠的技术只有在一个单一的蛋白质或基因,这可能会导致假阳性的诊断检测结果。【94,95】然而,细胞和组织成像应用中,只有三到四种量子点蛋白质颜色标记已经被证明在同行评论的出版物中得到证明。与此相反,多达九个有机荧光标记已经被用于细胞(尽管这需要一个特别的分析光学设置)。【96】这是为什么呢?
什么是细胞生物学量子点使用的主要挑战?这里有一些与使用量子点有关联的一些限制。这些包括:1)对量子点(最近五年多才作了量子点的颜色市售)供应不足,2)在表面化学变化具有有效的预防与biorecognition分子涂层,,3)缺乏在生物环境对量子点的光学特性的基础研究,4)非特异性结合,可能降低量子点检测灵敏度,5)仪器的限制(在特定波长探测器地区最佳检测)。
第一个问题已经解决,;多家公司目前正在销售量子点,截至2006年6月,至少有八个不同颜色,生物相容性量子点可购得。然而,荧光全半高宽和量子产率似乎从一种颜色变化到另一个排放(这可能是对量子点多色应用程序的限制)。许多研究人员正在解决第二个问题。目前涂料远远不能满足于细胞成像量子点的理想。当前涂料是大(可添加“> 10纳米),加上大量量子点,这可能会干扰量子点结合生物分子,也可能影响整个检测信号(在标签接近proteinsbeing彼此事件)。第三个问题已被描述的第2款。第四个问题是一个重大的缺点,因为非特异性结合的量子点限制到表面可以检测灵敏度,更重要的是,导致错误的信号。非特异性结合程度似乎不尽相同,从表面涂层到细胞类型。目前,答案是防止预防量子点绑定的涂层聚(乙二醇)(聚乙二醇)非特异性结合到量子点面;【52】聚乙二醇在制药行业是降低药物和药物输送系统的非特异性摄取的一种很受欢迎的聚合物。【97】由于在可降解聚乙二醇下长期贮存,它可能不是最后的用于解决所有的非特异性结合的要求的答案。因此,进一步的研究工作是必要的。第五个和最后
一个问题还有另一个重要的问题。随着量子点探针进步,专门的检测仪器,CCD 相机可以识别很宽的范围,但是,这并不代表能提供给量子点足够的灵敏度。(例如,由于相机的量子效率,即使红色和绿色的量子点在细胞中的浓度是相同的,相机记录的信号绿色的可能比红色的要高)。另一个问题可能是光激励;如果不同排放两种不同颜色的量子点具有相同的波长激发,摩尔吸水率值是不同的(因此,这将影响整体荧光强度)。最后,我们要提的是使用量子点会不会出现毒性需要长期跟踪培养细胞研究。Derfus等和基什内尔等表明涂料化学能防止细胞毒性。Derfus等【39】和Kichner【40】已经显示了量子点在长期跟踪培养细胞中的使用。【58,72】对于体内应用,毒性的影响将更加重要;我们将在第5部分进一步讨论,如果量子点要实现单分子水平的的多色标签以加强对疾病的诊断,研究生物分子在活细胞的活动,这些问题必须得到解决。
这些问题有些还应当使用在量子点生物传感器的应用上,第一次报告的生物传感器系统的某些方面涉及FRET<共振>,【86,87】其中量子点充当施主,有机荧光充当受体。(见表5)在共振,生物分子传感或检测时,当量子点捐助者发射信号的下降,有机荧光发射信号增强。这些共振实验的证明只在溶液中。对于这些齐次实验,了解如何影响他们的不同的表面分子的荧光发射的使用是至关重要的。信号的变化(表示检测)必须来自分子检测的利益,而不是其他因素。
生物学家常用的蛋白质复杂样品分析DNA并利用异质碳水化合物或surfacebased检测。如,包括斑点杂交和酶联免疫测定复分析。其中多个分子同时检测,具有极强的重要性,它可以提供快速检测和分析。一个例子是DNA和蛋白质微阵列,在一天内分析检测成千上万的生物分子。对于量子点,多色排放的开发利用也许有一天允许它们与芯片相同的方式使用。表面使用不同的彩色发光检测量子点已被证明用作毒素检测。高盛(人名)等采用五种不同颜色的量子点同时检测五种不同的毒素。【85】条码的量子点光学设计也被证明作为多重分析。聂和同事在聚苯乙烯珠内放置不同颜色的量子点做出快速检测条码(有类似的分析能力的芯片)。【84】这种微球的描述见图6。然而,以表面为基础的技术,非特异性结合的影响可能是一个主要问题,因为他们可以影响到噪声检测方案,降低了信号与噪声(信噪比)的比值。
5.量子点在体内的应用
一对新的和令人激动的量子点研究途径是他们作为造影剂应用在体内用于成像。有机荧光和化学发光探针是目前最常用的动物成像光学探针。【91,98,99】然而,光造影剂的限制是缺乏在近红外(NIR)的发射范围(>650nm)的可用探针。近红外发射窗口是有吸引力的生物光学成像,是因为在这个范围内的低组织吸收和散射影响。【100,101】。在近红外成像光学窗口动物的界限通常是定在650-900纳米(图7)最近,Frangioni和同事发现其他近红外(1025至1150纳米,1225至
1370纳米,和1610至1710纳米)进行光学成像的体内最大发射窗口。一个在近红外发光的有机荧光已经实现商业化,最流行的莫过于菁染料系列。由于量子点的光学性能可以通过规模和组成来调整,它应该能够编写近红外发光的动物影像量子点系列。CdTe, CdTeSe,InPAs, PbS, and PbSe 已在近红外发射区成功合成。【46,47,80,103】只有CdTe, CdTeSe, and InPAs 量子点已经被证实用来进行动物成像。
到目前为止,也只有少数的手稿显示量子点作为体内的造影剂。Akerman等,【52】发现以肽共轭量子点可以靶向针对荷瘤小鼠的肿瘤。他们在荧光显微镜下观察到被量子点染色的肿瘤组织切片。Gao等,【81】证明了利用共轭量子点对小鼠前列腺癌抗体的全动物成像,Kim等人,【80】展示了量子点前哨-淋巴结定位在猪上的使用,这有助于指导外科医生去除肿瘤细胞。V oura等,跟踪了量子点标记的肿瘤细胞,他们穿过脉管到达了淤血肺组织。最后,Rao等表明,生物发光共振能量转移(FRET)没有一个使用激光激发源来激发量子点在体内成像。【105】对于量子点在体内的应用走向临床,还存在挑战。虽然这些研究表明量子点可以在体内使用,但有几个基本问题必须加以解决:1)体内成像量子点的最佳剂量的是多少?2)什么是体内量子点动力学?3)如何防止被网状内皮细胞量子点吸收?4)这些量子点对动物是否有毒?计量要求没有得到妥善解决。报告的量子点剂量的范围从1 nmol到300 nmol。配液的浓度会影响肿瘤荧光量子点总体信号。聂和同事表明当组织中的积累机制是被动与主动扩散时检测肿瘤需要浓度较高的量子点。【81】动力学研究中,研究量子点在体内的分布,在肿瘤积中积累的量子点,还没有得到彻底的调查研究。迄今为止,图像和遍历血液和器官累积量子点影片已被证明,【106】但只出现了极少的定量测量报告。需要一个定量研究,以确定体内的非特异性结合的程度,在患病处的吸收程度,量子点的新陈代谢和清理的程度,并提供信息,以协助最佳适当剂量的检测鉴定。所有这些参数都对量子点走向临床应用相当重要。菲舍尔等人研究监测硒化镉/硫化锌在大白鼠体内的药(物)代(谢)动力学。【107】实验表明MUA酸涂层、赖氨酸交联量子点、牛血清白蛋白(BSA)的共轭量子点都在肝脏血浆中整合出来,而且在脾脏,肾脏和骨髓(器官属于网状内皮系统,解像度的一部分)也有显着的吸收发生。然而在这两种情况下,在尿和粪便中被观测到微不足道的残存间隙。最后,为了最大限度地使用量子点造影剂,设计量子点来避免网状内皮系统(RES)的细胞的吸收是重要的。RES是一个人体具有防御机制的机构,能吸收体内的纳米结构。如果量子点被困在RES,他们将无法到达其目标部位,所以他们作为对比剂的效用可能会受到影响。Akerman【52】和Ballou【106】等人证明,以PEG表面涂层量子点
可以减轻一些该问题,但这些并不完全。量子点表面化学定性和定量的认识,和他们在体内动力学和积累的关系,进行更深的认识是必要的。
体内量子点探针的细胞毒作用程度需要确定,目前还是一个开放式问题。重金属有众所周知的毒性,用于生物应用的量子点目前由镉,锌,汞,或铅组成。毒性研究,迄今只完成了体外培养模型。Derfus等人【39】研究表明当紫外线照射或暴露于过量的过氧化氢时,硒化镉对初级肝细胞有毒,这种细胞是肝脏参与金属解毒的主要细胞。然而,当有硫化锌包覆硒化镉量子点降低量子点光氧化时,他们观察到最小的细胞毒作用。得出的结论是紫外线或过氧化氢造成对量子点进行光氧化,并释放金属离子进入细胞。实际上金属离子会造成细胞死亡。基什内尔等人扩展这项研究,并表明不同的涂层化学能影响细胞毒作用的程度。【40】例如,高分子聚乙二醇包覆的共轭量子点可提高细胞前毒性量子点的临界浓度。因此,许多因素,如表面化学,钝化膜,水溶涂料,和细胞类型,确定量子点的细胞毒作用。虽然这些结论是在体外实验中得来的,但在体内wholeanimal 量子点动力学和毒性进行评估时它们可能是重要的考虑因素。巴罗等人定性表明量子点动力学是依赖于表面涂层,但他们的数据没有明确表明量子点在体内代谢或清除方式。在量子点成为有用的体内的临床应用之前的很长一段时间,必须对这些机制有更深刻的理解。
6.未来展望
在最近10年,量子点技术在生物纳米技术领域以变得十分的重要。由于量子点独特和美丽的放射,研究人员已经设想了许多那些不可能使用有机荧光的量子点应用。伴随着量子点,其他纳米结构,如金属和碳基纳米粒子,被添加为混合原料,同时可以加快基础研究和应用生物研究。正如任何新的领域一样,新的问题随之出现,如在不同溶剂中,量子点细胞毒性和排放量的波动等,这已经不是最初考虑时所体现的应用原理了。为了推动生物纳米技术,注意研究生物系统中的纳米结构的基本性质是至关重要的,以便使他们在生物利用得到的结果是可预测和定量的。
至于量子点开始走向成熟,将有一个融合与其他纳米和生物技术的量子点增加的趋势。量子点将成为生物纳米技术的一部分。新型纳米结构的金属特性被发现(例如:把金纳米粒子封装在树脂中,观察荧光发射,发现表面拉曼效应增强了,它们的大小,【109】取决于细胞吸收,【110】和在金属纳米粒子表面增加的靶向分子对目标生物分子的亲和力【111】)这有一个研究重点这些纳米结构,构建功能单
元,可以一体化。例如,检测和治疗疾病。这些新的“BUZZ”结构是一个多功能的纳米结构。最近的一些报告描述如何组装纳米结构和表征纳米结构对单个纳米结构的光学和电子性质的集成效应。【4,114-116】最终的目标是能够组装成一维结构,类似于一个标准病毒“(<150 nm)的程序功能。
其他领域的融合研究,将纳米结构的分析纳入到设备中。这种装置将有多路复用功能(即,对蛋白质和基因的检测能力,同时与singlemolecule(最终水平的检测))大量筛检。此外,多式联运成像探针和检测系统领域的兴趣(应用)增加。量子点已被用来作为双峰成像探针的一部分,与磁共振成像的光学显微镜的能力(MRI)【117】和电子显微镜(EM)【118】配对的方式。广泛应用于艾滋病毒的临床检测,以及检查农业疾病,药物制剂在体内跟踪等领域。
7.结束语
基于最近生物纳米技术领域中的活动,似乎有一个潜在的生物纳米技术研究的一般范式。在这个范式中,研究人员开发纳米结构,了解其特点,理解并操纵其表面化学生物的应用,并证明其有能力解决问题或将其纳入生物系统或临床诊断设备中。图8显示了这个序列的示意图。在过去的二十年,量子点的发展和成熟是这种模式很好的例子。在这次审查中,我们总结了生物量子点最近取得的进展,并提出了观点,以期量子点领域能推进生物研究和日常应用。
Received: April 18, 2005
Final version: May 24, 2006
参考文献
[1] R. K. Jain, M. Stroh, Nat. Biotechnol. 2004, 22, 959.
[2] G. M. Whitesides, Nat. Biotechnol. 2003, 21, 1161.
[3] X. Michalet, F. F. Pinaud, L. A. Bentolila, J. M. Tsay, S. Doose, J. J. Li, G. Sundaresan, A. M. Wu, S. S. Gambhir, S. Weiss, Science 2005,307, 538.
[4] C. M. Niemeyer, Angew. Chem. Int. Ed. 2001, 40, 4128.
[5] J. W. G. Wildoer, L. C. Venema, A. G. Rinzler, R. E. Smalley,C. Dekker, Nature 1998, 391, 59.
[6] C. B. Murray, D. J. Norris, M. G. Bawendi, J. Am. Chem. Soc. 1993,115, 8706.
[7] L. R. Becerra, C. B. Murray, R. G. Griffin, M. G. Bawendi, J. Chem.Phys. 1994, 100, 3297.
[8] M. A. Hines, P. Guyot-Sionnest, J. Phys. Chem. 1996, 100, 468.
[9] X. Peng, M. C. Schlamp, A. V. Kadavanich, A. P. Alivisatos, J. Am.Chem. Soc. 1997, 119, 7019.
[10] J. E. Bowen Katari, V. L. Colvin, A. P. Alivisatos, J. Phys. Chem.1994, 98, 4109.
[11] D. A. Tomalia, M. Hall, D. Hedstrand, J. Am. Chem. Soc. 1987, 109,1601.
[12] S. Iijima, Nature 1991, 354, 56.
[13] R. D. Averitt, D. Sarkar, N. J. Halas, Phys. Rev. Lett. 1997, 78, 4217.
[14] M. Bruchez, M. Moronne, P. Gin, S. Weiss, A. P. Alivisatos, Science1998, 281, 2013.
[15] W. C. W. Chan, S. Nie, Science 1998, 281, 2016.
[16] R. Elghanian, J. J. Storhoff, R. C. Mucic, R. L. Letsinger, C. A. Mirkin,Science 1997, 277, 1078.
[17] A. Henglein, Chem. Rev. 1989, 89, 1861.
[18] A. P. Alivisatos, Science 1996, 271, 933.
[19] M. Nirmal, L. Brus, Acc. Chem. Res. 1999, 32, 407.
[20] A. P. Alivisatos, Nat. Biotechnol. 2004, 22, 47.
[21] J. K. Jaiswal, S. M. Simon, Trends Cell Biol. 2004, 14, 497.
[22] W. J. Parak, T. Pellegrino, C. Plank, Nanotechnology 2005, 16, R9.
[23] I. L. Medintz, H. T. Uyeda, E. R. Goldman, H. Mattoussi, Nat. Mater.2005, 4, 435.
[24] A. J. Sutherland, Curr. Opin. Solid State Mater. Sci. 2002, 6, 365.
[25] A. I. Ekimov, A. A. Onushchenko, JETP Lett. 1981, 34, 345.
[26] A. L. Efros, A. L. Efros, Sov. Phys.—Semicond. 1982, 16, 772.
[27] A. Henglein, J. Phys. Chem. 1982, 86, 2291.
[28] R. Rossetti, S. Nakahara, L. E. Brus, J. Chem. Phys. 1983, 79, 1086.
[29] L. Spanhel, M. Haase, H. Weller, A. Henglein, J. Am. Chem. Soc.1987, 109, 5649.
[30] A. R. Kortan, R. Hull, R. L. Opila, M. G. Bawendi, M. L. Steigerwald,P. J. Carroll, L. E. Brus, J. Am. Chem. Soc. 1990, 112, 1327.
[31] M. L. Steigerwald, A. P. Alivisatos, J. M. Gibson, T. D. Harris,R. Kortan, A. J. Muller, A. M. Thayer, T. M. Duncan, D. C.Douglass, L. E. Brus, J. Am. Chem. Soc. 1988, 110, 3046.
[32] Z. A. Peng, X. Peng, J. Am. Chem. Soc. 2001, 123, 183.
[33] I. Mekis, D. V. Talapin, A. Kornowski, M. Haase, H. Weller, J. Phys.Chem B 2003, 107, 7454.
[34] D. V. Talapin, A. L. Rogach, A. Kornowski, M. Haase, H. Weller,Nano Lett. 2001, 1, 207.
[35] P. W. Voorhees, J. Stat. Phys. 1985, 38, 231.
[36] D. V. Talapin, A. L. Rogach, M. Haase, H. Weller, J. Phys. Chem. B2001, 105, 12 278.
[37] B. O. Dabbousi, J. Rodriguez-Viejo, F. V. Mikulec, J. R. Heine,H. Mattoussi, R. Ober, K. F. Jensen, M. G. Bawendi, J. Phys. Chem.,B 1997, 101, 9463.
[38] W. G. J. H. M. van Sark, P. L. T. M. Frederix, D. J. Van den Heuvel,H. C. Gerritsen, A. A. Bol, J. N. J. van Lingen, C. de Mello Donega,A. Meijerink, J. Phys. Chem. B 2001, 105, 8281.
[39] A. M. Derfus, W. C. W. Chan, S. N. Bhatia, Nano Lett. 2004, 4, 11.
[40] C. Kirchner, T. Liedl, S. Kudera, T. Pellegrino, A. M. Javier, H. E.Gaub, S. Stolzle, N. Fertig,W. J. Parak, Nano Lett. 2005, 5, 331.
[41] X. Peng, J. Wickham, A. P. Alivisatos, J. Am. Chem. Soc. 1998, 120,5343.
[42] M. Green, P. O’Brien, Chem. Mater. 2001, 13, 4500.
[43] T. Trindade, P. O’Brien, Adv. Mater. 1996, 8, 161.
[44] E. M. Chan, R. A. Mathies, A. P. Alivisatos, Nano Lett. 2003, 3, 199.
[45] B. K. H. Yen, A. Gunther, M. A. Schmidt, K. F. Jensen, M. G. Bawendi,Angew. Chem. Int. Ed. 2005, 44, 5447.
[46] R. E. Bailey, S. Nie, J. Am. Chem. Soc. 2003, 125, 7100.
[47] S. W. Kim, J. P. Zimmer, S. Ohnishi, J. B. Tracy, J. V. Frangioni,,M. G. Bawendi, J. Am. Chem. Soc. 2005, 127, 10 526.
[48] O. E. Raola, G. F. Strouse, Nano Lett. 2002, 2, 1443.
[49] K. M. Hanif, R. W. Meulenberg, G. F. Strouse, J. Am. Chem. Soc.,2002, 124, 11 495.
[50] B. Dubertret, P. Skourides, D. J. Norris, V. Noireaux, A. H. Brivanlou,A. Libchaber, Science 2002, 298, 1759.
[51] X. Wu, H. Liu, J. Liu, K. N. Haley, J. A. Treadway, J. P. Larson,N. Ge, F. Peale, M. P. Bruchez, Nat. Biotechnol. 2003, 21, 41.
[52] M. E. Akerman, W. C. W. Chan, P. Laakkonen, S. N. Bhatia,E. Ruoslahti, Proc. Natl. Acad. Sci. USA 2002, 99, 12 617.
[53] H. Mattoussi, J, M. Mauro, E. R. Goldman, G. P. Anderson, V. C.Sundar, F. V. Mikulec, M.
G. Bawendi, J. Am. Chem. Soc. 2000, 122,12 142.
[54] H. Mattoussi, J. M. Mauro, E. R. Goldman, T. M. Green, G. P. Anderson,V. C. Sundar, M. G. Bawendi, Phys. Status Solidi 2001, 224,277.
[55] L. E. Brus, J. Chem. Phys. 1984, 80, 4403.
[56] L. E. Brus, J. Phys. Chem. 1986, 90, 2555.
[57] M. Dahan, T. Laurence, F. Pinaud, D. S. Chemla, A. P. Alivisatos,M. Sauer, S. Weiss, Opt. Lett. 2001, 26, 825.
[58] J. K. Jaiswal, H. Mattoussi, J. M. Mauro, S. M. Simon, Nat. Biotechnol.2003, 21, 47.
[59] A. P. Alivistatos, J. Phys. Chem. 1996, 100, 13 226.
[60] C. B. Murray, C. R. Kagan, M. G. Bawendi, Ann. Rev. Mat. Sci.2000, 30, 545.
[61] H. Weller, Angew. Chem. Int. Ed. 1993, 32, 41.
[62] H. Weller, Adv. Mater. 1993, 5, 88.
[63] W. C. W. Chan, D. J. Maxwell, X. Gao, R. E. Bailey, M. Han, S. Nie,Curr. Opin. Biotechnol. 2002, 13, 40.
[64] W. Jiang, S. Mardyani, H. Fischer, W. C. W. Chan, Chem. Mater.2006, 18, 872.
[65] J. Silver,W. Ou, Nano Lett. 2005, 5, 1445.
[66] M. Nirmal, B. O. Dabbousi, M. G. Bawendi, J. J. Macklin, J. K.Trautman, T. D. Harris, L. E.
Brus, Nature 1996, 383, 802.
[67] S. A. Empedocles, M. G. Bawendi, Science 1997, 278, 2114.
[68] B. Lounis, H. A. Bechtel, D. Gerion, A. P. Alivisatos, W. E. Moerner,Chem. Phys. Lett. 2000, 329, 399.
[69] C. Gales, R. V. Rebois, M. Hogue, P. Trieu, A. Breit, T. E. Hebert,M. Bouvier, Nat. Methods 2005, 2, 177.
[70] M. Dahan, S. Levi, C. Luccardini, P. Rostaing, B. Riveau, A. Triller,Science 2003, 302, 442.
[71] F. Pinaud, D. King, H. Moore, S. Weiss, J. Am. Chem. Soc. 2004, 126,6115.
[72] A. M. Derfus, W. C. W. Chan, S. N. Bhatia, Adv. Mater. 2004, 16,961.
[73] M. Howarth, K. Takao, Y. Hayashi, A. Y. Ting, Proc. Natl. Acad. https://www.doczj.com/doc/e68791092.html,A 2005, 102, 7583.
[74] S. Pathak, S. Choi, N. Arnheim, M. E. Thompson, J. Am. Chem. Soc.2001, 123, 4103.
[75] W. J. Parak, R. Boudreau,M. Le Gros, D. Gerion, D. Zanchet, C. M.Micheel, S. C. Williams,
A. P. Alivisatos, C. Larabell, Adv. Mater.2002, 14, 882.
[76] J. Zheng, Q. Song, S. Mardyani, W. C. W. Chan, C. W. Wang, Lab.Hemetol. in press.
[77] B. C. Lagerhom, M. Wang, L. A. Ernst, D. H. Ly, H. Liu, M. P. Bruchez,A. S. Waggoner, Nano Lett. 2004, 4, 2019.
[78] X. Gao, S. Nie, Anal. Chem. 2004, 76, 2406.
[79] Y. Xiao, P. E. Barker, Nucl. Acids Res. 2004, 32, e28.
[80] S. Kim, Y. T. Lim, E. G. Soltesz, A. M. De Grand, J. Lee, A. Nakayama,J. A. Parker, T. Mihalijevic, R. G. Laurence, D. M. Dor,
L. H. Cohn, M. G. Bawendi, J. V. Frangioni, Nat. Biotechnol. 2004,22, 93.
[81] X. Gao, Y. Cui, R. M. Levenson, L. W. K. Chung, S. Nie, Nat. Biotechnol.2004, 22, 969.
[82] L. Zhu, S. Ang,W. Liu, Appl. Environ. Microbiol. 2004, 70, 597.
[83] R. Edgar, M. McKinstry, J. Hwang, A. B. Oppenheim, R. A. Fekete,G. Giulian, C. Merril, K. Nagashima, S. Adhya, Proc. Natl. Acad.Sci. USA 2006, 103, 4841.
[84] M. Han, X. Gao, J. Z. Su, S. Nie, Nat. Biotechnol. 2001, 19, 631.
[85] E. R. Goldman, A. R. Clapp, G. P. Anderson, H. T. Uyeda, J. M.Mauro, I. L. Medintz, H. Mattoussi, Anal. Chem. 2004, 76, 684.
[86] I. L. Medintz, A. R. Clapp, H. Mattoussi, E. R. Goldman, B. Fisher,J. M. Mauro, Nat. Mater. 2003, 2, 630.
[87] A. R. Clapp, I. L. Medintz, J. M. Mauro, B. R. Fisher, M. G. Bawendi,H. Mattoussi, J. Am. Chem. Soc. 2003, 126, 301.
[88] X. Gao, W. C. W. Chan, S. Nie, J. Biomed. Opt. 2002, 7, 532.
[89] D. Hanahan, R. A.Weinberg, Cell 2000, 100, 57.
[90] H. Kitano, Science 2002, 295, 1662.
[91] R. Weissleder, Nat. Rev. Cancer 2002, 2, 1.
[92] M. Stoll, A. W. Cowley, Jr., P. J. Tonellato, A. S. Greene, M. L. Kaldunski,R. J. Roman, P. Dumas, N. J. Schork, Z. Wang, H. J. Jacob,Science 2001, 294, 1723.
[93] L. Hood, J. R. Heath, M. E. Phelps, B. Lin, Science 2004, 306,640.
[94] S. Pottumarthy, V. C. Wells, A. J. Morris, J. Clin. Microbiol. 2000, 38,2227.
[95] Y. Sbihi, A. Rmiqui, M. N. Nieves Rodriguez-Cabezas, A. Orduna,A. Rodriguez-Torres, A. Osuna, J. Clin. Lab. Anal. 2001, 15, 14.
[96] M. Bigos, N. Baumgarth, G. C. Jager, O. C. Herman, T. Nozaki, R. T.Stovel, D. R. Parks, L.
A. Herzenberg, Cytometry 1999, 36, 36.
[97] R. Gref, Y. Minamitake, M. T. Peracchia, V. Trubetskoy, V. Torchilin,R. Langer, Science 1994, 263, 1600.
[98] R. Weissleder, C. Tung, U. Mahmood, A. Bogdanov, Nat. Biotechnol.1999, 17, 375.
[99] C. H. Contag, B. D. Ross, J. Magn. Reson. Imaging 2002, 16, 378.
[100] R. Weissleder, Nat. Biotechnol. 2001, 19, 316.
[101] W. Jiang, E. Papa, H. Fischer, S. Mardyani, W. C. W. Chan, TrendsBiotechnol. 2004, 22, 607.
[102] Y. T. Lim, S. Kim, A. Nakayama, N. E. Stott, M. G. Bawendi, J. V.Frangioni, Mol. Imaging 2003, 2, 50.
[103] L. Bakueva, I. Gorelikov, S. Musikhin, X. S. Zhao, E. H. Sargent,E. Kumacheva, Adv. Mater. 2004, 16, 926.
[104] E. B. Voura, J. K. Jaiswal, H. Mattoussi, S. M. Simon, Nat. Med.2004, 10, 993.
[105] M. So, C. Xu, A. M. Loening, S. S. Gambhir, J. Rao, Nat. Biotechnol.2006, 24, 339. [106] B. Ballou, B. C. Lagerholm, L. A. Ernst, M. P. Bruchez, A. S. Waggoner,Bioconjugate Chem. 2004, 15, 79.
[107] H. C. Fischer, L. Liu, K. S. Pang, W. C. W. Chan, Adv. Funct. Mater.2006, 16, 1299. [108] J. Zheng, C. Zhang, R. M. Dickson, Phys. Rev. Lett. 2004, 93,147 402.
[109] S. Nie, S. R. Emory, Science 1997, 275, 1102.
[110] B. D. Chithrani, A. A. Ghazani, W. C. W. Chan, Nano Lett. 2006, 6,662.
[111] N. L. Rosi, D. A. Giljohann, C. S. Thaxton, A. K. R. Lytton-Jean,M. S. Han, C. A. Mirkin, Science 2006, 312, 1027.
[112] A. G. Tkachenko, H. Xie, Y. Liu, D. Coleman, J. Ryan, W. R.Glomm, M. K. Shipton, S. Franzen, D. L. Feldheim, Bioconjugate
Chem. 2004, 15, 482.
[113] A. G. Tkachenko, H. Xie, D. Coleman, W. R. Glomm, J. Ryan, M. F.Anderson, S. Franzen, D. L. Feldheim, J. Am. Chem. Soc. 2003, 125,4700.
[114] A. Ongaro, F. Griffin, L. Nagle, D. Iacopino, R. Eritja, D. Fitzmaurice,Adv. Mater. 2004, 16, 1799.
[115] M. G. Grimau, D. Iacopino, A. Avino, B. G. de la Torre, A. Ongaro,D. Fitzmaurice, J. Wessels, R. Eritja, Helvet. Chim. Acta 2003, 86,2814.
[116] I. Gryczynski, J. Malicka, W. Jiang, H. Fischer, W. C. W. Chan,Z. Gryczynski, W. Grudzinski, J. R. Lakowicz, J. Phys. Chem. B
2005, 109, 1088.
[117] W. J. M. Mulder, R. Koole, R. J. Brandwijk, G. Storm, P. T. K. Chin,
G. J. Strijkers, C. de Mello Donega, K. Nicolay, A. W. Griffioen,Nano Lett. 2006, 6, 1.
[118] B. N. G. Giepmans, T. J. Deerinck, B. L. Smarr, Y. Z. Jones, M. H.Ellisman, Nat. Methods 2005, 2, 743.
[119] M. Unger, E. Kartalov, C.-S. Chiu, H. A. Lester, S. R. Quake, Bio-Techniques 1999, 27, 1008.
[120] H. E. Grecco, K. A. Lidke, R. Heintzmann, D. S. Lidke, C. Spagnuolo,O. E. Martinez, E. A. Jares-Erijman, T. M. Jovin, Microsc. Res.Tech. 2004, 65, 169.
[121] R. Helm, A. B. Cubitt, R. Y. Tsien, Nature 1995, 373, 663.
[122] Q. S. Hanley, V. Subramaniam, D. J. Arndt-Jovin, T. M. Jovin, Cytometry2001, 43, 248. [123] H. Ditlbacher, N. Felidj, J. R. Krenn, B. Lamprecht, A. Leitner, F. R.Aussenegg, Appl. Phys.
B 2001, 73, 373.
[124] A. M. Michaels, J. Jiang, L. Brus, J. Phys. Chem. B 2000, 104, 11 965.
[125] M. A. Noginov, M. Vondrova, S. N. Williams, M. Bahoura, V. I. Gavrilenko,S. M. Black, V. P. Drachev, V. M. Shalaev, A. Sykes, J. Opt.A 2005, 7, S219.
[126] E. T. Knobbe, B. Dunn, P. D. Fuqua, F. Nishida, Appl. Opt. 1990, 29,2729.
[127] M. F. Garcia-Parajo, J.-A. Veerman, G. M. J. Segers-Nolten, B. G.de Grooth, J. Greve, N. F. van Hulst, Cytometry 1999, 36, 239.
[128] M. Ishikawa, E. Sekizuka, S. Sato, N. Yamaguchi, J. Inamasu, H. Bertalanffy,T. Kawase, C. Iadecola, Stroke 1999, 30, 1679.
[129] R. Y. Tsien, Annu. Rev. Biochem. 1998, 67, 509.
翻译校正:陈华龙杜俊秋李密
2018年最新医学统计源核心期刊 医学综合 安徽医学安徽医药北京医学东南国防医药广西医学贵州医药海军医学杂志河北医学河北医药华南国防医学华西医学基础医学与临床解放军医学解放军医药空军医学齐鲁医学山东医药上海医学四川医学天津医药武警医学西部医学西南国防医药现代生物医学进展现代医学新医学医学研究所学报医学研究杂志医学综述浙江医学中国急救复苏与灾害医学中国煤炭工业医学中国现代医学中国医学前沿杂志电子版中国医药导报中华医学杂志中南医学科学杂志中日友好医院学报转化医学杂志 医药大学学报: 安徽医科大学学报蚌埠医学院学报北京大学学报医学版成都医学院学报重庆医科大学学报川北医学院学报大连医科大学学报第二军医大学学报第三军医大学学报东南大学学报医学版福建医科大学学报复旦学报医学版广东药学院学报 医学学术论文快速发表绿色通道—期刊之家网 发表流程:收稿---稿件初审---商定期刊---杂志社审稿---办理定金---修改定稿---确认---付余款---杂志社发采稿通知---发表见刊---接收期刊样册---知网收录 论文刊发时间:从收到论文版面费起3-4个月(特殊情况除外),针对需要快速发表的作者提供绿色通道服务。 本站声明:期刊之家网与多家医学期刊结成了学术联盟,如果您有发表中国科技论文统计源期刊(中国科技核心期刊)、中文核心期刊、SCI收录期刊的需求,以及对于需要论文发票的作者可以与我们联系,详情咨询杨编辑Q Q :1966715440 广西医科大学学报贵州有医科大学学报哈尔滨医科大学学报海南医学院学报河北医科大学学报湖南师范大学学报医学版华中科技大学学报医学版吉林大学学报医学版暨南大学学报自然科学与医学版江苏大学学报医学版解放军医学院学报昆明医科大学学报报兰州大学学报医学版南昌大学学报医学版南方医科大学学报南京医科大学学报自然科学版内蒙古医科大学学报宁夏医科大学学报青岛大学学报医学版山东大学耳鼻喉眼学报山东大学学报医学版山西医科大学学报上海交通大学学报医学版沈阳药科大学学报首都医科大学学报四川大学学报医学版同济大学学报医学版新疆医科大学学报新乡医学院学报徐州医学院学报浙江大学学报医学版郑州大学学报医学版中国药科大学学报中国医科大学学报中国医学科学院学报中南大学学报.医学版中山大学学报医学版遵义医学院学报 基础医学: 国际免疫学国际遗传学寄生虫与医学昆虫学报解剖科学进展解剖学报解剖学研究解剖学杂志临床和病理杂志临床和实验病理学杂志免疫学杂志神经解剖学杂志生理学报实验动物与比较医学微循环学杂志细胞与分子免疫学杂志现代免疫学医学分子生物学杂志医用生物力学诊断病理学杂志中国比较医学中国病理生理杂志中国寄生虫与寄生虫病杂志中国临床解剖学中国免疫学中国医学物理学中国组织化学与细胞化学中华病理学中华微生物学和免疫学中华细胞与干细胞杂志电子版中华医学遗传学临床医学 综合类: 国际输血及血液病学杂志临床和实验医学杂志临床急诊杂志临床军医临床输血与检验
医学生物化学各章节知识点习题详解 单项选择题 第一章蛋白质化学 1. .盐析沉淀蛋白质的原理是( ) A. 中和电荷,破坏水化膜 B. 与蛋白质结合成不溶性蛋白盐 C. 降低蛋白质溶液的介电常数 D. 调节蛋白质溶液的等电点 E. 使蛋白质溶液的pH值等于蛋白质等电点 提示:天然蛋白质常以稳定的亲水胶体溶液形式存在,这是由于蛋白质颗粒表面存在水化膜和表面电荷……。具体参见教材17页三、蛋白质的沉淀。 2. 关于肽键与肽,正确的是( ) A. 肽键具有部分双键性质 B. 是核酸分子中的基本结构键 C. 含三个肽键的肽称为三肽 D. 多肽经水解下来的氨基酸称氨基酸残基 E. 蛋白质的肽键也称为寡肽链 提示:一分子氨基酸的α-羧基和一分子氨基酸的α-氨基脱水缩合形成的酰胺键,即-CO-NH-。氨基酸借肽键联结成多肽链。……。
具体参见教材10页蛋白质的二级结构。 3. 蛋白质的一级结构和空间结构决定于( ) A. 分子中氢键 B. 分子中次级键 C. 氨基酸组成和顺序 D. 分子内部疏水键 E. 分子中二硫键的数量 提示:多肽链是蛋白质分子的最基本结构形式。蛋白质多肽链中氨基酸按一定排列顺序以肽键相连形成蛋白质的一级结构。……。具体参见教材20页小结。 4. 分子病主要是哪种结构异常() A. 一级结构 B. 二级结构 C. 三级结构 D. 四级结构 E. 空间结构 提示:分子病由于遗传上的原因而造成的蛋白质分子结构或合成量的异常所引起的疾病。蛋白质分子是由基因编码的,即由脱氧核糖核酸(DNA)分子上的碱基顺序决定的……。具体参见教材15页。 5. 维持蛋白质三级结构的主要键是( ) A. 肽键 B. 共轭双键
2013-2014-1 医学生物学复习重点(预防医学) 生命的分子基础 核酸的基本结构(3’,5’-磷酸二酯键):前一个核苷酸戊糖3’碳位上的羟基与后一个核苷酸戊糖5’碳位磷酸上的氢结合,在核酸聚合酶的催化下,脱下一份子水连接而成的共价键称为3’、5’-磷酸二酯键。 (5’端上有磷酸基游离者为首端,3’端碳位上有羟基游离者为尾端) DNA的结构(B-双螺旋、A、Z-DNA) B-双螺旋:(生物体内天然状态的DNA绝大多数都以B-DNA存在) 1、DNA分子由两条反向平行的多核苷酸链组成,以右手螺旋方式盘绕成双螺旋结构,螺距为3、4nm(磷酸和脱氧核糖位于双螺旋的外侧,形成DNA的骨架,碱基位于双螺旋的内侧) 2、碱基互补原则 3、多样性 A-DNA:反向平行、右手螺旋,但螺距比较宽短 Z-DNA:左手双螺旋,细长 蛋白质分子的结构(一级、二级) 蛋白质的一级结构:以肽键为主键,二硫键为副键的多肽链中,氨基酸的排列顺序,即为蛋白质分子的一级结构。(一级结构是蛋白质的基本结构,是蛋白质最重要的特征。) 蛋白质的二级结构: α螺旋是肽链按右手螺旋方向形成的空间结构 β折叠是由两条肽链平行排列或一条肽链回折平行排列折叠成的锯齿状构象。 三股螺旋(又称π螺旋),是胶原蛋白独有的结构。 (蛋白质必须在三级结构的基础上才能表现出生物活性) 蛋白质的变构和变性概念: 变构:在生物体内,某些代谢中间物或变构剂能够使蛋白质的构象发生轻微变化,从而使其生物活性发生改变,使其更有效的完成生理功能。这种通过蛋白质构象变化而实现调节功能的现象称为变构或变构调节。 变性:蛋白质分子受到某些物理因素或化学因素,空间结构发生破坏,理化性质改变,生物活性丧失的过程。 (变性和变构都不涉及蛋白质以及结果的改变,蛋白质变性,有时是可逆的) 生命的细胞基础
【细胞器标志酶】 内质网:葡萄糖-6-磷酸酶 高尔基体:糖基转移酶 溶酶体:酸性磷酸酶 过氧化物酶体:过氧化氢酶 【高尔基体的超微结构及功能】 高尔基体呈网状结构,是一种较为复杂的膜性细胞器,由扁平囊、小囊泡、大囊泡构成,内含多种酶,其标志酶为糖基转移酶。 扁平囊,高尔基体的主体部分,由3-10层平行排列,相邻囊间距20-30nm,每个囊腔宽6-15nm,其凸面称顺面或形成面,凹面称反面或成熟面;小囊泡,为直径30-80nm的球形小泡,膜厚6nm,多集中分布于扁平囊形成面与内质网间,由糙面内质网芽生而来,载有糙面内质网合成蛋白质成分转运至扁平囊中,又称运输小泡;大囊泡,直径100-500nm,膜厚8nm,多见于扁平囊周边或局部呈球状膨突而后脱落形成,带有扁平囊所含分泌物,有继续浓缩的作用,又称浓缩泡或分泌泡。 主要功能:参与细胞的分泌活动;对蛋白质进行修饰加工,如糖蛋白的合成修饰和蛋白质的改造;对蛋白质进行分选运输,如分泌蛋白、膜嵌蛋白、溶酶体蛋白的分选;形成溶酶体;参与膜的转变。【溶酶体的超微结构及功能】 溶酶体是单层膜包裹多种酸性水解酶的囊泡状细胞器,膜厚6nm,是直径0.25-0.5nm的圆形、卵圆形小体,可视为细胞内消化系统。
其标志酶为酸性水解酶。溶酶体膜上有氢离子泵,可保持内部酸性环境;膜内存在特殊的转运蛋白,可将消化水解的产物运出溶酶体;溶酶体膜的蛋白高度糖基化,可防止被自身的水解酶消化。 主要功能:消化作用,对外源性异物的消化称异噬作用,消化自身衰老和损伤的细胞器或细胞器碎片称自噬作用;自溶作用,指细胞内溶酶体膜破裂,消化酶释放入细胞质使细胞本身被消化;对细胞外物质的消化作用,指溶酶体通过胞吐作用将溶酶体酶释放到细胞外,消化分解细胞外物质。 【线粒体的半自主性】 线粒体中含有mtDNA,多为双链的环状分子,和细菌DNA相似,裸露而不与组蛋白结合,分散在线粒体基质不同区域。线粒体DNA具有遗传功能。线粒体含有自身特有的mRNA、tRNA和rRNA及其蛋白质合成的其他组分,可自主合成蛋白质。但mtDNA的基因数量不多,编码合成的蛋白质有限。mtDNA所用的遗传密码表与通用的遗传密码表也不完全相同。这说明线粒体的生物合成依靠两套遗传系统。而实现线粒体基因组复制与表达所需的许多酶,又是由核基因编码的,所以线粒体是半自主性的细胞器。 【细胞氧化】 细胞氧化是指依靠酶的催化,氧将细胞内各种供能物质氧化而释放能量的过程。其基本过程为: 酵解。在细胞质中进行。反应过程无需氧,故称为无氧酵解。葡萄糖等物质在细胞质中酵解形成丙酮酸。
2019-2020年版最新科技核心医学类期刊目录 (中国科技核心期刊) 《2019年版中国科技期刊引证报告(核心版)自然科学卷》以《中国科技论文与引文数据库(CSTPCD)》为基础,采用科学客观的研究方法与评价形式,遴选中国自然科学领域各个学科分类的重要期刊作为统计来源期刊。《2019年版中国科技期刊引证报告(核心版)自然科学卷》收录了在中国(不含港澳台地区)正式出版的1933种中文期刊和116种英文期刊,共2049种“中国科技核心期刊(中国科技论文统计源期刊)”。《2019年版中国科技期刊引证报告(核心版)自然科学卷》共收录医学领域41类学科700余种期刊,并有10种医学类期刊新入选(见下表)。2019年新入选中国科技核心期刊——医学类(10种)JOURNAL OF ACUPUNCTURE AND TUINA SCIENCE 1.陕西中医 2.重庆医学 3.中华老年骨科与康复电子杂志 4.分子影像学杂志 5.中华医院感染学杂志 6.肝癌电子杂志 7.中华重症医学电子杂志 8.国际流行病学传染学杂志 9.中医药学报
42种医学综合类期刊平均影响因子为,其中《FRONTIERS OF MEDICINE》《解放军医学杂志》《解放军医药杂志》《医学研究生学报》《中华医学杂志》共5种期刊影响因子超过1。 2019年中国科技核心期刊——医学综合类(42种) 期刊名称影响因子 CHINESE MEDICAL JOURNAL 武警医学 CHINESE MEDICAL SCIENCES JOURNAL 西部医学 FRONTIERS OF MEDICINE 西南国防医药 安徽医学 现代生物医学进展 安徽医药 现代医学 北京医学 协和医学杂志 东南国防医药 新医学 广西医学 医学研究生学报 海军医学杂志
大学医学生物学考试试题(闭卷) 课程名称:医学生物学 学号:姓名: 一、选择题(每题选一正确答案,写于答卷纸上。每题一分,共40分): 1.下列哪一种细胞内没有高尔基复合体 A、淋巴细胞 B、肝细胞 C、癌细胞 D、胚胎细胞 E、红细胞 2.在电镜下观察生物膜结构可见 C.两层深色致密层和中间一层浅色疏松层 D.两层浅色疏松层和中间一层深色致密层 E.上面两层浅色疏松层和下面一层深色致密层 3.属于动态微管的是 A.中心粒 B. 纺锤体 C. 鞭毛 D. 纤毛 E. 胞质收缩环 4.小肠上皮细胞吸收氨基酸的过程为 A.通道扩散 B. 帮助扩散 C. 主动运输 D. 伴随运输 E. 膜泡运输 5.关于细菌,下列哪项叙述有误 A、为典型的原核细胞 B、细胞壁的成分为蛋白多糖类 C、仅有一条 DNA分子 D、 具有 80S 核糖体 E、有些鞭毛作为运动器 6.关于真核细胞,下列哪项叙述有误 A、有真正的细胞核 B、有多条DNA分子并与组蛋白构成染色质 C、基因表达的转录和翻译过程同时进行 D、膜性细胞器发达 E. 有核膜 7.氚(3H)标记的尿嘧啶核苷可用于检测细胞中的 A、蛋白质合成 B、 DNA复制 C、 RNA转录 D、糖原合成 E、细胞分化 8.β 折叠属于蛋白质分子的哪级结构 A. 基本结构 B. 一级结构 C. 二级结构 D. 三级结构 E. 四级结构 9.在奶牛的乳腺细胞中,与酪蛋白的合成与分泌有密切关系的细胞结构是 A、核糖体,线粒体,中心体,染色体 B、线粒体,内质网,高尔基体,纺锤体 C、核糖体,线粒体,高尔基体,中心体 D、核糖体,内质网,高尔基体,分泌小泡 E、核糖体,分泌小泡,高尔基体,中心体 10.膜脂不具有的分子运动是 A、侧向运动 B、扭曲运动 C、翻转运动 D、旋转运动 E、振荡运动 11.微管和微丝大量存在于 A、细胞质基质 B、细胞外被 C、细胞膜 D、胞质溶胶 E、细胞连接 12.能封闭上皮细胞间隙的连接方式称为 A、紧密连接 B、粘着连接 C、桥粒连接 D、间隙连接 E、锚定连接 13.细胞表面的特化结构是 A、紧密连接 B、桥粒 C、微绒毛 D、胶原 E、绒毛 14.真核细胞的核外遗传物质存在于
现代生物医学 如何影响癌症的诊断与治疗
现代医学治疗癌症方法主要有:手术治疗、放射治疗、药物治疗、中药治疗,其各自有自己的优点和缺点,并且在不同病症时期有不同的治疗方法。微小RNA在转录后水平通过促进靶mRNA的降解或抑制翻译过程发挥负调控基因的作用,与个体发育、千细胞分化和疾病发牛密切相关。在多种恶性肿瘤中,微小RNA的表达高低各异,与其在正常组织中的表达存在显著差异。通过研究微小RNA与癌症的关系,对寻找新的癌症诊断和治疗的策略以及抑制癌症转移有重大的意义。 癌症治疗的主要传统方法: 一.手术治疗:手术治疗是早、中期病人的最主要的治疗手段之一,给许多癌症带来长期生存的希望。如早期的食管癌、宫颈癌、乳腺癌患者的5年治愈率已超过90%。即使中晚期病人经过手术也能大大提高治愈率,或者达到延长生存时间的目的。因此,每个癌症患者一经确诊,皆应该首先考虑是否有手术切除的可能性。凡能手术治疗者,应及时采取手术治疗,莫失良机。癌瘤的手术分根治性和姑息性两类。根治性手术是指组织切除范围大于肿瘤,争取消除全部瘤组织(包括转移瘤)。 优点:能从根本上切除肿瘤,大大提高治愈率。 缺点:由于癌症早期时的良性肿瘤大多不会给患者带来疼痛,所以很难诊断出早、中期癌症,于是使得手术治疗的最佳时期被错过;有时会带来术后的功能障碍,而出现一些新的症状。 二.放射治疗:(放射源有同位素、镭、60钴、37铯等)、X线治疗机和粒子加速器(产生高能电子束、中子束等)。有外照射和内照射两类方法。外照射是指从体外一定距离来照射人体的某一个部位。内照射则是将放射性同位素放入特制容器中置留病人体中,或把某种放射性同位素口服或注射,被病人的病变部位所吸收,从而受到照射。放射治疗可造成正常组织细胞的损害,产生一些副反应,如放射性肺炎、放射性食道炎、放射性肠炎、血细胞减少、胃肠反应等,一般在放疗停止后均能恢复。为了减轻放疗的不良反应,常配合养阴补肾、益气健脾的中药治疗。 优点:①可保护肿瘤未累及的组织。②产生的损伤较少。③无瘢痕,不引起人体外形的改变。④不形成肥厚性瘢痕、瘢痕瘤、皮肤挛缩。⑤治疗时无痛。⑥患者心理创伤轻。⑦不需要住院。 缺点:①毛发接触后脱落,不易再生。②治疗区汗腺丧失功能。③皮肤萎缩、毛细血管扩张,色素脱失或沉着、干燥或角化。④不能作组织病理检查,不能控制肿瘤的确切边界,会造成其他正常细胞的死亡,后遗症非常明显。
细胞学说的建立: “一切生物,包括单细胞生物、高等动物和植物都是由细胞组成的,细胞是生物形态结构和功能活动的基本单位”。这就是著名的细胞学说(ce11theory)。细胞学说的基本内容 一切生物都是由细胞组成的 所有细胞都具有共同的基本结构 生物体通过细胞活动反映其生命特征 细胞来自原有细胞的分裂 细胞的基本定义 细胞是构成生物有机体的基本结构单位 细胞是代谢与功能的基本单位 细胞是生物有机体生长发育的基本单位 细胞是遗传的基本单位,具有遗传的全能性 细胞的主要共性 所有细胞都具有选择透性的膜结构 细胞都具有遗传物质 细胞都具有核糖体 细胞膜又称细胞质膜(plasma membrane)是指包围在细胞表面的一层极薄的膜,主要由膜脂和膜蛋白所组成。质膜的基本作用是维护细胞内微环境的相对稳定,并参与同外界环境进行物质交换、能量和信息传递。另外,在细胞的生存、生长、分裂、分化中起重要作用 膜功能 界膜和细胞区域化;调节运输;功能定位与组织化;信号转导;参与细胞间的相互作用;能量转换 细胞核(nucleus) 细胞核由核膜、核仁、染色质(染色体)和核基质组成,是细胞内遗传信息贮
存、复制和转录的场所,也是细胞功能及代谢、生长、增殖、分化、衰老的控制中心。 核基质 在核液中存在着一个主要由非组蛋白纤维组成的网络状结构,被命名为核基质。由于它的形态与胞质骨架很相似,相互之间又有一定的联系,也被称为核骨架。 染色质与染色体 染色质是由DNA、组蛋白、非组蛋白和少量RNA组成的线性复合结构,是遗传物质在间期细胞的存在形式,常呈网状不规则的结构。染色体是指细胞在有丝分裂或减数分裂过程中,由染色质聚缩而成的棒状结构。 核糖体(ribosome) 核糖体普遍存在于真核细胞和原核细胞中,是专门用来合成蛋白质的细胞器,这种颗粒小体由rRNA和蛋白质组成。 内质网(endoplasmic reticulum,ER) 内质网是由一层单位膜形成的囊状、泡状和管状结构,并形成一个连续的网膜系统,广泛存在于真核细胞中,是细胞内生物大分子合成基地。光滑内质网是脂类合成的重要场所 。粗糙内质网主要功能是合成分泌蛋白、多种膜蛋白和酶蛋白。 能量转换细胞器 线粒体是普遍存在于真核细胞中的一种重要细胞器。由于线粒体是细胞进行氧化磷酸化并产生ATP的主要场所,细胞生命活动所需能量的80%是由线粒体提供的,因此被称为细胞的“动力工厂”。 生殖是生命的特征之一,通过生殖,生命才得以延续、繁衍并完成进化过程。无性生殖 无性生殖(asexual reproduction)是不经过生殖细胞的结合,由母体直接产生新个体的生殖方式。 有性生殖 有性生殖(sexual reproduction)是高等动、植物普遍存在的生殖方式,是经过两性生殖细胞(卵细胞和精子)的结合,形成合子的方式。 第一次减数分裂 前期Ⅰ:细线期(染色线(chromonema)染色粒(chromomere));偶线期(联会(synapsis),联会复合体(synaptonemal complex)二价体(bivalent));粗线期(四分体(tetrad)非姐妹染色单体(non-sister chromatid)交叉(chiasma)和交
医学生物学知识点 第一章生命的特征与起源 1.生命的基本特征★★★(9条p7-p9) ①生命是以核酸与蛋白质为主导的自然物质体系 ②生命是以细胞为基本单位的功能结构体系 ③生命是以新陈代谢为基本运动形式的自我更新体系 ④生命是以精密的信号转导通路网络维持的自主调节体系 ⑤生命是以生长发育为表现形式的“质”“量”转换体系 ⑥生命是通过生殖繁衍实现的物质能量守恒体系 ⑦生命是以遗传变异规律为枢纽的综合决定体系 ⑧生命是具有高度时空顺序性的物质运动演化体系 ⑨生命是与自然环境的协同共存体系 第二章生命的基本单位-细胞 1.细胞的发现(时间、人物)(P10) 1665年,英国物理科学家胡克。 2.细胞学说的基本内容(4条)p13 ①一切生物都是由细胞组成的 ②所有细胞都具有共同的基本结构 ③生物体通过细胞活动反映其生命特征 ④细胞来自原有细胞的分裂
3.细胞的基本定义(4条)p14 ①细胞是构成生物有机体的基本结构单位。一切有机体均由细胞构成(病毒为非细胞形态的生命体除外); ②细胞是代谢与功能的基本单位。在有机体的一切代谢活动与执行功能过程中,细胞呈现为一个独立的、有序的、自动控制性很强的独立代谢体系; ③细胞是生物有机体生长发育的基本单位。生物有机体的生长与发育是依靠细胞的分裂、细胞体积的增长与细胞的分化来实现的。绝大多数多细胞生物的个体最初都是由一个细胞——受精卵,经过一系列过程发育而来的; ④细胞是遗传的基本单位,具有遗传的全能性。人体内各种不同类型的细胞,所含的遗传信息都是相同的,都是由一个受精卵发育来的,他们之所以表现功能不同是有于基因选择性开放和表达的结果。4.细胞体积守恒定律(p14) 器官的大小与细胞的数量成正比,而与细胞的大小无关,这种关系有人称为“细胞体积守恒定律”。 5.细胞的主要共性(3条) ①所有细胞都具有选择透性的膜结构 ②细胞都具有遗传物质 ③细胞都具有核糖体 6.真核细胞和原核细胞的主要区别★★★(表2-1)
生物技术在医学方面的应用发展 摘要: 二十一世纪,生物技术室高技术中发展最快的领域,似乎是不争的事实。分子生物技术近年来发展迅速,已成为推动分子医学发展的重要工具。生物技术在医药领域中发挥着超重要的作用,促进了医学治疗方法与相关仪器的进步,生物芯片技术,分子生物技术在制药中的重要性正在突出显现,生物技术在医药方面的应用,必将越来越广泛。 生物技术药物或称生物药物是集生物学,医学,药学的现金技术为一体,以组合化学,药学基因(功能抗原学,生物信息学等高技术为依托,以分子遗传学,分子生物,生物物理等基础学科的突破后盾形成的产业。现在,世界生物制药急速的产业化已进入投资收获期,生物技术药品已应用和渗透到医药,保健食品和日产品等各个领域,尤其在新药研究开发、生产和改造传统制药工业中得到日益广泛的应用,生物制药产业已成为最活跃、进展最快的产业之一。目前生物制药主要集中在以下几个方面:1.肿瘤在全世界肿瘤死亡率居首位,美国每年诊断为肿瘤的患者为100万,死于肿瘤者达54.7万。用于肿瘤的治疗费用1020亿美元。肿瘤是多机制的复杂疾病,目前仍用早起诊断、放疗、化疗等综合手段治疗。今后10年抗肿瘤生物药物会急剧增加。如应用基因工程抗体抑制肿瘤,应用导向1L-2受体的融合毒素治疗CTCL肿瘤,应用基因治疗法治疗肿瘤可抑制肿瘤血管生长,阻止肿瘤生长与转移。这类抑制剂有可能成为广谱抗肿瘤治疗剂,已有3中化合物进入临床试验。2.神经退化性疾病老年痴呆症、帕金森氏病,脑中风及脊椎外伤的生物技术药物治疗,胰岛素生长因子rh1GF-1已进入Ⅲ期临床,可以消除症状30%。3.自身免疫性疾病许多炎症由自身免疫缺陷引起,如哮喘,风湿性关节炎,多发性硬化症,红斑狼疮等。风湿性关节炎患者多于4000万,每年医疗费达千亿美元,一些制药公司正在积极攻克这类疾病。如Cenentech公司燕京一种人员化单克隆抗体免疫球蛋白E用于治疗哮喘,已进入Ⅱ期临床,Cetor's公司研制一种TNF-α抗体治疗风湿性多发性硬化病。还有的公司在应用基因疗法治疗糖尿病,如将胰岛素基因导入患者的皮肤细胞,再将细胞注入人体,使工程细胞产生全程胰岛素供应。4.冠心病美国有100万人死于冠心病,每年治疗费用高于1170亿美元。今后10年,防冠心病的药物是制药工业的重点增站点。Concoctor’s Reopro公司应用单克隆抗体治疗冠心病的心绞痛和恢复心脏功能取得成功,这标志一种行业的重要增长点。Concoctor’s Reopro公司应用单克隆抗体治疗冠心病的心绞痛和恢复心脏功能取得成功,这标志着一种新型冠心病治疗药物的诞生。 基因组科学的简历与基因操作技术的日益成熟,使基因治疗与基因测序技术的商业化成为可能,正在达到未来治疗学的新高度。转基因技术用于构造转基因植物和转基因动物,已逐渐进入产业阶段,用转基因绵羊生产蛋白酶抑制剂ATT,用于治疗肺气肿和囊性纤维变性,已进入Ⅱ期,Ⅲ期临床。大量的研究成果表明转基因动物、植物将成为未来制药工业的另一个重要发展领域。 除了遗传学之外,生物技术还可以继续改进预防治疗疾病的方法。这些新疗法可以封锁病原体进入人体并运行传播的能力,使病原体变得更加脆弱并使人的免疫功能对新的病原体作出犯病。这些方法可以克服病原体对抗生素的耐受性越来越强的不良趋势,对感染形成新的攻势。 除了解决传统的细菌和病毒问题之外,人们正在开发解决化学不平衡和化学成分积累的新疗法。例如,正在开发之中的抗体可以攻击体内的可卡因,将来可以用于治疗成瘾的问题。这种方法不仅有助于改善瘾君子的状况,而且对于解决全球性非法毒品贸易问题具有重大影响。 21世纪,生物技术在药物研发方面的作用已经达到了一个新的高度,生物制药技术趋于成熟,将对制药工业和健康保险业产生重大影响。 从化验唾液检查癌症,到只打一针,就可以使神经重新沿着脊髓生长出来,医学界取得的这些新成果,帮助我们回复健康,改善生活,延长生命,使得生物技术在医学领域的地位逐渐重要起来,生物技术开始改变传统的医学技术。例如:人造淋巴,淋巴结对人体非常重要,它可产生具有抗生物技术感染功能的免疫细胞,现在已经制造处人造淋巴,医生利用特定细胞填充这种淋巴结,就能治疗癌症或艾滋病等。
第二章蛋白质的结构和功能 第一节蛋白质分子组成 一、组成元素: N为特征性元素,蛋白质的含氮量平均为16%.———--测生物样品蛋白质含量:样品含氮量×6.25 二、氨基酸 1。是蛋白质的基本组成单位,除脯氨酸外属L—α-氨基酸,除了甘氨酸其他氨基酸的α—碳原子都是手性碳原子。 2。分类:(1)非极性疏水性氨基酸:甘、丙、缬、亮、异亮、苯、脯,甲硫。(2)极性中性氨基酸:色、丝、酪、半胱、苏、天冬酰胺、谷氨酰胺。(3)酸性氨基酸:天冬氨酸Asp、谷氨酸Glu。(4)(重)碱性氨基酸:赖氨酸Lys、精氨酸Arg、组氨酸His。 三、理化性质 1。两性解离:两性电解质,兼性离子静电荷+1 0 —1 PH 生物医学工程学科分支及相关研究进展 生物医学工程是一门由理、工、医相结合的边缘学科,是多种工程学科向生物医学渗透的产物。它是运用现代自然科学和工程技术的原理和方法,从工程学的角度,在多层次上研究人体的结构、功能及其相互关系,揭示其生命现象,为防病、治病提供新的技术手段的一门综合性、高技术的学科。有识之士认为,在新世纪随着自然科学的不断发展,生物医学工程的发展前景不可估量。生物医学工程学科是一门高度综合的交叉学科,这是它最大的特点。 生物医学工程的主干学科是生物医学工程二级学科主要包括如下方面: 1.学习科学:研究学习的规律,研究学生如何有效地从原有知识和能力,向新知识和能力的转移。 2.生物信息技术:实现生物技术和信息技术以及其他学科的有机结合,发展生物信息高通量、高效、快速的提取方法,发展疾病检测的新方法和新技术,发展研究药物与靶标作用的新方法,发展基因组数据、蛋白质组数据和结构基因组数据的计算机处理、分析和可视化方法,解析生物大分子结构和功能之间关系等,提高生物信息处理、分析和利用的水平,为我国生命科学和生物技术的源头创新奠定基础。 3.医学图像与医学电子学:医学图像处理和分析、计算机辅助诊断和治疗、医学物理等,以及生物、医学和工程学等领域理论和方法,并通过这些学科的交叉形成了新型学科。 4.生物与医学纳米技术:包括纳米生物材料、纳米生物器件研究、纳米生物技术在临床诊疗中的应用、纳米材料与器件的计算模拟。 5.生物医学材料:生物医用材料研究,用于人体、器官的诊断、修复、替换或增进其功能。 6.医学信息学及工程:应用系统分析工具这一新技术(算法)来研究医学的管理、过程控制、决策和对医学知识科学分析。 学科内容 生物力学是运用力学的理论和方法,研究生物组织和器官的力学特性,研究机体力学特征与其功能的关系。生物力学的研究成果对了解人体伤病机理,确定治疗方法有着重大意义,同时可为人工器官和组织的设计提供依据。 生物力学中又包括有生物流变学(血液流变学、软组织力学和骨骼力学)、循环系统动力学和呼吸系统动力学等。目前生物力学在骨骼力学方面进展较快。 生物控制论是研究生物体内各种调节、控制现象的机理,进而对生物体的生理和病理现象进行控制,从而达到预防和治疗疾病的目的。其方法是对生物体的一定结构层次,从整体角度用综合的方法定量地研究其动态过程。 生物效应是研究医学诊断和治疗中,各种因素可能对机体造成的危害和作用。它要研究光、声、电磁辐射和核辐射等能量在机体内的传播和分布,以及其生物效应和作用机理。 生物材料是制作各种人工器官的物质基础,它必须满足各种器官对材料的各项要求,包括强度、硬度、韧性、耐磨性、挠度及表面特性等各种物理、机械等性能。由于这些人工器官大多数是植入体内的,所以要求具有耐腐蚀性、化学稳定性、无毒性,还要求与机体组织或血液有相容性。这些材料包括金属、非金属及复合材料、高分子材料等;目前轻合金材料的应用较为广泛。 医学影像是临床诊断疾病的主要手段之一,也是世界上开发科研的重点课题。 05《细胞生物学》试题 姓名班级学号成绩 一、A型题(每题1分,共70分) 1、下列不属细胞生物学的研究层面 A、器官水平 B、细胞整体水平 C、亚细胞水平 D、超微结构水平 E.分子水平 2、细胞内含量最多的物质就是: A、蛋白质 B、核酸 C、脂类 D、无机离子 E、水 3、原核细胞与真核细胞最大区别在于: A.细胞大小 B.有无核膜 C.细胞器数目 D.增殖方式 E.遗传物质的种类 4、测定某一DNA中碱基的组成,T含量为20%,则C含量为: A、10% B、20% C、30% D、40% E、60% 5、核仁中主要含有: A、ATP B、rRNA C、mRNA D、tRNA E、核小体 6、下列那些不属内在蛋白的功能: A.受体 B.载体 C.酶 D.参与运动 E.抗原 7、细胞的总RNA中,含量最多的就是: A、mRNA B、tRNA C、rRNA D、hnRNA E、snRNA 8、下列那些不属磷脂的成分: A、甘油 B、脂肪酸 C、H3PO4 D、核苷酸 E、含N碱 9、电镜下观察到的两层深色致密层与中间一层浅色疏松层的细胞膜性结构,称为: A、生物膜 B、细胞膜 C、细胞内膜 D、单位膜 E、质膜 10、下列那种属蛋白质在膜上的运动方式: A、旋转扩散 B、弯曲运动 C、伸缩震荡 D、翻转运动 E、跳跃 11、下列那些因素使膜流动性增大: A、饱与脂肪酸多 B、胆固醇高 C、膜蛋白的含量高 D、卵磷脂/鞘磷脂比值大 E、常温 12、构成细胞膜基本骨架的成分就是: A、镶嵌蛋白 B、边周蛋白 C、多糖 D、脂类 E、金属离子 13、下列那里就是需能运输: A、脂溶性小分子进出 B、不带电的极性小分子进出 C、通道蛋白质运输 D、载体蛋白质 E、离子泵 14、细胞膜受体都就是细胞膜上的: A、边周蛋白 B、镶嵌蛋白 C、脂质分子 D、糖脂 E、无机离子 15、内膜系统不包括: A、核膜 B、内质网 C、高尔基体 D、溶酶体 E、线粒体 16、细胞膜的不对称性表现在: A、膜脂分布对称,蛋白质与糖类分布不对称 B、膜脂与蛋白质分布对称,糖类分布不对称 C、膜脂与镶嵌蛋白分布对称,边周蛋白质与糖类分布不对称 D、膜脂、镶嵌蛋白与糖类分布对称,边周蛋白质不对称 E、膜脂、蛋白质与糖类分布都不对称 17、核糖体不具有: A、T因子 B、GTP酶 C、A部位 D、P部位 E、ATP酶 (2018年最新医学统计源核心期刊) 医学综合: 安徽医学安徽医药北京医学东南国防医药广西医学贵州医药海军医学杂志河北医学河北医药华南国防医学华西医学基础医学与临床解放军医学解放军医药空军医学齐鲁医学山东医药上海医学四川医学天津医药武警医学西部医学西南国防医药现代生物医学进展现代医学新医学医学研究所学报医学研究杂志医学综述浙江医学中国急救复苏与灾害医学中国煤炭工业医学中国现代医学中国医学前沿杂志电子版中国医药导报中华医学杂志中南医学科学杂志中日友好医院学报转化医学杂志医药大学学报:安徽医科大学学报蚌埠医学院学报北京大学学报医学版成都医学院学报重庆医科大学学报川北医学院学报大连医科大学学报第二军医大学学报第三军医大学学报东南大学学报医学版福建医科大学学报复旦学报医学版广东药学院学报论文快速发表绿色通道 发表流程:收稿---稿件初审---商定期刊---杂志社审稿---办理定金---修改定稿---确认---付余款---杂志社发采稿通知---发表见刊---接收期刊样册---知网收录 论文刊发时间:从收到论文版面费起3-4个月(特殊情况除外),针对需要快速发表的作者提供绿色通道服务。 工作QQ:993383282(董编辑) 信誉保证: 1、杂志社官方合作学术期刊、专业。合理、快速、诚信! 2、我们提供的期刊杂志均是经国家新闻出版总署批准,同时具有CN刊号和ISSN刊号的公开出版物,所有期刊可以在官方渠道查询真假。增刊、非法刊物、香港刊号等一概不予推荐。 本站优势:1.审稿快!2.通过率更高!3.合作期刊范围广,选择性更大! 广西医科大学学报贵州有医科大学学报哈尔滨医科大学学报海南医学院学报河北医科大学学报湖南师范大学学报医学版华中科技大学学报医学版吉林大学学报医学版暨南大学学报自然科学与医学版江苏大学学报医学版解放军医学院学报昆明医科大学学报报兰州大学学报医学版南昌大学学报医学版南方医科大学学报南京医科大学学报自然科学版内蒙古医科大学学报宁夏医科大学学报青岛大学学报医学版山东大学耳鼻喉眼学报山东大学学报医学版山西医科大学学报上海交通大学学报医学版沈阳药科大学学报首都医科大学学报四川大学学报医学版同济大学学报医学版新疆医科大学学报新乡医学院学报徐州医学院学报浙江大学学报医学版郑州大学学报医学版中国药科大学学报中国医科大学学报中国医学科学院学报中南大学学报.医学版中山大学学报医学版遵义医学院学报 基础医学:国际免疫学国际遗传学寄生虫与医学昆虫学报解剖科学进展解剖学报解剖学研究解剖学杂志临床和病理杂志临床和实验病理学杂志免疫学杂志神经解剖学杂志生理学报实验动物与比较医学微循环学杂志细胞与分子免疫学杂志现代免疫学医学分子生物学杂志医用生物力学诊断病理学杂志中国比较医学中国病理生理杂志中国寄生虫与寄生虫病杂志中国临床解剖学中国免疫学中国医学物理学中国组织化学 线粒体: 1.呼吸链(电子传递链)Respiratory chain一系列能够可逆地接受和释放H+和e-的化学物质所组成的酶体系在线粒体内膜上有序地排列成互相关联的链状。 2.化学渗透假说(氧化磷酸化偶联机制):线粒体内膜上的呼吸链起质子泵的作用,利用高能电子传递过程中释放的能量将H+泵出内膜外,造成内膜内外的一个H+梯度(严格地讲是离子的电化学梯度),A TP合酶再利用这个电化学梯度来合成A TP。 3.电子载体:在电子传递过程中与释放的电子结合并将电子传递下去的物质称为电子载体。参与传递的电子载体有四种∶黄素蛋白、细胞色素、铁硫蛋白和辅酶Q,在这四类电子载体中,除了辅酶Q以外,接受和提供电子的氧化还原中心都是与蛋白相连的辅基。 4.阈值效应:突变所产生的效应取决于该细胞中野生型和突变型线粒体DNA的比例,只有突变型DNA达到一定数量(阈值)才足以引起细胞的功能障碍,这种现象称为阈值效应。 5.导向序列:将游离核糖体上合成的蛋白质的N-端信号称为导向信号,或导向序列,由于这一段序列是氨基酸组成的肽,所以又称为转运肽。 6.信号序列:将膜结合核糖体上合成的蛋白质的N-端的序列称为信号序列,将组成该序列的肽称为信号肽。 7.共翻译转运:膜结合核糖体上合成的蛋白质通过定位信号,一边翻译,一边进入内质网,由于这种转运定位是在蛋白质翻译的同时进行的,故称为共翻译转运。 8.蛋白质分选:在膜结合核糖体上合成的蛋白质通过信号肽,经过连续的膜系统转运分选才能到达最终的目的地,这一过程又称为蛋白质分选。 核糖体: 1.原核生物mRNA中与核糖体16S rRNA结合的序列称为SD序列(SD sequence) 。 2.核酶:将具有酶功能的RNA称为核酶。 3.N-端规则(N-end rule): 每一种蛋白质都有寿命特征,称为半衰期(half-life)。研究发现多肽链N-端特异的氨基酸与半衰期相关,称为N-端规则。 4.泛素介导途径:蛋白酶体对蛋白质的降解通过泛素(ubiquitin)介导,故称为泛素降解途径。蛋白酶体对蛋白质的降解作用分为两个过程:一是对被降解的蛋白质进行标记,由泛素完成;二是蛋白酶解作用,由蛋白酶体催化。 细胞核: 1.核内膜:有特有的蛋白成份(如核纤层蛋白B受体),膜的内表面有一层网络状纤维蛋白质,即核纤层(nuclear lamina),可支持核膜。 核外膜:靠向细胞质的一层,是内质网的一部分,胞质面附有核糖体 核周隙:内、外膜之间有宽20~40nm的腔隙,与粗面内质网腔相通 核孔复合体:内、外膜融合处,物质运输的通道 核纤层:内核膜内表面的纤维网络,支持核膜,并与染色质、核骨架相连。 2.核孔复合体:是细胞核内外膜融合形成的小孔,直径约为70 nm,是细胞核与细胞质间物质交换的通道。 3.核孔蛋白:参与构成核孔的蛋白质,可能在经核孔的主动运输中发挥作用。 核运输受体:参与物质通过核孔的主动运输。 核周蛋白: 是一类与核孔选择性运输有关的蛋白家族,相当于受体蛋白。 5.输入蛋白:核定位信号的受体蛋白, 存在于胞质溶胶中, 可与核定位信号结合, 帮助核蛋白进入细胞核。 输出蛋白:存在于细胞核中识别并与输出信号结合的蛋白质, 帮助核内物质通过核孔复合 (生物科技行业)生物医学工程学科分支及研究进展 生物医学工程学科分支及相关研究进展 生物医学工程是壹门由理、工、医相结合的边缘学科,是多种工程学科向生物医学渗透的产物。它是运用现代自然科学和工程技术的原理和方法,从工程学的角度,在多层次上研究人体的结构、功能及其相互关系,揭示其生命现象,为防病、治病提供新的技术手段的壹门综合性、高技术的学科。有识之士认为,在新世纪随着自然科学的不断发展,生物医学工程的发展前景不可估量。生物医学工程学科是壹门高度综合的交叉学科,这是它最大的特点。 生物医学工程的主干学科是生物医学工程二级学科主要包括如下方面: 1.学习科学:研究学习的规律,研究学生如何有效地从原有知识和能力,向新知识和能力的转移。 2.生物信息技术:实现生物技术和信息技术以及其他学科的有机结合,发展生物信息高通量、高效、快速的提取方法,发展疾病检测的新方法和新技术,发展研究药物和靶标作用的新方法,发展基因组数据、蛋白质组数据和结构基因组数据的计算机处理、分析和可视化方法,解析生物大分子结构和功能之间关系等,提高生物信息处理、分析和利用的水平,为我国生命科学和生物技术的源头创新奠定基础。 3.医学图像和医学电子学:医学图像处理和分析、计算机辅助诊断和治疗、医学物理等,以及生物、医学和工程学等领域理论和方法,且通过这些学科的交叉形成了新型学科。 4.生物和医学纳米技术:包括纳米生物材料、纳米生物器件研究、纳米生物技术在临床诊疗中的应用、纳米材料和器件的计算模拟。 5.生物医学材料:生物医用材料研究,用于人体、器官的诊断、修复、替换或增进其功能。 6.医学信息学及工程:应用系统分析工具这壹新技术(算法)来研究医学的管理、过程控制、决策和对医学知识科学分析。 学科内容 生物力学是运用力学的理论和方法,研究生物组织和器官的力学特性,研究机体力学特征和其功能的关系。生物力学的研究成果对了解人体伤病机理,确定治疗方法有着重大意义,同时可为人工器官和组织的设计提供依据。 生物力学中又包括有生物流变学(血液流变学、软组织力学和骨骼力学)、循环系统动力学和呼吸系统动力学等。目前生物力学在骨骼力学方面进展较快。 生物控制论是研究生物体内各种调节、控制现象的机理,进而对生物体的生理和病理现象进行控制,从而达到预防和治疗疾病的目的。其方法是对生物体的壹定结构层次,从整体角度用综合的方法定量地研究其动态过程。 生物效应是研究医学诊断和治疗中,各种因素可能对机体造成的危害和作用。它要研究光、声、电磁辐射和核辐射等能量在机体内的传播和分布,以及其生物效应和作用机理。 生物材料是制作各种人工器官的物质基础,它必须满足各种器官对材料的各项要求,包括强度、硬度、韧性、耐磨性、挠度及表面特性等各种物理、机械等性能。由于这些人工器官大多数是植入体内的,所以要求具有耐腐蚀性、化学稳定性、无毒性,仍要求和机体组织或血液有相容性。这些材料包括金属、非金属及复合材料、高分子材料等;目前轻合金材料的应用较为广泛。 医学影像是临床诊断疾病的主要手段之壹,也是世界上开发科研的重点课题。医用影像设备主要采用X射线、超声、放射性核素磁共振等进行成像。 X射线成像装置主要有大型X射线机组、X射线数字减影(DSA)装置、电子计算 [整理]医学生物学重点 医学生物学终极总结 1. 观察和实验是我们了解生命知识的唯一源泉。 2. 生命的层次:元素—小分子—生物大分子—细胞—组织—器官—生物个体—种群—生物群落—生态系统—生物圈 3. 分化是生物体发育过程中,自受精卵开始,从同质的细胞逐渐分化,形成在形态、结构和功能 方面差异显著的异质细胞,进而形成具有不同结构、执行不同功能的组织、器官的过程。 4. 干细胞是指一类尚未分化,但具有无限或较长自我更新潜能的细胞,在一定条件下,这类干细 胞可通过细胞分化、分裂产生一种以上类型的特化细胞。 5. 克隆是通过无性方式,由单个细胞或个体产生的,和亲代非常相似(或在遗传上基本相同)的一群细胞或生物体。 6. 生物的九个基本特征: 1) 核酸、蛋白质——共同的生命大分子基础 2) 细胞——相似的生命的基本单位 3) 新陈代谢——高度一致的生命基本形式 4) 信息传递——维持机体生命活动的统一机制 5) 生长和发育——生物体由量变到质变的表现形式 6) 生殖——生命现象无限延续的根本途径(会区分无性生殖和有性生殖) 7) 遗传和变异——决定和影响生命现象的中枢 8) 进化——生命活动的全部历史 9) 生物与环境的统一——生命自然界的基本法则 7. 生物的进化包含了生物进化和化学进化 8. 多分子体系形成的两个学说:蛋白起源学说,福克斯的微球体学说、 9. 生物界最原始的生命是:异养、厌氧型的(35亿年前) 10. 从原核生物到真核生物的变化有两个学说:内共生起源说、分化起源说 11. 胡克第一个发现了死细胞;列文虎克第一个发现了活细胞;施莱登和施旺提出了细胞学说。 12. 为什么说细胞是构成生物体的基本单位, 1) 细胞是构成生物有机体的基本结构单位 2) 细胞是代谢与功能的基本单位 3) 细胞是生物有机体生长发育的基本单位 4) 细胞是遗传的基本单位 13. 细胞守恒学说 同类型细胞的体积一般是相近的,不依生物个体的大小而增大或缩小。器官的大小主要决定于细胞的数量,与细胞的数量成正比,而与细胞的大小无关。 14. 支原体是最小的原核细胞 15. 原核细胞一般由:细胞壁、细胞膜、拟核、细胞质、核糖体、中间体组成。 16. 质粒是细胞质中裸露的环状DNA。 17. 原核细胞的增殖方式是:二分裂18. 真核细胞中的膜相结构有:细胞膜、溶酶体、高尔基复合体、线粒体、过氧化氢酶体、内质网、 核膜 19. 真核细胞结构和原核细胞结构的比较特征原核细胞真核细胞细胞大小 较小,1,10 μm 较大,10,100 μm 细胞壁肽聚糖 纤维素(植物细胞) 细胞质仅有核糖体,无胞质环流各种细胞器,存在胞质环流核糖体 70S(50S,30S) 80S(60S,40S) 细胞骨架无有内膜系统无有生物医学工程学科分支及研究进展
《医学生物学》考试试题
2018年最新医学统计源核心期刊
医学细胞生物学知识点归纳
2020年(生物科技行业)生物医学工程学科分支及研究进展
[整理]医学生物学重点