
动物药理学 动物药理学复习题 一、名词解释5*3=15分二、选择题25*2=50分三、填空题15分四、问答题:20分 名词: 1、兽药:是指用于预防、治疗、诊断动物疾病或者有目的地调节动物生理机能的物质。 2、(1)对因治疗:用药目的在于消除疾病的原发致病因子,中医称治本。(2)对症治疗:用药目的在于改善疾病症状,中医称治标。 3、LD50(半数致死量):引起半数动物死亡的剂量。 4、首过效应:内服药物从胃肠道吸收经门静脉系统进入肝脏,药物在肝药酶、胃肠道酶和微生物的联合作用下进行首次代谢,使进入全身循环的药量减少,这种现象称为首过效应,又称首过消除。P18 5、耐药性:又称抗药性。分固有耐药性和获得耐药性。 (1)固有耐药性是由细菌染色体基因决定而代代相传的耐药性。(2)获得耐药性是细菌在多次接触抗菌药物后,产生了结构、生理及生化功能的改变,从而形成具有抗药性的变异菌株,它们对药物的敏感性下降或消失6、交叉耐药性:某种病原菌对一种药物产生耐药性后,往往对同一类的药物也具有耐药性。7、抗菌药后效应:指抗菌药在撤药后其浓度低于
最小抑菌浓度时,仍对细菌保持一定的抑制作用。 8、药物的配伍禁忌:两种以上药物混合使用或制成制剂时,可能出现药物的中和、水解、破坏失效等理化反应,产生诸如混浊、沉淀、产生气体及变色等外观异常的现象,称为配伍禁忌。P35 9、不良反应:指在按规定用法用量应用兽药的过程中产生的与用药目的无关或有害的毒性反应。P42 10、副作用:指药物在常用治疗计量时产生的与治疗无关的作用或危害不大的不良反应。P5 11、肝肠循环:从胆汁排泄进入小肠的药物中,某些具有脂溶性的药物可被直接重吸收,另一些与葡萄糖醛酸的结合物可被肠道微生物的β-葡萄肝酸酶所水解并释放出原形药物,然后被重吸收的过程。P24 12、封闭疗法:将局麻药注射于患部周围或神经通路,阻断病灶部的不良冲动向中枢传导,以减轻疼痛、改善神经营养。P69 13、MIC:最小抑菌浓度指能够抑制培养基内细菌生长的最低浓度。P226 14、化疗指数:是评价化疗药安全性的指标。以动物的半数致死量(LD50)与治疗感染动物的半数有效量(ED50)的比值表示,即CI=LD50/ED50;或以动物的5%致死量(LD5)与治疗感染动物的95%有效量(ED95)之比值来衡量。P226 15、化疗三角:使用化疗药防治畜禽疾病的过程中,化疗药物、机体、病原体三者之间存在复杂的相互作用关系,称为“化疗三角”.P225 16、穿梭用药:在同一个饲养期内,换用两种或三种不同性质的抗球
实验动物剂量换算问题的解析 一、体表面积计算法 关于不同实验动物之间或者实验动物与人之间的剂量如何作“等效”换算的问题。我们在实验中估算一种药物或化合物的使用剂量的时候,差不多是来源于两条途径:一是查文献,参考别人使用的剂量。有时有现成的,可直接用。有时没有我们所用动物的剂量,但有其它实验动物的。也有的是有临床用量的,但没有实验动物的。这样,我们就得进行换算。 另一种方法就是根据自己或文献上有关急性毒性的数据来进行估算,以期采用合适的剂量。一般参考数据是LD50。至于该选择LD50的多少分之一来作为参考剂量,众说纷纭。下面我来说一说用第一种方法进行如何换算。 目前我们大多数人用的方法,是参考徐叔云教授主编的《药理实验方法学》。在其附录中有一个表,列出了人和动物间按体表面积折算的等效剂量比值。这个表,几乎被药理专业的人们奉为经典,一直在科研中沿用。表如下所示: 人和动物间按体表面积折算的等效剂量比值
本人认为在此表中,人的体重设为70kg,是有点不妥的。如果设为60kg,则能为大多数人接受。这样一来,这个表就得进行修正。如果为60kg,则人的体表面积为1.55m2左右。那么,这样一来,折算系数表的中数字,全部要修正。最后一行的数字要乘以1.72 / 1.55 =1.11,而表最右上端的人的体重改为60kg。 那么我们来看看上面这个表的最后一行,这个也是我们通常要用到的,把人的临床剂量转换为实验动物的剂量。但是如果按这个表来计算实验动物的等效剂量,需要动物的体重基本上在标准体重的区间内相差不大才会准确。也就是说,小鼠在20g左右,大鼠在200g左右,豚鼠在400g左右等等,这样计算出来才会准确。当大鼠的体重为180g、250g、300g、350g、400g时,那么它的剂量根据体型系数计算实际体表面积应是多少?而按折算系数算又是多少?它们之间相差有多大?当大鼠体重在哪个范围内波动时,上述折算系数仍然基本准确呢?为什么说,当实验动物体重不在上述标准体重的附近的话,按折算系数算出来的剂量就不那么准了呢? 这是因为,我们用这个折算系数,只是一个点对点的关系。就是说,70kg的人对200g的大鼠,那么这个剂量完全准确的。但如果大鼠不是200g,那么就会有偏差了。这个偏差来源于体型系数的公式。 如:人的临床剂量为Xmg/kg,换算成大鼠的剂量: 大鼠的剂量=(X mg/kg×70kg×0.018)/200g =(X mg/kg×70kg×0.018)/0.2kg =6.3X mg/kg。 这也就是说,按单位体重的剂量来算,大鼠的等效剂量相当于人的6.3倍。在这里,我们要看到每种动物
实验1 实验动物的捉持法和给药法 一、常用实验动物的捉持法 1.蛙和蟾蜍 通常以左手握持,用食指和中指夹住左前肢,拇指压住右前肢,右手将下肢拉直,左手用无名指及小指夹住(图1)。 图1 蟾蜍捉持法 2.小鼠 (1)双手法:右手提鼠尾,放在鼠笼盖或其他粗糙面上,向后方轻拉鼠尾,使小鼠前肢固定在粗糙面上。迅速用左手拇指和食指捏其双耳间颈背部皮肤,无名指、小指和掌心夹其背部皮肤和尾部,便可将小鼠牢固捉持(图2)。 图2 小鼠双手捉持法 (2)单手法:小鼠置于笼盖上,先用左手食指和拇指抓住鼠尾,后手掌尺侧和小指夹住鼠尾,然后左手拇指与食指捏住颈部皮肤(图3)。 图3 小鼠单手捉持法 3. 大鼠 大鼠容易激怒咬人,捉持时应戴防护手套。先用右手抓住鼠尾,再用左手拇指和食指握住头部,其余手指与掌部握住背部和腹部。注意不要捏其颈部,以防用力过大、过久,窒息死亡。 4.家兔 一只手抓住兔颈背部皮肤,将兔轻轻提起,另一只手托住臀部,使兔呈蹲坐姿势(图4)。切不可用手握持双耳提起兔子。 图4 家兔捉持法 5.豚鼠
豚鼠性情温和,不咬人,用手轻轻握住身体即可抓起。 6. 猫 应戴好防护手套。轻声呼唤,慢慢将手伸入猫笼,轻抚猫头、颈和背部,一只手抓住颈背部皮肤,另一只手抓住腰背部。性情凶暴的猫可用布袋或网套捉持,操作中应防其利爪和牙齿伤人。 7. 狗 驯服的狗可戴上特制嘴套,用绳带固定于耳后颈部;凶暴的狗可用长柄捕狗夹钳住狗的颈部,然后套上嘴套。狗嘴也可用绳带固定,操作时先将绳带绕过狗嘴的下颌打结,再绕到颈后部打结,以防绳带滑落。狗麻醉后四肢固定于手术台上,取下嘴套或绳带,将一金属棒经两侧嘴角,穿过口腔压于舌上,再用绳带绕过金属棒绑缚狗嘴,并固定于手术台上。应将狗舌拉出口腔,以防窒息。 二、常用实验动物给药法 1. 经口给药法 此法有口服与灌胃两种方法。适用于小鼠、大鼠、豚鼠、兔、犬等动物。口服法可将药物放入饲料或溶于饮水中令动物自由摄取。若为保证剂量准确,可应用灌胃法。 (1)灌胃法 小鼠:左手捉持小鼠,腹部朝上,右手持灌胃管经口角插入口腔,使灌胃管与食管成一直线,再沿上颚壁缓慢插入食管,稍感有阻力时(大约灌胃管插入1/2),如动物安静,呼吸无异常,即可注入药液。如遇阻力应抽出灌胃管重新插入,若药液误注气管,小鼠可立即死亡。一次灌注药量0.1-0.3ml/10g体重。操作宜轻柔,防止损伤食管(图5)。灌胃管可用粗大的注射针头制作,磨钝针尖制成,管长4-5cm,直径1mm,连接于1-2ml 注射器上即成。 图5 小鼠灌胃法 大鼠:左手捉持大鼠,右手持灌胃器,灌胃方法与小鼠相同。若两人合作时,可由助手协助固定后肢与尾巴。但灌胃管必须长6-8cm,直径1.2mm,尖端呈球状,并安装在5 -10ml的注射器上。注药前应回抽注射器,证明未插入气管(无空气逆流)方可注入药液。一次投药量1—2ml/100g体重。 家兔:需两人合作,一人坐好将兔躯体夹于两腿之间,左手紧握双耳固定头部,右手抓住两前肢固定前身,使兔头稍向后仰;另一人将木或竹制开口器横放于兔口中,将兔舌压住,以8号导尿管经开口器中央小孔,沿上颚壁慢慢插入食管15-18cm。为避免误入气管,可将导尿管外口端放入清水杯中,无气泡逸出方可注入药液,并应再注入少量清
2005/2006-1 04级《动物药理》课程期末考试试题A 班级姓名学号成绩 一、名词解释:(每题5分,共20分) 1.副作用 2.局部作用 3.生物半衰期 4.最小中毒量 二、选择题:(请将正确的字符填在括号内)(每题2分,共10分)1.氨基糖苷类抗生素主要用于引起的疾病。()A.革兰氏阳性菌B.革兰氏阴性菌 C.病毒D.真菌 2.某鸡场发生呼吸道感染,以下哪种措施无效?()A.肌注硫酸链霉素B.口服硫酸链霉素 C.肌注青霉素G钠D.口服环丙沙星 3.动物出现病毒感染时,应使用抗病毒药物,以下哪种药物无抗病毒作用?() A.呋喃唑酮B.利巴韦林C.金刚烷胺D.吗啉呱4.一奶牛产后出现后躯的不全麻痹,应使用哪种中枢神经兴奋药?() A.尼可刹米B.回苏灵C.咖啡因D.士的宁5.低血钾病畜发生尿淋,水肿时,应使用哪种利尿剂?()A.呋塞米片B.呋塞米注射液
C.螺内酯胶囊D.氢氯噻嗪片 三、判断题对的在括号内打 V ,错的在括号内打×(每题2分,共10分) 1.氯化钙只能肌注。() 2.强心苷可与氯化钙配合使用。() 3.盐酸普鲁卡因不宜作表面麻醉。() 4.某奶牛场一奶牛发生难产,挤奶员使用了麦角制剂进行催产。() 5.阿托品是有极磷农药中毒的特效解毒药。() 四、填空题(每空1分,共25分) 1.动物发生氰化物中毒时血液呈色,使用特效解毒药?2.一怀孕奶牛被其他奶牛顶伤,有流产迹象,使用作安胎药物?3.一奶牛产后发生前胃迟缓,应使用瘤胃兴奋药。4.TMP口服主要用于感染。 5.乙醇最佳的消毒浓度是- ,配制70%的乙醇500ml需要95%乙醇约ml。 6.某一药物在某一动物体内的血浆药物浓度由100mg/L下降到50mg/L 需要3小时,请问这一药物在该动物体内的生物半衰期是,如果这一药物在该动物体内的血浆药物浓度由200mg/L下降到25mg/L,需要小时。 7.药物对机体的作用叫。 8.口服小剂量的大黄会出现作用,口服中等剂量的大黄会
()动物给药量的确定 在观察一药物的作用时,应该给动物在的剂量是实验开始时应确定的一个重要问题剂量太小,作用不明显,剂量太,又可能引起动物中毒致死,可以按下述方法确定剂量:1.先用小鼠粗略地探索中毒剂量或致死剂量,然后用小于中毒量的剂量,或取致死量的若干分之一应用剂量,一般可取1/10-1/5。 4.确定剂量后,如第一次实验的作用不明显,动物也没有中毒的表现(体重下降、精神不振、活动减少或其他症状),可以加大剂量再次实验。如出现中毒现象,作用也明显,则应降低剂量再次实验。在一般情况下,在适宜的剂量范围内,药物的作用常随剂量的加大而增强。所以有条件时,最好同时用几个剂量作实验,以便迅速获得关于药物作用的较完整的资料。如实验结果出现剂量与作用强度之间毫无规律时,则应慎重分析。 动物实验所用的药物剂量,一般按mg/kg体重或g/kg体重计算,应用时须从已知药液的浓度换算出相当于每kg体重应注射的药液量(ml),以便给药。
例2:计算给体重23g的小白鼠,注射盐酸吗啡15mg/kg重,溶液浓度为0.1%,应注射多少m l? 计算方法:小白鼠每kg体重需吗啡的量为15mg,则0.1%盐酸吗啡溶液的注射量应为15ml/kg 体重,现小白鼠体重为23g,应注射0.1%盐酸吗啡溶液的用量=15×0.023=0.345ml。 (三)人与动物及各类动物间药物剂量的换算方法 1.人与动物用药量换算人与动物对同一药物的耐受性是相差很大的。一般说来,动物的耐受性要比人大,也就是单位体重的用药理动物比人要大。人的各药物的用量在很多书上可以查得,但动物用药量可查的书较少,而且动物用的药物种类远不如人用的那么多。因此,必须将人的用药量换算成动物的用药量。一般可按下列比例换算:人用药量为1,小白鼠、大白鼠为25-50,兔、豚鼠为15-20,狗、猫为5-10。 此外,可以采用人与动物的体表面积计算法来换算: (1)人体体表面积计算法计算我国人的体表面积,一般认为许文生氏公式(中国生理学杂志1 2:327,1937)尚较适用,即: 体表面积(m2)=0.0061×身高(cm)+0.0128×体重(kg)-0.1529 例:某人身高168cm,体重55kg,试计算其体表面积。 解:0.061×168+0.0128×55.0.1529=1.576m2 (2)动物的体表面积计算法有许多种,在需要由体重推算体表面积时,一般认为Meeh-Rubn er氏公式尚较适用,即: 式中的K为一常数,随动物种类而不同:小白鼠和大白鼠9.1、豚鼠9.8、家兔10.1、猫9.8、狗11.2、猴11.8、人10.6(上列K值各家报导略有出入)。应当指出,样计算出来的表面积还是一种粗略的估计值,不一定完全符合于每个动物的实测数值。 例:试计算体重1.50kg家兔的体表面积。
3.4 实验动物的给药方法 3.4.1 经口投药法 (1) 口服法. 口服法是将能溶于水并且在水溶液中较稳定的药物放入动物饮水中,不溶于水的药物混于动物饲料内,由动物自行摄入。该方法技术简单,给药时动物接近自然状态,不会引起动物应激反应,适用于多数动物慢性药物干预实验,如抗高血压药物的药效、药物毒性测试等。其缺点是动物饮水和进食过程中,总有部分药物损失,药物摄入量计算不准确,而且由于动物本身状态、饮水量和摄食不同,药物摄入量不易保证,影响药物作用分析的准确性。 (2) 灌服法 灌服法是将动物适当固定,强迫动物摄入药物。这种方法能准确把握给药时间和剂量,及时观察动物的反应,适合于急性和慢性动物实验,但经常强制性操作易引起动物不良生理反应,甚至操作不当引起动物死亡。故应熟练掌握该项技术。强制性给药方法主要有两种: ①固体药物口服 一人操作时用左手从背部抓住动物头部,同时以拇、食指压迫动物口角部位使其张口,右手用镊子夹住药片放于动物舌根部位,然后让动物闭口吞咽下药物。 ②液体药物灌服 小白鼠与大白鼠一般由一人操作,左手捏持小白鼠头、颈、背部皮肤,或握住大白鼠以固定动物,使动物腹部朝向术者,右手将连接注射器的硬质胃管由口角处插入口腔,用胃管将动物头部稍向背侧压迫,使口腔与食管成一直线,将胃管沿上颚壁轻轻插入食道,小白鼠一般用3 cm,大白鼠一般用5 cm的胃管(图3.4-1)。插管时应注意动物反应,如插入顺利,动物安静,呼吸正常,可注入药物;如动物剧烈挣扎或插入有阻力,应拔出胃管重插,如将药物灌入气管,可致动物立即死亡。 给家兔灌服时宜用兔固定箱或由两人操作。助手取坐位,用两腿夹住动物腰腹部,左手抓免双耳,右手握持前肢,以固定动物;术者将木制开口器横插入兔口内并压住舌头,将胃管经开口器中央小孔沿上腭壁插入食道约15 cm,将胃管外口置一杯水中,看是否有气泡冒出,检测是否插入气管,确定胃管不在气管后,即可注入药物(图3.4-2)。 3.4.2 注射给药
药理学实验及作业第一部分:绪论及总论 1、药物:用于疾病治疗、预防或诊断的安全、有效和质量可控的化学物质。 2、毒物:对动物机体产生能损害作用的物质。 3、兽药:指用于预防、治疗、诊断动物疾病,以及有目的地调节动物生理机能的物质 4、药物利用度:指药物制剂被机体吸收的速率和吸收程度的一种度量。 5、药物的来源:药物可分为天然药物、合成药物和生物技术药物,天然药物包括植物、动物、矿物及微生物发酵产生的抗生素,合成药物包括各种人工合成的化学药物、抗菌药物等,生物技术制药即通过基因工程、细胞工程等分子生物学技术生产的药物。 6、剂型:这些药物的原料一般不能直接用于动物疾病的治疗或预防,必须进行加工,制成安全、稳定和便于应用的形式,称为药物剂型。 7、兽医药理学:是研究药物与动物机体之间相互作用规律的一门学科,是为临床合理用药、防治疾病提供基本理论的兽医基础学科。 8、药效学:研究药物对机体的作用规律,阐明药物防治疾病的原理,称为药效学。 9、药动学:研究机体对药物的处置过程,即药物在体内的吸收、分布、生物转化和排泄过程中药物浓度随时间变化的规律。 10、兴奋:机体在药物作用下,使机体器官、组织的生理、生化功能增强的效应。 11、抑制:机体在药物作用下,使机体器官、组织的生理、生化功能减弱的效应。 12、局部作用:药物在吸收进入血液以前在用药局部产生的作用。 13、吸收作用:药物经吸收进入全身循环后分布到作用部位而产生的作用,又称全身作用。 14、直接作用:药物对直接接触到的器官、组织、细胞的作用。 15、间接作用:由于机体的整体性,会对药物的直接作用产生反射性或生理性调节,即为药物的间接作用。 16、药物作用的选择性:指药物在一定剂量范围内只作用于某些组织和器官,对其他组织和器官没有作用。 17、对因治疗:用药目的在于消除原发致病因子,彻底治愈疾病。 18、对症治疗:用药目的在于改善症状,称对症治疗,或称治标。 19、药物的不良反应:与用药目的无关的或对动物产生损害的作用。包括副作用、毒性作用、、变态反应、继发性反应、后遗效应、停药反应。 20、副作用:药物在常用治疗剂量时产生的与治疗无关的作用或危害不大的不良反应。 21、毒性作用:是有用药剂量过大或用药时间过长对机体产生的有害作用。 22、变态反应:又称过敏反应,药物和血浆蛋白或组织蛋白结合后作为抗原而引起的机体体液性或细胞性的免疫反应,并对机体造成一定程度上的损害。 23、药物的构效关系:药物的药理作用与其化学结构之间的关系。 24、药物的量效关系:定量分析与阐明药物的剂量与效应之间的变化规律 25、LD50:引起半数动物死亡的量称半数致死量。 26、ED50:对50%个体有效的药物剂量称半数有效量。 27、治疗指数:药物LD50与ED50的比值称为治疗指数。 28、安全范围ED95~LD5之间的距离或95%有效量~5%致死量 29、受体:对特定的生物活性物质具有识别能力并可选择性结合的生物大分子。 30、受体的功能:与配体结合、传递信息。 31、受体的特性:饱和性、可逆性、特异性、灵敏性、多样性。 32、受体的调节:增敏调节和脱敏调节 33、占领学说:药物与受体间的相互作用是可逆的;药效与被占领受体的数量成正比,当全部受体被占领时,就会产生最大药理效应;药物浓度与效应关系服从定量作用定律;药
请注意最后一行,这个就是我们通常用到的。把人的临床剂量转换为实验动物的剂量。 试着换算一个。 如:人的临床剂量为X mg/kg , 换算成大鼠的剂量: 大鼠的剂量=X mg/kg×70kg×200g=X mg/kg×70kg×0.2kg=X mg/kg. 这也就是说,按单位体重的剂量来算,大鼠的等效剂量相当于人的倍。 在这里,我们要看到每种动物的体重(包括人),在上表中以蓝色显示的。还要注意到折算系数,也就是表中以红色所示的。将人的剂量转换成哪种动物的,就在相应的动物那一列下找到与人的相交的地方的折算系数,将剂量乘以折算系数,再乘上人的体重与那种动物体重的比值。注意体重的单位要化成一致。这个折算系数是以上表中蓝色所示的标准体重计算得来的。 依此类推,我们可以算出小鼠、豚鼠等其它动物剂量与人的比值。各常用实验动物折算系数的验证如下: 小鼠体型系数:标准体重:20g=0.02kg 小鼠的折算系数=(体型系数小鼠*W小鼠2/3)/(体型系数人*W人2/3) =(* 2/3 )/*70 2/3)* 70*X / = = 大鼠体型系数:标准体重:200g=0.2kg 大鼠的折算系数=(体型系数大鼠*W大鼠2/3)/(体型系数人*W人2/3) =(* 2/3 )/*70 2/3)* 70*X /
= = 豚鼠体型系数:标准体重:400g=0.4kg 豚鼠的折算系数=(体型系数豚鼠*W豚鼠2/3)/(体型系数人*W人2/3) =(* 2/3 )/*70 2/3)* 70*X / = = 兔体型系数:标准体重:1.5kg 兔的折算系数=(体型系数兔*W兔2/3)/(体型系数人*W人2/3)=(* 2/3 )/*70 2/3) = = 猫体型系数:标准体重:2.0kg 猫的折算系数=(体型系数猫*W猫2/3)/(体型系数人*W人2/3)=(* 2/3 )/*70 2/3) = = 狗体型系数:标准体重:12kg 狗的折算系数=(体型系数狗*W狗2/3)/(体型系数人*W人2/3)=(*12 2/3 )/*70 2/3) =
常用实验动物的给药途径和方法 在动物实验中,为了观察药物对机体功能、代谢及形态的变化,常需将药物注入动物体内。由于实验目的、动物种类、药物剂型不同,给药途径和方法也多种多样。 一经口给药法 (一)灌胃法 此法给药剂量准确,是借灌胃器将药物直接灌到动物胃内的一种常用给药方法。 1、白鼠灌胃法:抓起小鼠,以左手拇指、食指固定头部,小指、无名指和掌心夹注尾巴,使腹部朝上,颈部拉直,右手持灌胃器,将灌胃针从鼠的口角插入口腔,从舌背沿上腭插入食道。灌胃量0.2~0.5ml/10g。 胃管可用适宜口径的硬质塑料管或磨去针头的8号注射针头弯成适当的弧度制成。 注意,操作时不要用力猛插,以免插破食道或误插入器官造成动物死亡。 2、白鼠灌胃法:左手戴上棉手套,用左手拇指和食指将大鼠头部固定,将大鼠 灌胃器沿腭后壁慢慢插入食道。灌胃针插入时应无阻力,如有阻力或动物挣扎则应退针或将针拔出,重新再插。灌胃器由注射器和特殊的灌胃针构成。灌胃量10~20ml/kg 3 兔、犬等:灌胃一般要借助于开口器、灌胃管进行。先将动物固定,再将开口器固定于上下门齿之间,然后将灌胃管(常用导尿管代替)从开口器的小孔插入动物口中,沿咽后壁而进入食道。插入后应检查灌胃管是否确实插入食道。可将灌胃管外开口放入盛水的烧杯中,若无气泡产生,表明灌胃管被正确插入胃中,未误入气管。此时将注射器与灌胃管相连,注入药液。 4、猪的胃内灌注法:给猪下鼻饲管较困难,因猪的鼻翼与上唇联合形成吻突,鼻腔内上下鼻夹与鼻中隔通道极窄,只能通过F10-12号的导尿管,F14号以上的导尿管不能插入,故一般均给猪采用经口入胃的灌胃方法。具体方法是,预先做好一矩形小木块,中间有一洞,让小猪咬住,将其固定,然后再由此洞下胃管。此种操作较为简便。 5、鸟类:包括鸽、鸡等,经口灌胃给药,可由助手将其身体用毛巾裹住固定好。实验者用左手将动物向后拉,使其颈部倾斜,用左拇指和食指将动物嘴撬开,其他三只手指固定好动物头部,右手取带有灌胃针头的注射器,将灌胃针头由动物舌后插入食管。不要象其它动物灌胃时插的太深,如动物不挣扎,插针头又很顺利,即可将药液经口或食管上端罐入胃内。罐入速度要慢。
动物实验的基本操作技术 实验动物 实验动物(experimental animals)是指经过人工饲养、繁育,对其携带的微生物及寄生虫实行控制,遗传背景明确或者来源清楚,应用于科研、教学、生产和检定以及其他科学实验的动物。这些个体具有较好的遗传均一性、对外来刺激的敏感性和实验再现性。 一、常用实验动物的种类和特点 (一)狗(dog)属于哺乳纲、食肉目、犬科动物。其嗅觉、视和听觉均很灵敏,对外界环境的适应能力强。消化、循环和神经系统均发达,且与人类很相似。适用于各类实验外科手术学的教学和临床科研工作,是复制休克、DIC、动脉粥样硬化等动物模型首选的动物之一,由于其价格较昂贵,教学实验中不如某些中小动物常用。 (二)家兔(rabbit) 属于哺乳纲、啮齿目、兔科、草食类动物。品种有:青紫蓝兔(livor blue rabbit)、中国白兔(china white rabbit)、新西兰白兔和大耳白兔(maximus ear white rabbit)等。具有性情温顺,对温度适应敏锐和便于静脉注射等特点,是教学实验中最常用的动物之一。可用于血压、呼吸、泌尿等多种实验,还可用于体温实验和热原的研究与鉴定。 (三)大白鼠(rat) 属哺乳纲、啮齿目、鼠科类动物。其性情凶猛、喜欢啃咬、繁殖周期短、抗病能力较强、心血管反应敏锐。用于水肿、休克、炎症、心功能不全、肾功能不全和应激反应等实验。大鼠不能呕吐,故不能做催吐实验。 (四)小白鼠(mouse) 属哺乳纲、啮齿目、鼠科类动物。具有繁殖周期短、产仔多、生长快、体型小、温顺易捉、易于饲养等特点。广泛应用于各种药物的毒理实验、药物筛选实验、生物药效学实验,以及癌症研究、营养学、遗传学、免疫性疾病研究等项实验。 (五)豚鼠(cavy) 属哺乳纲、啮齿目、豚鼠科类动物。又名天丝鼠、荷兰猪。其性情温顺,嗅觉和听觉较发达。对某些病毒反应敏锐,易引起变态反应。适用于药理学、营养学、各种传染病的实验研究。细菌、病毒诊断学研究、过敏、变态反应性实验研究和内耳及听神经疾病研究。也常用于离体心脏实验研究。 (六)蛙和蟾蜍(frog and toad ) 均属两栖纲、无尾目类动物。常用于教学实验。其心脏在离体后仍可有节律地跳动。常用于心脏生理、药理和病生实验。蛙舌与肠系膜是观察炎症和微循环变化的良好标本。此外,蛙类还可用于水肿和肾功能不全的实验研究。 二、常用实验动物的品系
我们在实验中估算一种药物或化合物的使用剂量的时候,差不多是来源于两条途径: 一是查文献,参考别人使用的剂量。有时有现成的,可直接用。有时没有我们所用动物的剂量,但有其它实验动物的。也有的是有临床用量的,但没有实验动物的。这样,我们就得进行换算。这是我们今天要谈的这种方法。 另一种方法就是根据自己或文献上有关急性毒性的数据来进行估算,以期采用合适的剂量。一般参考数据是LD50。至于该选择LD50的多少分之一来作为参考剂量,众说纷纭。这个我们再另题讨论。 下面我来说一说用第一种方法进行如何换算。 目前我们大多数人用的方法,是参考徐叔云教授主编的《药理实验方法学》。在其附录中有一个表,列出了人和动物间按体表面积折算的等效剂量比值。这个表,几乎被药理专业的人们奉为经典,一直在科研中沿用。 表如下所示: 请注意最后一行,这个就是我们通常用到的。把人的临床剂量转换为实验动物的剂量。 试着换算一个。 如:人的临床剂量为X mg/kg ,换算成大鼠的剂量: 大鼠的剂量=X mg/kg×70kg×0.018/200g=X mg/kg×70kg×0.018/0.2kg=6.3 X mg/kg. 这也就是说,按单位体重的剂量来算,大鼠的等效剂量相当于人的6.3倍。 在这里,我们要看到每种动物的体重(包括人),在上表中以蓝色显示的。还要注意到折算系数,也就是表中以红色所示的。将人的剂量转换成哪种动物的,就在相应的动物那一列下找到与人的相交的地方的折算系数,将剂量乘以折算系数,再乘上人的体重与那种动物体重的比值。注意体重的单位要化成一致。这个折算系数是以上表中蓝色所示的标准体重计算得来的。 依此类推,我们可以算出小鼠、豚鼠等其它动物剂量与人的比值。 小鼠的剂量=X mg/kg×70kg×0.0026/20g=X mg/kg×70kg×0.0026/0.02kg=9.1 X mg/kg.
实验动物的给药途径和方法及药量计算方法标准化管理部编码-[99968T-6889628-J68568-1689N]
一.经口给药法 (一)灌胃法 此法给药剂量准确,是借灌胃器将直接灌到动物胃内的·种常用给药法。1.鼠类:鼠类的灌胃器由特殊的灌胃针构成。左手固定鼠,右手持灌胃器,将灌胃针从鼠的右U角中,插入口中,沿咽后壁慢慢插入食道,使其前端到达膈肌位置,灌胃针插入时应无阻力,如有阻力或动物挣扎则应退针或将针拔出,以免损伤、穿破食道或误入气管。 2.兔、犬等:灌胃一般要借助于开口器、灌胃管进行。先将动物固定,再将开口器固定于上下门齿之间。然后将灌胃管(常用导尿管代替)从开口器的小孔插入动物口中,沿咽后壁而进入食道。插入后应检查灌胃管是否确实插入食道。可将灌胃管外开口放入盛水的烧杯中,若无气泡产生,表明灌胃管被正确插入胃中,未误入气管。此时将注射器与灌胃管相连,注入药液。 (二)口服法 口服给药是把混入饲料或溶干饮水中让动物自由摄取。此法优点是简单方便,缺点是剂量不能保证准确,且动物个体间服药量差异较大。大动物在给予片剂、丸剂、胶囊剂时,可将用镊子或手指送到舌根部,迅速关闭口腔,将头部稍稍抬高,使其自然吞咽。 二、注射给药法
(一)皮下注射 皮卜注射一般选取皮下组织疏松的部位,大鼠、小鼠和豚鼠可在颈后肩胛问、腹部两侧作皮下注射;家兔可在背部或耳根部作皮卜注射;猫、犬则在大腿外侧作皮下注射。皮下注射用左手拇指和食指轻轻提起动物皮肤,右手持注射器,使针头水平刺入皮下。推送药液时注射部位隆起。拨针时,以手指捏住针刺部位,可防止药液外漏。 (二)肌肉注射 肌肉注射一般选肌肉发达,无大血管通过的部位。大鼠、小鼠、豚鼠可注射大腿外侧肌肉;家兔可在腰椎旁的肌肉、臀部或股部肌肉注射;犬等大型动物选臀部注射。注射时针头宜斜刺迅速人肌肉,回抽针栓如无回血,即可注射。(三)腹腔注射 给大鼠、小鼠进行腹腔注射时,以左手固定动物,使腹部向上,为避免伤及内脏,应尽量使动物头处于低位,使内脏移向上腹,右手持注射器从下腹两侧向头方刺入皮下,针头稍向前,再将注射器沿45角斜向穿过腹肌进入腹腔,此时有落空感,回抽无回血或尿液,即可注入药液。免、犬等动物腹腔注射时,可由助手固定动物,使其腹部朝上,者即可进行操作。注射位置为:家兔下腹部近腹白线左右两侧1cm处,犬脐后腹白线两侧边1—2cm处进行腹腔注射。(四)静脉注射
动物药理练习题 一、填空题 1、药物保管应按照国家颁布的药品管理办法,建立严格的保管制度,实行(专人专账)和(专柜保管),保证账目与药品相符。 2、药物应根据药品说明书的要求科学合理储存,《中国兽药典》对各种药品的储存都有具体要求,总的原则是避光、(密闭)、(密封)、(熔封)或(严封),在阴凉处,凉暗处,冷处等贮存。 3、联合用药的结果有(协同作用)和(拮抗作用)。 4、抗生素根据抗菌活性可分为(抗菌药)和(杀菌药)。 5、机体对药物的作用表现为(吸收)、(分布)、(转化)和(排泄)。 6、请写出下列疾病的首选药物:链球菌病(青霉素),猪喘气病(恩诺沙星),鸡白痢(庆大霉素),烧伤感染(庆大霉素),雏鸡眼曲霉菌性肺炎(制霉菌素)。 7祛痰药主要有(氯化铵)、(碘化钾)和(乙酰半胱氨酸)。 8、子宫收缩药是一类能兴奋子宫平滑肌,引起子宫收缩的药物,常用药有(缩宫素)、(垂体后叶素)和(麦角新碱)。 9、可作为助消化药物的酸是(稀盐酸),酶是(胰酶)和(胃蛋白酶)。 10、有机磷中毒对症解毒药是(阿托品),特效解毒药是(解磷定)。 二、选择题 1、青霉素主要作用于(D)引起的疾病。 A、革兰氏阴性菌 B、真菌 C、支原体 D、革兰氏阳性菌 2、不属于兽药范畴的是(D)。 A、疫苗 B、抗生素 C、血液制品 D、消毒药 3、不能作为注射液使用的药物是(D)。 A、灭菌澄明液 B、灭菌浑浊液 C、注射粉针剂 D、软膏剂 4、属于假兽药的是(C)。 A、不标明有效成分 B、超过有效期 C、变质药物 D、更改生产批次的药物 5、药物经吸收进入血液循环后产生的作用称为(A)。 A、全身作用 B、局部作用 C、直接作用 `D间接作用 6、洋地黄引起的尿量增多是(D)。 A、全身作用 B、局部作用 C、直接作用 D间接作用 7、药物转化主要在(C)进行。 A、肾脏 B、心脏 C、肝脏 D、脾脏 8、药物的主要排泄途径是(B) A、胆汁排泄 B、肾脏排泄 C、皮肤排泄 D、乳腺排泄 9、杀菌力最强的乙醇是(C)。 A、100% B、80% C、70% D、60% 10、作为眼科消毒药物的是(B)。 A、氢氧化钠 B、硼酸 C、过氧化氢 D、鱼石脂 11、动物出现病毒感染时,应使用抗病毒药物,以下哪种药物无抗病毒作用?(A) A、呋
动物实验给药剂量换算 医学 2009-02-19 14:24 阅读672 评论2 字号:大中小 关于不同实验动物之间或者实验动物与人之间的剂量如何作“等效”换算的 问题。分以下几点来探讨这个问题。 第一、等效剂量系数折算法换算 第二、体表面积法换算 第三、系数折算法与体表面积法的比较 第四、系数折算法的相对误差 第五、小孩与成人的剂量换算 第六、少常用实验动物剂量间的换算 第七、不同给药途径间的剂量换算 第八、LD50与药效学剂量间的换算 我们在实验中估算一种药物或化合物的使用剂量的时候,差不多是来源于 两条途径: 一是查文献,参考别人使用的剂量。有时有现成的,可直接用。有时没有我们所用动物的剂量,但有其它实验动物的。也有的是有临床用量的,但没有实验动物的。这样,我们就得进行换算。这是我们今天要谈的这种方法。 另一种方法就是根据自己或文献上有关急性毒性的数据来进行估算,以期采用合适的剂量。一般参考数据是LD50。至于该选择LD50的多少分之一来作为参考剂量,众说纷纭。这个我们再另题讨论。 下面我来说一说用第一种方法进行如何换算。
目前我们大多数人用的方法,是参考徐叔云教授主编的《药理实验方法学》。在其附录中有一个表,列出了人和动物间按体表面积折算的等效剂量比值。这个表,几乎被药理专业的人们奉为经典,一直在科研中沿用。 表如下所示: screen.width-333)this.width=screen.width-333" align=absMiddle border=0> 请注意最后一行,这个就是我们通常用到的。把人的临床剂量转换为实验 动物的剂量。 试着换算一个。 如:人的临床剂量为X mg/kg ,换算成大鼠的剂量: 大鼠的剂量=X mg/kg×70kg×0.018/200g=X mg/kg×70kg×0.018/0.2kg =6.3 X mg/kg. 这也就是说,按单位体重的剂量来算,大鼠的等效剂量相当于人的6.3倍。 在这里,我们要看到每种动物的体重(包括人),在上表中以蓝色显示的。还要注意到折算系数,也就是表中以红色所示的。将人的剂量转换成哪种动物的,就在相应的动物那一列下找到与人的相交的地方的折算系数,将剂量乘以折算系数,再乘上人的体重与那种动物体重的比值。注意体重的单位要化成一致。这个折算系数是以上表中蓝色所示的标准体重计算得来的。 依此类推,我们可以算出小鼠、豚鼠等其它动物剂量与人的比值。 小鼠的剂量=X mg/kg×70kg×0.0026/20g=X mg/kg×70kg×0.0026/0.02 kg=9.1 X mg/kg. 豚鼠的剂量=X mg/kg×70kg×0.031/400g=X mg/kg×70kg×0.031/0.4kg =5.42 X mg/kg. 兔的剂量=X mg/kg×70kg×0.07/1.5kg =3.27 X mg/kg.
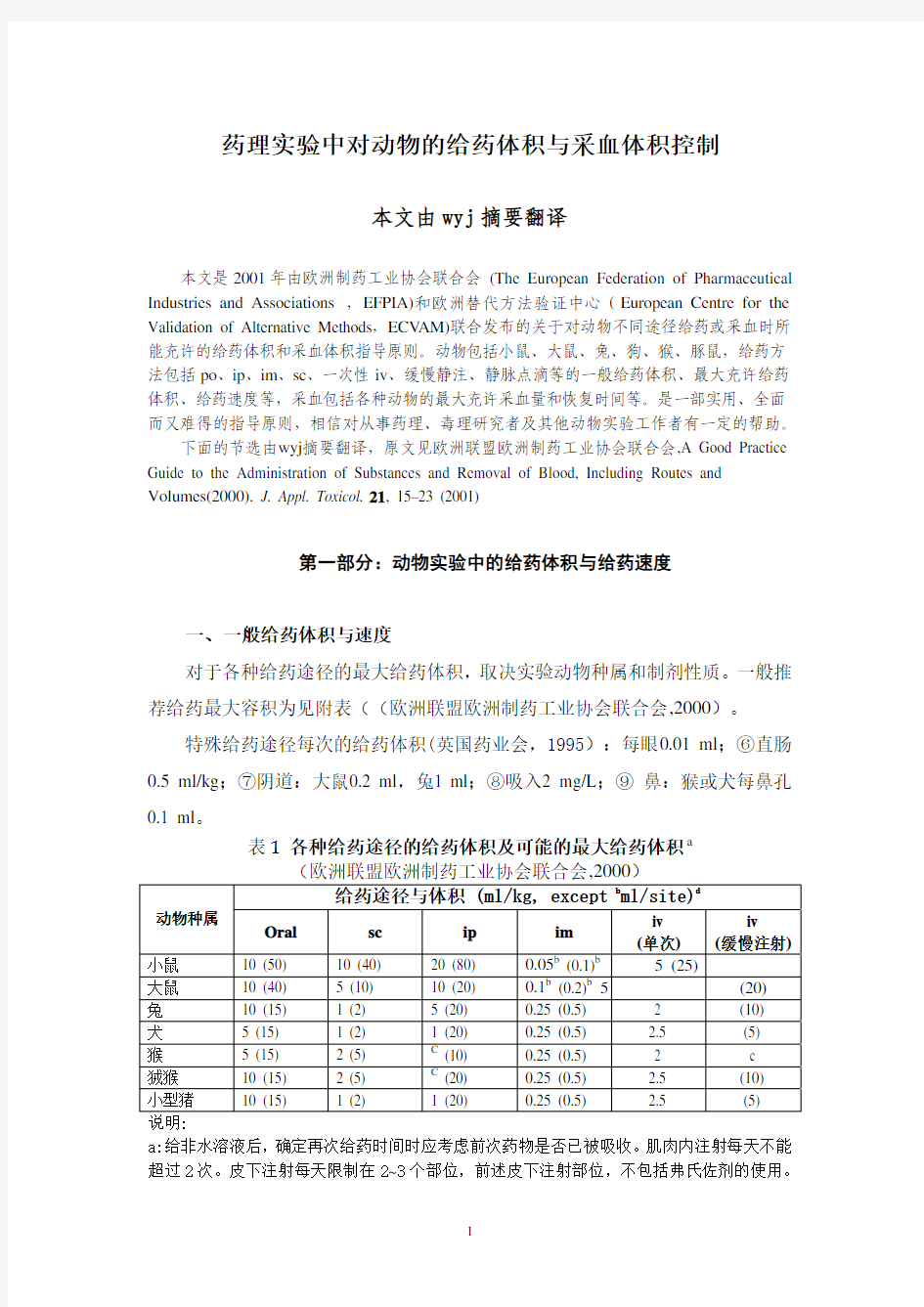
药理实验中对动物的给药体积与采血体积控制 本文由wyj摘要翻译 本文是2001年由欧洲制药工业协会联合会 (The European Federation of Pharmaceutical Industries and Associations ,EFPIA)和欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods,ECV AM)联合发布的关于对动物不同途径给药或采血时所能充许的给药体积和采血体积指导原则。动物包括小鼠、大鼠、兔、狗、猴、豚鼠,给药方法包括po、ip、im、sc、一次性iv、缓慢静注、静脉点滴等的一般给药体积、最大充许给药体积、给药速度等,采血包括各种动物的最大充许采血量和恢复时间等。是一部实用、全面而又难得的指导原则,相信对从事药理、毒理研究者及其他动物实验工作者有一定的帮助。 下面的节选由wyj摘要翻译,原文见欧洲联盟欧洲制药工业协会联合会,A Good Practice Guide to the Administration of Substances and Removal of Blood, Including Routes and Volumes(2000). J. Appl. Toxicol. 21, 15–23 (2001) 第一部分:动物实验中的给药体积与给药速度 一、一般给药体积与速度 对于各种给药途径的最大给药体积,取决实验动物种属和制剂性质。一般推荐给药最大容积为见附表((欧洲联盟欧洲制药工业协会联合会,2000)。 特殊给药途径每次的给药体积(英国药业会,1995):每眼0.01 ml;⑥直肠0.5 ml/kg;⑦阴道:大鼠0.2 ml,兔1 ml;⑧吸入2 mg/L;⑨鼻:猴或犬每鼻孔0.1 ml。 表1各种给药途径的给药体积及可能的最大给药体积a (欧洲联盟欧洲制药工业协会联合会,2000) 给药途径与体积 (ml/kg, except b ml/site)d 动物种属 Oral sc ip im iv (单次) iv (缓慢注射) 小鼠10 (50) 10 (40) 20 (80) 0.05b (0.1)b 5 (25) 大鼠10 (40) 5 (10) 10 (20) 0.1b (0.2)b 5 (20) 兔10 (15) 1 (2) 5 (20) 0.25 (0.5) 2 (10) 犬 5 (15) 1 (2) 1 (20) 0.25 (0.5) 2.5 (5) 猴 5 (15) 2 (5) C (10) 0.25 (0.5) 2 c 狨猴10 (15) 2 (5) C (20) 0.25 (0.5) 2.5 (10) 小型猪10 (15) 1 (2) 1 (20) 0.25 (0.5) 2.5 (5) 说明: a:给非水溶液后,确定再次给药时间时应考虑前次药物是否已被吸收。肌肉内注射每天不能 超过2次。皮下注射每天限制在2~3个部位,前述皮下注射部位,不包括弗氏佐剂的使用。
动物实验基本操作一(固定、性别判定、标识) 【实验目的】在做动物试验时,为确保给药、实验顺利进行,防止被动物咬伤、准确辨别动物性别、准确标识动物,要学会用正确方法捉拿实验动物、掌握辨别动物性别的方法以及掌握标识动物的方法。 【实验对象】SD大鼠,KM小鼠,雌雄各半,体重180-250g。 【实验器材和药品】 器材:鼠笼、大小鼠固定器、方木板、美式图钉、细绳、防护手套 药品:苦味酸80%~90%酒精饱和溶液、20%乌拉坦 【实验步骤】 一、小鼠的捉拿 1、徒手固定:用右手提起尾巴中部,放在鼠笼盖或其他粗糙面上。向后上方轻拉,此时,小鼠前肢紧紧抓住粗糙表面。左手拇指和食指迅速捏住小鼠颈背部皮肤,再置小鼠于左手心,并以左手掌心和中指夹住小鼠背部皮肤,无名指压住小鼠尾根部,将其固定于手中。右手可行注射或其它操作。 2、固定器固定:尾静脉注射或给药时,将小鼠放进固定器中或者大小和重量适当的容器(如烧杯),只露出尾巴,该类容器能够压住尾部,避免其活动。勿固定过紧造成窒息死亡。进行腹腔手术或心脏采血时,先准备一个15-20cm的方木板,边缘钉入五颗钉子。将小鼠四肢分别用20-30cm的线绳捆绑,线的另一头分别绑在方木板的钉子上,并且在头部上颚切齿牵引一根线绳,也固定在钉子上,达到完全固定。 二、大鼠的捉拿
4-5周内的大鼠,方法同小鼠。周龄较大的,则:1、首先戴好防护手套。2、用右手拇指和食指抓住大鼠尾巴中部将大鼠提起,放在大鼠饲养盒的面罩上。3、左手顺势按、卡在大鼠躯干背部,稍加压力向头颈部滑行。4、以左手拇指和食指捏住大鼠两耳后部的头颈皮肤,其余三指和手掌握住大鼠背部皮肤,完成抓取保定。三、性别判定 小鼠、大鼠性别判定 (1)幼鼠外生殖器与肛门间隔短的是♀,外生殖器与肛门间隔长的是♂。 (2)成年动物可直接肉眼辨认,雄性有膨起的阴囊和阴茎,雌性动物有阴道口。四、动物的标记 小鼠的短期标记法:苦味酸80%~90%酒精饱和溶液(黄色),标出属于自己的编号【注意事项】 1、实验人员要有精神准备:掌握方法,胆大心细,做好防护。 2、动物兴奋的时候不要抓取,待其安静下来。 3、根据受试动物的给药部位或采血方法的不同,事先选择徒手固定还是固定器固定。 4、固定时把握好力度,过分用力会使小鼠颈椎脱臼或窒息死亡,若用力过轻头部能反转过来咬伤实验者的手。 【思考题】 1.在固定实验动物时如何才能快、准、稳?
动物实验给药剂量换算 关于不同实验动物之间或者实验动物与人之间的剂量如何作“等效”换算的问题。分以下几点来探讨这个问题。 第一、等效剂量系数折算法换算 第二、体表面积法换算 第三、系数折算法与体表面积法的比较 第四、系数折算法的相对误差 第五、小孩与成人的剂量换算 第六、少常用实验动物剂量间的换算 第七、不同给药途径间的剂量换算 第八、LD50与药效学剂量间的换算 我们在实验中估算一种药物或化合物的使用剂量的时候,差不多是来源于两条途径:一是查文献,参考别人使用的剂量。有时有现成的,可直接用。有时没有我们所用动物的剂量,但有其它实验动物的。也有的是有临床用量的,但没有实验动物的。这样,我们就得进行换算。这是我们今天要谈的这种方法。 另一种方法就是根据自己或文献上有关急性毒性的数据来进行估算,以期采用合适的剂量。一般参考数据是LD50。至于该选择LD50的多少分之一来作为参考剂量,众说纷纭。这个我们再另题讨论。 下面我来说一说用第一种方法进行如何换算。 目前我们大多数人用的方法,是参考徐叔云教授主编的《药理实验方法学》。在其附录中有一个表,列出了人和动物间按体表面积折算的等效剂量比值。这个表,几乎被药理专业的人们奉为经典,一直在科研中沿用。 表如下所示: 请注意最后一行,这个就是我们通常用到的。把人的临床剂量转换为实验动物的剂量。 试着换算一个。 如:人的临床剂量为X mg/kg ,换算成大鼠的剂量: 大鼠的剂量=X mg/kg×70kg×0.018/200g=X mg/kg×70kg×0.018/0.2kg=6.3 X mg/kg. 这也就是说,按单位体重的剂量来算,大鼠的等效剂量相当于人的6.3倍。
动物实验基础知识系列之一:剂量换算 关于剂量换算的问题 最近不少战友询问关于不同实验动物之间或者实验动物与人之间的剂量如何作“等效”换算的问题。 这个问题对学习药理的战友来讲,可能是非常熟悉了。但对于非药理专业但又需做药理实验的战友来说,仍然是令人困扰的问题。 下面我们分以下几点来探讨这个问题。 第一、等效剂量系数折算法换算 第二、体表面积法换算 第三、系数折算法与体表面积法的比较 第四、系数折算法的相对误差 第五、小孩与成人的剂量换算 第六、少常用实验动物剂量间的换算 第七、不同给药途径间的剂量换算 第八、LD50与药效学剂量间的换算 下面我来简单说一下这个问题。 我们在实验中估算一种药物或化合物的使用剂量的时候,差不多是来源于两条途径: 一是查文献,参考别人使用的剂量。有时有现成的,可直接用。有
时没有我们所用动物的剂量,但有其它实验动物的。也有的是有临床用量的,但没有实验动物的。这样,我们就得进行换算。这是我们今天要谈的这种方法。 另一种方法就是根据自己或文献上有关急性毒性的数据来进行估算,以期采用合适的剂量。一般参考数据是LD50。至于该选择LD50的多少分之一来作为参考剂量,众说纷纭。这个我们再另题讨论。 下面我来说一说用第一种方法进行如何换算。 目前我们大多数人用的方法,是参考徐叔云教授主编的《药理实验方法学》。在其附录中有一个表,列出了人和动物间按体表面积折算的等效剂量比值。这个表,几乎被药理专业的人们奉为经典,一直在科研中沿用。 表如下所示: 请注意最后一行,这个就是我们通常用到的。把人的临床剂量转换为实验动物的剂量。
试着换算一个。 如:人的临床剂量为X mg/kg , 换算成大鼠的剂量: 大鼠的剂量=X mg/kg×70kg×0.018/200g=X mg/kg×70kg×0.018/0.2kg=6.3 X mg/kg. 这也就是说,按单位体重的剂量来算,大鼠的等效剂量相当于人的6.3倍。 在这里,我们要看到每种动物的体重(包括人),在上表中以蓝色显示的。还要注意到折算系数,也就是表中以红色所示的。将人的剂量转换成哪种动物的,就在相应的动物那一列下找到与人的相交的地方的折算系数,将剂量乘以折算系数,再乘上人的体重与那种动物体重的比值。注意体重的单位要化成一致。这个折算系数是以上表中蓝色所示的标准体重计算得来的。 依此类推,我们可以算出小鼠、豚鼠等其它动物剂量与人的比值。小鼠的剂量=X mg/kg×70kg×0.0026/20g=X mg/kg×70kg×0.0026/0.02kg=9.1X mg/kg. 豚鼠的剂量=X mg/kg×70kg×0.031/400g=X mg/kg×70kg×0.031/0.4kg=5.42 X mg/kg. 兔的剂量=X mg/kg×70kg×0.07/1.5kg =3.27 X mg/kg. 猫的剂量=X mg/kg×70kg×0.078/2.0kg=2.73 X mg/kg. 猴的剂量=X mg/kg×70kg×0.06/4.0kg=1.05 X mg/kg. 狗的剂量=X mg/kg×70kg×0.32/12kg =1.87 X mg/kg.