
管理体系内审检查表
管理体系内审检查表
管理体系内审检查表
管理体系内审检查表
管理体系内审检查表
管理体系内审检查表
管理体系内审检查表
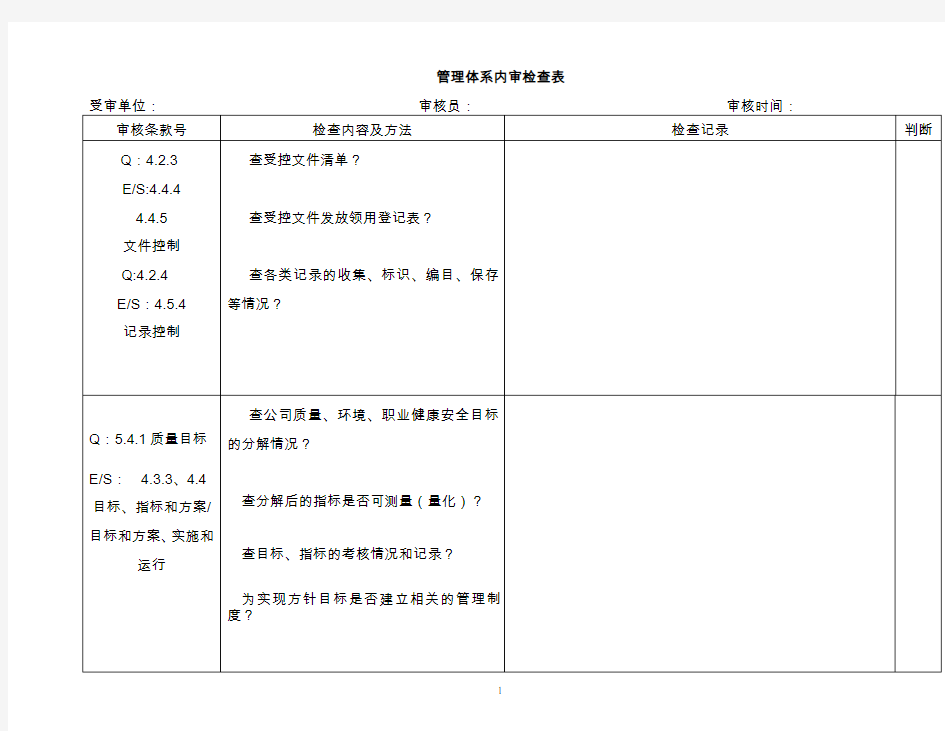
管理体系内审检查表 (××××年第××次) ××××××××××公司 内审员:被审核部门负责人:审核日期:××××年××月××日
条款号评审内容检查对象责任部门 检查结果 备注符合不符合不适用 4.1.1 1、检验检测机构应是依法成立并能够承担相应 法律责任的法人或者其他组织。 企业法人或其他组织是否工商注册,工商营业执 照、机构代码证(范围应有检验检测或技术服务内 容)。 当机构法人不是最高管理者时,应对最高管理者 授权并有授权文件,同时机构法人承诺承担法律责任。 2、检验检测机构或者其所在的组织应有明确的 法律地位,对其出具的检验检测数据、结果负 责,并承担相应法律责任。 体系文件中应规定“对其出具的检验检测数据、 结果负责,并承担相应法律责任”。 3、不具备独立法人资格的检验检测机构应经所 在法人单位授权。 独立法人单位是否有法人授权文件,并愿为机构 承担起相应的法律责任。 4.1.2 检验检测机构应明确其组织结构及管理、技术 运作和支持服务之间的关系。检验检测机构应 配备检验检测活动所需的人员、设施、设备、 系统及支持服务。 机构应明确其内部组织构成,并通过组织结构图 来表述。 明确管理、技术运作、支持服务的职责及组织部 门。 4.1.3 检验检测机构及其人员从事检验检测活动,应 遵守国家相关法律法规的规定,遵循客观独立、 公平公正、诚实信用原则,恪守职业道德,承 担社会责任。 有公正性声明或承诺及相关的程序或制度,无 违规现象(含信用等级等行业规定)。 4.1.4 1、检验检测机构应建立和保持维护其公正和诚 信的程序。 建立保证检验检测公正和诚信的程序,以识别影 响公正和诚信的因素,并消除或最大化减少该因素对 公正和诚信的影响。 2、检验检测机构及其人员应不受来自内外部 的、不正当的商业、财务和其他方面的压力和 影响,确保检验检测数据、结果的真实、客观、 准确和可追溯。 有公正性和诚信的承诺(不受行政和商业的、相 关利益的干预)。 3、检验检测机构应建立识别出现公正性风险的 长效机制。如识别出公正性风险,检验检测机 构应能证明消除或减少该风险。 建立识别出现公正性风险的程序。当识别出公正 性风险时,能消除或减少该风险。
过程特性:是否是否对下述有关支持性过程的问题加以澄清?是否 是否已确定过程的所有人?X 做什么?X 是否已对过程加以定义?X 谁做?X 过程是否已文件化?X 用哪些指标衡量?X 是否已对过程的接口加以定义?X 在哪里做?X 过程是否监控?X 记录是否保存?X 2)与顾客相关的主要过程和支持性程3)输入 /输出4)绩效指标 5)相关质量 文件 6) ISO9001:20 15 相关的条 款 7)审核记录8)结果 C1订单评审输入: 1)顾客交付订单 2)顾客规范要求 3)法律法规要求 4)库存状况 5)生产能力 6)供方信息。 输出: 1)合同评审记录 2)生产计划 3)交付计划 4)采购需求 合同评审率 《顾客沟通控 制程序》 《产品有关要 求评审控制程 序》 8.2 特殊订单按照新产品开发流程,评审,打样等保 留评审记录。 经查客户的订单,常规订单公司由市场部人员签 字确认或者回复邮件告知客户,可达成。 符合
过程特性:是否是否对下述有关支持性过程的问题加以澄清?是否 是否已确定过程的所有人?X 做什么?X 是否已对过程加以定义?X 谁做?X 过程是否已文件化?X 用哪些指标衡量?X 是否已对过程的接口加以定义?X 在哪里做?X 过程是否监控?X 记录是否保存?X 2)与顾客相关的主要过程和支持性程3)输入 /输出4)绩效指标 5)相关质量 文件 6) ISO9001:20 15 相关的条 款 7)审核记录8)结果 COP2过程开发过程输入: 1)新产品开发协议 2)产品图纸和技术规范 3)市场调查结果 4)法律法规要求 5)行业信息 6)顾客开发周期 输出: 1)图纸 2)作业指导书 3)检验指导书 4)BOM清单 送样一次合格率 《产品质量先 期策划控制程 序》 8.1/8.3/8.5.6 过程指标一样送样合格率达到目标值, 符合新产品开发按照,客户的技术要求进行策划 过程设计开发,输出设备台账、工装台账、加工 指导书、检验指导书、包装指导书等 符合
XXXX医疗器械有限公司 内部审核检查表 FX/ JL8.2.2-03 №:2审核日期2017.04.04 审核人员XXXX、XXXX、XXXX 受审部门技术部受审部门负责人XXXX 序号涉及条款检查内容检查方法检查结果 1 1.1.1应当建立与医疗器械生产相适应的管理机 构,具备组织机构图。 查看提供的质量手册,是否包括企业的组织 机构图,是否明确各部门的相互关系。 是。查《质量手册》中的FX/SC 2.0《组织机 构图》和FX/SC 3.0《职责分配表》。符合要 求 2 *1.1.2应当明确各部门的职责和权限,明确质量管 理职能。 查看企业的质量手册,程序文件或相关文 件,是否对各部门的职责权限作出了规定; 质量管理部门应当能独立行使职能, 查看质 量管理部门的文件,是否明确规定对产品质 量的相关事宜负有决策的权利。 是。查《质量手册》和《程序文件》FX/CX 5.5 《职责、权限与内部沟通程序》。符合要求 3 1.4.1 技术、生产、质量管理部门负责人应当熟悉 医疗器械法律法规,具有质量管理的实践经 验,应当有能力对生产管理和质量管理中实 际问题作出正确判断和处理。 查看相关部门负责人的任职资格要求,是否 对专业知识、工作技能、工作经历作出了规 定;查看考核评价记录,现场询问,确定是 否符合要求。 是。查技术部门负责人XXXX、生产部门负 责人XXXX、质管部门负责人XXXX,有相 应资质;2016年度岗位人员考核、评价和再 评价确认满足要求。符合要求 4 1.5.1应当配备与生产产品相适应的专业技术人 员、管理人员和操作人员。 查看相关人员的资格要求。是。查人员花名册。符合要求 5 2.22.2 与产品使用表面直接接触的气体,其对产品 的影响程度应当进行验证和控制,以适应所 生产产品的要求。 查看对与产品使用表面直接接触的气体对 产品所造成的影响进行评价和验证的记录, 是否根据评价和验证的结果规定了控制措 施并实施。 是。查看工艺用气验证资料。符合要求 6 3.2.1 生产设备的设计、选型、安装、维修和维护 应当符合预定用途,便于操作、清洁和维护。 查看生产设备验证记录,确认是否满足预定 要求。现场查看生产设备是否便于操作、清 洁和维护。 是。查看2016年度验证资料。符合要求 7 3.2.3 应当建立生产设备使用、清洁、维护和维修 的操作规程,并保存相应的设备操作记录。 是。抽查设备操作规程《滴斗自动组装机》。 符合要求
范文范例指导学习 审核部门:审核日期:审核员:2018 新版质量、环境、职业健康三体系内审检查表 9001 条款14001 条 18001 条款及 检查记录款及要检查内容 及要求要求 求 4.1 理解 4.1 理解 4.1 总要求Q:1、公司是否有企业简介,并能充分反应公司内部情况,组织及其组织及如:背景、经营范围、财务表现、规模及设施、人力资源 环境其所处能力、技术优势、知识等(内部因素)及涉及法律法规和的环境专利技术、市场占有率、主要合作伙伴及同行的影响、物 理边界、信息渠道(外部因素)?在工作例会或管理评审 会上,公司是否对公司的内部和外部因素的相关信息进行 监视、评价和更新? E:企业有无对这些内外部因素的相关信息进行监视和评 审? E/S :有无文审组织的相关文件?行业地方的新的法规要 求? E:组织的内部外部环境状况?有哪些需要应对和管理的 风险和机遇?相关的会议纪要? 4.2 理解 4.2 理解Q:公司是否收集相关方需求及期望( 上级及主要供方及客相关方的相关方户) 包括: 需求和期的需求? 顾客对事物的要求,如符合性,价格,安全性 望和期望? 已与顾客或外部供应商达成的合同 ? 行业规范及标准 ? 和社区团体或非政府组织的协议 ? 法规法案 ? 备忘录 ? 许可,执照或其他授权形式 ? 监管机构发布的制度 ? 条约,公约及草案 ? 和公共机构及顾客的协议 ? 组织要求 ? 自愿原则或行为规范 ? 自愿标示或环境承诺 ? 组织契约合同的承担义务 E:与 QEOH有关的相关方是谁? 这些相关方的有关需求和期望有哪些? 这些需求和期望中哪些是合规义务?是否具备相关的知 识严格执行? 有无对这些相关方及其要求的相关信息进行监视和评 审?
2018年*** 月内部审核计划 受控编号:****************** 共页第页
内部审核实施计划表 受控编号:********* 共2页第1页 ********质量检测有限公司 *****(****)第****号 实验室各科室: 根据《检验检测机构资质认定能力评价检验检测机构通用要求》(RBT 214-2017)和本实验室质量体系计划的安排,拟于2018年***月***日至***日进行2018年度****月份内部质量体系审核。现将内审实施计划发给你们,请按照计划表内容结合质量手册、程序文件、记录、报告等体系资料做好准备,迎接内审。 审核目的:审核2018年本公司的检验检测活动是否符合本公司质量管理体系的要求,确保质量体系持续、有效的运行,并为质量体系的改进提供依据。 审核要求:采用集中式审核,要求实事求是、不徇私舞弊、做到严格、公正、客观。 审核范围:检验检测机构资质认定评审准则各要素涉及的实验室各部门。 审核依据:《检验检测机构资质认定能力评价检验检测机构通用要求》(RBT 214-2017),质量体系文件【例如:《质量手册》、《程序文件》】,相关法律、法规和试验标准等。 审核时间:2018年****月****日至***日 审核组:组长:**** 审核组成员:*****(技术负责人、*****)、*****(检测一室主任、内审员、监督员)、*****(检测二室主任、内审员、监督员)、****(业务室主任、内审员)、******(内审员)。
首、末次会议参加人员:质量负责人、技术负责人、各科室负责人、办公室成员、设备管理员、内审组成员。
Notes on completion of the table: Field 1) a. col.2) to col. 6): are completed by the client prior to the audit and submitted to the certification body with the …Readiness Evaluation work sheet“. For every CRP (customer -related process) identified a work sheet has to be created. Field 1) should also include organisational or physical location of the CRP and inform of possible contact persons in the audit. Column 7) and column 8) are filled in by the auditor Column 8) NR = needs research, OFI = opportunity for improvement; nc = minor nonconformity; NC = major nonconformity
Notes on completion of the table: Field 1) a. col.2) to col. 6): are completed by the client prior to the audit and submitted to the certification body with the …Readiness Evaluation work sheet“. For every CRP (customer-related process) identified a work sheet has to be created. Field 1) should also include organisational or physical location of the CRP and inform of possible contact persons in the audit. Column 7) and column 8) are filled in by the auditor Column 8) NR = needs research, OFI = opportunity for improvement; nc = minor nonconformity; NC = major nonconformity
No. 审核地点:审核时间:被审核岗位:内审员:被审核人员确认: 审核条款/项目审核内容符合一般不 符合 严重不 符合 审核结果记录 CNAS-CL01:2018 4通用要求 4.1公正性4.1.1 测试中心是否公正的实施实验室(检测)活动,并从组织结构和管理上保证公正性 CNAS-CL01:2018 4.1.2 测试中心是否做出了公正性的承诺,测试中心人员和客户是否能够方便的获取公正性承诺 CNAS-CL01:2018 4.1.3 测试中心是否能对实验室活动的公正性负责, 测试中心是否有措施确保实验室活动的公正性,避免来自内外部的不正当的商业、财务和其他方面的压力和影响对公正性造成的损害 CNAS-CL01:2018 4.1.4 测试中心是否持续的识别影响公正性的风险,是否采取措施应对实验室活动、实验室各种关系或实验室人员关系而引发的风险 CNAS-CL01:2018 4.1.5 测试中心是否可以证明采用了何种方式消除或最大程度的降低实验室的公正性风险 CNAS-CL01:2018 4.2保密性 4.2.1 测试中心是否通过作出具有法律效力的承诺,对在实验室活动中获得或产生的所有信息承担管理责任?是否将其准备公开的信息事先通知客户?是否对除客户公开或与客户有约定的信息以外的所有信息视为专属信息并予以保密? CNAS-CL01:2018 4.2.2 测试中心是否对法律禁止外的根据法律要求或合同授权透露保密信息时,将所提供的信息通知到相关客户或个人? CNAS-CL01:2018 4.2.3 测试中心是否采取相应的保密措施确保从客户以外获知的客户信息应在客户和实验室间保密?是否采取措施为信息提供方保密,且不告知客户,除非信息提供方同意? CNAS-CL01:2018 4.2.4 测试中心是否对法律要求除外的包括但不限于委员会、合同方、外部机构人员或代表实验室的个人等人员对在实施实验室活动中获得或产生的所有信息保密?