
酸碱盐的性质及用途专题测试
一.选择题(每小题只有一个选项符合题意。请将正确选项的序号填入下表相应空格内。)1.下列物质的俗称与化学式不相符合的是
A.干冰CO2 B.生石灰Ca(OH)2 C.烧碱NaOH D.苏打Na2CO3
2.下列溶液暴露在空气中,因发生化学变化而使溶液质量增大的是
A. 浓氢氧化钠溶液
B. 浓盐酸
C. 浓硫酸
D.饱和食盐水
3.下列化肥中,能促使植物根系发达,耐寒耐旱的是
A.尿素CO(NH2)2 B.氯化钾KCl
C.磷酸二氢钙Ca(H2PO4)2 D.硫酸铵(NH4)2SO4
4.小烧杯中盛有含紫色石蕊的氢氧化钠溶液.逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是
A.紫色——红色——蓝色 B.蓝色——紫色——红色
C.蓝色——红色——紫色 D.紫色——蓝色——红色
5.盐在日常生活中是用途非常广泛的一类物质。下列说法中不正确的是
A.添加大量的亚硝酸钠来保鲜食品 B.“请往菜里加点盐”中的“盐”特指食盐C.KNO3是一种复合肥 D.用纯碱可除去面粉发酵生成的酸
6.盐酸、稀硫酸在水溶液中都能产生H+,故有许多共同的性质。下列有关叙述正确的是
A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
B.稀盐酸和稀硫酸都可用于除铁锈
C.浓盐酸、浓硫酸都可用来干燥氧气
D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀
7.氯气(Cl2)能与水发生如下反应:Cl2+H2O=HCl+HClO,其中HClO是一种酸。将Cl2通入过量氢氧化钠溶液中,反应后的生成物有
A.NaCl、H2O B.NaClO、H2O C.NaCl、NaClO D.NaCl、NaClO、H2O
8. 物质性质决定它的用途,还决定了它的保存方法。固体NaOH具有以下性质:
①白色片状固体②有腐蚀性③易吸收水分而潮解④易溶于水,溶解放热⑤能与
空气中的二氧化碳反应。实验室中必须将它密封保存的主要原因是:
A.①②B.①②③C.②③④D.③⑤
9.家庭生活中一些常见物质的pH如下:
当我们被蚊虫叮咬后,蚊虫能在人的皮肤内分泌蚁酸(具有酸的性质),从而使皮肤肿痛。要减轻痛痒,应在叮咬处涂抹下列物质中的
A.食醋 B.牛奶 C.食盐水 D.牙膏或肥皂水
10.为证明木炭粉中是否混有氧化铜,某兴趣小组设计了以下四种方案,其中可行的是
A.在样品中加氢氧化钠溶液,看粉末是否会减少
B.在样品中加稀硫酸,充分反应后过滤,看滤液是否呈蓝色
C.在空气中加热样品,恢复至原温度后,称量固体质量是否减少
D.在样品中加水,看是否有蓝色沉淀
11.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液 C.稀盐酸 D.NaNO3溶液
12.根据复分解反应发生的条件,判断下列各组物质不能
..发生反应的一组是
A.Na2CO3溶液和CaCl2溶液B.NaOH溶液和盐酸溶液
C.CuSO4 溶液和BaCl2溶液D.K2SO4溶液和NaCl溶液
13.小明设计了趣味实验装置(见右图),其气密性良好。若要使B
中尖嘴导管有“喷泉”产生,则A中加入的固体和液体可能是
A.氯化钠和水B.硝酸铵和水
C.二氧化锰和过氧化氢溶液D.铜和稀硫酸
14.中和反应在日常生产和生活中有广泛的用途。下列做法应用了中和反应的是
A.用生石灰作食品干燥剂B.用熟石灰与硫酸铜溶液来配制农药波尔多液C.用含Al(OH)3的药物治疗胃酸过多D.用碳酸氢钠和柠檬酸等原料自制汽水
15.下列说法错误的是
A. 在硫酸铵中加入熟石灰研磨能闻到刺激性氨味
B. 含Cl-的盐溶液能与AgNO3溶液反应,产生白色沉淀
C. 含SO42-的盐溶液能与Ba(NO3)2溶液反应,产生白色沉淀
D. 某盐能与盐酸反应放出使澄清石灰水变浑浊的气体,该盐一定是含有CO32-的盐
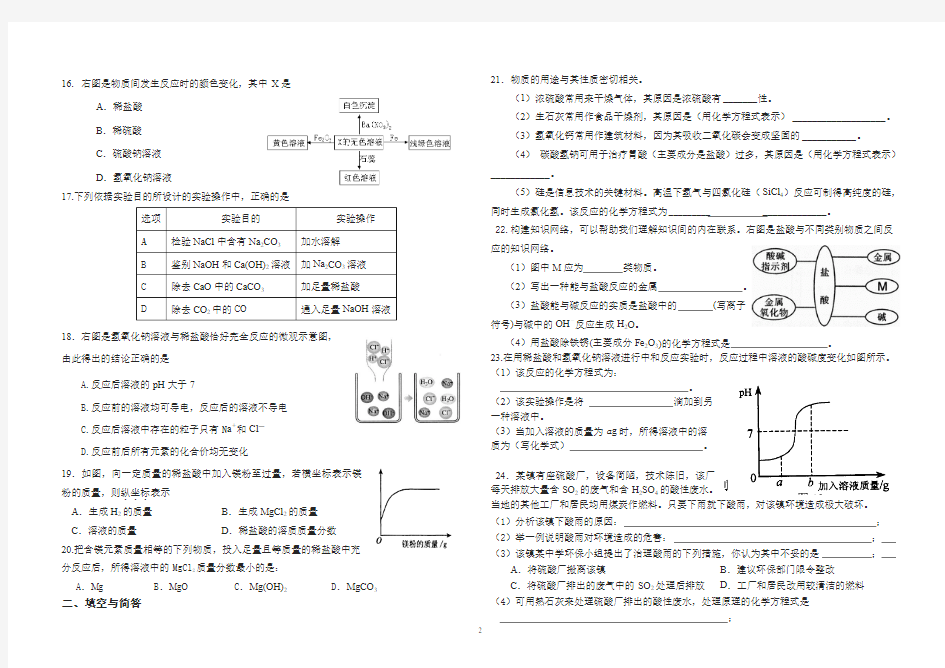
16. 右图是物质间发生反应时的颜色变化,其中X 是
A .稀盐酸
B .稀硫酸
C .硫酸钠溶液
D .氢氧化钠溶液
17.下列依据实验目的所设计的实验操作中,正确的是
18.右图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论正确的是
A.反应后溶液的pH 大于7
B.反应前的溶液均可导电,反应后的溶液不导电
C.反应后溶液中存在的粒子只有N a +
和Cl ―
D.反应前后所有元素的化合价均无变化
19.如图,向一定质量的稀盐酸中加入镁粉至过量,若横坐标表示镁粉的质量,则纵坐标...
表示 A .生成H 2的质量 B .生成MgCl 2的质量 C .溶液的质量 D .稀盐酸的溶质质量分数 20.把含镁元素质量相等的下列物质,投入足量且等质量的稀盐酸中充分反应后,所得溶液中的MgCl 2质量分数最小的是:
A .Mg
B .MgO
C .Mg(OH)2
D .MgCO 3
二、填空与简答
21.物质的用途与其性质密切相关。
(1)浓硫酸常用来干燥气体,其原因是浓硫酸有_______性。
(2)生石灰常用作食品干燥剂,其原因是(用化学方程式表示)___________________。 (3)氢氧化钙常用作建筑材料,因为其吸收二氧化碳会变成坚固的___________。 (4) 碳酸氢钠可用于治疗胃酸(主要成分是盐酸)过多,其原因是(用化学方程式表示)____________。
(5)硅是信息技术的关键材料。高温下氢气与四氯化硅(SiCl 4)反应可制得高纯度的硅,
同时生成氯化氢。该反应的化学方程式为_________ _____________。
22.构建知识网络,可以帮助我们理解知识间的内在联系。右图是盐酸与不同类别物质之间反
应的知识网络。
(1)图中M 应为 类物质。
(2)写出一种能与盐酸反应的金属 。 (3)盐酸能与碱反应的实质是盐酸中的 (写离子 符号)与碱中的OH -
反应生成H 2O 。
(4)用盐酸除铁锈(主要成分Fe 2O 3)的化学方程式是 。
23.在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图所示。 (1)该反应的化学方程式为:
。 (2)该实验操作是将 滴加到另 一种溶液中。
(3)当加入溶液的质量为a g 时,所得溶液中的溶
质为(写化学式) 。
24.某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO 2的废气和含H 2SO 4的酸性废水。
当地的其他工厂和居民均用煤炭作燃料。只要下雨就下酸雨,对该镇环境造成极大破坏。 (1)分析该镇下酸雨的原因: ; (2)举一例说明酸雨对环境造成的危害: ; (3)该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是 ;
A .将硫酸厂搬离该镇
B .建议环保部门限令整改
C .将硫酸厂排出的废气中的SO 2处理后排放
D .工厂和居民改用较清洁的燃料 (4)可用熟石灰来处理硫酸厂排出的酸性废水,处理原理的化学方程式是 ;
(5)浓硫酸弄到手上后应立即用水冲洗,然后涂上碳酸氢钠。若是稀硫酸弄到手上,(填“需要”或“不需要”)这样做,理由是。25.许多植物的果实和花瓣中含有色素。现提取几种植物的果实或花瓣的汁液,用稀酸、稀碱
(1)上述植物的汁液不能用来区别稀硫酸和氢氧化钠溶液的是、 (填植物的名称)。
(2)手工制作一朵纸玫瑰花,用pH=12的某种溶液浸泡后晾干,用所提取的玫瑰的汁液均匀的涂在纸玫瑰花上,纸花会变成色。
(3)与实验中常用的指示剂石蕊的变色原理相似的是。(填植物的名称)
26.有一白色粉末A,由Na2SO4、Na2CO3、BaCl2、NaCl中的三种物质混合而成。把A
加入到适量水中后,可得到白色沉淀B和溶液C,则:
(1)若B能全部溶于稀硝酸时,A的成分为;
(2)若B只能部分溶于稀硝酸时,A的成分为;
(3)若B不能溶于稀硝酸时,A的成分为;
(4)溶液C中一定存在的溶质是。
27.框图中B用于改良酸性土壤,J是最常见的金属,G是红棕色物质,E、F、I为无色气体,I 能使湿润的红色石蕊试纸变蓝,在溶液D中滴入AgNO3溶液产生难溶于硝酸的白色沉淀。
(1)写出反应②、④的化学方程式: ②,
④,
(2)指出反应①的基本反应类型。
(3)日常生活中为了阻止反应③发生,通常采取的措施是(写一条)。
(4)I气体的化学式为。
三、三、实验与探究
28.某化学兴趣小组进行了识别化肥的探究活动,他们对氯化铵、碳酸氢铵、硫酸钾、磷矿粉四种化肥的实验探究步骤如下:
(1)步骤一:取上述四种化肥各少量分别放入试管,观察,从外观上即可与其他化肥区别出来的是。
(2)步骤二:在装有另外三种化肥的试管中,分别加入少量稀盐酸,有气体产生的是
。
(3)步骤三:再分别取少量未区别出的另外两种化肥于研钵中,各加入少量熟石灰粉末,混合、研磨,有刺激性气味气体放出的是。因此可知,在使用该类化肥时,要避免与(填“酸”或“碱”)性物质混合施用,以防降低肥效。
有同学提出,氯化铵、硫酸钾也可用下列某种物质进行区分,你认为可行的是。
A.硝酸钡溶液
B. 氯化钠溶液
C.酚酞溶液
D. 稀盐酸
29.聪聪同学在实验室帮老师整理废弃药品时发现一瓶没有标签的绿色粉末,对其组成很好奇。征得老师允许后,设计了以下实验进行探究。
30.在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
⑴写出试管②中碳酸钠与氢氧化钙反应的化学方程式:
。
⑵实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是(写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由。
你认为小亮同学对实验结果判断是否正确?请说明理由。
【反思拓展】
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考;
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水
道?。
四、分析与计算
31.小苏打(主要成分为NaHCO3)中常含有少量氯化钠。化学兴趣小组的同学为了测定某品牌小苏打中NaHCO3的质量分数。进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀
(1)样品中的NaHCO3质量分数;
(2)所得溶液中NaCl的质量分数。
二、填空与简答
21.(1)吸水性(2)CaO+ H2O=Ca(OH)2 (3)CaCO3(4)NaHCO3+HCl== NaCl+H2O+CO2↑(5)SiCl4+H2=高=温Si+4HCl
22.(1)盐(2)Zn等(3)H+ (4)Fe2O3+6HCl=2FeCl3+3H2O
23.(1)NaOH+HCl=NaCl+ H2O (2)氢氧化钠(3)HCl和NaCl
24. (1)工厂排放的废气,煤炭的燃烧都会产生导致酸雨的气体(2)土壤酸性化等(3)
A (4)Ca(OH)2+ H2SO4= Na2SO4+2 H2O(5)需要,稀硫酸也有腐蚀性
25. (1)万寿菊、胡萝卜(2)绿色(3)牵牛花
26. (1)Na2CO3、BaCl2、NaCl (2)Na2CO3、Na2SO4、BaCl2
(3)Na2SO4、BaCl2、NaCl (4)NaCl
27.(1)② 2 H2O=通=电2H2↑+O2↑④CaCl2+ Ca(OH)2=2NaCl+ CaCO3↓(2)置换反应
(3)在铁器表面刷漆等(4)NH3
三、实验与探究
28.(1)磷矿粉(2)碳酸氢铵(3)氯化铵碱 A
29.①碳酸根②铜①Fe+H2SO4=Fe SO4+H2↑②Fe+ CuSO4=Fe SO4+Cu
30.(1)Na2CO3 + Ca(OH)2 === CaCO3↓ + 2NaOH
(2)[猜想]氢氧化钠和氢氧化钙
[讨论]小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存
[实验设计] 实验步骤:通入二氧化碳气体(或滴加可溶性碳酸盐溶液)
实验现象:试管中出现白色浑浊
[实验分析]不正确,因有氢氧化钠存在,滴入几滴稀盐酸量太少,不会立即出现气泡,但Na2CO3有可能存在 [反思拓展] ①反应物是否有剩余
②在废液中加酸至溶液的pH=7
四、分析与计算
31.解:根据质量守恒定律得CO2的质量==9+75.4-80==4.4 g
设NaHCO3质量为X,生成的NaCl的质量为Y。则:
NaHCO3+HCl== NaCl+H2O+CO2↑
84 58.5 44
X Y 4.4g
84:44== X:4.4g
X==84×4.4÷44 ==8.4 g
样品中NaHCO3的质量分数==8.4÷9×100%==93.3% 58.5:44== Y:4.4
Y==58.5×4.4÷44
==5.85g
样品中NaCl的质量==9g -8.4 g ==0.6 g
NaCl的总质量==0.6g+5.85g g==6.45g
NaCl溶液中NaCl的质量分数==6.45g÷80×100%==8.1%
初三化学酸碱盐测试题 一、选择题(以下各题只有一个符合要求的答案,每题1分,共15分) 1.为合理利用“垃圾’’资源,提倡垃圾分类回收,生活中废弃的铁锅、铝制易拉罐 以归为一类加以回收,它们属于 ( ) A.有机物 B.无机盐 C.金属或合金 D.难溶性碱 2.将铁钉置于下列四种环境中,容易生锈的是 ( ) A.置于潮湿的空气中 B.置于干操的空气中 C.浸没于煮沸的水中 D.浸没于油中 3.能一次性鉴别NaCl、BaCl2、Na2CO3,三种无色溶液的试剂是 ( ) A.稀硫酸 B.盐酸 C.石灰水 D.硝酸银溶液 4.—些食物的近似pH如下:葡萄3.5——4.5,苹果2.9,——3.3,牛奶6.3,——6.6,鸡蛋清7.6——8.0。下列说法错误的是() A.胃酸过多的人不应多食苹果 B.苹果汁的酸性比葡萄汁强 C.鸡蛋清是碱性食物 D.葡萄汁能使紫色石蕊试液变蓝 5.下列药品未经密封保存,敞口放置一段时间后,质量增加并发生化学反应的是() ①苛性②碳酸⑧浓盐酸④浓硫酸⑤熟石灰 A.①⑧ B.②④ C.①⑤ D.④⑤ 6.我国著名化学家侯德榜先生作出的重大贡献是() A.发明黑火药 B.创造湿法冶金 C. 改进纯碱的生产 D.发现了新元素 7.现有①Ba(NO3)2:溶液、②KCI溶液、⑧K2SO4溶液、④CuSO4溶液,不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是 ( ) A.①②⑧④ B.①④⑧② C.④⑧②① D.④①⑧② 8.向盛有Fe、Cu的烧杯中加入过量稀硫酸,所得溶液中的溶质有( ) A.1种 B.2种 C 3种 D 4种 9.CuCI2和MgCl2的混合溶液中加入过量锌粉,充分反应后过滤,留在滤纸上的物质是( ) A.Zn B.Cu C.Zn和Cu D.Cu和Mg 10.不符合“酸和盐反应生成另一种酸和另一种盐”的反应是 ( ) A.盐酸和硝酸钠溶液 B.稀硫酸和氯化钡溶液 C.稀盐酸和硝酸银溶液 D.硝酸和碳酸钙
初三化学酸碱盐专题训练(一) 一、选择题 1、食品与健康相关,下列作法不会危害人体的是(C ) A、香肠中加过量的亚硝酸钠 B、饲养猪加入瘦肉精 C、蒸馒头加适量纯碱 D、长期使用铝餐具 2、在水溶液中,一般不与其它物质发生复分解反应的是(A) A、硝酸钠 B、氢氧化钾 C、氢氧化铁 D、硝酸 2. 解析:复分解反应是生成水,气体或沉淀的反应,而A中的Na离子和硝酸根离子均可溶,所以一般不与其它物质发生复分解反应. 3、为了防治病害,对生长过程中的菜喷洒农药,用碱性溶液或清水冲洗可使毒性降低,浸泡时可加入(A) A、固体碳酸钠 B、食醋 C、白酒 D、白糖 3.解析:碳酸钠溶于水显碱性,食醋显酸性,白酒,白糖均显中性,所以选A. 4、配制番茄无土培养液用到KNO3,化肥硝酸钾是(A) A、复合肥 B、磷肥 C、钾肥 D、氮肥 5、为除去氯化钠溶液中的少量硫酸钠,可加入适量的(B) A、铁屑 B、氯化钡 C、硝酸银 D、氢氧化钾 5.解析:除去硫酸钠,则(1)不能引入新杂质,故排除A,C,D(2)不能与氯化钠反应,B中氯化钡不 与氯化钠反应,而与硫酸钠反应生成白色沉淀BaSO4,可过滤去除,故选B. 6、下列各物质在空气中,质量增加且发生了化学变化的是(B) A、Na2CO3·10H2O B 、CuSO4 C、浓硫酸D、NaCl 固体 6,解析:A久置于空气风化失水,质量减少.发生化学变化.B 硫酸铜在空气中与水反应生成五 水硫酸铜,质量增加且发生化学变化.C 浓硫酸有吸水性,所以质量增加但无化学变化D NaCl 固体质量不变. 7、将下列各组物质分别放入水中,可能得到无色透明溶液的一组是( B ) A、K2SO4、HNO3、BaCl2 B、BaCl2、Na2CO3、HCl(过量) C、CaCl2、KOH、Na2CO3 D、CuSO4、FeCl3、NaOH
化学酸碱盐测试题月日 一、选择题(以下各题只有一个符合要求的答案,每题1分,共15分) 1.为合理利用“垃圾’’资源,提倡垃圾分类回收,生活中废弃的铁锅、铝制易拉罐 以归为一类加以回收,它们属于 ( ) A.有机物 B.无机盐 C.金属或合金 D.难溶性碱2.将铁钉置于下列四种环境中,容易生锈的是( ) A.置于潮湿的空气中 B.置于干操的空气中 C.浸没于煮沸的水中 D.浸没于油中 3.能一次性鉴别NaCl、BaCl2、Na2CO3,三种无色溶液的试剂是 ( ) A.稀硫酸 B.盐酸 C.石灰水 D.硝酸银溶液 4.—些食物的近似pH如下:葡萄3.5——4.5,苹果2.9,——3.3,牛奶6.3,——6.6,鸡蛋清7.6——8.0。下列说法错误的是() A.胃酸过多的人不应多食苹果 B.苹果汁的酸性比葡萄汁强 C.鸡蛋清是碱性食物 D.葡萄汁能使紫色石蕊试液变蓝 5.下列药品未经密封保存,敞口放置一段时间后,质量增加并发生化学反应的是 ①苛性②碳酸⑧浓盐酸() ④浓硫酸⑤熟石灰 A.①⑧ B.②④ C.①⑤ D.④⑤ 6.我国著名化学家侯德榜先生作出的重大贡献是() A.发明黑火药 B.创造湿法冶金 C. 改进纯碱的生产 D.发现了新元素 7.现有①Ba(NO3)2:溶液、②KCI溶液、⑧K2SO4溶液、④CuSO4溶液,不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是 ( ) A.①②⑧④ B.①④⑧② C.④⑧②① D.④①⑧② 8.向盛有Fe、Cu的烧杯中加入过量稀硫酸,所得溶液中的溶质有 ( ) A.1种 B.2种 C 3种 D 4种 9.CuCI2和MgCl2的混合溶液中加入过量锌粉,充分反应后过滤,留在滤纸上的物质是 ( ) A.Zn B.Cu C.Zn和Cu D.Cu和Mg 10.不符合“酸和盐反应生成另一种酸和另一种盐”的反应是 ( ) A.盐酸和硝酸钠溶液 B.稀硫酸和氯化钡溶液 C.稀盐酸和硝酸银溶液 D.硝酸和碳酸钙 11.某工厂排放的五色废水经测定PH=2,为治理废水,需将此废水的PH调至7~8,为达此目的,并采用经济可行的方法,需在此废水中加入( ) A.生石灰 B.氢氧化钠 C.铁粉 D.盐酸 12.以铁矿石(含Fe203)为原料炼铁时,一氧化碳是() A.氧化剂 B.还原剂 C.催化剂 D.燃料 13.某溶液中含Fe3+,Mg2+,S042-,NO3-,其中Fe3+,Mg2+,S042-的个数比为3:3 :1, 可推知溶液中Fe3+,S042-,N03-的个数比是() A.3:2:1 B.1:2:1 C.3:1:15 D.3:1:13 14.分别取少量下列各组物质同时加到足量水中,得到无色透明溶液的是 ( ) A.FeCI3、Ba(OH)2、KNO3, B.Na2CO3、CaCl2、Zn(NO3)2 C.CuS04、KCI、NaCI D.MgCl2、NaN03、Na2S04 15.欲除去括号内的少量杂质,选用试剂不正确的是( ) A.NaOH溶液(Na2CO3)选用稀盐酸· B.C(CuO)选用稀硫酸
酸碱盐综合应用 【酸碱盐及其性质】 1. 按酸、碱、盐、氧化物的分类,下列各组物质属于一类的是() A氯化钠和碳酸钙B氢氧化钠和硝酸钾 C氧化镁和氯化氢D氧化钙和氢氧化钙 2. 将浓盐酸和浓硫酸分别暴露在空气中,变化的结果是容器内() A. 两瓶酸溶液质量都减小 B. 两瓶酸溶液质量都增大 C. 两瓶酸中溶质的质量分数都减小 D. 两瓶酸中溶质的质量分数都增大 3.将少量生石灰加入水中,得到澄清石灰水,该溶液的溶质是() A. Ca(OH)2 B. CaCO3 C. CaO D. H2O 4.蒸馒头、炸油条时常用到一种白色物质,它既能中和发酵过程产生的酸,又能引起发泡作用,这种白色物质是() A.NaOH B.NaHCO3C.Ca(OH)2D.NaCl 5.下列各组物质在溶液中,不能发生复分解反应的是() A盐酸和氢氧化钠B碳酸钠和稀硫酸 C氯化钠和氢氧化钾D硝酸银和氯化钡 6.滴有酚酞的氢氧化钙溶液与下列各物质恰好完全反应仍显红色的是() A.稀硫酸 B.氯化铜溶液 C.碳酸钾溶液 D.二氧化碳 7.下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而减少的是()A.烧碱B.石灰水C.浓盐酸 D.氯化钾 8.如图所示,若想小试管(试管中装有水)中分别加入一定量的下列物质, 右侧U型管中的液面未发生明显变化,该物质是() A浓硫酸B食盐固体C氧化钙固体D氢氧化钠固体 9. 下列物质间的转化,不能一步实现的是() A.Fe(OH)3→FeCl3 B.CO2→CaCO3 C.Cu →CuCl2D.MgCl2→KCl 10. 如图所示,将密闭的相互连通的装置放在天平上, 调节天平使之平衡。经过一段时间后,下列有关叙述与 事实相符合的是() A.指针偏左,食盐溶液一定变稀 B.指针偏右,食盐溶液一定饱和 C.指针偏左,食盐溶液一定变浓 D.指针偏右,食盐溶液一定变浓 【鉴别除杂】 1 .下列各项中括号里的物质是除去杂质所用的药品,其中错误的是( ) A.NaOH中混有Na2CO3(盐酸) B. CO中混有CO2(NaOH溶液) C. H2中混有HCl(NaOH溶液) D. KNO3溶液中混有KCl(AgNO3溶液) 2. 氯化钙溶液中含有少量盐酸杂质,在没有指示剂又不能增加其他杂质的情况下除去杂质,最好选用() A. 石灰石 B. 烧碱 C. 碳酸钠 D. 熟石灰 【实验】
九年级化学酸碱盐单元测试题 一、选择题(以下各题只有一个符合要求的答案,每题1分,共15分) 1.为合理利用“垃圾’’资源,提倡垃圾分类回收,生活中废弃的铁锅、铝制易拉罐以归为一类加以回收,它们属于( ) A.有机物 B.无机盐 C.金属或合金 D.难溶性碱 2.将铁钉置于下列四种环境中,容易生锈的是( ) A.置于潮湿的空气中 B.置于干操的空气中 C.浸没于煮沸的水中 D.浸没于油中3.能一次性鉴别NaCl、BaCl2、Na2CO3,三种无色溶液的试剂是( ) A.稀硫酸 B.盐酸 C.石灰水 D.硝酸银溶液 4.—些食物的近似pH如下:葡萄3.5——4.5,苹果2.9,——3.3,牛奶6.3,——6.6,鸡蛋清7.6——8.0。下列说法错误的是( ) A.胃酸过多的人不应多食苹果 B.苹果汁的酸性比葡萄汁强 C.鸡蛋清是碱性食物 D.葡萄汁能使紫色石蕊试液变蓝 5.下列药品未经密封保存,敞口放置一段时间后,质量增加并发生化学反应的是( ) ①苛性②碳酸⑧浓盐酸④浓硫酸⑤熟石灰 A.①⑧ B.②④ C.①⑤ D.④⑤ 6.我国著名化学家侯德榜先生作出的重大贡献是( ) A.发明黑火药 B.创造湿法冶金 C. 改进纯碱的生产 D.发现了新元素 7.现有①Ba(NO3)2:溶液、②KCI溶液、⑧K2SO4溶液、④CuSO4溶液,不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是( ) A.①②⑧④ B.①④⑧② C.④⑧②① D.④①⑧② 8.向盛有Fe、Cu的烧杯中加入过量稀硫酸,所得溶液中的溶质有( ) A.1种 B.2种 C 3种 D 4种 9.CuCI2和MgCl2的混合溶液中加入过量锌粉,充分反应后过滤,留在滤纸上的物质是( ) A.Zn B.Cu C.Zn和Cu D.Cu和Mg 10.不符合“酸和盐反应生成另一种酸和另一种盐”的反应是( ) A.盐酸和硝酸钠溶液 B.稀硫酸和氯化钡溶液 C.稀盐酸和硝酸银溶液 D.硝酸和碳酸钙11.某工厂排放的五色废水经测定PH=2,为治理废水,需将此废水的PH调至7~8,为达此目的,并采用经济可行的方法,需在此废水中加入( ) A.生石灰 B.氢氧化钠 C.铁粉 D.盐酸 12.以铁矿石(含Fe203)为原料炼铁时,一氧化碳是( ) A.氧化剂 B.还原剂 C.催化剂 D.燃料 13.某溶液中含Fe3+,Mg2+,S042-,NO3-,其中Fe3+,Mg2+,S042-的个数比为3:3 :1,可推知溶液中Fe3+,S042-,N03-的个数比是( ) A.3:2:1 B.1:2:1 C.3:1:15 D.3:1:13 14.分别取少量下列各组物质同时加到足量水中,得到无色透明溶液的是( ) A.FeCI3、Ba(OH)2、KNO3, B.Na2CO3、CaCl2、Zn(NO3)2 C.CuS04、KCI、NaCI D.MgCl2、NaN03、Na2S04
酸碱盐综合训练题(一)及答案山西省怀仁四中吴兴文 一.选择题 1.某盐在人体的新陈代谢中十分重要,它可维持血液 中适当的酸碱度,并通过人体复杂的作用产生消化液,帮助消化.该盐是() A.氯化钙 B.氯化钠 C.硝酸钾 D.碳酸钠 2.下列一些化学常识与我们的生活息息相关,其中叙 述错误的是() A.成年人在正常情况下每天要摄入食盐5g左右 B.医用生理盐水是0.5%的氯化钠溶液 C.当空气中的二气化碳的体积分数达到1%时,对人体就有害 D.通常的食醋中约有3%-5%的醋酸 3.(2009,佛山)下列物质能共存于同一溶液中,且无色透明的是()A.NaOH、NaNO3、K2SO4 B.CuSO4、MgSO4、KCl C.Ba(OH)2、H2SO4、NaCl D.NaCl、AgNO3、HNO3 4.我国化学家侯德榜改进了一种化工产品的工业生产 技术,其产品获得美国费城万国博览会金奖,这种生产技术用于() A、生产烧碱 B、生产纯碱 C、精制精盐 D、生产尿素 5.(2007,烟台)下列推论正确的是() A、碳酸盐与盐酸反应放出气体,所以与盐酸反应放 出气体的物质一定是碳酸盐 B、酸与碱反应生成盐和水,所以生成盐和水的反应 一定是酸与碱的反应 C、燃烧都伴随着发光、发热,所以有发光、放热现 象的就是燃烧 D、碱性溶液能使石蕊溶液变蓝,所以能使石蕊溶液 变蓝的溶液呈碱性 6.(2009,四川)下列离子能在pH=12的水溶液中大量共存的是() A.SO42-、NO3-、K+、H+ B.Na+、Cl-、OH-、Al3+ C.Cl-、NO3-、K+、Na+ D.Ag+、Cl-、CO32-、K+ 7.(2008,山东)下列各组物质能按照关系图 (→表示反应一步完成)相互转化的是() A B C D X NaOH Ca(OH)2Fe2O3Cu Y NaNO3CaCl2Fe CuO Z Na2SO4CaCO3FeCl2Cu(OH)2 8.(2008,乐山)图中,四圆甲、乙、丙、丁分别表示一种溶液,两圆的相交部分为两溶液混合后出现的主要实验现象,下表中符合图示关系的是() 甲乙丙丁 A Na2CO3 H2SO4 Ba(OH)2 石蕊 B Na2CO3 HCl Ca(OH)2 CuSO4 C Na2SO4 HCl Ba(OH)2 石蕊 D HCl Na2CO3 Ca(OH)2 酚酞 9.(2010,桂林)下列化肥能与碱性物质混放或混用的是() A.碳铵 B.硝铵 C.硫铵 D.硫酸钾 10.(2008,咸宁)已知某固体粉末是由NaCl、Ba(NO3)2、CuSO4、Na2SO4、Na2CO3中的一种或几种组成,取这种粉末加足量的水,振荡后呈浑浊,再加稀盐酸,沉淀不溶解,过滤后得无色滤液,取滤液并滴加AgNO3溶液,产生白色沉淀,对原固体粉末的判断正确的是() A.可能含CuSO4和Na2CO3 B.一定含NaCl,可能含Ba(NO3)2、Na2SO4,一定不含 Na2CO3、CuSO4 C.一定含有NaCl、Ba(NO3)2、Na2SO4,一定不含Na2CO3, 可能含CuSO4 D.可能含NaCl,一定含Ba(NO3)2、Na2SO4,一定不含 Na2CO3、CuSO4 11.(2009,锦州)将稀硫酸、澄清的石灰水、碳酸钠溶液、氧化铁、锌粒五种物质两两混合,发生的反应共有() A.7个 B.6个 C.5个 D.4个12.(2010,镇江)下列各组溶液,不加其他试剂就能鉴别的是(双选)() A.NaOH NaCl MgCl2 FeCl3 B.Na2CO3稀H2SO4稀HCl NaNO3 X Y Z 1
、选择题 1、目前,国家食品监督检验部门检出某 粽子会有害健康.硫酸铜属于( A 、氧化物 B 、混合物 返青粽叶”包装的粽子中含有硫酸铜, ) C 、金属单质 酸碱盐化肥 2、下列说法正确的是( ) A 、纯碱不是碱 B 、食盐不是盐 C 、火碱不是碱 D 、盐酸不是酸 3、下列物质的俗名与化学式一致的是( A 、水银Ag B 、纯碱NaHCO 3 ) C 、酒精CH 4 D 、烧碱NaOH 4、下列区分物质的试剂或方法不正确的是 A 、用水区分氯化钙和碳酸钙 C 、用盐酸区分黄金和黄铜(含锌) B 、用闻气味的方法区分白酒和白醋 D 、用酚酞溶液区分氯化钠溶液和盐酸 5、右图是一种化肥包装袋上的部分说明, A 、氮肥 B 、磷肥 该化肥属于( C 、钾肥 ) D 、复合肥料 6、配制番茄的无土栽培营养液要用到 A 、复合肥料 B 、磷肥 KNO 3做肥料, C 、钾肥 化肥KNO 3是一种( D 、氮肥 7、某学习性学习小组的同学为家乡农业生产提出了下列建议,其中不合理的是( A 、 要加大灌溉用水的管理力度,防止水资源的污染和浪费 B 、 禁止就地焚烧农作物秸秆,应该将其回收用于制沼气 C 、 用熟石灰改良酸性土壤,应同时施加碳铵( NH 4HCO 3)以提高土壤肥力 D 、 要综合利用农家肥和化肥,重视在增施农家肥的基础上,配合使用化肥 &氮肥、磷肥、钾肥是农业生产中最主要的化肥,用简便方法区别三种化肥,在农业生产中 具有实用性。区别下列相关化肥的方法可行的是( ) A 、NH 4CI 与KCl :观察外观 B 、NH 4HCO 3与KCl :加水 C 、K 2SO 4与Ca 3( PO 4)2 :闻气味 D 、(NH 4)2SO 4与K 2SO 4 :加熟石灰研磨后闻气味 9、下列关于物质用途的描述不正确的是( ) A 、食盐可用作调味品 B 、熟石灰可用于改良碱性土壤 C 、干冰可用于人工降雨 D 、盐酸可用于金属除锈 10、下列各组物质中,在水中都不能溶解的一组是( ) A 、MgCl 2、Ca (NO 3)2、BaCO 3 B 、AgCl 、BaSO 4、Na 2CO 3 若食用这样的 D 、盐
酸碱盐的常见化学方程式及推断题练习 跟盐酸有关的化学方程式: NaOH(也可为KOH)+HCl==NaCl+H2O 现象:不明显 HCl+AgNO3==AgCl↓+HNO3现象:有白色沉淀生成,这个反应用于检验氯离子 CaCO3+2HCl==CaCl2+H2O+CO2↑现象:百色固体溶解,生成能使纯净石灰水变浑浊的气体 Na2CO3+2HCl==2NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体 NaHCO3+HCl==NaCl+H2O+CO2↑现象:生成能使纯净石灰水变浑浊的气体 Fe2O3+6HCl==2FeCl3+3H2O 现象:红色固体逐渐溶解,形成黄色的溶液 Fe(OH)3+3HCl==FeCl3+3H2O 现象:红棕色絮状沉淀溶解,形成了黄色的溶液 Cu(OH)2+2HCl==CuCl2+2H2O 现象:蓝色沉淀溶解,形成黄绿色的溶液 CuO+2HCl==CuCl2+H2O 现象:黑色固体溶解,生成黄绿色的溶液 Zn+2HCl==ZnCl2+H2↑现象:同上 Mg+2HCl==MgCl2+H2↑现象:同上 Fe+2HCl==FeCl2+H2↑现象:溶液变成浅绿色,同时放出气体 2Al+6HCl==2AlCl3+3H2↑现象:有气体生成 以上四个反应,盐酸、硫酸都相似,后面两类就不赘述了,只需写出配平即可;硝酸一般具有氧化性,所以产物一般不为H2 跟硫酸有关的化学方程式: 2NaOH(或KOH)+H2SO4==Na2SO4+2H2O 现象:不明显 Fe2O3+3H2SO4==Fe2(SO4)3+3H2O 现象:红色固体溶解,生成黄色溶液 CuO+H2SO4==CuSO4+H2O 现象:黑色固体溶解,生成蓝色溶液 Cu(OH)2+H2SO4==CuSO4+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液 H2SO4+BaCl2==BaSO4↓+2HCl 现象:生成不溶于强酸的白色沉淀,用于检验硫酸根离子 CaCO3+H2SO4==CaSO4+H2O+CO2↑ Na2CO3+H2SO4==Na2SO4+H2O+CO2↑ 2NaHCO3+H2SO4==Na2SO4+2H2O+2CO2↑现象:这三个反应现象同与盐酸反应现象一致 跟硝酸有关的化学方程式: Fe2O3+6HNO3==2Fe(NO3)3+3H2O 现象:红色固体溶解,生成黄色溶液 CuO+2HNO3==Cu(NO3)2 +H2O 现象:黑色固体溶解,生成蓝色溶液 Cu(OH)2+2HNO3==Cu(NO3)2+2H2O 现象:蓝色沉淀溶解,生成蓝色溶液 NaOH(或KOH)+HNO3==NaNO3+H2O 现象:不明显 Mg(OH)2+2HNO3==Mg(NO3)2+2H2O 现象:白色沉淀溶解 CaCO3+2HNO3==Ca(NO3)2+H2O+CO2↑ Na2CO3+2HNO3==2NaNO3+H2O+CO2↑ NaHCO3+HNO3==NaNO3+H2O+CO2↑现象:以上三个反应现象同与盐酸反应现象一致 跟碱有关的化学方程式: NaOH+HCl(或HNO3、H2SO4)==NaCl+H2O 现象:酸碱中和反应,现象不明显 CaO+H2O==Ca(OH)2现象:放出大量的热 3NaOH(KOH)+FeCl3(Fe(NO3)3、Fe2(SO4)3)==Fe(OH)3↓+3NaCl 现象:生成红棕色絮状沉淀,括号里面的反应过程相似,产物相对应就行了 2NaOH(KOH)+FeCl2(Fe(NO3)2、FeSO4)==Fe(OH)2↓+2NaCl 现象:生成白色絮状沉淀,括号里面的反映过程相似,产物相对应就行了 2NaOH(KOH)+CuCl2(Cu(NO3)2、CuSO4)==Cu(OH)2↓+2NaCl 现象:生成蓝色絮状沉淀,括号里面的反应过程相似,产物相对应就行了 NH4Cl(NH4NO3、(NH4)2SO4)+NaOH(KOH)==NH3↑+H2O+NaCl 现象:有可以使石蕊试纸变蓝的气体生成 MgCl2(Mg(NO3)2、MgSO4)+2NaOH(KOH)==Mg(OH)2↓+2NaCl 现象:生成白色沉淀,括号里面的反应过程相似,产物相对应就行了 NaHCO3+NaOH==Na2CO3+H2O 现象:不明显此反应的Na换成K是一样的
《酸碱盐》测试题附答案 1、下列说法正确的是() A、正盐是由金属离子和酸根离子组成的化合物 B、凡是能电离出氢离子的化合物就是酸 C、凡是能电离出氢氧根离子的化合物就是碱 D、凡是含有酸根离子的化合物就是盐 2、下列物质能电离出氢离子,但不是酸的是() A、HCl B、HNO3 C、NaHSO4 D、H2SO4 3、下列物质中属于碱的是() A、KOH B、Cu(OH)2CO3 C、KHCO3 D、K2SO4 4、下列物质属于盐的是() A、CuO B、Cu(OH)2 C、(NH4)2SO4 D、H2SO4 5、下列关于盐酸的叙述正确的是() A、盐酸就是液态氯化氢 B、纯净的盐酸是浅黄色液体 C、浓盐酸在空气里会冒白烟 D、盐酸有腐蚀性 6、下列物质中不属于酸类的是() A、硫酸 B、硝酸银 C、硝酸 D、盐酸 7、下列物质中能与盐酸或稀硫酸反应放出气体的是() A、铁 B、氯化镁 C、氢氧化钠 D、硝酸银 8、下列化学反应方程式中正确的是() A、2Fe+6HCl == 2FeCl3+3H2 ↑ B、Fe2O3+HCl ==FeCl2+H2O C、Cu+2HCl ==CuCl2+H2↑ D、Cu(OH)2+2HCl == CuCl2+2H2O 9、下列不属于复分解反应的是() A、2Al+HCl== AlCl3+3H2↑ B、CaCO3+2HCl == CaCl2+H2O+CO2 ↑ C、Ba(OH)2+2HCl ==BaCl2+2H2O D、BaCl2+AgNO3==Ba(NO3)+2AgCl↓ 10、下列溶液中,能使紫色石蕊试液变红的是() A、氯化钠溶液 B、氯化氢气体的水溶液 C、氢氧化钠溶液 D、硝酸钾溶液 11、在盛有下列固体的试管内,加入足量的稀盐酸,能得到无色溶液的是() A、AgNO3 B、Fe2O3 C、CuO D、Na2CO3 12、下列关于酸的叙述中,正确的是() A、电离时能产生氢离子的化合物 B、能与金属反应生成氢气的化合物 C、电离时产生的阳离子全部都是氢离子的化合物 D、电离时能产生氢离子和酸根离子的化合物 13、下列金属中,活动性最强的分别是() A、Ag B、Zn C、Cu D、Fe 14、能与酸反应,并放出可燃性气体的是() A、Au B、Al C、Fe2O3 D、BaCO3 15、下列金属中最容易在酸溶液中变为金属离子的是() A、Mg B、Zn C、Ca D、Fe 16、下列说法中错误的是()
中考化学酸碱盐专题复习 一.酸、碱、盐的初步概念 1 电离时生成的阳离子全部是氢离子的化合物叫做酸。如 H2SO4、HNO3、HCl等都属于酸类。 2 电 离时生成的阴离子全部是氢氧根离子的化合物叫做碱。如 NaOH、Ca(OH)2、Ba(OH)2等。3 电离时生成金属离子和酸根离子的化合物叫做盐。如 NaCl、KNO3、CuSO4·5H20等都属于盐类。铵根离子虽不是金属离子,但因其具备金属离子的特征,因此铵根离子和酸根离子构成的化合物应属盐类。 二.酸性氧化物和碱性氧化物 (1)金属氧化物大多为碱性氧化物,非金属氧化物大多为酸性氧化物。(2)碱性氧化物中只有 K2O、Na2O、BaO、CaO能与水化合生成可溶性碱;酸性氧化物如 CO2、SO2、SO3、P2O5等能与水化合生成对应的含氧酸。(3)酸性氧化物与碱的反应可看作先是酸性氧化物与水化合生成含氧酸,含氧酸再与碱相互交换成分得出生成物,即: 二、酸、碱、盐的性质 1.酸的通性 酸的通性。酸的通性实质上是氢离子的性质。 方法指导:“通性”是指某类物质所共有的一般规律,是具有一定条件和运用范围的,“酸”──常用盐酸、稀硫酸,而不能用具有强氧化性的硝酸、浓硫酸,因为它们跟金属反应一般不生成氢气。 2.酸溶液与酸性溶液 酸溶液是酸的水溶液,酸性溶液是指呈酸性(PH<7)的溶液。酸溶液一定呈酸性,但呈酸性的溶液其溶质不一定是酸。有些盐溶液,如NaHSO4溶液、NH4Cl 溶液也呈酸性,也能使紫色石蕊试液变红。
3.碱的通性 碱在水溶液中电离生成的阴离子都是氢氧根离子,因而碱类都具有一些相似的化学性质,即碱的通性。 方法指导:学习碱的性质时既要掌握OH-具有的一般规律即通性,又要明确不同的阳离子所具有的特殊性。如 Ca(OH)2溶液能与Na2CO3溶液反应,而 NaOH溶液却不与 Na2CO3溶液反应。 4.难溶性碱如Cu(OH)2、Fe(OH)3等的特性 (1)大多数难溶性碱受热容易分解,如:Cu(OH)2=CuO+ H2O . 而可溶性碱通常是很稳定的,受热不易分解。可溶性碱可由其对应金属氧化物与水化合而得。如 Na2O+ H2O=2NaOH,而难溶性碱一般不能用其对应金属氧化物与水反应而得。如 CuO与H2O不反应,即CuO─→Cu(OH)2不能通过一步反应完成。(2)难溶性碱除可与酸发生中和反应外,通常不能和酸性氧化物或盐起反应。 5.盐类的化学性质 为便于掌握,盐类在溶液中表现的化学性质总结如下: 6.溶解性酸、碱、盐的溶解性对于学习复分解反应及盐的化学性质起着至关重要的作用,必须熟练记忆酸、碱、盐的溶解性表,为方便记忆,可按如下口诀。 钾钠硝铵溶水快碱溶钾钠钡和钙碳酸盐只溶钾钠铵盐酸盐不溶氯化银硫酸盐不溶硫酸钡 另外:AgCl、BaSO4不仅不溶于水,而且还不溶于稀硝酸。
初三化学酸碱盐和溶液专题训练 一、选择题 1、食品与健康相关,下列作法不会危害人体的是() A、香肠中加过量的亚硝酸钠 B、饲养猪加入瘦肉精 C、蒸馒头加适量纯碱 D、长期使用铝餐具 2、在水溶液中,一般不与其它物质发生复分解反应的是() A、硝酸钠 B、氢氧化钾 C、氢氧化铁 D、硝酸 3、为了防治病害,对生长过程中的菜喷洒农药,用碱性溶液或清水冲洗可使毒性降低,浸泡时可加入() A、固体碳酸钠 B、食醋 C、白酒 D、白糖 5、为除去氯化钠溶液中的少量硫酸钠,可加入适量的() A、铁屑 B、氯化钡 C、硝酸银 D、氢氧化钾 6、下列各物质在空气中,质量增加且发生了化学变化的是() A、Na2CO3·10H2O B 、CuSO4 C、浓硫酸D、NaCl固体 7、将下列各组物质分别放入水中,可能得到无色透明溶液的一组是() A、K2SO4、HNO3、BaCl2 B、BaCl2、Na2CO3、HCl(过量) C、CaCl2、KOH、Na2CO3 D、CuSO4、FeCl3、NaOH 8 、在下列物质的溶液中滴加氢氧化钠溶液,能产生蓝色沉淀的是() A、氯化铜 B、氯化铁 C、硝酸镁 D、硫酸 9、下列各组溶液,只用无色酚酞就可以鉴别的是() A、NaCl、NaOH B、NaCl、HCl、NaOH C、NaCl、H2SO4 D、NaCl、NaOH、Na2SO4 10、下列各组物质均能在NaOH溶液中共存的是() ,KNO3,KCl B. NaCl,CuSO4,HCl ,NH4Cl,CaCl2D. CaO,CO2,HNO3 11、如图,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡,一 段时间后可见小气球鼓起。下表中的各组物质不出现上述现象的是() A B C D X CO CO2HCl SO2 Y Ca(OH)2NaOH Ba(OH)2NaOH 12、在实验室用盐酸与氢氧化钠溶液作用研究中和反应时看不到明显的实验现象,有如下做法:①放弃对此问题的研究②挪用其他人的实验结果③实验前向氢氧化钠溶液中滴加两滴酚酞试液④改用氢氧化铜与稀硫酸反应,其中正确的是() A.①③B.③④C.①④D.②④ 13、鱼胆弄破后,会使鱼肉粘上一种叫胆汁酸(一种酸)的难溶于水物质,使鱼肉变苦,要消除这种苦味,可用下列的何种溶液冲洗最适宜() A. 食盐水 B. 醋酸 C. 纯碱溶液 D. 氢氧化钠溶液 9、一包白色粉末,可能含有CuSO4、NaCl、AgCl、Na2SO4、Na2CO3中的一种或几种,现进行如下的实验:(1)将白色粉末放入足量的水中,得到无色澄清溶液。(2)向无色澄清溶液中加入氯化钡溶液,有白色沉淀生成。(3)向白色沉淀中加入足量的稀硝酸,有部分沉淀溶解,并生成能使澄清石灰水变浑浊的气体。根据以上事实,该白色粉末中一定含有________,可能含有_______,一定没有_________。 10、将一定量的Fe、Cu放入AgNO3溶液中,待反应完全后过滤。 (1)若向滤液中加入少量盐酸,不出现白色沉淀,则滤液中一定含有_____________,没有___________。 (2)若向滤渣中加入少量盐酸,产生气泡,则滤渣中一定有____________,滤液中的溶质是_______。 1 在装有下列固体的烧杯中,加入过量的稀硫酸,能得到澄清无色溶液的是 ()A、Cu(OH)2B、Zn C、Fe2O3D、 2 一块质量为的铁片,可能含有下列某一种杂质,当它与足量的稀盐酸充分反应后,生成氢气,则铁片中含有的杂质可能是()A、Cu B、Zn C、Mg D、Al 1、下列酸中没有刺激性气味的是( )A、浓硫酸B、浓盐酸C、浓硝酸D、稀醋酸 2、下列物质放在敞口容器中质量增加,溶质质量分数减少的是( ) A、浓硫酸 B、浓盐酸 C、浓硝酸 D、稀硫酸 3、下列物质能除去铁制品表面铁锈的( ) A、NaOH溶液 B、CuSO4溶液 C、稀盐酸 D、NaCl溶液 4、下列物质加入足量硝酸后,固体不溶解的是(A、CuO B、AgCl C、CaCO3 D、BaSO4
《酸碱盐》测试题附答案 1、下列说确的是() A、正盐是由金属离子和酸根离子组成的化合物 B、凡是能电离出氢离子的化合物就是酸 C、凡是能电离出氢氧根离子的化合物就是碱 D、凡是含有酸根离子的化合物就是盐 2、下列物质能电离出氢离子,但不是酸的是() A、HCl B、HNO3 C、NaHSO4 D、H2SO4 3、下列物质中属于碱的是() A、KOH B、Cu(OH)2CO3 C、KHCO3 D、K2SO4 4、下列物质属于盐的是() A、CuO B、Cu(OH)2 C、(NH4)2SO4 D、H2SO4 5、下列关于盐酸的叙述正确的是() A、盐酸就是液态氯化氢 B、纯净的盐酸是浅黄色液体 C、浓盐酸在空气里会冒白烟 D、盐酸有腐蚀性 6、下列物质中不属于酸类的是() A、硫酸 B、硝酸银 C、硝酸 D、盐酸 7、下列物质中能与盐酸或稀硫酸反应放出气体的是() A、铁 B、氯化镁 C、氢氧化钠 D、硝酸银 8、下列化学反应方程式中正确的是() A、2Fe+6HCl == 2FeCl3+3H2 ↑ B、Fe2O3+HCl ==FeCl2+H2O C、Cu+2HCl ==CuCl2+H2↑ D、Cu(OH)2+2HCl == CuCl2+2H2O 9、下列不属于复分解反应的是() A、2Al+HCl== AlCl3+3H2↑ B、CaCO3+2HCl == CaCl2+H2O+CO2 ↑ C、Ba(OH)2+2HCl ==BaCl2+2H2O D、BaCl2+AgNO3==Ba(NO3)+2AgCl↓ 10、下列溶液中,能使紫色石蕊试液变红的是() A、氯化钠溶液 B、氯化氢气体的水溶液 C、氢氧化钠溶液 D、硝酸钾溶液 11、在盛有下列固体的试管,加入足量的稀盐酸,能得到无色溶液的是() A、AgNO3 B、Fe2O3 C、CuO D、Na2CO3 12、下列关于酸的叙述中,正确的是() A、电离时能产生氢离子的化合物 B、能与金属反应生成氢气的化合物 C、电离时产生的阳离子全部都是氢离子的化合物 D、电离时能产生氢离子和酸根离子的化合物 13、下列金属中,活动性最强的分别是() A、Ag B、Zn C、Cu D、Fe 14、能与酸反应,并放出可燃性气体的是() A、Au B、Al C、Fe2O3 D、BaCO3 15、下列金属中最容易在酸溶液中变为金属离子的是() A、Mg B、Zn C、Ca D、Fe 16、下列说法中错误的是()
酸碱盐的性质及用途专题测试 一.选择题(每小题只有一个选项符合题意。请将正确选项的序号填入下表相应空格内。) 1.下列物质的俗称与化学式不相符合的是 A.干冰 CO2 B.生石灰 Ca(OH)2 C.烧碱 NaOH D.苏打 Na2CO3 2.下列溶液暴露在空气中,因发生化学变化而使溶液质量增大的是 A. 浓氢氧化钠溶液 B. 浓盐酸 C. 浓硫酸 D.饱和食盐水 3.下列化肥中,能促使植物根系发达,耐寒耐旱的是 A.尿素CO(NH2)2 B.氯化钾KCl C.磷酸二氢钙Ca(H2PO4)2 D.硫酸铵(NH4)2SO4 4.小烧杯中盛有含紫色石蕊的氢氧化钠溶液.逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的顺序是 A.紫色——红色——蓝色 B.蓝色——紫色——红色 C.蓝色——红色——紫色 D.紫色——蓝色——红色 5.盐在日常生活中是用途非常广泛的一类物质。下列说法中不正确的是 A.添加大量的亚硝酸钠来保鲜食品 B.“请往菜里加点盐”中的“盐”特指食盐 C.KNO3是一种复合肥 D.用纯碱可除去面粉发酵生成的酸 6.盐酸、稀硫酸在水溶液中都能产生H+,故有许多共同的性质。下列有关叙述正确的是 A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾 B.稀盐酸和稀硫酸都可用于除铁锈 C.浓盐酸、浓硫酸都可用来干燥氧气 D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀 7.氯气(Cl2)能与水发生如下反应:Cl2+H2O=HCl+HClO,其中HClO是一种酸。将Cl2通入过量氢氧化钠溶液中,反应后的生成物有 A.NaCl、H2O B.NaClO、H2O C.NaCl、NaClO D.NaCl、NaClO、H2O 8. 物质性质决定它的用途,还决定了它的保存方法。固体NaOH具有以下性质: ①白色片状固体②有腐蚀性③易吸收水分而潮解④易溶于水,溶解放热⑤能与空气中的 二氧化碳反应。实验室中必须将它密封保存的主要原因是: A.①②B.①②③C.②③④D.③⑤ 9.家庭生活中一些常见物质的pH如下: 物质食醋牛奶食盐水牙膏肥皂水 pH 2~3 6~7 7 8~9 9~10 当我们被蚊虫叮咬后,蚊虫能在人的皮肤内分泌蚁酸(具有酸的性质),从而使皮肤肿痛。要减轻痛痒,应在叮咬处涂抹下列物质中的 A.食醋 B.牛奶 C.食盐水 D.牙膏或肥皂水 10.为证明木炭粉中是否混有氧化铜,某兴趣小组设计了以下四种方案,其中可行的是 A.在样品中加氢氧化钠溶液,看粉末是否会减少 1
酸碱盐测试题附答案 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
《酸碱盐》测试题附答案 1、下列说法正确的是() A、正盐是由金属离子和酸根离子组成的化合物 B、凡是能电离出氢离子的化合物就是酸 C、凡是能电离出氢氧根离子的化合物就是碱 D、凡是含有酸根离子的化合物就是盐 2、下列物质能电离出氢离子,但不是酸的是() A、HCl B、HNO3 C、NaHSO4 D、H2SO4 3、下列物质中属于碱的是() A、KOH B、Cu(OH)2CO3 C、KHCO3 D、K2SO4 4、下列物质属于盐的是() A、 CuO B、Cu(OH)2 C、(NH4)2SO4 D、H2SO4 5、下列关于盐酸的叙述正确的是() A、盐酸就是液态氯化氢 B、纯净的盐酸是浅黄色液体 C、浓盐酸在空气里会冒白烟 D、盐酸有腐蚀性 6、下列物质中不属于酸类的是() A、硫酸 B、硝酸银 C、硝酸 D、盐酸 7、下列物质中能与盐酸或稀硫酸反应放出气体的是() A、铁 B、氯化镁 C、氢氧化钠 D、硝酸银 8、下列化学反应方程式中正确的是() A、2Fe+6HCl == 2FeCl3+3H2 ↑ B、Fe2O3+HCl ==FeCl2+H2O C、Cu+2HCl ==CuCl2+H2↑ D、Cu(OH)2+2HCl == CuCl2+2H2O
9、下列不属于复分解反应的是() A、2Al+HCl== AlCl3+3H2↑ B、CaCO3+2HCl == CaCl2+H2O+CO2 ↑ C、Ba(OH)2+2HCl ==BaCl2+2H2O D、BaCl2+AgNO3==Ba(NO3)+2AgCl↓ 10、下列溶液中,能使紫色石蕊试液变红的是() A、氯化钠溶液 B、氯化氢气体的水溶液 C、氢氧化钠溶液 D、硝酸钾溶液 11、在盛有下列固体的试管内,加入足量的稀盐酸,能得到无色溶液的是() A、AgNO3 B、Fe2O3 C、CuO D、Na2CO3 12、下列关于酸的叙述中,正确的是() A、电离时能产生氢离子的化合物 B、能与金属反应生成氢气的化合物 C、电离时产生的阳离子全部都是氢离子的化合物 D、电离时能产生氢离子和酸根离子的化合物 13、下列金属中,活动性最强的分别是() A、Ag B、Zn C、Cu D、Fe 14、能与酸反应,并放出可燃性气体的是() A、Au B、Al C、Fe2O3 D、BaCO3 15、下列金属中最容易在酸溶液中变为金属离子的是() A、Mg B、Zn C、Ca D、Fe 16、下列说法中错误的是() A、凡有盐和水生成的反应就是中和反应 B、中和反应属于复分解反应 C、酸跟碱作用,生成盐和水的反应一定是中和反应
2019-2020年中考化学专题训练酸碱盐(含答案) 1.下列各组溶液,不加其他试剂就能鉴别的是() A.K2SO4、BaCl2、Na2CO3、HCl B.HNO3、Na2CO3、Ca(NO3)2、HCl C.CuCl2、K2SO4、NaNO3、NaOH D.AgN03、KCl、NaCl、HNO3 2.下列能一次性将稀H2SO4、Ca(OH)2溶液、NaCl溶液区别出来的试剂是()A.无色酚酞溶液B.紫色石蕊溶液C.NaOH溶液D.CaCl2溶液 3.下列物质能用于鉴别氢氧化钠溶液和稀盐酸的是() A.酚酞试液B.CO2C.澄清石灰水 D.铁粉 4.下列试剂能一次鉴别出稀盐酸,澄清石灰水,氢氧化钠溶液的是()A.紫色石蕊试液B.酚酞试液C.碳酸钙粉末 D.碳酸钾溶液 5.下列各组溶液,不用其他试剂就能鉴别出来的是() A.CuSO4、NaOH、KNO3、NaCl B.K2CO3、NaOH、稀HCl、BaCl2 C.FeCl3、KOH、稀HCl、NaCl D.稀HCl、Na2CO3、稀H2SO4、Na2SO4 6.下列区分物质的方法不正确的是() A.用水区分碳酸钙粉末和碳酸钠粉末 B.用水区分硝酸铵固体和氢氧化钠固体 C.用硝酸钡溶液区分稀盐酸和稀硫酸 D.用酚酞溶液区分稀盐酸和食盐水 7.不用外加试剂,下列溶液被鉴别出来的先后顺序是() ①FeCl3②K2SO4③MgCl2④NaOH. A.①④③②B.①②④③C.③①④②D.④①③② 8.区分氢氧化钠溶液和碳酸钠溶液,不可用的试剂是() A.稀盐酸B.酚酞试液C.氯化钡溶液 D.氢氧化钙溶液 9.下列各组物质中都有三种溶液,只用Na2CO3溶液就能将三种溶液区分开来的 是() A.CuSO4、H2SO4、NaNO3 B.NaCl、CaCl2、Ba(NO3)2 C.HNO3、H2SO4、NaHCO3 D.HNO3、BaCl2、Na2SO4
1: Na2CO3·nH2O62g恰好与某硫酸溶液98g完全反应,测得反应后溶液质量为138g。 求:(1)反应后生成CO2的质量(2’) (2)所用硫酸溶液的质量百分比浓度(2’) (3)Na2CO3·nH2O中结晶水的质量分数,并求出n的数值。(3’) 2: t℃某饱和氢氧化钙溶液149.48g与草木灰(其主要成分为碳酸钾)5.5g反应,生成2g沉淀。 求:(1)草木灰中碳酸钾的含量(5’) (2)t℃下氢氧化钙的溶解度(5’) 3.使未知质量分数的盐酸50克跟7.8克锌充分反应后,锌有剩余,再加入7.3%的盐酸20克,恰好与剩余的锌完全反应,求 (1)第一次所用盐酸的质量分数 (2)反应后所得溶液中溶质的质量分数? 4.已知t℃时氯化钾的溶解度为34.7克.在该温度下将氯化钙和氯化钾的混合物16.2克,放入26.2克水中使其完全溶解,然后加入27.6克溶质质量分数为50%的碳酸钾溶液,恰好完全反应.求:(1)生成碳酸钙沉淀的质量。 (2)反应所得溶液中溶质的质量分数。
5.把30g锌放入200g未知浓度的稀H2SO4中,反应停止后,锌有剩余,取出锌后,称溶液的质量比反应前增加了25.2g。试求: (1)原稀H2SO4的溶质质量分数; (2)反应后的溶液的主要质量分数; (3)未反应的锌的质量是多少克? 6. 为了测定某石灰石样品中碳酸钙的含量,取20g此样品,将80g的稀盐酸分四次加入样品使之充分反应(石灰石中的杂质不溶于水,也不与盐酸及生成物反应),每次用盐酸的质量与反应后剩余固体的质量见下表。(计算结果保留到小数点后一位数字) 计算:(1)样品中碳酸钙的质量分数; (2)20g此样品与足量盐酸反应最多生成二氧化碳的质量; (3)加入的稀盐酸中溶质的质量分数。