2016年药品不良反应分析报告
一、药品不良反应类型统计:
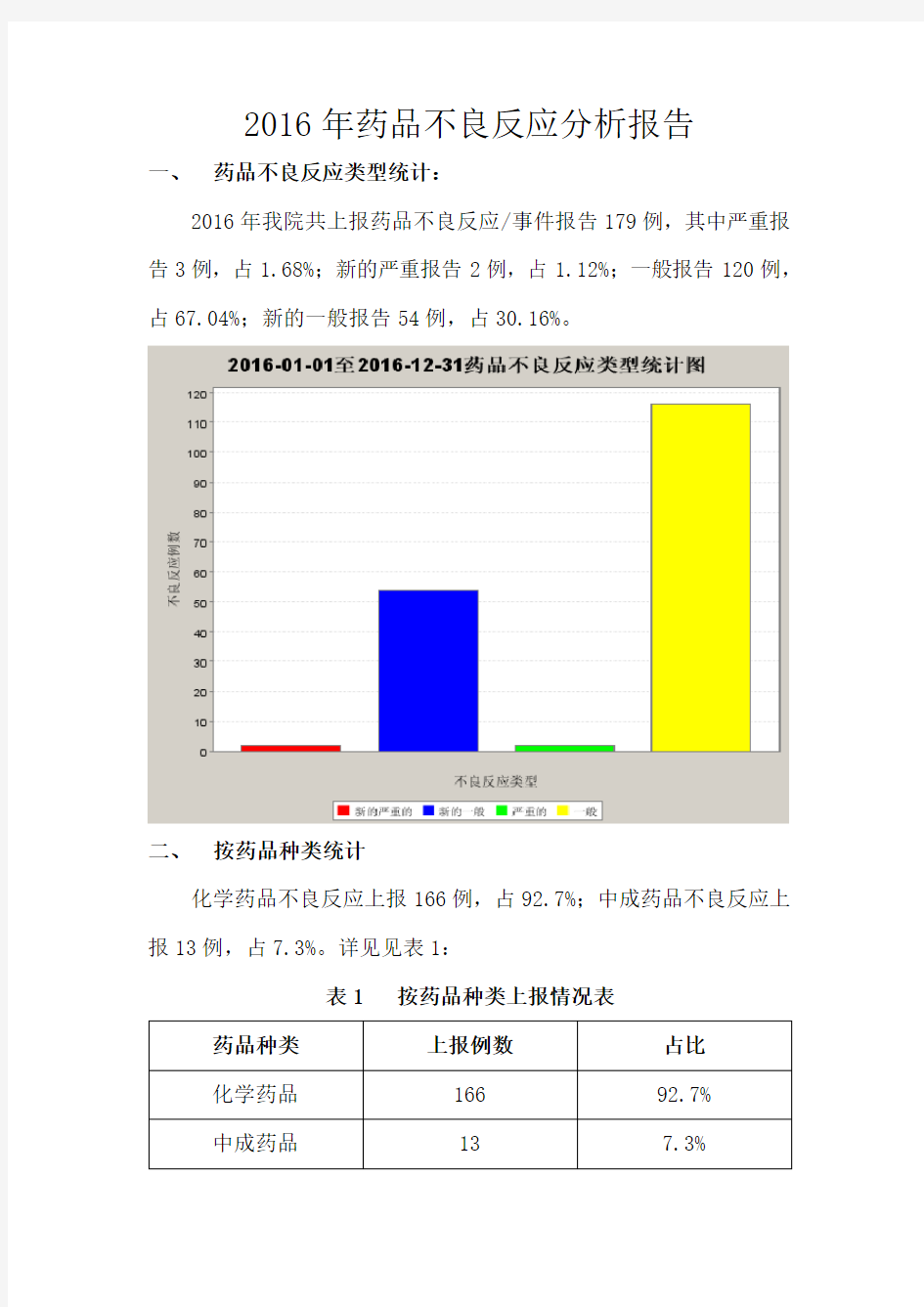
2016年我院共上报药品不良反应/事件报告179例,其中严重报告3例,占1.68%;新的严重报告2例,占1.12%;一般报告120例,占67.04%;新的一般报告54例,占30.16%。
二、按药品种类统计
化学药品不良反应上报166例,占92.7%;中成药品不良反应上报13例,占7.3%。详见见表1:
表1 按药品种类上报情况表
药品种类上报例数占比
化学药品166 92.7%
中成药品13 7.3%
三、按药理作用统计
抗感染药品不良反应上报112例,占62.57%;非抗感染药品不良反应上报67例,占37.43%。见表2:
表2 按药理作用上报情况表
四、抗感染药品不良反应报告:
硝基咪唑类上报6例,占5.36%;头孢菌素类上报36例,占32.14%;青霉素类上报1例,占0.89%;其他B-酰胺类上报5例,占4.46%;喹诺酮类上报54例,占48.12%;大环酯类上报3例,占2.68%;其他抗生素上报6例,占5.36%;抗病毒药品上报1例,占0.89%。见表3:
表3 抗感染药品ADR上报情况表
五、报告科室分布
药品不良反应报告来自全院18科室,其中住院患者162例,门急诊患者17例。详见表4:
表4 ADR科室上报情况表
六、药品不良反应报告性别和年龄分布
在报告的179例ADR中,男性75例,女性104例。年龄分布区间为1-90岁,具体情况见表5:
表5 患者年龄分布情况
七、用药途径情况分析:
用药途径包括静脉给药及口服、皮下注射等。最常见仍为静脉滴注,占%。详见表6
表6 给药途径情况表
八、药物不良反应涉及的系统、器官及表现情况分析
上报的ADR涉及的系统损害多为皮肤及其附件损害,常见症状为皮疹、瘙痒等,具体容见表7:
表7 药物不良反应所涉及的系统、器官及临床表现情况
九、统计ADR报表中发现的问题
1.上报药品不良反应类型单一:由表7可见,我院上报的药品不良反应多局限为各种药物致皮疹,且均为轻微皮疹,停药后多自行消散,所涉及药物无上市5年的新药。医务人员应对不良反应类别的定义严格掌握,临床应鼓励医务人员积极发现新的、严重的不良反应,对于造成器官损害、致残、致畸、致死、导致住院治疗甚至延长住院时间的药物不良反应,要在规定时限准确上报。
2.药物不良反应报表书写不规:本次回顾分析发现,本院ADR报表书写虽比往年有很大提高,但仍存在部分不规的情况,如填写漏项、不良反应发生经过描述不详、阐述容无逻辑关系等,导致这一现象的主要原因是上报人对于表格各项目的要求理解不到位。
3.抗菌药物使用的安全隐患:与国文献报道一致,我院2016年收集到的ADR病例怀疑由抗菌药物引起的不良反应所占比例最大,其中以喹诺酮类抗菌药物为主,由此提示临床科室在用药过程中应告知患者,如感觉不适应立即反馈。
4.开展ADR监测工作需要医务人员的共同努力,全面配合。做好药物不良反应事件的管理工作是医务人员的责任,与医疗安全息息相关,希望我院医务人员提高对ADR监测工作的积极性和主动性,进一步推进此项工作,促进临床安全合理用药。
药品不良反应分析报告 (20 年月--20 年月) 生产企业:(盖章) 地址: 联系人: 电话: 报告日期: 一、企业监测体系建设概况
我司于2006年已建立药品不良反应报告和监测体系,并有效实施。2012年按《药品不良反应报告和监测管理办法》(卫生部令第81号)》和《浙江省药品不良反应报告和监测管理实施细则》完善我司药品不良反应监测体系、组织机构,明确其职责。 我司监管网络为一线销售人员从医院收集药品不良反应报告,汇总至市场部相关人员。市场部相关人员将数据汇总至相应QA人员,QA人员将数据上报至国家药品不良反应监测系统中。 组织机构: 我司处理药品不良反应/事件的专职部门为质量保证部,监测部门为市场部。 组成人员: 质量负责人、质保部负责人、一名市场部人员、一名QA人员。 职责: (1)市场部人员和QA人员及时收集与公司生产的药品有关的安 全性信息,发现与公司有关的药品不良反应,及时通过药品不良反应监测信息网络报告。每年向所在地药品不良反应监测机构提交药品不良反应监测工作报告; (2)对严重药品不良反应或者药品群体不良事件进行调查,必要时对药品采取紧急控制措施,如召回; (3)配合各级食品药品监督管理局、卫生行政部门和药品不良反应监测机构对药品不良反应或者群体不良事件的调查,并提供调查所需的资料,并填写《药品不良反应/事件报告表》,填报内容应真实、完整、准确。 (4)开展药品不良反应报告数据与药品质量的关联性研究,必要时进行重点监测或再评价;
(5)按要求撰写和提交定期安全性更新报告; (6)正确介绍药品的使用要求和注意事项等,将说明书修改等安全性信息及时告知相关药品经营企业和医疗机构。 (7)经常查阅国家食品药品监督管理局定期通报国家药品不良反应报告和监测情况。 二、公司品种概况 我司现有1个品种:****(批准文号:国药准字*****)。20**年1月1日至9月30日,我司对该品种进行了生产......... 无监测期品种和重点监测品种。 三、产品基本信息和不良反应收集情况 (一)不良反应反馈数据核实情况: 无。 (二)反馈数据涉及产品的基本信息: 产品的批准文号、通用名称、剂型、统计周期内的销量、不良反应报告例数、严重的不良反应例数及其构成比、新的一般的不良反应例数及其构成比、死亡病例数见附表1。 我司无文号转入或转出情况。 (三)其他不良反应信息收集情况: 在此次报告时间段内,我司未收集到到涉及本企业药品的不良反应或可疑不良反应信息情况。
2016年产品质量情况分析报告
2016年产品质量状况分析报告 质量管理部 质量是企业的生命。近年来,随着公司技改开发的大力投入,产业布局的系统优化和整合完善,形成了以202车间为代表的南方矿分离体系和以204车间焙烧工序为龙头、201车间萃取分离工序为承接、218车间沉淀煅烧为收尾的北方矿分离体系,形成了稀土加工分离、稀土金属、稀土研磨材料、稀土贮氢材料、稀土磁性材料、稀土发光材料、氯碱化工等七大产业链。公司严把质量关,从原材料的入厂、中间品的控制到产成品出厂都严格按内部标准执行,在各工序间制定了质量控制标准,细化了关键岗位控制标准,编制了质量岗位巡视路线图,强化质量巡视工作,从而使公司的产品质量有了较明显的提升,确保了公司在市场中的竞争力。下面就公司产品质量做如下具体分析: 一、原材料方面 目前公司所用稀土原料全部来自外购,南方矿多采购自江西和广东,稀土总量为92%左右,稀土配分、放射性大小由于产地不同存在一定的差异,202车间在萃取分离过程中及时调整萃取工艺指令同时做好镧产品中放射性的去除工作;北方矿主要为包头高矿,兼顾山东矿和四川矿,矿型差异较大,204车间联合研究所做好实验工作,研究焙烧工艺,做好各类矿型混合焙烧的技术策划;碳铵做为公司沉淀工序的重要原料,由于市场原因,采购自不同厂家,2016年合格率为89.69%,不合格原因除总量偏低外,不同厂家的产品对沉淀过程
液、镧铈液、镨钕液稀土组分不合格的主要原因受生产工艺影响,在萃取稀土过程中,温度、酸度、流量等条件稍微控制不当,容易使产品配分引起波动。产品中非稀土杂质超标的主要原因是201车间高纯线除杂不彻底,下游218车间需加强在沉淀环节和煅烧环节对稀土杂质的控制,及时调整生产工艺,关注外接稀土料液、生产用水、沉淀剂碳铵中Fe、CaO、Mg、Na、等非稀土杂质的含量以及生产设备、搅拌装置等腐蚀程度对产品质量的影响,车间生产技术人员在追求稀土产品相对纯度满足的前提下应足够重视对非稀土杂质的控制。三、产成品方面 202车间2016年产品一次合格率为99.82%,较2015年上升 0.65%,产品质量有明显提升;218车间2016年产品一次合格率为99.95%,较2015年上升0.05%,产品质量与2015年基本持平;205车间、磁材车间、贮氢车间、应用型产品质量一次合格率均为100%;金属车间2016年产品一次合格率为96.31%,较2015年降低1.5%,产品质量有所下降。其中202车间氧化钆松装比重不合格,主要原因是沉淀过程控制不当,在今后的生产过程中要把单纯控制产品化学指标转变为为产品晶形晶貌的控制;218车间氧化镨钕稀土杂质La2O3不合格,主要原因为为转产前未彻底清理炉膛导致煅烧过程污染使产品中组分La2O3超标,在今后的生产过程中车间技术人员应提高质量意识,做好生产前的质量策划;金属镧、金属铈、金属钕、镧铈金镨钕金属中稀土杂质AL、C、Si、Mo等超标,主要原因电解过程控制
****** 学期末 学业水平考试质量分析报告 ***年,******组织小学***年级、初中***年级进行统一的学业水平考试,抽调***年级数学、英语两科试卷集中批阅。根据阅卷组的反馈和测试成绩评价,我们对此次考试进行了认真分析,形成了本次考试的质量分析报告。 一、***年级成绩评价结果统计及情况分析: (一)考试科目及参考人数 本次***年级学考科目共有语文、数学、英语、生物、地理、政治、历史***科,总分共计分。全***参加考试人数人,成绩核算时,按照******考核规定和随班就读筛选鉴定小组核定结果,剔除随班就读人(其中,*** 人,***学校人,***中学人,*** 中人,***中学人),参评人数为人。 (二)***与***年度考试成绩对比分析: 1. ***与***年度全***考试成绩对比分析 全******年级学考***科平均分为分,去年***科均分分,较去年提高分,分以上百分率为,较去年的提高了个百分点,分的百分率为,较去年的提高了个百分点,分的百分率为,较去年的降低了个百分点,以上数据说明,我******年级优秀学生数量明显提升,良好学生人数大幅提高,可以肯定一点的说,这一年来,学校培优工作和后进生转化工作成绩显著。
2.城区学校考试成绩对比分析: 城区所中学和去年成绩相比较,成绩稳步提高。*** 成绩评价***项总得分为分,较去年***项总得分高分,***学校***项总得分为,较去年***项总得分高分。从校总得分极差(最大值-最小值)分来看,校成绩还存在差距。具体分析:分以上学生所占比例*** ,***学校,相差个百分点,分学生所占比例*** ,***学校,相差个百分点,分学生所占比例*** ,***学校,相差个百分点,从以上数据对比不难看出,两校优秀生所占比例相差不大,*** 后进生转化工作还需要进一步加强。 3. 农村中学考试成绩对比分析: 农村所中学和去年成绩相比较,农村中学成绩有了大幅度提高。***中学成绩评价***项总得分为分,较去年***项总得分高分,*** 中***项总得分为较去年***项总得分分高分,***中学***项总得分为,较去年***项总得分分高分。从分数段分析:***中学分以上学生较去年多人,涨幅个百分点,分学生数较去年多人,涨幅个百分点,*** 中分学生数较去年多人,涨幅个百分点。***中学分以上学生较去年多人,涨幅个百分点。分学生数较去年多人,涨幅个百分点。 ()***与***年度***年级***科考试成绩对比分析: 全***语文分学生所占比列有所下降(或为0)。从去年中考
药品不良反应分析报告 药品不良反应(ADR)监测是合理用药的重要依据,是关系到广大患者用药安全,减少医患纠纷的一项重要工作。我院2019年第一季度共收集报告146例,现就2019年第一季度的ADR报告进行统计、分析,了解ADR发生的一般规律和特征,为临床合理用药提供参考。 一、ADR监测统计结果及分析 1、性别与年龄分布 我院2019年第一季度共收到146例ADR报告,其中男性66人,占比45.21 %,女性80人,占比54.79%。患者的年龄分布见表1: 表1 发生ADR患者的年龄分布 年龄/岁例数/n 构成比/% 0~10 32 21.92 11~20 4 2.74 21~30 8 5.48 31~40 14 9.59 41~50 24 16.44 51~60 19 13.01 > 60 45 30.82
合计146 100.00 2、患者家族史、既往史情况 146例ADR报告中,患者既往有过敏史的26例,占17.81%;无过敏史的113例,占77.40%;不详的7例,占4.79%。146例患者中有家族药物过敏史的0例,占0%;无家族药物过敏史的51例,占34.93%;不详的95例,占65.07%。
3、患者转归情况 146例ADR中,其中痊愈77例,占52.74%;好转45例,占30.82%;不详24例,占16.44%。大多数患者经积极治疗均好转或痊愈(占83.56%),不详占16.44%,主要因为观察时间不够长,说明我院医务人员发现药品不良反应能够及时上报。 4、药品剂型及用药途径分布 药品剂型 146例病例报告涉及药品剂型17种,以注射剂为主。本季度涉及药品剂型分布及所占比例见表2。 表2 药物剂型分布 剂型例次/n 构成比/% 注射剂142 64.25 粉针剂21 9.50
报告编号:YT-FS-7001-76 产品质量分析报告格式 (完整版) After Completing The T ask According To The Original Plan, A Report Will Be Formed T o Reflect The Basic Situation Encountered, Reveal The Existing Problems And Put Forward Future Ideas. 互惠互利共同繁荣 Mutual Benefit And Common Prosperity
产品质量分析报告格式(完整版) 备注:该报告书文本主要按照原定计划完成任务后形成报告,并反映遇到的基本情况、实际取得的成功和过程中取得的经验教训、揭露存在的问题以及提出今后设想。文档可根据实际情况进行修改和使用。 产品质量分析报告一般由五部分组成:标题、主送 单位、正文、附件和签署。 (一)标题 质量分析报告的标题有以下三种写法: (1)单一性标题。即只写文种名称,如“质量分析 报告”。 (2)两要素标题。由被分析对象和文种组成,如“印 刷品质量分析报告”。 (3)三要素标题。由年度、被分析对象和文种组成, 如“20xx年电视机质量状况分析报告”;或由企业名 称、被分析对象和文种组成,如“重庆江陵摩托车集 团AS 100型摩托车质量分析报告”。 (二)主送单位
质量分析报告一般是写给企业的上级主管部门或者企业领导层的,所以,要有主送单位。主送单位即质量分析报告的呈送单位。 (三)正文 质量分析报告的正文一般由前言、主体和结语组成。 1前言 前言简要说明产品质量分析的缘由、目的、依据;或概述产品质量检查分析情况,如检查的范围、时间、地点、参加检查的有关人员、以说明报告的严肃性和可靠性。 2主体 主体部分是质量分析报告的核心。由于企业单位的性质、生产产品或承担的工程项目的不同,其写法有一定的区别,大体上可以分为检查的基本情况、剖析原因和提出建议三部分。 (1)检查的基本情况。主要包括检查的内容、检查的基本方法和检查的结果。检查的内容应当按照《中
2010年产品质量分析报告 【说明】 一、应开展年度质量回顾分析的产品如下: 1) 常年生产、产量较大的品种; 2) 高风险品种:如注射剂类产品、毒性药品、精神药品、麻醉药品、放射性药品、血液制品、疫苗等。 二、企业应使用风险管理理念,对产品进行分类后,选取具代表性的品种或品规开展质量回顾分析。 分类原则如下: 1)生产工艺和质量控制相似、共线生产的非高风险类产品,经质量受权人批准,可按剂型或产品系列进行分类。 2)高风险产品,经质量受权人批准,可按品种或产品系列进行分类。 3)常年生产的产品,经质量受权人批准,可按剂型、产品或产品系列进行分类。 4)无菌原料药,经质量受权人批准,可按产品或产品系列进行分类。 5)该年度变更工艺或关键生产设备等变更(如注射剂灌装设备变更、除菌过滤系统变更、灭菌设备改变)的产品,经质量受权人批准,可按剂型、产品或产品系列进行分类。
委托加工的产品,经质量受权人批准,可按产品或产6). 品系列进行分类。 三、本模版是企业撰写《年度产品质量回顾分析报告》的基本要求,仅供企业参考。各企业可根据实际情况,在积极学习和充分借鉴国外先进经验的基础上,不断完善相关内容。 2010年产品质量分析报告
产品名称、规格 回顾日期:XX年XX月-XX年XX月产品编码:XXXXX 起草签时间 QA 审核签时间 Q经 批准签时间 车间主 生产部负责 工艺技术负责 物料/销售负责人 质量受权人
] 目录[ 1概要……………………………….………………………………….…2回顾期限…………………………………………………….…….……3制造情况………………………………………………….……….……4产品描述………………………………………………….……….…… 4.1产品工艺………………………………………….……….…….. 4.2产品给药途径及适应症………………………….……….…….. 4.3关键参数………………………………………….……….…….. 5物料质量回顾…………………………………………….…….……… 5.1原辅料、包装材料质量问题回顾……………………….………. 5.2主要原辅料购进情况回顾……………………………….………. 5.3供应商管理情况回顾………………………….….……………… 5.4工艺用水、与药品直接接触的气体质量问题回顾……….….… 6产品质量标准情况…………………………………………….………. 6.1产品质量标准…………………………………………………….. 6.2质量指标统计及趋势分析……………………………………….. 7 生产工艺分析………………………………………………………..… 7.1关键工艺参数控制情况…………………………………….……. 7.2中间体控制情况………………………………………………….. 7.3工艺变更情况………………….…………………………………. 7.4物料平衡………………………………………………………….. 7.5收率……..………………………………………………………… 7.6返工与再加工……………………….……………………………. 7.7设施设备情况…………………………………………………….. 8 偏差回顾………………..……………………………………………… 9 超常超标回顾………………………………..………………………… 10 产品稳定性考察……………………………………..………………… 11 拒绝批次………………………………………………………..……… 11.1拒绝的物料……………………………………………………….. 11.2拒绝的中间产品及成品………………………………………….. 12 变更控制回顾……………………………………..…………………… 13 验证回顾……………………………..………………………………… 14 环境监测情况回顾………………………………………………..…… 15 人员情况……………………………..………………………………… 16 委托加工、委托检验情况回顾…………………..…………………… 17 不良反应……………………………………………..………………… 18 产品召回、退货………………………………..……………………… 18.1产品召回………………………………………………………….. 18.2退货………………………………………………………………..
附表1 药品不良反应/ 事件报告表 首次报告□跟踪报告□编码:
填写说明 一、严重药品不良反应就是指因使用药品引起以下损害情形之一得反应: 1) 导致死亡; 2)危及生命; 3)致癌、致畸、致出生缺陷; 4)导致显著得或者永久得人体伤残或者器官功能得损伤; 5)导致住院或者住院时间延长; 6)导致其她重要医学事件,如不进行治疗可能出现上述所列情况得。 二、新得药品不良反应就是指药品说明书中未载明得不良反应。 药品不良反应在说明书中已有描述,但不良反应发生得性质、程度、后果或者频率与说明书描述不一致或者更严重得,按照新得药品不良反应处理。 三、报告时限 新得、严重得药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其她药品不良反应30日内报告。有随访信息得,应当及时报告。 四、关联性评价指标 肯定:用药及反应发生时间顺序合理;反应符合该药已知得不良反应类型;停药或减量后,反应停止或减轻;再次使用可疑药品,反应再现;已排除并用药、原患疾病等其它因素影响。 很可能:用药及反应发生时间顺序合理;反应符合该药已知得不良反应类型;停药或减量后,反应停止或减轻;已排除并用药、原患疾病等其它因素影响。 可能:用药及反应发生时间关系密切;反应表现与已知该药ADR不相吻合;无法排除并用药、原患疾病等其它因素影响。 可能无关:用药及反应发生时间相关性不密切;反应表现与已知该药ADR不相吻合;无法排除并用药、原患疾病等其它因素影响。 待评价:需要补充材料才能评价。 无法评价:评价得必需资料无法获得。 五、其她说明 怀疑药品:就是指患者使用得怀疑与不良反应发生有关得药品。 并用药品:指发生此药品不良反应时患者除怀疑药品外得其她用药情况,包括患者自行购买得药品或中草药等。 用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。 六、报告得处理 所有得报告将会录入数据库,专业人员会分析药品与不良反应/事件之间得关系。根据药品风险得普遍性或者严重程度,决定就是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用得信息等。在极少数情况下,当认为药品得风险大于效益时,药品也会撤市。 附表2 药品群体不良事件基本信息表
药品不良反应报告表 部分项目填报注意事项 一、药品不良反应事件名称及描述 1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”, 对于皮疹的发生部位、大约形态进行描述; 2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述; 3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征; 例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。 4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述; 例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状; 例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。 二、药品不良反应发生后采取的措施及转归 1、药品不良反应发生以后,主要采取的治疗措施要进行描述。例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。 2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。 国家规定药品不良反应报告的上报时限。大家应当按照规定时限完整的对药品不良反应进行上报。 备注:提供一个药品不良反应/事件报告表填写模板(见附表),供大家参考。
学业水平考试质量分析报告模板 ****** 学期末 学业水平考试质量分析报告 ***年,******组织小学***年级、初中***年级进行统一的学业水平考试,抽调***年级数学、英语两科试卷集中批阅。根据阅卷组的反馈和测试成绩评价,我们对此次考试进行了认真分析,形成了本次考试的质量分析报告。 一、***年级成绩评价结果统计及情况分析: (一)考试科目及参考人数 本次***年级学考科目共有语文、数学、英语、生物、地理、政治、历史 ***科,总分共 计分。全***参加考试人数人,成绩核算时,按照******考核规定和随班就读筛选鉴定小 组核定结果,剔除随班就读人(其中,*** 人,***学校人,***中学人,*** 中人,***中 学人),参评人数为人。 (二)***与***年度考试成绩对比分析: 1. ***与***年度全***考试成绩对比分析 全******年级学考***科平均分为分,去年***科均分分,较去年提高分,分以上百分率为,较去年的提高了个百分点,分的百分率为,较去年的提高了个百分点,分的百分 率为,较去年的降低了个百分点,以上数据说明,我******年级优秀学生数量明显提升,良好学生人数大幅提高,可以肯定一点的说,这一年来,学校培优工作和后进生转化工作成绩显著。 17 2.城区学校考试成绩对比分析: 城区所中学和去年成绩相比较,成绩稳步提高。*** 成绩评价***项总得分为分,较去年 ***项总得分高分,***学校***项总得分为,较去年***项总得分高分。从校总得分极差(最大值-最小值)分来看,校成绩还存在差距。具体分析:分以上学生所占比例*** , ***学校,相差个百分点,分学生所占比例*** ,***学校,相差个百分点,分学生所占 比例*** ,***学校,相差个百分点,从以上数据对比不难看出,两校优秀生所占比例相 差不大,*** 后进生转化工作还需要进一步加强。 3. 农村中学考试成绩对比分析:
质量分析报告样板 一、本月生产质量情况简介 (略) 二、产品审核情况 1.各单位质量水平可用下表表示,具体数值略 缺陷界定: A:影响客户人身、财产安全的性能缺陷; B:影响产品性能及客户正常使用,但对其人身财产、安全影响不大的缺陷; C:影响产品外观,对产品性能无影响的缺陷; 各单位质量水平 项目单位A级缺陷 总次数D A B级缺陷 总次数D B C级缺陷 总次数D C 样品数n 质量水平U 标准质量水平U S 车间 车间 车间 车间 件库 库 说明:U=(10D A+5D B+1D C)/n 2.各单位产品质量指数低于90%的零件清单用下表表示,具体数值略 单位序 号 零件号平均QKZ值(%)主要缺陷项目主要缺陷数量备注 XX车间 1 磕碰伤15 2 磕碰伤8 3 磕碰伤28 4 XX尺寸小 5 5 XX尺寸大 3 ..... XX车间 1 XX尺寸大 3 2 磕碰伤 3 3 磕碰伤 5 4 磕碰伤7 5 XX尺寸短 1 …. XX车间1 粗糙度次于XX 5 2 粗糙度次于XX 5 3 粗糙度次于XX 5 4 粗糙度次于XX 6 5 2 (5) XXX车间1 粗糙度次于XX 8 2 磕碰伤 3
3 粗糙度次于XX 2 XX尺寸大23 4 磕碰伤 … 3.各单位质量水平趋势图 各单位产品质量合格数据可用于下表表示,具体数字略 各单位产品质量合格数据 单位 金工车间电机车间驱动车间编码器车间零件库备注 月份 1月 2月 3月 4月 5月 6月 7月 8月 根据各单位质量数据表,做出各单位质量水平趋势图(略) 三、磕碰伤情况 各单位磕碰伤的产品数据可用下表表示,具体数值略 各单位磕碰伤的产品数据 单位 金工车间电机车间驱动车间编码器车间零件库备注 月份 1月 2月 3月 4月 5月 6月 7月 8月 9月 10月 11月 12月 根据各单位磕碰伤的产品数据,做出趋势图(略)。 四、废品统计分析 1.全厂废品金额元,责任废品金额元,责任废品率%,各单位具体数据可用下表表示,具 体数值略。 各单位废品数据表 序号主要项目废品金额累计频次累计百分比(%) 1 金工车间
考试结果质量分析报告的撰写考试的目的是检查教师教学和学生学习的情况,检查教与学目标达成情况。并以此为依据修改或制定下一阶段的教学目标。 考试之后及时撰写质量分析报告,就是对自己教学工作进行全面、深刻、系统的反思,总结经验、查找不足,进而拿出新的具体措施、制订出下一步行动方案的过程,不断调整教学方向的过程。可以说,它是不断提高教学质量,保证教学工作稳定有效的“驱动器”。 写好质量分析报告需要做好以下工作: 一、做好之前的分析与统计工作 对于采用计算机阅卷的学校来说,要想获得阅卷中的一些数据来说是很简单的,但对于采用人工阅卷的学校则需要对试卷进行抽样统计分析,工作比较辛苦。例如:第I(或II)卷统计情况: 分数段分布: 小题统计数据:
二、把握撰写质量分析报告的一般要素 (一)题目 题目要简练,揭示报告主题。为揭示是考试结果的质量分析报告的主题,同时体现文体特点,拟题时,可采用正、副标题的形式。如:《提高复习备考的有效性——××学校××考试质量分析报告》。 (二)正文 考试结果的质量分析报告正文一般来说,应该包括试卷分析、答题情况和今后的措施三个方面的内容。 1、试卷分析 试卷分析应包括:命制试卷的思路和策略、试卷考察的内容、试卷分数的权重和试题的难度、信度和效度四方面的内容。 (1)命制试卷的思路和策略 主要写明这份试卷意在用考试引导学生重视什么知识和能力,告诉学生哪些是重点,哪些是易错的地方。 (2)试卷考察的内容 主要写本学段教学的内容是什么,试卷是如何覆盖这些内容的,制作双向细目表可一目了然。 (3)试卷分数的权重 主要写明全卷试题分数的比例分配,知识型、能力型、重点内容是如何安排的。
医院药品不良反应总结分析报告 年药品不良反应分析、反馈报告2014监测是合理用药的重)药品不良反应(ADR减少医患是关系到广大患者用药安全,要依据,年共收集上报2014纠纷的一项重要工作。我院
。例增加了年的7190.14%135例ADR,较2013了解ADR报告进行统计、分析,现就2014年的的一般规律和特征,为临床合理用药提供ADR 依据。报告人包括医生报告人职业和科室分布;药份,占90.37%和药师,其中医生上报12218ADR报告来自全院份,占9.63%。13师上报例门诊患者。详见3个科室,132例住院患者,。表1上报科室排序1 2014年ADR表例数(例)构成比科室11.85% 16 外三病区
11.11% 15 内一病区 11.11% 15 内二病区 10.37% 14 内四病区 8.89% 12 内三病区 7.41% 临床药学室10 5.93% 8 外一病区 5.83% 8 儿科病区 5.19% (肛中医二病区7 肠)5.19% 7 中医一病区 3.70% 5 外四病区 3.70% (康中医二病区5 复)
2.96% 4 ICU综合组 1.48% 2 妇产科病区 1.48% 2 住院药房 1.48% 2 门诊急诊科 1.48% 2 外二病区0.74% 门诊西药房 1 100% 135 合计 发AD的患者性别及年龄分布情例,中,男81例,女54ADR在报告的135例 1-95
岁,情况详见表2。年龄分布区间为表2 患者年龄分布情况百分比年龄例数1.48% 2 1小于岁2.22% 1-4岁 3 2.96% 4 5-14岁22.96% 31 岁 15-4428.15% 岁38 45-6442.22% 6557 岁及其以上100% 总计135 用药情况分析用药途径包括静脉给药及 口服、皮下注射等。最常见仍为静脉滴注,占. 3:74.85%。详细统计见表表3:给药途 径统计排名 给药途径一般严重总计 例次百分例次百分比例次
产品质量分析报告格式 产品质量分析报告是日常工作中常见的应用文形式。*的内容为大家介绍的是产品质量分析报告格式,以供大家参考。 产品质量分析报告格式 产品质量分析报告一般由五部分组成:标题、主送单位、正文、附件和签署。 (一)标题 质量分析报告的标题有以下三种写法: (1)单一性标题。即只写文种名称,如“质量分析报告”。 (2)两要素标题。由被分析对象和文种组成,如“印刷品质量分析报告”。 (3)三要素标题。由年度、被分析对象和文种组成,如“20xx 年电视机质量状况分析报告”;或由企业名称、被分析对象和文种组成,如“重庆江陵摩托车集团AS 100型摩托车质量分析报告”。 (二)主送单位
质量分析报告一般是写给企业的上级主管部门或者企业领导层的,所以,要有主送单位。主送单位即质量分析报告的呈送单位。 (三)正文 质量分析报告的正文一般由前言、主体和结语组成。 1前言 前言简要说明产品质量分析的缘由、目的、依据;或概述产品质量检查分析情况,如检查的范围、时间、地点、参加检查的有关人员、以说明报告的严肃性和可靠性。 2主体 主体部分是质量分析报告的核心。由于企业单位的性质、生产产品或承担的工程项目的不同,其写法有一定的区别,大体上可以分为检查的基本情况、剖析原因和提出建议三部分。 (1)检查的基本情况。主要包括检查的内容、检查的基本方法和检查的结果。检查的内容应当按照《中华人民共和国产品质量法》第三章“生产者、销售者的产品质量责任和义务”规定的内容进行。如果是检查工程质量,检查的内容应按照国务院发布的《建设工程质量管理条例》第二章“建设单位的质量责任”的有关规定进行。
目的:确保药品不良反应报告和监测工作的有效开展,有效控制药品风险,保障公众用药安全,建立药品不良反应组织机构及运行体系。 适用范围:适用于公司药品不良反应报告和监测工作。 责任人:药品不良反应办公室、质量保证部、后勤部、销售公司、科研中心 内容: 1.组织机构简图 2. 体系运行 2.1 信息采集途径 2.1.1 信息采集途径包括被动收集:销售人员、400热线投诉电话,和主动收集:上市前和上市后的临床研究、文献检索、国内外政府网站。 2.1.2 信息采集技巧:第一时间了解:判断事情的严重性。是否停药?是否上报?是否召回? 第一时间控制:控制医生态度,控制患者情绪; 第一时间反馈:及时反馈至ADR管理员或药品不良反应办公室主任; 长期应对准备:掌握我公司产品主要不良反应及质量特性等,并具有一定的ADR判断能力,若不能独立解答患者疑问,切忌给予医疗服务建议,药品不良反应办公室给予支持。 信息收集要全:因其他原因不能全面收集ADR信息,至少收集以上四要素及时反馈至ADR管理员处,协助做好相关沟通工作。 2.2 单个病例管理 2.2.1 单个病例处理流程:收集(多渠道)→报告公司关联性评价→随访→上报ADR监测系统→纳入公司不良反应病例数据库。 2.2.2 出现药品不良反应及出现其他情况均应报告,即使没有伴随具体的不良事件,如: ·说明书已知一般不良反应、严重不良反应和新的不良反应 ·因药品停用而发生的事件 ·超适应症用药 ·孕妇暴露
·药品无效 ·用药错误 ·死亡结局 ·出现未预期的治疗/临床益处 2.2.3 临床试验安全性信息报告 临床试验定义:任何在人体(病人或健康志愿者)进行的药物系统性研究,以证实或揭示试验药物的作用、不良反应或试验药物吸收、分布、代谢和排泄,其目的是确定试验药物的疗效与安全性。 临床试验类别:I、Ⅱ、Ⅲ、IV期临床试验、生物等效性试验、重点监测、一致性评价、临床有效性试验及其他安全与疗效对比研究等。 上报流程: 研究者上报所有不良事件;申办方上报严重不良事件(时限:死亡和危及生命为7天,其他情况15天),以电话、传真或EMS邮寄的形式向CFDA注册司、BFDA注册处及卫计委提交首次报告,及时提交随访报告,并将收集的所有不良事件报告1个工作日内反馈至公司不良反应办公室;不良反应办公室按法规时限要求上报上市后临床研究不良反应,上市前不良反应长期保存,待产品上市后纳入不良反应数据库并带入PSUR中。 2.2.4 个例不良反应/事件评价、上报 2.2.4.1 不良反应/事件类型: 依据《药品不良反应和监测管理办法》对一般的、新的和严重的不良反应的定义,对比说明书中不良反应描述,确定不良反应/事件的类型。 2.2.4.2 不良反应/事件关联性评价: 从时间相关性、药理作用/同类药物反应、去激发、再激发、剂量等方面对不良事件与药品之间关系进行评定。同时考虑的其他因素:原患疾病、相互作用、伴随药物、伴发疾病。时间相关性:用药前、用药过程中或延迟发生不良反应的可能。 2.2.4.3 药理作用/同类药物反应:不良事件发生时间是否与药理/毒理反应一致,同类药物的不良反应。 去激发:停药观察,去激发是否为阳性 再激发:去激发后再次给药观察,再激发是否为阳性。 给药剂量:规定给药剂量与实际给药剂量是否一致。 原患疾病:分析不良事件是否为原患疾病的症状,或治疗适应症的自然进程。 药物相互作用:协同作用、拮抗作用、配伍禁忌。 伴随药物/伴发疾病:是否导致不良事件的发生。 其他因素:是否存在其他风险因素,如吸烟史、饮酒史、过敏史、家族病史及不良反应病史等。
复方氨酚那敏颗粒 质量风险评估报告 报告起草:年月日报告审核:年月日报告批准:年月日 有限公司 二0一三年八月
目录 1.复方氨酚那敏颗粒注册相关信息 (1) 2.复方氨酚那敏颗粒质量风险概述 (1) 3.复方氨酚那敏颗粒质量风险识别 (1) 4.风险分析 (3) 4.1复方氨酚那敏颗粒风险失败模式建立 (3) 4.2复方氨酚那敏颗粒风险分析 (4) 4.2.1人员风险 (4) 4.2.2设备、仪器风险 (5) 4.2.3复方氨酚那敏颗粒用物料风险 (6) 4.2.4复方氨酚那敏颗粒生产操作方法风险 (7) 4.2.5复方氨酚那敏颗粒生产环境风险 (10) 4.2.6复方氨酚那敏颗粒检验(测量)风险 (13) 5.评估总结论与建议 (14) 6.本风险评估依据与资料收集范围 (15)
产品名称:复方氨酚那敏颗粒产品阶段:生产全过程 评估小组成员: 评估日期:
1.复方氨酚那敏颗粒注册相关信息 药品注册基本信息:通用名称:复方氨酚那敏颗粒,规格:每袋装10g,有效期:24个月。批准注册认证信息:取得批件时间:,批件有效期:5年,再注册时间:,批准文号:国药准字,执行标准:国家食品药品监督管理局标准WS-10001-(HD-0256)-2002。 我公司复方氨酚那敏颗粒的工艺规程、质量标准以及包装标签上的信息均按上述信息执行,与注册信息相符合。 2.复方氨酚那敏颗粒质量风险概述 本报告复方氨酚那敏颗粒质量风险进行系统的分析评估,对复方氨酚那敏颗粒涉及的生产过程所有可能出现的风险进行评估,确定重点控制的目标,制定纠正和预防措施,对于高风险和中等风险的没有管理措施的必须确定降低风险的措施,低风险加强生产过程控制,确保产品质量,降低风险发生的可能性,提高可识别性,将风险控制在可接受水平。如果采取风险控制措施和预防措施后风险仍不可接受,应重新制定降低风险的措施和办法。本风险评估资料来源于公司复方氨酚那敏颗粒质量档案,历年生产记录,各种涉及的偏差、变更、验证、工艺规程、质量标准涉及等复方氨酚那敏颗粒生产的全部记录资料。 3、复方氨酚那敏颗粒风险识别 复方氨酚那敏颗粒质量风险的识别用鱼骨图来描述,根据鱼骨图(见下图)逐一展开分析和评价,找出风险点进行控制,把降低风险的措施落实到每个环节。
.word格式, 小学期末考试质量分析报告 五分地总校教导处 2012-2013学年度第二学期小学(1-5年级)期末教学质量检测工作已经结束,这次考试1-5年级由进修校统一出题,各总校组织考试(六年级全旗统考)。本次考试能站在一个宏观的角度,坚持“考”服务于“教”,服务于“学”的原则,强化考试的激励、诊断和反馈功能。对全旗的教育质量作出全面的监控,提高了考试的信度和效度,真正体现了新课程理念,与课程改革相适应,达到了以测导教、以测促教的功能。现对我校(1-5年级)各科成绩做如下分析报告: 一、试卷来源及试卷评价 本次考试由旗进修校统一命题。各科试卷,内容覆盖面广,重点突出,有一定的代表性,试卷题量适中,难易适度,有一定的层次性,较好地体现了《课程标准》的新理念和目标体系,既注重对基础知识的考查,又注重对学生能力的培养,较全面地检查了学生对本学期所学基础知识的掌握情况。 二、考试质量情况(见表)
五分地镇总校2012-2013学年度第二学期小学(1-5年级)教学质量检测成绩分析表 , 专业.专注.
, 专业.专注.
三、本次教学质量检测取得的成效 1、立足基础,恰当评价学生对基础知识和基本技能的理解和掌握。 语文学科大部分学生对拼音、生字、词等基础知识掌握较好,说明任课教师重视基础知识教学,加强训练,反复巩固,常抓不懈。本次考试中学生基础知识的得分率较高,如书写、看拼音写词语、组词、联系上下文选择词语、古诗名言积累等学生都掌握的比较熟练、牢固。 2、关注差异,不同的学生有不同的体验、收获。 将开放题引入试卷,引入教育评价,试题反映的不仅仅是“会”与“不会”、“对”与“错”,也反映对问题理解的深度与广度,为学生提供自己进行思考并用他们自己的观点表达的机会,要求学生建构他们的思维反应而不是选择一个简单的答案,允许学生表达他们对问题的深刻理解。 3、题型灵活多变,体现课改理念。 试题注重学生动手、思维能力的培养,如动手画一画,解决问题等学生的综合能力得到了锻炼。 四、存在的问题及原因 从整个学科考试情况来看,存在问题比较大的是英语和品社学科,主要原因是英语学科师资力量薄弱,教学水平不高,缺少英语教师,一人担任多个班级或不同年级课程;品社学科无专任教师,教师对社会现象缺乏判断能力,导之学生对是非判断模糊。下面以语文、数学两科为例分析:语文学科存在的问题主要有: 1、盲目复习,忽视基本功训练。 学生书写不规范,习作中错别字较多,对易混淆的字,
药品不良反应报告流程 一般的ADR/ADE病例报告流程 发现ADR/ADE病例 填写ADR/ADE报告表 于发现之日起10日内向ADR监测组报送报告表 分类整理报告表 ADR/ADE病例分析评价~签署关联性评价意见 将关联性评将ADR/ADE报告按规定时限 价意见反馈表信息输入ADR上报市ADR 报告者监测组报告表数监测中心 (以书面形式) 据库 新的、严重的ADR/ADE病例报告流程 发现新的、严重的ADR/ADE病 例 立即填写ADR/ADE报告表 于发现之日起7日内向ADR监测组报送报告表 分类整理报告表 组织专家分析评价~签署关联性评价意见 将ADR/ADE报告将关联性评于发现之日 表信息输入ADR价意见反馈起15日内上 监测组报告表数报告者报市ADR监据库 (以书面形式) 测中心 死亡的、群体性的ADR/ADE病例报告流程 发现死亡的、群体性的ADR/ADE病例 立即报告ADR监测组、医务处
立即报告市ADR立即组织核查 监测中心和行政主管部门及时填写报告表 及时向ADR监测组报送报告表 及时分类整理报告表 及时填写报告表 及时组织专家分析评价~ 签署关联性评价意见 将ADR/ADE报告将关联性评及时报告市表信息输入ADR价意见反馈ADR监测中 监测组报告表数报告者心 据库 (以书面形式) 下面是诗情画意的句子欣赏,不需要的朋友可以编辑删除!! 谢谢!!!!! 1. 染火枫林,琼壶歌月,长歌倚楼。岁岁年年,花前月下,一尊芳酒。水落红莲,唯闻玉磬,但此情依旧。 2. 玉竹曾记凤凰游,人不见,水空流。 3. 他微笑着,在岁月的流失中毁掉自己。
4. 还能不动声色饮茶,踏碎这一场,盛世烟花。 5. 红尘嚣浮华一世转瞬空。 6. 我不是我你转身一走苏州里的不是我。 7. 几段唏嘘几世悲欢可笑我命由我不由天。 8. 经流年梦回曲水边看烟花绽出月圆。 9. 人生在世,恍若白驹过膝,忽然而已。然,我长活一世,却能记住你说的每一话。 10. 雾散,梦醒,我终于看见真实,那是千帆过尽的沉寂。 11. 纸张有些破旧,有些模糊。可每一笔勾勒,每一抹痕迹,似乎都记载着跨越千年万载的思念。 12. 生生的两端,我们彼此站成了岸。 13. 缘聚缘散缘如水,背负万丈尘寰,只为一句,等待下一次相逢。 14. 握住苍老,禁锢了时空,一下子到了地老天荒 15. 人永远看不破的镜花水月,不过我指间烟云世间千年,如我一瞬。 16. 相逢一醉是前缘,风雨散,飘然何处。 17. 虚幻大千两茫茫,一邂逅,终难忘。相逢主人留一笑,不相识,又何妨。 18. 天下风云出我辈,一入江湖岁月催;皇图霸业谈笑间,不胜人生一场醉。 19. 得即高歌失即休,多愁多恨亦悠悠,今朝有酒今朝醉,明日愁来明日愁。 20. 直道相思了无益,未妨惆怅是清狂。 21. 看那天地日月,恒静无言;青山长河,世代绵延;就像在我心中,你从未离去,也从未改变。 22. 就这样吧,从此山水不相逢。 23. 人天自两空,何相忘,何笑何惊人。
质量分析报告格式 以下是关于质量分析报告格式,希望内容对您有帮助,感谢您得阅读。 质量分析报告格式 质量分析报告一般由五部分组成:标题、主送单位、正文、附件和签署。 (一)标题 质量分析报告的标题有以下三种写法: 二是内容全备课标、备教材、备教法;三是格式全备课必须有目标、教学重点、教学难点、教学方法、教学程序、教学反思。 2、把力量放在课内教师每堂课尽可能做到优质高效,必须遵循以下原则:(1)必须明确教学目标;(2)必须让学生参与教学活动;(3)必须当堂检查、反馈和巩固。 学校对课堂教学质量的管理方法是:推门观课、不打招呼,听后个别交流意见,提出要求和建议。学校领导组成员每学期听课不少于30节,教师每学期不少于20节。每位教师每学期公开课不少于两节。且听课要有评议,共同研究讨论教学改革的经验和做法。 3、把补困加在课后在教学过程中,要求所有学生完全掌 ·
握所学知识是不现实的,要求教师不放弃任何一个学生。不仅要帮助学生解决学习上的疑难问题,而且更要帮助学生解决思想问题。具体采取以下措施:(1)、建立后进生成长档案;(2)、任课教师必须对后进生做到心中有数,教学时分层教学,调动后进生学习积极性;(3)、教师利用课余时间对后进生进行个别指导,填写辅导纪录;(4)、经常与后进生谈心交流并经常与家长联系,争取家长支持,鼓励他们克服心理障碍,只要有进步就给予肯定和鼓励。 4、精选课堂教学例题、习题、作业题教师要关注“双基”,认真吃透教材与课标,确保教学有目标、有重点、有方法、有效果。习题和作业题做到精选精改,注重效率。 5、加强过程管理对教师的教育教学除了月检查外,加强对个别青年教师不安心教学的管理,采取分阶段、有重点有针对性地转变思想,提高其业务能力。方法为:一听(听课堂教学)二看(看教学设计、作业批改)三座谈问卷(开座谈会、满意度测评)四总结提高(在上述基础上,指导其总结成功经验,指出其教学中存在的问题并提出改进措施和意见)。全面解决“教”和“学”之间存在的实际问题,保证学校教学秩序正常,有培养全体学生严谨、认真、一丝不苟的教学作风,加强课堂教学管理。 (三)加大对后进生的转化力度,提高整体成绩 ·