
一、概要
在静态基因组碱基测序完成之后,系统生物学已经进入了后基因组学时代,蛋白质组学等功能基因学和代谢组学的研究目前已成为系统生物学研究的重点。蛋白质组学研究是生命科学研究进入后基因组时代的里程碑,同时也是功能基因组时代生命科学研究的核心内容之一,而代谢组学的研究越来越多,在发现生物标志物方面发挥了重要作用。
二、蛋白质组学介绍
蛋白质组学(Proteomics)是从整体水平上研究细胞内蛋白质的组成、活动规律及蛋白质与蛋白质的相互作用,是功能基因组学时代一门新的学科。目前蛋白质组学的研究主要有两条路线:一是基于双向电泳的蛋白质组学;二是基于质谱的蛋白质组学。目前基于质谱的蛋白质组学研究也越来越广泛。
定量蛋白质组
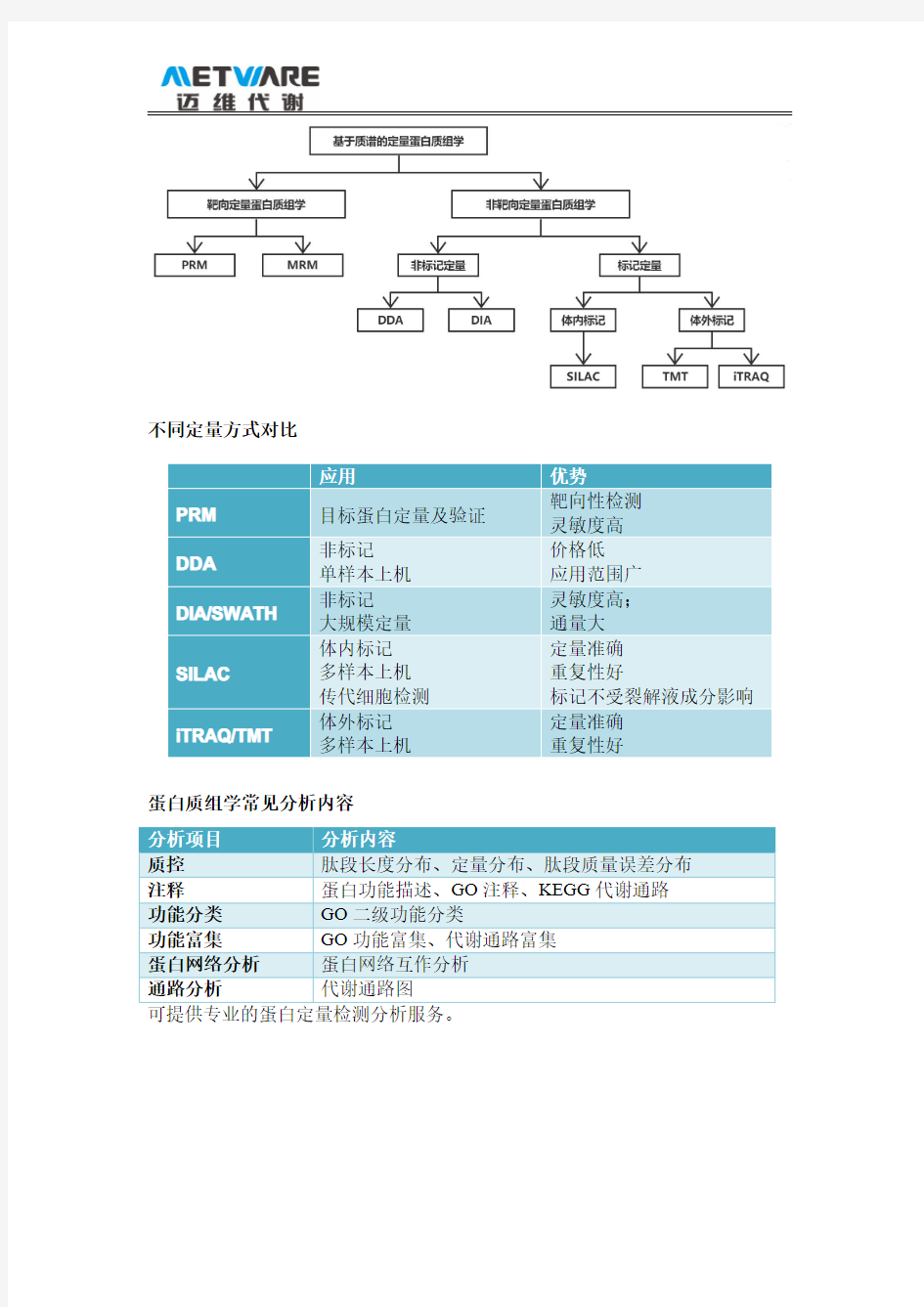
根据是否对目标蛋白进行定量,基于质谱的蛋白质组学定量技术可分为非靶向定量蛋白质组学(Untargeted quantitative proteomics)和靶向定量蛋白质组学(Targeted quantitative proteomics),其中靶向定量技术包括多重反应监测技术(Multiple reaction monitoring,MRM)和平行反应监测(Parallel reaction monitoring,PRM),非靶向定量技术包括非标记定量和稳定同位素标记定量,稳定同位素标记又可分为多种模式,最值得关注的是等重同位素标记相对和绝对定量(Isobaric tags for relative and absolute quantitation,iTRAQ)和串联质量标签(Tandem mass tags,TMT)技术。目前质谱定量技术主要采取数据依赖采集模式(Data dependent analysis,DDA),新发展的数据非依赖采集模式(Data independent analysis,DIA)。DIA具有更好的分析准确度和动态范围,也值得重点关注。
不同定量方式对比应用
优势PRM
目标蛋白定量及验证靶向性检测灵敏度高DDA
非标记单样本上机价格低应用范围广DIA/SWATH
非标记大规模定量灵敏度高;通量大SILAC
体内标记多样本上机传代细胞检测定量准确重复性好标记不受裂解液成分影响iTRAQ/TMT 体外标记
多样本上机定量准确重复性好
蛋白质组学常见分析内容
分析项目分析内容
质控肽段长度分布、定量分布、肽段质量误差分布
注释蛋白功能描述、GO 注释、KEGG 代谢通路
功能分类
GO 二级功能分类功能富集
GO 功能富集、代谢通路富集蛋白网络分析蛋白网络互作分析
通路分析代谢通路图
进行定量的测定,鉴定疾病、药物对生命过程的影响,以及解释基因表达调控的机制。通过对正常个体及病理个体间的蛋白质组比较分析,我们可以找到某些“疾病特异性的蛋白质分子”,它们可成为新药物设计的分子靶点,或者也会为疾病的早期诊断提供分子标志。
三、代谢组介绍
代谢组是指在某个时间点上一个细胞所有代谢物的集合,尤其指在不同代谢过程中充当底物和产物的小分子物质,如脂质、糖、氨基酸等,可以解释取样时该细胞的生理状态。代谢组学技术已广泛应用于生物学和医学相关的各个领域,如疾病诊断,发病机制研究,中医药现代化,药物毒理及安全评价,植物,微生物,环境、营养等研究。常用的代谢组学研究内容如下图所示。
四、联合分析
蛋白组告诉你已经发生什么(What actually happen),而代谢组学则告诉你什么确实发生了(What happened),二者互为因果。目前关于蛋白质组学和代谢组学整合分析的思路非常多,最常见的就是基于同一条KEGG通路的数据整合,通过对正常个体及病理个体间的蛋白质组比较分析,我们可以找到参与某条重要的代谢通路的差异表达的蛋白质,同时,在代谢组学分析结果中,我们需要重点关注该通路中代谢物的变化关系,基于该KEGG通路查找各种文献资料,进一步探讨代谢物的改变是否是由蛋白质的变化所引起。通过KEGG代谢通路将蛋
中发生显著性变化的蛋白质和代谢物,快速锁定关键蛋白和关键代谢物。
可免费提供蛋白质组+代谢组联合分析服务。
迈维代谢于2015年成立于武汉国家生物产业基地——光谷生物城生物创新园,是中国代谢组领域的知名企业,专注于创新代谢组技术在生命科学研究与医学健康两大领域的应用,创造性开发了以“广泛靶向”专利技术为核心的高通量、超灵敏、广覆盖代谢组技术平台,建立了含有5000多种代谢物的专属数据库,搭建了基于代谢组的多组学数据整合分析流程,相关技术成果近年来在Cell、Nature Genetics、Nature Communications、PNAS等国际学术期刊发表,并应邀在国际代谢组学年会、国际动植物基因组大会、全国罕见病大会、中药生物技术学会等会议作大会报告,引领代谢组学发展新方向。
蛋白质组学研究方法选择及比较 目前研究蛋白组学的主要方法有蛋白质芯片及质谱法,本文将从多方面对两种研究方法进行了解与比较; 蛋白质芯片(Protein Array) 将大量不同的蛋白质有序地排列、固定于固相载体表面,形成微阵列。利用蛋白质分子间特异性结合的原理,实现对生物蛋白质分子精准、快速、高通量的检测。 主要类型: ●夹心法芯片(Sandwich-based Array) ●标记法芯片(Label-based Array) ●定量芯片(Quantitative Array) ●半定量芯片(Semi-Quantitative Array) 质谱(Mass Spectrometry) 用电场和磁场将运动的离子按它们的质荷比分离后进行检测,测出离子准确质量并确定离子的化合物组成,即通过对样品离子质荷比的分析而实现对样品进行定性和定量的一种方法。 主要类型:
●二维电泳+质谱(2D/Mass Spectrometry, MS) ●表面增强激光解吸电离飞行时间质谱(Surface-enhanced laser desorption/ionization- time of flight, SELDI) ●同位素标记相对和绝对定量(Isobaric tags for relative and absolute quantitation, iTRAQ) Protein Array or Mass Spectrometry? 如何选择合适的研究方法?以下将从六个方面进行比较与推荐: 1.筛查蛋白组学表达差异 建议选择:RayBiotech(1000个因子的芯片)+质谱 a)不同的方法学有不同的特点:对于质谱,可以筛查到未知的蛋白,但是对于分子量大、 低丰度的蛋白质,质谱的灵敏度和准确性有一定的限制。 b)不同的方法能筛查到的目标不同:根据Proteome Analysis of Human Aqueous Humor 一文中报道,质谱筛查到的差异蛋白集中在小分子与代谢物。而用RayBiotech芯片筛查到的结果,多是集中在细胞因子、趋化、血管、生长等等。 c)质谱筛查到355个蛋白,而RayBiotech抗体芯片也筛查到328个蛋白,且用定量芯片 验证25个蛋白有差异,这些蛋白是质谱找不到的。目前RayBiotech夹心法抗体芯片已经可以检测到1000个蛋白,采用双抗夹心法,尤其是对于低丰度蛋白,有很好的灵敏度和特异性,很多的低丰度蛋白是抗体芯片可以检测出来,而质谱检测不到的,且样品不经过变性和前处理,保持天然状态的样品直接检测,对于蛋白的检测准确度高。 d)质谱的重复性一直是质谱工作者纠结的问题,不同操作者的结果,不同样品处理条件, 峰值的偏移等影响因素都会产生大的影响;RayBiotech的夹心法芯片重复性高。
1,基因组:一个细胞或病毒所包含的全部基因。 2,蛋白质组(Proteome)的概念最先由Marc Wilkins提出。定义:蛋白质组是由一个细胞,一个组织或一个机体的基因组所表达的全部相应的蛋白质。是一个整体概念。 3,蛋白质组学:是一门以全面的蛋白质性质研究(如表达水平、转录修饰、相互作用等)为基础,在蛋白质水平对疾 病机理、细胞模式、功能联系等方面进行探索的科学,包括表达蛋白质组学,细胞谱蛋白质组学以 3,等电聚焦:分离两性分子,特别是分离蛋白质的一种技术。根据在一个电场的影响下这些两性分子在ph梯度上的分布情况进行分离 等电聚焦技术:在一个pH梯度和外加电场下,蛋白质有移向pH梯度中使其净电荷为零的点的倾向。(带正电荷移向阴极,带负电荷移向阳极)。IEF可以基于极微小的电荷差异而分离蛋白,具有高分辨率。4,负染就是用重金属盐(如磷钨酸、醋酸双氧铀)对铺展在载网上的样品进行染色;吸去染料,样品干燥后,样品凹陷处铺了一薄层重金属盐,而凸的出地方则没有染料沉积,从而出现负染效果(图2-15),分辨力可达1.5nm左右 5,质谱(又叫质谱法)是一种与光谱并列的谱学方法,通常意义上是指广泛应用于各个学科领域中通过制备、分离、检测气相离子来鉴定化合物的一种专门技术。 质谱分析是一种测量离子荷质比(电荷-质量比)的分析方法,其基本原理是使试样中各组分在离子源中发生电离,生成不同荷质比的带正电荷的离子,经加速电场的作用,形成离子束,进入质量分析器。在质量分析器中,再利用电场和磁场使发生相反的速度色散,将它们分别聚焦而得到质谱图,从而确定其质量。 7,分子离子峰:子受电子束轰击后失去一个电子而生成的离子M+成为分子离子。在质谱图中,由M+所形成的峰称为分子离子峰。 7.碎片离子峰当电子轰击的能量超过分子离子电离所需要的能量(50~70eV)时,可能使分子离子的化 学键进一步断裂,产生质量数较低的碎片,称为碎片离子。在质谱图上出现相应的峰,称为碎片离子峰。 碎片离子峰在质谱图上位于分子离子峰的左侧。研究最大丰度的离子断裂过程,能提供被分析化合物的结构信息。 8.软电离技术在质谱分析中,离子源是将分子离解成离子或解离成碎片,在这里分子失去电子, 生成带正电荷的分子离子。分子离子可进一步裂解,生成质量更小的碎片离子。由于离子化所需要的能量随分子不同差异很大,因此,对于不同的分子应选择不同的离解方法。通常称能给样品较大能量的电离方法为硬电离方法,而给样品较小能量的电离方法为软电离方法,后一种方法适用于易破裂或易电离的样品。 9.源内衰变技术(insource-decay,ISD)源内衰变发生在离子源区域内,时间为激光撞击之后几 百纳秒之内,是离子的“即可片段化”。这些片段离子通过衰减离子取出,能在线性飞行时间质谱中被发现,许多蛋白质和大的肽常在MOLDI-TOF-MS的离子源区域内变成肽离子片段。主要产生含N端的b型和含C端的y型片段离子,通过分析这些片段离子谱可鉴定蛋白质。 10.肽质量指纹图谱是指蛋白质被酶切位点专一的蛋白酶水解后得到的肽片段质量图谱。由于 每种蛋白质的氨基酸序列都不同,蛋白质被酶水解后,产生的肽片段序列也各不相同,其肽混合物质量数据也具特征性,这种特征就像指纹一样,所以称为指纹谱。肽质量指纹图谱可用于蛋白质的鉴定,用实验测得的PMF与蛋白数据库中的蛋白质理论PMF比对,就可以鉴定该蛋白质 肽序列标签是由一个多肽的部分氨基酸序列和该肽的质量以及该肽未测序部分的质量等组成。
蛋白质化学思考题总汇 绪论 基因组,蛋白质组,功能基因组 为什么从基因组到蛋白质组是一个十分复杂而漫长的过程? 蛋白质一级结构 1、各种氨基酸的三字母符合和单字母符合。 2、名词概念:同源蛋白质、趋异突变、趋同、变异、蛋白质家族、蛋白质超家族、蛋白质、亚家族、单位进化周期、中性突变、蛋白质的一级结构。 3、各种氨基酸的性质与蛋白质空间结构的关系. 蛋白质的空间结构 1、名词及符号:蛋白质构象、蛋白质二级结构、超二级结构、三级结构、四级结构、结构域、连接条带、无规卷曲、无序结构、α-螺旋、β-折叠、β-转角、EF-手、3.6 13螺旋、HTH、HLH、b-Zip、motif、Zn指、domain、 2、稳定球蛋白构象有哪些的化学键. 3、二级结构的类型有哪些? 4、举例说明5种motif的结构特征。 蛋白质的分离纯化 1.透析、超滤、盐溶、盐析、亲和层析、电泳。 2.如何理解分子筛分离pr的原理。 3.有机溶剂分级分离pr的基本原理。 4.据支持物不同,电泳可分为哪几种类型? 5.常用的选择性吸附剂有哪几种? 6.哪些物质可作用蛋白质亲和层析的配体? 7.测定pr分子量有哪些方法? 8.如何理解蛋白质电泳中的浓缩效应,电荷效应及分子筛效应。 9.聚焦法测定pr、pI的基本原理。 10.可用哪些方法来分要蛋白质的N-末端和C-末端AA。
蛋白质转运和修饰 1、名词及符号:翻译同步转运、翻译后转运、信号肽、易位子、SRP、I、II型膜蛋白、内部信号序列、分子伴侣、hsp70、内体、靶向序列、靶向班块、网格蛋白、包被体、停靠蛋白、PDI、ARF、COP、内质网分拣信号(KDEL)、核定位信号(PKKKRKV)、过氧化体分拣信号(SKF)、线粒体基质信号(N-端15-35AA形成两亲a螺旋或b折叠)、溶酶体分拣信号(M6P)、泛蛋白。 2、蛋白质的修饰包括哪些内容。 3、决定蛋白质半衰期的因素及泛素化作用。 4、受体介导的内化的生物学意义。 5、简述翻译同步转运和翻译后转运的基本内容。 6、如何理解小泡介导的蛋白质转运的“生物膜不对称性”的意义。 7、简述SRP介导的蛋白质转运。 免疫球蛋白 1、Ig, V区,C区,抗原决定族,D基因,J基因,超变区(补体决定区,CDR),类别转换(CH启换),12-23bp规则,茎环结构,Fab,Fc,去环缺失模式,Ig的分类与重链。 2、描述Ig四链单位的分子特征(结构域,功能域)。 3、如何根据Ig分子的V区和C区的结构变化,将Ig分子的变异体分成类、亚类、型、亚型、群和亚群。 4、如何从基因水平上解释Ig的多样性。 脂蛋白 1、名词及符号: LP,Apo,TG,FC,PL,CM,VLDL,LDL,HDL,IDL,HL,LPL,LCAT,LTP;郭清作用,增加调节。 2、简述一种脂蛋白受体的分子结构特征。 3、主要脂蛋白的密度分类、电泳分类、功能及缩写符号间的关系。 4、Apo可分哪些大类。 5、CM,VLDL,LDL,HDL代谢的基本情况及其相互关系 细胞黏附分子 1、名词及符号:ECM、Fn、Ln、FAK、TPK、SH、Ln-R、CD44,Ig-SF;血管地址素、整联蛋白、层连蛋白、钙粘蛋白、粘着班激酶、酪氨酸蛋白激酶、纤连蛋白。
蛋白质组学研究的完整解决方案 人体内真正发挥作用的是蛋白质,蛋白质扮演着构筑生命大厦的“砖块”角色,随着破译生命密码的人类基因组计划进入尾声,一个以蛋白质和药物基因学为研究重点的后基因组时代已经拉开序幕,蛋白质将是今后的重点研究方向之一。然而,蛋白质的分离和鉴定非常费时,目前测定蛋白质的技术远远落后于破译基因组的工具,最好的实验室每天只能分离和识别出100种蛋白质。据估计,人体内可能有几十万种蛋白质,这大概需要10年时间进行识别。 为了加快蛋白质组学研究进程,以专业生产蛋白质组学研究设备而著称的美国Genomic Solution Inc.公司开发了完整的蛋白质组学解决方案,由一系列机械手臂与软件,并结合了二维电泳实验设备与质谱仪,可以进行高效、自动化且具重复性的试验分析。在Genomic solution值得信赖的技术平台上,你的研究工作将更富成效,重复性更好。在这一整套Investigator平台上,各仪器之间配合无隙,由于它的整合性及标准性,使得研究进程大大加快,原来需要9—12个月才能获得数据结果发表的时间减少到9—12周。这套完整的系统具备蛋白质组研究所需的众多功能:2-D电泳、图像获取、2-D胶分析、蛋白样品切割、蛋白消化、MALDI样品准备、消化及点样、数据分析整合,再加上制备好的胶、试剂及附件,使研究工作可以立即展开。此套设备为进行蛋白质组学研究的利器,大大加速了蛋白质分离和鉴定的速度。该系统主要由以下几部分组成: 一、2-D电泳系统(Investigator? 2-D Electophoresis System) 该系统主要进行2D PAGE第一向等电聚焦凝胶电泳和第二向SDS-PAGE电泳,设备包括2-D电泳系统所需的各种设备,如pHaser?(IPG胶条电泳)、管状制胶设备、二维电泳装置、电源设备、半导体冷却器及各种相关的蛋白纯化试剂盒。 产品特征: * 提供2D PAGE电泳所需的各种设备,使电泳更加简便,大大节约研究时间 * 高分辨率:有效的第一向等电聚焦凝胶电泳和23cm X 23cm第二向SDS-PAGE大面积板胶提供清晰的电泳图像,有效提高单体、磷酸化和糖基化蛋白的分离 * 大容量:可同时容纳15块1mm一维管状胶,或8块2-3mm管状胶;10块IPG胶条和10块二维电泳板胶 * 灵活性:该系统用于管状胶、IPG 胶条、预制胶、自制胶和SDS PAGE胶使用 * 恒温:高效的半导体制冷装置保证电泳体系温度恒定,温度变化< 0.5℃ * 专门为高分辨率2D PAGE而设计的电源系统 * 提供超纯的相关化学试剂和药品
生化实验讲义思考题参考答案 实验一淀粉的提取和水解 1、实验材料的选择依据是什么? 答:生化实验的材料选择原则是含量高、来源丰富、制备工艺简单、成本低。从科研工作的角度选材,还应当注意具体的情况,如植物的季节性、地理位置和生长环境等,动物材料要注意其年龄、性别、营养状况、遗传素质和生理状态等,微生物材料要注意菌种的代数和培养基成分的差异等。 2、材料的破碎方法有哪些? 答:(1) 机械的方法:包括研磨法、组织捣碎法; (2) 物理法:包括冻融法、超声波处理法、压榨法、冷然交替法等; (3) 化学与生物化学方法:包括溶胀法、酶解法、有机溶剂处理法等。 实验二总糖与还原糖的测定 1、碱性铜试剂法测定还原糖是直接滴定还是间接滴定?两种滴定方法各有何优缺点? 答: 我们采用的是碱性铜试剂法中的间接法测定还原糖的含量。间接法的优点是操作简便、反应条件温和,缺点是在生成单质碘和转移反应产物的过程中容易引入误差;直接法的优点是反应原理直观易懂,缺点是操作较复杂,条件剧烈,不易控制。 实验五粗脂肪的定量测定─索氏提取法 (1)本实验制备得到的是粗脂肪,若要制备单一组分的脂类成分,可用什么方法进一步处理? 答:硅胶柱层析,高效液相色谱,气相色谱等。 (2)本实验样品制备时烘干为什么要避免过热? 答:防止脂质被氧化。 实验六蛋白质等电点测定 1、在等电点时蛋白质溶解度为什么最低? 请结合你的实验结果和蛋白质的胶体性质加以说明。
蛋白质是两性电解质,在等电点时分子所带净电荷为零,分子间因碰撞而聚沉倾向增加,溶液的粘度、渗透压减到最低,溶解度最低。结果中pH约为4.9时,溶液最浑浊,达到等电点。 答: 2、在分离蛋白质的时候,等电点有何实际应用价值? 答: 在等电点时,蛋白质分子与分子间因碰撞而引起聚沉的倾向增加,所以处于等电点的蛋白质最容易沉淀。在分离蛋白质的时候,可以根据待分离的蛋白质的等电点,有目的地调节溶液的pH使该蛋白质沉淀下来,从而与其他处于溶液状态的杂质蛋白质分离。 实验七氨基酸的分离鉴定-纸层析法 1、如何用纸层析对氨基酸进行定性和定量的测定? 答: 将标准的已知氨基酸与待测的未知氨基酸在同一张层析纸上进行纸层析,显色后根据斑点的Rf值,就可以对氨基酸进行初步的定性,因为同一个物质在同一条件下有相同的Rf 值;将点样的未知氨基酸溶液和标准氨基酸溶液的体积恒定,根据显色后的氨基酸斑点的面积与点样的氨基酸质量成正比的原理,通过计算斑点的面积可以对氨基酸溶液进行定量测定。 3、纸层析、柱层析、薄层层析、高效液相层析各有什么特点? 答:
进展评述 比较蛋白质组学研究中的稳定同位素标记技术 刘新1,2 应万涛1,2 钱小红1,23 (1军事医学科学院放射与辐射医学研究所 北京 100850;2北京蛋白质组研究中心 北京 102206) 摘 要 比较蛋白质组学是指在蛋白质组学水平上研究正常和病理情况下细胞或组织中蛋白质表达变化,以期发现具有重要功能的生物标识物,为疾病的早期诊断提供依据。近年来它正成为蛋白质组学研究的热点和发展趋势。比较蛋白质组学的研究方法和策略有多种,本文就最近几年来稳定同位素标记技术(体内代谢标记技术和体外化学标记技术)在比较蛋白质组学研究中的进展进行综述。 关键词 比较蛋白质组学 稳定同位素标记 体内代谢标记 体外化学标记 Application of Stable Isotope Labeling in Comparative Proteomics Liu X in1,2,Y ing Wantao1,2,Qian X iaohong1,23 (1Beijing Institute of Radiation Medicine,Beijing100850; 2Beijing Proteome Research Center,Beijing102206) Abstract C omparative proteomics is the research of protein expression changing between normal and pathological cell or tissue on the proteome level.P otential biomarkers w ould be discovered from the research by comparative proteomics, which will be helpful to the diagnosis and therapy of diseases.In the recent years,it has been becoming the hot spot of the proteomics research and many strategies used in comparative proteomics have been developed.During those approaches,the strategies based on stable is otopic labeling coupled with mass spectrometry have been extensively used and lots of success ful applications have been reported.In contrast to the traditional radioactive is otope labeling method,stable is otope labeling technique was not radioactive and the operation is simple.Metabolic labeling in viv o and chemical labeling in vitro are tw o parts of stable is otope labeling technique,which both have various advantages and disadvantages.This paper reviewed the progress of stable is otope labeling technique in comparative proteomics. K ey w ords C omparative proteomics,S table is otope labeling,Metabolic labeling in viv o,Chemical labeling in vitro 随着人类基因组精确图谱的公布,基因组功能的阐明已经成为生命科学研究中一项极重要的任务[1]。蛋白质是基因的最终产物同时也是基因功能的最终执行体,因而人类基因的表达及其功能有待于在蛋白水平上揭示。蛋白质组学的研究目的是分离和鉴定组织或细胞中的所有蛋白质。生物体在生长发育过程中,基因组是相对稳定的,而蛋白表达是高度动态变化的,并且具有严格调控的时间和空间特异性[2]。为了研究生物体在不同状态下表达的所有蛋白质的动态变化,比较蛋白质组学应运而生,即在蛋白组学水平上,研究在正常生理和病理状态,或受到不同的外部环境刺激下,或在突变等因素影响下,蛋白质表达的变化情况,以期发现生物体内关键的调控分子及与疾病相关的蛋白质标志物,最终为疾病的防诊治、新型疫苗的研发等提供理论依据。 为了研究蛋白质表达的动态变化,基因表达检测技术,如微阵列法[3]、DNA(脱氧核糖核酸)芯片法[4]等曾被广泛使用。这些方法虽然能够实现对mRNA(信使核糖核酸)进行定性和定量分析,但 刘新 男,27岁,博士生,现从事比较蛋白质组学研究。 3联系人,E2mail:qianxh1@https://www.doczj.com/doc/e22228835.html, 国家自然科学基金(20505019、20505018)、国家重点基础研究发展规划项目(2004C B518707)和北京市科技计划重大项目(H030230280190)资助项目 2006207220收稿,2006209221接受
蛋白质组学相关试题及答案 解释 1. Proteome(蛋白质组):由一个细胞或者组织的基因组所表达的全部相应的蛋白质,称为蛋白质组。 2. Proteomics(蛋白质组学):指应用各种技术手段来研究蛋白质组的一门新兴学科,即研究细胞在不同生理或病理条件下蛋白质表达的异同,对相关蛋白质进行分类和鉴定。更重要的是蛋白质组学的研究要分析蛋白质间相互作用和蛋白质的功能. 3. Mass Spectrometer(质谱仪):质谱仪是一个用来测量单个分子质量的仪器,但实际上质谱仪提供的是分子的质量与电荷比(m/z or m/e)。分离和检测不同同位素的仪器。即根据带电粒子在电磁场中能够偏转的原理,按物质原子、分子或分子碎片的质量差异进行分离和检测物质组成的一类仪器。质谱仪最重要的应用是分离同位素并测定它们的原子质量及相对丰度。 4. Proteome sample holographic preparation(蛋白组样品的全息制备):(1)keep protein information (2)adapted to separation and identification methods (3)different samples,different extraction. 蛋白质样品制备是蛋白质组研究的第一步,也是最关键的一步。因为这一步会影响蛋白质产量、生物学活性、结构完整性。因此要用最小的力量使细胞达到最大破坏程度同时保持蛋白质的完整性。原则是,保持蛋白质的所有信息;选择合适的分离和鉴定方法;对于不同的样品要用不同的提取方法。 5. Post translational modification(蛋白质翻译后修饰) 肽链合成的结束,并不一定意味着具有正常生理功能的蛋白质分子已经生成。已知很多蛋白质在肽链合成后还需经过一定的加工(processing)或修饰,由几条肽链构成的蛋白质和带有辅基的蛋白质,其各个亚单位必须互相聚合才能成为完整的蛋白质分子。 6. De novo sequencing(从头测序) 从头测序为蛋白质组研究提供了一种不用借助于任何蛋白质序列数据库信息,直接解读串联质谱数据的方法。其基本算法主要由4个部分组成:质谱图的构建、
2013——2014第一学期蛋白质组学试题 一名词解释(6分题,共30分) 1. 基因组:生物细胞中的全部基因。 蛋白质组:生物细胞中由全套基因编码控制的蛋白质 2. 基因组学:是研究生物基因组和如何利用基因的一门学问。提供基因组信息以及相关数据系统利用,试图解决生物,医学,和工业领域的重大问题。 蛋白质组学:研究蛋白质组中蛋白质表达与功能变化的科学。可视为分子生物学的大规模筛选技术,目的在于归类细胞中的蛋白质的整体分布,鉴定并分析感兴趣的个别蛋白,最终阐明它们的关系与功能。 3. 质谱:被分析样品经离子化,成为分子离子及其碎片,后利用离子在电场或磁场中的运动性质,把离子按其质量与所带电荷比(m/z)的大小依次排列并记录下来成为质量波谱,称为质谱。 质谱分析:是通过对样品分子的离子质量和强度进行测定来分析样品成分和结构的一种分析方法。 4. MALDI与ESI MALDI:即基质辅助激光解吸电离,在波长为775-1250nm的真空紫外光辐射下光致电离和解吸作用使生物分子电离为分子离子和含有结构信息的碎片。 ESI:即电喷雾电离,采用强静电场(3-5kV),以喷雾形式使液体样品形成高度荷电的雾状小液滴,小液滴经过反复的溶剂挥发-液
滴分裂后,产生多种质子化离子。 两者均属于软电离技术。 5. SDS-PAGE:聚丙烯酰胺凝胶电泳(PAGE),在聚丙烯酰胺凝胶系统中加入十二烷基硫酸钠(SDS)构成SDS-PAGE系统用于分离蛋白质,蛋白电泳迁移率取决于其分子量,而与形状及所带电荷无关。 2-D:即双向凝胶电泳,根据蛋白质的等电点和分子质量的差异使之在二相平面上分开 是目前使用最广泛的蛋白质组学分离技术。 二简答题(6分题,共30分) 1 简述CHIP技术的原理 被剪切,与所研究蛋白相关的DNA片断被选择性免疫沉淀;相关DNA 片断被纯化,顺序被测定。 2 简述ICAT技术的原理 ICATS是一种蛋白质组学定量研究常见方法,ICAT试剂结构,包括3个部分,SH反应集团, biotin标签,同位素 其原理是来源不同处理的蛋白质分别用重型ICAT试剂和轻型ICAT试剂标记,标记后等量混合,胰蛋白酶酶切,亲和纯化得到ICAT标记的多肽,质谱分析,依据MS质谱峰图强度进行定量,MS/MS鉴定肽段。
第一章绪论 DNA 重组技术和基因工程技术。 DNA 重组技术又称基因工程技术,目的是将不同DNA 片段(基因或基因的一部分)按照人们的设计定向连接起来,在特定的受体细胞中与载体同时复制并得到表达,产生影响受体细胞的新的遗传性状。 DNA 重组技术是核酸化学、蛋白质化学、酶工程及微生物学、遗传学、细胞学长期深入研究的结晶,而限制性内切酶DNA连接酶及其他工具酶的发现与应用则是这一技术得以建立的关键。DNA重组技术有着广泛的应用前景。首先,DNA重组技术可以用于大量生产某些在正常细胞代谢中产量很低的多肽,如激素、抗生素、酶类及抗体,提高产量,降低成本。其次,DNA 重组技术可以用于定向改造某些生物的基因结构,使他们所具有的特殊经济价值或功能成百上千倍的提高。 请简述现代分子生物学的研究内容。 1、DNA 重组技术(基因工程) 2、基因表达调控(核酸生物学) 3、生物大分子结构功能(结构分子生物学) 4、基因组、功能基因组与生物信息学研究 第二章遗传的物质基础及基因与基因组结构 核小体、DNA 的半保留复制、转座子。核小体是染色质的基本结构单位。是由H2A、 H2B、H3、H4各两分子生成八聚体和由大约200bp 的DNA 构成的。核小体的形成是染色体中DNA 压缩的第一步。 DNA 在复制过程中,每条链分别作为模板合成新链,产生互补的两条链。这样新形成的两个DNA 分子与原来DNA 分子的碱基顺序完全一样。因此,每个子代分子的一条链来自亲代DNA,另一条链则是新合成的,这种复制方式被称为DNA 的半保留复制。 转座子是存在染色体DNA上的可自主复制和移位的基本单位。转座子分为两大类:插入序列和复合型转座子。 DNA 的一、二、三级结构特征。 DNA 的一级结构是指4 种脱氧核苷酸的连接及其排列顺序,表示了该DNA 分子的化学构成。DNA 的二级结构是指两条多核苷酸链反向平行盘绕所生成的双螺旋结构。分为左手螺旋和右手螺旋。 DNA 的高级结构是指DNA 双螺旋进一步扭曲盘绕所形成的特定空间结构。超螺旋结构是DNA 高级结构的主要形式,可分为正超螺旋与负超螺旋两大类。 DNA 复制通常采取哪些方式? 1、线性DNA双链的复制:复制经过起始、延伸、终止和分离三个阶段。复制是从5'端向3' 端移动,前导链的合成是连续的,后随链通过冈崎片段连接成完整链。 2、环状DNA 双链的复制 (1)θ型:是一种双向复制方式。复制的起始点涉及DNA 的结旋和松开,形成两个方向相反的复制叉,复制从定点开始双向等速进行。 (2)滚环型:是单向复制的一种特殊方式,发生在噬菌体DNA 和细菌质粒上,首先对正链原点进行专一性的切割,形成的5'端被单链结合蛋白所覆盖,3'端在DNA聚合酶的作用下不断延伸。
第35卷 第1期2011年1月 南京林业大学学报(自然科学版) J o u r n a l o f N a n j i n g F o r e s t r y U n i v e r s i t y (N a t u r a l S c i e n c e E d i t i o n ) V o l .35,N o .1 J a n .,2011 h t t p ://w w w .n l d x b .c o m [d o i :10.3969/j .i s s n .1000-2006.2011.01.024] 收稿日期:2009-12-31 修回日期:2010-10-26 基金项目:国家自然科学基金项目(31000287);江苏省高校自然科学基础研究项目(10K J B 220002) 作者简介:甄艳(1976—),副教授,博士。*施季森(通信作者),教授。E -m a i l :j s h i @n j f u .e d u .c n 。 引文格式:甄艳,施季森.质谱技术在蛋白质组学研究中的应用[J ].南京林业大学学报:自然科学版,2011,35(1):103-108. 质谱技术在蛋白质组学研究中的应用 甄 艳,施季森 * (南京林业大学,林木遗传与生物技术省部共建教育部重点实验室,江苏 南京 210037) 摘要:随着蛋白质组学研究的迅速发展,质谱技术已成为应用于蛋白质组学研究中的强有力工具和核心技术。质谱技术的先进性在于为蛋白质组学研究提供的通量和分子信息。笔者重点概述了基于质谱路线的蛋白质组学研究,介绍了基于质谱的定量蛋白质组学﹑翻译后修饰蛋白质组学、定向蛋白质组学、功能蛋白质组学以及基于串联质谱技术的蛋白质组学数据解析的研究 进展。 关键词:质谱;蛋白质组学;定量蛋白质组学;翻译后修饰;定向蛋白质组学;功能蛋白质组学中图分类号:Q 81 文献标志码:A 文章编号:1000-2006(2011)01-0103-06 A p p l i c a t i o n o f m a s s s p e c t r o m e t r y i n p r o t e o m i c s s t u d i e s Z H E NY a n ,S H I J i s e n * (K e y L a b o r a t o r y o f F o r e s t G e n e t i c s a n d B i o t e c h n o l o g y M i n i s t r y o f E d u c a t i o n , N a n j i n g F o r e s t r y U n i v e r s i t y ,N a n j i n g 210037,C h i n a ) A b s t r a c t :W i t ht h e r a p i d d e v e l o p m e n t o f p r o t e o m i c s ,m a s s s p e c t r o m e t r y i s m a t u r i n g t o b e a p o w e r f u l t o o l a n dc o r e t e c h -n o l o g y f o r p r o t e o m i c s s t u d i e s d u r i n g t h e r e c e n t y e a r s .T h e s u p e r i o r i t y o f m a s s s p e c t r o m e t r y l i e s i n p r o v i d i n g t h e t h r o u g h -p u t a n d t h e m o l e c u l a r i n f o r m a t i o n ,w h i c hn o o t h e r t e c h n o l o g y c a n b e m a t c h e di np r o t e o m i c s .I nt h i s r e v i e w ,w e m a d e a g l a n c e o n t h e o u t l i n e o f m a s s s p e c t r o m e t r y -b a s e d p r o t e o m i c s .A n dt h e nw e a d d r e s s e d o n t h e a d v a n c e s o f d a t a a n a l y s i s o f m a s s s p e c t r o m e t r y -b a s e dp r o t e o m i c s ,q u a n t i t a t i v em a s ss p e c t r o m e t r y -b a s e dp r o t e o m i c s ,p o s t -t r a n s l a t i o n a l m o d i f i c a t i o n s b a s e d m a s s s p e c t r o m e t r y ,t a r g e t e d p r o t e o m i c s a n df u n c t i o n a l p r o t e o m i c s b a s e d -m a s s s p e c t r o m e t r y . K e yw o r d s :m a s ss p e c t r o m e t r y ;p r o t e o m i c s ;q u a n t i t a t i v ep r o t e o m i c s ;p o s t -t r a n s l a t i o n m o d i f i c a t i o n ;t a r g e t e d p r o -t e o m i c s ;f u n c t i o n a l p r o t e o m i c s 蛋白质组学(P r o t e o m i c s )是从整体水平上研究细胞内蛋白质的组成、活动规律及蛋白质与蛋白质的相互作用,是功能基因组学时代一门新的学科。目前蛋白质组学的研究主要有两条路线:一是基于双向电泳的蛋白质组学;二是基于质谱的蛋白质组学,其中基于双向电泳的蛋白质组学研究路线最终也离不开质谱技术的应用。自20世纪80年代末,两种质谱软电离方式即电喷雾电离(e l e c t r o s p r a y i o n i z a t i o n ,E S I )和基质辅助激光解析离子化(m a -t r i x a s s i s t e d l a s e r d e s o r p t i o n i o n i z a t i o n ,M A L D I )的发明和发展解决了极性大、热不稳定蛋白质和多肽分 析的离子化和分子质量大的测定问题[1] ,蛋白质组学研究中常用的质谱分析仪包括离子阱(i o n t r a p ,I T ),飞行时间(t i m e o f f l i g h t ,T O F ),串联飞行时间(T O F -T O F ),四级杆/飞行时间(q u a d r u p o l e /T O F h y b r i d s ),离子阱/轨道阱(I T /o r b i t r a ph y b r i d ) 和离子阱/傅里叶变换串联质谱分析仪(I T /F o u r i e r t r a n s f o r m i o n c y c l o t r o nr e s o n a n c em a s s s p e c t r o m e t e r s h y b r i d s ,I T /F T M S ),这些质谱仪具有不同的灵敏度、分辨率、质量精确度和产生不同质量的M S /M S 谱[2] 。质谱作为蛋白质组学研究的一项强有力的工具日趋成熟,并作为样品制备及数据分析的信息学工具被广泛地应用。因此,有学者指出质谱技术 已在蛋白质组学研究中处于核心地位[3] 。目前在通量及所包含的分子信息内容上,基于质谱的蛋白质组学技术在细胞生物学研究中可以鉴定和量化
《蛋白质》思考题 二、判断题 1、蛋白质主要是由C、H、O和N四种元素组成。√ 2、蛋白质元素组成的特点是含氮量比较接近,平均为6.25%。 3、氨基酸有D型和L型两种构型,故组成蛋白质的氨基酸也有D型和L型。 4、丙氨酸和苯丙氨酸各自都有一个氨基和一个羧基,所以它们的等电点是相同的。 5、组成蛋白质的所有氨基酸都含有手性碳原子。 6、维持蛋白质二级结构的主要次级键是二硫键。 7、组成蛋白质的氨基酸只有20种。 8、所有α-氨基酸都与茚三酮发生反应呈蓝紫色。 9、蛋白质的四级结构是指各亚基间以共价键相连聚合而成,有一定空间结构的聚合体。 10、蛋白质的分子结构决定它的生物学活性。√ 11、蛋白质都具有四级结构。 12、蛋白质的等电点可以有很多个,而等离子点只有一个。√ 13、蛋白质分子净电荷为零时的溶液pH值是该蛋白质的等电点。√ 14、人体体液中很多蛋白质的等电点在pH=5、0左右,所以这些蛋白质在体液中主要以负离子形式存在。√ 15、分子量相同的蛋白质在电场中泳动的速度也相同。 16、蛋白质溶液稳定的主要因素是蛋白质分子表面可以形成水化膜,并在偏离等电点时带有相同电荷。√ 17、用透析方法可以分离提纯蛋白质,其原理是蛋白质分子可以透过半透膜。 18、蛋白质都能发生双缩脲反应. √ 19、蛋白质变性后会沉淀,沉淀的蛋白质也一定已变性。 20、食物蛋白经加热变性后,一级结构被破坏,肽键断裂,故而更易被人体所吸收。 三、填空题 1、组成蛋白质的编码氨基酸主要有 20 种,它们除甘氨酸外都是 L 型α-氨基酸。其中酸性氨基酸有 Glu 和 Asp ,碱性氨基酸有 Lys 、 Arg 和 His 。 2、测得某生物样品含蛋白质12、5g该样品中含氮 2 g。 3、组成蛋白质的氨基酸中含有巯基的氨基酸是 Cys 。 4、肽键是蛋白质一级结构的主键,维持蛋白质空间结构的副键有离子键、氢键、范德华力、疏水键、二硫键。 5、蛋白质二级结构主要有α- 螺旋和β- 折叠两种形状,维持其稳定结构的副键是氢键。 6、两分子氨基酸脱水缩合成二肽,多个氨基酸分子间脱水成多肽,其中含有氨基的一端叫 N末端,含有羧基的一端叫 C末端。 7、使蛋白质沉淀常用的盐试剂有硫酸铵、硫酸钠、和氯化钠。 8、用重金属盐沉淀蛋白质时,溶液的pH须大于蛋白质的pI,当用生物碱试剂沉淀蛋白质时,溶液的pH则须小于蛋白质的pI。 9、血浆清蛋白的pI=4、6,在血液中带负电荷,置入电场中向阳极移动。 10、蛋白质分子直径一般在 1-100 nm之间,同时又带有许多亲水基团,所以蛋白质溶液 是一种胶体溶液。 11、蛋白质空间结构被破坏,不对称性增加,粘度随之增大。 12、按蛋白质的分子形状可将其分为球状和纤维状两大类。按照化学组成成分可分为单纯蛋白质和结合蛋白质,可溶性蛋白质分为清蛋白、球蛋白质、谷蛋白、醇溶谷蛋白、组蛋白、精蛋白和硬蛋白七个小类。 13、面筋主要由谷蛋白和醇溶谷蛋白组成,含量各约 40 %。 14、在蛋白质和多肽分子中,连结氨基酸残基的共价键有肽键和二硫键。 15、物质形成胶体的条件是颗粒的大小在1-100纳米之间、颗粒带有同种电荷、颗粒外围能形成溶剂化层。 16、超二级结构主要有αα、βαβ和βββ三种主要类型。 17、β-转角靠氢键键维持,涉及四个氨基酸残基,转角处常出现的氨基酸有甘氨酸和脯氨酸。
各章思考题及答案 一糖类化学 糖蛋白中的寡糖链有些什么功能? 糖蛋白的种类繁多,功能也十分广泛。一般来说,糖蛋白的寡糖链可保护其蛋白部分免遭蛋白酶的水解,而延长其生物半衰期。此外寡糖链还影响蛋白质构象、聚合和溶解性等。在某些糖蛋白中寡糖链参与蛋白质在细胞内的分拣和运输。一些属于糖蛋白的酶,其寡糖链结构可影响酶的活性。许多激素为糖蛋白,其寡糖链的结构与激素的生物活性密切相关。存在于细胞表面的糖蛋白,其寡糖链还参与蛋白质分子之间的相互识别和结合作用。 二脂类化学 试述生物膜的两侧不对称性。 生物膜的不对称性表现在: a) 磷脂成分在膜的两侧分布是不对称的。 b) 膜上的糖基(糖蛋白或糖脂)在膜上分布不对称,在哺乳动物质膜都位于膜的外表面。 c) 膜蛋白在膜上有明确的拓扑学排列。 d) 酶分布的不对称性。 e) 受体分布的不对称性。 膜的两侧不对称性保证了膜的方向性功能。 三蛋白质化学 1 某氨基酸溶于pH7的水中,所得氨基酸溶液的pH为6,问此氨基酸的pI是大于6、等于6还是小于6? 氨基酸在固体状态时以两性离子形式存在。某氨基酸溶于pH7的水中,pH从7下降到6,说明该氨基酸溶解于水的过程中放出了质子,为了使该氨基酸达到等电点,只有加些酸,因此氨基酸的等电点小于6。 2 一系列球状的单体蛋白质,相对分子质量从10 000到100 000,随着相对分子质量的增加,亲水残基与疏水残基的比率将会发生什么变化? 随着蛋白质相对分子质量的增加,表面积与体积的比率也就是亲水残基与疏水残基的比率必定减少。假设这些蛋白质是半径为r的球状蛋白质,由于蛋白质相对分子质量的增加,表面积随r2的增加而增加,体积随r3的增加而增加,体积的增加比表面积的增加更快,所以表面积与体积的比率减少,因此亲水残基与疏水残基的比率也就减少。 3 从热力学上考虑,一个多肽的片段在什么情况下容易形成α-螺旋,是完全暴露在水的环境中还是完全埋藏在蛋白质的非极性内部?为什么? 当多肽片断完全埋藏在蛋白质的非极性内部时,容易形成氢键,因为在水的环境中,肽键的C=O和N-H基团能和水形成氢键,亦能彼此之间形成氢键,这两种
请简述蛋白质组学研究的基本步骤 1.蛋白质样品的制备:蛋白质样品的制备是蛋白质组学研究的首要环节,也是最为重要的部分。蛋白质样品的质量直接影响到科学研究的真实性和可信度。 2.蛋白质的分离:双向凝胶电泳技术是目前最基础和常用的蛋白质分离方法,它能将数千种蛋白质同时分离与展示的分离技术。双向电泳分为等电聚焦电泳和SDS-PAGE两个步骤,即先进行等电聚焦电泳,按照pI的不同将蛋白分离,然后再进行SDS-PAGE按照分子量的大小不同对蛋白进行分离。IPG胶条的应用,大大提高了双向电泳的重复性。 3. 蛋白质双向电泳凝胶的染色。目前双向电泳凝胶的染色的方法有3种,分别为考马斯亮蓝染色法、银染法和荧光染色法。考马斯亮蓝染色法,操作简便,无毒性,染色后的背景及对比度良好,与下游的蛋白质鉴定方法兼容,但灵敏度较低,可以检测到30~100 ng蛋白质。银染法是一种较为流行的染色方法,银染成本较低,灵敏度高,可检测少到2~5ng的蛋白。荧光试剂显色对蛋白质无固定作用,与质谱兼容性好,而其灵敏度与银染相仿,但线性范围要远高于银染,这使二维电泳分离蛋白质的荧光检测受到普遍关注和应用。 4.双向电泳凝胶图像的采集与分析:图像采集系统通过投射扫描根据吸光度的大小获碍蛋白质点的光密度信息。一般来说,该光密度值与蛋白质点的表达丰度成正比,以便于软件分析时的定量比较。完成图像采集后采用ImageMaster等图像分析软件进行分析。分析步骤:蛋白质点检测、背景消减、归一化处理、蛋白质点匹配。 5.蛋白质鉴定:蛋白质鉴定是蛋白质组学研究中的核心内容。目前蛋白质鉴定技术主要有Edman 降解法测序、质谱。质谱是目前最常用的蛋白质鉴定方法。质谱技术的基本原理是带电粒子在磁场或电场中运动的轨迹和速度依粒子的质量与携带电荷之比质荷比( m/z) 的不同而变化,可以据此来判断粒子的质量和特性。质谱完成后利用蛋白质的各种属性参数如相对分子质量、等电点、序列、氨基酸组成、肽质量指纹谱等在蛋白质数据库中检索,寻找与这些参数相符的蛋白质。