
化学反应的方向、限度与速率
——单元复习(讲义)
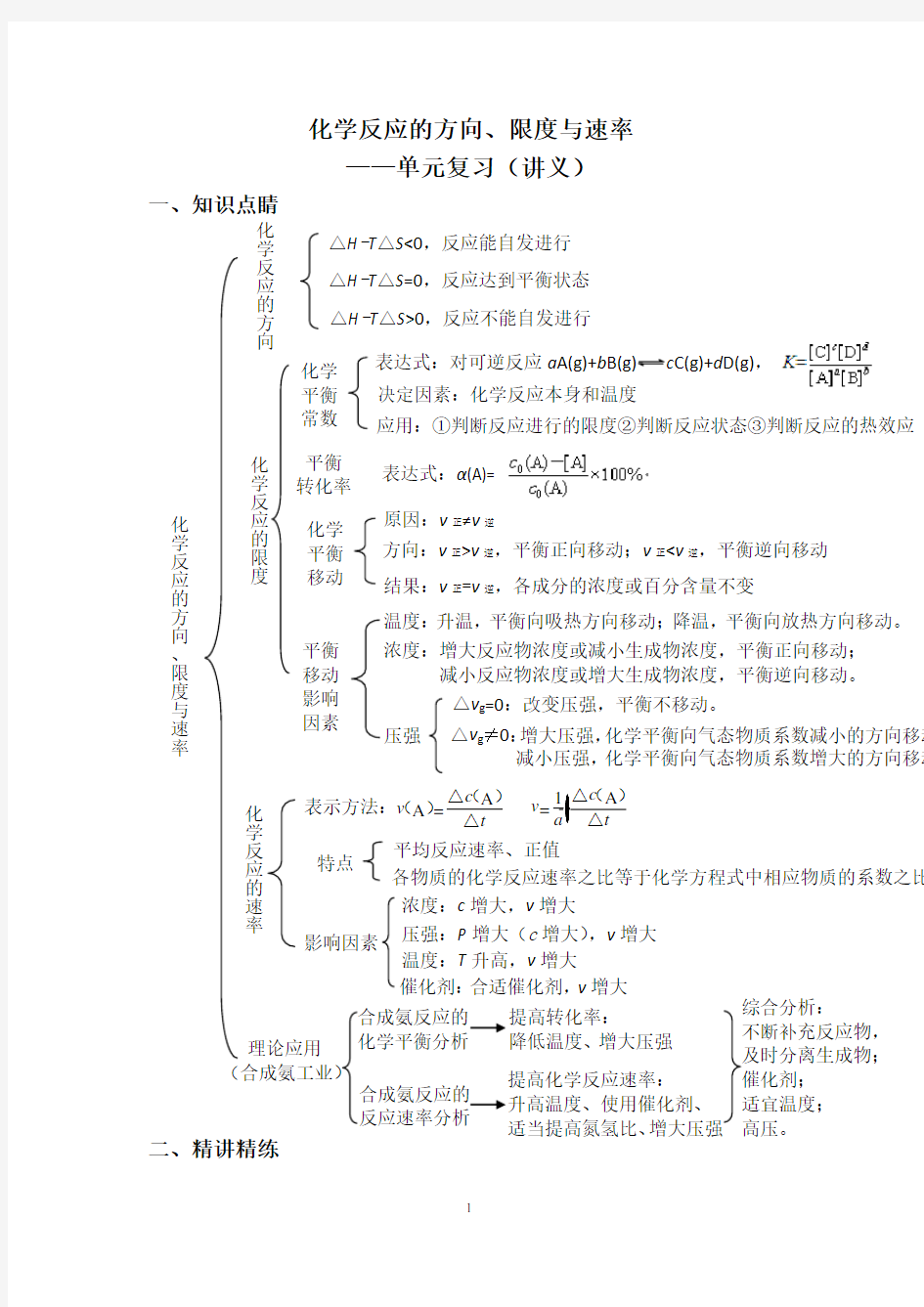
一、知识点睛
压强
浓度:增大反应物浓度或减小生成物浓度,平衡正向移动;
减小反应物浓度或增大生成物浓度,平衡逆向移动。
平衡 转化率 化学反应的速率
温度:升温,平衡向吸热方向移动;降温,平衡向放热方向移动。 表达式:α(A)= 结果:v 正=v 逆,各成分的浓度或百分含量不变
△H -T △S =0,反应达到平衡状态
△H -T △S <0,反应能自发进行 △H -T △S >0,反应不能自发进行 化学反应的方向、限度与速率
化学反应的限度 决定因素:化学反应本身和温度
表达式:对可逆反应a A(g)+b B(g)c C(g)+d D(g),
应用:①判断反应进行的限度②判断反应状态③判断反应的热效应方向:v 正>v 逆,平衡正向移动;v 正 平衡 移动 影响 因素 △v g =0:改变压强,平衡不移动。 表示方法: 特点 平均反应速率、正值 △v g ≠0:增大压强,化学平衡向气态物质系数减小的方向移动 减小压强,化学平衡向气态物质系数增大的方向移动 影响因素 理论应用 (合成氨工业) 浓度:c 增大,v 增大 催化剂:合适催化剂,v 增大 压强:P 增大(c 增大) ,v 增大 温度:T 升高,v 增大 各物质的化学反应速率之比等于化学方程式中相应物质的系数之比 化学平衡移动 化学 平衡 常数 原因:v 正≠v 逆 化学反应的方向 A A =c v t △() ()△化学平衡分析合成氨反应的综合分析: 1A = c v a t △()△ 1.下列有关说法正确的是() A.SO2(g)+H2O(g)H2SO3(l) ,该过程熵值增大 B.SO2(g)S(s)+O2(g) △H>0 △S<0,该反应能自发进行C.SO2(g)+2H2S(g)3S(s)+2H2O(l) △H<0,低温下能自发进行 D.某温度下SO2(g)+1/2O2(g)SO3(g),K= 1 2 22 3 [SO][O] [SO] 2.如图为反应2X(g)+Y(s)2Z(g)的反应过程和能量关系图,下列说法正确的是 () A.曲线a和b表示两个反应过程的反应热不同 B.曲线a一定表示反应是在无催化剂时的反应过程 C.反应达到平衡后,升高温度,平衡常数K值一定减小 D.增大压强,X的转化率一定增大 3.反应NH4HS(s)3(g)+H2S(g)在一定温度下达到平衡。下列各种情况下,不 能使平衡发生移动的是() A.容器容积不变,通入SO2气体 B.移走一部分NH4HS固体 C.容器容积不变,充入HCl气体 D.保持压强不变,充入N2 4.COCl22(g) △H>0。当反应达到平衡时,下列措施能提高COCl2 转化率的是() ①升温②增加CO的浓度 ③加催化剂④减压 ⑤恒容通入惰性气体⑥恒压通入惰性气体 A.①②④B.①④⑥ C.②③⑥D.③⑤⑥ 5.密闭容器中一定量的混合气体发生反应:x A(g)+y B(g) z C(g),达到平衡时,测得A的浓度为0.5 mol?L-1,在温度不变的条件下,将容器的体积扩大到原来的两倍,使其重新达到平衡,测得A的浓度为0.3 mol ?L-1,下列有关判断正确的是() A.平衡向正反应方向移动B.x+y C.B的平衡转化率提高D.C的体积分数降低 6.下列实验事实不能用平衡移动原理解释的是() A.工业合成氨通常选择高压的条件 B.工业生产硫酸过程中使用过量空气以提高SO2的利用率 C.向H2O2溶液中加入二氧化锰,反应速率加快 D.将两只充有等量NO2的密闭烧瓶分别浸泡在盛有冷水和热水的烧杯中,一段时间后热水中的烧瓶颜色更深 7.如图表示外界条件(温度、压强)的变化对反应L(s)+G(g) 2R(g) △H>0的影响。则图中y轴可能指的是() ①平衡混合气中R的质量分数 ②平衡混合气中G的体积分数 ③G的转化率 ④R的转化率 A.①③B.②C.④D.②④ 8.可逆反应a A(s)+b B(g)c C(g)+d D(g) △H,当其他条件不变时,反应过程中某 物质在混合物中的百分含量与温度(T)、压强(P)的关系如图所示,下列判断正确的是() A.T1>T2,△H<0 B.T1 C.P1 9.向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应 SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间 变化的示意图如图所示。由图可得出的正确结论是() A.反应在c点达到平衡状态 B.反应物浓度:a点小于b点 C.反应物的总能量低于生成物的总能量 D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 10.已知:Fe(s)+CO2(g)FeO(s)+CO(g) K1① Fe(s)+H2O(g)FeO(s)+H2(g) K2② H2(g)+CO2(g)H2O(g)+CO(g) K3③ 又已知不同温度下,K 温度/℃K1K2 500 1.00 3.15 700 1.47 2.26 900 2.40 1.60 (1)若500℃时进行反应①,CO2起始浓度为2 mol?L 1, 两分钟后建立平衡,则CO2的平衡转化率为_______。 (2)反应③的平衡常数K3的表达式为_________________(用K1、K2表示),焓变△H______0(填“>”、“<”或“=”,下同),若该反应仅在高温时 能自发进行,则△S______0。 11.现有反应CO(g)+H2O(g)CO2(g)+H2(g) △H<0,在850℃时,平衡常数K=1。 (1)若升高温度到950℃并达到平衡时,K_____1(填“>”、“<”或“=”)。 (2)850℃时,若向一容积可变的密闭容器中同时充入 1 mol CO、3 mol H2O(g)、1 mol CO2和x mol H2,则: ①当x=5时,上述平衡向________(填“正反应”或“逆反应”)方向 进行。 ②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 ________________。 ③850℃时,若设x=5 mol和x=6 mol,其他物质的投料不变,当上述反 应达到平衡后,测得H2的体积分数分别为a%、b%,则a____b(填 “>”、“<”或“=”)。 12.恒温条件下进行反应m X(g)+n Y(g)p Z(g) △H>0,平衡混合气体中X的转化 率与压强的关系如图所示。请回答: (1)此反应中m、n、p满足的关系为___________。 (2)在a点时,该反应是否处于化学平衡状态_____(填“是”或“否”),此时 该反应v 正____v 逆 (填“>”、“<”或“=”);在b点,该反应是否处于化学 平衡状态_____,此时该反应v 正____v 逆 。 (3)在c点时,该反应是否处于化学平衡状态_____(填“是”或“否”),此时 该反应v 正____v 逆 (填“>”、“<”或“=”);在d点,该反应是否处于化学 平衡状态_____,此时该反应v 正____v 逆 。 (4)在a、b两点时,该反应的化学反应速率v a与v b的关系为v a_____v b(填“无法比较”、“>”、“<”或“=”,下同);在c、d两点时,该反应的化学反应速率v c与v d的关系为v c_____v d。 13.N2O4是常用的火箭推进剂,火箭残骸中常出现红棕色气体,原因为: N2O4(g)2NO2(g)。 (1)当温度升高时,气体颜色变深,则上述反应为_______ (填“吸热”或“放热”)反应。 (2)一定温度下,上述反应的焓变为△H。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是___________ (填字母)。 若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平 衡常数_________(填“增大”、“不变”或“减小”),反应3 s后NO2 的物质的量为0.6 mol,则0~3 s内的平均反应速率v(N2O4)=_______mol ?L-1?s-1。 14.某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可 加快氢气的生成速率。请回答下列问题: (1)上述实验中发生反应的化学方程式有______________ _____________________________________________。 (2)硫酸铜溶液可以加快氢气生成速率的原因是________ _____________________________________________。 (3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是__________。 (4)要加快上述实验中气体产生的速率,还可采取的措施有 ___________________________________(答两种)。 (5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒 的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。 混合溶液 实验 A B C D E F 4 mol?L-1H2SO4/mL 30 V1V2V3V4V5 ①请完成此实验设计,其中:V1=______,V6=______, V9=______。 ②反应一段时间后,实验E中的金属呈______色。 ③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的 速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气 的速率反而会下降。请分析氢气生成速率下降的主要原因: __________ __________________________________________________________ _____________________________。 【参考答案】 二、精讲精练 1. C 2. C 3. A 4. B 5. D 6. C 7. D 8. C 9. D 10.(1)50% (2)K3=K1/K2> > 11.(1)< (2)①逆反应②0≤x<3 ③< 12.(1)m+n (2)是= 是= (3)否> 否< (4)< < 13.(1)吸热 (2)AD 不变0.1 14.(1)Zn+H2SO4ZnSO4+H2↑ Zn+CuSO4ZnSO4+Cu (2)CuSO4与Zn反应生成Cu,Cu与Zn形成原电池 (3)Ag2SO4 (4)升高温度、适当增加硫酸的浓度、增加锌粒的比表面积等(答两种)(5)①30 10 17.5 ②红 ③当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低 了Zn与溶液的接触面积