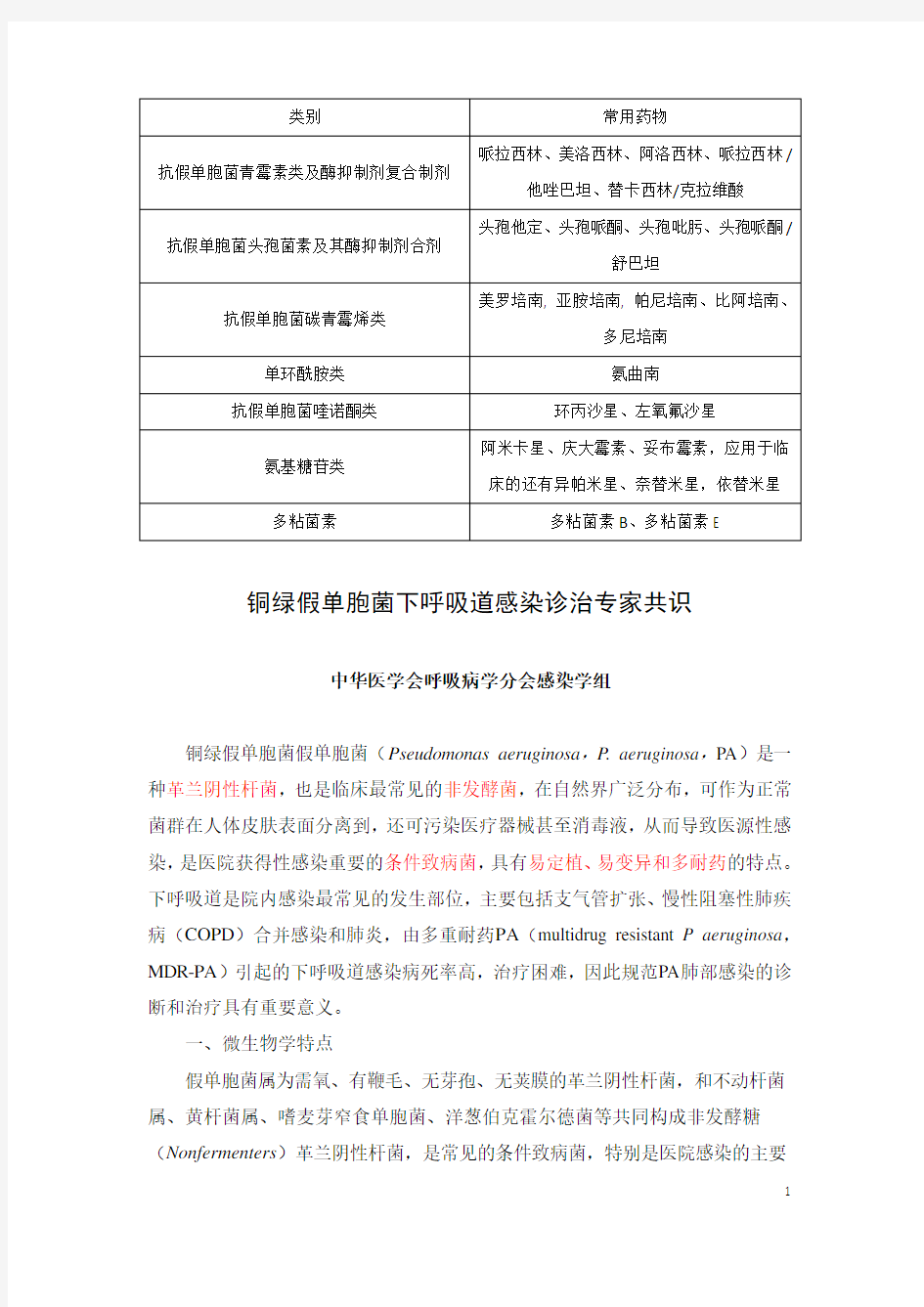

类别常用药物
哌拉西林、美洛西林、阿洛西林、哌拉西林/抗假单胞菌青霉素类及酶抑制剂复合制剂
他唑巴坦、替卡西林/克拉维酸
头孢他定、头孢哌酮、头孢吡肟、头孢哌酮/抗假单胞菌头孢菌素及其酶抑制剂合剂
舒巴坦
美罗培南, 亚胺培南, 帕尼培南、比阿培南、抗假单胞菌碳青霉烯类
多尼培南
单环酰胺类氨曲南
抗假单胞菌喹诺酮类环丙沙星、左氧氟沙星
阿米卡星、庆大霉素、妥布霉素,应用于临氨基糖苷类
床的还有异帕米星、奈替米星,依替米星多粘菌素多粘菌素B、多粘菌素E
铜绿假单胞菌下呼吸道感染诊治专家共识
中华医学会呼吸病学分会感染学组
铜绿假单胞菌假单胞菌(Pseudomonas aeruginosa,P. aeruginosa,PA)是一种革兰阴性杆菌,也是临床最常见的非发酵菌,在自然界广泛分布,可作为正常菌群在人体皮肤表面分离到,还可污染医疗器械甚至消毒液,从而导致医源性感染,是医院获得性感染重要的条件致病菌,具有易定植、易变异和多耐药的特点。下呼吸道是院内感染最常见的发生部位,主要包括支气管扩张、慢性阻塞性肺疾病(COPD)合并感染和肺炎,由多重耐药PA(multidrug resistant P aeruginosa,MDR-PA)引起的下呼吸道感染病死率高,治疗困难,因此规范PA肺部感染的诊断和治疗具有重要意义。
一、微生物学特点
假单胞菌属为需氧、有鞭毛、无芽孢、无荚膜的革兰阴性杆菌,和不动杆菌属、黄杆菌属、嗜麦芽窄食单胞菌、洋葱伯克霍尔德菌等共同构成非发酵糖(Nonfermenters)革兰阴性杆菌,是常见的条件致病菌,特别是医院感染的主要
病原之一。PA是假单胞菌的代表菌株,占所有假单胞菌感染的70%以上。PA呈球杆状或长丝状,宽约0.5-1.0μm,长约1.5-3.0μm。一端有单鞭毛,无芽孢,成双或短链排列。PA能产生多种色素,如绿脓素和荧光素等,专性需氧,部分菌株能在兼性厌氧条件下生长。
二、流行病学
(一)流行状况
近年来,PA感染的流行病学特点突出地表现在两个方面,一是院内感染尤其是肺部感染的发病率不断增加。国内已有多项大型流行病学调查显示我国PA 感染的严重性,其中最有代表性的“中国CHINET细菌耐药性监测”资料显示2005年8家成人综合性教学医院PA的分离率占革兰阴性菌的11.6%,居第2位(大肠埃希菌居第1位)。从2006年起参加监测的医院不断增加,2009年达到14家医院,资料显示从2006至2011年,PA的分离率分别占革兰阴性菌的14.1%、16.9%、16.4%、15.8%、14.8%和14.2%,居第2~4位。2009年有13家教学医院参与的中国医院内感染抗生素耐药监测计划(CARES)中PA在所有分离细菌中也是居第4位,分离率为10.8%。这一点在呼吸系统感染更为突出,根据美国疾病预防控制中心(CDC)的全国医院感染研究数据显示,PA肺炎的发生率在逐年升高,从1975年到2003年医院获得性肺炎(HAP)中PA比例从9.6%上升至18.1%,几乎翻了一倍[1]。在一项大规模ICU感染病原学的流调中PA是最常见的革兰阴性需氧菌,占23%(8 244/35 790),也是最常见的从呼吸道分离出的细菌(31.6%)[2]。美国一项关于呼吸机相关肺炎(VAP)的回顾性研究显示PA分离率达9.3%,尤其是上机4天以后。即便得到有效地治疗,PA导致的感染总病死率达42.1%~87.0%,直接病死率为32%~42.8%[3]。2005年胡必杰等[10]报告562例HAP中PA的分离率为18.6%,列第一位;我国近期进行的13家大型教学医院HAP临床调查结果显示,PA的分离率为20.9%,居第2位[A]。二是PA的耐药率居高不下。全球细菌耐药监测数据(SENTRY)显示PA在HAP致病原中居前几位,同时伴随着对常用抗菌药物耐药率的逐年提高[4]。中国CHINET 2005年~2011年连续监测资料显示,PA 对常用抗生素的耐药率保持在较高位置,但略有下降趋势。如亚胺培南的耐药率分别为31.0%、42.8%、35.8%、30.5%、30.5%、30.8%和29.1%,对美罗培南的耐药率分别为32.0%、34.1%、28.5%、24.5%、25.2%、25.8%和25.0%,但其中全耐
药(PDR)菌株数量显著增多,达到1.8%[5]。远高于CHINET监测分离菌中PA 对碳青酶烯类的耐药率。PA对于其他具有抗假单胞菌活性的药物敏感性也不容乐观,2011年CHINET资料显示PA对阿米卡星、头孢哌酮-舒巴坦、头孢他啶、环丙沙星和哌拉西林-他唑巴坦的耐药率分别为14.3%、19.8%、19.5%、20.8%和21.7%[5]。
PA导致的社区获得性肺炎(CAP)非常少见,在美国CAP中PA的分离率仅有0.9%~1.9%,中国的流行病学调查资料结果类似,只有1.0%[5]。一项包括127个研究、涉及33 148例患者的meta分析结果提示,由PA引起的CAP患者只有18例,但是总病死率高达61.1%(11/18)。说明需要入住ICU的重症CAP中PA也是不可忽视的致病原[6]。
(二)耐药机制
1.定义:一般认为MDR是指细菌对于常见抗生素(包括头孢菌素类、碳青霉烯类、β-内酰胺酶抑制剂复方制剂、氟喹诺酮类和氨基糖苷类)中三类及三类以上的药物耐药,广泛耐药(XDR)是指细菌仅对1-2种抗生素敏感(通常指粘菌素和替加环素),而PDR则是指对目前所有的抗菌药物都耐药的菌株。
2.PA是临床最常见的MDR和PDR致病菌之一,其耐药机制涉及多个方面[7]。
(1)产生灭活酶:PA可产生β-内酰胺酶、氨基糖苷类修饰酶、氯霉素乙酰转移酶等,其中β-内酰胺酶、氨基糖苷类修饰酶具有重要临床价值。
①产生β-内酰胺酶:这是PA对β-内酰胺类抗菌药物耐药的主要机制,水解酶的种类繁多,主要包括AmpC酶、超广谱β-内酰胺酶(ESBLs)及金属酶(MBL)和其他酶,如KPC酶。
②产生氨基糖苷类钝化酶:该酶能将氨基糖苷类抗菌药物的游离氨基乙酰化,将游离羟基磷酸化、核苷化,从而使氨基糖苷类抗菌药物发生钝化而耐药。
(2)膜通透性下降:
①主动外排系统过度表达:PA细胞膜上的许多蛋白具有将抗菌药物主动外排到细胞外的作用,并与细胞外膜的低通透性对耐药起协同作用,在致PA多重耐药中发挥越来越重要的作用。在PA细胞膜上常见的七种外排系统包括MexAB-oprM、MexXY-oprM、MexCD-oprJ、MexEF-oprN、MexJk-OprM、
MexGHI-OpmD、MexVW-OprM等。外排系统能有效地清除除多粘菌素外所有的抗生素,从而导致多耐药。目前研究表明,MexAB-OprM是惟一的确定存在于野生型PA中的外排蛋白,具有最广的底物特异性,包括β-内酰胺类、β-内酰胺酶抑制剂复合制剂、氟喹诺酮类、大环内酯类、四环素类、氯霉素类、新生霉素类、磺胺类及甲氧苄氨嘧啶,可导致野生型PA对上述药物耐药。如果该泵表达增多,使得药物排出增多,菌体内药物难以达到有效浓度,细菌就会产生耐药。
②膜孔蛋白丢失或表达下降:中国碳青霉烯耐药PA的主要耐药机制是外膜孔蛋白OprD2缺失及表达量下降,导致药物难以进入细菌细胞内。
(3)靶位改变:
①拓扑异构酶突变:氟喹诺酮类抗菌药物的作用靶位是细菌DNA拓扑异构酶II和拓扑异构酶Ⅳ。PA对喹诺酮类药物耐药主要是由于编码两类拓扑异构酶的基因突变,导致酶结构改变,使药物不能与酶-DNA复合物稳定结合而失去抗菌效力。
②16s核糖体RNA甲基酶是氨基糖苷类抗菌药物耐药的原因之一。
(4)生物被膜(biofilm)形成:生物被膜是指细菌附着于物体表面后,繁殖并分泌一些多糖基质、纤维蛋白等复合物,将细菌黏连包裹其中而形成的膜样物。细菌能够通过生物被膜的形式生存,是细菌耐药另一个重要机制,即保护细菌逃避机体免疫和抗菌药物的杀伤作用。利用群感效应(quorum sensing, QS)的细胞沟通机制在革兰阴性杆菌,特别是PA的生物被膜形成中发挥重要作用。目前已经知道PA的QS效应机制主要通过2个信号系统(LasI-LasR,RhII-RhIR)构成的级联反应来实现调控。大环内酯类抗生素自身没有对抗PA的作用,但能抑制生物被膜的形成,同时具有调节免疫,增强吞噬细胞的吞噬作用。红霉素、克拉霉素、阿奇霉素和罗红霉素能有效抑制生物被膜的形成,其中以阿奇霉素抑制作用最强。16元环大环内酯类抗生素如麦迪霉素、交沙霉素、乙酰螺旋霉素等对生物被膜无效。
近些年对于整合子的研究日趋增多,整合子检出率呈逐年上升趋势,由2006年的37.5%上升至2008年52.38%。整合子是存在于细菌质粒、染色体或转座子上的一种基因捕获和表达的遗传单位,可以通过接合、转化、转导和转座等方法
在细菌间转移,成为细菌多重耐药迅速发展的重要原因,这种情况在革兰阴性菌尤其是PA中更为显著。
值得注意的是,2011年CHINET细菌耐药性检测结果显示PA对碳青霉烯类的耐药率已经高于青霉素类和头孢菌素类抗生素,其机制尚需要进一步探讨,但应引起临床的高度重视。
三、诊断
由于PA在呼吸道的定植极为常见,目前临床上对PA肺部感染的最大困惑是诊断问题,即痰或者经气管吸引标本(TTA)分离到的PA应该如何区别是定植菌还是感染菌?区别定植与感染对于抗生素的合理使用非常重要,否则极易导致治疗不足或治疗过度,但这恰恰是呼吸道感染临床迄今仍难以解决的难题。
(一)PA感染的危险因素
PA肺部感染多有危险因素,如长期入住ICU病房,机械通气,气管切开,留置中心静脉导管,长期使用三代头孢菌素或者碳青霉烯类抗生素,与已感染非发酵菌的病人处于同一病房,工作人员疏于环境和手部清洁等,这些危险因素如发生在免疫功能低下患者如中性粒细胞缺乏、糖皮质激素治疗和实体肿瘤化疗后则导致耐药机会更多[5]。综合目前罹患PA的危险因素包括:①皮肤粘膜屏障发生破坏,如气管插管、机械通气、严重烧伤、留置胃管;②免疫功能低下,如中性粒细胞缺乏、实体肿瘤化疗、糖皮质激素治疗、AIDS;③菌群失调;④慢性结构性肺病,如支气管扩张症、COPD、肺囊性纤维化;⑤长期住院,尤其是长期住ICU;⑥曾经长期使用三代头孢菌素或者含酶抑制剂青霉素。
在呼吸系统疾病中,COPD是最常见的容易发生PA感染的基础疾病之一,当AECOPD患者出现以下四项中的两项时应考虑PA感染可能:①近期住院史;②经常(>4次/年)或近期(近3个月内)抗菌药物应用史;③病情严重(FEV1<30%);④应用口服糖皮质激素(近2周服用泼尼松>10mg/d)。
(二)PA感染的临床表现
PA为机会致病菌,在患者体内或者医院环境中寄殖,感染常继发于免疫功能低下的患者。因此,当这些患者出现发热、咳嗽、咯黄色或黄绿色脓性痰,痰液粘稠,伴有气急等呼吸道症状时,应考虑PA感染的可能;尤其在原有肺部慢性疾病的患者,平时就常伴慢性咳嗽、咳痰,当出现黄绿色脓痰,呼吸困难加重,
肺功能进行性减退时,应考虑PA感染的可能。在HAP,尤其是VAP中PA为最常见的致病菌之一,这与气管插管或者切开建立人工气道后PA能够直接侵入下呼吸道,引起吸入性的感染有关。PA菌血症多继发于大面积烧伤、静脉导管、心瓣膜置换术及各种严重慢性疾病等的过程中,病死率高,可有高热,常伴休克、急性呼吸窘迫综合征(ARDS)或弥散性血管内凝血(DIC)等。在严重全身感染时炎症标志物,如内毒素和降钙素原(PCT)可以出现升高。
肺部PA感染的病理改变与体表感染一样表现为特征性坏疽性深脓疱,周围环以红斑,影像学上可表现为弥漫性支气管肺炎,伴有小结节和小的透亮区“微脓肿”。值得注意的是,在考虑下呼吸道PA感染时,需排除其他感染如鼻窦炎、尿路感染或导管相关感染等。
(三)如何区别定植与感染
PA-HAP很少有血培养阳性,所以难以通过血培养确定病原学诊断,而单行痰革兰染色没有诊断价值。从气管插管后气道内分泌物中能够在很长时间内持续培养出PA,但可以没有症状或者体征。即使是脓痰或者气管内分泌物PA培养阳性亦不能诊断VAP。文献报道,4%~15%的COPD患者痰中能够分离到PA[8]。广谱抗生素的使用能增加ICU患者气道中PA的定植。这是由于PA能增加粘液的分泌,破坏纤毛的活力,引起上皮结构受损,影响肺的清除能力。但与血培养中分离的PA相比,气道寄植的PA虽然毒力较弱,但耐药性更强、更易产生生物被膜[9]。即使经过有效地抗生素治疗,PA仍可从VAP发生后8天的肺内分离到。因此,呼吸道分泌物,包括痰、咽拭子、气管吸引标本(TTA)、保护性毛刷标本(PBS)支气管肺泡灌洗液(BALF)等PA培养阳性,必须认真评估其临床意义。应严格掌握痰标本的正确留取方法,并通过镜检确认是否真正为来自下呼吸道的标本,据此进行培养才有价值。TTA、PBS和BALF标本要比痰标本更可靠更有价值,应尽可能采用。
痰培养应尽量采用定量培养,至少应做半定量培养,而目前国内许多医院采用的定性培养价值非常有限。当呼吸道标本PA培养阳性时,应结合临床情况进行仔细分析。首先是患者是否存在肺部感染的临床与实验室表现,是否有PA感染的危险因素,如果患者一般情况良好,又没有危险因素,PA培养阳性多考虑污染或定植,可以观察,暂不做抗感染处理,更多地采取感染控制措施。但如果
患者有肺部感染的临床表现,又存在高危因素,应高度警惕感染的可能,再充分参考其他临床指标如痰涂片镜检和定量、半定量培养结果,CRP和PCT等综合判断。
患者在出现肺部感染时第一次呼吸道标本PA培养阳性的临床意义较大,应结合临床危险因素进行分析是否为感染责任菌;而在初始治疗采用不针对非发酵菌的抗菌药物治疗过程中,治疗有效又反复培养出PA,则应考虑为抗生素筛选的结果。临床另一困难之处是在那些具有PA感染危险因素的患者,呼吸道分泌物PA与其他病原体同时培养阳性时责任菌的判断,需要谨慎确定。未经治疗患者如果与抗生素敏感菌如大肠埃希菌、肠杆菌属细菌等同时培养阳性,则PA为定植菌的可能性大;如果与耐药菌如MRSA、鲍曼不动杆菌等同时培养阳性,前者又占优势,则需要分析各自定量和半定量培养结果,如果PA为低浓度培养阳性则考虑为定植菌的可能性大。
就目前的认知水平,可以从以下两个方面着手解决PA定植与感染的鉴别诊断问题。首先,临床采集呼吸道标本时,应对患者进行充分培训,必要时采用气管镜下防污染毛刷采样,尽量提高呼吸道分泌物标本的质量。临床微生物实验室要严格把握痰标本的质量,痰标本接种前应进行革兰染色镜检,判断痰标本是否合格,同时注意有无白细胞吞噬或伴行现象及细菌的染色和形态。呼吸道标本的半定量、定量细菌培养能够为临床提供有帮助的参考价值。如有研究根据细菌定量培养结果气管内吸引物(PA≥105cfu/mL)、肺泡灌洗液(PA≥104cfu/mL)、防污染保护性气管镜毛刷(PA≥103cfu/mL)达到一定阈值可以考虑为感染。
总之,与其它非发酵菌相同,在痰标本中分离出PA的临床意义即使想尽办法仍很难正确评价。本共识建议临床与微生物专家互通信息,共同协作解决这一问题,但责任归于临床而非微生物科。即使是合格痰分离到多量单一PA,临床首先要考虑患者是否存在肺部感染的临床表现,是否需要针对PA治疗。如果与其它细菌同时分离到,又有肺部感染的临床表现,则需要区别何种是真正的致病原或混合感染。当针对单一PA治疗后疗效满意时较易确定是PA感染,但当疗效不满意时也难以完全否定,因为尚有剂量、疗程、联合用药与否、是否有混合感染(特别是厌氧菌)等许多问题的干扰,或在治疗过程中产生急性耐药(以单药治疗最为常见)。因此,在呼吸道标本分离到PA的患者是否需要抗生素治疗
应当参考以下几点:①有与下呼吸道感染相符合的临床症状、体征和影像学上出现新的、或持续的、或加重的肺部渗出、浸润、实变;②宿主因素,如基础疾病、免疫状态、先期抗生素治疗、其他与发病相关的危险因素如机械通气时间等;③正在接受非抗PA抗生素治疗的患者如果一度好转,复又加重,在时间上与PA 的出现相符合,并排除其他感染如鼻窦炎、尿路感染或导管相关感染等;④从标本采集方法、标本质量、细菌浓度(定量或半定量培养)、涂片所见等,评价阳性培养结果的临床意义。如痰培养多次提示PA优势生长则具有较大的临床意义
[1]。
四、治疗
由于细菌耐药性的不断增加,临床上对PA肺部感染的治疗面临越来越多的困难。曾经应用于PA感染治疗的药物包括抗假单胞菌青霉素和头孢菌素、氨曲南、氨基糖苷类、氟喹诺酮类、碳青霉烯类等,尤其是碳青霉烯类曾经是治疗PA感染非常重要和有效的药物。但近年来在大型综合医院内由于PA对其耐药性迅速增加,且同时对其他多数抗生素耐药,导致XDR甚至PDR菌株不断增多,使可应用的敏感药物非常有限,治疗非常困难。
(一)PA下呼吸道感染的治疗原则
PA肺部感染的治疗,应该遵循以下原则:①选择有抗PA活性的抗生素,通常需要联合治疗;②根据PK/PD理论选择正确的给药剂量和用药方式;③充分的疗程;④消除危险因素;⑤重视抗感染外的综合治疗。
(二)具有抗PA活性的抗生素
1.抗假单胞菌青霉素类及酶抑制剂复合制剂:哌拉西林、美洛西林、阿洛西林、哌拉西林/他唑巴坦、替卡西林/克拉维酸。其中最具代表性的药物是哌拉西林/他唑巴坦。2011年CHINET细菌耐药性检测结果显示哌拉西林/他唑巴坦对PA 的敏感性78.1%,高于单药哌拉西林(70.6%),而替卡西林/克拉维酸的敏感性只有61.3%。即使在HAP中的PA感染其敏感率仍可达%【5】,显示了良好的抗PA活性,是治疗PA感染的基础用药之一。此类药物为半合成青霉素,属时间依赖性抗生素,对于肾功能正常患者每日哌拉西林剂量应达到达12~16g,分3~4次给药,常用方法为(4:1制剂),4.5g,q6~8h。
2.抗假单胞菌头孢菌素及其酶抑制剂合剂:2011年CHINET细菌耐药性检测结果显示头孢他定、头孢哌酮、头孢吡肟、头孢哌酮/舒巴坦对PA敏感性分别为74.1%、52.4%、71.7%、62.4%【5】。此类药物也属时间依赖性抗生素,每日剂量分3~4次给药。对于肾功能正常的成年病人来说,常用剂量如下:头孢吡肟和头孢他啶的充分治疗剂量为2g,q8h;头孢哌酮/舒巴坦(2:1制剂)为3g,q8h。
3.抗假单胞菌碳青霉烯类:包括美罗培南, 亚胺培南, 帕尼培南、比阿培南。2011年CHINET细菌耐药性检测结果显示亚胺培南、美罗培南对PA敏感性分别为67.8%和71.5%[5]。美罗培南的常用剂量为1g,q6~8h,最好能使用静脉泵给药,每次持续3h。亚胺培南的常用剂量为1g,q6~8h,使用静脉泵给药,每次持续2h。其他如帕尼培南,常用剂量为;比阿培南,常用剂量为0.3g,q6h,或0.6g,q12h。新的碳青霉烯类药物如多尼培南,据报道是目前抗PA较强的碳青霉烯类药物【】,目前我国尚无产品供应。需要注意的是,厄他培南对PA无抗菌活性;国内目前还有法罗培南供应,但为口服制剂,很少用于PA感染的治疗。
4.单环酰胺类:2011年CHINET细菌耐药性检测结果显示氨曲南对PA敏感性只有51.7%【5】,对青霉素及头孢菌素过敏者以及产金属酶G-菌感染者可慎用,一般应联合其它抗PA药物。
5.抗假单胞菌喹诺酮类:此类药物中环丙沙星和左氧氟沙星都具有抗假单胞菌活性,但环丙沙星的抗菌活性更强,其最低抑菌浓度(MIC)为0.5mg/mL,低于左氧氟沙星(1.0 m g/mL);左氧氟沙星的抗菌活性与环丙沙星相仿,其口服吸收率高,肺组织浓度高,但左氧氟沙星通常不用于肺外感染。2011年CHINET 细菌耐药性检测结果显示环丙沙星和左氧氟沙星对PA敏感性分别为70.5%和67.9%。此类药物为浓度依赖性抗生素,主张1天1次给药,如左氧氟沙星
0.5~0.75g,静滴,qd;欧洲建议重症感染可以用到0.5g,静滴,q12h[?]。环丙沙星由于半衰期较短,依然采用分次给药,轻至中度感染,400mg,静滴,q12h;重症感染400mg,静滴,q8h。
6.氨基糖苷类:常用的有阿米卡星、庆大霉素、妥布霉素;应用于临床的还有异帕米星、奈替米星,依替米星,其中以阿米卡星的活性最强。2011年CHINET 细菌耐药性检测结果显示阿米卡星和庆大霉素对PA敏感性分别为80.2%和
68.6%[5]。此类药物通常不单独应用于肺部感染。根据PK/PD理论,此类药物为
浓度依赖性,主张将过去常用的一日二次给药方法改为二次剂量集中一天一次使用,但国内外的剂量之间有差别。通常推荐剂量阿米卡星为15mg/kg/d,静滴,qd;妥布霉素和庆大霉素为7mg/kg/d,静滴,qd;我国常用的还有异帕米星、奈替米星和依替米星。阿米卡星欧洲推荐的剂量为15~20mg/kg/d,ATS推荐的剂量为20mg/kg/d,高于我国的推荐剂量,这值得引起我国临床医师的注意,一方面提示,我国在临床实践中可能存在治疗剂量不足的情况;另一方面,欧美推荐的剂量是否适合我国的具体国情,尚需要我们自己的高等级循证医学证据来支持。为减少不良反应发生,此类药物建议疗程通常不超过1周。
7.多粘菌素:多粘菌素B、多粘菌素E,应用于PA,尤其是XDR-PA和PDR-PA 菌株感染。2011年CHINET细菌耐药性检测结果显示多粘菌素B和多粘菌素E 对PA敏感性分别为55.9%和96.2%[5]。此类药物肾毒性明显,剂量选择必须根据肌酐清除率调整。临床上主要应用的是多粘菌素E,国际上推荐的常用剂量为每天2.5mg/kg~5mg/kg或每天200万U~400万U(100万U相当于多粘菌素E 甲磺酸盐80mg),分2~4次静滴。该类药物存在明显异质性耐药,常需联合应用其他抗菌药物,可与抗假单胞菌碳青霉烯类/氨基糖苷类/喹诺酮类/其它抗假单胞菌β内酰胺类联合使用。在一项V AP对照研究中静脉注射多黏菌素的临床有效率达75%,与对照组亚胺培南72%相似[13]。体外和动物实验中多黏菌素联合利福平或者亚胺培南治疗PA感染,但是临床中如果多黏菌素联合亚胺培南应用>13天,可能分离出MDR-PA并对目前所有抗生素耐药(包括多黏菌素)【】。该类药物的肾毒性及神经系统不良反应发生率高,对于老年人、肾功能下降等患者特别需要注意肾功能的监测。国内该类药物的临床应用经验少。
(三)抗生素治疗合理使用
1.抗生素的选择:
2.联合治疗:体外抗菌研究显示联合治疗存在不同程度的协同作用,如碳青霉烯类(亚胺培南)联合阿米卡星或异帕米星体外抗MDR-PA 4.0%呈现协同作用,46.0%呈现部分协同作用[7]。临床研究也证实多药联合治疗可降低PA肺部感染病死率。包含5个临床研究的meta分析显示,比较单药与多药联合治疗PA 感染的疗效,联合用药组病死率都要低于单药治疗组10%~20%左右[10]。β-内酰胺类抗生素与氨基糖苷类或氟喹诺酮类抗菌药物体外联合后均可提高对PA的
敏感率,但氨基糖苷类的增效作用略强于氟喹诺酮类。所以,PA肺炎治疗的国内外指南(无论2007年IDSA还是2005年ATS指南)均推荐联合用药,包括:抗假单胞菌β-内酰胺类+氨基糖苷类;或抗假单胞菌β-内酰胺类+抗假单胞菌喹诺酮类;或抗假单胞菌喹诺酮类+氨基糖苷类;或者还有双β-内酰胺类治疗,如哌啦西林/他唑巴坦+氨曲南。而对碳青霉烯类耐药尤其是PDR-PA肺部感染,推荐上述联合的基础上再加多粘菌素的治疗。
3.PK/PD理论的应用:应用抗假单胞菌的碳青霉烯类抗生素特别是美罗培南和多尼培南也需要缓慢持续静脉输注1~4小时,目标就是保证给药间隔时的血药浓度仍然维持在MIC以上。多尼培南是在体外抗PA活性最强的碳青霉烯类,在一项前瞻性随机试验中,针对531例V AP患者的治疗,多尼培南的临床缓解率和PA清除率在数字上高于亚胺培南,但无统计学意义[11]。
多黏菌素表现出浓度依赖性的抗菌活性,在体外实验中以浓度-时间曲线下面积为最佳抗菌活性指标。但是多粘菌素几乎没有抗生素后效应,一旦血药浓度低于MIC 2~6小时后,PA会迅速生长。异质性耐药的结果导致耐药菌株取代原有的敏感菌株。因此,从药效学角度尽可能的抑制耐药菌,多粘菌素每6~8h给药一次最为理想[12]。
4.局部抗生素的雾化治疗:用于雾化的抗生素主要是氨基糖苷类和多黏菌素类,主要用于有结构性肺病的PA感染,如支气管扩张症、COPD、囊性肺纤维化和肺移植后。抗生素雾化后局部肺内药物浓度高而血浆浓度低,但通常建议局部抗生素应在全身应用的基础上应用,及作为静脉治疗的补充,如多粘菌素和妥布霉素雾化作为静脉治疗的补充用于MDR-PA难治性肺炎的治疗。氨曲南也可用于局部雾化治疗[14]。此类药物国外正在积极开发,也有临床应用,但国内尚待获得批准。
5.疗程:对于PA感染的临床诊断不确定且临床症状在3天内稳定,推荐8天疗程。如果分离的PA为MDR或PDR菌株,或者为重症PA-HAP,则推荐10~14天疗程。值得注意的是,在有结构性肺部患者中,不应将PA的清除作为停用抗生素的指征。
(四)免疫支持治疗
感染的引流。免疫治疗。营养支持。气道廓清。生物被膜的处理。
五.MDR-PA播散的控制措施[15]
需要注意的是,如果仅仅是呼吸道分泌物PA分离培养阳性而没有临床症状或者影像学依据,可以暂时不需要抗感染治疗。机械通气患者如果病情允许应该尽早拔除气管插管,必要时可以用无创呼吸机辅助呼吸。另一方面,临床容易忽视的是预防,要控制PA肺炎最重要的措施是防止PA在医疗机构中暴发流行。例如防止湿化器、吸引器和家具、血压袖带的污染,注意医疗工作人员手部清洁,对易感染病人行床边隔离消毒,口腔清洁,医疗侵袭性操作时注意清洁等[1]。同样重要的是抗生素管理,包括:①缩短抗生素疗程。②限制或防止细菌耐药性产生:制定抗生素治疗指南,采用抗生素轮换使用策略;在医院中对某些抗生素的使用加以限制;对轻、中度感染尽可能采用窄谱抗生素,严重感染患者经验治疗往往需用广谱抗生素;对MDR-PA感染者采用联合治疗,尤其是粒细胞减低和血流感染患者。③主动监测和隔离医院内MDR-PA感染的患者。
参考文献
1.Gaynes R, Edwards JR; National Nosocomial Infections Surveillance System .
Overview of nosocomial infections caused by gram-negative bacilli . Clin Infect Dis . 2005; 41( 6): 848- 854.
2.Neuhauser MM , Weinstein RA , Rydman R , et al . Antibiotic resistance among
gramnegative bacilli in US intensive care units: implications for fluoroquinolone use . JAMA . 2003 ; 289 ( 7 ): 885 - 888 .
3.Shigeki Fujitani, Hsin-Yun Sun, Victor L, et al. Pneumonia Due to
Pseudomonas aeruginosa Part I: Epidemiology, Clinical Diagnosis. Chest 2011;139(4);909-919
4.朱德妹,汪复, 胡付品等.2010年中国CHINET细菌耐药性监测.中国感染与
化疗杂志.2011;11(5):321-329
5.胡付品, 朱德妹,汪复等.2011年中国CHINET细菌耐药性监测.中国感染与
化疗杂志.2012;12(5):321-329
6.刘又宁,陈民钧,赵铁梅等.中国城市成人社区获得性肺炎665例病原学多中
心调查.中华结核和呼吸杂志2006,29(1):3-8
7.Fine MJ , Smith MA , Carson CA , et al . Prognosis and outcomes of patients with
community-acquired pneumonia. A meta-analysis . JAMA . 1996 ; 275 ( 2 ): 134 - 141 .
8.Robert A, Bonomo and Dora Szabo. Mechanisms of Multidrug Resistance in
Acinetobacter Species and Pseudomonas aeruginosa. Clinical Infectious Diseases.2006(9),43:S49–S56.
9.Murphy TF , Brauer AL , Eschberger K , et al . Pseudomonas aeruginosa in
chronic obstructive pulmonary disease . Am J Respir Crit Care Med . 2008 ; 177 ( 8 ): 853 - 860 .
10.El Solh AA , Akinnusi ME , Wiener-Kronish JP , et al. Persistent infection with
Pseudomonas aeruginosa in ventilator-associated pneumonia . Am J Respir Crit Care Med . 2008 ; 178 ( 5 ): 513 - 519 .
11.Nasia Safdar, Jo Handelsman, and Dennis G Maki. Does combination
antimicrobial therapy reduce mortality in Gram-negative bacteraemia? A meta-analysis. Lancet Infect Dis, 2004; 4(8): 519–27
12.Castanheira M , Jones RN , Livermore DM . Antimicrobial activities of
doripenem and other carbapenems against Pseudomonas aeruginosa , other nonfermentative bacilli, and Aeromonas spp . Diagn Microbiol Infect Dis . 2009 ;
63 ( 4 ): 426 - 433 .
13.Bergen PJ , Li J , Nation RL , Turnidge JD , Coulthard K , Milne RW .
Comparison of once-, twice- and thrice-daily dosing of colistin on antibacterial effect and emergence of resistance: studies with Pseudomonas aeruginosa in an in vitro pharmacodynamic model . J Antimicrob Chemother .2008 ; 61 ( 3 ): 636 - 642 .
14.Kallel H , Hergafi L , Bahloul M , et al . Safety and efficacy of colistin compared
with imipenem in the treatment of ventilator-associated pneumonia: a matched case-control study . Intensive Care Med . 2007 ; 33 ( 7 ): 1162 - 1167 .
15.Michalopoulos A , Fotakis D , Virtzili S , et al . Aerosolized colistin as
adjunctive treatment of ventilator-associated pneumonia due to multidrug-resistant gram-negative bacteria: a prospective study . Respir Med .
2008 ; 102 ( 3 ): 407 - 412 .
16.David L. Paterson. Serious Infections in the Intensive Care Unit: Pseudomonas
aeruginosa and Acinetobacter baumannii. Clin Infect Dis,2006;43(Suppl 2):S41- 21.
17.A. 刘又宁,曹彬,王辉,等. 中国九城市成人医院获得性肺炎微生物学与
临床特点调查. 中华结核和呼吸杂志,2012;35(10):739-746.
铜绿假单胞菌感染和耐药机制 [摘要] 铜绿假单胞菌是医院内感染的重要的致病菌之一,它可导致较高的发病率和病死率,铜绿假单胞菌容易出现耐药性,并且容易表达多种毒性因素,这一切使得现在临床上所用的治疗方法常常无效,本文针对这种状况,首先介绍铜绿假单胞菌在临床上引起的常见的感染和疾病,其次介绍铜绿假单胞菌的耐药性机制,最后提出对抑制铜绿假单胞菌耐药性的药物研究的展望。 [关键词] 铜绿假单胞菌耐药性毒性因素药物 铜绿假单胞菌是革兰氏阴性杆菌,是条件致病菌,它对健康的机体几乎不会引起感染,但是对免疫受损的机体可以引起严重的感染,免疫受损的机体包括囊性纤维化患者,癌症病人,艾滋病毒感染者,严重烧伤病人[1]。由于传统的抗生素治疗,使铜绿假单胞菌对许多抗生素产生了严重的耐药性,它可以产生各种灭活酶或修饰酶, 如内酰胺酶等; 菌体蛋白结构和功能改变逃避抗菌药物作用; 膜屏障与主动排外;形成生物保护膜等[4],来抵制抗生素的作用。这也是在临床上很棘手的问题,使铜绿假单胞菌不仅成为难以治疗的病原菌,也使其成为众多研究细菌致病性和耐药性的对象。首先来了解一下铜绿假单胞菌引起的常见的感染和疾病。 1、铜绿假单胞菌引起的常见的感染和疾病 在临床上发现呼吸科和烧伤科铜绿假单胞菌感染率和检出率较高。 1.1铜绿假单胞菌相关性肺炎它包括慢性阻塞性肺疾病( COPD),医院获得性肺炎(CAP),呼吸机相关性肺炎( V AP),气管镜相关性肺炎,囊性纤维变性(CF)等。 慢性阻塞性肺疾病( COPD) 慢性阻塞性肺疾病( COPD) 是以感染为主要表现的疾病, 由于其呼吸道防御功能下降, 支气管清除能力减弱, 故能引起多种细菌的感染, 铜绿假单胞菌感染是COPD 病人急性加重的主要原因。铜绿假单胞菌一开始就被认为是引起慢性阻塞性肺疾病( COPD)的重要的致病菌[10],Laura 的研究证明铜绿假单胞菌引起COPD病人的慢性感染[11]。 医院获得性肺炎(CAP) 铜绿假单胞菌在社区获得性肺炎中不常见,但在医院获得性肺炎(CAP)中较常见的病原菌之一[2]。CAP 是COPD 常见并发症和重要死亡原因之一, 近年来国内关于COPD 患者合并CAP 方面的研究得到广泛关注。同时由于社会人口的老龄化、免疫损害宿主增加、病原菌变迁和抗菌药物耐药率上升等原因, 其致病菌的组成和耐药特性在不同国家、不同地区之间存在着明显差异, 而且随着时
铜绿假单胞菌下呼吸道感染诊治专家共识 铜绿假单胞菌(Pseudomonas aeruginosa,P. aeruginosa,PA)是一种革兰阴性杆菌,也是临床最常见的非发酵菌,在自然界广泛分布,可作为正常菌群在人体皮肤表面分离到,还可污染医疗器械甚至消毒液,从而导致医源性感染,是医院获得性感染重要的条件致病菌,具有易定植、易变异和多耐药的特点。下呼吸道是医院内细菌感染最常见的发生部位,感染种类主要包括支气管扩张合并感染、慢性阻塞性肺疾病(简称慢阻肺)合并感染和肺炎等,由多重耐药PA(multidrug resistant P aeruginosa,MDR-PA)引起的下呼吸道感染病死率高,治疗困难,因此规范PA下呼吸道感染的诊断和治疗具有特别重要意义。 一、微生物学特点 假单胞菌属为需氧、有鞭毛、无芽孢及无荚膜的革兰阴性杆菌,和不动杆菌属、黄杆菌属、嗜麦芽窄食单胞菌及洋葱伯克霍尔德菌等共同构成非发酵糖(Nonfermenters)革兰阴性杆菌,是常见的条件致病菌,是医院感染的主要病原之一。PA是假单胞菌的代表菌株,占所有假单胞菌感染的70%以上。PA呈球杆状或长丝状,宽约0.5~1.0 μm,长约1.5~3.0 μm,一端有单鞭毛,无芽孢,成双或短链排列。PA能产生多种色素,如绿脓素和荧光素等,专性需氧,部分菌株能在兼性厌氧条件下生长。 二、流行病学 (一)流行状况 近年来,PA感染的流行病学特点突出地表现在两个方面,一是院内感染尤其是肺部感染的发病率不断增加。国内已有多项大型流行病学调查显示我国PA感染的严重性,其中最具代表性的“中国CHINET细菌耐药性监测”资料显示,2012年综合性教学医院PA的分离率占所有分离菌的第5位,2005-2012年PA的分离率分别占革兰阴性菌的11.6%、14.1%、16.9%、16.4%、15.8%、14.8%、14.2%和14.0%,居第2~5位[1]。有13家教学医院参与的中国医院院内获得性细菌耐药性分析(CARES)结果显示,2009年和2011年PA在所有分离细菌中也是居第4位,分离率分别为10.8%和12.6%[2],且MDR-PA的比例高达12.7%。这一点在呼吸系统感染更为突出,根据美国疾病预防控制中心(CDC)的全国医院感染研究数据显示,PA 肺炎的发生率在逐年升高,1975-2003年医院获得性肺炎(HAP)中PA比例从9.6%上升至18.1%,几乎翻了一倍[3]。一项大规模ICU感染病原学的流行病学调查结果显示,PA是最常见的革兰阴性需氧菌,占23%(8 244/35 790),也是最常见的从呼吸道分离出的细菌(31.6%)[4]。美国一项关于呼吸机相关肺炎(VAP)的回顾性研究结果显示,PA分离率达9.3%。即便得到有效地治疗,PA导致的感染总病死率仍高达42.1%~87.0%,直接病死率为 32.0%~42.8%[5]。2005年胡必杰等[6]报道562例HAP中PA的分离率为18.6%,列第1位;我国近期进行的13家大型教学医院HAP的临床调查结果显示,PA的分离率为20.9%,居第2位[7]。2011年CARES研究也证实HAP中PA的分离率为22.9%,居第2位[2]。二是PA的耐药率居高不下,全球细菌耐药监测数据(SENTRY)显示PA在HAP致病原中居前几位,同时对常用抗菌药物耐药率的逐年升高[8]。中国CHINET 2005-2012年连续监测资料显示,PA对常用抗菌药物的耐药率保持在较高水平,但略呈下降趋势。如亚胺培南的年度耐药率分别为31.0%、42.8%、35.8%、30.5%、30.5%、30.8%、29.1%和29.1%,对美罗培南的年度
铜绿假单胞菌(也称绿脓杆菌),为革兰阴性杆菌。在自然界分布广泛,对外界环境的抵抗力较其他细菌强,在潮湿环境能长期生存,对干燥也有较强的抵抗力。 资料表明,水与铜绿假单胞菌的存在联系紧密。医院内长期潮湿的地方及湿的物品是铜绿假单胞菌贮存的场所。水源污染主要来自人或动物排泄物、人肠道铜绿假单胞菌两个途径。铜绿假单胞菌在污染的水中可较长时间的存留,各种液体药剂,包括眼药水长期放置有可能被铜绿假单胞菌污染,消毒剂、手术器械浸泡液都可能成为铜绿假单胞菌的贮存场所。呼吸机湿化装置及导管可作为传播的直接媒介。 铜绿假单胞菌因其生物学特点,营养要求低,潮湿处易生长。大量资料表明医院内病人带菌率很高。人体本身是一个主要的铜绿假单胞菌贮存所,细菌主要存在人体较为潮湿的部位如腋下、会阴部、呼吸道和肠道等。本菌是医院内感染的主要病原菌之一,气管切开和插管、大面积烧伤、恶性肿瘤、免疫力低下、静脉插管及各种侵入性操作的患者易感染本菌,近年来住院患者感染的该细菌多为多重耐药菌,治疗上难度较大。 预防措施 1、铜绿假单胞菌感染的患者应实行接触隔离,住隔离病室,隔离标志明确、醒目,在隔离病房或者区域的入口处应配备手套、手消毒凝胶、隔离衣及外科口罩; 2、医务人员接触患者前,戴好口罩、帽子,穿隔离衣; 3、加强医务人员手卫生,接触患者血液、体液、污物后均应洗手。洗手提倡采用流动水洗手,如果手没有明显污染时,可以用消毒凝胶消毒双手;医务人员如手皮肤有破损,不宜护理此类感染性疾病的患者; 4、护士对患者导管的各项操作,应先从清洁的部位开始再到污染的部位,避免交叉污染,如进行可能产生气溶胶的操作(吸痰或雾化治疗、纤维支气管镜等)时必须戴标准外科口罩,必要时带保护性眼罩; 5、进行床旁检查(如便携式照片、心电图、B超)的仪器在检查完成后用消毒剂进行擦拭消毒; 6、如患者需离开隔离病室到医技科室做检查,主管医生应先电话通知该诊疗科室或在检查单上标注患者感染情况,检查完毕患者接触过的物体表面要及时进行消毒处理; 7、隔离病室患者接触过的一切物品,如被单、衣物、各类医疗器械、导管等应先行消毒处理,然后再清洁(洗)、消毒、灭菌; 8、严格医疗废物管理,患者用过的所有敷料、导管等废物须置入专用黄色医疗废物袋内、封口,锐利器具用后及时放入专用利器盒内,集中焚毁。 铜绿假单胞菌和不动杆菌属都是医院感染的重要病原菌。近年来临床上出现了两者对所有β内酰胺类及喹诺酮类抗菌药耐药的多重耐药株,造成治疗的极大困难。2004 年5 月美国匹兹
龙源期刊网 https://www.doczj.com/doc/e016474378.html, 铜绿假单胞菌的耐药分析 作者:胡慧玲等 来源:《中外医学研究》2014年第10期 【摘要】目的:了解铜绿假单胞菌(PA)医院感染现状及其对抗菌药物的耐药性,为临床医生合理用药提供科学依据。方法:2012年1月-2013年6月某三甲医院分离的1003株铜绿假单胞菌株进行耐药分析,采用法国生物梅里埃VITEK-2 XL全自动微生物鉴定系统,及VITEK-2配套药敏卡片。结果:PA在呼吸道标本中检出率最高,占74.88%,在20种抗菌药物中耐药率小于30%从低到高依次为阿米卡星(2.4%)、妥布霉素(3.9%)、哌拉西林/他唑巴坦(5.9%)、庆大霉素(6.2%)、左旋氧氟沙星和环丙沙星(6.7%)、美洛培南 (7.8%)、亚胺培南(7.9%)、头孢吡肟(8.7%)、哌拉西林(9.8%)、头孢他啶 (11.7%)、氨曲南(21.2%)。2004-2007年与2012-2013年的PA耐药率比较,差异均有统 计学意义(P 【关键词】绿假单胞菌;医院感染:耐药机制 中图分类号 R37 文献标识码 B 文章编号 1674-6805(2014)10-0069-03 1 资料与方法 1.1 一般资料 1003株菌株来源于2012年1月-2013年7月笔者所在医院送检标本。送检标本阳性分离率前五位依次为痰液(包括咽拭子,支气管灌洗液)、分泌物、体液、血、尿。 1.2 方法 采用法国生物梅里埃VITEK-2 XL全自动微生物鉴定系统,及VITEK-2配套药敏卡片。 1.3 质控操作 按全国检验操作规程及仪器操作说明书,美国CLSI药敏规则。质控菌株ACTT27853。 1.4 统计学处理 采用SPSS 18.0软件对所得数据进行统计分析,计量资料用均数±标准差(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。P 2 结果
多重耐药铜绿假单胞菌的感染因素及耐药分析 目的探讨我院多重耐药铜绿假单胞菌的感染情况和特点,为临床感染控制提供依据。方法采用梅里埃VITEC2-Compact全自动微生物分析系统进行鉴定和药敏试验,对2013年1月~2015年1月临床各种标本分离出的95株多重耐药铜绿假单胞菌的耐药性及临床资料进行分析。结果95例多重耐药铜绿假单胞菌中,来自患者的痰液标本占78.9%(75/95),其次是伤口表面分泌物,占10.5%(10/95)。感染因素与气管插管、深静脉插管、外伤创面等因素有关。药敏结果分析显示,PA对头孢曲松的耐药率已达95.00%以上,对头孢他定的耐药率也已达到36.30%。结论多重耐药铜绿假单胞菌感染与各种侵入性的导管和器械检查有关,因此,临床进行创伤治疗时,必须制定有效的感染控制措施,并对铜绿假单胞菌感染患者进行连续的耐药监测和患者隔离,控制多重耐药铜绿假单胞菌的扩散和流行。 [Abstract]Objective To explore the infection situation and features of multi-drug resistant Pseudomonas aeruginosa in our hospital and to provided basis for clinical infection control.Methods BioMerieux VITEC2-Compact automatic microbiology analysis system was applied to identify and to conduct the drug sensitive test.The drug resistance and clinical materials of 95 strains of multi-drug resistant Pseudomonas aeruginosa separated from clinical samples from January 2013 to January 2015 were analyzed.Results 78.9% (75/95)of the 95 strains of multi-drug resistant Pseudomonas aeruginosa were separated from sputum samples,followed by secretion of wounds (10.5%,10/95).Trachea intubation,deep venous cannula,and trauma wound were significant infection factors.Drug sensitivity results showed that the drug resistance of ceftriaxone was over 95.00%,and the resistance rate of ceftazidime was 36.30%.Conclusion Infection of multi-drug resistant Pseudomonas aeruginosa is related to various invasive catheters and instrumental examinations.Therefore,in the treatment of trauma,effective infection control measures should be formulated to conduct continuous drug resistance monitoring and isolation of those infected with Pseudomonas aeruginosa and to control the spread and prevalence of multi-drug resistant Pseudomonas aeruginosa. [Key words]Multi-drug resistant;Pseudomonas aeruginosa;Infection control 铜绿假单胞菌(Pseudomonas aeruginosa,PA)俗称绿脓杆菌,广泛存在于自然界、各种医疗器械及导管表面,是院内感染的常见病原菌[1]。由于抗菌药物的不合理应用,使得PA产生多种耐药机制,出现大量的多重耐药菌株,治疗效果很不理想,因此,有效预防多重耐药菌的出现是控制感染的关键。 1资料与方法 1.1一般资料
铜绿假单胞菌对碳青霉烯类耐药的机制及临床研究[关键词] 铜绿假单胞菌;耐药性;美罗培南;亚胺培南 各种抗假单胞菌药物在治疗铜绿假单胞菌感染过程中或治疗后可出现不同程度的耐药导致治疗失败,但各种药物诱导耐药的相对危险性可有差异。了解铜绿假单胞菌对碳青霉烯类耐药的机制,及时掌握新的耐药动向及其相关因素,有助于制定切合实际的控制耐药方案。 1铜绿假单胞菌对碳青霉烯类耐药的机制 OprD为铜绿假单胞菌外膜孔道蛋白,可被动性摄取碱性氨基酸,亦可渗透碳青霉烯类药物。对亚胺培南的渗透率为736nm/s,对美罗培南为73nm/s,表明亚胺培南透入铜绿假单胞菌比美罗培南快10倍。OprD丢失后,两者的渗透率分别为6nm/s及5.5nm/s,对亚胺培南的MIC从1-2mg/L上升到8-32mg /L,对美罗培南的MIC从0.12~0.5mg/L上升到2~4mg/L。铜绿假单胞菌OprD丢失或下降是介导对亚胺培南耐药的主要机制,对美罗培南的影响较少可能与通过尚未确定的通道进入菌体有关。因单纯OprD丢失不影响对非碳青霉烯类药物的敏感性,属窄谱耐药机制。 亚胺培南为强力β-内酰胺酶诱导剂,诱导铜绿假单胞菌产生Bush IB-内酰胺酶,Bush I酶可快速水解抗假单胞菌头孢菌素类及青霉素类药物,但对亚胺培南只具缓慢水解作用。铜绿假单胞菌外膜孔道蛋白(OprD)丢失可引起对亚胺培南耐药,但若单纯OprD丢失而无β一内酰胺酶参入,则对亚胺培南的MIC只由0.25mg /L增至0.5mg/L,若OprD丢失同时伴口一内酰胺酶的作用,则可使其MIC 增至16mg/L,表明β-内酰胺酶与渗透性改变介导对亚胺培南耐药具协同作用。美罗培南比亚胺培南对β-内酰胺酶更稳定,OprD丢失伴β-内酰胺酶作用仅使铜绿假单胞菌对美罗培南的MIC增至2-4mg/L。产金属β-内酰胺酶的菌株亦可能需要OprD丢失才对碳青霉烯类耐药,虽然产金属酶类药物仍属少见,但正在成为铜绿假单胞菌对亚胺培南及美罗培南高度耐药的原因,并可能成为今后严重的问题。 MexB蛋白为广谱泵,位于胞浆膜中,OprM为孔道蛋白通过外膜的出口,MexA为连接蛋白。在mexR位nalB突变导致MexAB-OprM上调最为常见。MexAB—OprM具天然清除双歧性分子(对胞浆膜有损害作用)的功能,并演变具特殊性。因亚胺培南无嗜脂苯或杂环侧链,故MexB不能识别亚胺培南,亦不能外排,但美罗培南具有2’杂环侧链,可被MexB识别,并被外排。MexAB-OprM 上调是介导对美罗培南耐药的主要机制,可使美罗培南的MIC从0.12~0.5mg /L上升到2-4mg/L。MexAB-OprM高表达能影响对美罗培南的抗菌活性,而对亚胺培南则无影响。还有MexXY-OprM及MexCD—OprJ上调都可引起对美罗培南敏感性降低,亦不影响对亚胺培南的敏感性,且与MexAB-OprM一样都可引起对喹诺酮类及其他β-内酰胺酶类耐药,MexXY-OprM上调还可引起对氨基苷类耐药。另一泵出系统MexEF-OprN是由nfxc突变上调,不常见,对美罗
铜绿假单胞菌感染治疗策略 铜绿假单胞菌作为一种条件致病菌常定植于正常人的呼吸道,皮肤粘膜以及医疗设备等处。当患者免疫力低下,长期使用广谱抗生素,糖皮质激素及接受吸氧、气管插管机械通气时,铜绿假单胞菌大量繁殖,往往导致严重下呼吸道感染。因为铜绿假单胞菌的耐药及复发率高,故临床治疗较为困难。为更好地预防和控制医院感染,建议应采取以预防为主,加强对铜绿假单胞菌的耐药性监测,及早进行菌株鉴定和药敏检测,避免大量和长期使用同一类型的抗菌药物,并规范抗菌药物的应用,具体措施如下: 一、阻断病原菌播散 医院加强对高危患者的病原菌监测,尤其将下列患者列为目标监测的重点:住在ICU、接受过广谱抗菌药物治疗或抗菌药物治疗效果不佳的患者,留置各种导管以及合并慢性基础疾病的患者。对目标监测患者进行主动筛查和定期监测,及时发现、早期诊断铜绿假单胞菌感染与定植患者。如:患者的呼吸道长期定植铜绿假单胞菌,到多家医院就诊导致其克隆传播,致使不同医院间存在同一克隆株的PA,因此,加强对铜绿假单胞菌定植患者的监控,是控制克隆株播散的关键。有文献报导PA克隆朱主要在ICU病房流行,原因可能为ICU住院患者病情重、自身免疫力低下,多接受过侵入性治疗,因此,加强病区(尤其是重点科室)的消毒、隔离和监控工作,阻断外源性传播媒介,是有效控耐药PA在医院感染发生和流行的重要途径。 二、加强监测抗铜绿假单胞菌的药物及其敏感性
目前可用于治疗铜绿假单胞菌感染的药物基本有六类:青霉素类、头孢菌素类、碳青霉烯类、单环β-内酰胺类,氨基糖苷类和喹诺酮类,另外多黏菌素类(如黏菌素,多黏菌素B)以及磺胺类(甲磺灭脓、磺胺嘧啶银)主要用于铜绿假单胞菌的局部感染的治疗。多黏菌素B也用于难治性的铜绿假单胞菌感染的全身治疗。2011年中国C H IN E T铜绿假单胞菌耐药性监测显示铜绿假单胞菌对阿米卡星的耐 药率最低,为14.3%,对头孢哌酮和氨曲南的耐药率最高,分别为31.7%和38.9%,对其他抗菌药物的耐药率为19~30%,耐药率从低到高依次为:阿米卡星<头孢吡肟<头孢他啶<头孢哌酮一舒巴坦<环丙沙星<哌拉西林一他唑巴坦<庆大霉素<美罗培南<亚胺培南<哌拉 西林<头孢哌酮<氨曲南。 (1)青霉素类药物包括哌拉西林、哌拉西林/他唑巴坦、美洛西林、替卡西林、替卡西林/克拉维酸,其中以哌拉西林最常用于铜绿假单胞菌导致的肺部感染。 (2)头孢菌素类药物包括头孢他啶、头孢吡肟、头孢哌酮、头孢匹胺是铜绿假单胞菌的敏感药物。头孢他啶是目前针对铜绿假单胞菌作用最强的药物,头孢吡肟对铜绿假单胞菌的作用与头孢他啶相似,头孢哌酮对铜绿假单胞菌有良好的抗菌作用,可用于铜绿假单胞菌感染的联合治疗用药,头孢匹胺对铜绿假单胞菌的作用与头孢哌酮和哌拉西林相似或略优。 (3)碳毒霉烯类药物该类药物抗菌谱特别广,抗菌活性强。治疗PA感染应首选敏感药物碳青霉烯类,并且初始剂量宜大,以增强其
综述中国生化药物杂志2016年第12期总第36卷D O I:10.3969/j.issn. 1005-1678. 2016. 12.058 铜绿假单胞菌产生耐药性的机制 孟鑫,尚德静& (辽宁师范大学生命科学学院,辽宁大连116081) [摘要]铜绿假单胞菌鳳s aeru扣而a,_P.aeru扣而a)与其它革兰氏阴性菌相比,其外膜渗透性低,并且多种耐药机制 协同作用,更容易表现出对大多数抗生素极低的易感性,从而加入了 “超级细菌”的行列。最近使用突变体库筛选,微阵列技术和突 变频率分析已经证实在体内生长条件或复杂的适应条件下(如b io film生长或群体迁移),抗生素本身也能够诱发非常大的基因团簇 突变从而导致耐药性以及新的适应性抗性。 [关键词]铜绿假单胞菌耐药性适应性抗性 [中图分类号]R453.2 [文献标识码]A Mechanism of drug resistance of P seudom onas aeruginosa MENG Xin, SHANG De-jingA (Faculty of Life Science,Liaoning Normal University,Dalian 116081 ,China) [A b s t r a c t]Pseudomonas aeruginosa exhibits an inherently reduced susceptibility to most antibiotics compared with most other Gram-negative bacterial species because its low outer membrane permeability and the multiple ways in which P. aeruginosa can become drug-resistant. Pseudomonas has joined the “super bacteria”. Recent researches, using mutant library screening, microarray technology, and mutation frequency analysis have demonstrated that antibiotics themselves can induce very large groups of genes in vivo growth conditions or complex adaptation conditions ( for example, biofilm growth or swarming motility) , resulting in resistance as well as new forms of adaptive resistance. [K e y w o r d s] Pseudomonas aeruginosa;resistance ;adaptive resistance 自临床引人抗生素并滥用抗生素以来,细菌具有越来越复 杂的耐药性,导致“超级细菌”的出现和扩散,几乎对市场上所有 可用的抗菌药物都有一定的抗性。铜绿假单胞菌 aeru扣而a)是革兰氏阴性细菌,可以广泛感染动植 物宿主[1],常见的医院感染中有10 ~ 15%是由其引起的[2],主要 引起了囊性纤维化(cystic fibrosis,CF)患者的慢性肺部感染[33]。此夕卜,P.aerugi/WMa是呼吸机相关性肺炎(ventilator associated pneumonia,VAP)最常见的致病菌之一[5_6],_P.引起的肺炎,常常导致急性肺损伤和继发性脓毒症,造成高死亡率[7_11]。 与其他病原体相比,对多种抗生素(包括氨基 糖苷类,氟喹诺酮类和P-内酰胺类)显示出较强的内源性抗性。例如:对羧苄青霉素的内源性抗性使得大多数P-内酰胺类(包括 美罗培南而非亚胺培南)抗生素的最小抑菌浓度(minimum inhibitory concentmtion,MIC)增加4 倍;对非p-内酰胺抗生素 如喹诺酮,甲氧苄氨嘧啶,四环素和氯霉素也有一定的内源性抗 作者筒介:孟鑫,女,硕士在读,研究方向:分子遗传学,E-m ail: 1317302082@ https://www.doczj.com/doc/e016474378.html,;尚德静,通信作者,女,博士,教授,博士生导师,研究方向:生物化学与分子生物学,E-mail :djshang@ lnnu. edu. cn。性。这种内源性抗性主要源于其极低的外膜渗透性或外排系统 被激活产生的去抑制作用。f*.外膜中存在大量无效的成孔蛋白,限制了抗生素分子穿人细胞的速度[12],使得次级 适应性抗性机制能更有效地运行,如增加外排功能和酶对抗生 素的修饰。 这些内在机制是遗传组成的一部分,可以通 过突变来稳定或增强,有些突变影响耐药性基因的表达及产物 的活性从而导致M IC变大,使许多常见的抗生素对P. aeragimwa没有效果,其他突变可能轻微地增加耐药性,使P. aeragmosa在大多数抗生素作用下的易感性逐渐降低,此外,一些菌株还可以通过水平转移(即菌株之间)抗性基因决定簇增加 耐药性。 除了内源性抗性这种比较传统的耐药机制,近年来发现P. aeragiraosa对不断变化的环境条件和胁迫有很强的适应性,也可 以引起对抗生素的适应性抗性,如接触抗生素,改变培养基条件 或改变生长状态等[13],这种适应性抗性的现象早就报道过,然 而,最近才研究其对临床问题的广泛适用性。 虽然抗生素对多数由aeragimwa引起的感染有效,但是 其仍可以通过多种方式产生耐药性,导致耐药率不断增加,加之 —200—
铜绿假单胞菌分布及耐药性分析 发表时间:2011-08-03T16:04:13.653Z 来源:《中国健康月刊(学术版)》2011年第6期供稿作者:樊剑吴稷高咏梅李敬梅刘云秀陈艳玲 [导读] 铜绿假单胞菌广泛分布于自然界、正常皮肤、肠道、呼吸道、医院病房及医疗器械等樊剑吴稷高咏梅李敬梅刘云秀陈艳玲 【摘要】目的:了解本地区铜绿假单胞菌的耐药性,为临床合理选用抗菌药物提供依自动微生物鉴定/药敏分析仪进行培养、分离、鉴定及药敏试验。对分离80株铜绿假单胞菌的分布及细菌耐药性进行回顾性分析。结果细菌检出最高分别为大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌。铜绿假单胞菌在痰液标本中分布最高为86.25%。铜绿假单胞菌对头孢哌酮、头孢曲松、哌拉西林、耐药率分别为50.00%、46.15%、45.45%,耐药率低的是左氧氟沙星、亚胺培南、氨曲南、头孢吡肟、头孢他啶,耐药性分别是为18.42%、21.79%、21.79%、23.1%、25.79%。结论铜绿假单胞菌为医院呼吸道感染的常见致病菌,对多种抗菌药物呈不同程度耐药,应加强其耐药性的监测,合理使用抗菌药物。 【关键词】铜绿假单胞菌;耐药性;感染;抗菌药物 【中图分类号】R886【文献标识码】B【文章编号】1005-0515(2011)06-0159-02 铜绿假单胞菌广泛分布于自然界、正常皮肤、肠道、呼吸道、医院病房及医疗器械等,是临床上常见的条件致病菌,因其易定植、易变异、以及多重耐药性的特征,已逐渐成为医院感染的主要致病菌之一。特别是呼吸道感染感染多见,由于该菌属有多重耐药性,给治疗带来很多困难。王以光等报道[1]铜绿假单胞菌对目前临床应用的100种抗生素均显示有抗药性,是新世纪对人类生命造成威胁的3种细菌之一。为探讨铜绿假单胞菌感染分布及耐药现状,我们对本地区2008年1月~12月本院临床送检标本中分离的80株铜绿假单胞菌在标本中的分布及常用抗菌药物的耐药性进行统计分析,为合理选用抗菌药物提供依据。 1资料与方法 1.1标本来源来自我院2009年1月~ 12月临床送检标本,包括血、尿、痰及各种分泌物。 1.2菌株的培养、分离、鉴定、药敏试验采用英国Aris 全自动微生物鉴定/药敏分析仪,配套鉴定及药敏板,药敏板完全符合NCCLS 标准。 1.3质控菌株铜绿假单胞菌ATCC27853,大肠埃希菌ATCC25922,肺炎克雷伯菌ATCC700603 1.4采用回顾性统计分析。 2结果 2.1细菌检出情况:共送检标本1985份,阳性标本703份,检出率为35.41%。在检出的703株检出率排在前3位的是:大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌。 2.2检出的铜绿假单胞菌在送检标本中的分布情况见表1
铜绿假单胞菌治疗策略 HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】
铜绿假单胞菌感染治疗策略 铜绿假单胞菌作为一种条件致病菌常定植于正常人的呼吸道,皮肤粘膜以及医疗设备等处。当患者免疫力低下,长期使用广谱抗生素,糖皮质激素及接受吸氧、气管插管机械通气时,铜绿假单胞菌大量繁殖,往往导致严重下呼吸道感染。因为铜绿假单胞菌的耐药及复发率高,故临床治疗较为困难。为更好地预防和控制医院感染,建议应采取以预防为主,加强对铜绿假单胞菌的耐药性监测,及早进行菌株鉴定和药敏检测,避免大量和长期使用同一类型的抗菌药物,并规范抗菌药物的应用,具体措施如下: 一、阻断病原菌播散 医院加强对高危患者的病原菌监测,尤其将下列患者列为目标监测的重点:住在ICU、接受过广谱抗菌药物治疗或抗菌药物治疗效果不佳的患者,留置各种导管以及合并慢性基础疾病的患者。对目标监测患者进行主动筛查和定期监测,及时发现、早期诊断铜绿假单胞菌感染与定植患者。如:患者的呼吸道长期定植铜绿假单胞菌,到多家医院就诊导致其克隆传播,致使不同医院间存在同一克隆株的PA,因此,加强对铜绿假单胞菌定植患者的监控,是控制克隆株播散的关键。有文献报导PA克隆朱主要在ICU病房流行,原因可能为ICU住院患者病情重、自身免疫力低下,多接受过侵入性治疗,因此,加强病区(尤其是重点科室)的消毒、隔离和监控工作,阻断外源性传播媒介,是有效控耐药PA在医院感染发生和流行的重要途径。 二、加强监测抗铜绿假单胞菌的药物及其敏感性
目前可用于治疗铜绿假单胞菌感染的药物基本有六类:青霉素类、头孢菌素类、碳青霉烯类、单环β-内酰胺类,氨基糖苷类和喹诺酮类,另外多黏菌素类(如黏菌素,多黏菌素B)以及磺胺类(甲磺灭脓、磺胺嘧啶银)主要用于铜绿假单胞菌的局部感染的治疗。多黏菌素B也用于难治性的铜绿假单胞菌感染的全身治疗。2011年中国C H IN E T 铜绿假单胞菌耐药性监测显示铜绿假单胞菌对阿米卡星的耐药率最低,为14.3%,对头孢哌酮和氨曲南的耐药率最高,分别为%和%,对其他抗菌药物的耐药率为19~30%,耐药率从低到高依次为:阿米卡星<头孢吡肟<头孢他啶<头孢哌酮一舒巴坦<环丙沙星<哌拉西林一他唑巴坦<庆大霉素<美罗培南<亚胺培南<哌拉西林<头孢哌酮<氨曲南。 (1)青霉素类药物包括哌拉西林、哌拉西林/他唑巴坦、美洛西林、替卡西林、替卡西林/克拉维酸,其中以哌拉西林最常用于铜绿假单胞菌导致的肺部感染。 (2)头孢菌素类药物包括头孢他啶、头孢吡肟、头孢哌酮、头孢匹胺是铜绿假单胞菌的敏感药物。头孢他啶是目前针对铜绿假单胞菌作用最强的药物,头孢吡肟对铜绿假单胞菌的作用与头孢他啶相似,头孢哌酮对铜绿假单胞菌有良好的抗菌作用,可用于铜绿假单胞菌感染的联合治疗用药,头孢匹胺对铜绿假单胞菌的作用与头孢哌酮和哌拉西林相似或略优。 (3)碳毒霉烯类药物该类药物抗菌谱特别广,抗菌活性强。治疗PA 感染应首选敏感药物碳青霉烯类,并且初始剂量宜大,以增强其迅速的杀菌能力和延长药物浓度依赖性的药物后效应。
编译 多重耐药铜绿假单胞菌与鲍曼不动杆菌严重感染的防治策略 汪 复编译 关键词: 铜绿假单胞菌;鲍曼不动杆菌;多重耐药株;泛耐药株 中图分类号:R 378.991 文献标识码:C 文章编号:1009 7708(2007)03 0230 03 Strategies for control of serious infections caused by multi drug resistant Pseudo monas aeruginosa and Acinetobacter baumannii WAN G Fu. (Institute of Antibiotics,H uashan H osp ital,Fudan University ,Shanghai 200040,China) 作者单位:复旦大学附属华山医院抗生素研究所,上海 200040。 作者简介:汪复。 通讯作者:汪复。 铜绿假单胞菌和不动杆菌属都是医院感染的重要病原菌。近年来临床上出现了两者对所有 内酰胺类及喹诺酮类抗菌药耐药的多重耐药株,造成治疗的极大困难。2004年5月美国匹兹堡医学中心举行高层专家专题讨论会,内容涉及革兰阴性杆菌(重点为多重耐药铜绿假单胞菌和鲍曼不动杆菌)耐药性的流行病学、耐药机制、防治对策及病原治疗等问题,现就若干主要问题达成的共识作一简述,供读者参考。 一、多重耐药株和泛耐药株定义及流行病学 一般认为对下列5类抗菌药中(具有抗铜绿假单胞菌活性者)1类以上药物耐药者为多重耐药株,包括头孢菌素类、碳青霉烯类、 内酰胺酶抑制剂复方、氟喹诺酮类和氨基糖苷类。泛耐药株是指对目前推荐用于上述细菌铜绿假单胞菌和鲍曼不动杆菌感染经验治疗的药物全部耐药者,包括头孢吡肟、头孢他啶、亚胺培南、美罗培南、哌拉西林 三唑巴坦、环丙沙星、左氧氟沙星。但氨基糖苷类可不计入,因为该类药物单独用于治疗铜绿假单胞菌感染,往往失败。 铜绿假单胞菌适宜在潮湿环境中生长,如水、土壤、植物、水果、花、蔬菜等。在人体定植少,可能存在于消化道及鼻、腋下、会阴等部位。医院中医疗用液体(如消毒液、冲洗液、透析液等)、呼吸器等医疗器械或淋浴头等亦可有该菌污染。不动杆菌属多处 于潮湿或干燥表面,并可在正常人皮肤上定植。通常不致病,医院中蒸馏水容器、瓶装水、静脉营养液、 湿化器吸引管、冲洗液人工通气装置等可能受到该菌污染。分子流行病学研究证实上述2种细菌在医院内均存在克隆传播,但主要通过医院环境接触还是经人与人之间直接传播目前尚无定论。 多重耐药菌产生的危险因素:多项研究结果显示应用氟喹诺酮类药和 内酰胺类(如阿莫西林 克拉维酸、第三代头孢菌素或亚胺培南)是导致多重耐药铜绿假单胞菌医院感染的危险因素。另有多项临床对照试验结果,使用第三代头孢菌素或联用氨曲南、或碳青霉烯类、或氟喹诺酮类是导致多重耐药不动杆菌属感染的危险因素。鉴于上述两种细菌中的多耐株和泛耐株感染缺乏有效治疗药物,因此专家指出在细菌耐药性监测中除调查细菌对不同抗菌药的耐药率外,尤应重视多重耐药株和泛耐药株的发生率,以便了解此种耐药菌在全球范围内的影响。 二、铜绿假单胞菌和不动杆菌属的耐药机制(表1)(一) 内酰胺酶 两者均可产生染色体介导头孢菌素酶(Am pC 酶),某些抗生素的应用可能选择出去抑制高产AmpC 酶的突变株导致铜绿假单胞菌对哌拉西林、第三代头孢菌素等多种抗生素耐药。此外该两种菌尚可产生多种其他 内酰胺酶以及丝氨酸或金属碳青霉烯酶(IM P 、VIM 酶)等。 (二)细菌外膜蛋白改变使抗生素进入细菌体内的量减少。 (三)氨基糖苷类钝化酶导致此两种细菌对多种氨基糖苷类抗生素耐药。 (四)喹诺酮类耐药 两种细菌均可发生拓扑异
铜绿假单胞菌下呼吸道感染诊治专家共识中华医学会呼吸病学分会感染学组)是一种革兰阴性杆菌,也是临床最常PA,P.aeruginosa,铜绿假单胞菌(Pseudomonasaeruginosa见的非发酵菌,在自然界广泛分布,可作为正常菌群在人体皮肤表面分离到,还可污染医疗器械甚至消毒是医院获得性感染重要的条件致病菌,具有易定植、易变异和多耐药的特点。液,从而导致医源性感染.下呼吸道是医院内细菌感染最常见的发生部位,感染种类主要包括支气管扩张合并感染、慢性阻塞性)MDR-PA Paeruginosa,肺疾病(简称慢阻肺)合并感染和肺炎等,由多重耐药PA(multidrug resistant下呼吸道感染的诊断和治疗具有特别重要的意义。因此规范PA引起的下呼吸道感染病死率高,治疗困难,一、微生物学特点假单胞菌属为需氧、有鞭毛、无芽孢及无荚膜的革兰阴性杆菌和不动杆菌属、黄杆菌属、嗜麦芽窄食单胞菌及洋葱伯克霍尔德菌等共同构成非发酵糖革兰阴性杆菌,是常见的条件致病菌,尤其是医院感染的主要病原之一。0.5~1.0呈球杆状或长丝状,宽约以上。PAPA是假单胞菌的代表菌株,占所有假单胞菌感染的70%能产生多种色素,如绿脓素和荧PA.成双或短链排列。xm,—端有单鞭毛,无芽孢(xm,长约1.5~3.0(光素等,专性需氧,部分菌株能在兼性厌氧条件下生长。二、流行病学(一)流行状况感染的流行病学特点突出地表现在两个方面,一是院内感染,尤其是肺部感染的发病率PA近年来,CHINET中国感染的严重性,其中最具代表性的“不断增加。国内已有多项大型流行病学调查显示我国PA年—2012的分离率占所有分离菌的第5位,2005资料显示,细菌耐药性监测”2012年综合性教学医院PA,和14.0%、14.8%、14.2%,14.1%,16.9%、16.4%、15.8%PA的分离率分别占革兰阴性菌的11.6%2~5位。居第20112009年和家教学医院参与的中国医院院内获得性细菌耐药性分析(CARES)结果显示,有1312.7%。且MDR-PA的比例高达4位,分离率分别为10.8%和12.6%m,年PA在所有分离细菌中也是居第肺炎)的全国医院感染研究数据显示,PA这一点在呼吸系统感染更为突出,美国疾病预防控制中心(CDC,几乎翻18.1%比例从9.6%上升至—19752003年医院获得性肺炎(HAP)中PA的发生率在逐年升高,倍。了123%是最常见的革兰阴性需氧菌,占ICU感染病原学的流行病学调查结果显示,PA一项大规模)。8244/35790),也是最常见的从呼吸道分离出的细菌(31.6%(。即便得到有效的9.3%)的回顾性研究结果显示.PA分离率达美国一项关于呼吸机相关性肺炎(VAP。,直接病死率为32.0%~42.8%治疗,PA导致的感染总病死率仍髙达42.1%~87.0%家大型教13位;我国近期进行的18.6%,列第1PA2005年胡必杰等报道562例HAP中的分离率为2位。,居第的临床调查结果显示,PA的分离率为20.9%学医院HAP 的耐药率居高不下,位。二是PA的分离率为22.9%,居第22011年CARES研究也证实HAP中PA致病原中居前几位,同时对常用抗菌药物的耐药率逐在HAPSENTRY)显示,PA全球细菌耐药监测数据(年升高。对常用抗菌药物的耐药率保持在较高水平,但略年连续监测资料显示,PACHINET2005—2012中国29.1%,30.5%、30.8%42.8%、35.8%、30.5%、呈下降趋势。如亚胺培南的年度耐药率分别为31.0%、25.0%,,25.8%28.5%,24.5%、25.2%和29.1%,对美罗培南的年度耐药率分别为32.0%、34.1%, 1.5%。2012年分别达到1.8%和和27.1%,但其中全耐药(PDR)菌株数量显著增多,在2011年和,这一点在呼吸系22.1%对亚胺培南和美罗培南的耐药率达29.3%和CARES2011年研究也证实PA和70.7%PA对亚胺培南和美罗培南的耐药率分别高达统感染中更为突出,我国HAP临床调查结果显示,PA对碳青霉烯类的耐药率。,远高于48.8%CHINET监测中各种标本分离菌中对PA年的中国CHINET资料显示2012PA 对于其他具有抗假单胞菌活性的药物敏感度也不容乐观,,19.8%,舒巴坦、头孢他啶、环丙沙星和哌拉西林--他唑巴坦的耐药率分别为13.5%阿米卡星、头孢哌酮。和、19.6%17.9%17.5% 1
铜绿假单胞菌下呼吸道感染诊治专家共识(全文) 铜绿假单胞菌(Pseudomonas aeruginosa,P. aeruginosa,PA)是一种革兰阴性杆菌,也是临床最常见的非发酵菌,在自然界广泛分布,可作为正常菌群在人体皮肤表面分离到,还可污染医疗器械甚至消毒液,从而导致医源性感染,是医院获得性感染重要的条件致病菌,具有易定植、易变异和多耐药的特点。下呼吸道是医院内细菌感染最常见的发生部位,感染种类主要包括支气管扩张合并感染、慢性阻塞性肺疾病(简称慢阻肺)合并感染和肺炎等,由多重耐药PA(multidrug resistant P aeruginosa,MDR-PA)引起的下呼吸道感染病死率高,治疗困难,因此规范PA下呼吸道感染的诊断和治疗具有特别重要意义。 一、微生物学特点 假单胞菌属为需氧、有鞭毛、无芽孢及无荚膜的革兰阴性杆菌,和不动杆菌属、黄杆菌属、嗜麦芽窄食单胞菌及洋葱伯克霍尔德菌等共同构成非发酵糖(Nonfermenters)革兰阴性杆菌,是常见的条件致病菌,是医院感染的主要病原之一。PA是假单胞菌的代表菌株,占所有假单胞菌感染的70%以上。PA呈球杆状或长丝状,宽约0.5~1.0 μm,长约1.5~3.0 μm,一端有单鞭毛,无芽孢,成双或短链排列。PA能产生多种色素,如绿脓素和荧光素等,专性需氧,部分菌株能在兼性厌氧条件下生长。 二、流行病学
(一)流行状况 近年来,PA感染的流行病学特点突出地表现在两个方面,一是院内感染尤其是肺部感染的发病率不断增加。国内已有多项大型流行病学调查显示我国PA感染的严重性,其中最具代表性的“中国CHINET细菌耐药性监测”资料显示,2012年综合性教学医院PA的分离率占所有分离菌的第5位,2005-2012年PA的分离率分别占革兰阴性菌的11.6%、14.1%、16.9%、16.4%、15.8%、14.8%、14.2%和14.0%,居第2~5位[1]。有13家教学医院参与的中国医院院内获得性细菌耐药性分析(CARES)结果显示,2009年和2011年PA在所有分离细菌中也是居第4位,分离率分别为10.8%和12.6% [2],且MDR-PA的比例高达12.7%。这一点在呼吸系统感染更为突出,根据美国疾病预防控制中心(CDC)的全国医院感染研究数据显示,PA肺炎的发生率在逐年升高,1975-2003年医院获得性肺炎(HAP)中PA比例从9.6%上升至18.1%,几乎翻了一倍[3]。一项大规模ICU感染病原学的流行病学调查结果显示,PA是最常见的革兰阴性需氧菌,占23%(8 244/35 790),也是最常见的从呼吸道分离出的细菌(31.6%)[4]。美国一项关于呼吸机相关肺炎(VAP)的回顾性研究结果显示,PA分离率达9.3%。即便得到有效地治疗,PA导致的感染总病死率仍高达42.1%~87.0%,直接病死率为32.0%~42.8%[5]。2005年胡必杰等[6]报道562例HAP中PA的分离率为18.6%,列第1位;我国近期进行的13家大型教学医院HAP的临床调查结果显示,PA 的分离率为20.9%,居第2位[7]。2011年CARES研究也证实HAP中PA的分离率为22.9%,居第2位[2]。二是PA的耐药率居高不下,全球