
创作编号:
GB8878185555334563BT9125XW
创作者:凤呜大王*
酸碱中和滴定原理的计算
酸碱中和滴定原理:
在中和反应中使用一种已知物质的量浓度的酸(或碱)溶液与未知物质的量浓度的碱(或酸)溶液完全中和,测出二者所用的体积,根据化学方程式中酸碱物质的量比求出未知溶液的物质的量浓度。根据酸碱中和反应的实质是: H++OH-=H2O
C酸V酸=C碱V碱或:C未知V未知=C标准V标准,或
一、简单酸碱中和滴定
1.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
若滴定开始和结束时,碱式滴定管中的液面如图所示,
则起始读数为________mL,终点读数为_______________________ mL;
所用盐酸溶液的体积为____________mL.
0.0025.90根据C酸V酸=C碱V碱可得盐酸溶液的体积25.90mL.
2.某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为:某学生根据三次实验分别记录有关数据如下表:
列式计算该盐酸溶液的物质的量浓度:c(HCl)=。
根据C酸V酸=C碱V碱,混合碱的体积为(22.62+22.72+22.80)/3=22.71mL,可得盐酸溶液的浓度为0.1136 mol/L
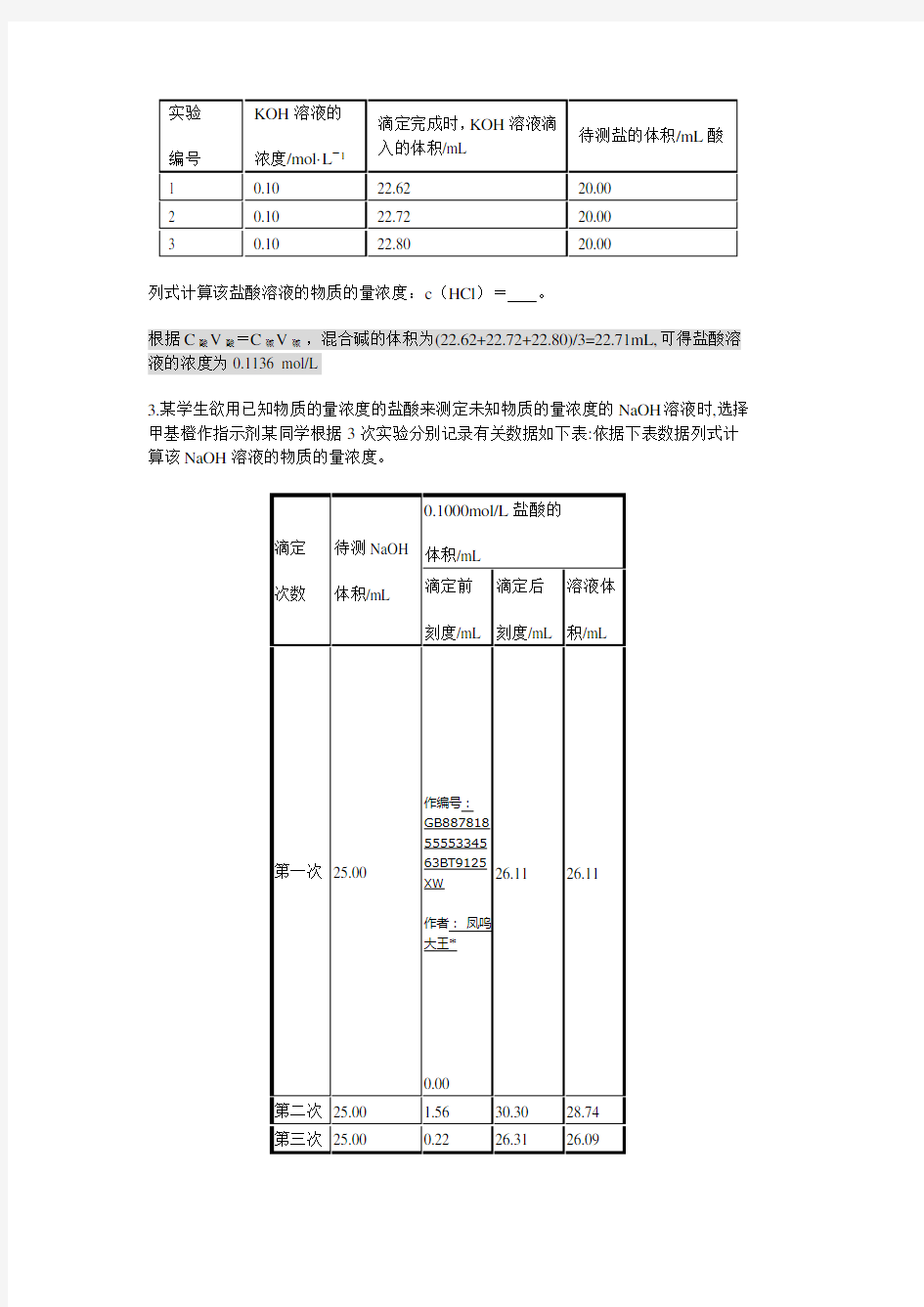
3.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂某同学根据3次实验分别记录有关数据如下表:依据下表数据列式计算该NaOH溶液的物质的量浓度。
由表格可知第二组数据存在错误,所以舍弃,则
mL=26.10mL,c(NaOH)==0.104 4 mol/L
4.实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取w g无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。若滴到终点时,中和w g Na2CO3消耗盐酸V mL,则盐酸的物质的量浓度为________mol·L—1。
盐酸的浓度为
5.实验室常用邻苯二甲酸氢钾(KHC8H4O4)来测定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH====KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份质量均为0.510 5 g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00 mL,则NaOH溶液的物质的量浓度是多少?(结果保留四位有效数字)
二、应用酸碱中和滴定测混合物纯度、质量分数计算
(一般是根据已知文字信息,把文字转化为化学反应方程式,,找到对应的物质的量之间的关系,基于酸碱中和滴定的原理可以测定出混合物质中某一物质的纯度、质量分数)
1.维生素C是一种水溶性维生素(其水溶液呈酸性),它的化学式是C6H8O6,人体缺乏这样的维生素能得坏血症,所以维生素C又称抗坏血酸。在新鲜的水果、蔬菜、乳制品中都富含维生素C,例如新鲜橙汁中维生素C的含量在500mg/L左右。十二中某研究性学习小组测定了某品牌软包装橙汁中维生素C的含量,下面是他们的实验分析报告。
(一)测定目的:测定×××牌软包装橙汁中维生素C的含量。
(二)测定原理:C6H8O6+I2→C6H6O6+2H++2I―
(三)实验用品及试剂
(1)仪器和用品(自选,略)
(2)试剂:指示剂_________(填名称),浓度为8.00×10-3mol·L-1的I2标准溶液、蒸馏水等。
(四)实验过程
(3)洗涤仪器,检查滴定管是否漏液,润洗相关仪器后,装好标准碘溶液待用。
(4)用________________(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
(5)用左手控制滴定管的____________(填部位),右手摇动锥形瓶,眼睛注视
___________,直到滴定终点。滴定至终点时的现象是________________。
(五)数据记录与处理
(6)若经数据处理,则此橙汁中维生素C的含量是____________mg/L。
(2)淀粉(4)酸式滴定管(5)活塞锥形瓶中溶液颜色变化
最后一滴标准液滴入时,溶液由无色变为蓝色,且半分钟内不褪色。
(6)取三次实验的平均值,则在实验中消耗的标准碘溶液的体积应该是15ml.
15ml标准碘溶液碘的质量为:15mL×10-3(L/ mL)×8.00×10-3)mol·L-1)×254(g/mol)×1000(mg/g)="30.48" mg设20.0mL待测橙汁中维生素C的质量为x
C6H8O6+I2→C6H6O6+2H++2I-
176 254
x 30.48mg
176×30.48mg=254×X
解得:X=21.12mg
则1L中含维生素C的质量为:21.12mg×1000ml/20ml=1056.00mg,
2.称取NaOH、Na2CO3的混合物Wg,溶于水中,加入酚酞作指示剂,以Mmol/L的盐酸滴定,耗用V1L时变为粉红色,此时发生的化学反应方程式是_________________;
若最初以甲基橙作指示剂,当耗用V2L盐酸时变橙色,此时发生的化学反应方程_____________________________________________
由此计算混合物中NaOH和Na2CO3的质量分数分别为多少?
①NaOH+HCl NaCl+H 2O
②Na 2CO3+HCl NaCl+NaHCO3
③NaOH+HCl NaCl+H 2O
④Na 2CO3+2HCl2NaCl+CO2↑+H2O
×100%,×100%
3.实验室有一瓶混有少量NaCl杂质的NaOH固体试剂,为准确测其纯度,采用盐酸滴定法进行测定。
①称取WgNaOH固体试剂配制成100.00mL水溶液备用;
②将浓度为Cmol/L的标准盐酸装在用标准盐酸润洗过的25.00mL酸式滴定管中,调节液面位置在零刻度以下,并记下刻度;
③取V1 mL NaOH待测溶液置于洁净的锥形瓶中,加入2-3滴甲基橙指示剂充分振荡,然后用浓度为C mol/L的标准盐酸滴定,用去盐酸V2 mL,试回答固体试剂NaOH纯度计算公式为?
4.测定硫酸铝晶体样品中Al2(SO4)3·18H2O(含杂质Pb2+)质量分数的实验步骤为(EDTA 分别能与Al3+或Pb2+以物质的量之比1∶1进行反应):
步骤1:准确称取硫酸铝晶体样品mg,溶于25mL。
步骤2:加入c1mol·L EDTA溶液V1mL(过量),煮沸、冷却,稀释至100mL。
步骤3:取25.00mL上述稀释液,滴加指示剂,用c2mol·L-1 Pb(NO3)2标准溶液滴定过量的EDTA溶液,达到终点时消耗V2mL Pb(NO3)2标准溶液。
根椐上述数据计算,该样品中Al2(SO4)3·18H2O的质量分数为_________(用含字母的代数式表示)。
样品中的Al3+量是(c1V1×10-3-4c2V2×10-3)mol,n[Al2(SO4)3·18H2O]=1/2(c1V1×10-3-4c2V2×10-3)mol,m[Al2(SO4)3·18H2O]=233(c1V1×10-3-4c2V2×10-3)g,质量分数
为
三、氧化还原滴定
氧化还原滴定实验同酸碱中和滴定实验类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之),计算方法一般是根据电子守恒来进行计算,整体分为两类,一类是已知的氧化还原方程式,一类是未知的氧化还原方程式,对于未知的氧化还原方程式,需要掌握陌生氧化还原方程式书写的方法。
(a)已知反应方程式
1.某活动小组测定制取的Na2S2O3·5H2O的纯度的方法如下:准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O62-+2I-
(1)滴定至终点时,溶液颜色的变化:
____________________________________________。
(2)测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
(1)由无色变蓝色
(2)18.100.018L×0.100 0 mol·L-1×2×M/W×100%
2.氧化还原滴定实验同中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂
溶液或反之)。现有0.001mol/L酸性KMnO4和未知浓度的无色NaHSO3溶液VL。反应的离子方程式是2MnO4-+5HSO3-+H+=====2Mn2++5SO42-+3H2O。填空回答问题:滴定前平视KMnO4液面,刻度为amL,滴定后液面刻度为bmL,则待测NaHSO3浓度计算表达式为?
由已知的化学方程式可知KMnO4和NaHSO3物质的量之比为2:5,实验过程中消耗KMnO4的量为(b-a)×0.001,则NaHSO3为(b-a)0.001×2.5/V
3.葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O=H2SO4+2HI):准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分.取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol?L﹣1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL.重复以上操作,消耗标准I2溶液15.98mL.计算葡萄酒样品中抗氧化剂的残留量(单位:mg?L﹣1,以SO2计算,请给出计算过程.)
根据题意可知,消耗标准I2溶液的体积为=16.0mL,所以I2的物质的量为16.0×10﹣3L×0.0225mol?L﹣1=3.6×10﹣4mol,根据反应
SO2+I2+2H2O=H2SO4+2HI,可知二氧化硫的物质的量为3.6×10﹣4mol,SO2的质量为
64g/mol×3.6×10﹣4mol=23.04mg,所以葡萄酒样品中抗氧化剂的残留量为
=230.4mg?L﹣1
4.维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可通过在弱酸性溶液中用已知浓度的I2溶液进行滴定。该反应的化学方程式如下:C6H8O6+I2→C6H6O6+2HI。现欲测定某样品中维生素C的含量,取10 mL 6 mol·L-1 CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后冷却。精确称取0.200 0 g样品,溶解于上述冷却的溶液中,加入1 mL淀粉溶液作指示剂,立即用浓度为0.050 00 mol·L-1的I2溶液进行滴定,直至溶液中的蓝色持续不退为止,共消耗21.00 mL I2溶液。计算样品中维生素C的质量分数。
滴定过程中消耗的I2的物质的量为0.012L×0.05mol/L,测定某样品中维生素C的含量为0.012L×0.05mol/L×176g/moL,质量分数表达式为
0.012L×0.05mol/L×176g/moL/0.2g×100%=92.4%
创作编号:
GB8878185555334563BT9125XW
创作者:凤呜大王*
(b)已知多个方程式,根据转移电子数相等确定待测物质的质量分数
1.二氧化硒是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se.回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3→Na2S4O6+2NaI
实验中,准确称量SeO2样品0.1500g,消耗了0.2000mol/L的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为
根据反应的方程式可知SeO2~2I2~4Na2S2O3,消耗的n=0.2000
mol/L×0.025L=0.005mol,根据关系式计算样品中n=0.005mol×=0.00125mol,故SeO2
的质量为0.00125mol×111g/mol=0.13875g,所以样品中SeO2的质量分数为
×100%=92.5%,故答案为:92.5%.
2.环境监测测定水中溶解氧的方法是:
①量取amL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为: 2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
②测定:开塞后迅速加入1mL~2mL浓硫酸(提供H+),使之生成I2,再用bmol/L 的Na2S2O3
溶液滴定(以淀粉为指示剂),消耗VmL。有关反应式为: MnO(OH)2+2I—+4H+=Mn2++I2+3H2O I2+2S2O32-=2I—+S4O62- 试回答水中溶解氧的计算式是(以g/L 为单位)。
设水中溶解氧的物质的量为x,根据题中给出的三个有关方程式可建立多步计算关系式:
O2~2MnO(OH)2~2I2~4S2O32-
1mol 4 mol
x b×V×10-3 mol
列式,解得x=0.25bV×10-3 mol。
所以水中溶解氧的量为(0.25bV×10-3)×32/(a×10-3)=8bV/a(g·L-1)
(c)根据电荷守恒确定未知的氧化还原方程式
1.已知高锰酸钾(硫酸酸化)溶液和草酸(H2C2O4)溶液可以发生氧化还原反应。)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是取2 mL血液用蒸
馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是
。
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是。
③若消耗了1.0×10-4 mol·L-1的KMnO4溶液20.00 mL,则100 mL该血液中含钙 g。设100ml由CaC2O4+H2SO4═CaSO4+H2C2O4、
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O可以得出关系式:
5Ca2+~2KMnO4,所以n(Ca2+)=2.5n(KMnO4)=1.0×10-4mol/L×0.02L×2.5,所以可计算出100 mL该血液中含钙的质量为:1.0×10-4mol/L×0.02L×2.5×40g/mol×100ml/2ml=0.01
2.准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)。
n(Fe2+)=0.050 0 mol·L-1×20.00mL/1000=1.00×10-3 mol
n(Mn2+)=n(Fe2+)=1.00×10-3 mol
m(MnSO4·H2O)=1.00×10-3 mol×169 g·mol-1=0.169 g
MnSO4·H2O样品的纯度为:×100%=98.8%
3.氧化还原滴定是水环境监测常用的方法,可用于测定废水中的化学耗氧量(单位:mg/L——每升水样中还原性物质被氧化需O2的质量)。某废水样100.00mL,用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化。然后用0.1000mol/L的FeSO4标准溶液滴定剩余的Cr2O72—,实验数据记录如下:
实验数据实验序号FeSO4溶液体积读数/mL
滴定前滴定后
第一次0.10 16.20 第二次0.30 15.31 第三次0.20 15.19
①完成离子方程式的配平:
___Cr2O72—+___Fe2++____ _______ ____Cr3++____Fe3++____H2O
②计算废水样的化学耗氧量。(写出计算过程,结果精确到小数点后一位。)
①根据质量守恒定律、电子守恒、电荷守恒可得离子方程式:Cr2O72—+6Fe2++14H+== 2Cr3++6Fe3++7H2O ;②根据表格提供的数据可知第一次实验误差太大,舍去,消耗的FeSO4溶液的体积要按照第2、3此来计算,V(FeSO4)=15.00ml;在反应的过程中电子转移数目相等0.01667mol/L ×0.025L×2×3=0.1000mol/L ×0.0150L×1+n(O2)×4, n(O2)=0.001÷4=0.00025mol.所以每升废水中的还原性物质消耗的氧气的物质的量是0.00025mol×10=0.0025mol,其质量是0.0025mol×32g=0.08g=80mg.
4.K2Cr2O7可用于测定亚铁盐的含量,现有FeSO4试样0.4000克,溶解酸化后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定,消耗标准溶液20.00mL,则该试样中FeSO4的质量分数为。
根据氧化还原反应中电子转移数目相等可知:K2Cr2O7~6FeSO4。n(K2Cr2O7)=
0.02000mol/L÷0.02L=4.0×10-4mol,则n(FeSO4)=2.4×10-3mol,m (FeSO4)=2.4×10-3mol×152g/mol=0.3648g。则该试样中FeSO4的质量分数为(0.3648g÷0.4000g)×100%=91.2%
5.中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g/L。某兴趣小组用题图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1)仪器A的名称是______________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图2中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00ml,该葡萄酒中SO2含量为:__g/L。
(1)冷凝管(或冷凝器) b (2)SO2+H2O2===H2SO4(3)③酚酞④
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
SO2与NaOH存在如下关系:
SO2~H2SO4~2NaOH
64 g 2 mol
m(SO2)0.090 0 mol·L-1×0.025 L
解得:m(SO2)=0.072 g,故葡萄酒中SO2的含量为=0.24 g·L-1。
四、通过酸碱中和滴定确定未知物质化学式
一般是根据无机化学中离子检验的方法来确定未知的离子种类,然后通过电荷守恒,质量守恒进行计算出各离子或原子之间的系数比,从而确定出待测物质的化学式。
1.硫酸镍铵[(NH4)x Ni y(SO4)m?nH2O]可用于电镀、印刷等领域.某同学为测定硫酸镍铵的组成,进行如下实验:
①准确称取2.3350g 样品,配制成100.00mL 溶液A;
②准确量取25.00mL 溶液A,用0.04000mol?L﹣1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2﹣=NiY2﹣+2H+),消耗EDTA 标准溶液31.25mL;
③另取25.00mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56.00mL(标准状况).
通过计算确定银硫酸镍铵的化学式(写出计算过程)
______________________________.
25mL溶液中镍离子的物质的量是:n(Ni2+)=n(H2Y2﹣)=0.04000 mol?L﹣
1×0.03125L=1.250×10﹣3 mol,
氨气的物质的量等于铵离子的物质的量,n(NH4+)==2.500×10﹣3 mol
根据电荷守恒,硫酸根的物质的量是:n(SO42﹣)=×[2n(Ni2+)+n(NH4+)]=2.500×10﹣3mol,
所以:m(Ni2+)=59 g?mol﹣1×1.250×10﹣3 mol=0.07375 g
m(NH4+)=18 g?mol﹣1×2.500×10﹣3 mol=0.04500 g
m(SO42﹣)=96 g?mol﹣1×2.500×10﹣3 mol=0.2400 g
n(H2O)==1.250×10﹣2mol
x:y:m:n=n(NH4+):n(Ni2+):n(SO42﹣):n(H2O)=2:1:2:10,
硫酸镍铵的化学式为(NH4)2Ni(SO4)2?10H2O
2.硫酸钠过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.770 0 g样品,配制成100.00 mL溶液A。
②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.582 5 g。
③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:
2MnO42-+5H2O2+6H+===2Mn2++8H2O+5O2↑
通过计算确定样品的组成(写出计算过程)。
25.00 mL溶液A中含有Na2SO4的物质的量为n(Na2SO4)=n(BaSO4)==2.50×10-3 mol。
含有H2O2的物质的量为n(H2O2)=n(KMnO4)=×0.020 00 mol·L-1×25.00×10-3 L =1.25×10-3 mol。
所取25.00 mL溶液A中所含样品中水的质量为m(H2O)=1.770 0 g×-2.50×10
-3 mol×142 g·mol-1-1.25×10-3 mol×34 g·mol-1=0.045 00 g,则n(H2O)=
=2.50×10-3 mol。
综上可知,x∶y∶z=n(Na2SO4)∶n(H2O2)∶n(H2O)=2∶1∶2,故硫酸钠过氧化氢加合物的化学式为2Na2SO4·H2O2·2H2O。
3.碱式次氯酸镁[Mg a(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验:
①准确称取1.685 g碱式次氯酸镁试样于250 mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用0.800 0 mol·L-1的Na2S2O3标准溶液滴定至终点(离子方程式为2S2O32-+I2===S4O62-+2I-),消耗25.00 mL。
②另取1.685 g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3%H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1 000 mL。移取25.00 mL溶液至锥形瓶中,在一定条件下用0.020 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-===MgY2-+2H+),消耗25.00 mL。通过计算确定碱式次氯酸镁的化学式(写出计算过程)
关系式:ClO-~I2~2S2O32-
n(ClO-)=n(S2O32-)=1/2×0.800 0 mol·L-1×25.00×10-3 L=1.000×10-2 mol
n(Mg2+)=0.020 00 mol·L-1×25.00×10-3 L×1 000 mL/25.00 mL=2.000×10-2 mol
根据电荷守恒,可得:
n(OH-) =2n(Mg2+)-n(ClO-)
=2×2.000×10-2 mol-1.000×10-2 mol=3.000×10-2mol
m(H2O) =1.685 g-1.000×10-2 mol×51.5 g·mol-1-2.000×10-2 mol×24 g·mol-1-
3.000×10-2mol×17 g·mol-1=0.180 g
n(H2O)=0.180 g/18 g·mol-1=1.000×10-2mol
n(Mg2+)∶n(ClO-)∶n(OH-)∶n(H2O)
=(2.000×10-2 mol)∶(1.000×10-2 mol)∶(3.000×10-2 mol)∶(1.000×10-2 mol)=
2∶1∶3∶1
碱式次氯酸镁的化学式为:Mg2ClO(OH)3·H2O
4.草酸晶体的组成可表示为H2C2O4.xH2O,为测定x值,进行下列实验.
①称取m g草酸晶体,配成100.0mL溶液.
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c
mol/LKMnO4溶液滴定.滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4═
K2SO4+10CO2↑+2MnSO4+8H2O若滴定时,滴定前后两次读数分别为amL和bmL,因此计算出草酸晶体x值为。
滴定管的刻度由上而下刻度增大,滴定前后两次读数分别为amL和bmL,故消耗KMnO4溶液体积(b-a)mL,n(KMnO4)
=c mol/L×(b-a)×10-3L=c×(b-a)×10-3mol,根据关系式2KMnO4~5H2C2O4可知25.0mL草酸溶液中n(H2C2O4)=2.5×c×(b-a)×10-2mol,进而计算100mL草酸溶
液中n′(H2C2O4)=2.5×c×(b-a)×10-2mol×=c×(b-a)×10-2mol,草酸晶体中草酸的质量为c×(b-a)×10-2mol×90g/mol=0.9c(b-a)g,由化学式可知:
=,解得x=-5,故答案为:-5;
5.一种含Mn2+的结晶水合物组成为A x Mn y B z·mH2O(A表示一种阳离子,B表示一种阴离子)。现称取39.10 g晶体配成100 mL溶液X,取20 mL溶液X,向其中加入足量的氢氧化钠溶液,加热,得到896 mL气体(标准状况);另取20 mL溶液X,向其中加入盐酸,无沉淀产生,再加入BaCl2溶液,产生白色沉淀,过滤,洗涤,烘干,得到固体9.32 g。
①A、B的离子符号分别为、。
②通过计算确定该结晶水合物的化学式(写出计算过程)。
①NH4+SO42-
②39.10 g样品中:
n(NH4+)=n(NH3)×=0.896 L÷22.4 L/mol×5=0.2 mol
n(SO42-)=n(BaSO4)×=9.32 g÷233 g/mol×5=0.2 mol
根据电荷守恒:n(NH4+)+2n(Mn2+)=2n(SO42-)
n(Mn2+)=(2×0.2 mol-0.2 mol)÷2=0.1 mol
n(H2O)=(39.10 g-0.2 mol×18 g/mol-0.1 mol×55 g/mol-0.2 mol× 96 g/mol) ÷18 g/mol =0.6 mol
n(NH4+)∶n(Mn2+)∶n(SO42-)∶n(H2O)=2∶1∶2∶6
故该结晶水合物的化学式为:(NH4)2Mn(SO4)2·6H2O
创作编号:
GB8878185555334563BT9125XW
创作者:凤呜大王*