
第一章从实验学化学
第二节化学计量在实验中的应用
(第1课时)
教学目标:
1.使学生认识物质的量及其单位,能用于进行简单的化学计算。
2.使学生知道引入物质的量这一物理量的重要性和必要性,知道阿伏加德罗常数的涵义。
3.通过本部分的学习培养学生演绎推理、归纳推理的能力;调动学生参与知识形成的积极性和主动性。
教学重点、难点
重点:物质的量及其单位
难点:物质的量及其单位
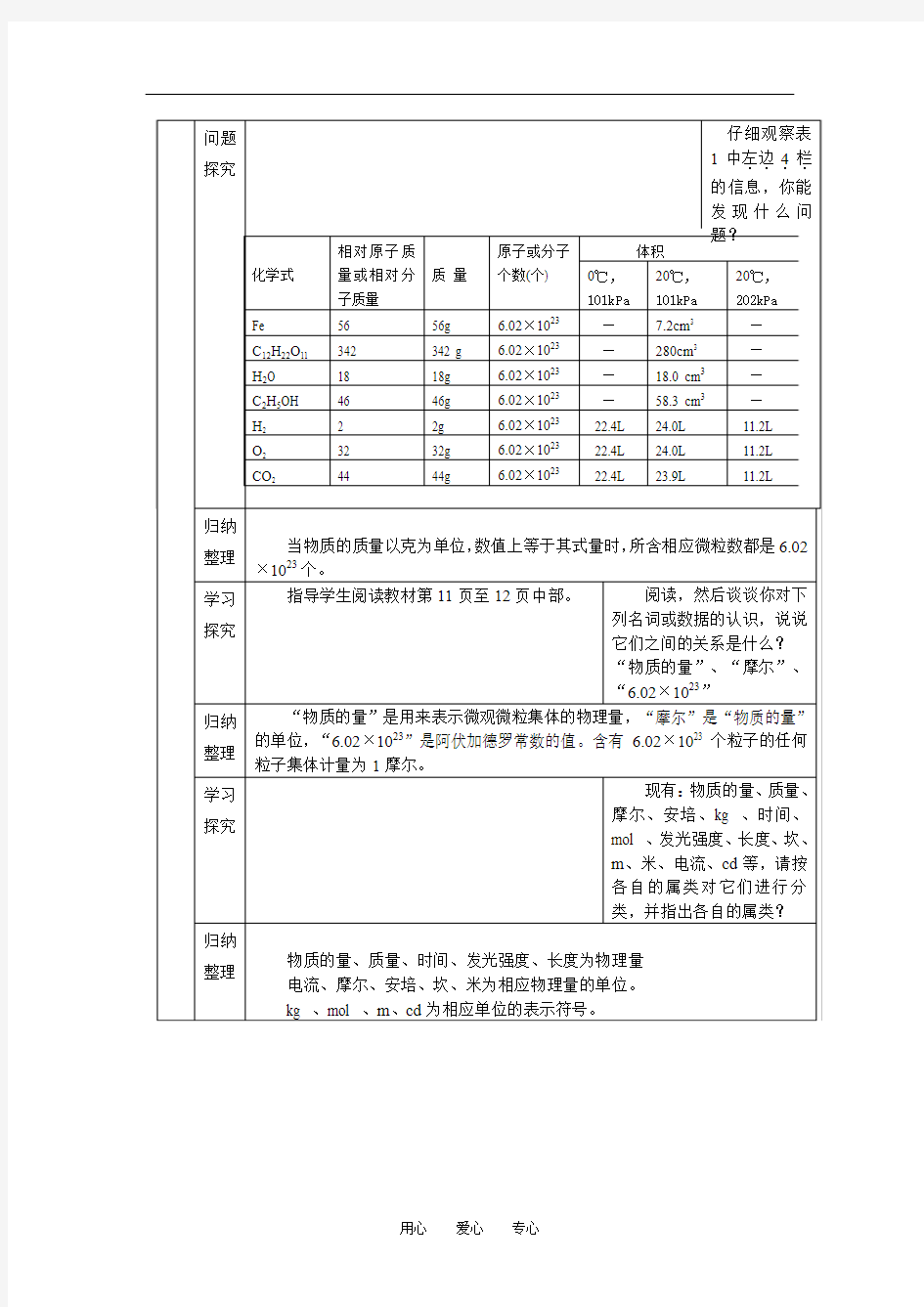
101kPa101kPa 56g 6.02×1023—7.2cm3 342 g 6.02×1023—280cm3 18g 6.02×1023—18.0 cm3 46g 6.02×1023—58.3 cm3 2g 6.02×102322.4L 24.0L 32g 6.02×102322.4L 24.0L 44g 6.02×102322.4L 23.9L
⑩1 mol铅笔
使用摩尔时必须是微观微粒,必须指明微粒
的种类,可以是分数、小数、整数。
页下半部分 1mol物质的质量在数
值上有什么特点?什么是摩
尔质量?其单位是什么?
单位物质的量的物质所具有的质量叫做摩
巩固练习:
1.下列关于物质的量的叙述中,错误的是()
A. 1mol任何物质都含有6.02×1023个分子
B.0.012Kg12C中含有6.02×1023个碳原子
C.1molH2O中含有2 mol氢和1mol氧
D. 1molH2O中含有3 mol原子
2.下列说法正确的是 ( ) A. H 2的摩尔质量是2 g B. 1molH 2O 的质量是18 g C.氧气的摩尔质量是32 g/ mol D.2g H 2含1mol H
3.比较1.0mol N 2和1.0mol CO 的下列物理量:①质量 ②分子总数 ③原子总数,其中相同的是
( )
A. ①
B. ①②
C. ①②③
D. ②③
4.相同质量的下列物质,所含分子数目最多的是 ( ) A.CH 4 B.NH 3 C.H 2O D.HF
5.2.5 molBa(OH)2中含有 个Ba 2+,含有 个OH -
;5molNa 2SO 4溶
于水电离出Na +
个;含SO 42-
0.6mol 的Al 2(SO 4)3 中含Al 3+ mol 。
6. 0.1 mol ?L -
1Na 2O 放入 克水中才能使溶液中Na +
与H 2O 的个数比为1∶100。
7.请你在括号内填入适当的数字,完成这幅关系图。 8.49g H 3PO 4的物质的量是多少?1.5 molNaOH 的质量是多少?
9.在求相同质量的SO 2和SO 3所含硫原子的个数比时,不同的同学用了不同的解法。 解法1:设SO 2和SO 3的质量均为mg ,每个硫原子的质量为ag 。
4:58032
:6432=??
ag mg ag mg 或mg 4:580
32:6432=??mg 解法2:设SO 2和SO 3的质量均为mg 。
4:51002.680:1002.66423
1
231=??????--mol
g mg mol g mg 解法3:设SO 2和SO 3的质量均为mg 。
4:580:641
1=??--mol g mg
mol g mg
这几种解法在解题思路上有什么差异?你倾向于使用哪一种解法?为什么?
10.血液中的血清素(摩尔质量为176g?mol-1)在人体中起着镇定情绪、解出忧虑的作用。血清素所含碳元素的质量分数为68.2%,所含氢元素的质量分数为6.82%,所含氮元素的质量分数为15.9%,所含氧元素的质量分数为9.08%。请你尝试写出血清素的化学式。
参考答案
1.AC
2.BC
3.C
4.A
5.1.505×1024、3.01×1024、
6.021024、0.4
6.361.8g
7.略
8. 0.5 mol 60 g
9.解法1先求出硫元素的总质量(以质量为计算基础),再比上一个硫原子的质量求硫原子数
解法2先求出硫元素的物质的量(以物质的量为计算基础),再乘以阿佛加德罗常数求原子个数
解法3根据阿佛加德罗定律的推论求解.
倾向于解法3,简洁易懂.
(此题可各抒己见)
10.C10H12N2O
第二节化学计量在实验中的应用
(第2课时)
教学目标:
1.使学生在知道气体的体积与温度和压强有密切关系的基础上,认识气体摩尔体积的概念。
2.通过气体摩尔体积的学习,培养学生分析、推理、归纳的能力。
3.通过本节内容的学习,使学生主动参与学习过程,激发学生的学习兴趣。
教学重点、难点
重点:气体摩尔体积的概念及有关计算
难点:气体摩尔体积的概念
对原子质
或相对分质量原子或分子
个数(个)
6.02×10—
7.2cm—6.02×1023—280cm3 —6.02×1023—1
8.0 cm3—6.02×1023—58.3 cm3—6.02×102322.4L 24.0L 11.2L 6.02×102322.4L 24.0L 11.2L 6.02×102322.4L 23.9L 11.2L
)相同条件下,相同物质的量的不同物质所占的体积: 固体<液体<气体
巩固练习:
1.N A表示阿伏加德罗常数的值,下列说法中正确的是()
A.含0.1 mol BaCl2的溶液中Cl-数为0.2 N A
B.22 g CO2所含有的分子数为0.5 N A
C.11.2L CO2所含有的分子数为0.5 N A
D.常温下N A个Cl2分子所占有的体积为22.4L
2.标准状况下,两种气体的体积相等,则()
A. 所含原子数一定相等
B.物质的量一定相同
C.质量一定相同
D.密度一定相同
3.标准状况下,32g某气体的分子数目与22 g CO2的分子数目相同,则该气体的摩尔质量为()
A.32
B.32 g/ mol
C.64g/ mol
D.64
4.N A表示阿伏加德罗常数的值,下列说法中正确的是( )
A.常温常压下,0.05 N A个CO2分子所占的体积是1.12L
B.氨气的摩尔质量和N A个氨分子的质量在数值上相等
C.常温常压下,32g 氧气和34 g H 2S 分子个数比为1:1
D.标准状况下, N A 个水分子所占的体积为22.4L
5.同温同压下,已知O 2的密度为ρg ?L -
1,则NH 3的密度为 ( )
A.
32
17ρ g ?L -1 B.1732ρ g ?L -1 C.ρ1732 g ?L -1 D.ρ3217 g ?L -
1
6.两个体积相同的容器,一个盛有NO ,另一个盛有N 2和O 2,在同温同压下两容器内的气体一定具有相同的( )
A.原子总数
B.质子总数
C.分子总数
D.质量
7.关于同温同压下等体积的CO 2和CO ,下列叙述:(1)质量相等 (2)密度相等 (3)所含分子数相等(4)所含碳原子数相等,其中正确的是( ) A.(1)(2)(3)(4) B. (2)(3)(4) C.(3)(4) D.(3)
8.今有H 2和CO(体积比为1:2)的混合气体V L ,当其完全燃烧时,所需要 O 2的体积为( ) A.3V L B.2V L C.V L D.0.5V L
9.如果a g 某气体中所含有的分子数为b,则c g 该气体在标准状况下的体积是(式中N A 为阿伏加德罗常数)( )
A.22.4bc/aN A L
B.22.4ab/cN A L
C.22.4ac/ bN A L
D. 22.4b/acN A L 10.下列数量的各物质:(1)0.5molNH 3 (2)标准状况下22.4L 氦(He),(3)4。
C 时9ml 水(4)0.2mol 磷酸钠,所含原子个数由大到小的排列顺序是 _____________________________。
11.在某温度时,一定量的元素A 的氢化物AH 3,在恒温密封容器中完全分解为两种气态单质,此时压强增加了75%,则A 单质的分子式为_____________AH 3分解反应的化学方程式______________________________________。
参考答案:
1.AB 2.B 3.C 4.BC 5.A 6.AC 7.C 8.D9.A 10.(1)(4)(3)(2)
11.A 4 4AH 3=A 4+6H 2
第二节 化学计量在实验中的应用
(第3课时)
教学目标:
1.使学生理解物质的量浓度的概念,掌握有关物质的量浓度的计算以及一定物质的量浓度的溶液加水稀释的计算。
2.培养学生对知识的应用能力。
3.调动学生参与知识形成的积极性和主动性,培养学生合作学习的意识和能力。教学重点、难点
重点:物质的量浓度的概念,有关物质的量浓度的计算
c(B)=
V
mol/L1(或mol·L-1)
.浓溶液的稀释
.
巩固练习:
1. 100mL0.3mol/LNa2SO4溶液和50mL0.2mol/LAl2(SO4)3溶液混合后,溶液中SO42-的物质的
量浓度为:()
(A)0.2mol/L(B)0.25mol/L(C)0.40mol/L(D)0.50mol/L
2. 300mL某浓度的NaOH溶液中含有60g溶质,现欲配制1mol/LNaOH溶液,应取原溶液与蒸馏水的体积比约为()
(A)1∶4(B)1∶5(C)2∶1(D)2∶3
3.下溶液中c(CI-) 于50mL 1mol/L 氯化铝溶液中的c(CI-) 相等的是()
(A)150 mL 1mol/L氯化钠溶液(B)75 mL 2mol/L氯化铵溶液
(C)150 mL 1mol/L氯化钾溶液(D) 75 mL 1mol/L氯化铁溶液
4.今有0.1mol/LNa2SO4溶液300 mL,0.1mol/LMgSO4溶液200 mL和0.1mol/L Al2(SO4)3溶液100 mL,这三种溶液中硫酸根离子浓度之比是()
(A)1∶1∶1(B)3∶2∶2(C) 3∶2∶3(D) 1∶1∶3
5.实验室要确定一瓶盐酸的浓度,进行了下列试验:取25.00 mL盐酸溶于锥形瓶中,加入两滴酚酞溶液,在搅拌条件下,向锥形瓶中慢慢滴加0.1000 0 mol?L-1NaOH溶液,当锥形瓶中溶液由无色变为红色时,记录消耗NaOH溶液的体积为24.50 mL。计算盐酸的物质的量浓度。
6. 在标准状况下,350体积氨气溶于1体积水中,得到密度为0.92g?cm-3的氨水,求此氨水
的物质的量浓度(已知溶质为NH3)。
7.106 g碳酸钠溶于1L水中,所得溶液与1 molNa2CO3溶于水稀释成1L溶液相比,物质
的量浓度是否相等?为什么?
8.现有一种泉水样品,1.0L这种样品含有46.0mgMg2+。那么,该泉水中Mg2+的物质的量浓度是多少?含1.0 mol Mg2+的这种泉水的体积是多少升?
9.①20g NaOH溶于水形成500mL溶液,所得溶液的物质的量浓度是。
②标准状况下,44.8LNH3溶于水形成1L溶液,所得溶液的物质的量浓度是多少
。
③配制500mL 0.5 mol?L-1的盐酸溶液,需要标准状况下的HCl气体多少升?
参考答案
1.C
2.A
3.D 4D
5.0.098mol/L
6.14.13mol/L
7.不相等,前后两种溶液的体积不一样.
8.1.9×10—3 526.3ml
9.①1 mol/L ②2 mol/L ③5.6L
第二节化学计量在实验中的应用
(第4课时)
教学目标:
1.了解物质的量浓度的溶液配制的基本原理,初步学会配制一定物质的量浓度溶液的方法和技能。学会容量瓶的使用方法。
2.培养学生的动手能力和基本实验技能。
3.通过实验培养学生学习化学的兴趣和严谨的学习态度。
教学重点、难点
重点:物质的量浓度的溶液的配制
难点:正确配制一定物质的量浓度的溶液。
2.容量瓶内壁存有水珠。
3.定容时仰视读数。
4.未用蒸馏水洗涤烧杯内壁。
自我测评题
1.某学生计划用12 mol?L-1的浓盐酸配制0.10mol?L-1的稀盐酸500 mL。回答下列问题:(1)量取浓盐酸的体积为mL,应选用的量筒规格为。
(2)配制时应选用的容量瓶规格为。
(3)配制时(除容量瓶外)还需选用的仪器主要有、、和试剂瓶。
2.①配制100g 20%碳酸钠溶液,需要碳酸钠g,用到的主要仪器
有
。
②配制100 mL 2.00 mol?L-1的碳酸钠溶液,需要碳酸钠mol,用到的和①中不同的仪器有。
简述完成该试验所需要的主要操作步骤:
a.
b
3.实验室需要0.1 mol?L-1NaOH溶液100 mL,现有2 mol?L-1 NaOH溶液。
(1)计算所需2 mol?L-1 NaOH溶液的体积。
参考答案
1.(1)4.2 mL 10 mL (2)500 mL (3)量筒、烧杯、玻璃棒、胶头滴管2.(1)①20 g ②量筒、烧杯、玻璃棒
(2)0.2 mol 容量瓶胶头滴管
操作步骤略
3.?5ml
(2)①计算②量取③配制④装瓶(详见课本后边学生实验)