
第三章金属及其化合物
第一节金属的化学性质
一、钠及其化合物
(一)钠 Na
1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。
2、单质钠的化学性质:
①钠与O2反应
常温下:4Na + O2=2Na2O (新切开的钠放在空气中容易变暗)
加热时:2Na + O2==Na2O2(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na2O2。)
钠在空气中的变化过程:Na―→Na2O―→NaOH―→Na2CO3·10H2O(结晶)―→Na2CO3(风化),最终得到是一种白色粉末。一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH易潮解),最终变成白色粉未(最终产物是Na2CO3)。
②钠与H2O反应
2Na+2H2O=2NaOH+H2↑离子方程式:2Na++2H2O=2Na++2OH-+H2↑(注意配平)
实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH遇酚酞变红”。
③钠与盐溶液反应
如钠与CuSO4溶液反应,应该先是钠与H2O反应生成NaOH与H2,再和CuSO4溶液反应,有关化学方程式:2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
总的方程式:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑
实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出
K、Ca、Na三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应④钠与酸反应:2Na+2HCl=2NaCl+H2↑(反应剧烈)离子方程式:2Na+2H+=2Na++
H 2↑
3、钠的存在:以化合态存在。
4、钠的保存:保存在煤油或石蜡中。
5、工业制钠:电解熔融的NaCl :2NaCl(熔融
) 2Na + Cl 2↑
6、钠的用途:① 在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;
② 钠钾合金是快中子反应堆的热交换剂;
③ 钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强。
(二)氧化钠和过氧化钠
1、Na 2O Na 2O + H 2O == 2NaOH,
Na 2O + CO 2 == Na 2CO 3,
Na 2O + 2HCl == 2NaCl + H 2O .
另外:加热时,2Na 2O + O 2 == 2Na 2O 2
2、Na 2O 2:淡黄色固体是复杂氧化物,易与水和二氧化碳反应。
2Na 2O 2 + 2H 2O == 4NaOH + O 2 ;2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2 (作供氧
剂)。
因此Na 2O 2常做生氧剂,同时,Na 2O 2还具有强氧化性,有漂白作用。如实验:Na 2O 2
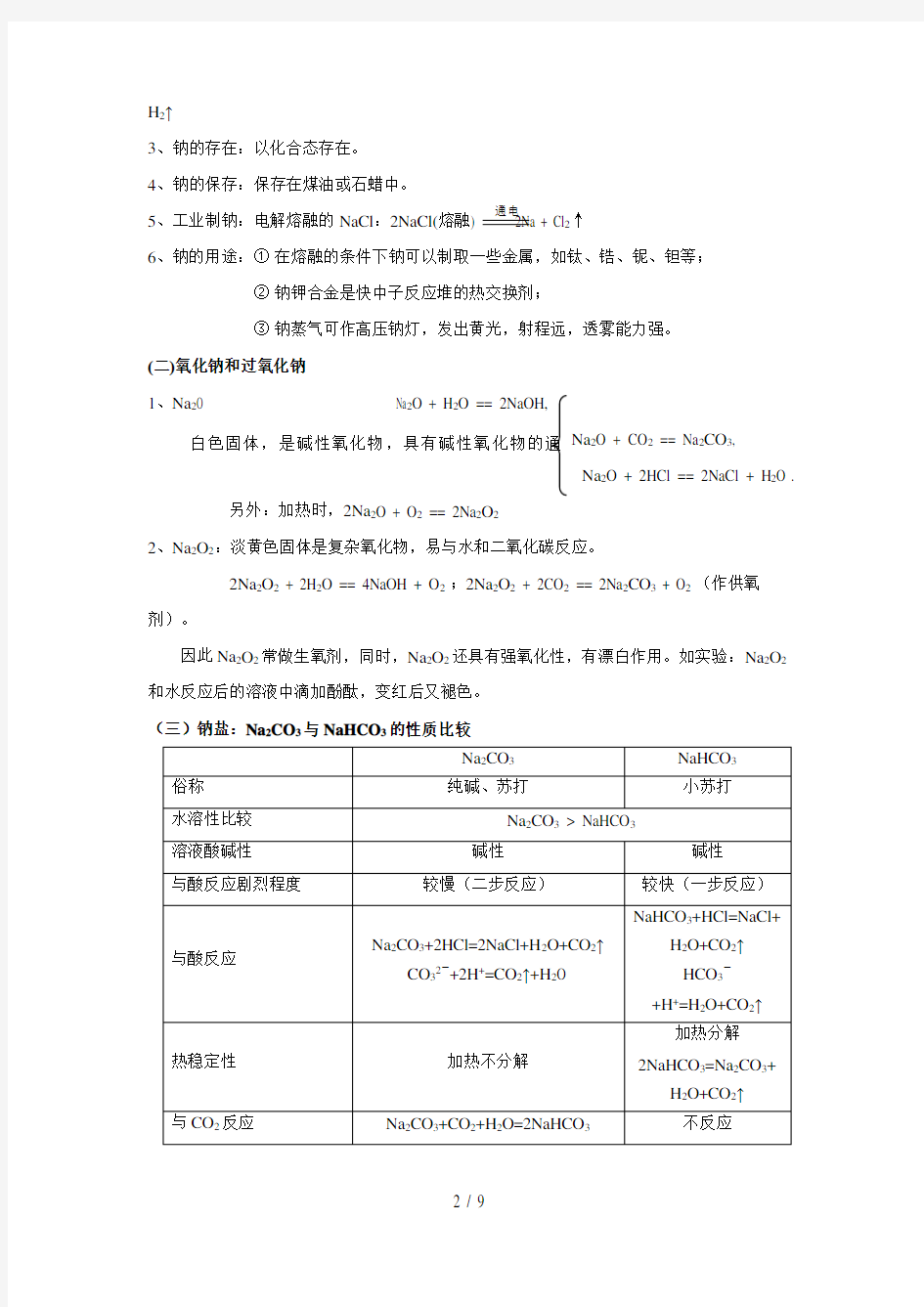
和水反应后的溶液中滴加酚酞,变红后又褪色。 (三)钠盐:Na 2CO 3与NaHCO 3的性质比较 通电
白色固体,是碱性氧化物,具有碱性氧化物的通
★注意几个实验的问题:
1、向饱和的Na2CO3溶液中通足量的CO2有晶体NaHCO3析出。
2、Na2CO3溶液与稀HCl的反应①:向Na2CO3溶液中滴加稀HCl,先无气体,后有气体,
如果n(HCl)小于n(Na2CO3)时反应无气体放出。发生的反应:先Na2CO3 + HCl == NaCl + NaHCO3,
后NaHCO3 + HCl == NaCl + H2O +CO2↑
②向稀HCl中滴加Na2CO3溶液,先有气体,反应是:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑
如果用2mol的Na2CO3和2.4mol的稀HCl反应,采用①方法放出CO2是0.4mol;采用方法放出CO2为1.2mol。希望同学们在解题时要留意。
3、Na2CO3溶液和NaHCO3溶液的鉴别:取两种试液少量,分别滴加CaCl2或BaCl2溶液,
有白色沉
淀的原取溶液为Na2CO3,另一无明显现象的原取溶液为NaHCO3
4、侯氏制碱法
反应式:NaCl + NH3 + CO2 + H2O == NaHCO3 + NH4Cl.
注意:在生产中应先在饱和的NaCl溶液中先通入NH3,后通入CO2,NaHCO3晶体析出过滤,在滤液中加入NaCl细末和通NH3析出NH4Cl晶体为副产品。NH4Cl晶体析出后的母液进行循环试用,提高原料的利用率。
(四)氢氧化钠NaOH:俗称烧碱、火碱、苛性钠,易潮解,有强腐蚀性,具有碱的通性。
二、铝及其化合物
(一)铝的性质
1、物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。有良好的导电、导热性和延展性。
2、化学性质:铝是较活泼的金属。
①通常与氧气易反应,生成致密的氧化物起保护作用。4Al + 3O2 == 2Al2O3。同时也
容易与Cl2、S等非金属单质反应。
②与酸反应:强氧化性酸,如浓硫酸和浓硝酸在常温下,使铝发生钝化现象;加热
时,能反应,但无氢气放出;非强氧化性酸反应时放出氢气。( 2Al+6H+=2Al3++3H2↑)
③与强碱溶液反应:2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑( 2Al+2OH-+2H2O=2AlO2-+3H2↑)
④与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
⑤铝热反应:铝与某些金属氧化物的反应(如V、Cr、Mn、Fe的氧化物)叫做铝热反应
2Al + Fe2O3高温 Al2O3 + 2Fe。Al 和 Fe2O3的混合物叫做铝热剂。利用铝热反应焊接钢轨。
(二)氧化铝(Al2O3)
白色固体,熔点高(2054℃),沸点2980℃,常作为耐火材料;是两性氧化物。我们常见到的宝石的主要成分是氧化铝。有各种不同颜色的原因是在宝石中含有一些金属氧化物的表现。如红宝石因含有少量的铬元素而显红色,蓝宝石因含有少量的铁和钛元素而显蓝色。工业生产中的矿石刚玉主要成分是α-氧化铝,硬度仅次于金刚石,用途广泛。
两性氧化物:既能与强酸反应又能与强碱反应生成盐和水的氧化物。
Al2O3 + 6HCl == 2AlCl3 + 3H2O ,Al2O3 + 2NaOH == 2NaAlO2 + H2O 。
Al2O3是工业冶炼铝的原料,由于氧化铝的熔点高,电解时,难熔化,因此铝的冶炼直到1886年美国科学家霍尔发现在氧化铝中加入冰晶石(Na3AlF6 ),使氧化铝的熔点降至1000
通电
度左右,铝的冶炼才快速发展起来,铝及其合金才被广泛的应用。2Al2O3 4Al + 3O2↑。
(三)氢氧化铝(Al(OH)3)
白色难溶于水的胶状沉淀,是两性氢氧化物。加热易分解。
两性氢氧化物:既能与强酸又能与强碱反应生成盐和水的氢氧化物。
Al(OH)3 + 3HCl == AlCl3 + 3H2O, Al(OH)3 + NaOH == NaAlO2 + 2H2O.
2Al(OH)3 Al2O3 +3 H2O
(四)铝的冶炼
铝是地壳中含量最多的金属元素,自然界中主要是以氧化铝的形式存在。工业生产的流程:铝土矿(主要成分是氧化铝)→用氢氧化钠溶解过滤→向滤液中通入二氧化碳酸化,过滤→氢氧化铝→氧化铝→铝。
主要反应:Al2O3 + 2NaOH == 2NaAlO2 + H2O ,CO2 + 3H2O + 2NaAlO2 == 2Al(OH)3↓+
Na2CO3,2Al(OH)3△
Al2O3 +3 H2O ,2Al2O3
通电
4Al + 3O2↑。
(五)铝的用途:铝有良好的导电、导热性和延展性,主要用于导线、炊具等,铝的最大用途是制合金,铝合金强度高,密度小,易成型,有较好的耐腐蚀性。迅速风靡建筑业。也是飞机制造业的主要原料。
(六)明矾的净水:化学式:KAl(SO4)2·12H2O,它在水中能电离:KAl(SO4)2 == K+ + Al3+ + 2SO42-。铝离子与水反应,生成氢氧化铝胶体,具有很强的吸附能力,吸附水中的悬浮物,使之沉降已达净水目的。Al3+ + 3H2O == Al(OH)3 (胶体)+ 3H+。
知识整理:
①(Al(OH)3)的制备:在氯化铝溶液中加足量氨水。AlCl3 + 3NH3·H2O == Al(OH)3↓+ 3NH4Cl 。
②实验:A、向氯化铝溶液中滴加氢氧化钠溶液,现象是先有沉淀,后溶解。
反应式:先Al3+ + 3OH- == Al(OH)3↓, 后Al3+ + 4OH- == AlO2- + 2H2O。
B、向氢氧化钠溶液中滴加氯化铝溶液,现象是开始无沉淀,后来有沉淀,且不溶解。
反应式:先Al3+ + 4OH- == AlO2- + 2H2O,后Al3+ + 3AlO2- + 6H2O == 4Al(OH)3↓。
③实验:向偏铝酸钠溶液中通二氧化碳,有沉淀出现。CO2 + 3H2O + 2NaAlO2 ==
2Al(OH)3↓+ Na2CO3。
④将氯化铝溶液和偏铝酸钠溶液混和有沉淀出现。 Al3+ + 3AlO2- + 6H2O == 4Al(OH)3↓。
△
⑤ 实验:A 、向偏铝酸钠溶液中滴加稀盐酸,先有沉定,后溶解。
反应的离子方程式:AlO 2- + H + + H 2O == Al(OH)3 ,Al(OH)3 + 3H + == Al 3+ + 2H 2O 。 B 、向稀盐酸中滴加偏铝酸钠溶液,先无沉淀,后有沉淀且不溶解。
反应的离子方程式:AlO 2- + 4H + == Al 3+ + 2H 2O ,3AlO 2- + Al 3+ + 6H 2O == 4Al(OH)3↓。 ⑥
三、铁及其化合物 (一)铁 Fe
1、单质铁的物理性质:铁片是银白色的,铁粉呈黑色,纯铁不易生锈,但生铁(含碳杂质的铁)在潮
湿的空气中易生锈。(原因:形成了铁碳原电池。铁锈的主要成分是Fe 2O 3)。 2、单质铁的化学性质:
① 与非金属单质反应:3Fe +2O 2 Fe 3O 4(现象:剧烈燃烧,火星四射,生成黑色的
固体)
2Fe + 3Cl 2 2FeCl 3,
Fe + S FeS 。
② 与非氧化性酸反应:Fe +2HCl =FeCl 2+H 2↑ ( Fe +2H +=Fe 2+
+H 2↑ ) 常温下铝、铁遇浓硫酸或浓硝酸钝化。加热能反应但无氢气放出。
③ 与盐溶液反应:Fe +CuSO 4=FeSO 4+Cu ( Fe +Cu 2+
=Fe 2+
+Cu );Fe +2 FeCl 3 == 3FeCl 2
④ 与水蒸气反应:3Fe + 4H 2O(g)
高温
Fe 3O 4 + 4H 2↑
(二) 铁的氢氧化物 △
点燃
点燃
(三)Fe 2+、Fe 3+的检验
(四)铁三角
S
、
I 2、
C
u 2+H +C l 2、B r 2
、H N O 3 H 2S O 4(浓)O 2、Cl 2、HNO 3、H 2SO 4(浓)、(其它如:Br 2、H 2O 2、MnO 4-)
Fe 、Cu 、H 2S 、S 2-、I -、
H 2、C O 、C
、
活泼金属H
2
、C O
、C 、
活泼金属Fe
Fe 3+
Fe 2+
Fe 与弱氧化剂反应,如H +、Cu 2+ 、I 2 、S 等;
用还原剂如H 2 、CO 等还原FeO 或用Mg 、Zn 、Al 等还原Fe 2+盐溶液。 铁与强氧化剂反应如Cl 2、Br 2、浓H 2SO 4 、浓HNO 3等。
用还原剂如H 2 、CO 等还原Fe 2O 3或用足量Mg 、Zn 、Al 等还原 Fe 2+遇强氧化剂的反应如Cl 2、Br 2、O 2、浓H 2SO 4、浓HNO 3、 H 2O 2、Na 2O 2、HClO 等。
Fe 3+遇某些还原剂的反应如Fe 、Cu 、SO 2、I -、H 2S 等以及少量的Zn 、Mg 、Al 等。
(2)Fe Fe2
+Fe+2Fe3
+==3Fe2+(3)Fe Fe3
+2Fe 3++3Zn==2Fe+3Zn 2+
(1) Fe2
+Fe 3+
2Fe3++2I -== 2Fe 2++I 22Fe 2++Cl 2 == 2Fe3
++2Cl -3Fe 2+ +4H ++NO 3-== 3Fe 3++NO + 2H 2O
2Fe3
+ + Fe == 3Fe 2+2Fe3
++Cu==2Fe 2++Cu 2+Fe+2H +==Fe2
++H 2Fe2
++Zn==Zn 2++Fe Fe + 4H ++NO 3–(稀)== Fe 3++ NO + 2H 2O 点燃
2Fe+3Cl 2===2FeCl 3
Fe+S == FeS
加热
(五)铁的冶炼
原料:铁矿石(提供铁元素)、焦炭(提供热量和还原剂)、空气(提供氧气)、石灰石(除去铁矿石中的二氧化硅杂质)。 设备:高炉。
主要反应:C + O 2 CO 2 ,,C + CO 2 2CO (这两个反应是制造还原剂并提供热量),
3CO + Fe 2O 3 2Fe + 3CO 2 ,CaCO 3 CaO + CO 2↑ ,CaO + SiO 2 CaSiO 3. (六)焰色反应
1、定义:金属或它们的化合物在灼烧时使火焰呈现特殊颜色的性质。
2、操作步骤:铂丝(或铁丝)用盐酸浸洗后灼烧至无色,沾取试样(单质、化合物、气、液、固均可)在火焰上灼烧,观察颜色。
3、 重要元素的焰色:钠元素黄色、 钾元素紫色(透过蓝色的钴玻璃观察,以排除钠的焰
色的干扰)
焰色反应属物理变化。与元素存在状态(单质、化合物)、物质的聚集状态(气、液、固)等无关,只有少数金属元素有焰色反应。 (七)合金
1、合金的概念:由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。
2、合金的特性:合金与各成分金属相比,具有许多优良的物理、化学或机械的性能。
点燃
高温
高温
高温
高温
①合金的硬度一般比它的各成分金属的大
②合金的熔点一般比它的各成分金属的低