Classifying potassium ion channels from sequence
- 格式:pdf
- 大小:274.33 KB
- 文档页数:35

离子通道在细胞中的功能调控离子通道是一类跨膜蛋白,在细胞膜上形成孔道,可以允许离子分子在细胞内外之间进行运输。
离子通道在细胞中具有广泛的功能调控作用,包括调节细胞膜电位、维持离子平衡、参与细胞兴奋性传递等。
首先,离子通道调节细胞膜电位。
细胞膜电位是指细胞内外两侧离子浓度差所形成的电位差。
离子通道通过调节细胞内离子的通过程度来调节细胞膜电位。
例如,钠通道和钾通道是参与动作电位形成的关键离子通道。
在动作电位的产生过程中,钠通道迅速开启导致钠离子内流,使细胞膜内电位上升,而钾通道的开启又使钾离子外流,恢复细胞膜电位的负值。
通过这样的开关作用,离子通道能够快速改变细胞膜电位,并调节细胞的兴奋性。
其次,离子通道维持离子平衡。
细胞内外的离子浓度差是保持细胞内外环境稳定的重要因素。
离子通道能够调节离子的通透性,以维持细胞内外的离子平衡。
例如,钙通道是细胞内钙离子浓度调节的关键通道。
细胞膜上的钙通道能够在感受到外界刺激后迅速开启,使钙离子内流,从而改变细胞内钙离子浓度。
钙离子浓度的变化能够触发一系列细胞信号传导过程,调节细胞的代谢、增殖和分化等生理功能。
此外,离子通道参与细胞兴奋性传递。
兴奋性传递是神经元之间传递信号的重要过程,离子通道在其中起到了重要的调节作用。
例如,神经元细胞膜上的钠通道和钾通道能够调节动作电位的产生和传导,从而参与神经冲动的传递。
此外,阻塞或激活特定离子通道也能够影响神经递质的释放,进一步影响神经元之间的信息传递。
除了以上功能,离子通道还参与细胞体内外离子浓度的调节、细胞内信号转导和兴奋性的维持等生理过程。
对离子通道的研究有助于我们进一步了解细胞的功能机制,并为治疗相关疾病提供新的策略。
例如,一些疾病如心律失常、癫痫等与离子通道的功能异常有关,通过调节离子通道活性可能有助于治疗这些疾病。
总之,离子通道在细胞中具有广泛的功能调控作用。
通过调节细胞膜电位、维持离子平衡、参与细胞兴奋性传递等机制,离子通道能够调控细胞内外离子浓度,维持细胞的正常功能。
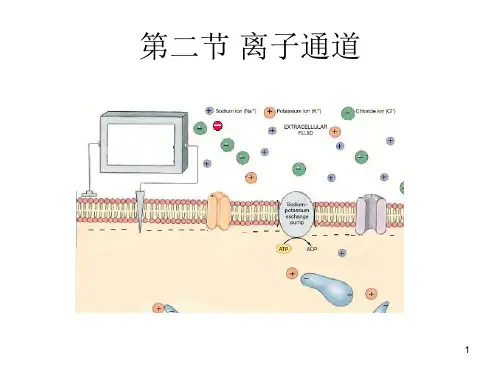


生物膜离子通道百科名片生物膜离子通道示意图生物膜离子通道(ion channels of biomembrane)是各种无机离子跨膜被动运输的通路。
生物膜对无机离子的跨膜运输有被动运输(顺离子浓度梯度)和主动运输(逆离子浓度梯度)两种方式。
被动运输的通路称离子通道,主动运输的离子载体称为离子泵。
生物膜对离子的通透性与多种生命活动过程密切相关。
例如,感受器电位的发生,神经兴奋与传导和中枢神经系统的调控功能,心脏搏动,平滑肌蠕动,骨骼肌收缩,激素分泌,光合作用和氧化磷酸化过程中跨膜质子梯度的形成等。
目录1111111111展开生物膜离子通道简介活体细胞不停地进行新陈代谢活动,就必须不断地与周围环境进行物质交换,而细胞膜上的离子通道就是这种物质交换的重要途径.人们已经知道,大多数对生命具有重要意义的物质都是水溶性的,如各种离子,糖类等,它们需要进入细胞,而生命活动中产生的水溶性废物也要离开细胞,它们出入的通道就是细胞膜上的离子通道. 离子通道由细胞产生的特殊蛋白质构成,它们聚集起来并镶嵌在细胞膜上,中间形成水分子占据的孔隙,这些孔隙就是水溶性物质快速进出细胞的通道.离子通道的活性,就是细胞通过离子通道的开放和关闭调节相应物质进出细胞速度的能力,对实现细胞各种功能具有重要意义.两名德国科学家埃尔温·内尔和贝尔特·扎克曼即因发现细胞内离子通道并开创膜片钳技术而获得1991年的诺贝尔生理学奖.研究简史在生物电产生机制的研究中发现了对离子通透性的变化。
1902年J.伯恩斯坦在他的膜学说中提出神经细胞膜对钾离子有选择通透性。
1939年A.L.霍奇金与A.F.赫胥黎用微电极插入枪乌贼巨神经纤维中,直接测量到膜内外电位差。
1949年 A.L.霍奇金和B.卡茨在一系列工作基础上提出膜电位离子假说,认为细胞膜动作电位的发生是膜对纳离子通透性快速而特异性地增加,称为“钠学说”。
尤其重要的是,1952年A.L.霍奇金和 A.F.赫胥黎用电压钳技术在巨神经轴突上对细胞膜的离子电流和电导进行了细致地定量研究,结果表明Na+和K+的电流和电导是膜电位和时间的函数,并首次提出了离子通道的概念。

细胞膜氯离子通道1. 引言细胞膜氯离子通道是细胞膜上的一种重要的离子通道,它负责调节细胞内外氯离子的平衡,参与多种生理过程。
本文将介绍细胞膜氯离子通道的结构、功能以及其在生物体中的重要作用。
2. 结构细胞膜氯离子通道主要由蛋白质组成,其结构可以分为两类:受体激活的和电压门控的。
2.1 受体激活型氯离子通道受体激活型氯离子通道是通过受体与配体的结合来打开或关闭的。
这类通道包括GABA(γ-氨基丁酸)受体和甘氨酸受体等。
当相应的神经递质或药物结合到这些受体上时,会引起蛋白质构象变化,使得通道开放并允许克服能垒通过。
2.2 电压门控型氯离子通道电压门控型氯离子通道是通过细胞内外电位的变化来调节的。
这类通道包括GABAA受体和CLC家族等。
当细胞膜电位发生变化时,通道会从关闭状态转换为开放状态,使得氯离子进入或离开细胞。
3. 功能细胞膜氯离子通道在生物体中具有多种重要功能。
3.1 稳定细胞内外电位差细胞膜氯离子通道可以调节细胞内外的氯离子浓度,从而稳定细胞的内外电位差。
这对于正常的神经传递、肌肉收缩等生理过程至关重要。
3.2 调节细胞水平氯离子是体内调节渗透压和水平的重要成分之一。
通过调节细胞膜上的氯离子通道开放程度,可以控制细胞内水分平衡,保持正常的细胞功能。
3.3 参与免疫反应氯离子通道在免疫反应中也起到重要作用。
它们参与调节免疫细胞的活性和功能,影响炎症反应、免疫细胞迁移等过程。
3.4 调节酸碱平衡细胞膜氯离子通道还参与调节细胞内外的酸碱平衡。
通过调节细胞内氯离子浓度,可以影响细胞内外的pH值,维持正常的酸碱平衡。
4. 细胞膜氯离子通道与疾病异常的细胞膜氯离子通道功能与多种疾病相关。
4.1 先天性氯离子通道缺陷症先天性氯离子通道缺陷症是由于细胞膜上的氯离子通道功能异常引起的一类遗传性疾病。
常见的先天性氯离子通道缺陷症包括囊性纤维化、甘汞中毒等。
4.2 神经系统相关疾病某些神经系统相关疾病也与细胞膜氯离子通道功能异常有关。


离子通道药物的筛选及研究随着现代医学的发展,越来越多的疾病被归于离子通道缺陷所引起。
离子通道是一个嵌入细胞膜的蛋白质通道,调节着细胞内外离子的平衡与交换。
钾离子、钠离子、钙离子和氯离子等是离子通道中主要的离子。
一旦离子通道出现问题,细胞内外的离子平衡必然受到干扰,从而影响神经、心血管、肌肉等生理功能。
离子通道药物是治疗离子通道相关疾病的重要手段,包括心律失常、肌无力症、癫痫等多种疾病。
因此,筛选和研究离子通道药物具有重要意义。
一、离子通道药物的筛选离子通道药物的筛选首先需要了解离子通道分布的组织和细胞学结构,以便确定筛选的靶点。
常见的靶点包括钠离子通道、钾离子通道、钙离子通道等。
其次,需要通过药物分子模拟方法进行离子通道药物的库筛选。
离子通道药物的分子量通常较大,跨膜区域具有大量的疏水性氨基酸残基,因此,药物分子分布在跨膜区间,是离子通道药物筛选的难点。
此外,通过离子通道药物的细胞注射实验,也能筛选出离子通道药物。
专业实验室通常会利用膜片钳技术进行电生理研究,以记录细胞膜上的离子通道电流。
利用这些电流,分析药物对离子通道进行调节的作用,最终筛选出具有高效性和安全性的离子通道药物。
二、离子通道药物的研究离子通道药物的研究需要从药物的作用机制、药物的动力学和药效学等方面进行深入研究。
1. 作用机制离子通道药物的作用机制主要是靶点对药物的亲和力和作用程度。
因此,需要进行靶点结构的深入研究。
研究人员可以使用X-射线衍射技术,通过解析离子通道的高分辨率晶体结构,了解药物在靶点上的作用方式。
此外,还可以使用生物信息学技术,预测药物与离子通道蛋白的亲和力和相互作用机理,从而为药物设计提供理论依据。
2. 动力学动力学主要研究药物在体内吸收、分布、代谢和排泄等生物转化过程。
研究人员可以通过药物的药代动力学研究,来了解药物在体内的转化机制,预测药物对人体的毒性和副作用,并制定更加个性化、有效的调控方案。
3. 药效学药效学主要研究药物的疗效和副作用,以及这些效应与药物剂量和浓度之间的关系。



钠、钾离子通道和钠钾泵的辨析钠、钾离子通道和钠钾泵是细胞膜上关键的离子传输通路,维持了细胞内外的电化学平衡,对细胞的正常功能起到重要作用。
在下面的文章中,我们将详细介绍钠、钾离子通道和钠钾泵的区别和功能。
细胞膜是细胞内外环境的一道隔离屏障,能够限制离子和其他化合物的通过。
而钠、钾离子通道和钠钾泵则是细胞膜上的特殊蛋白质,允许离子在特定条件下跨过细胞膜。
这些离子通道和泵起到细胞外内电位差的维持和改变的作用。
首先,钠离子通道是细胞膜上的一种膜蛋白,特异地允许钠离子跨过膜从细胞外进入细胞内。
它的开放和关闭状态由细胞膜电位控制。
当细胞膜内外电位差过大时(如在动作电位时),钠离子通道会迅速开放,使得钠离子大量进入细胞内。
这个过程叫做钠离子的“迅速激活”。
随着时间的推移,钠离子通道逐渐关闭,离子传输减少。
这称为“缓慢失活”。
钠离子通道在神经细胞中起到了促进神经冲动传递的作用。
钾离子通道是另一种位于细胞膜上的膜蛋白,和钠离子通道类似,允许钾离子从细胞内流出细胞外。
整个过程也受到细胞膜电位的控制。
钾离子通道的开放状态和关闭状态是反向的。
当细胞膜内外电位差减小时(如在细胞静息状态),钾离子通道保持开放,使得钾离子大量流出细胞外。
这种大量的钾离子外流会导致细胞膜内外电位差增大,进而关闭钾离子通道。
钾离子通道的开放和关闭状态与细胞的兴奋性密切相关,通过调节细胞膜电位,影响了神经肌肉细胞的功能。
钠钾泵是一种转运蛋白,位于细胞膜上,通过使用细胞内的三磷酸腺苷(ATP),将细胞内的钠离子和钾离子转运到细胞外,并保持钠离子与钾离子的浓度梯度。
钠钾泵的工作过程可以简单地描述为,在一个周期里,钠泵会利用ATP,将细胞内的三个钠离子排出,同时将两个钾离子带入细胞内。
这种电子输送器的转运过程相当于用能力源驱动了离子的运动。
钠钾泵在维持正常细胞体内钠离子与钾离子的平衡,并参与了多种细胞功能的调节。
综上所述,钠、钾离子通道和钠钾泵是细胞内外离子平衡调节的重要组成部分。
钾离子通道研究方法全文共四篇示例,供读者参考第一篇示例:钾离子通道是细胞膜上的一种通道蛋白,负责调控细胞内外钾离子的流动,是神经元、心肌细胞等细胞的重要调节机制。
钾离子通道的研究方法主要包括生物物理学实验、分子生物学实验、细胞生物学实验等多种方法,下面将分别介绍这些方法在研究钾离子通道中的应用。
生物物理学实验是研究钾离子通道最基础的方法之一,其中电生理学实验是最常用的技术之一。
通过电生理学技术,可以记录细胞膜上钾离子通道的电活动,测定其打开、关闭的特性,以及不同物质对其活性的影响。
常用的电生理学技术包括膜片钳技术、全细胞记录技术、小动物离体脑片记录技术等。
通过这些技术,可以研究钾离子通道的结构、功能特性以及调节机制。
细胞生物学实验是研究钾离子通道在细胞内定位、表达水平等方面的方法之一。
通过细胞培养技术,可以培养出含有钾离子通道的细胞,观察其在不同条件下的表达情况,以及与其他细胞器的相互作用。
常用的细胞生物学技术包括细胞染色、蛋白质质谱技术、免疫荧光技术等。
通过这些技术,可以研究钾离子通道在细胞内的作用以及其与其他细胞器的关系。
除了上述介绍的方法外,近年来,随着生物技术的发展,一些新兴技术也被应用于钾离子通道的研究中。
单细胞测序技术可以在个体细胞水平上研究钾离子通道的表达情况;顶点成像技术可以观察钾离子通道在细胞内的分布情况。
这些新技术的应用,为我们更深入地了解钾离子通道的结构、功能特性提供了新的可能性。
钾离子通道的研究方法包括生物物理学实验、分子生物学实验、细胞生物学实验等多种技术手段。
这些方法的应用,帮助我们深入理解钾离子通道的结构与功能,以及其在生理疾病中的作用机制,为新药研发、疾病治疗提供了重要的理论依据。
随着生物技术的不断进步,相信在未来的研究中,我们将能够更加深入地认识和探索钾离子通道的奥秘。
【2000字】第二篇示例:钾离子通道是细胞膜上的一种蛋白质通道,它负责调控细胞内外钾离子的流动,从而参与细胞的兴奋性传导、细胞的稳态调节等多种生物学过程。
化学本质为离子通道的受体离子通道是细胞膜上的一类蛋白质,具有高度的选择性和速度,能够调节细胞内外离子的平衡和信号传递,对于生命的维持和调节起着非常重要的作用。
而受体则是细胞膜上的一类分子,能够感受、接受外部信号,并将其转化为细胞内部的信号,参与细胞生理活动的调节和调控。
结合这两者的特点,我们可以得出结论:化学本质为离子通道的受体是细胞膜上的一类可以通过控制离子流通来调节信号传递的受体。
离子通道与信号传递离子通道的主要功能是调节离子的流通。
它们能够透过细胞膜从一侧传递到另一侧的离子,比如钠离子、钾离子和钙离子等。
这些离子的流通对于许多生物过程都至关重要,比如神经传导、肌肉收缩和细胞凋亡等。
离子通道的表现形式可以是电压门控、化学门控或是机械门控。
电压门控的离子通道在细胞膜上的开放状态和细胞膜的电势有关,当细胞膜电势达到一定程度时,离子通道就能打开,导致离子流通。
化学门控的离子通道则会在特定的分子浓度下打开或关闭。
机械门控的离子通道是指当细胞或分子与其接触时,离子通道能够发生一定的形变,从而导致开放或关闭状态的变化。
信号传递是细胞内外信息的传递和调节,其实现的关键是信号分子、受体和效应器。
信号分子为化学物质,它们能够作用于特定的受体,一旦与受体结合,就能够激活特定的效应器,并引发一系列的反应。
其中,受体在整个过程中起着非常重要的作用。
可以说,受体就是信号传递的关键节点,它们能够感受、接收并转化外部的信号,并将其传递给细胞内部的效应器,从而调节细胞的生理功能。
离子通道受体的结构和功能离子通道受体的结构和功能具有一定的多样性。
比较常见的是离子通道的通道蛋白和受体蛋白共同组成的离子通道受体。
这种受体是由膜蛋白质和多肽链组成,具有高度的特异性和选择性。
离子通道受体的特点在于,它们能够透过细胞膜传递离子,并由此产生特定的信号传递效应。
在离子通道受体中,通道蛋白是负责离子通道的径向空间,而受体蛋白则是负责确定离子通道的通透性和选择性。
CLASSIFYING POTASSIUM CHANNELS FROM SEQUENCEASHOK PALANIAPPANa, b AND ERIC G. JAKOBSSONa, b, c, d, e
*
aCenter for Biophysics and Computational Biology, bBeckman Institute, cDepartments ofBiochemistry and dMolecular and Integrative Physiology, eNCSA Senior ResearchScientist, University of Illinois, Urbana, IL 61820, USA
ABSTRACT:
Potassiumchannels are an ancient, diverse protein family. Individual K channels are assigned to various subfamilies based on biochemical andelectrophysiological characterization. Computational methods utilizing sequence, structure and function data and schematizing a classification that provides for annotation of new channel sequences are useful. A difficulty in classifying K channels arises from the diversity in their attributes, namely membrane topology, gating, conduction, and other electrophysiological properties. We suggest a hypothesis that the permeation pathway, the one structural domain common to all K channels, contains enough information about the entire channel that a phylogenetic analysis of this domain functions as a channel subfamily classifier. The hypothesis is validated by: 1) showing that it replicatesthe classification for human potassium channels existing in the Human Genome *Corresponding author(jake@ncsa.uiuc.edu)Organization (HUGO) database, 2) providing a classification for two-pore K channels that also points to their origin, and 3) showing the existence of a new K channel subfamily that had not previously been identified in the human genome. We provide classification for many human potassium channel genes that had not been previously classified. A related investigation into the evolutionary conservation of structural features of the K channel permeation pathway in human and prokaryotes is also detailed. INTRODUCTION:Potassium channels are the most ancient family of the voltage-gated ion channel superfamily. All fully sequenced eukaryotic genomes code for at least one potassium channel protein, and most code for many, which also agrees with the theory that the “pump-leak” model for ion and water cellular homeostasis, which depends on potassium channels in the plasma membrane, is ubiquitous in eukaryotic cells (Jakobsson, 1980). An ability to selectively pass potassium ions must be important to most prokaryotes too (supplement to Koonin (2000)). Potassium channels have evolved to play critical roles in many diverse cellular processes. This functional diversity has come about in large part by their acquisition of various regulatory modules to modulate their gating and conductance properties and in some eukaryotes, by their association with auxiliary components as well (Yi et al., 2001). Some key roles played by potassium channels include electrical excitability, electrolyte balance, volume regulation, sensory signal transduction and immune response regulation. Regulatory factors for potassium channels include membrane voltage, pH, cyclic nucleotides, intracellular calcium, ATP, polyamines, G-proteins, and temperature. The classification of potassium channels into distinct subfamilies has classically depended on their biochemical characterization (i.e., the nature of the particular physiological regulation) as well as electrophysiological characteristics (large vs. small conductance, fast vs. slow inactivation, depolarization-activated or hyperpolarization-activated etc.). Automated sequence annotation pipelines, including those using ‘profile-based’ approaches, do not succeed in discriminating among even the primary voltage-gated ion channel families, i.e., the K+-, Na+-, and Ca2+- channel families. Since electrophysiological studies are time-consuming in the least, it would be useful to devise a robust computationally-based classification method that proceeds from and utilizes the already present large repository of information about potassium channels. An analytical approach to classification would ideally take stock of the biological definition of potassium channels, and account for their diversity.
Potassium channels, structurally, are membrane proteins that have a signature selectivity filter (almost always G[YF]G) (Heginbotham et al., 1994) in a “pore region” that is flanked by transmembrane helices on either side. Together, this structural motif constitutes the “permeation pathway” of the channel and subfamily designations commonly indicate the ‘attachments’ to this basic design. The pore-forming monomers are usually referred to as alpha-subunits and most often form homotetramers in the membrane in order to function. It is reasonable to suppose that the diverse functional properties of potassium channels necessarily stem from the nature of their particular sequences (Anfinsen, 1973; Danchin, 1999; Orengo et al., 1999). Hydropathy plots, which can be used to infer