
几种重要的金属化合物
题目几种重要的金属化合物第 1 课时
学习
目标
1、掌握钠的重要化合物(Na2O、Na2O
2、Na2CO
3、NaHCO3)的性质与主要用途。
2、能用焰色反应判断某些金属元素的存在。
学习
疑问
学习
建议
【相关知识点回顾】
金属钠性质活泼,因此钠元素在自然界中都是以态存,初中所学过的钠的化合物主要有等。
【预习能掌握的内容】
一、钠的重要化合物
1、氧化钠和过氧化钠
结合课本P55“思考与交流”,尝试填写下表:氧化钠与过氧化钠的比较。
氧化钠过氧化钠
化学式与O
的化合价
氧化物类型
构成粒子
颜色状态
与H2O反应方
程式
与CO2反应方
程式
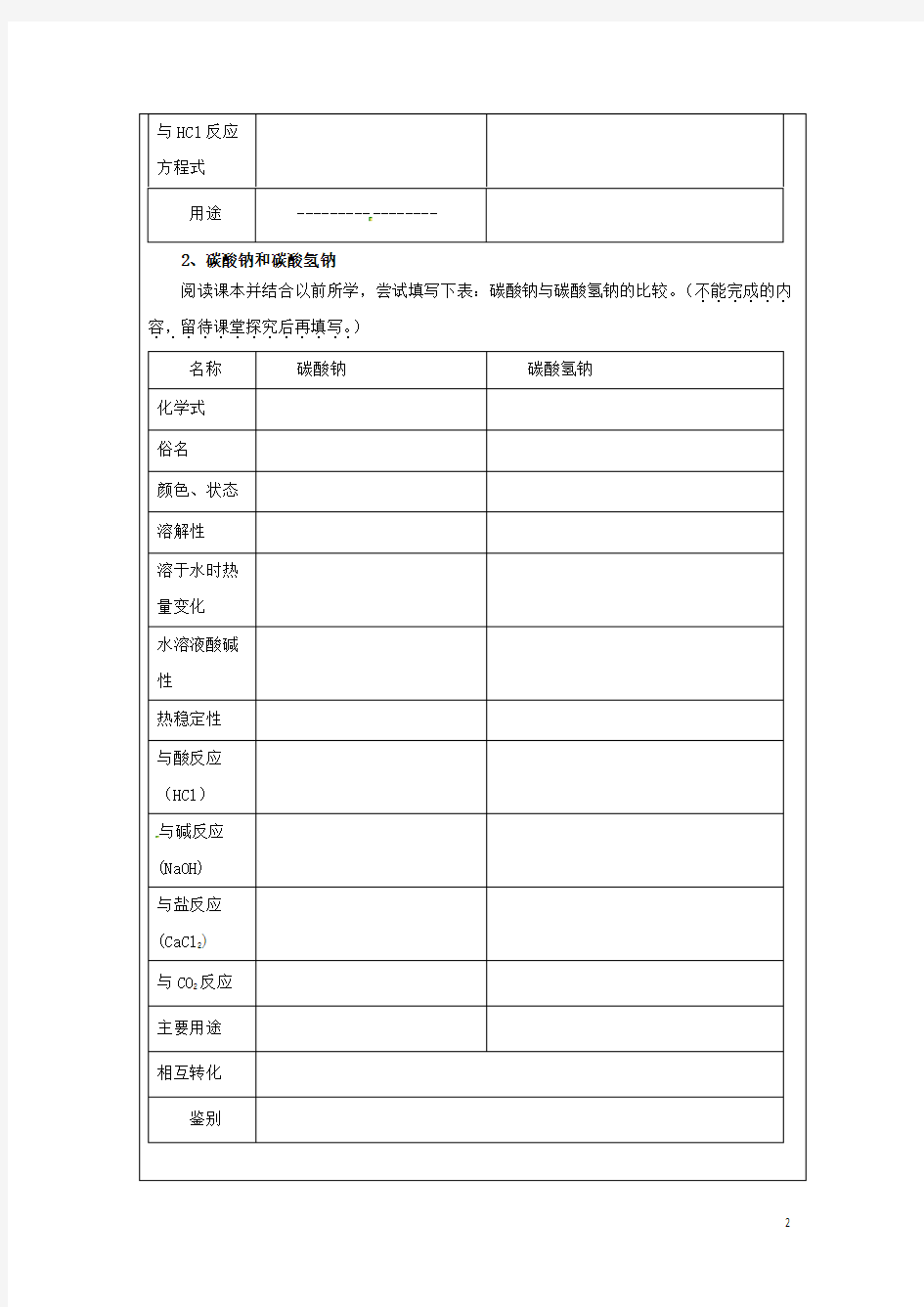
2、碳酸钠和碳酸氢钠
阅读课本并结合以前所学,尝试填写下表:碳酸钠与碳酸氢钠的比较。(不能完成的内......容,留待课堂探究后再填写。.............
) 名称
碳酸钠 碳酸氢钠 化学式
俗名
颜色、状态
溶解性
溶于水时热
量变化
水溶液酸碱
性
热稳定性
与酸反应
(HCl )
与碱反应
(NaOH)
与盐反应
(CaCl 2)
与CO 2反应
主要用途
相互转化
鉴别
与HCl 反应
方程式
用途 -----------------
3、焰色反应
(1)定义:很多或它们的在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫。
(2)应用:节日燃放的烟花,就是以及、等金属化合物焰色反应呈现的各种颜色。
(3)钠钾的焰色反应:钠的焰色:,钾的焰色:。
一、钠的重要化合物
〖交流展示〗
小组交流课前预习收获与疑惑,并积极展示。
〖实验探究1〗
小组合作完成课本P55“实验3-5”(或观察老师演示),思考、讨论如下问题:
(1)实验现象。
(2)写出下列反应的化学方程式:
Na2O2和H2O反应:
Na2O2和CO2反应:
(3)上述两个反应是氧化还原反应吗?你能分析清楚其中元素化合价变化吗?
(4)过氧化钠是碱性氧化物吗?为什么?
〖实验探究2〗碳酸钠和碳酸氢钠
(1)小组合作完成课本P56“科学探究”(或观察老师演示),完成课本中表格填写。
(2)补充完成下列实验探究:
①分别向Na2CO3溶液和NaHCO3溶液滴入稀盐酸,观察现象并比较异同。写出反应的化学方程式。
②分别向Na2CO3溶液和NaHCO3溶液滴入BaCl2溶液,观察现象并比较。写出反应的化学方程式。
〖合作探究1〗
(1)分别向Na2CO3溶液和NaHCO3溶液滴入NaOH溶液,有什么现象吗?是否有反应发生?
(2)分别向Na2CO3溶液和NaHCO3溶液滴入澄清石灰水,有什么现象吗?试着写出反应的化学方程式和离子方程式?
请自己归纳酸式盐与碱反应的规律:
〖合作探究2〗
(1)如何鉴别Na2CO3、NaHCO3两种固体?如果是溶液,又如何鉴别?
(2)在Na2CO3中混有NaHCO3,如何除去?在NaHCO3中混有Na2CO3又如何除去?
〖实验探究3〗焰色反应
小组合作完课本P57“实验3-7”,思考、讨论如下问题:
(1)焰色反应每次实验都要用试剂洗净铂丝,这种试剂是()
A. Na2CO3溶液 B.NaOH溶液 C.硫酸 D.稀盐酸
(2)“钠的焰色呈黄色”,这里的钠是指钠单质还是化合物?
(3)焰色反应是物理变化还是化学变化?有什么应用?
〖课堂练习〗
1、写出下列反应的离子方程式
①Na2CO3和HCl
②NaHCO3和HCl
③NaHCO3和NaOH
④Na2CO3和Ca(OH)2
⑤Na2CO3和CaCl2
2、把CO2通入NaOH溶液中,开始反应时的离子方程式为,若继续通入CO2至过,反应的离子方程式。
3、把CO2通入饱和的Na2CO3溶液中会出现混浊,试分析可能的原因。
〖及时总结〗
自主总结本课时主要内容并积极展示。
层次一:【基础达标】
1、下列关于Na2O与Na2O2的说法中,不正确的是()
A.Na2O2比Na2O稳定
B.均与水反应生成NaOH,因而均是碱性氧化物
C.Na2O能被氧化成Na2O2 D.均可与H2O、CO2 反应
2、对2Na2O2+2CO2==2Na2CO3+O2下列说法正确的是()
A.是氧化还原反应,Na2O2是氧化剂,CO2是还原剂
B.是氧化还原反应,CO2是氧化剂,Na2O2是还原剂
C.不是氧化还原反应,是碱性氧化和酸性氧化物反应
D.是氧化还原反应,Na2O2既是氧化剂,又是还原剂
3. 下列说法中不正确
...的是()
A.Na2CO3比NaHCO3易溶于水 B.Na2CO3比NaHCO3稳定
C.Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与盐酸反应得CO2物质的量之比为2︰1
4.用光洁的铂丝蘸取无色溶液,在无色火焰上灼烧时观察到黄色火焰,则下列有关叙述中正确的是
A.只含有Na+ B.一定含有Na+,也可能含有K+
C.既含有Na+,又含有K+ D.可能含有Na+和K+的一种
层次二:【能力提升】
5、Na2O2与足量NaHCO3混合后,在密闭容器中充分加——排除气体物质后冷却,残留的是()
A.Na2CO3和Na2O2 B.只有Na2CO3 C.Na2CO3和NaOH D.Na2O和NaHCO3
6、要除去CO2中的HCl气体,最好的方法是将混合气体通过()
A.饱和NaHCO3 B.饱和Na2CO3溶液 C.饱和石灰水 D.氨水
7、欲除去小苏打溶液中的苏打杂质,加入的物质最适宜的是()
A.通CO2 B.加HCl C.加CaCl2后过滤 D.加Ca(OH)2后过滤
8、在一定温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复
到原温,下列说法正确的是()
A.溶液中Na+浓度增大,有O2放出 B.溶液的OH-浓度不变,有H2放出
C.溶液中Na+数目减少,有O2放出 D.OH-浓度增大,有O2放出
2021届新高考化学模拟试卷
一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.设N A为阿伏加德罗常数的值,下列说法正确的是
A.1 L0.1 mol·L-1的氨水中含有的NH3分子数为0.1 N A
B.标准状况下,2.24 L 的CC l4中含有的C-Cl 键数为0.4 N A
C.14 g 由乙烯与环丙烧( C3H6) 组成的混合气体含有的碳原子数目为N A
D.常温常压下,Fe 与足量稀盐酸反应生成2.24 L H2, 转移电子数为0.3N A
2.2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )
A.元素乙的原子序数为32
B.原子半径比较:甲>乙>Si
SiH。
C.元素乙的简单气态氢化物的稳定性强于4
D.推测乙可以用作半导体材料
3.我国科学家发明了一种“可固氮”的锂-氮二次电池,将可传递Li+的醚类作电解质,电池的总反应为。下列说法正确的是
A.固氮时,锂电极发生还原反应
B.脱氮时,钌复合电极的电极反应:2Li3N-6e-=6Li++N2↑
C.固氮时,外电路中电子由钌复合电极流向锂电极
D.脱氮时,Li+向钌复合电极迁移
4.下列物质属于氧化物的是
A.Cl2O B.H2SO4C.C2H5OH D.KNO3
5.《本草纲目》记载:“凡使白矾石,以瓷瓶盛。于火中,令内外通赤,用钳揭起盖,旋安石峰巢人內烧之。每十两用巢六两,烧尽为度。取出放冷,研粉”。在实验室完成该操作,没有用到的仪器是
A.蒸发皿B.坩埚C.坩埚钳D.研钵
6.下列有关化学用语表示正确的是
A.中子数为10的氟原子:10F
B.乙酸乙酯的结构简式:C4H8O2
C.Mg2+的结构示意图:
D.过氧化氢的电子式为:
7.下列说法正确的是()
A.Na2CO3分子中既存在离子键,也存在共价键
B.硅晶体受热融化时,除了破坏硅原子间的共价键外,还需破坏分子间作用力
C.H2O不易分解是因为H2O分子间存在较大的分子间作用力
D.液态AlCl3不能导电,说明AlCl3晶体中不存在离子
8.用化学用语表示2CO2+2Na2O2===2Na2CO3+O2中的相关微粒,其中正确的是() A.中子数为6的碳原子:612C B.氧原子的结构示意图:
C.CO2的结构式:O—C—O D.Na2O2的电子式:Na Na
9.N A为阿伏加德罗常数的值。下列说法正确的是( )
A.18gD2O 和18gH2O 中含有的质子数均为10N A
B.12 g 石墨烯(单层石墨)中含有六元环的个数为0.5 N A
C.标准状况下,5.6LCO2 与足量Na2O2反应转移的电子数为0.5 N A
D.某密闭容器盛有1 mol N2和3 mol H2,在一定条件下充分反应,转移电子的数目为6N A 10.对甲基苯乙烯()是有机合成的重要原料。下列对其结构与性质的推断错误的是()
C H
A.分子式为910
B .能发生加聚反应和氧化反应
C .具有相同官能团的芳香烃同分异构体有5种(不考虑立体异构)
D .分子中所有原子可能处于同一平面
11.25℃时,用0.1 mol·L -1NaOH 溶液分别滴定20.00mL 0.1 mol·L -1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
A .Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B .pH=7时,滴定盐酸和醋酸消耗NaOH 溶液的体积相等
C .V(NaOH)=10.00mL 时,醋酸溶液中c(CH 3COO -)> c(Na +)> c(H +)> c(OH -)
D .V(NaOH)=20.00mL 时,两溶液中c(CH 3COO -)> c(Cl -)
12.设N A 为阿伏加德罗常数的值,下列说法正确的是( )
A .2278gNa O 固体含有离子的数目为A 3N
B .常温下,pH 1 的醋酸溶液中H +数目为A 0.1N
C .13g 由12C 和14C 组成的碳单质中所含质子数一定为A 6N
D .20.1molSO 与足量2O 在一定条件下化合,转移电子数为A 0.2N
13.在环境和能源备受关注的今天,开发清洁、可再生新能源已成为世界各国政府的国家战略,科学家发现产电细菌后,微生物燃料电池(MFC)为可再生能源的开发和难降解废物的处理提供了一条新途径。微生物燃料电池(MFC)示意图如下所示(假设有机物为乙酸盐)。下列说法错误的是
A .A 室菌为厌氧菌,
B 室菌为好氧菌
B .A 室的电极反应式为CH 3COO ??8e ? +2H 2O
2CO 2 +8H +
C .微生物燃料电池(MFC)电流的流向为b→a
D .电池总反应式为CH 3COO ?+2O 2+H +2CO 2 +2H 2O 14.常温下,用0.1000-1mol L ?NaOH 溶液滴定20.00mL 某未知浓度的CH 3COOH 溶液,滴定曲线如右图所示。已知在点③处恰好中和。下列说法不正确...
的是( )
A .点①②③三处溶液中水的电离程度依次增大
B .该温度时CH 3COOH 的电离平衡常数约为51.810-?
C .点①③处溶液中均有c(H +)=c(CH 3COOH)+c(OH -)
D .滴定过程中可能出现:c(CH 3COOH)>c(CH 3COO -)>c(H +)>c(Na +)>c(OH -)
15.在指定条件下,下列各组离子一定能大量共存的是
A .滴加甲基橙试剂显红色的溶液中:23Na Fe Cl NO ++--
、、、
B .滴入KSCN 显血红色的溶液中:32434NH Al NO SO ++--、、、
C .-+c(OH )c(H )
=1012的溶液中:43NH K Cl HCO ++--、、、 D .由水电离的c(H +)=1.0×l0-13 mol/L 溶液中:3243K Al SO CH COO ++--
、、、
二、实验题(本题包括1个小题,共10分)
16.磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:
已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
pH 3.5 5.0 6.5 8.0 10.0 12.0
ω(Fe)/%66.5 79.2 88.5 97.2 97.4 98.1
ω(Li)/%0.9 1.3 1.9 2.4 4.5 8.0
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________
三、推断题(本题包括1个小题,共10分)
17.为了寻找高效低毒的抗肿瘤药物,化学家们合成了一系列新型的1,3- 二取代酞嗪酮类衍生物。
(1)化合物B 中的含氧官能团为__________和__________(填官能团名称)。
(2)反应i-iv 中属于取代反应的是___________。
(3)ii 的反应方程式为___________。
(4)同时满足下列条件的的同分异构体共有_____种,写出其中一种的结构简式: _______
I.分子中含苯环;II.可发生银镜反应;III.核磁共振氢谱峰面积比为1∶2∶2∶2∶1 (5)是一种高效低毒的抗肿瘤药物,请写出以和和
为原料制备该化合物的合成路线流程图(无机试剂任用):______________。
四、综合题(本题包括2个小题,共20分)
18. (1)磷在成键时,能将一个3s 电子激发进入3d 能级而参加成键,写出该激发态原子的核外电子排布式_______。
(2)钛存在两种同素异形体,Ti α-采纳六方最密堆积,Ti β-采纳体心立方堆积,由Ti α-转变为Ti β-晶体体积______(填“膨胀”或“收缩”)
(3)[Cu(CH 3CN)4]+是非常稳定的络合离子,配体中σ键和π键个数之比为_______。
(4)水杨酸第一级电离形成离子,相同温度下,水杨酸的K a2_________苯酚()的Ka(填“>”“ =”或“<”)
(5)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220?C。Cr(CO)6的晶体类型是_____,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的化学键类型为_______。
(6)已知N-N、N=N和N≡N键能之比为1.00:2.17:4.90.而C-C、C=C、C≡C键能之比为1.00:1.77:2.34.如何用这些数据理解氮分子不容易发生加成反应而乙炔容易发生加成反应?
_____________。
(7)将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代可形成碳的一种新型三维立方晶体结构——T-碳。已知T-碳密度为ρg/cm,阿伏加德罗常数为N A,则T-碳的晶胞参数a=_______pm(写出表达式即可)
19.(6分)冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。
Ⅰ.用活性炭处理工厂尾气中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(l)ΔH1=a kJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l)ΔH2=b kJ·mol-1
③C(s)+O2(g)=CO2(g)ΔH3=c kJ·mol-1
则反应C(s)+2NO(g)N2(g)+CO2(g)的ΔH=_____。
(2)在容积不变的密闭容器中,一定量的NO与足量的C发生反应:
C(s)+2NO(g)N 2(g)+CO2(g)ΔH=Q k J·mol-1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是______。
A.其他条件不变,改变活性炭的用量,平衡一定不移动
B.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K2
C.温度为T2时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
(3)已知某温度时,反应C(s)+2NO(g)N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L 密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_______
(4)工业上实际处理废气时,常用活性炭作催化剂,用NH3还原NO,同时通入一定量的O2以提高处理效果。当n(NH3)=n(NO)时,写出体系中总反应的化学方程式:______________。Ⅱ.用纳米铁粉或电解法处理废水中的硝酸盐。
(5)纳米铁粉处理污水中NO3-的离子方程式为4Fe+ NO3-+10H+=4Fe2++NH4++3H2O。
实验证实,pH偏小将会导致NO3-的去除率下降,其原因是_______________。相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见图),产生该差异的可能原因是__。(6)电解法处理水中硝酸盐的原理是以金属Pt作电极,用质子交换膜把溶液分为阴阳两极区,阴极区为含硝酸盐的工业废水,接通直流电源进行电解。请写出阴极的电极反应式:
__________。
参考答案
一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意) 1.C
【解析】
【分析】
【详解】
A.氨水中存在电离平衡,因此溶液中实际存在的氨分子一定少于0.1mol ,A 项错误;
B.四氯化碳在标况下不是气体,因此无法按气体摩尔体积计算其分子数,B 项错误;
C.乙烯和环丙烷的最简式相同,均为2CH ,因此14g 混合物相当于1mol 的2CH ,自然含有N A 个碳原子,C 项正确;
D.常温常压下,气体摩尔体积并不是22.4L/mol ,因此无法根据氢气的体积进行计算,D 项错误;
答案选C 。
2.C
【解析】
【分析】
由元素的相对原子质量可知,甲、乙的相对原子质量均比As 小,As 位于第四周期V A 族,则C 、Si 、乙位于第IV A 族,乙为Ge ,B 、Al 、甲位于ⅢA 族,甲为Ga ,以此来解答。
【详解】
A .乙为Ge ,元素乙的原子序数为32,故A 正确;
B .电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径比较:甲>乙>Si ,故B 正确;
C .非金属性Ge 小于Si ,则元素乙的简单气态氢化物的稳定性弱于SiH 4,故C 错误;
D .乙为Ge ,位于金属与非金属的交界处,可用作半导体材料,故D 正确。 故选C 。
【点睛】
本题考查位置、结构与性质,把握相对原子质量、元素的位置及性质为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用。
3.B
【解析】
【分析】
据总反应可知:放电时锂失电子作负极,负极上电极反应式为
6Li-6e-═6Li+,Li+移向正极,氮气在正极得电子发生还原反应,电极反应式为
6Li++N2+6e-═2Li3N,充电是放电的逆过程,据此解答。
【详解】
A. 固氮时,锂电极失电子发生氧化反应,故A错误;
B.脱氮时,钌复合电极的电极反应为正极反应的逆反应:2Li3N-6e-=6Li++N2↑,故B正确;
C.固氮时,外电路中电子由锂电极流向钌复合电极,故C错误;
D.脱氮时,Li+向锂电极迁移,故D错误;
答案:B
【点睛】
明确原电池负极:升失氧;正极:降得还,充电:负极逆反应为阴极反应,正极逆反应为阳极反应是解本题关键,题目难度中等,注意把握金属锂的活泼性。
4.A
【解析】
有两种元素组成其中一种是氧元素的化合物叫氧化物,H2SO4、C2H5OH、KNO3的组成元素均为三种,只有Cl2O符合题意,故答案为A。
5.A
【解析】
【详解】
这是固体的加热、灼烧、冷却和研磨的过程,固体加热用坩埚B,要用坩埚钳C取放,研磨在研钵D中进行,所以蒸发皿是没有用到的仪器。答案为A。
6.C
【解析】
【详解】
A. 中子数为10的氟原子为:199F,选项A错误;
B. C4H8O2为乙酸乙酯的分子式,乙酸乙酯的结构简式:CH3COOC2H5,选项B错误;
C. Mg2+的结构示意图为:,选项C正确;
D. 过氧化氢是共价化合物,两个氧原子之间共用一对电子,过氧化氢的电子式应为:
,选项D错误。
答案选C。
7.D
【解析】
【详解】
A. Na2CO3是离子化合物,没有分子,A项错误;
B. 硅晶体是原子晶体,不存在分子间作用力,B项错误;
C. H2O不易分解是因为水分子中氢氧键键能大,C项错误;
D. 晶体加热熔化后所得液态物质不能导电,说明在液态时不存在自由移动的离子,即原晶体中不存在离子,则液态AlCl3不能导电,说明AlCl3晶体中不存在离子,D项正确;
答案选D。
8.B
【解析】
【详解】
A. 中子数为6的碳原子:,A项错误;
B. 氧原子的原子序数为8,其原子结构示意图:,B项正确;
C. CO2分子中各原子满8电子稳定,其中碳与氧原子形成的是共价双键,其结构式为:O=C=O,C项错误;
D. Na2O2为离子化合物,存在离子键与非极性共价键,其电子式为:,D项错误;
答案选B。
【点睛】
化学用语是化学考试中的高频考点,其中元素符号的含义要牢记在心,其左上角为质量数(A)、左下角为质子数(Z),质子数(Z)=核电荷数=原子序数,质量数(A)=质子数(Z)
+中子数(N)。
9.B
【解析】
【详解】
A.D2O的摩尔质量为20g/mol,故18gD2O的物质的量为0.9mol,则含有的质子数为9 N A,A错误;
B.单层石墨的结构是六元环组成的,一个六元环中含有
1
62
3
?=个碳原子,12g石墨烯物
质的量为1mol,含有的六元环个数为0.5N A,B正确;
C.标准状况下,5.6LCO2的物质的量为0.25mol,与Na2O2反应时,转移电子数为0.25 N A,C错误;
D.N2与H2反应为可逆反应,由于转化率不确定,所以无法求出转移电子,D错误。
答案选B。
【点睛】
本题B选项考查选修三物质结构相关考点,石墨的结构为,利用均摊法即
可求出六元环的个数。
10.D
【解析】
【分析】
对甲基苯乙烯()含有甲基、苯环和碳碳双键,具有苯、乙烯的结构特点和性质。【详解】
A项、对甲基苯乙烯()含有9个碳和10个氢,分子式为C9H10,故A正确;
B项、含有碳碳双键,可发生加聚反应和氧化反应,故B正确;
C项、含有两个支链时,有邻间对三种结构,含有一个支链时:支链为-CH=CH-CH3、-CH2CH=CH2、-C(CH3)=CH2,除了本身,共有5种同分异构体,故C正确;
D项、含有苯环和碳碳双键,都为平面形结构,处于同一平面,分子中含有-CH3,甲基为四面体结构,所以分子中所有原子不可能处于同一平面,故D错误。
【点睛】
本题考查有机物的结构与性质,侧重分析与应用能力的考查,把握有机物的结构、苯环与H 原子的判断为解答的关键。
11.C
【解析】
【分析】
A.盐酸为强酸,醋酸为弱酸,浓度相同时盐酸的pH较小;
B.浓度、体积相等时,醋酸与氢氧化钠反应生成醋酸钠溶液呈碱性,而盐酸与氢氧化钠反应生成氯化钠溶液呈中性;
C.V(NaOH)=10.00mL时,反应后为等物质的量浓度的醋酸和醋酸钠的混合液,醋酸的电离程度大于醋酸钠的水解程度,溶液呈酸性;
D.V(NaOH)=20.00mL时,反应后得到等物质的量浓度的醋酸钠、氯化钠溶液,醋酸根离子部分水解,则醋酸根离子浓度较小。
【详解】
A.根据图示可知,Ⅰ的起始pH较大,Ⅱ的起始pH较小,则Ⅰ表示的是醋酸,Ⅱ表示盐酸,选项A错误;
B.醋酸为弱酸,溶液体积相同时,醋酸和氯化氢的物质的量相等,醋酸与氢氧化钠反应生成醋酸钠,溶液呈碱性,而盐酸与氢氧化钠反应生成氯化钠溶液呈中性;若pH=7时,醋酸消耗的NaOH溶液体积应该稍小,选项B错误;
C.V(NaOH)=10.00mL时,反应后为等物质的量浓度的醋酸和醋酸钠的混合液,醋酸的电离程度大于醋酸钠的水解程度,溶液呈酸性,则c(H+)>c(OH-),反应后溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),选项C正确;
D.V(NaOH)=20.00mL时,两溶液都恰好反应得到等物质的量浓度的醋酸钠和NaCl溶液,由于醋酸根离子部分水解,则两溶液中c(CH3COO-)<c(Cl-),选项D错误;
答案选C。
【点睛】
本题考查了酸碱混合的定性判断,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力。12.A
【详解】
A 项、78gNa 2O 2固体物质的量为1mol ,1molNa 2O 2 固体中含离子总数为3N A ,故A 正确;
B 项、未说明溶液的体积,无法确定pH=1的醋酸溶液中H +的个数,故B 错误;
C 项、12C 和14C 组成的碳单质中两者的个数之比不明确,故碳单质的摩尔质量不能确定,则13g 碳的物质的量无法计算,其含有的质子数不一定是6N A 个,故C 错误;
D 项、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故转移电子的个数小于0.2N A 个,故D 错误。
故选A 。
【点睛】
本题考查了阿伏加德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键。 13.B
【解析】
【分析】
【详解】
根据装置图可知B 室中氧气参与反应,应为好氧菌,选项A 正确;方程式中电荷和氢原子不守恒,选项B 错误;MFC 电池中氢离子向得电子的正极移动,即向b 极移动,b 为正极,电流方向是由正极流向负极,即b→a ,选项C 正确;电池的总反应是醋酸根离子在酸性条件下被氧化成CO 2、H 2O ,即CH 3COO ?+2O 2+H +
2CO 2 +2H 2O ,选项D 正确。
14.C
【解析】
【详解】 点③处恰好中和,反应生成醋酸钠,原溶液中醋酸的浓度为:0.1000mol/L 0.02011L 0.02L
?=0.10055mol/L , A. 溶液中氢离子或氢氧根离子浓度越大,水的电离程度越小,在逐滴加入NaOH 溶液至恰好完全反应时,溶液中氢离子浓度减小,水的电离程度逐渐增大,A 项正确;
B. 点②处溶液的pH=7,此时c(Na +)=c(CH 3COO ?)=
0.1000mol/L 0.02L 0.02L+0.02L
? =0.05mol/L ,c(H +)=10?7mol/L ,此时溶液中醋酸的浓度为:0.100552/mol L ?0.05mol/L=0.000275mol/L ,