
第一章:打开原子世界的大门
从葡萄干面包模型到原子结构的行星模型
课前引导:1,人们对原子的认识经历了怎样一个过程
古典原子论:
战国惠施:物质是无限可分的。“一尺之棰,日取其半,万世不竭”
墨子:物质被分是有条件的。“非半弗,则不动,说在端……”
古希腊得莫利克特:物质是由极小的“原子”构成。原子不可再分割。
、
近代对原子的认识:
英国道尔顿:(1)化学元素均由不可再分的微粒构成,这种微粒称为原子;
(2)原子在一切化学变化中均保持其不可再分性;
(3)同一元素的原子在质量和性质上都相同,不同元素的原子在质量和性质上都
不相同;
(4)不同元素化合时,这些元素的原子按简单整数比结合成化合物。
从现代化学理论看(1)(3)(4)是不合理的。
汤姆孙:发现电子,提出葡萄干面包原子模型。原子中的正电荷均匀地分布在整个原子的球形体内,电子则均匀地分布在这些正电荷之间。
2,从X射线到元素放射性的发现的过程
!
X射线的发现--1895年伦琴
天然(铀)放射性的发现-- 1896年贝克勒尔
(暗示出原子也存在内部结构)
电子的发现--1897年汤姆逊
(明确地揭示了原子是可分割的)
αβγ粒子的发现--1905年卢瑟福
(进一步揭示了原子的内部结构)
电子的发现和元素放射性现象说明了什么
电子的发现和元素的放射性现象说明了原子不是不可再分的微粒,原子还可以再分,原子是有结构的。
3,原子结构的行星模型是如何建立的,它的内涵是什么
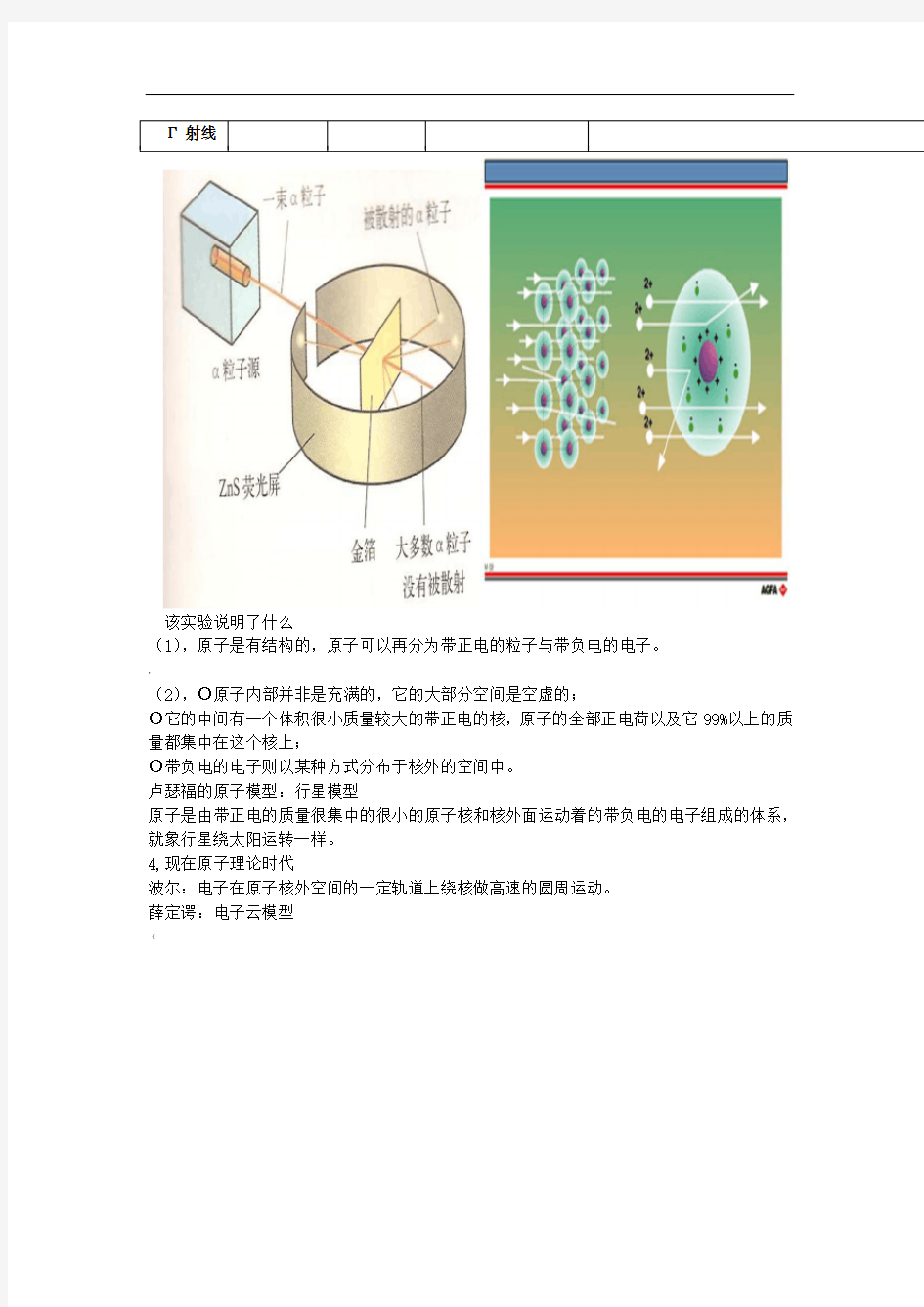
英国卢瑟福 1.射线(带正电)
粒子:氦原子失去电子后的正离子(He2+)
射线(带负电)电子流
2.做了著名的:粒子散射实验
|
3.提出“原子结构的行星模型”
该实验说明了什么
(1),原子是有结构的,原子可以再分为带正电的粒子与带负电的电子。
,
(2),○原子内部并非是充满的,它的大部分空间是空虚的;
○它的中间有一个体积很小质量较大的带正电的核,原子的全部正电荷以及它99%以上的质量都集中在这个核上;
○带负电的电子则以某种方式分布于核外的空间中。
卢瑟福的原子模型:行星模型
原子是由带正电的质量很集中的很小的原子核和核外面运动着的带负电的电子组成的体系,就象行星绕太阳运转一样。
4,现在原子理论时代
波尔:电子在原子核外空间的一定轨道上绕核做高速的圆周运动。
薛定谔:电子云模型
《
。
原子结构和相对原子质量
一、原子及其相关微粒
1、原子的构成带电情况质量相对质量整数值
| 原子核质子(+) +1 *10-27kg 1
原子中子(0) 0 *10-27kg 1
.
| 核外电子(-) -1 *10-31(kg) 1/1837 1/1837
原子核只占原子半径的几万分之一,但原子质量却绝大部分集中在原子核。
①质子数、核电荷数、核外电子数等关系
原子:核电荷数 = 核内质子数 = 核外电子数=原子序数。
离子:核电荷数核外电子数。电子数
阳离子:核电荷数 = 核内质子数 > 核外电子数 a X m+ a-m
阴离子:核电荷数 = 核内质子数 < 核外电子数 b Y n- b+n
思考:什么是核电荷数核电荷数为什么等于质子数
>
(质子所带的正电荷数叫核电荷数)
2、质量数(A)
——将原子核内所有的质子和中子相对质量取近似整数值,加起来所得的数值叫质量数。质量数用A表示。即:A=Z+ N
质量数质子数中子数
元素:具有相同核电荷数(即质子数)的同一类原子总称为元素。(质子数决定元素种类)例,1、已知A2-、B-、C+、D2+、E3+五种简单离子的核外电子数相等,与它们对应的原子的核电荷数由大到小的顺序是
2.现有b X n-和aY m+两种离子,它们的电子数相同,则 a 与下列式子有相等关系的是( B )(
A. a=b-m-n
B. a=b+m+n
C. a=b-m+n
D. a= b+m-n
二,同位素
1、定义
——具有相同质子数和不同中子数的同一种元素的原子互称为同位素。
(绝大多数元素存在同位素,只有少数元素无同位素,如:Al、F、P、Y)
)
注意:质子数和中子数决定原子的种类。
2、由同位素的不同原子可构成不同物质(其物性不同,化性相似。)
3、同位素与同素异形体的区别
同:都是由同种元素组成的。异:同位素是指质子数相同,中子数不同的原子。
同素异形体是指结构,形状不同的单质。
4,在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子个数百分比一般是不变的。
5、同位素的用途
(1)碳—14测定地质年代。(考古断代)
~
(2)研究化学反应机理。
(3)培育良种。
(4)保存食物。
(5)放射治疗。60Co 放射治疗癌症9038Cr 治疗皮肤癌
(6)探测金属器械的缺陷。
三、元素的相对原子量
整理:11H、21H、31H、质子数相同,电子数相等的原子。
CH4、NH3、H2O、HF、质子数 = 电子数 = 10的不同分子。
|
NH4+、 H3O+、 Na+、 Mg2+、 Al3+、电子数 = 10
OH-、 F- 、电子数 =10
四,辨析
1,元素与同位素
(1),元素是一个概念,不是微粒,只讲种类,不讲个数,而同位素是微粒(原子),既讲种类,又讲个数。
(2)元素的种类由质子数决定,原子的种类由质子数和中子数共同决定。
2,原子,元素的相对原子质量
(1),同位素原子的相对原子质量:以一个C-12原子质量的1/12作为标准,任何一个原子的真实质量跟一个C-12原子质量1/12的比值,称为该原子的相对原子质量。
;
即:原子的相对原子质量(Ar)= m(一个同位素原子的质量)
m(C-12的质量)*1/12
(2)元素的平均相对原子质量:元素所含各同位素相对原子质量与其丰度乘积的和。
即:元素平均相对原子质量=A1*a1%+A2*a2%+…+A n*a n% (A各同位素原子的相对原子质量,a%各同位素原子的丰度)。
同位素丰度:各种同位素原子所占的原子个数百分比。
如氯的稳定同位素中有3517Cl和3717Cl ,在自然界的丰度分别为%和%,元素表中所列的
氯的相对原子质量是两者按丰度计算的均值。
例:1. 下列各组为同位素的是()
A. T和D
B. 金刚石和石墨
C. H2O和D2O
D. H2和D2
\
2. 下列说法中不正确的是()
A.质子数相同的粒子一定属于同一种原子
B.同位素的化学性质几乎相同
C.质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
D.电子数相同的粒子不一定是同一种元素
3. 13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWüthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是() A.13C与15N有相同的中子数 B.13C与C60互为同素异形体
C.15N与14N互为同位素 D.15N的核外电子数与中子数相同
4.35Cl相对原子质量为,自然界中的含量(丰度)%,37Cl 相对原子质量为,自然界中的含量(丰度)%,求Cl元素的平均相对原子质量.
、
(3)元素的近似相对原子质量:元素所含各同位素的质量数与其丰度乘积的和。
求例四近似相对原子质量。()
(4)利用十字交叉法求元素的相对原子质量
1,如果是两种物质组成的混合系统,且有n1份(摩尔)组分与M1与n2份(摩尔)组分M2相混合(M1>M2),则必然存在下列关系式:
M1 M-M2 n1 M-M2
M =
M2 M1-M n2 M1-M
其中:1/n1+1/n2=1
<
例:1.氯元素的近似相对原子质量为,它的两种天然同位素35Cl和37Cl的原子个数比是( )
A. 2︰1
B. 1︰3
C. 3︰1
D. 1︰4
2.元素M有质量数为16和18的两种同位素,该元素的近似平均相对原子质量为,则其中18M 的质量分数是()
A 20%
B 22%
C 50%
D 78%
3.(提高题)某元素构成的双原子单质分子有3种,其相对分子质量分别为158、160、162。在天然单质中, 此三种单质的物质的量之比为1︰1︰1, 由此推断的以下结论中,正确的是( ) (多选)
A.此元素有三种同位素
B.其中质量数为79的同位素原子占原子总数的1/2
C.其中一种同位素的质量数为80
D.此元素的单质的平均分子量为160
(点播:只有三种组合)
2,M1 例如:氖的天然同位素有氖20和氖22两种,已知氖元素的相对原子质量为,则氖20和氖22的原子个数比= & 思考:原子质量和相对原子质量有何区别 揭开原子核外电子运动的面纱 一,核外电子的运动状态的描述 1、核外电子的特征——质量小,运动空间范围小,绕核作高速运动,无确定的运动轨道, 无法描述运动轨迹。 2、电子云 ——用小黑点的疏密来形象的表示由于电子在核外不同直径上出现概率的多少的一 种图象。 其意义是:①电子各自在其能量区域里做高速运动。 \ ②离核近的电子能量低,离核远的能量高。也即能量低的电子通常在离核近的区域运动,能量高的电子在离核远的区域运动。 3、核外电子的运动状态。 (1)电子是分层排布的——我们用电子层来表明离核远近区域的不同。 电子层为一二三四五六七 K L M N O P Q 电子能量由低到高、 电子离核由近到远 (2)原子核外电子的排布是有一定规律的。 [ 思考:① K、L、M、N电子层上最多是可容纳的电子数有多少个 ②原子的最外层电子数最多是几个 ③核外电子排布的规律是什么 ④元素的性质与最外层电子的数目的关系是什么 ①各电子层最多可容纳的电子数为2n2个(n表示电子层的层序数) K L M N 2 8 18 32 ②最外层电子数目不超过8个,K层只能是2个,次外层电子数目不超过 18个,倒数第三层数目不超过32个。 … 则当M层为最外层时,最多可容纳的电子数8个 当M层不是为最外层时,最多可容纳的电子数18个 ③核外电子总是尽先排布在能量最低的电子层里,然后由里及外,依次排 布在能量较高的电子层里。 ④最外层电子数为8(K层为2)的结构为稳定结构,∴稀有气体性质稳定, 不易与其它物质反应。 4、原子结构示意图与电子式 (1)原子结构示意图。 例,根据核外电子排布规律,判断下列原子结构示意图是否正确如果不正确,怎样改正 \ (2)电子式:用小黑点(或×)来表示元素原子的最外层上的电子的式子。 原子的电子式 :请写出C,H,O,Na ,Si ,Cl 的电子式 5、最外层电子数与元素性质的关系 电子能量越高,运动轨道离核越远,受到核的吸引力越小,电子也就越活泼,容易变化, 故元素的化学性质主要由最外层电子数决定。 , 二,离子 ——原子或原子团得失电子后形成的带电微粒称为离子。 % 离子也是构成物质的一种微粒。 离子结构示意图: Mg 2+, Na+ ,S 2-, Ca 2+, O 2-,H +,Si 4+ 离子的电子式:阳离子:H +,Ca 2+,Al 3+,简单阳离子的电子式为离子符号本身 阴离子: 注意:一带[ ];二带负电荷 离子团: 离子化合物 共价化合物 练习:请写出下列微粒的电子式: | 氟离子;氖原子;镁离子;硫离子;氧离子,铵根,水分子,氨气分子,氢氟酸,甲烷,氢氧根,硫化氢,氢氧化钙,氢氧化钠 电子层结构相同的粒子::H-, He, Li+, Be2+,H2 :Ne, CH4, NH3, H20, HF, N3-, O2-, F-,OH-, NH2-, Na+,Mg2+,Al3+,, NH4+, H3O+, :Ar,, HCl, H2O2, SiH4, PH3, F2,CH3OH,N2H4 K+,Ca2+, ~ P3-,S2-,Cl-,, HS- 例: 1.试写出质子为9,电子数都为10的两种阴离子的符号: 2.试写出质子为11,电子数都为10的两种阴离子的符号: 两类等式:简单阳离子:电子数=质子数-离子电荷数 电子层数=原子电子层数-1 简单阴离子:电子数=质子数+离子电荷数 电子层数=原子电子层数 元素的推断: (1)原子中无中子的原子:H (2)最外层电子数与K层电子数相同的是:Be、Mg、Ca (3)最外层电子数=次外层电子数的元素:Be、Ar (4)最外层电子数是次外层电子数2倍的元素是:C (5)最外层电子数是次外层电子数3倍的元素是:O (6)最外层电子数是次外层电子数4倍的元素是:Ne (7)最外层电子数与电子层数相等的元素是:H、Be、Al (8)最外层电子数是电子层数2倍的元素是:He、C、S (9)最外层电子数是电子层数3倍的元素是:O (10)最外层电子数是电子层数4倍的元素是:Ne (11)次外层电子数是最外层电子数2倍的元素是:Si (12)核电荷数是电子层数的5倍,是最外层电子数的3倍的元素是:P (13) K层与L层电子数之和等于L层与M层电子数之和的是:Mg (14)电子总数是电子层数3倍:C,P (15)最外层电子数是次外层的1/2:Li,Si 例:1,写出核电荷数小于20,符合下列情况的元素符号 (1)次外层电子数是最外层电子数2倍的原子 (2)最外层电子数和次外层电子数相等的原子 (3)最外层电子数是次外层电子数3倍的原子 2,已知A、B两元素的原子都有三层电子层,A元素的M层电子数=K层电子数,B元素的M层电子比A的M层电子多5个,推断A、B各是什么元素 第一节原子结构 教学目标: 知识目标: 1.复习原子构成的初步知识,使学生懂得质量数和A Z X的含义,掌握构成原子的粒子间的关系。 2.了解关于原子核外电子运动特征和常识。 3.理解电子云的描述和本质。 4.了解核外电子排布的初步知识,能画出1~号元素的原子结构示意图。 能力目标: 培养自学能力、归纳总结能力、类比推理能力。 教学重点:原子核外电子的排布规律。 教学难点:原子核外电子运动的特征,原子核外电子的排布规律。 (第一课时) 教学过程: [复习]原子的概念,原子的构成,原子为什么显电中性? [板书]一、原子核 1。原子结构 质子: 1.6726×10-27kg 原子核 原子中子: 1.6748×10-27kg 电子: 1.6726×10-27kg/1836 注意:核电荷数=质子数=电子数近似原子量=质子数+中子数原子的粒子间的关系: 决定元素种类的是:,决定原子质量的 是: 决定元素化学性质的主要是:,决定原子种类的是: 1.6726×10-27kg 1.66×10-27kg 2.质量数 质子的相对质量= =1.007≈1 1.6748×10-27kg 1.66×10-27kg 中子的相对质量= =1.008≈1 将原子核内所有的质子和中子的相对质量取近似值整数加起来,所得的数值叫质量数(A) 质量数(A)=质子数(Z)+中子数(N) N = A – Z 练习:用A Z X表示原子: (1)求中性原子的中子数:N= (2)求阳离子的中子数,A X n+共有x个电子,则N= (3)求阴离子的中子数,A X n-共有x个电子,则N= (4)求中性分子或原子团的中子数,12C16O2分子中, N= (5) A2-原子核内有x个中子,其质量数为m,则n g A2-离子所含电子的物质的量为 : . 二、核外电子运动的特征 请一位同学讲述宏观物体的运动的特征。 比较电子的运动和宏观物体的运动。 1.核外电子运动的特征: (1)带负电荷,质量很小。 (2)运动的空间范围小。 (3)高速运动。 学生阅读课本P91,播放电子云形成的动画。 2.电子云 电子在原子核外空间一定范围内出现,可以想象为一团带负电荷的云雾笼罩在原子核的周围,所以人们形象地把它叫做“电子云”。 注意:(1)图中的每个小黑点并不代表一个电子,小黑点的疏密表示电子在核外单位体积内出现机会的多少。 (2)“电子云”是核外电子运动的一种形象化表示。 1.已知一种碳原子(质子数、中子数均为6)的一个原子的质量为m kg,若一个铁原子的质量为n kg ,则铁的原子量是 2.以下有关电子云的描述,正确的是() A 电子云示意图的小黑点疏密表示电子在核外空间出现机会的多少 B 电子云示意图中的每一个小黑点表示一个电子 C 小黑点表示电子,黑点愈多核附近的电子就愈多 D 小黑点表示电子绕核作圆周运动的轨道 第二课时 [复习]1。原子的结构。 2.电子云的概念及核外电子运动的特征。 对于多电子的原子,核外电子的运动要复杂一些,通常,能量低的在离核较近的区域运动,能量高的在离核较远的区域运动。 三、原子核外电子的排布 1.电子层 层序数 1 2 3 4 第一章打开原子世界的大门 道尔顿——提出近代原子论和实心球模型,都是错误的 汤姆孙:葡萄干面包原子模型;卢瑟福:原子结构行星模型 质子决定元素种类;质子和中子决定原子种类;最外层电子数决定化学性质同位素:具有相同质子数和不同中子数的同一种元素的原子 掌握原子结构示意图和电子式的书写 熟练背出1-18号元素 第二章开发海水中的卤素资源 过滤的操作(p24页的思考题) Ca2+、Mg2+、SO 42-离子除杂顺序:Na 2 CO 3 在BaCl 2 之后 电解饱和食盐水:2NaCl+2H 2O→(通电)2NaOH+H 2 ↑+Cl 2 ↑ 阴极:H 2和NaOH(酚酞变红) 阳极:Cl 2 (检验:湿润的淀粉碘化钾试纸变蓝) Cl-的检验:加AgNO 3,产生不溶于稀HNO 3 的白色沉淀Ag++Cl-→AgCl↓ 氯化氢不使干燥蓝色石蕊试纸变红,盐酸使干燥蓝色石蕊试纸变红(前者无H+) 制HCl和Cl 2 方程式及实验装置系列(注意:1微热方程式2除杂3尾气吸收)氯气的物理性质:黄绿色,与水不能喷泉,HCl可以(1:500) 氯气与铁反应方程式现象,条件;注意与Fe与HCl反应产物区别 氯气与钠,铜,氢气反应方程式,现象,条件 氯气与水反应方程式(注意可逆符号) 新制氯水成份:三分子四离子;久置氯水成份。 HClO a.强氧化性(氯水滴在紫色石蕊试纸的现象) b.不稳定性(HClO见光分解方程式) c.弱酸性Ca(ClO) 2+2CO 2 +2H 2 O→Ca(HCO 3 ) 2 +2HClO 氯气与NaOH,漂粉精(制法,使用,失效)方程式;漂粉精主要成份,有效成份 溴和碘的提取:2I-+Cl 2→I 2 +Cl-。 Br 2 深红棕色液体,密度>水,易挥发,有毒,水封。 I 2紫黑色固体,蒸气呈紫红色,易升华用于分离碘,I 2 的检验:淀粉。 能使淀粉碘化钾试纸变蓝:氯水,溴水,碘水。 Br 2和I 2 在有机溶剂中的溶解度大,用于萃取,仪器:分液漏斗 高三化学第一章打开原子世界的大门知识点 原子是目前被用来表示化学物质的最小单位,以下是第一章打开原子世界的大门知识点,请大家认真阅读。 1.1从葡萄干面包模型到原子结构的行星模型 1.2原子结构和相对原子质量 1.3揭开原子核外电子运动的面纱 1.对原子结构认识的历程: 古典原子论:惠施、墨子、德谟克利特; 近代原子论:道尔顿; 葡萄干面包模型:汤姆孙; 原子结构行星模型:卢瑟福; 电子云模型:波尔。了解 2.重要人物及成就: 道尔顿(原子论)、汤姆孙(发现电子及葡萄干面包模型)、伦琴(X射线)、贝克勒尔(元素的放射放射性现象)、卢瑟福(粒子的散射实验及原子结构行星模型)。 3.原子的构成;(看第一章例题) 原子核的组成:质子数、中子数、质量数三者关系;原子、离子中质子数和电子数的关系; ①原子原子核质子(每个质子带一个单位正电荷)质子数决定元数种类 AZ X (+) 中子(不带电) 质子与中子数共同决定原子种类核外电子(-)(带一个单位负电荷) 对中性原子:顾电荷数 = 质子数 = 核外电子数 = 原子垿数对阳离子:核电荷数 = 质子数核外电子数,电子数= 质子数-阳离子所带电荷数如:ZAn+ e=Z-n, Z=e+n 对阴离子:核电荷数 = 质子数核外电子数,电子数=质子数+阴离子所带电荷数 如:ZBm+ e=Z+m, Z=e-m ②质量数(A)= 质子数(Z)+ 中子数(N)。即 A = Z + N 质量数(A) (原子核的相对质量取整数值被称为质量数)。 将原子核内所有的质子和中子相对质量取近似整数值,加起来所得的数值叫质量数。 4.知道同位素的概念和判断;同素异形体;(看第一章例题) 同位素质子数相同而中子数不同 的同一元素的不同原子互称为同位素。①同位素讨论对象是原子。②同位素原子的化学性质几乎完全相同。 ③在天然存在的某种元素里,不论是游离态还是化合态,也不论其来源如何不同,各种同位素所占的原子个数百分比保持不变。(即丰度不变) (见1.2提纲) 5.相对原子质量:原子的相对原子质量、元素的相对原子质量(简单计算); a (设某原子质量为a g) ①同位素原子的相对原子质量 m12c1/2 此相对质量不能代替元素的相对质量。②元素的相对原子质量 (即元素的平均相对原子质量) 是某元素各种天然同位素的相对原子质量与该同位素原子 所占的原子个数百分比(丰度)的乘积之和。即:M = Maa% + 教案 课题:第一节原子结构(2)授课班级 课时第二课时 教学目的 知识 与 技能 1、了解原子结构的构造原理,能用构造原理认识原子的核外电子排布 2、能用电子排布式表示常见元素(1~36号)原子核外电子的排布 3、知道原子核外电子的排布遵循能量最低原理 4、知道原子的基态和激发态的涵义 5、初步知道原子核外电子的跃迁及吸收或发射光谱,了解其简单应用 过程 与 方法 复习和沿伸、动画构造原理认识核外电子排布,亲自动手书写,体会原理情感 态度 价值观 充分认识原子构造原理,培养学生的科学素养,有利于增强学生学习化学 的兴趣。 重点电子排布式、能量最低原理、基态、激发态、光谱难点电子排布式 知识结构与板书设计三、构造原理 1.构造原理:绝大多数基态原子核外电子的排布的能级顺序都遵循下列顺序:1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s…… 2、能级交错现象(从第3电子层开始):是指电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。 电子先填最外层的ns,后填次外层的(n-1)d,甚至填入倒数第三层的(n-2)f的规律叫做“能级交错” 3.能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。即在基态原子里,电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。 4、对于同一电子亚层(能级)(等价轨道),当电子排布为全充满、半充满或全空时,原子是比较稳定的。 5、基态原子核外电子排布可简化为:[稀有气体元素符号]+外围电子(价电子、最外层电子) 四、基态与激发态、光谱 1、基态—处于最低能量的原子。 最新整理高一化学教案原子结构教案知识目标: 1、认识原子核的结构 2、理解质量数和AZX的含义, 3、掌握质量数、质子数、中子数、电子数间的关系。能进行质量数、质子数、中子数、电子数间的简单计算 4、理解元素、核素、同位素的含义,会判断同位素 能力情感目标: 1、培养学生对数据的分析处理、概括总结能力 2、尝试运用比较、归纳等方法对信息进行加工 3、通过假说、模型等科学研究方法培养学生科学的学习方法和科学的学习态度 4、通过放射性同位素作用的自学和查阅,激发学生学习的热情 学习重点: 原子核的结构,构成原子的各微粒间的关系及同位素的判断 难点:原子核的结构及构成原子的各微粒间的关系 教法:模型展示、多媒体动画模拟、问题推进、对比归纳 学法:交流研讨、比较归纳、练习巩固 [引入]初中我们学习了原子结构的初步知识,原子由原子核和核外电子构成。那么原子核和核外电子在原子中的相对关系是怎样的呢?下面我们重温一下著名的卢瑟福实验。 [多媒体动画演示1]卢瑟福的α粒子散射实验及实验现象2· [学生活动]学生观看实验,总结现象,分析现象并思考问题: 1、大部分粒子穿过金箔不偏转,说明了什么? 2、少数粒子被偏转,个别粒子被反射分别说明了什么? 3、试想象推测原子的结构模型 [多媒体演示2]展示卢瑟福的解释:原子:原子核(带正电);核外电子(带负电)在此实验的基础上,卢瑟福提出了“核式原子模型”,较好的解释了原子核与核外电子的关系,那么,原子核内部的结构又是怎样的? 多媒体演示3学习目标1· 一、原子核核素 1、原子核的构成 [交流研讨]9·阅读P3表格,分析电子、质子、中子的基本数据表,思考讨论以下问题 微粒 电子 质子 中子 质量(Kg) 9.109×10-31 1.673×10-27 1.675×10-27 相对质量 0.000548 1.007 1.008 1.2.1 原子结构与元素的性质(第2课时) 知识与技能: 1、掌握原子半径的变化规律 2、能说出元素电离能的涵义,能应用元素的电离能说明元素的某些性质 3、进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系 4、认识主族元素电离能的变化与核外电子排布的关系 5、认识原子结构与元素周期系的关系,了解元素周期系的应用价值 教学过程: 【复习】元素周期表结构,核外电子排布式书写。 【板书】二、元素周期律 【提问】思考回答元素周期表中,同周期的主族元素从左到右,最高化合价和最低化合价、金属性和非金属性的变化有什么规律? 【回答】同周期的主族元素从左到右,最高化合价从+1~+7,最低化合价从-4~-1价,金属性逐渐减弱,非金属性逐渐增强。 【讲解】元素的性质随核电荷数递增发生周期性的递变,称为元素周期律。元素周期律的内涵丰富多样,下面,我们来讨论原子半径、电离能和电负性的周期性变化。 【板书】元素周期律:元素的性质随核电荷数递增发生周期性的递变。 1、原子半径 【讨论】原子半径的大小取决于两个相反的因素:一是电子的能层数,另一个因素是核电荷数。这两个因素怎样影响原子半径? 【总结】电子的能层越多,电子之间的负电排斥将使原子的半径增大;而核电荷数越大,核对电子的引力也就越大,将使原子的半径缩小。这两个因素综合的结果使各种原子的半径发生周期性的递变。 【板书】影响因素:能层数、核电荷数。 【投影】主族元素的原子半径如图l—20所示。 【学与问】元素周期表中的同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?周期表中的同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势? 【回答】原子半径的大小取决于两个相反的因素:一是电子的能层数,另一个是核电荷数。显然电子的能层数越大,电子间的负电排斥将使原子半径增大,所以同主族元素随着原子序数的增加,电子层数逐渐增多,原子半径逐渐增大。而当电子能层相同时,核电荷数越大,核对电子的吸引力也越大,将使原子半径缩小,所以同周期元素,从左往右,原子半径逐渐减小。 【板书】2、电离能 【讲解】气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。上述表述中的“气态”“基态”“电中性”“失去一个电子”等都是保证“最低能量”的条件。 【板书】(1)电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。 沪科版高一上册化学期末复习知识点总结提纲第一章:打开原子世界的大门 一、原子结构发现史 古希腊哲学家德谟克利特提出古典原子论-------道尔顿原子理论------约瑟夫·约翰·汤姆生葡萄干面包模型------卢瑟福提出原子结构的行星模型 二、元素、核素、同位素、同素异形体 元素的新概念:具有相同核电荷数(即质子数)的同一类原子。所以氕、氘、氚都是同一种元素——氢元素。 核素:具有一定数目质子和一定数目中子的一种原子。 同位素的定义:具有相同质子数和不同中子数的同一种元素的原子(核素)互称为同位素。氕、氘、氚互称同位素。 同位素性质性质:(1)同位素的不同原子的化学性质几乎完全相同 (2)在天然存在的某周元素里,不论是游离态还是化合态,各种同位素所占的原子个数百分比一般是不变的 同素异形体:同一种元素形成的不同单质之间互为同素异形体 【归纳】: 质子数决定元素的种类; 质子数和中子数决定原子的种类; 同一元素的不同核素之间互称为同位素; 同种元素可以有多种核素(同位素),所以元素的种数远少于原子的种数。 三、原子的组成和三种微粒间的关系 A X的含义:代表一个质量数为A、质子数为Z的原子。 Z 质子带正电荷,电子带负电荷,中子不显电性。 质量数(A)=质子数(Z)+中子数(N)。 核电荷数=元素的原子序数=质子数=原子的核外电子数。 四、离子 定义:原子或原子团得失电子后形成的带电微粒称为离子。 注意:离子也是构成物质的一种 。 分类:阳离子—— 的离子;质子数=原子的核外电子数+电荷数 阴离子—— 的离子;质子数=原子的核外电子数-电荷数 例1. 假设的相对原子质量为24,则下列推断不正确的是 A .标准状况时11.2 LO 2的质量为32g B .16O 的相对原子质量为32 C .44gCO 2和28gCO 含有相同的分子数 D .标准状况时44gCO 2的体积是22.4L 【答案】D 例2.Se 是人体必需的微量元素。下列关于和的说法,正确的是 A .二者互为同素异形体 B .二者属于同一种元素 C .和的性质相同 D .和分别含有44和46个质子 【答案】B 例3. 下列说法中不正确的是 A .质子数相同的粒子不一定属于同种元素 B .电子数相同的粒子不一定属于同种元索 C .质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子 D .同位素的性质几乎完全相同 【答案】D 例4. 伊朗核问题已引起国际社会的普遍关注,所谓浓缩铀就是提取一定浓度的.下列有关的说 法中,正确的是 A .不具有放射性 B .铀元素的相对原子质量为235 C .与互为同素异形体 D .原子核内中子数为143,核外电子数为92 【答案】D 例5. 金属钛代替钢铁广泛应用于宇宙火箭和导弹中,有“宇宙金属”之称。下列有关的说法中正确的是 A .原子中均含22个中子 B .在周期表中位置相同,都在第4纵行 C 12Se 7834Se 8034Se 7834Se 8034Se 7834Se 80 34U 23592U 23592U 23592U 23592U 23892U 235 92Ti Ti 502248 22和Ti Ti 50 224822和Ti Ti 502248 22和 高一化学_第一章_打开原子世界的大门 【知识梳理】 一、原子结构学说的发展历程及原子结构模型的演变 1、古代朴素的原子观:我国战国时期的惠施认为物质是无限可分的;我国战国时期的墨翟认为物质被分割是有条件的;古希腊哲学家德谟克利特提出古典原子论(原子是构成物质的微粒,万物是由间断的、不可分割的微粒即原子构成的,原子的结合和分割是万物变化的根本原因)。 2、英国科学家道尔顿提出近代原子学说——实心球模型:①物质由原子组成;②原子不能创造,也不能被毁灭;③原子在化学变化中不可再分割,它们在化学变化中保持本性不变。 3、汤姆生的“葡萄干面包式”原子结构模型:①原子中存在电子,电子的质量为氢原子质量的1/1836;②原子中平均分布着带正电荷的粒子,这些粒子之间镶嵌着许多电子。 4、英国物理学家卢瑟福的“行星式”原子结构模型(核式原子结构模型): ①原子由原子核和核外电子组成,原子核带正电荷,位于原子的中心,电子带负电荷,在原子核周围作高速运动;②电子的运动形态就像行星绕太阳运转一样。 5、丹麦物理学家玻尔的轨道原子结构模型:他引入量子论观点,提出原子核外,电子不是随意占据在原子核的周围,而是在固定的层面上运动,当电子从一个层面跃迁到另一个层面时,原子便吸收或释放能量。 6、现代原子结构学说——电子云模型:用电子在给定时间内在空间的几率分布的图像来描述电子的运动,这些图像就是电子云。电子出现几率密度大的地方,电子云“浓密”一些;几率密度小的地方,电子云“稀薄”一些。但电子云的正确意义并不是说电子真的像云那样分散,电子云只是一种几率云。 二、原子结构和相对原子质量 1、元素:具有相同核电荷数(即质子数)的同一类原子叫做元素。 2、原子的构成: 3、质量数:忽略电子的质量,将原子核内所有的质子和中子相对质量取近似整数值,加起来所得的数值,叫做质量数,用符号A表示。( X) 注: 4、构成原子或离子粒子间的数量关系 质量数(A)=质子数(Z)+中子数(N) 原子中:核电荷数(Z)=质子数=原子序数=核外电子数 阳离子中:核电荷数(Z)=质子数=原子序数=核外电子数+离子电荷数 第一章第一节原子结构(第二课时) 教学目标: 1、知道原子核外电子的排布遵循能量最低原理 2、知道原子的基态和激发态的涵义 3、初步知道原子核外电子的跃迁及吸收或发射光谱,了解其简单应用 重点难点:能量最低原理、基态、激发态、光谱 教学过程: 〖引入〗在日常生活中,我们看到许多可见光如灯光、霓虹灯光、激光、焰火与原子结构有什么关系呢? 创设问题情景:利用录像播放或计算机演示日常生活中的一些光现象,如霓虹灯光、激光、节日燃放的五彩缤纷的焰火等。 提出问题:这些光现象是怎样产生的? 问题探究:指导学生阅读教科书,引导学生从原子中电子能量变化的角度去认识光产生的原因。 问题解决:联系原子的电子排布所遵循的构造原理,理解原子基态、激发态与电子跃迁等概念,并利用这些概念解释光谱产生的原因。 应用反馈:举例说明光谱分析的应用,如科学家们通过太阳光谱的分析发现了稀有气体氦,化学研究中利用光谱分析检测一些物质的存在与含量,还可以让学生在课后查阅光谱分析方法及应用的有关资料以扩展他们的知识面。 〖总结〗 原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。 处于最低能量的原子叫做基态原子。 当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。光(辐射)是电子释放能量的重要形式之一。 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。许多元素是通过原子光谱发现的。在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。 〖阅读分析〗分析教材p8发射光谱图和吸收光谱图,认识两种光谱的特点。 阅读p8科学史话,认识光谱的发展。 〖课堂练习〗 1、同一原子的基态和激发态相比较() A、基态时的能量比激发态时高 B、基态时比较稳定 C、基态时的能量比激发态时低 D、激发态时比较稳定 2、生活中的下列现象与原子核外电子发生跃迁有关的是() A、钢铁长期使用后生锈 B、节日里燃放的焰火 C、金属导线可以导电 D、卫生丸久置后消失 3、比较多电子原子中电子能量大小的依据是() A.元素原子的核电荷数 B.原子核外电子的多少 C.电子离原子核的远近 D.原子核外电子的大小 4、当氢原子中的电子从2p能级,向其他低能量能级跃迁时 ( ) A. 产生的光谱为吸收光谱 B. 产生的光谱为发射光谱 C. 产生的光谱线的条数可能是2 条 D. 电子的势能将升高. 电子云原子轨道泡利原理洪特规则 【教学目标】 了解电子云、原子轨道、泡利原理、洪特规则 【重点难点】 电子云、原子轨道、泡利原理、洪特规则 【教学过程】 一、引言: 01.20世纪初,丹麦科学家玻尔把原子类比为太阳系,提出了原子的行星模型,认为核外电子像行星绕着太阳运行那样绕着原子核运动,玻尔还因此于1916年获得诺贝尔物理奖,然而在后来的十年里,玻尔的行星模型却被彻底否定了,你知道为什么吗? 02.那是因为电子是一种质量极小的微观粒子,电子在核外的运动速度又接近光速,因此电子的运动和光一样,具有波粒二相性。此时,不可能像描述宏观物体那样,确定一定状态的核外电子在某个时刻处于原子核外空间何处。而只能用统计的方法,确定它在原子中某一区域内出现的概率。 03.就以最简单的原子氢原子为例,这种概率统计的结果如何?有 何规律? 二、指导阅读: 01.假想给电子拍照,然后把照片叠加在一起得到电子云图像(右图)。 02.把电子出现的概率约为90%的空间圈出来,即为电子云轮廓图,该 轮廓图即为原子轨道。 03.s能级的原子轨道和p能级的原子轨道图分别如下,由此可见:s电子的原子轨道都是球形的,p电子的原子轨道是纺锤形的,每个p能级的3个原子轨道相互垂直。 三、基态原子电子排布图: 01.描述核外电子的运动状态,你已经了解了哪几个方面? 02.写出原子序数为3-10的电子排布式,到此,你能解释下列电子排布图吗? 03.阅读:泡利原理、洪特规则、电子自旋。 四、小结: 01.描述电子运动状态应从哪几方面着手? 02.构造原理解决了哪些方面的问题?其余问题靠什么解决的? 03.可见,学习原子结构的方法如何? 五、课后作业: 01.图1和图2分别表示1s电子的概率分布和原子轨道。下列说 法正确的是() A.图1中的每个小黑点表示1个电子 B.图2表示1s电子只能在球体内出现 C.图2表明1s轨道呈圆形,有无数对称轴 D.图1中的小黑点表示某一时刻,电子在核外所处的位置 02.各能级最多容纳的电子数是该能级原子轨道数的二倍,其理论依据是()A.构造原理B.泡利原理 C.洪特规则 D.能量最低原理 03.电子排布在同一能级时,总是()A.优先单独占据不同轨道,且自旋方向相同 B.优先单独占据不同轨道,且自旋方向相反 C.自由配对,优先占据同一轨道,且自旋方向相同 D.自由配对,优先占据同一轨道,且自旋方向相反 04.基态原子的4s能级中只有1个电子的元素共有()A.1种 B.2种C.3种 D.8种 05.下图中,能正确表示基态硅原子的是() A B C D 《打开原子世界的大门》复习 1.本单元知识体系的框架的构建 2.原子质量的五种表示方法 ①原子的质量:例如,1个12C原子的质量是1.993×10-23 g ②质量数:针对某种原子而言,质量数(A)=质子数(Z)+中子数(N) ③同位素的相对原子质量:该同位素原子的质量(m)与12C原子的1/12的比值 ④元素的相对原子质量:将各同位素原子的相对原子质量,按其丰度计算的平均值 ⑤元素的近似相对原子质量:用同位素原子的质量数代替同位素的相对原子质量,按其丰度计算的平均值 例题:下表是元素周期表中核电荷数为3~10的元素的某种性质的一组数据(所列数据的单位是相同的)。除带“……”的四种元素外,其余元素都给出了该种元素性质的全部数据。 研究这些数据: (1)每组数据可能是该元素的_________。 (A)原子得到电子所放出的能量 (B)原子形成不同分子时的半径大小 (C)原子逐个失去电子所吸收的能量 (2)分析各元素原子的第一个数据,随原子的质子数递增:①总体变化的趋势是____(填“增大”或“减小”);②与前后元素相比,由于该元素的数值增大得较多而有反常的元素是________、________。 (3)根据以上规律,推测镁与铝的第一个数据的大小:Mg________Al。 (4)同一种元素的一组数据是约以倍比关系增大,可能的原因是_________。 (A)失去部分电子后,成为带正电荷的离子,再失去电子就难 (B)失去部分电子后,微粒半径减小,再失去电子就难 (C)得到部分电子后,成为带负电荷的离子,再得到电子就难 (5)每种元素的一组数据中个别地方增大的比例特大,形成突跃,请找出这些数据出现的规律,你认为氧元素出现该情况的数据应该是8个数据中的第_____个。 (6)上述规律可以证明原子结构中的核外电子是_________。 (A)分层排布的(B)按原子半径递增排布的(C)能量不同的 上海市2019年高一上学期化学期中考试试卷(I)卷 姓名:________ 班级:________ 成绩:________ 一、单选题 (共20题;共40分) 1. (2分) (2018高二上·牡丹江月考) 某学生的实验报告中,描述合理的是() A . 用10mL量筒量取7.13mL稀盐酸 B . 用托盘天平称量25.20g NaCl C . 用25mL碱式滴定管量取出15.00mLKMnO4溶液 D . 用25mL碱式滴定管做酸碱中和滴定实验时,共用去某浓度的碱溶液21.70mL 2. (2分) (2018高一上·九江期中) 下面关于电解质的叙述中正确的是() A . 电解质在水中一定能导电 B . 纯水的导电性很差,所以水不是电解质 C . 化合物电离时,生成的阳离子是氢离子的是酸 D . 电解质、非电解质都指化合物而言,单质不属于此范畴 3. (2分) (2018高二下·武冈模拟) 用红色激光照射下列物质,能观察到丁达尔效应的是() A . 乙醇溶液 B . 牛奶 C . 硫酸铜溶液 D . 蔗糖溶液 4. (2分) (2018高一上·杭州期中) 中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是() A . CCl4是一种化合物 B . 金刚石属于金属单质 C . 制造过程中元素种类没有改变 D . 这个反应是置换反应 5. (2分) (2017高一上·台州期中) 将一小块钠投入下列溶液时,既能产生气体又会出现白色沉淀的是() A . 稀H2SO4 B . 氢氧化钠饱和溶液 C . 硫酸铜溶液 D . 氯化铁溶液 6. (2分) (2020高二上·扬州会考) 氨水是生产热固性酚醛树脂的催化剂。其中的NH3·H2O属于() A . 酸 B . 碱 C . 盐 D . 混合物 7. (2分) (2016高一上·株洲期中) 下列反应中必须加入还原剂才能进行的是() A . Cl2→Cl﹣ B . Zn→Zn2+ C . H2→H2O D . CuO→CuCl2 8. (2分) (2016高一上·清流期中) 下列化学反应基本类型中一定有发生电子转移的是() A . 化合反应 B . 分解反应 C . 复分解反应 D . 置换反应 【W】化学真正成为一门科学是从什么时候开始的呢? (是从道尔顿提出近代原子学说,阿佛加德罗提出分子概念,形成了原子-分子论以 后。) 【A】我们现在都知道原子中有原子核和电子组成,但20世纪初,人们连原子都看不见,怎么会知道原子中有一个比原子还小得多的核呢?又如何知道原子核的性质的 呢? 一、从古典原子论到葡萄干面包原子模型 【W】对物质的构成,早在古代就有不少的观点,谈谈看书后感想 在科学发展的今天,看他们的观点当然有很不完善的地方,甚至是错误的。但在科 学十分落后的当时,他们能提出这样的观点,实在是一件了不起的事情,体现了先 辈们敏锐的洞察力和丰富的想象力。是值得我们后人学习的。 【W】最早提出原子论的是古希腊哲学家德模克利特,他认为物质是由许多微粒组成的,这些微粒叫原子,意思是不可分割。但为什么最终古代原子学说无法确立,其原因是 什么呢?(任何科学结论确立必须由实验来验证,古代的原子学说只是凭想像并无 实验根据。这是一个原因,另一个原因是当时人们崇尚上帝,并不相信科学。) 【W】化学开始成为一门科学,是道尔顿提出了近代的原子学说请凭借你现有的知识对道尔顿的原子学说来作一个评价。 【A】道尔顿的原子学说曾经起了很大的作用,但我们现在知道原子并不是实心、不能再分的小球,而在当时人们认识到这一点是因为1897年英国科学汤姆生从阴极射线的 研究中发现了电子,从此,人们认识到原子不是组成物质的最小微粒,原子也有一 定的结构。怎么会从电子想到原子是有结构的呢? (物质在通常情况下显电中性,而物质中既然存在带负电的电子,那么一定还存在 带正电荷的部分。对原子来说,它所带的正电荷的电量必然与其电子的负电荷的电 量相等。) 【W】那么原子的结构到底是怎样的呢?如果你处在当时情况,你会怎样想象原子的结构呢? 【A】为了研究原子的内部结构,1903年汤姆生提出了一种葡萄干面包原子模型。他认为整个原子就好象是一个均匀分布的正电荷的球,而电子则均匀地分布在这些正电荷之 间。就好象葡萄干面包一样。 虽然汤姆生的原子模型与我们现在知道的大不相同,但毕竟它指出了原子是有结构 的,使人们对原子结构认识又进了一步。 人类对原子结构的探索有重要突破,是从发现天然放射现象开始的。 二、从X射线到元素放射性的发现 第一章 原子结构与元素周期律 第一节 原子结构 一.教材分析 (一) 知识脉络 通过初中的化学学习,同学们已经知道原子是由原子核和核外电子构成的。本节教材,就是要在已有经验的基础上继续深入地探讨原子核的结构以及核外电子的排布的规律,并利用原子结构的知识解释某些元素的部分性质,使学生初步了解原子的最外层电子排布与元素的性质(得失电子能力、化合价等)的关系。同时,通过原子结构知识的学习,为后阶段学习元素周期律、元素周期表和分子结构打下基础。 (二)知识框架 (三)新教材的主要特点: 新教材(必修)与旧教材相比,删掉了描述核外电子运动特征的电子云;降低了核外电子排布规律的要求;增加了原子结构示意图,元素的部分化学性质与原子的最外层电子排布的关系;调整了核素、同位素在教材中出现的位置。使得它更符合知识的逻辑关系,符合学生认识规律。同时,新教材更注重了让学生参与学习,提高了学生学习的主动性,更注重了学生能力的培养。 二.教学目标 (一) 知识与技能目标 1.引导学生认识原子核的结构,懂得质量数和 A Z X 的含义,掌握构成原子的微粒间的关系;知道元素、核素、同位素的涵义;掌握核电荷数、质子数、中子数、质量数之间的相互关系。 2.引导学生了解原子核外电子的排布规律,使他们能画出1~18号元素的原子结构示意图;了解原子的最外层电子排布与元素的原子得、失电子能力和化合价的关系。 (二)过程与方法目标 通过对构成原子的微粒间的关系和氢元素核素等问题的探讨,培养学生分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。 (三)情感态度与价值观目标 1.通过构成物质的基本微粒的质量、电性的认识,了解微观世界的物质性,从而进一步认识物质世界的微观本质;通过原子中存在电性不同的两种微粒的关系,认识原子是矛盾的对立统一体。 2.通过人类探索原子结构的历史的介绍,使学生了解假说、模型等科学研究方法和科学研究的历程,培养他们的科学态度和科学精神,体验科学研究的艰辛与喜悦。 3.通过“化学与技术----放射性同位素与医疗”,引导学生关注化学知识在提高人类生活质量中所起的作用。 4.通过“未来的能源----核聚变能”,引导他们关注与化学有关的热点问题,形成可持续发展的思想。 三.教学重点、难点 (一)知识上重点、难点:构成原子的微粒间的关系和核外电子排布规律。 (二)方法上重点、难点:培养分析、处理数据的能力,尝试运用比较、归纳等方法对信息进行加工。了解假说、模型等科学研究方法和科学研究的历程。 四.教学准备 (一)学生准备:上网查阅,14 6C在考古上的应用;核素、同位素在生产和生活中的应用。搜集有关原子结构模型的资料。 (二)教师准备:教学媒体、课件、相关资料。 五.教学方法 问题推进法、讨论法。 六.课时安排 2课时 七.教学过程 第1课时 【提问】化学变化中的最小微粒是什么? 【学生回答】原子是化学变化中的最小微粒。 【引出课题】这一节就从探讨原子的结构开始我们的学习。 【点评】开头简洁,直截了当,由初中相关知识提出问题,过渡到原子结构的学习。 【板书】第一节原子结构 【提出问题】原子是化学变化中的最小微粒。同种原子的性质和质量都相同。那么原子能不能再分?原子又是如何构成的呢? 【学生思考、回答】 上海市高一上学期化学期末考试试卷 姓名:________ 班级:________ 成绩:________ 一、单选题 (共16题;共16分) 1. (1分) (2016高二下·桓台月考) 下列叙述正确的是() A . 电能是二次能源 B . 水力是二次能源 C . 天然气是二次能源 D . 水煤气是一次能源 2. (1分) (2018高一上·九江期中) 净化水的方法很多,下列净化水的操作中净化程度最高的是() A . B . C . D . 3. (1分)化学与我们的生活密切相关,但我们在改善自己生活环境的同时也破坏了自然,旨在限制温室气体排放量、抵制全球范围内气候持续变暖的《京都议定书》于2005年2月16日正式生效.我国二氧化碳的排放量 位居世界第二,下列减少二氧化碳这种温室气体排放的措施不切实际的是() A . 积极开发氢能源 B . 充分利用太阳能 C . 不使用化石燃料 D . 积极开发核能源 4. (1分)(2015·崇州模拟) 运用相关化学知识进行判断,下列结论错误的是() A . 某吸热反应能自发进行,因此该反应是熵增反应 B . NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 C . 可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 D . 增大反应物浓度可加快反应速度,因此用浓硫酸与铁反应能增大生成H2的速率 5. (1分)下列仪器常用于物质分离的是() A . ①③⑤ B . ①②⑥ C . ②④⑤ D . ②③⑤ 6. (1分) (2016高二上·郑州开学考) 设NA为阿伏伽德罗常数的值,下列叙述正确的是() A . 标准状况下,22.4 L H2O含有分子数为NA B . 分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g C . 常温常压下,1.6 g CH4含原子数为0.5NA 第3单元课时1 原子结构模型的演变教学设计 一、学习目标 1. 通过原子结构模型演变的学习,了解原子结构模型演变的历史,了解科学家探索原子结构的艰难过程。认识实验、假说、模型等科学方法对化学研究的作用。体验科学实验、科学思维对创造性工作的重要作用。 2.了解钠、镁、氯等常见元素原子的核外电子排布情况,知道它们在化学反应过程中通过得失电子使最外层达到8电子稳定结构的事实。通过氧化镁的形成了解镁与氧气反应的本质。了解化合价与最外层电子的关系。 3.知道化学科学的主要研究对象,了解化学学科发展的趋势。 二、重点、难点 重点:原子结构模型的发展演变 镁和氧气发生化学反应的本质 难点:镁和氧气发生化学的本质 三、设计思路 本课设计先让学生描绘自己的原子结构模型,继而追随科学家的脚步,通过交流讨论,逐步探讨各种原子结构模型存在的问题,并提出改进意见,让学生主动参与人类探索原子结构的基本历程,同时也可体会科学探索过程的艰难曲折。通过镁和氧气形成氧化镁的微观本质的揭示,初步认识化学家眼中的微观物质世界。 四、教学过程 [导入] 观看视频:扫描隧道显微镜下的一粒沙子。今天我们还将进入更加微观的层次,了解人类对于原子结构的认识。你认为我们可以通过什么样的方法去认识原子的内部结构呢? 直接法和间接法,直接法努力的方向是观察技术的提高和观察工具的改进,而间接法则依赖精巧的实验和大胆的假设。事实上直到今天即使借助扫描隧道显微镜也无法观察到原子的内部结构,所以在人们认识原子结构的过程中,实验和假设以及模型起了很大的作用。 一、中国古代物质观 [提出问题]我们通常接触的物体,总是可以被分割的(折断粉笔)。但是我们能不能无限地这样分割下去呢? [介绍]《中庸》提出:“语小,天下莫能破焉”。惠施的人也说道“其小无内,谓之小一”。 第一章原子结构与性质 引言 【知识要点】 组成和性质 化学研究 性质和变化 1、分子的组成不同——结构不同——性质不同 元素种类一样 2、分子组成相同——结构不同——性质不同 化学式 3、分子组成不同,但结构相似——性质相似 4、无机物中,化学组成相同,但晶体结构不同,从而导致性质不同。 第一章原子结构与性质 第一节原子结构 【学习重点】 1、根据构造原理写出1~36号元素原子的电子排布式; 2、核外电子的运动状态,电子云与原子轨道; 3、泡利原理、洪特规则。 【学习难点】 1、电子云和原子轨道; 2、基态、激发态和光谱。 (第1课时) 【知识要点】 一、原子的诞生 1932年勒梅特首次提出了现代宇宙大爆炸理论:整个宇宙最初聚集在一个“原始原子”中,后来发生了大爆炸,碎片向四面八方散开,形成了我们的宇宙。大爆炸后两小时,诞生了大量的、少量的及极少量的Li,然后经过长或短的发展过程,以上元素发生原子核的熔合反应,分期分批的合成了其它元素。 元素宇宙中最丰富的元素占88.6%(氦1/8),地球上的元素大多数是金属,非金属元素(包括稀有气体)仅种。 二、原子结构模型(人类对原子结构的认识历史) 古希腊哲学家德谟克利特是原子学说的奠基人,他认为原子是构成物质的粒子。万物都是由间断的、不可分的粒子即原子构成的,原子的结合和分离是万物变化的根本原因。 1、道尔顿原子模型(1803年)英国科学家道尔顿是近代原子学说的创始人。他认为原子是组成物质的基本粒子,它们是坚实、不可再分的实心球,同种原子的质量和性质都相同。 2、汤姆生原子模型(1904年)英国科学家汤姆生发现了电子。他认为原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。(也称“枣糕”模型或“葡萄干布丁”模型) 3、卢瑟福原子模型(1911年)英国物理学家卢瑟福根据α—粒子散射实验提出:在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就象行星环绕太阳运转一样。(电子绕核旋转的原子结构模型) 4、玻尔原子模型(1913年)丹麦物理学家玻尔通过光谱研究提出电子在核外空间的一定轨道内绕核做高速圆周运动的理论。(核外电子分层排布的原子结构模型) 5、电子云模型(1927年—1935年)又称现代物质结构学说。奥地利物理学家薛定谔等人 上海市高一上学期化学期末考试试卷A卷 姓名:________ 班级:________ 成绩:________ 一、单项选择题 (共20题;共20分) 1. (1分) (2018高二上·汕头期末) 下列物质属于混合物的是() A . 矿泉水 B . 冰醋酸 C . 液氯 D . 碳酸钠 2. (1分)下列化学式与指定物质的主要成分对应正确的是() A . 刚玉﹣﹣SiO2 B . 明矾﹣﹣Al2(SO4)3?12H2O C . 小苏打﹣﹣Na2CO3 D . 漂白粉﹣﹣Ca(ClO)2、CaCl2 3. (1分) (2016高一上·孝感期中) 关于强、弱电解质及非电解质的组合完全正确的是() A . A B . B C . C D . D 4. (1分) (2016高一上·福建期中) 最近中科院近代物理所有关专家在世界上首先发现了镤元素的一种新同位素 Pa,它的中子数为() A . 330 B . 91 C . 239 D . 148 5. (1分) (2018高三上·漯河期中) 化学与生活、生产密切相关,下列有关说法错误的是() A . 碘酒能使蛋白质变性,涂在人体皮肤上可杀菌消毒 B . 大米、小米、马铃薯中均含有淀粉,可为人体活动提供能量 C . “滴水石穿、绳锯木断”都不涉及化学变化 D . “凿开混沌得乌金,藏蓄阳和意最深.爝火燃回春浩浩,洪炉照破夜沉沉”这里“乌金”指的是煤 6. (1分) (2017高一上·桂林期中) 鉴别氯化铁溶液与氢氧化铁胶体最简便的方法是() A . 萃取 B . 渗析 C . 过滤 D . 丁达尔效应 7. (1分) (2018高一上·扶余期中) 化学与生活、社会发展息息相关,下列说法不正确的是() A . “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 B . “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 C . “青蒿一握,以水二升渍,绞取汁”,此句中体现的屠呦呦对青蒿素的提取属于化学变化 D . “春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应 8. (1分) (2018高一上·九江开学考) 在含有大量Na+、H+、Cl-的溶液中,还可能大量存在的是()高一化学 第一节 原子结构教案
最新沪教版化学高一上复习资料
高三化学第一章打开原子世界的大门知识点
人教版高中化学选修3第一章第一节第二课时《原子结构》教案
最新整理高一化学教案原子结构教案.docx
高中化学《原子结构与元素的性质》教案14 新人教版选修3
沪科版高一上册化学期末复习知识点总结提纲(全面!)
高一化学第一章打开原子世界的大门
高中化学《原子结构》教案2 新人教版选修3
人教版高中化学选修三《原子结构》教案设计
《打开原子世界的大门》复习
上海市2019年高一上学期化学期中考试试卷(I)卷
打开原子世界的大门答疑
高中化学1.1原子结构教案鲁科版必修2
上海市高一上学期化学期末考试试卷
高中化学《原子结构模型的演变》教学设计 苏教版必修1.doc
高中化学第一章原子结构与性质第一节原子结构教学案苏教版选修
上海市高一上学期化学期末考试试卷A卷