第八章s区元素
8.1 S区元素概述 (1)
8.2 S区元素的一些规则 (3)
8.3 重要单质与化合物 (10)
8.4 制备 (18)
8.5 S区元素的生物作用 (20)
8.1 S区元素概述
8.1.1 碱金属
S区元素价电子构性、氧化还原性及其变化规律
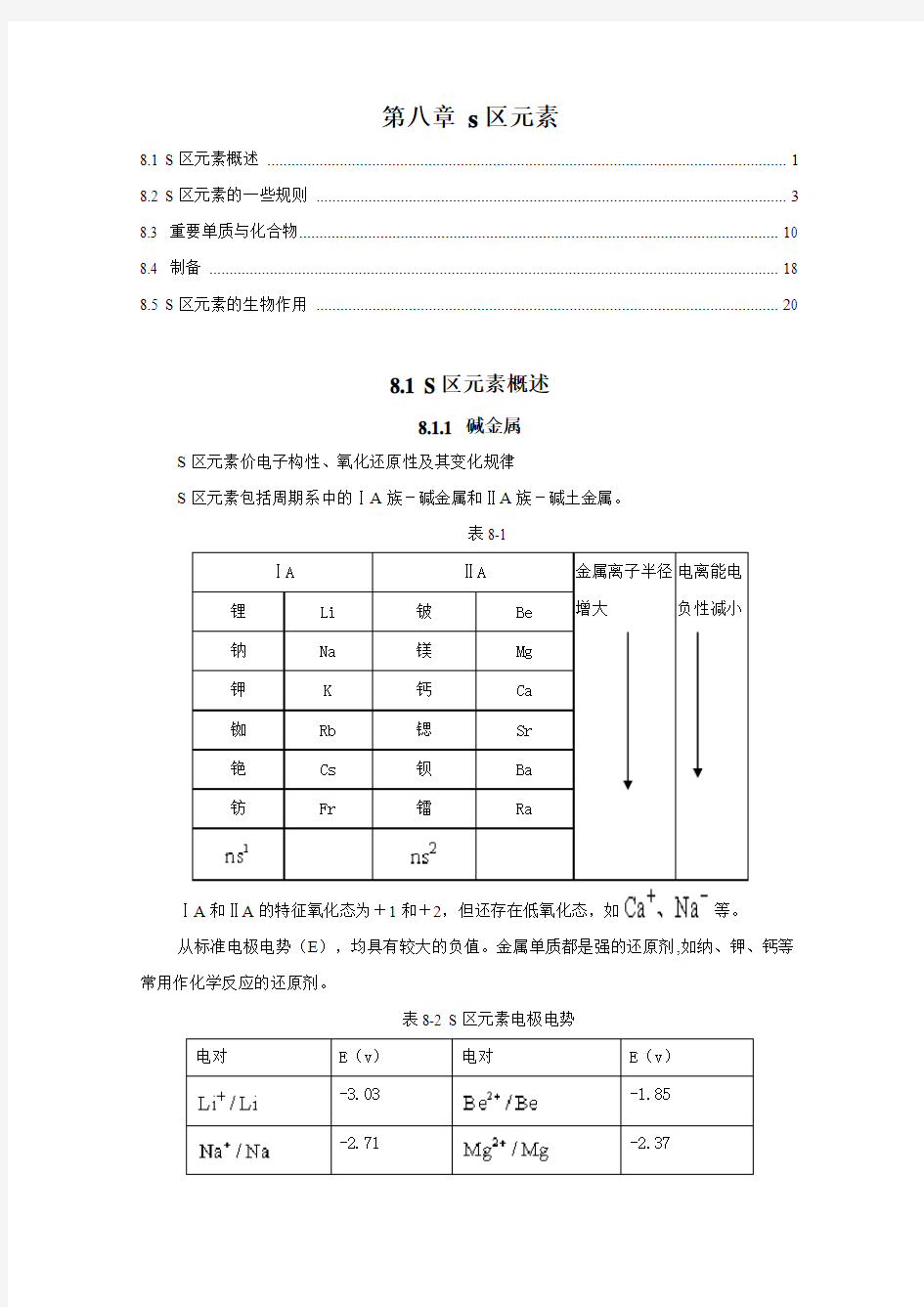
S区元素包括周期系中的ⅠA族-碱金属和ⅡA族-碱土金属。
表8-1
ⅠA和ⅡA的特征氧化态为+1和+2,但还存在低氧化态,如等。
从标准电极电势(E),均具有较大的负值。金属单质都是强的还原剂,如纳、钾、钙等常用作化学反应的还原剂。
表8-2 S区元素电极电势
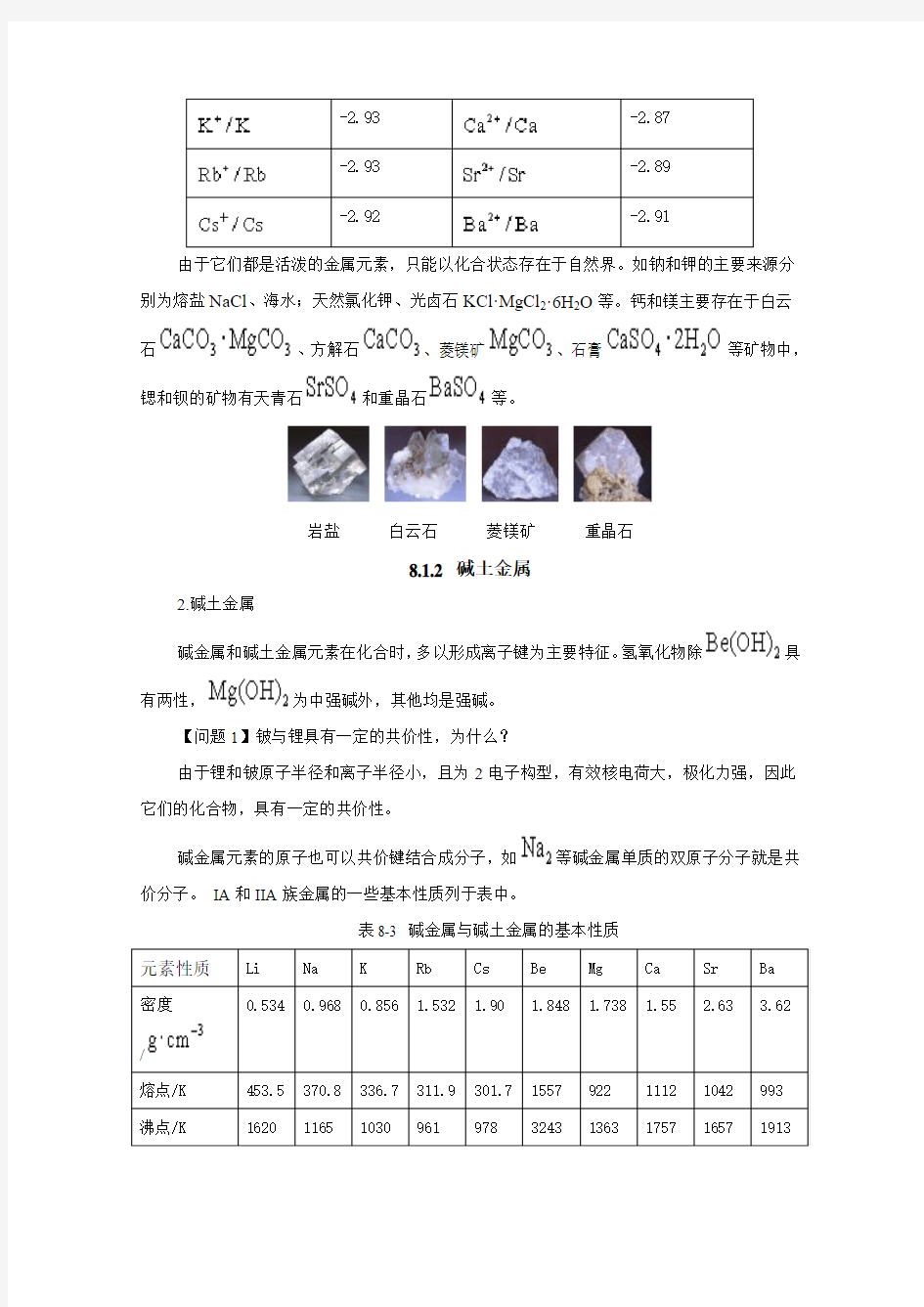
由于它们都是活泼的金属元素,只能以化合状态存在于自然界。如钠和钾的主要来源分别为熔盐NaCl 、海水;天然氯化钾、光卤石KCl·MgCl 2·6H 2O 等。钙和镁主要存在于白云石
、方解石
、菱镁矿
、石膏
等矿物中,
锶和钡的矿物有天青石
和重晶石
等。
岩盐 白云石 菱镁矿 重晶石
8.1.2 碱土金属
2.碱土金属
碱金属和碱土金属元素在化合时,多以形成离子键为主要特征。氢氧化物除具
有两性,
为中强碱外,其他均是强碱。
【问题1】铍与锂具有一定的共价性,为什么?
由于锂和铍原子半径和离子半径小,且为2电子构型,有效核电荷大,极化力强,因此它们的化合物,具有一定的共价性。
碱金属元素的原子也可以共价键结合成分子,如等碱金属单质的双原子分子就是共
价分子。 IA 和IIA 族金属的一些基本性质列于表中。
表8-3 碱金属与碱土金属的基本性质
【问题2】为什么ⅡA 金属的熔沸点升华热高于IA ?ⅡA 离子水合放热更多? 因为ⅡA 金属中有两个电子参与形成金属键,金属键较强,所以熔沸点及升华热均高于IA 。ⅡA 离子带有两个正电荷,更容易与水结合,会放出更多的热量。
8.2 S 区元素的一些规则
8.2.1 对角线规则(1)
锂和镁的相似性 S 区元素的一些规律
1.对角线规则
第二周期元素Li 、Be 、B 的性质和第三周期处于对角位置的元素Mg 、Al 、Si 一一对应,它们的相似性称为对角线规则。
(1).锂和镁的相似性
a.锂、镁在氧气中燃烧,均生成氧化物(
和
),不生成过氧化物。
b.锂、镁在加热时直接和氮反应生成氮化物(和
),而其它碱金属不能和氮作
用。
c.锂、镁和氟化物(LiF、)、碳酸盐(、)、磷酸盐(、
)均难(或微)溶于水,其他相应化合物为易溶盐。
d.水合锂、镁氯化物晶体受热发生水解。
e.锂和镁、硝酸盐分解产物相似。
自测:写出其他碱金属硝酸盐分解方程式?
f.IA中只有锂能直接和碳生成,镁和碳生成((C=C=C)4-)
g.锂、镁的氯化物均溶于有机溶剂中表现出共价特性。
8.2.2 对角线规则(2)
铍和铝、硼和硅的
(2).铍和铝的相似性
a.铍和铝均为两性金属,其氧化物和氢氧化物均为两性。
b.无水氯化物为共价化合物,易生成双聚体(气态下)、易升华、溶于乙醇、乙醚等有机溶剂中。IIA族其他元素的为离子型化合物、熔融态能导电。
c.铍、铝和冷硝酸接触表面易钝化,其他IIA族金属易和硝酸反应。
d.氧化铍和氧化铝都具有高硬度和高熔点。
(3).硼和硅的相似性
a.B、Si 均能从NaOH 中置换出氧气。
b.其单质为原子型晶体
c.B-O、Si-O十分稳定。
问题1:为什么会出现对角相似?
因为锂和镁,铍和铝,硼和硅Z/r比较相似,极化能力相近,因此出现性质上的某种相似。
8.2.3 R—OH规则
2.R-OH规则
氢氧化物的强弱通常用的离子势φ=Z/r(Z为电荷数,r为离子半径)判断,简称ROH 规则。我们把任何碱和含氧酸都统一表示为R—O—H的结构(R代表)。以为例,在水溶液中存在两种解离方式:
(1).酸式电离
φ值越大,的静电场越强,对氧原子上的电子云的吸引力就越强(M—O—H),M—O 之间呈现显著的共价性,而O—H键受的强烈影响,其共用电子对强烈地偏向氧原子,以致O—H键呈现显著的极性,即随M—O键的增强,按酸式电离的趋势就越大。
8.2.4 离子性盐类溶解性的判断方法
3. 离子性盐类溶解性的判断方法
物质在溶剂中的溶解是较为复杂的过程。根据相似相容原理,离子化合物易溶于极性溶剂中。在此,我们讨论具有8电子构性的金属离子所形成的盐的溶解度。
(1).水合能、晶格能与溶解度
以IA族无水卤化物溶解为例,设计下列热化学循环:
为离子型盐溶解过程的标准自由能变
(为什么?<<<)
在常温下,熵效应对贡献较小,可忽略。
从上述循环和晶格能、水和热的定义,我们能看出:
也就是说盐类在水中溶解的难易程度粗略地用晶格能和水合能(总的)的相对大小来判断。若水合能大于晶格能其盐类可以溶解或溶解度较大,反之则难溶。表8-3中列出碱金属氟化物和碳酸盐(钠)在水中溶解的热力学参数。
表8-3 碱金属氟化物和碳酸盐(钠)在水中溶解度的热力学参数
总水合能
【问题1】此方法有什么优缺点?
此方法数据易得,简单方便,适用于大多数溶解过程。但该方法忽略了熵对离子型盐的溶解性的影响,有些溶解过程熵的变化较大,则判断就会出现错误。
8.2.5 巴索洛经验规则
(2)巴索洛经验规则
阴阳离子之间有一定的匹配关系,在缺乏有关数据的前提下,可以作为判断盐类溶解性的一种定性方法。
巴索洛经验规则:
当阴阳离子电荷的绝对值相同而它们的半径相近时,生成的盐类一般难溶于水。
【问题1】比较LiF、CsF;LiI、CsI溶解度大小?
LiF是小与小配,CsI是大与大配,难溶于水。CsF、LiI阴阳离子半径相差甚远,大小严重不匹配,易溶于水。
【问题2】要使碱金属离子生成沉淀,需要那些的阴离子?
从巴索洛经验规则可联想起要使碱金属这类大阳离子生成沉淀,必须找大阴离子作为沉
淀剂,如等大阴离子与、等形成的化合物均难溶于水。
【问题3】据巴索洛经验规则分析碱土金属盐类溶解度大致规律?
、为半径较小的阴离子,从阴离子半径增大,越来越不匹配,所以溶解度越来越大.而,则为半径较大的阴离子,从阴离子半径增大,越来越不匹配,因此与ⅡA离子形成盐的溶解度从上到下越来越小。
对其他族的阳离子和阴离子也可根据巴索洛经验规律加以预测。如下列的阳离子与阴离子可组成稳定的化合物(符合电荷绝对值相等,半径相近原则)。
8.2.6 盐的稳定性
4.盐的热稳定性
(1).碳酸盐的热稳定性
一般碱金属盐具有较高的热稳定性,除了在高温下部分分解外,其余碱金属碳酸盐难分解。碱土金属碳酸盐不稳定,按下式分解:
碳酸盐的热稳定性也可用离子极化观点来说明:
在中,既存在中心C原子对周围的作用,也存在对的作用。阳离子电荷愈高半径愈小,极化力愈强,愈容易从中夺取;成为MO。同时放出,表现为的热稳定性愈低,最易发生分解。
【问题1】解释碱土金属碳酸盐的分解规律。
在碱土金属碳酸盐中,阳离子半径从至增加,极化力随之降低(Z/r下降),即对的作用力随到减弱,热稳定性随之增加。的热分解温度由族往下逐渐升高,这与实验结果相一致,见下表。
【问题2】为什么碳酸氢盐十分不稳定?
因为其中半径较小,极化能力特别强,所以碳酸氢盐不稳定。
碳酸氢盐都不及碳酸盐稳定,碱金属的碳酸氢盐受热时即分解为碳酸盐:
(2).硝酸盐热稳定性
碱金属硝酸盐热稳定性低,在一定温度下就会分解。
8.3 重要单质与化合物
8.3.1 单质的性质
重要单质与化合物
1.单质的性质
(1).物理性质
碱金属和碱土金属都是低熔点、低硬度的轻金属。除铍、镁较硬外,其他金属均较软,能用刀切割。它们均具有金属的外观及良好的导电性。
(2).单质的化学性质
IA、IIA族金属有很强的活泼性,都能同卤素、氧及活泼非金属发生反应,大多数能与氢、水作用,生成的相应化合物(除锂、铍的某些化合物外)一般是以离子键相结合。如NaH、
等为离子型氢化物,而和为过渡型氢化物。
与水之间的反应在实验室用来除去溶剂或惰性气体(如、Ar)中的痕量水:
【问题1】可用此脱去大量的水吗?
不适合于脱除大量水,由于该反应为剧烈的放热反应,产生可燃性氢气是相当危险的。
锂、钠、钾分别投入水中,除锂外,反应非常激烈,同时放出大量的热。
碱金属和碱土金属(铍和镁除外)均溶于液氨,形成具有导电性的蓝色溶液:
蓝色是由溶剂合电子跃进引起的。碱金属的液氨溶液可以采用蒸发方法回收金属。金属的氨溶液是一种能够在低温下使用的非常强的还原剂。
【问题2】此蓝色溶液的磁性如何?
此蓝色溶液(稀溶液)具有顺磁性,并随碱金属浓度的增加,顺磁性降低。随金属溶解量的增加,溶剂和电子配对作用加强,顺磁性降低。
液氨中碱金属同氨也有生成氨基化物的慢反应:
式中M=Na、K、Rb、Cs。如果在体系中有催化剂(如过渡金属氧化物、铁盐)存在时,反应会十分快速地进行。碱金属有很高的反应性,在空气中极易形成的覆盖层。(碱金属如何保存?)
要将它们保存在无水煤油中,锂保存在液体石腊中。(密度小,能浮在煤油上)
碱土金属的活泼性不如碱金属,铍和镁表面形成致密的氧化物保护膜。
8.3.2 氧化物和过氧化物
2.氧化物、过氧化物、超氧化物、臭氧化物
IA、IIA族金属能形成各种类型的氧化物:正常氧化物、过氧化物、超氧化物、臭氧化物,它们均为离子型化合物。
(1).氧化物
Li和IIA族金属在氧气中燃烧生成氧化物。钠、钾在空气中燃烧得到过氧化物。因此它们的氧化物需用其它方法制备。如Na还原,K等还原等得相应的氧化物。
碱土金属的氧化物可以通过其碳酸盐或硝酸盐等的热分解来制备:
除BeO为两性外,其它碱金属碱土金属氧化物均显碱性。经过煅烧的BeO和MgO极难与水反应,它们的熔点很高,都是很好的耐火材料。氧化镁晶须(极细的纤维状单结晶)有良好的耐热性、绝缘性、热传导性、耐碱性、稳定性和补强特性。用作各种复合材料的补强材料。超细氧化镁的活性高,烧结效率高,常用作烧结精细陶瓷,各种陶瓷的烧结助剂、稳定剂和各种电子材料用的辅助材料,也可作为橡胶、塑料等材料的特殊添加剂。
(2).过氧化物
IA、IIA族金属(除Be外)都能生成离子型过氧化物,但其制备方法各异。
的工业制法是将除去的干燥空气通入熔融钠中,控制空气流量和温度即可得到(纯的为白色,因其中常含有而呈淡黄色)。
与水或稀酸反应产生,随即分解放出。
自测:写出上述反应的方程式?
所以可用作氧化剂、漂白剂和氧气发生剂。与反应能放出,故在防毒面具、高空飞行和潜艇中作的吸收剂和供氧剂。无水只能在液氨溶液中获得,不能通过直接氧化制得。可以通过的脱水得到(制备
的原料为、、)。SrO、BaO和在一定条件下反应生成和。
也可作供氧剂、引火剂。
【问题1】问什么Li在空气中与氧反应,生成正常氧化物而不生成过氧化物和超氧化物?
半径较小,与、半径不匹配;极化能力强,对、极化能力强,易生成正常氧化物。
8.3.3 超氧化物和臭氧化物
(3).超氧化物
超氧化物可通过下列反应得到:
碱金属超氧化物和、反应放出,被用作供氧剂。
【自测】请写出方程式?
【问题1】
由于、反键轨道上的电子比多,所以、的键能小于(、、
的键能分别为142、298及498),因此
8.3.4 氢氧化物
3. 氢氧化物
IA和IIA族中除Be(OH)2为两性,LiOH、Mg(OH)2为中强碱外,其余MOH、M(OH)2
均为强碱性。(ROH 规则>>> )
一般说来,M(OH)2的溶解度较低。MOH、M(OH)2的溶解度变化是从Li → Cs;Be→ Ba 顺序依次递增,Be(OH)2和Mg(OH)2是难溶氢氧化物。(巴索洛规则>>>)
电解碱金属氯化物水溶液可得到氢氧化物,工业上电解NaCl溶液得NaOH。根据电解槽的形式及电极材料不同,有隔膜法、汞阴极法和离子膜法。
作为强碱的碱金属和碱土金属的氢氧化物,有一系列的碱性反应,现以NaOH为例扼要予以说明:
(1).同两性金属反应:
(2).同非金属硼、硅等反应:
(3).同卤素等非金属作用时,非金属发生歧化:
氢氧化钠能与酸进行中和反应,生成盐和水。
【问题1】如何保存NaOH?
存放NaOH时必须注意密封,以免吸收空气中的及水分。方程式如下:
【问题2】如何配置不含的NaOH溶液?
可先配置很浓的NaOH溶液,在这种溶液中,经静置后即可沉淀出,而上面的清夜就是纯NaOH溶液。
【问题3】为什么盛放NaOH溶液的瓶子要用橡皮塞子而不要用玻璃塞子?
NaOH与二氧化硅发生缓慢的反应,生成硅酸盐会使瓶口粘塞。方程式如下:
8.3.5 盐类化合物
碱金属盐类的特点
4. 盐类化合物
(1).碱金属盐类的特点:
a.溶解性:绝大多数碱金属盐类易溶于水。少数难溶于水的有离子半径小的锂盐,及由大阴离子和较大阳离子组成的盐,这些难溶盐可用于鉴定反应中。
【问题】请举出几个例子?
、(六羟基锑酸钠)、(高氯酸钾)、(六氯合铂酸钾)、(四苯硼酸钾)、(六亚硝基合钴酸钠钾)。
b.水合盐:相当数量的碱金属能以水合盐形成存在,依Li+、Na+、K+、Rb+、Cs+离子半径的逐渐增大,形成水合盐的倾向递减。Li+盐有75%是水合的,K+盐只有25%是水合的,水合Na+盐比水合K+盐数量多,Rb+和Cs+的水合盐极少。(为什么?>>>)
这是由于Li+半径最小,水合作用特别强之故。
c.晶体类型:绝大多数为离子晶体,只有半径特别小的的某些盐(如卤化物)具有不同程度的共价性。
d.易形成复盐:
由于Li+半径特别小,难以形成复盐。
e.颜色:所有碱金属盐,除了与有色阴离子形成有色盐外(如KMnO4),其余都为无色盐。
f.热稳定性:碱金属盐一般具有较高的热稳定性。
结晶卤化物:在高温时挥发而不分解
硫酸盐:高温时既不挥发也难分解
碳酸盐:除L i2CO3部分(1000k部分分解)外,其余部分均难分解
硝酸盐:热稳定性低,在一定温度下就会分解
相关方程式:
g.水解性:除外,其他碱金属阳离子均难以水解。当晶体受热发生水解,产物为LiOH和HCl。
8.3.6 盐类化合物
碱土金属盐类的特点
(2).碱土金属盐类的特点
常见的碱土金属盐类有卤化物、硫酸盐、碳酸盐、磷酸盐等。由于碱土金属与碱金属相比离子电荷增加、半径变小。故其离子势增大,极化能力增强,因经它们的盐类具有某些特殊性,Be2+、Mg2+更为突出。
a.溶解性:
碱土金属的盐比相应的碱金属盐溶解度小,而且不少是难溶的。常常利用化合物溶解度的差别进行分离提纯。
硫酸盐、铬酸盐的溶解度差别较大。例如是易溶的,而
都是难溶的。
b.键型:
碱土金属在化合时,多以形成离子键化合物为主要特征。铍由于离子半径小,与IA相比电荷增大,且为2电子构型,极化能力增强,化学键中共价成分显著增加。铍常表现出与同族元素不同化学性质。BeCl2是共价型化合物,在气态为双聚分子;固体BeCl2具有无限长链结构。BeCl2可溶于有机溶剂中。和在加热条件下按下式水解,说明它们的氯化物具有一定程度的共价性。
c.热稳定性:
由于M2+的极化力较强,IIA族盐的热稳定性较IA族的低,如碳酸盐的热稳定性较碱金属碳酸盐要低。热分解温度BeCO3<373K,而Li2CO3>1273K才发生分解。
d.颜色:
M2+在晶体和水溶液中均是无色的。它们的有色盐是由带色的阴离子所引起的。如K2CrO4中的为橙色。
8.3.7 锂电池和锂离子电池
5.锂电池和锂离子电池
(1).锂电池
锂是高能电池理想的负极活性物质.(为什么?>>>)
因它具有最负的标准电极电势。
锂电池具有电压高、比能量高、比功率大、寿命长、轻(周期表中第三号元素)的特点,应用于飞机、导弹点火系统、鱼雷、电子手表、计算器、录音机、心脏起搏器等方面。
用于手机的锂电池
引线的镍网或其他金属网上。正极活性物质有SO2、
SOCl2、SO2Cl2、V2O5、CrO3、Ag2CrO4、MnO2、TiS2、FeS2、Ag2S、MoS2、VS2、CuS、FeS、CaO、Bi2O3等。
【问题1】电解质可以用水溶液吗?
锂十分活泼,不能用水作溶剂。
非水电池采用有机溶剂或非水无机溶剂电解液,锂熔融电池用固体电解质。常用的有机溶剂有乙腈、二甲基甲酰胺等(LiClO4、LiAlCl4、LiBF4、LiBr、LiAsF6等做支持电解质,非水无机溶剂有SOCl2、SO2Cl2、POCl3等可兼作正极活性物质)。
以下将锂电池与其他电池的性能作一比较(表8-4)。
表8-4 锂电池与其他电池的性能比较
(2).锂离子电池
锂离子电池由日本索尼公司于1990年最先开发成功,它是把锂离子嵌入碳(石油焦炭和石墨)中形成负极(传统锂电离用锂或锂合金作负极)。正极材料常用,也用
和,电解液用+ 二乙烯碳酸酯(EC)+二甲基碳酸酯(DMC)。
锂离子电池
石油焦炭和石墨作负极材料无毒,且资源充足,锂离子嵌入碳中,克服了锂的高活性,解决了传统锂电池存在的安全问题,正极在充放电性能和寿命上均能达到较高水平,使成本降低,总之锂离子电池的综合性能提高了。预计21世纪锂离子电池将会占有很大的市场。锂离子二次电池充放电时的反应式为:
8.4 制备
8.4.1 单质制备
制备
1.单质制备
ⅠA、ⅡA金属比较活泼,所以常采用两种方法:熔盐电解法和热还原法。
(1)电解熔融盐
如电解熔融NaCl制备金属Na。
电解用的原料是氯化钠和氯化钙(或氯化锶、氯化钾、氟化钠)的混合盐。
【问题1】为什么要加入CaCl2?
若直接电解氯化钠,则不仅需要很高温度,浪费能源,而且电解析出的液态钠既易挥发,又易分散于熔盐中不好分离。但加入氯化钙后,电解质的熔点明显降低(氯化钠的熔点为1074K,混合盐的熔点约为873K),防止了钠的挥发,并可减小金属的分散性,因为熔融的混合盐密度比金属钠大,液钠可以浮在上面。
此方法可以制备Li、Mg、Na、Ca、Be。
(2)高温还原
K、Rb、Cs常采用强还原剂还原。如:
【问题1】为什么相对不活泼金属可以把活泼金属置换出来?
钠的沸点1155.9K,钾为1032.9K,反应先生成钠钾合金,在分馏塔中加热钠-钾合金,钾沸点低,首先成为气体从反应体系中分离出来。
【问题2】为什么一般不用熔融盐电解制取K?
钾沸点低易挥发,又易熔于KCl中难分离,而且在电解过程中产生的KO2与K会发生爆炸反应。
8.4.2 重晶石制备其它钡盐
2.重晶石制备其它钡盐
重晶石主要成份是BaSO4,是制备其它各类钡盐的原料。
【问题3】直接用BaS+HNO3制备Ba(NO3)2好吗?
不好!因为还会发生HNO3氧化BaS中的S2-,造成原料浪费和环境污染,正确方法是向BaCO3中加入稀HNO3制备Ba(NO3)2。
8.5 S区元素的生物作用
S区元素的生物作用
在所有碱金属与碱土金属中,许多元素与生命过程密切相关。锂、钠、钾、镁、钙均是生物体必需的常量元素,在生物体内发挥重要作用。
1.锂
锂在大多数生物有机体中含量比钠、钾低,一些植物(如烟草)没有锂就长不好。锂对高等动物的神经系统肯定有作用,根据这种作用,精神科医生用碳酸锂治疗狂郁精神病。
2.钠
钠是动物的必需元素,动物所需要的钠必须从食盐摄取。人体内钠的总量约为90g。钠的主要功能是维持细胞内外的渗透压。
3.钾
钾也是动物的必需元素,但植物只需要钾而不需要钠。所以动物吃植物可以得到钾。钾的主要功能是维持细胞的新陈代谢。钾和钠都保持神经细胞对外界刺激的反应正常。研究表明,细胞外的Na+浓度要比细胞内的约大100倍,而K+的浓度分布则相反。当神经细胞收入
过渡元素(二) 1.试回答和解释下列事实: (1)PdCl 2·2PF 3比PdCl 2·2NH 3稳定?而BF 3·NH 3却比BF 3·PF 3稳定得多?这是为什么? (2)相应的化学式为PtCl 2(NH 3)2的固体有两种异构体(顺、反),它们的颜色不同,一种 是棕黄色,另一种是淡黄色;它们在水中的溶解度也有差别,其中溶解度较大的应是哪一种?为什么? (3)钌和锇的四氧化物都是低熔点的固体(RuO 4为298K 、OsO 4为314K ),试加以解释。 (4)ZrO 2的碱性比TiO 2强,为什么? (5)Nb 和Ta 的原子半径几乎相同,为什么? 2.Pt(NH 3)2(NO 3)2有α和β两种构形。α形与草酸反应生成Pt(NH 3)2C 2O 4,但β形与草酸反应得到的反应产物却是Pt(NH 3)2(C 2O 4H)2。为什么会出现不同的反应产物?用什么物理方法来区分α形和β形。请画出这两种配合物的结构式。 3.完成下列方程式 (1)Pt +HNO 3+HCl → (2)PdCl 2+CO +H 2O → (3)K 2PtCl 6+K 2C 2O 4 → (4)MoO 42-+Zn 2++H + → (5)Mo 3+ +NCS - → (6)(NH 4)2PtCl 6 → (7)K 2PtCl 6+N 2H 2·2HCl → (8)ZrCl 4+H 2O → (9)PtF 6+Xe → (10)Ru +KClO 3+KOH → (11)MoO 3+NaOH → (12)WO 3+NaOH → (13)WO 3·nH 2O → (14)(NH 4)2ZrF 6 → 4.Zr 和Hf 有何宝贵的特征?基于这些特性有哪些主要用途? 5.锌汞齐能将钒酸盐中的钒(V )还原至钒(II ),将铌酸盐中的铌(V )还原至铌(IV ),但 △ △ △ △
第十二章ds区元素 12.1 铜族元素 (1) 12.2 锌族元素 (10) 12.1 铜族元素 12.1.1 铜族元素通性 铜族元素 1.铜族元素通性 铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高。 对于Cu、Ag、Au,Δ(I2-I1)Au < Δ(I2-I1)Cu < Δ(I2-I1)Ag 所以常见氧化态物+3,+2,+1。 铜、银、金的标准电势图如下所示: 12.1.2 铜族元素金属单质 2.铜族元素金属单质 (1).物理性质 铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。这可能与d电子也参与形成金属键有关。由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的
碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。 (2).化学性质 铜族元素的化学活性远较碱金属低,并按Cu--Ag--Au的顺序递减。 在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。铜绿可防止金属进一步腐蚀,其组成是可变的。银和金不会发生该反应。 空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。() 在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。但当有空气存在时,铜可缓慢溶解于这些稀酸中: 浓盐酸在加热时也能与铜反应,这是因为Cl-和Cu+形成了较稳定的配离子[CuCl4]3-,使Cu == Cu++e-的平衡向右移动: 铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解 银与酸的反应与铜相似,但更困难一些;而金只能溶解在王水中:
无机化学s区元素练习题 S区元素练习题 一、完成并配平下列反应方程式 1、Na +H2→ 2、LiH → 3、CaH+H2O→ 4、Na2O+ CO→ 5、 Na2O+ MnO4- + H+→ 6、BaO+ H2SO4 → 7、纯氧中加热氧化钡 8、唯一能生产氮化物的碱金属与氮气反应 9、铍与氢氧化钠溶液反应 10、金属钙在空气中燃烧,将燃烧产物再与水反应 11、写出氢氧化锂和过氧化钡的常用制取方法的化学方程式 二、请用热力学数据计算碱金属的过氧化物的稳定性增强 请用热力学数据计算碱金属超氧化物的稳定性也在逐渐增强 三、已知r=227pmr=197pm,Ar=39.0Ar=40.078,计算钾和钙的密度。 四、写出Ca2与氯化镁溶液反应的离子方程式,计算
该反应在298K下的标准平衡常数K? 五、已知NaH晶体中,Na与H的核间距离为245pm,试用Born-Lande公式计算NaH的晶格能。再用波恩-哈伯循环计算NaH的标准摩尔生成焓。 ????六、计算反应MgO + C?的?rHm,?rSm和???CO +Mg+- ?rGm,以及该反应可以自发进行的最低温度。 ? 七、已知镁的升华焓?SubHm=147.70kJ·mol,第一,第二电离分别为I1=743.94 ?2?kJ·mol-1,I2=1456.8kJ·mol-1,?fHm=-466.8kJ·mol-1,?-1 ?fGm=-454.kJ·mol,试计算?fHm,计算E和Mg的水合热2+2?/Mg)。 八、s区某金属A与水反应剧烈,生成的产物之一溶液呈碱性。B与溶液C反应可得到中性溶液D,D在无色火焰中的焰色反应呈现为黄色。在D中加入硝酸银溶液有白色沉淀E生成,E可溶于氨水中。一淡黄色粉末物质F与金属A反应生成G,G溶于水得到B溶液,F溶于水则得到B和H的混合溶液,H的酸性溶液可使高锰酸钾溶液退色,并放出气体I。试确定各字母所代表物质的化学式,写出有关的反应方程式。 某碱土金属A在空气中燃烧时火焰呈橙红色,反应产
班级 姓名 分数 一、选择题 ( 共18题 35分 ) 1. 2 分 InCl 2为逆磁性化合物,其中In 的化合价为…………………………………………( ) (A) +1 (B) +2 (C) +3 (D) +1和+3 2. 2 分 下列氢化物中,在室温下与水反应不产生氢气的是…………………………………( ) (A) LiAlH 4 (B) CaH 2 (C) SiH 4 (D) NH 3 3. 2 分 和水反应得不到H 2O 2的是……………………………………………………………( ) (A) K 2O 2 (B) Na 2O 2 (C) KO 2 (D) KO 3 4. 2 分 下列物质的水解产物中既有酸又有碱的是………………………………………… ( ) (A) Mg 3N 2 (B) SbCl 5 (C) POCl 3 (D) NCl 3 5. 2 分 有关H 3PO 4、H 3PO 3、H 3PO 2不正确的论述是…………………………………( ) (A) 氧化态分别是+5,+3,+1 (B) P 原子是四面体几何构型的中心 (C) 三种酸在水中的离解度相近 (D) 都是三元酸 6. 2 分 下列各组化合物中,都有颜色的一组化合物是…………………………………… ( ) (A) SiCl 4,SnCl 4,PbO (B) CCl 4,NO 2,HgI 2 (C) SiC ,B 2H 6,N 2O 4 (D) PbO 2,PbI 2,SnS 7. 2 分 下列化合物中最稳定的是…………………………………………………………… ( ) (A) Li 2O 2 (B) Na 2O 2 (C) K 2O 2 (D) Rb 2O 2 8. 2 分 1 mol 下列各物质溶于1 dm 3水中,生成的溶液 中H + 浓度最高的是……………( ) (A) SO 3 (B) P 4O 10 (C) HF (D) MgH 2 厦门大学“无机化学(二)”课程试卷 化学化工学院化学、材料系2004年级化学各专业 试卷类型:(A 卷)
厦大无机化学考研经验 现在说说我的考研复习时间安排吧,我是从2011年4月份开始复习无机化学上册,整个四月份都只看无机化学上册,只看书,每天花半天时间(3小时)去图书馆。我看书比较注重效率,也感觉自己那段时间效率比较高,所以就抓紧时间看(考研复习都有疲劳期,所以趁状态好的时候多复习点)。每次看书的时候只带课本和笔,本人不习惯用笔记本,看书期间遇到的问题或是重点我喜欢直接标注在书本上,我那本无机化学课本在最后反正是找不到一页没有注解的空白地方。我还有个习惯就是喜欢将书本上的重要公式或是非常重要的定义写在那一页的顶端或是下端,这样有助于复习时加深印象,翻到那一页就知道主要讲了什么内容。整个四月份我将无机化学上册看了一遍,当然有些难以理解的地方就多花了时间。我找的考研资料、考题考点解析、知识框架图及历年真题及答案解析等内容都是在百度文库找的,价格便宜,用起来很方便。我看书也是主要是以章节为单位,争取看一章能将那一章的知识有个了解,争取看懂。 看完这本书就给自己放了一个五一长假,然后就开始复习物理化学了,物理化学也注重看书,最好是复习厦大孙世刚那两本书,很全面,跟考试结合很紧密。物理化学是一项艰苦的工程,不仅难懂,还很难记住,感觉就是看不懂,看了后面就忘了前面,做题几乎没把握。不过这时不要灰心,始终要坚信难是对于所有人的,只要自己努力了,结果肯定不会差。物理化学需要一章节一章节的复习,然后做课后习题,这样有助于理解,重复看书,重复做题,吃透每章节的内容,只有这样才会在看后续章节时不会不知所云。复习物理化学花的时间就多了,两本物理化学书我是从5月份看到了八月底,当然这期间也有一些耽误,比如复习期末考试,暑假休息半个月,总的算来花了三个月把书本拉通看了一遍。最重要的是在这期间无机化学不能丢下,虽然不像四月份那样每天看,但是需要时常翻翻书,看一看比较难理解的章节,如原子结构和元素周期律,化学键理论和配位化学那几章,顺带做做题。这样到九月开学时几乎就把无机化学上册搞定了,物理化学也有了个大概的了解。对于这期间花在专业课上的时间应该每天不少于三小时吧,而且是连续的三小时,这样有助于系统复习。 九月开学后就要安排全程复习了,无论是公共课还是专业课,具体时间安排因人而异,自己感觉难的科目可以多安排点时间,复习顺利的科目少花点时间,
厦门大学2004级无机化学二期中考试试题 厦门大学“无机化学(二)”课程试卷 化学化工学院化学、材料系2004年级化学各专业 试卷类型:(A卷) 班级姓名分数 一、选择题 ( 共18题 35分 ) 1. 2 分 InCl2为逆磁性化合物,其中In的化合价为…………………………………………() (A) +1 (B) +2 (C) +3 (D) +1和+3 2. 2 分 下列氢化物中,在室温下与水反应不产生氢气的是…………………………………() (A) LiAlH4 (B) CaH2 (C) SiH4 (D) NH3 3. 2 分 和水反应得不到H2O2的是……………………………………………………………() (A) K2O2 (B) Na2O2 (C) KO2 (D) KO3 4. 2 分 下列物质的水解产物中既有酸又有碱的是…………………………………………() (A) Mg3N2 (B) SbCl5 (C) POCl3 (D) NCl3 5. 2 分 有关H3PO4、H3PO3、H3PO2不正确的论述是…………………………………() (A) 氧化态分别是+5,+3,+1 (B) P原子是四面体几何构型的中心 (C) 三种酸在水中的离解度相近 (D) 都是三元酸 6. 2 分 下列各组化合物中,都有颜色的一组化合物是……………………………………() (A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2 (C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS 7. 2 分 下列化合物中最稳定的是……………………………………………………………() (A) Li2O2 (B) Na2O2 (C) K2O2 (D) Rb2O2 8. 2 分 1 mol 下列各物质溶于1 dm3水中,生成的溶液中H+ 浓度最高的是……………() (A) SO3 (B) P4O10 (C) HF (D) MgH2 9. 2 分 对于H2O2和N2H4,下列叙述正确的是………………………………………………() (A) 都是二元弱酸 (B) 都是二元弱碱 (C) 都具有氧化性和还原性 (D) 都可与氧气作用 10. 2 分
无机化学练习答案(六)元素化学班级姓名得分 一、选择题:(单选,每题1分,共30分) 1、下列物质中,稳定性最强的物质是------------------------------------------------------------( B ) A. KClO B. KClO3 C. HClO D. HClO3 2、在地壳中,丰度(按原子百分比)最大的四种元素排列是----------------------------------( C ) A. O, Si, Al, H B. O, H, Al, Si C. O, H, Si, Al D. O, Al, H, Si 3.下列物质中酸性最强的是--------------------------------------------------------------------------(D ) A. HClO B. HClO2 C. HClO3 D. HClO4 4.在氯水中加入下列物质(或操作),有利于氯水反应的是-------------------------------( B ) A.硫酸 C. NaCl D. 放在黑暗处 5.能形成酸雨的气体是--------------------------------------------------------------------------------( B ) A. O3 B. SO2 C. CO2 D. 氟利昂 6.既有氧化性,又有还原性,但是氧化性为主的二元弱酸是------------------------------ ( B ) A. H2S 2 C. H2SO3 D. H2S2O3 7、下列物质最易被氧化的是---------------------------------------------------------------------( B ) A. SO2 3 C D.无法判断 8.能溶于稀盐酸()的下列硫化物是-----------------------------------------------( B )
氮族元素 1. 从N2分子的结构如何看出它的稳定性?哪些数据可以说明N2分子的稳定性? 2. NF3的沸点低(-129℃),且不显碱性,而NH3沸点高(-33℃)却是众所周知的路易斯碱。请说明它们挥发性差别如此之大及碱性不同的原因? 3. 为什么在化合物分类中往往把铵盐和碱金属盐列在一起? 4. 加热固体的碳酸氢铵,氯化铵,硝酸铵和硫酸铵将发生什么反应?写出有关反应方程式。 5. 写出联氨、羟氨、氨基化钠和亚氨基化锂的分子式,指出它们在常温下存在的状态及其特征化学性质。将联氨选作火箭燃剂的根据是什么? 6. 为什么亚硝酸和亚硝酸盐既有还原性,又有氧化性?试举例说明。 7. 比较亚硝酸在不同介质中的氧化还原性。 8. 为什么硝酸在不同浓度时被还原的程度大小,并不是和氧化性的强弱一致的?比如,浓HNO3通常被还原为NO2只得一个电子,而氧化性较差的稀HNO3却被还原为NO得3个电子。 9. 提供实验室制取氮气的二种方法,并写出相应的反应方程式。 10. 写出钠、铅、银等金属硝酸盐热分解反应方程式。 11. 在P4分子中P-P-P键的键角约为多少?说明P4分子在常温下具有高反应活性的原因? 12. 通常如何存放金属钠和白磷,为什么? 13. 试讨论为什么PCl3的水解产物是H3PO3和HCl,而NCl3的水解产物却是HOCl和NH3? 14. 讨论H3PO4的分子结构,挥发性和酸性强弱。从结构上判断下列酸的强弱: H3PO4 H4P2O7 HNO3 15. 固体五氯化磷是由阴、阳离子组成的能导电的离子型化合物,但其蒸
气却是分子型化合物。试画图确定固态离子和气态分子的结构及杂化类型。 16. 写出由PO43-形成P4O124-聚合物的平衡方程式。 17. 为什么磷酸在分析化学中可用掩蔽Fe3+离子? 18. 在Na2HPO4和NaH2PO4溶液中加入AgNO3溶液均析出黄色沉淀?而在PCl5完全水解后的产物中,加入AgNO3只有白色沉淀,而无黄色沉淀,试对上述事实加以说明。 19. 在地球电离层中,可能存在下列五种离子,你认为哪一个最稳定?为什么? N2+ NO+ O2+ Li2+ Be2+ 20. 砒霜的分子式是什么?比较As2O3、Sb2O3、Bi2O3及它们的水化物酸碱性,自As2O3到Bi2O3递变规律如何? 21. 讨论SbCl3和BiCl3的水解反应的产物。 22. 为什么铋酸钠是一种很强的氧化剂?As、Sb、Bi三元素的+3、+5氧化态化合物氧化还原性变化规律如何? 23. As、Sb、Bi三元素的硫化物分别在浓HCl、NaOH或Na2S溶液里的溶解度如何?它们的硫代酸盐生成与分解情况如何? 24. 画出PF5、PF6-的几何构型。 25. 分别往Na3PO4溶液中加过量HCl,H3PO4,CH3COOH,问这些反应将生成磷酸还是酸式盐? 26. Sb2S3能溶于Na2S或Na2S2,而Bi2S3既不能溶于Na2S,也不能溶于Na2S2。请根据以上事实比较Sb2S3,Bi2S3的酸碱性和还原性。 27. 用电极电势说明:在酸性介质中Bi(Ⅴ)氧化Cl-为Cl2,在碱性介质中Cl2可将Bi(Ⅲ)氧化成Bi(Ⅴ)。 28. 如何鉴定NO2-和NO3-?NO3-和PO45-? 30.(1)计算0.1mol·L-1 K2HPO4,KH2PO4,K3PO4溶液的pH值。(2)计算KH2PO4和等体积、等摩尔K3PO4混合液的pH值。 31. 试说明H4P2O7的酸性比H3PO3强?
第十二章ds区元素 12.1 铜族元素.................................................................................................. 错误!未定义书签。 12.2 锌族元素.................................................................................................. 错误!未定义书签。 12.1 铜族元素 12.1.1 铜族元素通性 铜族元素 1.铜族元素通性 铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高。 对于Cu、Ag、Au,Δ(I2-I1)Au < Δ(I2-I1)Cu < Δ(I2-I1)Ag 所以常见氧化态物+3,+2,+1。 铜、银、金的标准电势图如下所示: 12.1.2 铜族元素金属单质 2.铜族元素金属单质 (1).物理性质 铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。这可能与d电子也参与形成金属键有关。由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。 (2).化学性质 铜族元素的化学活性远较碱金属低,并按Cu--Ag--Au的顺序递减。 在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。铜绿可防止金属进一步腐蚀,其组成是可变的。银和金不会发生该反应。 空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。() 在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。但当有空气存在时,铜可缓慢溶解于这些稀酸中:
第十五章f区元素 15.1 镧系锕系元素概述 (1) 15.2 镧系收缩及后果 (3) 15.3 镧系元素化合物 (5) 15.1 镧系锕系元素概述 15.1.1 名称、符号和电子层构性 1.名称和符号 周期表中有两个系列的内过渡元素,即第六周期的镧系和第七周期的锕系。镧系包括从镧(原子序数57)到镥(原子序数为71)的15种元素;锕系包括从锕(原子序数89)到铹(原子序数103)的15种元素。 2.电子层构型 镧系、锕系电子层构型比较复杂,第三层4f、5f轨道上。 表15-1 镧系元素原子的电子层结构
从表15-1可知,除镧原子外,其余镧系元素原子的基态电子层结构中都有f电子。镧虽然没有f电子,但它与其余镧系元素在化学性质上十分相似。镧系元素最外两个电子层对4f轨道有较强的屏蔽作用,尽管4f能级中电子数不同,它们的化学性质受4f电子数的影响很小,所以它们的化学性质很相似。 【问题】为什么La最外层电子构型不是4f16s2,而是4f05d16s2; Gd最外层电子构型不是4f86s2,而是4f75d16s2? 根据洪特规则,电子处于半满、全空时较为稳定。 15.1.2 电子层结构与氧化态 表15-2 锕系元素原子的电子层结构
3.氧化态 镧系元素前三级电离势之和是比较低的,比某些过渡元素要低。如: 而且无论在酸性还是碱性介质中,值的比较小,因此镧系金属在水溶液中容易形成+3价离子。+3是镧系元素特征氧化态。 镧系中有些元素还存在除+3价以外的稳定氧化态。Ce、Pr、Tb、Dy常呈现+4氧化态,而Sm、Eu、Tm、Yb则呈现+2价氧化态。(为什么?) 这是因为它们的离子电子结构保持或接近半充满或饱满状态。 15.2 镧系收缩及后果 1.镧系收缩现象 镧系元素的原子(离子)半径,随着原子序数的增大而缩小,这种现象称为镧系收缩。
厦门大学无机化学习题 11氧族元素 https://www.doczj.com/doc/dc9418719.html,work Information Technology Company.2020YEAR
氧族元素 1.少量Mn2+可以催化分解H2O2,其反应机理解释如下:H2O2能化Mn2+为 MnO2,后者又能使H2O2氧化,试用电极电势说明上述解释的合理性? 并写出离子反应方程式。 2. 3.为什么SF6的水解倾向比SeF6和TeF6要小得多? 4. 5.解释下列事实: (1)将H2S通入Pb(NO3)2溶液得到黑色沉淀,再加H2O2,沉淀转为白色。 (2)把H2S通入FeCl3溶液得不到Fe2S3沉淀。 (3)通H2S入FeSO4溶液不产生FeS沉淀,若在FeSO4溶液中加入一些氨水(或NaOH溶液),再通H2S则可得到FeS沉淀。 (4)在实验室内H2S、Na2S和Na2SO3溶液不能长期保存? (5)纯H2SO4是共价化合物,却有较高的沸点(675K)。 (6)稀释浓H2SO4时一定要把H2SO4加入水中,边加边搅拌而稀释浓HNO3与HCl没有这么严格规定,为什么? 6.以Na2CO3和硫磺为原料,怎样制取Na2S2O3,写出有关的反应式。 7.有四种试剂:Na2SO4、Na2SO3、Na2S2O2、Na2S,其标签已脱落,设计一 个简单方法鉴别它们。 8.写出下列反应方程式 (1)用盐酸酸化多硫化铵溶液 (2)H2O2+H2S → (3)Ag++S2O32-→ (4)Na2S2O8+MnSO4→ (5)H2S+Br2→ (6)H2S+I2→
(7)Te+ClO3-→ (8)H2O2+S2C82-→ (9)H2O2+PbS → (10)H2O2+KMnO4→ (11)Na2S2O3+Cl2→ (12)Na2S2O3+I2→ (13)SO2+Cl2+H2O → 9.确定O3的结构,如何利用特征反应来鉴别O3写出有关反应方程式。 10. 11.SO2与Cl2的漂白机理有什么不同? 12. 13.试确定SO2的结构,它能作为路易斯酸吗为什么请举例加以说明。说明 为什么SOCl2既是路易斯酸又是路易斯碱?画出它们的空间结构图。 14. 15.硫代硫酸钠在药剂中可作解毒剂,可解卤素(如Cl2)、重金属离子 (如Hg2+)中毒。试说明它作为解毒剂的作用原理及反应生成的主要产物有哪些? 16. 17.SF6和C10H22(癸烷)质量相近,它们的沸点也相近吗为什么 18. 19.工业上制取Na2S2O3是将Na2SO3和硫粉在水溶液中加热反应制得。在硫 粉与Na2SO3混合前一般先用少量乙醇润湿其作用是什么? 20. 21.许多有氧和光参加的生物氧化过程及染料光敏氧化反应过程中都涉及单 线态氧。那么单线态氧是指处于何种状态的氧? 22.在酸性的KIO3溶液加入Na2S2O3可能有哪些反应发生?写出有关反应方 程式。 23.
化学平衡 1、反应NO 2(g ) 2 1O 2(g) + NO (g )在某温度下(设T=300K )的?p K =1.2×10-2,计算该温度下,下面两个反应的? p K 。 ① 2NO 2(g ) O 2(g)+2NO (g ) ② 3NO (g )+ 23O 2(g) 2NO 2(g ) 2、CO (g )+2 1O 2(g) CO 2(g ),计算: ①反应的? m rG ?; ② 25℃的?p K ③ 100℃的? m rG ?及?p K ; 3、计算反应NiSO 4·6H 2O= NiSO 4(S)+6H 2O(g)的? m rG ?及? p K 。 已知:?m f G ?分别为-2222 KJ/mol ,-773.6 KJ/mol, -225.9 KJ/mol ; 4、PCl 5加热后它的分解反应式为: PCl 5(g ) PCl 3(g)+Cl 2(g) 在10升密闭容器中2mol PCl 5,某温度时有1.5mol 分解,求该温度下的平衡常数。若在该密闭容器中通入1mol Cl 2后,有多少摩尔PCl 5分解。 5、PCl 5加热分解为PCl 3和Cl 2,将2.659克PCl 5装入1升容器中,在523K 时达到平衡后,总压力为101.3KPa 求PCl 5的分解率、K P 和? P K 。 6、5升容器中装入等摩尔数的PCl 3和Cl 2。在523K 时达到平衡,如PCl 5的分压为101.3 KPa ,此时:PCl 5(g )3(g) + Cl 2(g) 反应的K P =185 KPa ,问原来装入的PCl 3和Cl 2为若干摩尔? 7、CuSO 4的风化若用式CuSO 4·5H 2O (s ) CuSO 4(s )+5H 2O (g )表示。 ① 求25℃时的?m rG ?及? P K ② 在25℃,若空气中水蒸气相对湿度为60%,在敞开容器中上述反应的ΔG 是多少?此时CuSO 4·5H 2O 是否会风化?(25℃ O H 2P =3.167 KPa ) 8、NH 4Cl 按下式分解: NH 4Cl (s ) NH 3(g )+ HCl(g) 298K 时,?m rG ?=+92KJ/mol ,求上述平衡体系中的总压力。 9、已知C (s )+ CO 2(g )
第八章s区元素 8.1 S区元素概述 (1) 8.2 S区元素的一些规则 (3) 8.3 重要单质与化合物 (10) 8.4 制备 (18) 8.5 S区元素的生物作用 (20) 8.1 S区元素概述 8.1.1 碱金属 S区元素价电子构性、氧化还原性及其变化规律 S区元素包括周期系中的ⅠA族-碱金属和ⅡA族-碱土金属。 表8-1 ⅠA和ⅡA的特征氧化态为+1和+2,但还存在低氧化态,如等。 从标准电极电势(E),均具有较大的负值。金属单质都是强的还原剂,如纳、钾、钙等常用作化学反应的还原剂。 表8-2 S区元素电极电势
由于它们都是活泼的金属元素,只能以化合状态存在于自然界。如钠和钾的主要来源分别为熔盐NaCl 、海水;天然氯化钾、光卤石KCl·MgCl 2·6H 2O 等。钙和镁主要存在于白云石 、方解石 、菱镁矿 、石膏 等矿物中, 锶和钡的矿物有天青石 和重晶石 等。 岩盐 白云石 菱镁矿 重晶石 8.1.2 碱土金属 2.碱土金属 碱金属和碱土金属元素在化合时,多以形成离子键为主要特征。氢氧化物除具 有两性, 为中强碱外,其他均是强碱。 【问题1】铍与锂具有一定的共价性,为什么? 由于锂和铍原子半径和离子半径小,且为2电子构型,有效核电荷大,极化力强,因此它们的化合物,具有一定的共价性。 碱金属元素的原子也可以共价键结合成分子,如等碱金属单质的双原子分子就是共 价分子。 IA 和IIA 族金属的一些基本性质列于表中。 表8-3 碱金属与碱土金属的基本性质
【问题2】为什么ⅡA 金属的熔沸点升华热高于IA ?ⅡA 离子水合放热更多? 因为ⅡA 金属中有两个电子参与形成金属键,金属键较强,所以熔沸点及升华热均高于IA 。ⅡA 离子带有两个正电荷,更容易与水结合,会放出更多的热量。 8.2 S 区元素的一些规则 8.2.1 对角线规则(1) 锂和镁的相似性 S 区元素的一些规律 1.对角线规则 第二周期元素Li 、Be 、B 的性质和第三周期处于对角位置的元素Mg 、Al 、Si 一一对应,它们的相似性称为对角线规则。 (1).锂和镁的相似性 a.锂、镁在氧气中燃烧,均生成氧化物( 和 ),不生成过氧化物。 b.锂、镁在加热时直接和氮反应生成氮化物(和 ),而其它碱金属不能和氮作 用。
氧族元素 1. 少量Mn2+可以催化分解H2O2,其反应机理解释如下:H2O2 能化Mn2+为MnO2,后者又能使H2O2氧化,试用电极电势说明上述解释的合理性?并写出离子反应方程式。 2. 为什么SF6的水解倾向比SeF6和TeF6要小得多? 3. 解释下列事实: (1)将H2S通入Pb(NO3)2溶液得到黑色沉淀,再加H2O2,沉淀转为白色。 (2)把H2S通入FeCl3溶液得不到Fe2S3沉淀。 (3)通H2S入FeSO4溶液不产生FeS沉淀,若在FeSO4溶液中加入一些氨水(或NaOH溶液),再通H2S则可得到FeS沉淀。 (4)在实验室内H2S、Na2S和Na2SO3溶液不能长期保存?(5)纯H2SO4是共价化合物,却有较高的沸点(675K)。(6)稀释浓H2SO4时一定要把H2SO4加入水中,边加边搅拌而稀释浓HNO3与HCl没有这么严格规定,为什么? 4. 以Na2CO3和硫磺为原料,怎样制取Na2S2O3,写出有关的反 应式。 5. 有四种试剂:Na2SO4、Na2SO3、Na2S2O2、Na2S,其标签已 脱落,设计一个简单方法鉴别它们。 6. 写出下列反应方程式 (1)用盐酸酸化多硫化铵溶液 (2)H2O2+H2S → (3)Ag++S2O32-→ (4)Na2S2O8+MnSO4 → (5)H2S+Br2 → (6)H2S+I2 → (7)Te+ClO3- →
(8)H2O2+S2C82- → (9)H2O2+PbS → (10)H2O2+KMnO4 → (11)Na2S2O3+Cl2 → (12)Na2S2O3+I2 → (13)SO2+Cl2+H2O → 7. 确定O3的结构,如何利用特征反应来鉴别O3?写出有关反应 方程式。 8. SO2与Cl2的漂白机理有什么不同? 9. 试确定SO2的结构,它能作为路易斯酸吗?为什么?请举例 加以说明。说明为什么SOCl2既是路易斯酸又是路易斯碱? 画出它们的空间结构图。 10. 硫代硫酸钠在药剂中可作解毒剂,可解卤素(如Cl2)、重金 属离子(如Hg2+)中毒。试说明它作为解毒剂的作用原理及反应生成的主要产物有哪些? 11. SF6和C10H22(癸烷)质量相近,它们的沸点也相近吗?为什 么? 12. 工业上制取Na2S2O3是将Na2SO3和硫粉在水溶液中加热反应 制得。在硫粉与Na2SO3混合前一般先用少量乙醇润湿其作用是什么? 13. 许多有氧和光参加的生物氧化过程及染料光敏氧化反应过程 中都涉及单线态氧。那么单线态氧是指处于何种状态的氧? 14. 在酸性的KIO3溶液加入Na2S2O3可能有哪些反应发生?写出 有关反应方程式。 15. 一种钠盐A溶于水后,加入稀HCl,有刺激性气体B产生,同 时有黄色沉淀C析出,气体B能使KMnO4溶液褪色。若通Cl2于A溶液中,Cl2消失并得到溶液D,D与钡盐作用,产生白色沉淀E。试确定A、B、C、D、E各为何物?并写出各步的反
一选择题 1、下列金属单质,硬度最大的是 A.Fe B.Cr C.Cs D.W 2、下列酸中氧化性最强的是 A、HCl B、HClO C、HClO3 D、HClO4 3、能与SCN- 生成血红色溶液的离子是 A、Ca2+ B、Mn2+ C、Fe2+ D、Fe3+ 4、往某卤化物溶液中加入氯水和四氯化碳并振荡,四氯化碳层显示紫色,则该卤化物是 A、氟化物 B、氯化物 C、溴化物 D、碘化物 5、下列物质中能与CO2反应放出氧气的是 A、Na2O B、K2O C、KOH D、KO2 6、下列金属能溶解在液氨中的是 A、K B、Cu C、Zn D、Fe 7、d区元素的价层电子组态通式是 A、(n-1)d10ns2 B、(n-1)d1-9ns2 C、(n-1)d1-9ns1-2 D、(n-1)d10ns1-2 8、下列元素中不属于过渡金属元素的是 A、Cr B、Mn C、Ni D、Mg 9、下列酸中,酸性最强的是 A、HClO4 B、H2SO4 C、H3PO4 D、H4SiO4 10、配制FeSO4溶液时,必须在稀硫酸溶液中加入少量的 A、FeCl3 B、FeO C、Fe2O3 D、铁钉 11、下列排列顺序中,符合氢卤酸还原性递减顺序的是 A、HF,HCl,HBr,HI B、HI,HBr,HCl,HF, C、HF,HBr,HCl,HI D、HI,HCl,HBr,HF 12.钠的液氨溶液呈深蓝色且能导电,一般认为溶液中含有 A、NH4+和NH2- B、Na+和NH2- C、NH4+和e- D、Na+(NH3)y和e- (NH3)x 13.下列各酸酸性强弱次序排列正确的是
A、HF>HCl>HBr B、H3PO4>H2SO4>HClO4 C、HClO>HClO3>HClO4 D、HClO 第一章化学热力学初步 1.1 热力学第一定律 1.1.1 基本概念 前言:热力学是研究热能和机械能以及其它形式能量之间转换规律的一门科学,用热力学的理论和方法研究化学则产生了化学热力学。化学热力学可以解决化学反应中能量变化问题进行的限度等问题。化学热力学在讨论物质的变化时,着眼于宏观性质的变化,不需涉及物质的微观结构,即可得到许多有用的结论,运用化学热力学方法研究化学问题时,只需知道研究对象的起始状态和最终状态而无需知道变化过程的机理,即可对许多过程的一般规律加以探讨。 一、热力学第一定律 1.基本概念 (1).环境和体系:热力学中称研究对象为体系,称体系以外的其它部分为环境。 例:研究杯中的水则水是体系,水面以上空气,盛水的杯子,乃至放杯子的桌子等都是环境。 按照体系与环境之间的物质和能量的交换关系,通常将体系分为三类: 敞开体系:体系与环境之间既有能量交换又有物质交换。 封闭体系:体系与环境之间有能量交换但没有物质交换。 孤立体系:体系与环境之间既无能量交换又无物质交换。 例:在一敞开杯中盛满热水,以热水为体系则是一敞开体系。降温过程中体系向环境放出热量,又不断有水分子变为水蒸气逸出。若在杯上加一个盖子则避免理论与环境间的物质交换。于是得到一个封闭体系。若将杯子换成一个理想保温杯杜绝了能量交换,于是得到一个孤立体系。 (2).状态和状态函数 状态:由一系列表征体系的物理量所确定下来的体系的存在形式,称为体系的状态。 状态函数:籍以确定体系状态的物理量。例:某理想气体,其物质的量n=1mol,压强p=1.013×105Pa,体积V=22.4L,温度T=273K。我们说它处于标准状态。P、V、T和n就是体系的状态函数。 无机化学(一)教学大纲 绪论(1学时) 第一章化学热力学初步(5学时) 1.1 热力学基本概念:状态与状态函数;过程与途径;热力学第一定律。 1.2 热化学:化学反应的热效应;恒容反应热Qρ和恒压反应热Qν;焓与反应焓变ΔH;热化学方程式的写法;几种反应焓 的计算方法:盖斯定律,由标准生成焓计算反应焓,由燃烧热计算反应焓,由键能估算反应焓。 1.3 化学反应的方向:反应的自发性;熵的初步概念;Gibbs自由能与ΔG;吉布斯—赫姆霍兹方程ΔG=ΔH-TΔS应用 第二章化学平衡(3学时) 2.1 化学平衡常数:可逆反应;化学平衡定律;经验平衡常数与热力学平衡常数;转化率。 2.2 化学平衡常数和自由能变:等温方程;化学平衡常数和标准自由能变 2.3 化学平衡移动:压力、浓度对化学平衡的影响;温度对化学平衡的影响 第三章化学反应速率(3学时) 3.1 反应速率定义及表示法:平均速度;瞬时速率。 3.2 反应速度理论简介:碰撞理论;过渡状态理论。 3.3 影响反化学反应速度的因素:基元反应与非基元反应;浓度对化学反应速率的影响 (零级、一级反应、二级反应);温度对化学反应速率的影响;催化剂对化学反应速率的影响。 第四章酸碱电离平衡(5学时) 4.1 酸碱理论简介:酸碱质子理论;酸碱电子理论。 4.2 强电解质溶液:离子氛;活度。 4.3 弱电解质的电离平衡:一元弱酸弱碱的电离平衡与pH值求算;多元弱酸弱碱的电离平衡与pH值求算;同离子效应、盐 效应;盐类水解。 4.4 缓冲溶液:定义;pH值求算;应用 第五章沉淀溶解平衡(2学时) 5.1 溶度积常数:溶度积原理;溶度积和溶解度的相互换算 5.2 沉淀与溶解的相互转化:多重平衡常数;沉淀-溶解计算 第六章核化学(2学时) 6.1 核衰变 6.2 核裂变 6.2 核聚变 第七章氧化还原反应(7学时) 7.1 基本知识与氧化还原反应式的配平 7.2 电极电位和电池电动势:原电池和电极电位;电极类型与原电池的简易表示法;标准氢电极与标准电极电势;标准电 极电位表的应用。 7.3 电池电动势(E池)与反应的自由能变(ΔG):E池与ΔG的关系;平衡常数K与的关系。 7.4 电池电动势与浓度的关系:能斯特方程式;能斯特方程式的应用。 元素化学重点内容合集 目录 元素化学通论 (2) 元素的存在 (8) 单质的制取 (10) 颜色 (14) 鉴定与测定 (18) 重要化合物的制取 (20) 特殊性质 (23) 毒性物质及处理 (26) 无机化学命名中特定的词头的含义 (28) 元素化学通论 一,含氧酸强度 1,R-O-H规则:含氧酸在水溶液中的强度决定于酸分子中质子转移倾向的强弱,质子转移倾向越大,酸性越强,反之则越弱。而质子转移倾向的难易程度,又取决于酸分子中R吸引羟基氧原子的电子的能力,当R的半径较小,电负性越大,氧化数越高时,R吸引羟基氧原子的能力强,能够有效的降低氧原子上的电子密度,使O-H键变弱,容易放出质子,表现出较强的酸性,这一经验规律称为R-O-H规律。 1)同一周期,同种类型的含氧酸(如HnRO4),其酸性自左向右依次增强。 如:HClO4>H2SO4>H3PO4>H4SiO4 2)同一族中同种类型的含氧酸,其酸性自上而下依次减弱。 如:HClO>HBrO>HIO 3)同一元素不同氧化态的含氧酸,高氧化态含氧酸的酸性较强,低氧化态含氧酸的酸性较弱。 如:HClO4>HClO3>HClO2>HClO 2,Pauling规则:含氧酸的通式是RO n(OH)m,n为非氢键合的氧原子数(非羟基氧),n值越大酸性越强,并根据n值把含氧酸分为弱酸(n=0),中强酸(n=1),强酸(n=2),极强酸(n=3)四类。因为酸分子中非羟基氧原子数越大,表示分子中R→O配键越多,R的还原性越强,多羟基中氧原子的电子吸引作用越大,使氧原子上的电子密度减小的越多,O-H键越弱,酸性也就越强。注意:应用此规则时,只能使用结构式判断,而不能使用最简式。 3,含氧酸脱水“缩合”后,酸分子内的非氢键合的氧原子数会增加,导致其酸性增强,多酸的酸性比原来的酸性强。 二,含氧酸稳定性 1,同一元素的含氧酸,高氧化态的酸比低氧化态的酸稳定。如:HClO4>HClO3>HClO2>HClO 2,氧化还原性: 1)同一周期主族元素和过渡元素最高价含氧酸氧化性随原子序数递增而增强。 如:H4SiO4厦门大学无机化学第01章 化学热力学初步
厦门大学无机化学教学大纲
考研无机化学-元素化学记忆内容汇总