
复方阿米三嗪片
(萝巴新)
(二甲硫酸阿米三嗪)
3
3
≯410
≯215
萝巴新3≯3≯115盐酸马普替林3≯2≯110
盐酸米托蒽醌3≯3≯710
盐酸异丙嗪片4 ≯215盐酸异丙嗪注射液4 ≯215盐酸雷尼替丁4 ≯215
盐酸雷尼替丁片4 ≯410盐酸雷尼替丁胶囊4 ≯410
盐酸雷尼替啶注射液4 ≯610盐酸萘甲唑林3 ≯210
柳氮磺吡啶4 ≯410 配制对照品溶液检查已知杂质的品种有盐酸乙胺丁醇、盐酸小檗碱、盐酸左旋咪唑、盐酸吗啡、癸氟奋乃静和氯硝西洋等40余个。此外配制自身稀释对照溶液和配制对照品溶液,用以检查未知杂质及已知杂质并控制杂质斑点数的品种有盐酸氯米帕明(杂质斑点≯4个)和贝诺酯(杂质斑点≯4个)。
本版药典在薄层色谱法中增加了系统适用性试验和测定法,上述列举的国内外药典的实例可供采用薄层色谱法作为鉴别与有关物质测定的品种正文,在修订或方法研究时参考,可根据品种自身的特点与具体情况,选择系统适用性试验项下的有关要求订入标准中,以使检测方法严谨和完善,确保方法的准确性和重现性,以利于药品质量控制。
《中国药典》2005年版(二部)残留溶剂检查法介绍
胡昌勤 刘颖(中国药品生物制品检定所,北京100050)
I n troduction of Residua l Solven ts Test i n Ch i nese Pharmacopoe i a2005Ed ition(Volu m e ) H u Changqin and L iu Y ing(N ational Institu te f or the Control of P har m aceu tical and B iolog ical P rod ucts,B eij ing100050)
药品中的残留溶剂系指在原料药、辅料以及制剂生产中使用的,但在工艺过程中未能完全去除的有机挥发性化合物。I CH(人用药品注册技术要求国际协调会)对残留溶剂的这一定义,明确了药品中残留溶剂的最基本特征,同时也包含了药品残留溶剂的测定具有如下特点:(1)残留溶剂的种类相对固定(I CH规定了69种);(2)在具体样品中具有不确定性;(3)残留量相对较低,一般在痕量或微量范围;
(4)同一样品中不同溶剂的残留量相差较大。因此各国药典对残留溶剂的测定均为限度实验,并根据生产工艺确定检测对象。中国药典2000版附录的残留溶剂测定法,仅对苯、氯仿、二氧六环、二氯甲烷、吡啶、甲苯、环氧乙烷等7种残留溶剂作出了具体规定。2005版附录对此进行了较大的修订,主要概括为:(1)残留溶剂的控制种类和限度与I CH一致;
(2)根据具体品种的生产工艺确定控制对象;(3)检测方法推荐采用顶空毛细管气相色谱法。
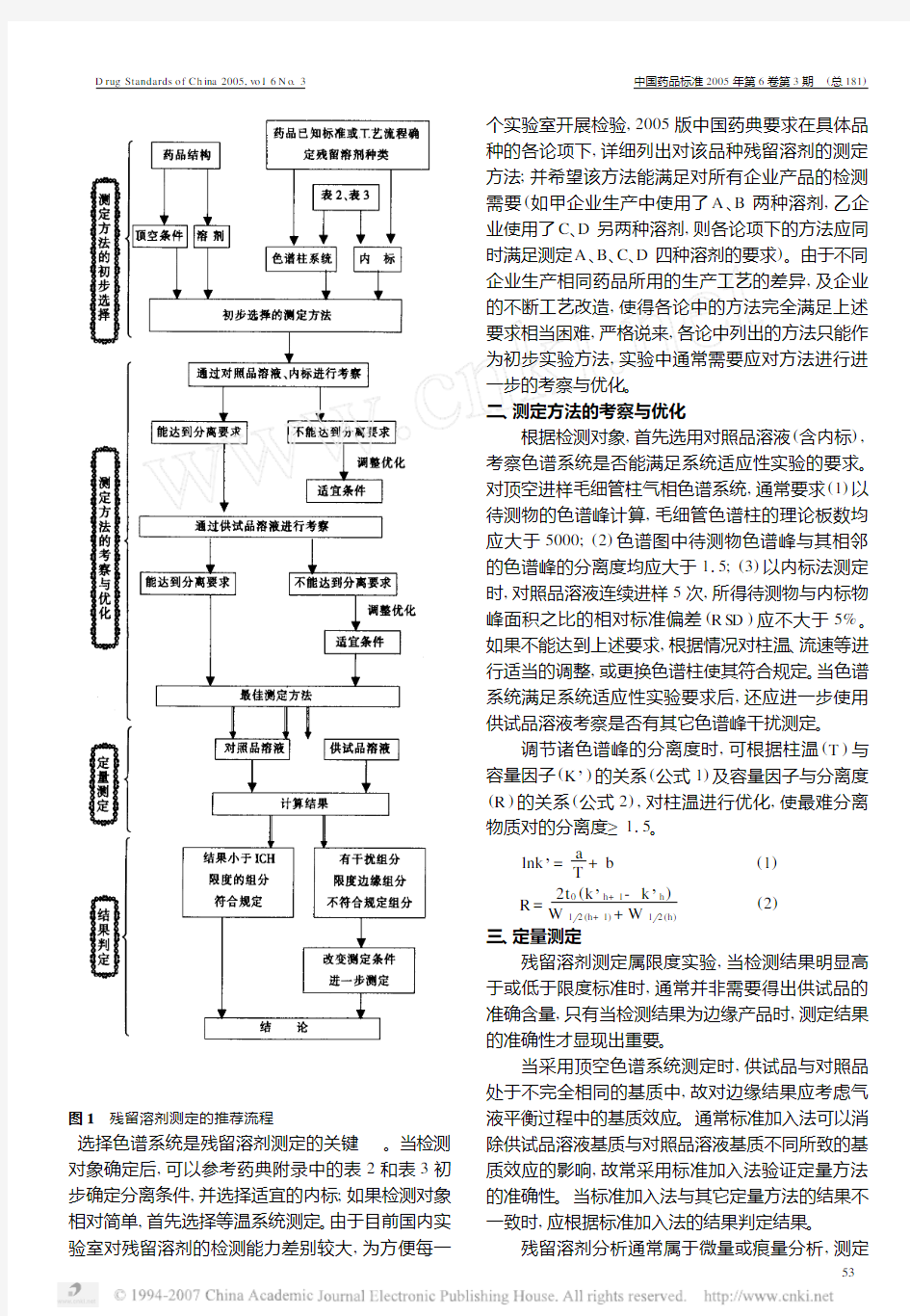
实际应用中,虽然残留溶剂的具体检测对象仅约70种,但它们可能以不同的组合存在于不同的药物中,增加了检测的复杂性。目前,理想的残留溶剂检测过程(如图1)所示,整个过程分为4个阶段。本文将每一阶段的关键及注意事项综述如下:一、测定方法的初步选择
在此步骤,首先应根据产品的工艺流程确定检测的对象;再依据待测药品的溶解性选择适宜的溶剂系统,制备供试品溶液;根据药物的结构及供试品溶液的特点确定顶空条件。
由于在溶解不完全或处于混悬液状态下,供试品顶空进样测定的重复性较差,故在残留溶剂测定之前应使供试品处于完全溶解状态。对水溶性药品,通常以水为溶剂;当药品不溶于水,但可溶解于一定浓度的酸或碱液中时,可采用酸或碱液为溶剂;对于非水溶性药物,可采用N,N2二甲基甲酰胺(DM F)或二甲基甲砜(DM SO)为溶剂。采用酸或碱液为溶剂时,应避免酸或碱对供试液的过度降解,防止药物降解后产生的共出峰干扰。
供试品中的未知杂质或其挥发性热降解物易对残留溶剂的测定产生干扰。干扰作用包括供试液中未知杂质或其挥发性热降解物与待测物的保留值相同(共出峰干扰);或热降解产生与待测物结构相同的产物(如含烷氧基化合物热裂解可能产生相应的醇)。为避免热降解所致的各类干扰,顶空温度一般不宜超过70℃。
25
图1 残留溶剂测定的推荐流程
选择色谱系统是残留溶剂测定的关键。当检测对象确定后,可以参考药典附录中的表2和表3初步确定分离条件,并选择适宜的内标;如果检测对象相对简单,首先选择等温系统测定。由于目前国内实验室对残留溶剂的检测能力差别较大,为方便每一个实验室开展检验,2005版中国药典要求在具体品种的各论项下,详细列出对该品种残留溶剂的测定方法;并希望该方法能满足对所有企业产品的检测需要(如甲企业生产中使用了A、B两种溶剂,乙企业使用了C、D另两种溶剂,则各论项下的方法应同时满足测定A、B、C、D四种溶剂的要求)。由于不同企业生产相同药品所用的生产工艺的差异,及企业的不断工艺改造,使得各论中的方法完全满足上述要求相当困难,严格说来,各论中列出的方法只能作为初步实验方法,实验中通常需要应对方法进行进一步的考察与优化。
二、测定方法的考察与优化
根据检测对象,首先选用对照品溶液(含内标),考察色谱系统是否能满足系统适应性实验的要求。对顶空进样毛细管柱气相色谱系统,通常要求(1)以待测物的色谱峰计算,毛细管色谱柱的理论板数均应大于5000;(2)色谱图中待测物色谱峰与其相邻的色谱峰的分离度均应大于115;(3)以内标法测定时,对照品溶液连续进样5次,所得待测物与内标物峰面积之比的相对标准偏差(R SD)应不大于5%。如果不能达到上述要求,根据情况对柱温、流速等进行适当的调整,或更换色谱柱使其符合规定。当色谱系统满足系统适应性实验要求后,还应进一步使用供试品溶液考察是否有其它色谱峰干扰测定。
调节诸色谱峰的分离度时,可根据柱温(T)与容量因子(K’)的关系(公式1)及容量因子与分离度(R)的关系(公式2),对柱温进行优化,使最难分离物质对的分离度≥115。
lnk’=
a
T
+b (1)
R=
2t0(k’h+1-k’h)
W1 2(h+1)+W1 2(h)
(2)
三、定量测定
残留溶剂测定属限度实验,当检测结果明显高于或低于限度标准时,通常并非需要得出供试品的准确含量,只有当检测结果为边缘产品时,测定结果的准确性才显现出重要。
当采用顶空色谱系统测定时,供试品与对照品处于不完全相同的基质中,故对边缘结果应考虑气液平衡过程中的基质效应。通常标准加入法可以消除供试品溶液基质与对照品溶液基质不同所致的基质效应的影响,故常采用标准加入法验证定量方法的准确性。当标准加入法与其它定量方法的结果不一致时,应根据标准加入法的结果判定结果。
残留溶剂分析通常属于微量或痕量分析,测定
35
误差与其残留量的水平有关,2005版中国药典中没有规定平行测定时允许的相对误差范围,实际操作可参考分析化学对微量或痕量分析的要求(表1)
表1 分析化学对微量或痕量分析的误差要求
残留量(%)允许相对误差(%)
1-5<510
011-1<20
0101-011<50
01001-0101<100
四、结果判定
当测定的有机溶剂残留量超出限度时,应进一步排除是否有共出峰干扰作用的存在。根据目前的色谱理论,不同的物质对在极性不同的色谱系统中的保留行为应具有差别,因此通常采用在另一种极性相反的色谱柱系统中对相同样品进行再测定,比较不同色谱系统中测定结果的方法。如二者结果一致,则可以排除测定中有共出峰的干扰;如二者结果不一致,则表明测定中有共出峰的干扰。
如对吡柔比星中正己烷的测定,两支不同的色谱柱的测定结果相差约10倍(表2)。中极性DB2 624柱上测得的正己烷残留量约为5%,远超出限度(015%);但更换非极性SPB21柱再次测定时,正己烷残留量约为016%。比较两个柱系统的色谱图可知,吡柔比星中有未知物在DB2624柱与正己烷共出峰导致检出量偏高。故SPB21柱的测定结果较为可靠。
表2 不同色谱柱测定吡柔比星中正己烷残留量比较
色谱柱
样品批号
PS2117PS2118PS2119
DB2624柱51449%61209%41794%
SPB21柱01569%01631%01579%
五、其它注意事项
11由于相同的药品在不同的生产过程中可以使用不同的有机挥发性化合物,虽然在起草具体各论时已经尽可能的考虑了不同的生产工艺,但实际检测中仍可能检测出各论中未规定的溶剂,此时如果检出溶剂超出了2005版中国药典附录中的限度,该样品仍为不符合规定。
对实验中发现的未知色谱峰,通常可按以下步骤确定残留溶剂种类:
1-11初步判断 采用程序升温法,在非极性和极性2种柱系统条件下,按推荐的程序升温条件测定;计算未知色谱峰与丁酮的相对保留时间并与附录表3中诸溶剂的相对保留时间比较,与该相对保留时间接近的溶剂即被认为可能是该未知色谱峰;当某溶剂在2种色谱柱系统条件下均被认为可能是该未知色谱峰,则可初步判断出该未知色谱峰。
1-21确定 根据初步判断结果,选择适当的等温色谱系统,在推荐的等温条件下测定;将测得的色谱峰的相对保留时间与附录表2中的相对保留时间比较,确定药物中残留溶剂的种类。
1-31验证 在上述等温色谱系统中,通过标准加入法,进一步验证确定的药物中残留溶剂种类的正确性。
1-41必要时,采用气相2质谱联用或气相2红外光谱联用技术进一步确证。
表3 头孢唑林钠H P2FFA P柱程升实验结果
峰号T r(m in)峰面积RR T附录表3中数据可能的残留溶剂111239111016290163正己烷21139910171001711二甲氧基甲烷31155421101789无相应数据4116041130181401816丙酮521067190171104911052异丙醇621907119114761148乙腈731297111674无相应数据841222182114221102异丁醇99185411551002无相应数据10111514155184351536甲氧基苯
丁酮1197
表4 头孢唑林钠SPB21柱程升实验结果
峰号T r(m in)峰面积RR T附录表3中数据可能的残留溶剂111842112401408无相应数据22105231550145501453甲醇32171119201601无相应数据4218411921790163001628异丙醇55124611461116311169异丙醚6101039913921226无相应数据711180331662161721617甲苯8141142171733113631152氯苯9161171131431586无相应数据101815446417941112无相应数据
丁酮4151
如对头孢唑林钠中未知残留溶剂的鉴定:分别在SPB21柱和H P2FFA P柱程升条件下测定头孢唑林钠中的色谱图,其测得的色谱峰与附录表3中数据的比较(见表3和表4)。由于仅异丙醇在两个色谱系统中均被鉴别,故初步判断头孢唑林钠中的未知残留溶剂可能是异丙醇。在等温条件下与异丙醇对照品比较(图2),可以确定头孢唑林钠中的未知残留溶剂是异丙醇。
21顶空条件的选择:顶空时间一般为30~45分钟,以保证供试品溶液的气2液两相有足够的时间
45
图2 头孢唑林钠中残留溶剂等温实验色谱图
达到平衡;顶空时间过长,如超过60分钟,可能引起顶空瓶的气密性变差,导致定量准确性的降低;对采用水为溶剂制备的供试液,顶空温度不宜超过100℃,否则产生的大量水蒸气易导致顶空瓶的泄漏,使得重现性变差。此外,对照品溶液与供试品溶液必须使用相同的顶空条件。
31对含氮碱性化合物的测定,由于普通气相色谱的不锈钢管路、进样器的衬管等对有机胺等含氮碱性化合物具有较强的吸附作用,致使其检出灵敏度降低。当采用顶空进行系统测定此类化合物时,应
采用惰性的硅钢材料或镍钢材料管路;建议采用弱
极性的色谱柱或经碱处理过的色谱柱分析含氮碱性化合物,如果采用胺分析专用柱进行分析,效果更好。
41残留溶剂测定一般选择F I D 检测器,可以得
到较宽度线性范围;对含卤素元素的残留溶剂如三氯甲烷等,采用ECD 检测器,易得到更高的灵敏度。
51甲酰胺、22甲氧基乙醇、22乙氧基乙醇、乙二醇、N 2甲基吡咯烷等一般不宜用顶空进样方式测定。
玻璃酸钠注射液粘度测定及其计算方法的比较
夏 瑞 周立春(北京市药品检验所 北京
100035)
摘要 目的:采用日本药典、欧洲药典及中国药典方法对玻璃酸钠注射液进行特性粘数的测定并计算。结论:日本药局方及欧洲药典对特性粘数的测定及计算方法较中国药典严谨,但中国药典的一点法能快速解决生产上测定溶液的特性粘数的要求。关键词 玻璃酸钠;特性粘数
V iscosity M ea surem en ts of Sod iu m Hya lurona te I n jection and Com par ison Ca lcula tion for I n tr i n sic V iscosity
X ia R u i and Zhou L ichun (B eij ing
Institu te f or D rug Control ,B eij ing 100035)
Abstract Objective :In trin sic visco sity of Sodium H yalu ronate w as m easu red by U bbelohde viscom eter and calcu lated u sing JP ,ChP and EP m ethods fo r in trin sic visco sity .Conclusion :T he m easu rem en t and calcu lati on of in trin sic visco sity by JP and EP are mo re rigid than that by ChP ,bu t the m ethod of ChP is fast ,si m p le and is p rop iti ou s to m anufactu re .Key words Sodium hyalu ronate ;in trin sic visco sity
特性粘数是孤立高分子链在溶液中的流体力学
性质的表征。由此参数可获得单个高分子链的形态尺寸及溶剂化能力等的信息。所以测量特性粘数是高分子表征的重要步骤。玻璃酸钠是一种粘多糖类生物大分子物质,属关节功能改善药物和眼科辅助治疗药物。本文对玻璃酸钠注射液的特性粘数进行
了测定,并对测定数据采用不同的计算方法进行处理、比较。一、仪器和试剂
乌氏粘度计(毛细管内径为015mm ±0105mm ),恒温水槽,秒表(1 100秒);6批玻璃酸钠进口样品;由韩国L G 公司提供;生理盐水。
5
5
残留溶剂测定法
残留溶剂测定法 1 简述 药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用过,但在工艺过程中未能完全去除的有机溶剂。药物中常见的残留溶剂及限度参照《中国药典》2015年版四部通则0861附表1的规定,除另有规定外,第一、第二、第三类溶剂的残留量应符合其规定;对其他溶剂,应根据生产工艺的特点,制订相应的限度,使其符合产品质量标准的要求。本法照气相色谱法(《中国药典》2015年版四部通则0521测定。 本测定方法适用于对各论项下未收载残留溶剂检测方法的品种中残留溶剂的检验,也可用于指导建立各论项下具体品种的残留溶剂检查方法。 2 仪器和用具 2.1 气相色谱仪,带FID检测器,顶空进样器。 2.2 计算机,安装工作站软件。 2.3 色谱柱 2.3.1 毛细管柱除另有规定外,极性相近的同类色谱柱之间可以互代使用。2.3.1.1 非极性色谱柱固定液为100%的二甲基聚硅氧烷的毛细管柱。 2.3.1.2 极性色谱柱固定液为聚乙二醇(PEG-20M)的毛细管柱。 2.3.1.3 中极性色谱柱固定液为(35%)二苯基-(65%)二甲基聚硅氧烷,(50%)二苯基-(50%)二甲基聚硅氧烷,(35%)二苯基-(65%)二甲基亚芳基聚硅氧烷,(14%)氰丙基苯基-(86%)二甲基聚硅氧烷,(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱。 2.3.1.4 弱极性色谱柱固定液为(5%)苯基-(95%)甲基聚硅氧烷,(5%)二苯基-(95%)二甲基亚芳基硅氧烷共聚物的毛细管柱。 2.3.2 填充柱以直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。 3 供试品溶液和对照品溶液的制备 3.1 供试品溶液的制备 3.1.1 顶空进样除另有规定外,精密称取供试品0.1~1g;通常以水为溶剂;对于非水溶性药物,可采用N,N-二甲基甲酰胺、二甲基亚砜或其他适宜溶剂;
方案批准 注:在方案批准部分签字表明签字者同意方案中规定的检测项目检测方法和记录要求。在执行本方案的过程中可能会出现影响严格执行本方案的偏差,对较小的偏差将通过偏差报告的形式来解决,对于关键性偏差,如对方法的调整、对参数或接受标准的调整必须制定出增补方案并按照原方案批准程序得到批准才能进行。所有的偏差报告和增补方案必须在提交验证报告供批准时一同提交。 目录
1.概述 (3) 2.参考资料 (4) 3. 职责 (4) 4. 色谱系统及色谱条件 (4) 5. 器材与试剂 (5) 6. 验证试验 (5) 6.1系统适应性 (5) 6.2专属性 (6) 6.3耐用性 (7) 6.4定量限 (7) 6.5检测限 (8) 6.6线性与范围 (8) 6.7准确度 (9) 6.8精密度 (11) 7.再验证周期 (12) 8.偏差及纠正措施 (12) 9.最终审核和批准 (12) 药品残留溶剂顶空分析方法草案 (14)
1.概述 1.1根据ICH对药品中残留溶剂含量的要求及盐酸噻氯匹定生产工艺,必须控制盐酸噻氯匹定生产工艺中使用到的溶剂乙醇、丁酮、甲苯、N,N-二甲基甲酰胺(DMF)的残留量。限度分别为:乙醇≤5000ppm、丁酮≤5000ppm、甲苯≤890ppm、DMF≤880ppm。 1.2分析方法草案见附件。 1.3本分析方法属于杂质定量分析,因此需要验证的项目有:系统适应性、专属性、线性、 准确度、检测限、定量限、精密度、耐用性,具体参数及接受标准要求见下表:
2.参考资料 ICH Q3C (R3), November 2005. ICH Q2 (R1), November 2005. <467> Residual Solvents, United States Pharmacopoeia 31, November 2007. <20424> Residual Solvents, European Pharmacopoeia 6.0, June 2007. 3. 职责 4.1色谱系统
1. 目的:建立残留溶剂测定法(二部)检验标准操作规程,并按规程进行检验,保证检验操作规范化。 2. 依据: 2.1. 《中华人民共和国药典》2010年版二部。 3.范围:适用于所有用残留溶剂测定法(二部)测定的供试品。 4. 责任:检验员、质量控制科主任、质量管理部经理对本规程负责。 5.正文: 5.1. 药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。药品中常见的残留溶剂及限度见附表1,除另有规定外,第一、第二、第三类溶剂的残留限度应符合表1中的规定;对其他溶剂,应根据生产工艺的特点,制定相应的限度,使其符合产品规范、药品生产质量管理规范(GMP)或其他基本的质量要求。 5.2. 本法照气相色谱法(附录ⅤE)测定。 5.3. 色谱柱 5.3.1. 毛细管柱:除另有规定外,极性相近的同类色谱柱之间可以互换使用。 5.3.1.1. 非极性色谱柱:固定液为100%的二甲基聚硅氧烷的毛细管柱。 5.3.1.2. 极性色谱柱:固定液为聚乙二醇(PEG-20M)的毛细管柱。
5.3.1.3. 中性色谱柱:固定液为(35%)二苯基-(65%)甲基聚硅氧烷、(50%)二苯基-(50%)二甲基聚硅氧烷、(35%)二苯基-(65%)二甲基聚硅氧烷、(14%)氰丙基苯基-(86%)二甲基聚硅氧烷、(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱等。 5.3.1.4. 弱极性色谱:柱固定液为(5%)苯基-(95%)甲基聚硅氧烷、(5%)二苯基-(95%)二甲基硅氧烷的毛细管柱等。 5.3.2. 填充柱:以直径为0.18~0.25mm 的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。 5.4. 系统适用性试验。 5.4.1. 用待测物的色谱峰计算,毛细管色谱柱的理论板数一般不低于5000;填充柱的理论板数一般不低于1000。 5.4.2. 色谱图中,待测物色谱峰与其相邻色谱峰的分离度应大于1.5。 5.4.3. 以内标法测定时,对照品溶液连续进样5次,所得待测物与内标物峰面积之比的相对标准偏差(RSD)不大于5%;若以外标法测定,所得待测物峰面积的RSD 应不大于10%。 5.5. 供试品溶液的制备。 5.5.1. 顶空进样:除另有规定外,精密称取供试品0.1~1g,通常以水为溶剂;对于非水溶性药物,可采用N,N-二甲基甲酰胺、二甲基亚砜或其他适宜溶剂;根据供试品
原料药或制剂中有机溶剂的残留量一般要求控制在几个至几千个ppm之间,属于微量或痕量测定,与常量测定有着不同的特点。残留溶剂检查方法的选择对测定结果有着重要的影响,有时采用不同的方法测定同一个样品会得到截然不同的结果。 通过对最近一段申报资料的审评,经常发现在残留溶剂的检查方法尚不合理的情况下,若样品的色谱图中未出现溶剂峰,也未经其它系统验证,研究者就简单地作出样品无该溶剂残留的结论,进而不将其残留定入质量标准,药检所也不再进行复核。针对这种情况,从审评的角度出发,就如何评价残留溶剂检查方法的合理性谈自己的一些认识,与各位业内同仁交流。 有机残留溶剂检查一般采用气相色谱法,评价色谱系统的适用性和方法学验证资料遵循与液相色谱方法评价相同的原则,不再赘述。与液相方法不同的是,气相色谱有多种进样方式,残留溶剂检查常用直接进样法或顶空进样法。针对这两种进样方法不同的特点,评价方法合理性的要点应有所不同。对于直接进样法,应着重评价方法的灵敏度和重复性。目前已普遍用毛细管柱取代填充柱,因为毛细管柱的柱效高,其灵敏度也较填充柱大为提高。但由于毛细管柱直接进样的体积小,一般仅几微升,即使提高供试溶液的浓度,对于测定限量极低的溶剂(如:苯、四氯化碳、1,2-二氯乙烷等)及对FID检测器响应低的溶剂(如:含氯的溶剂),其检测限一般接近或高于限量,灵敏度难以满足测定的需要。测定此类溶剂最好采用顶空进样法,对含卤素的溶剂可改用电子捕获检测器(ECD)。进样量小也易造成进样重复性差,采用内标法较外标法的结果更为准确。 顶空进样法是将大量样品中的残留溶剂富集在顶空瓶上层的气体中,对绝大多数有机溶剂而言,灵敏度较直接进样法大为提高,但顶空进样系统中存在气液两相的平衡问题,对结果准确性的影响因素增多。评价方法是否合理,应着重关注以下三个方面:1)顶空条件:顶空瓶的平衡温度和时间是最重要的参数,根据溶解样品的溶剂和待测溶剂的不同性质,达到气液平衡所需的温度和时间可能不同,应有试验数据作为选择的依据,但在申报资料中一般都未提及。判断顶空条件是否适用,一般的规律是:顶空瓶的平衡温度应低于溶解样品所用溶剂的沸点10℃以下,能满足检测灵敏度即可;对于沸点过高的溶剂,如DMF、DMSO、聚乙二醇等,用顶空进样测定的灵敏度不如直接进样,不适宜采用顶空法;顶空瓶的平衡时间一般应为30至60分钟,才能保证气液两相达到稳态平衡。 2)供试品和对照品是否平行:由于供试品和对照品的液体部分状态不完全一致而造成的基质效应会直接影响到结果的准确性。采用标准加入法可以消除基质效应,但目前在国内的申报资料中较少见到,其原因可能是方法较为繁琐,且需要消耗大量的样品,对新药研发初期样品量较少的情况或一些贵重的药品不太适用。如果申报资料中提供了回收率数据,就容易判断基质效应的大小,但由于目前对此没有强制要求,大多数资料都未对回收率进行研究。因此在评价方法时,至少应要求对照品和供试品采用相同的溶剂溶解,且液体部分的体积应完全一致。 3)重复性:由于顶空进样法存在气液平衡和气体进样的问题,粗放度较大,中国药典2005年版的要求是:内标法连续五次进样的相对标准偏差小于5%,外标法的相对标准偏差小于10%;欧洲药典则要求相对标准偏差小于15%,因此重复性应密切关注。 此外,无论是直接进样或顶空进样,都应尽量使供试液中的样品完全溶解,否则当残留溶剂被包裹在样品晶格中时就不能被检测出来,可能造成结果与实际情况完全不符。对溶解性差的样品,可采用不挥发性酸或碱的溶液、高沸点的有机溶剂、混合溶剂等来溶解样品,即使样品在加热的条件下可能被破坏,只要待测的残留溶剂不被破坏(如:测定酯类溶剂不
残留溶剂测定法 药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。药品中常见的残留溶剂及限度见附表1,除另有规定外,第一,第二,第三类溶剂的残留限度应符合附表1中的规定;对其他溶剂,应根据生产工艺的特点,制定相应的限度,使其符合产品规范,药品生产质量管理规范(GMP)或其他基本的质量要求。 本法照气相色谱法(通则0521)测定。 色谱柱 1,毛细管柱 除另有规定外,极性相近的同类色谱柱之间可以互换使用。 (1)非极性色谱柱固定液为100%的二甲基聚硅氧烷的毛细管柱。 (2)极性色谱柱固定液为聚乙二醇(PEG-20M)的毛细管柱。 (3)中极性色谱柱固定液为(35%)二苯基-(65%)甲基聚硅氧烷、(50%)二苯基-(50%)二甲基聚硅氧烷、(35%)二苯基-(65%)二甲基聚硅氧烷、(14%)氰丙基苯基-(86%)二甲基聚硅氧烷、(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱等。 (4)弱极性色谱柱固定液为(5%)苯基-(95%)甲基聚硅氧烷、(5%)二苯基-(95%)二甲基聚硅氧烷共聚物的毛细管柱等。 2,填充柱 以直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。 系统适用性试验 (1)用待测物的色谱峰计算,毛细管色谱柱的理论板数一般不低于5000,;填充柱的理论板数一般不低于1000。 (2)色谱图中,待测物色谱峰与其相邻色谱峰的分离度应大于1.5。 (3)以内标法测定时,对作品溶液连续进样5次,所得待测物与内标物峰面积之比的相对标准偏差(RSD)应不大于5%;若以外标法测定,所得待测物峰面积的RSD应不大于10%。 供试品溶液的制备 1,顶空进样 除另有规定外,精密称取供试品0.1~1g;通常以水为溶剂;对于非水溶性药物,可采用N,N-二甲基甲酰胺,二甲基亚砜或其他适宜溶剂;根据供试品和待测溶剂的溶解度,选择适宜的溶剂且应不干扰待测溶剂的测定。根据各品种项下残留溶剂的限度规定配制供试品溶液,其浓度应满足系统定量测定的需要。 2,溶液直接进样 精密称取供试品适量,用水或合适的有机溶剂使溶解;根据各品种项下残留溶剂的限度规定配制供试品溶液,其浓度应满足系统定量测定的需要。 对照品溶液的制备 精密称取各品种项下规定检查的有机溶剂适量,采用与制备供试品溶液相同的方法和溶剂制备对照品溶液;如用水作溶剂,应先将待测有机溶剂溶解在50%二甲基亚砜或N,N-二甲基甲酰胺溶液中,再用水逐步稀释。若为限度检查,根据残留溶剂的限度规定确定对照品溶液的浓度;若为定量测定,为保证定量结果的准确性,应根据供试品中残留溶剂的实际残留量确定对照品溶液的浓度;通常对
USP[467]有机挥发性杂质 残留溶剂限度 Ⅰ级需避免的溶剂 已知人体实验致癌物质; 强烈疑似人体实验致癌物质;环境危害物质 Ⅱ级需被限制的溶剂 动物实验非生殖毒性(遗传);动物实验致癌物质或其它可能的非可逆致病因子;产生毒性如神经毒性或致畸性; 其它疑似重大但可逆毒性 Ⅲ级具有低潜在毒性溶剂 对人体存在低毒性溶剂;无人体摄入量规定(注:Ⅲ级残留溶剂PDEs上限为≥50mg/天) 表1 Ⅰ级残留溶剂 溶剂浓度限度(ppm)不良反应 苯 2 致癌物四氯化碳 4 中毒和外周脑组织损害1,2-二氯乙烷 5 中毒 1,1-二氯乙烷8 中毒 1,1,1-三氯乙烷1500 环境危害 Ⅱ级残留溶剂 表2 Ⅱ级残留溶剂 溶剂PDE(mg/天)浓度限度(ppm) 乙腈Acetonitrile 4.1 410 氯苯Chlorobenzene 3.6 360 氯仿Chloroform0.6 60 环己烷Cyclohexane38.8 3880 1,2-二氯乙烯 1,2-Dichloroethene 18.7 1870 1,2-二甲氧乙烷 1.0 100 N,N-二甲基乙酰胺 N,N-Dimethylacetamide 10.9 1090 N,N-二甲基甲酰胺 N,N-Dimethylformamide 8.8 880 1,4-二氧六环 1,4-Dioxane 3.8 380 2-乙氧基乙醇 1.6 160 乙二醇Ethylene glycol 6.2 620 甲酰胺Formamide 2.2 220
己烷Hexane 2.9 290 甲醇Methanol30.0 3000 2-甲氧基乙醇0.5 50 甲基丁基(甲)酮 0.5 50 2-己酮 甲基环己烷11.8 1180 二氯甲烷 6.0 600 N-甲基吡咯烷酮 5.3 530 硝酸甲烷0.5 50 吡啶 2.0 200 环丁砜 1.6 160 四氢呋喃7.2 720 1,2,3,4-四氢化萘 1.0 100 甲苯8.9 890 三氯乙烯0.8 80 二甲苯* 21.7 2170 *通常含有60%间-二甲苯,14%对-二甲苯,9%邻-二甲苯和17%乙苯 Ⅲ级残留溶剂 表3 Ⅲ级残留溶剂 (GMP或其它原料药、赋形剂和药物制剂质量标准规定) 醋酸Acetic acid 庚烷Heptane 丙酮Acetone 乙酸异丁酯 苯甲醚乙酸异丙酯 正丁醇乙酸甲酯 2-丁醇3-甲基-1-丁醇 乙酸丁酯甲基乙基酮 叔丁基甲基醚甲基异丁基酮 异丙基苯2-甲基-1-丙醇 二甲基亚砜戊烷 乙醇1-戊醇 乙酸乙酯1-丙醇 乙醚2-丙醇 甲酸乙酯乙酸丙酯 甲酸 表4 其它残留溶剂 (缺乏足够的毒物学方面的资料) 1,1-二乙氧基丙烷甲基异丙基酮 1,1-二甲氧基甲烷甲基四氢呋喃 2,2-二甲氧基丙烷溶剂己烷 异辛烷三氯醋酸 异丙醚三氟醋酸除另有规定外,样品中残留的有机挥发性杂质不得超过下表中规定限度:
残留溶剂的指导原则 1.介绍 本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理学上的可接受水平。 药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以及在制剂制备过程中产生或使用的有机挥发性化合物,它们在工艺中不能完全除尽。在合成原料药中选择适当的溶剂可提高产量或决定药物的性质,如结晶型。纯度和溶解度。因此.有时溶剂是合成中非常关键的因素。本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂,也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作出合理的判断。 出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以符合产品规范、GMP或其他基本的质量要求。制剂所含残留溶剂的水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类,表1),除非被证明特别合理,在原药、赋形剂及制剂生产中应避免使用。一些溶剂毒性不太大(第二类,表2)应限制使用,以防止病人潜在的不良反应。使用低毒溶剂(第三类,表3)较为理想。附录1中列出了指导原则中的全部溶剂。 表中所列溶剂并非详尽无遗,其他可能使用的溶剂有待日后补充列人。第一、二类溶剂的建议限度或溶剂的分类会随着。新的安全性资料的获得而调整。含有新溶剂的新药制剂、其上市申请的安全性资料应符合本指导原则或原料药指导原则(Q3A新原料药中的杂质)或新药制剂(Q3B新药制剂中的杂质)中所述的杂质控制原则,或者符合上述三者。 2. 指导原则的范围 指导原则范围包括原料药、赋形剂或制剂中所含残留溶剂.因此,当生产或纯化过程中会出现这些溶剂时。应进行残留溶剂的检验。也只有在上述情况下,才有必要作溶剂的检查。虽然生产商可以选择性地测定制剂,但也可以从制剂中各成分的残留溶液水平来累积计算制剂中的残留溶剂。如果计算结果等于或低于本原则的建议水平,该制剂可考虑不检查残留溶剂,但如果计算结果高于建议水平则应进行检测,以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水平。果制剂生产中用到某种溶剂,也应进行测定。 本指导原则不适用于临床研究阶段的准新原料药、准赋形剂和准制剂。也不适用于已上市的药品。 本指导原则适用于所有剂型和给药途径。短期(如30天或更短)使用或局部使用时,允许存在的残留溶剂水平可以较高。应根据不同的情况评判这些溶剂水平。 有关残留溶剂的背景附加说明见附录2。 3.通则 3.1 根据危害程度对残留溶剂分类 “可耐受的日摄人量”(TDI)是国际化学品安全纲要(IPCS)用于描述毒性化合物接触限度的术语。“可接受的日摄人量”(ADI)是WHO及一些国家和国际卫生组织所用的术语。新术语“允许的日接触量”(PDE)是本指导原则中用于定义药物中可接受的有机溶剂摄人量,以避免与同一物质的ADI混淆。 本原则中残留溶剂的评价以通用名和结构列于附录1,根据它们对人体可能造成的危害分为以下三类; (1)第一类溶剂:应避兔的溶剂 为人体致癌物、疑为人体致癌物或环境危害物。 (2)第二类溶剂。应限制的溶剂 非遗传毒性动物致癌或可能导致其他不可逆毒性测神经毒性或致畸性)的试剂。 可能具其他严重的但可逆毒性的溶剂。
阿莫西林残留溶剂分析方法验证方案文件编号: VP-01-06-00-041 方案起草 方案审核 方案批准
生效日期:年月日 1、概述 在阿莫西林制备工艺中,使用了甲醇与丙酮两种对人体具有危害的二类溶剂,我公司为了确保阿莫西林原料中甲醇与丙酮的残留在国家要求范围内,开发了阿莫西林胶囊中甲醇与丙酮残留的检测方法,按照《中国药典》2015年版的要求对此检测方法进行方法学验证。 2、验证目的 证明本方法能满足阿莫西林原料中甲醇与丙酮的残留溶剂测定,确保阿莫西林原料中甲醇与丙酮的残留溶剂检测方法准确、重现并耐用,检测结果数据真实可靠。 3、验证范围 本验证方案适用于阿莫西林中甲醇与丙酮的残留溶剂检验方法验证。 4、确认小组成员及职责 5、验证前的风险评估
5.1验证小组人员按照《质量风险管理规程》,对分析方法进行了风险评估,确定了需进行方法确认的项目。 5.1.1严重性(S):危害可能产生后果的程度。严重程度分为五个等级。 5.1.2可能性(P):影响检测结果的事件发生的可能性频率或概率,建立以下五个等级: 5.1.3可检测性(D):检测到异常情况存在的能力的程度,定义如下:
5.2风险优先数量等级判定(RPN) 5.2.1风险等级判定标准的确定 RPN是事件发生的严重程度、可能性和可探测性三者乘积,用来衡量可能的仪器缺陷,以便采取可能的预防措施。 RPN = Severity(严重程度)×Possibility(发生的可能性)×Detection(可探测性) 5.2.2风险评价和处理 注:当RPN≤8,但严重性S为5时,仍需按中等以上风险进行后续控制。
杂质:残留溶剂的指导原则
杂质:残留溶剂的指导原则
1.介绍 本指导原则旨在介绍药物中残留溶剂在保证人体安全条件下的 可接受量,指导原则建议使用低毒的溶剂,提出了一些残留溶剂毒理 学上的可接受水平。 药物中的残留溶剂在此定义为在原料药或赋形剂的生产中,以 及在制剂制备过程中产生或使用的有机挥发性化合物, 它们在工艺中 不能完全除尽。 在合成原料药中选择适当的溶剂可提高产量或决定药 物的性质,如结晶型。纯度和溶解度。因此.有时溶剂是合成中非常 关键的因素。本指导原则所指的溶剂不是谨慎地用作赋形剂的溶剂, 也不是溶剂化物,然而在这些制剂中的溶剂含量也应进行测定,并作 出合理的判断。 出于残留溶剂没有疗效,故所有残留溶剂均应尽可能.去,以 符合产品规范、GMP 或其他基本的质量要求。制剂所含残留溶剂的 水平不能高于安全值,已知一些溶剂可导致不接受的毒性(第一类, 表 1) ,除非被证明特别合理,在原药、赋形剂及制剂生产中应避免 使用。一些溶剂毒性不太大(第二类,表 2)应限制使用,以防止病 人潜在的不良反应。使用低毒溶剂(第三类,表 3)较为理想。附录 1 中列出了指导原则中的全部溶剂。
第 1 页 共 18 页
杂质:残留溶剂的指导原则
表中所列溶剂并非详尽无遗, 其他可能使用的溶剂有待日后补充 列人。第一、二类溶剂的建议限度或溶剂的分类会随着。新的安全性 资料的获得而调整。含有新溶剂的新药制剂、其上市申请的安全性资 料应符合本指导原则或原料药指导原则(Q3A 新原料药中的杂质) 或新药制剂(Q3B 新药制剂中的杂质)中所述的杂质控制原则,或者 符合上述三者。 2. 指导原则的范围 指导原则范围包括原料药、 赋形剂或制剂中所含残留溶剂. 因此, 当生产或纯化过程中会出现这些溶剂时。应进行残留溶剂的检验。也 只有在上述情况下,才有必要作溶剂的检查。虽然生产商可以选择性 地测定制剂, 但也可以从制剂中各成分的残留溶液水平来累积计算制 剂中的残留溶剂。如果计算结果等于或低于本原则的建议水平,该制 剂可考虑不检查残留溶剂, 但如果计算结果高于建议水平则应进行检 测, 以确定制剂制备过程中是否降低了有关溶剂的量以达到可接受水 平。果制剂生产中用到某种溶剂,也应进行测定。 本指导原则不适用于临床研究阶段的准新原料药、 准赋形剂和准 制剂。也不适用于已上市的药品。 本指导原则适用于所有剂型和给药途径。短期(如 30 天或更短) 使用或局部使用时,允许存在的残留溶剂水平可以较高。应根据不同 的情况评判这些溶剂水平。 有关残留溶剂的背景附加说明见附录 2。
第 2 页 共 18 页
溶剂残留量检测方法 气相色谱仪检测器(氢火焰离子检测器) 色谱柱:25%PEG-1500,301有机担体,柱长2m,内径2mm(也可以采用专业的毛细管柱) 条件:柱室温度90℃检测器温度:150℃气化室温度:150℃ 1.包装材料溶剂残留量的检测 采用气相色谱仪或等同原理的仪器,按生产实际使用溶剂的种类配制标准溶剂样品,用微升注射器取0.5μl、1μl、2μl、 3μl和4μl样品,换算成质量。将样品分别注入用硅橡胶密封好的清洁干燥的500ml三角瓶中,送入80±2℃恒温烘箱中放置30 分钟后,用5ml注射器从瓶中取1ml气体,迅速注入色谱仪中测定。以其出峰总面积值分别与对应的样品质量做出标准曲线。 裁取0.2m2样品,将样品迅速裁成10mm×30mm碎片,放入清洁的、在80℃条件下预热的500ml 三角瓶中,用硅胶塞密封,送入80±2℃恒温烘箱中加热30分钟后,用5ml注射器取1ml瓶中气体注入色谱仪中测定。以出峰总面积值在标准曲线上查出对应的溶剂残留量,试验结果以mg/m2表示。 2.油墨溶剂残留量的检测 采用气相色谱仪或等同原理的仪器,按产品标准要求的溶剂种类配制标准溶剂,将每种溶剂用10μl进样器通过密封胶塞向300ml输液瓶中注入1μl标准溶剂,放入80±1℃恒温烘箱中20分钟后取出,隔日再放入50±1℃恒温烘箱中20小时以上,取出后用1ml注射器分别从瓶中抽取0.2、0.6、0.8、1.0ml的气体进行测试,做出标准曲线。 将油墨在双向拉伸聚丙烯薄膜上制成印样,悬空放置2小时,将试样裁切成4条,规格为5cm ×10cm,总面积为200cm2,立即置于300ml输液瓶中塞紧瓶口,置于80±1℃恒温烘箱中30分钟,取出后用1ml注射器抽取气体,注入色谱仪测定,以出峰总面积值在标准曲线上查出对应的溶剂残留量,试验结果以mg/m2表示。 中心以化工行业技术需求和科技进步为导向,以资源整合、技术共享为基础,分析测试、技术咨询为载体,致力于搭建产研结合的桥梁。以“专心、专业、专注“为宗旨,致力于实现研究和应用的对接,从而推动化工行业的发展。 科标化工分析检测中心致力于推动化工产业发展,欢迎各行同仁前来洽谈、合作。
本方法用石英毛细色谱柱GC检测,氮气为载气,FID检测器,依据GB/T 5009.37—1996方法并作改动、调整,使准确度提高,检出值可到1ppm,且重复性好,能为食用油产品准确定级提供有效、准确的结果。 关键词:GC 食用油溶剂残留检测 为了提高产品的检测、控制能力,配合国家对五种食用油新标准的制定和落实,更准确的得出食用油脂产品中溶剂残留结果,正确分级。 实验 试剂:N-N-二甲基乙酰胺(DMA)上海精化科技研究所 六号溶剂油宜春石油公司 设备:瓦里安GC 3900 检测器:FID 色谱柱:VB-5(30m×0.32×0.5um) 色谱条件: 进样器温度:250℃ 流速:2.5ml/min 检测器温度:280℃ 柱温箱温度:85℃(1min)20℃/min 130℃(2min) 2、试剂: N-N-二甲基乙酰胺(DMA):吸取1毫升放入100毫升洗好干燥的带胶塞的玻璃瓶中,在50摄氏度放置30分钟,取液上气1ul注入气相色谱仪在10分钟内无干扰即可使用。如有干扰用超声波处理30分钟。 3、六号溶剂标准溶液:称取洗净干燥的10毫升气化瓶的质量为A,瓶中放入比气化瓶体积少0.5毫升的DMA密塞后称量为B(M5),用50ul的注射器取约0.2毫升六号溶剂标准通过塞注入瓶中,混匀,准确称量为C。用下式计算六号溶剂的浓度:X7=(M5-M6)/(M6-M7)/0.935×1000 4、标准曲线的绘制 取预先在气相色谱仪测试无溶剂的成品油(新机榨毛油),分别称取25克放入以试过漏的6只气化瓶中,密塞。通过塞子注入六号溶剂标准液0、20ul 、40ul 、60ul、80ul、100ul。放入50摄氏度烘箱中,平衡30分钟,分别取液上气体注入色谱,各响应扣除空白后,绘制标准曲线。 5、测定 称取25克食用油样,密塞后于50摄氏度恒温烘箱加热30分钟,取出后立即用微量注射器吸取15ul液上气体注入色谱,记录组分测量峰高,与标准曲线比较,求出液上六号溶剂的含量。 6、计算 六号溶剂含量=测定气化瓶六号溶剂的质量/样品质量
残留溶剂测定法 1 简述 药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用过,但在工艺过程中未能完全去除的有机溶剂。药物中常见的残留溶剂及限度参照《中国药典》2015年版四部通则0861附表1的规定,除另有规定外,第一、第二、第三类溶剂的残留量应符合其规定;对其他溶剂,应根据生产工艺的特点,制订相应的限度,使其符合产品质量标准的要求。本法照气相色谱法(《中国药典》2015年版四部通则0521测定。 本测定方法适用于对各论项下未收载残留溶剂检测方法的品种中残留溶剂的检验,也可用于指导建立各论项下具体品种的残留溶剂检查方法。 2 仪器和用具 2.1 气相色谱仪,带FID检测器,顶空进样器。 2.2 计算机,安装工作站软件。 2.3 色谱柱 2.3.1 毛细管柱除另有规定外,极性相近的同类色谱柱之间可以互代使用。 2.3.1.1 非极性色谱柱固定液为100%的二甲基聚硅氧烷的毛细管柱。 2.3.1.2 极性色谱柱固定液为聚乙二醇(PEG-20M)的毛细管柱。 2.3.1.3 中极性色谱柱固定液为(35%)二苯基-(65%)二甲基聚硅氧烷,(50%)二苯基-(50%)二甲基聚硅氧烷,(35%)二苯基-(65%)二甲基亚芳基聚硅氧烷,(14%)氰丙基苯基-(86%)二甲基聚硅氧烷,(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱。 2.3.1.4 弱极性色谱柱固定液为(5%)苯基-(95%)甲基聚硅氧烷,(5%)二苯基-(95%)二甲基亚芳基硅氧烷共聚物的毛细管柱。 2.3.2 填充柱以直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。 3 供试品溶液和对照品溶液的制备 3.1 供试品溶液的制备 3.1.1 顶空进样除另有规定外,精密称取供试品0.1~1g;通常以水为溶剂;对于非水溶性药物,可采用N,N-二甲基甲酰胺、二甲基亚砜或其他适宜溶剂;根
[467]有机挥发性杂质 残留溶剂限度 根据药典要求,药品中残留溶剂定义:在药物或赋形剂制造或使用过程中,或药物制剂生产过程中残存的有机挥发性物质。目前制药技术不能完全去除残留溶剂。药物或赋形剂合成中选择适当的溶剂可提高得率,或获得某些特性如晶型、纯度和溶解性。因此,合成中所用溶剂有时可能是危险因素。本章节不包括涉及用于组分的溶剂或溶剂化物。尽管如此,以上产品仍应标明所含溶剂含量并证明对人体安全。 由于残留溶剂不用于治疗用途,因此应尽可能除去,以符合药物、赋形剂和产品规格要求、GMP或其他质量标准。药物制剂中所含溶剂不得高于安全性评价规定限度。众所周知,药物、赋形剂、药物制剂不应含能引起不可逆毒副作用(Ⅰ级,见表1)的残留溶剂,除非证明有很好的风险-效益比。应对引起次级严重毒副作用的残留溶剂(Ⅱ级,见表2)规定限度,以防止病人发生潜在的不良反应。理想状态下,应尽可能使用低毒性溶剂(Ⅲ级,见表3)。本章节所有溶剂列表见附录1。下述表格及限度并不代表全部。当医药工业发展需使用其他溶剂情况下,应将新溶剂添加到列表中。 当药物、赋形剂、药物制剂生产和纯化过程中残留已知有机溶剂时,应依法检查溶剂限度。本限度检查仅检查用于制造和纯化加工所用的溶剂。虽然制造商可能选择测试药物,我们可采用累积法从制造工艺水平计算产品中残留溶剂。如残留溶剂计算结果等于或低于本章节规定限度,可不进行残留溶剂检查。如残留溶剂计算结果高于本章节规定限度,仍需检查残留溶剂限度以确定是否精加工降低了有关溶剂水平至可接受量。如残留溶剂为制造所用溶剂,必须检查药物制剂残留溶剂限度。 附录2为有关残留溶剂的相关背景资料。 根据安全评估残留溶剂分类 国际化学安全机构用术语“可忍受日摄食量”(TDI)描述有毒化学物质残留限度。世界卫生组织和其他国家和国际卫生机构用术语“可接受日摄食量”(ADI)来描述残留限度。术语“允许日接触量”(PDE)定义为根据药效学残留溶剂可接受摄入量,避免与ADIs混淆。 本章节所列残留溶剂按通用名和结构列于附录1。它们用于评价对人类卫生可能存在的危险等级,共分成3个等级,见下表: Ⅰ级残留溶剂:不得残留 已知人体实验致癌物质;强烈疑似人体实验致癌物质;环境危害物质 Ⅱ级残留溶剂:应在限度内 动物实验非生殖毒性(遗传);动物实验致癌物质或其它可能的非可逆致病因子;产生毒性如神经毒性或致畸性;其它疑似重大但可逆毒性 Ⅲ级残留溶剂:低潜在毒性溶剂 对人体存在低毒性溶剂;无人体摄入量规定(注:Ⅲ级残留溶剂PDEs上限为≥50mg/天) *有关PDEs上限≥50mg/天的Ⅲ级残留溶剂,见残留溶剂限度下Ⅲ级讨论章节
·药典之页· 编者按2015年版《中国药典》即新中国成立以来的第10版药典,历时近5年的修订,将于明年正式颁布实施。 2015年版《中国药典》将紧密结合当前我国医药产业发展水平和药品监督管理、医药卫生体制改革的重大需求,积极探索和改革药品标准形成和淘汰机制,强化科技创新成果在药典标准中的应用,支持并保护先进生产工艺,促进医药产业结构优化升级;同时汲取国内外先进经验,保护环境、节约资源,不断优化、完善和提高国家药品标准,建立健全严格的、以《中国药典》为核心的国家药品标准体系,大幅提高我国药品质量控制水平和《中国药典》的国际地位,在保障公众用药安全、支撑药品科学监管、满足临床用药需求、促进医药产业健康发展上发挥更加重要的作用。 新版药典进一步完善收载品种的遴选原则和机制以满足国家基本药物目录、国家基本医疗保险、工伤保险和生育保险用药的需要;同时,中药标准主导国际发展,化学药和生物制品标准达到或接近国际标准。 所有这些新的内容与变化使得2015年版《中国药典》在当前我国全面深化改革大背景下,在强调依法治国和提高全民族健康水平的具体任务下,更加令我们期待。在历届《中国药典》颁布之际,《中国药学杂志》均组织专栏和专刊进行宣传,本刊也在近两年来持续关注2015年版《中国药典》修订的进展及新的变化。在2015年版《中国药典》颁布实施前夕,为了有效配合新版《中国药典》的出版,使广大药学工作者,尤其是本刊的读者提前了解、体会新版《中国药典》的创新和延续,本刊将开设“药典之页”栏目,并于2015年组织新版《中国药典》(重点号),征集和组织一批有关新版《中国药典》的理论性与实用性相结合的文章及时刊出,以飨读者。 中美药典残留溶剂测定法设计理念差异的探讨 崇小萌,胡昌勤*(中国食品药品检定研究院,北京100050) 摘要:目的对《中国药典》2010年版和《美国药典》36版中残留溶剂检测方法的异同进行了归纳与总结,以提高完善《中国药典》2015年版残留溶剂检测方法。方法分别在两国药典色谱条件下对适合顶空分析的52种残留溶剂进行分析,比较两国药典色谱条件的分离性能和互补性。结果《中国药典》条件下52种残留溶剂仅2种无法实现互补分离,而美国药典36版仅注重对第一、二类残留溶剂的分析,对其他类残留溶剂的互补分离效果明显较差。结论《中国药典》2010年版色谱条件较美国药典36版更适合残留溶剂分析,《中国药典》2015年版引入中等极性色谱系统,对残留溶剂的控制将更加完善。 关键词:药典;残留溶剂;气相色谱 doi:10.11669/cpj.2014.21.019中图分类号:R917文献标志码:A文章编号:1001-2494(2014)21-1945-05 Comparison of the Detection Methods ofResidual Solvents between US Pharmacopoeia and Chinese Phar-macopoeia CHONG Xiao-meng,HU Chang-qin*(National Institutes for Food and Drug Control,Beijing100050,China) ABSTRACT:OBJECTIVE To summarize the differences and similarities of the detection methods of residual solvents between US Pharmacopoeia36edition and Chinese Pharmacopoeia2010edition,so as to improve the detection methods of residual solvents in Chinese Pharmacopoeia.METHODS Nonpolar and polar systems were used in Chinese Pharmacopoeia2010,and medium polar and polar sys-tems were used in US Pharmacopoeia36.Fifty-two kinds of residual solvents were analyzed by the gas chromatography systems used in US and Chinese Pharmacopoeias respectively.And the resolution and complement of the two systems were compared.RESULTS Only2of 52kinds of solvents which were suitable for headspace analysis in Chinese Pharmacopoeia could not be seperated.The US Pharmacopoeia focused on the first and second classes of residual solvents,and the identification of other classes of residual solvents were not perfect e-nough.CONCLUSION The chromatographic conditions in Chinese Pharmacopoeia are more suitable for residual solvents detection than US Pharmacopoeia.The control of residual solvents would be improved if medium polarity system is introduced into Chinese Pharmacopoeia.KEY WORDS:Pharmacopoeia;residual solvent;gas chromatography 作者简介:崇小萌,女,硕士研究生研究方向:抗生素质量分析*通讯作者:胡昌勤,男,研究员研究方向:抗生素质量分析 Tel/Fax:(010)67095308E-mail:hucq@https://www.doczj.com/doc/dc4410846.html,
残留溶剂测定法 1简述 药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使 用过,但在工艺过程中未能完全去除的有机溶剂。药物中常见的残留溶剂及限度 参照《中国药典》2015年版四部通则0861附表1的规定,除另有规定外,第一、第二、第三类溶剂的残留量应符合其规定;对其他溶剂,应根据生产工艺的特点,制订相应的限度,使其符合产品质量标准的要求。本法照气相色谱法( 《中国药典》2015年版四部通则0521测定。 本测定方法适用于对各论项下未收载残留溶剂检测方法的品种中残留溶剂的检验,也可用于指导建立各论项下具体品种的残留溶剂检查方法。 2仪器和用具 2.1 气相色谱仪,带FID检测器,顶空进样器。 2.2 计算机,安装工作站软件。 2.3 色谱柱 2.3.1 毛细管柱除另有规定外,极性相近的同类色谱柱之间可以互代使用。 2.3.1.1 非极性色谱柱固定液为100%勺二甲基聚硅氧烷的毛细管柱。 2.3.1.2 极性色谱柱固定液为聚乙二醇(PEG-20M的毛细管柱。 2.3.1.3 中极性色谱柱固定液为(35%)二苯基-(65%)二甲基聚硅氧烷,(50%) 二苯基-(50%)二甲基聚硅氧烷,(35%)二苯基-(65%)二甲基亚芳基聚硅氧烷,(14%) 氰丙基苯基-(86%)二甲基聚硅氧烷,(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱。 2.3.1.4 弱极性色谱柱固定液为(5%)苯基-(95%)甲基聚硅氧烷,(5%)二苯基 -(95%)二甲基亚芳基硅氧烷共聚物的毛细管柱。 2.3.2 填充柱以直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。 3供试品溶液和对照品溶液的制备 3.1 供试品溶液的制备 3.1.1 顶空进样除另有规定外,精密称取供试品0.1~1g ;通常以水为溶剂;对于非
世界各国药典对药物残留溶剂测定法的比较研究 发表时间:2012-01-10T11:20:29.600Z 来源:《医药前沿》2011年第22期供稿作者:李明[导读] 为药物残留溶剂提供了不同药典测定的思路。 李明(江西省赣州卫生学校药学医技系江西赣州 341000)【中图分类号】R921.3/.7【文献标识码】A【文章编号】2095-1752(2011)22-0213-02 【摘要】目的比较世界各国药典对药物残留溶剂测定方法,为残留溶剂提供不同药典的测定思路。方法对ChP2010、USP34、BP2011、EP7.0、JP15收载的残留溶剂种类、限度、色谱检测方法和系统适用性要求,对照品及供试品的配制要求作了详细介绍。结论因为某一具体品种各生产企业引入的溶剂亦有不同而难于统一规定,国外药典通过混合对照品法对残留溶剂的测定控制较为严格,中国药典2010也逐步认识到残留溶剂测定的重要性。 【关键词】世界各国药典残留溶剂测定法药物中的残留溶剂系指在原料药或辅料的生产中,以及在制剂过程中使用或产生的,但在工艺过程中未能完全去除的有机溶剂。根据国际化学品安全性纲要,美国环境保护机构、世界卫生组织等一些国际组织的研究结果,很多有机溶剂对环境、人体都有一定的危害,因此,为保障药物的用药安全,控制产品质量,需要进行有机溶剂残留量的研究和控制。目前虽有陈立亚[1]和陈苏伟[2]等人发表了相关文章,但均未对各国药典中的残留溶剂测定法做系统的比较分析,本文通过对ChP2010、USP34、BP2011、EP7.0、JP15收载的残留溶剂种类、限度、色谱检测方法和系统适用性,对照品及供试品的配制要求作详细介绍。为药物残留溶剂提供了不同药典测定的思路。 1 各国药典收载的残留溶剂种类及限度目前ChP2010、USP34、BP2005、EP5.0、JP15 等残留溶剂的种类和限度的规定均参考人用药物注册技术要求国际协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceutical Use, ICH)颁布的指导原则。ICH于1996年11月6日颁布了残留溶剂测定指导原则征求意见稿,并对外公布,以便获取公众对指导原则的建议。该指导原则于1997年 7 月 17 日被ICH指导委员会采用,正式实施。 ICH 根据危害程度对残留溶剂进行了系统分类,“允许的日接触量”(permitted daily exposure ,PDE)的定义是指某一有机溶剂被允许摄入而不产生毒性的日平均最大剂量,单位为mg/天。依据毒性的不同,将69种残留溶剂分成了四类。(见表1)表 1 69种残留溶剂的分类 类别毒性 PDE(mg/天)第一类溶剂人体致癌物、疑为人体致癌物或环境危害物 0.1以下(1,1,1)三氯乙烷除外(15.0)第二类溶剂有非遗传致癌毒性或其他不可逆毒性、或其他严重的可逆毒性 0.5-50 第三类溶剂对人体低毒 50 以上 第四类溶剂尚无足够毒理学资料 PDE也一直是一个动态的修订过程,鉴于新的毒理学数据的获得,ICH 分别于2002年12月12日和10月28日修订了四氢呋喃(THF)和N-甲基吡咯烷酮(NMP)的PDE,将四氢呋喃(THF)由三类溶剂改为二类有机溶剂。ICH根据不同残留溶剂的的PDE值,制定了不同残留溶剂的限度。其中USP30版本之前对“残留溶剂”一直称为“有机挥发性杂质”(organic volatile impurities<467>,2008年7月1日美国药典统一改为了 “残留溶剂” (residual solvents <467>)。其中BP2011将环氧乙烷和二氧六环不再作为残留溶剂项下,而是另外作为一测定项单独列出。即各国药典收载的残留溶剂种类和限度是一致的,目前均遵守ICH 指导原则。 2 世界各国药典对残留溶剂色谱检测方法的比较世界各国药典均首选气相色谱法测定有机残留溶剂,但是具体在测定方法、色谱条件、供试品和对照品的制备、系统适用性方面有差别,下面分别予以比较。 2.1 ChP2010 的相关规定(表2)[3] 表2 ChP2010中残留溶剂的测定方法