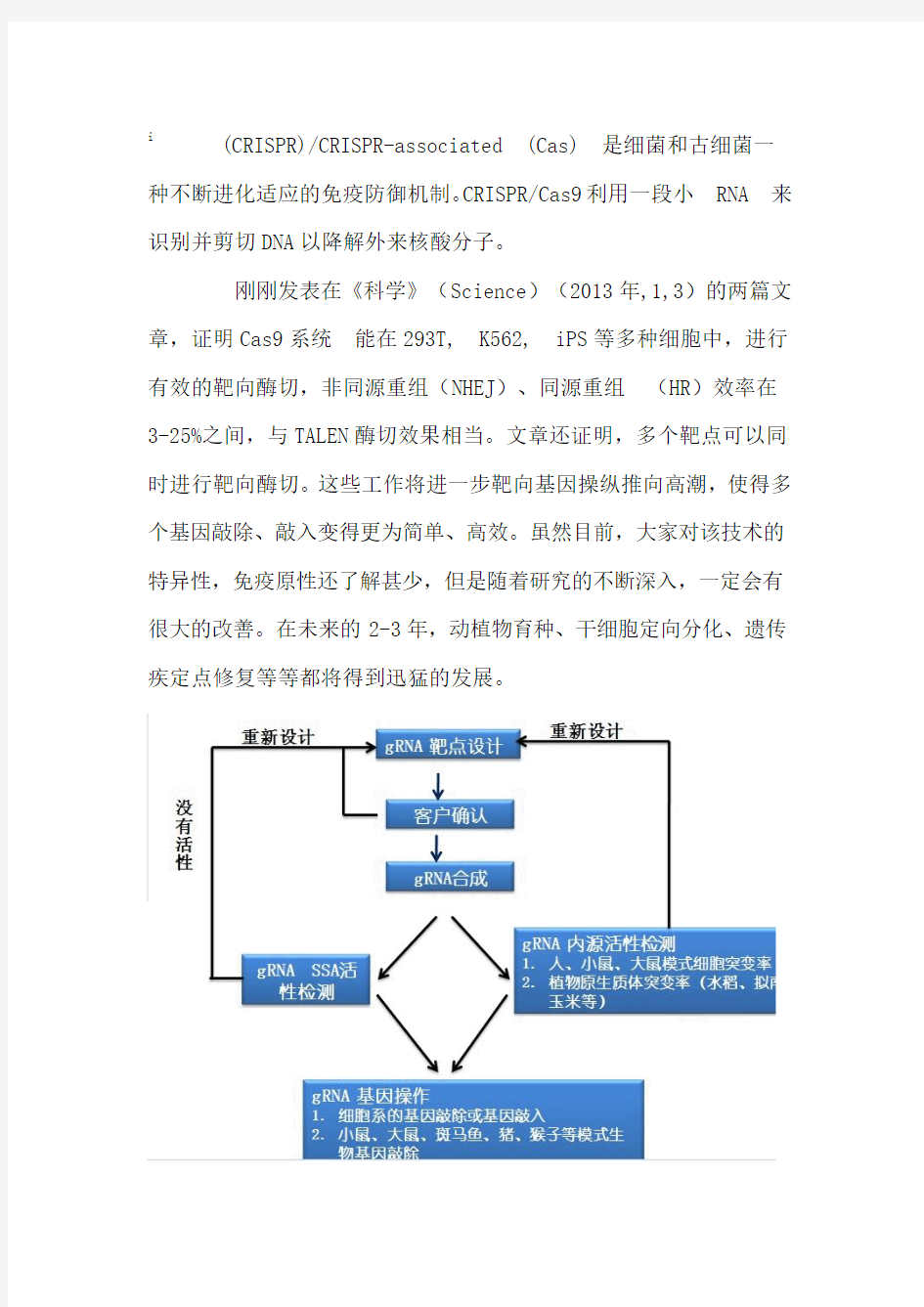

i (CRISPR)/CRISPR-associated (Cas) 是细菌和古细菌一种不断进化适应的免疫防御机制。CRISPR/Cas9利用一段小RNA 来识别并剪切DNA以降解外来核酸分子。
刚刚发表在《科学》(Science)(2013年,1,3)的两篇文章,证明Cas9系统能在293T, K562, iPS等多种细胞中,进行有效的靶向酶切,非同源重组(NHEJ)、同源重组(HR)效率在3-25%之间,与TALEN酶切效果相当。文章还证明,多个靶点可以同时进行靶向酶切。这些工作将进一步靶向基因操纵推向高潮,使得多个基因敲除、敲入变得更为简单、高效。虽然目前,大家对该技术的特异性,免疫原性还了解甚少,但是随着研究的不断深入,一定会有很大的改善。在未来的2-3年,动植物育种、干细胞定向分化、遗传疾定点修复等等都将得到迅猛的发展。
图1. RNA指导的CRISPR/Cas9基因剪切系统
唯尚立德已经利用CRISPR/Cas9在斑马鱼,哺乳动物细胞上成功实现基因敲除和基因敲入,现推出如下技术服务:
1. 应用CRISPR /Cas9提供稳定细胞系靶向基因敲除、敲入技术服务;
2. 应用CRISPR /Cas9提供模式生物靶向基因技术服务,包括小鼠,大鼠,斑马鱼等;
近几十年来,随着全基因组测序技术的不断成熟,我们在各种细菌和古细菌(archaea)中也陆续发现了很多成簇的、规律间隔的短回文重复序列
(clustered regularly interspaced short palindromic re peat sequences,即CRISPR序列,这就是二十多年前日本科学家发现的那个序列)和CRISPR相关基因
(CRISPR-associated genes, Cas gene)。研究发现,这些CRISPR 序列与很多病毒或者质粒的DNA序列是互补的,说明这套
CRISPR–Cas系统很有可能是生物体抵御病毒等外来入侵者的一套特异性防御机制,就好像是另外一套适应性免疫反应系统
(adaptive immune system)。后续的遗传学试验和生物化学试验也证实了这种猜测。
虽然有很多CRISPR–Cas系统需要多种蛋白的参与,但是在很多细菌
的胞内都只需要一种内切酶(endonuclease)——Cas9就足够了,我们将这种CRISPR–Cas系统也称作2型系统(type II systems),如图1所示。Cas9内切酶在向导RNA的指引下能够对各种入侵的外源DNA分子进行定点切割,不过主要识别的还是保守的间隔相邻基序(proto-spacer adjacent motifs,PAM基序)。如果要形成一个有功能的DNA切割复合体,还需要另外两个RNA分子的帮助,它们就是CRISPR RNA (crRNA)和反式作用CRISPR RNA
(trans -acting CRISPR RNA, tracrRNA)。不过最近有研究发现,这两种RNA可以被“改装”成一个向导RNA
(single-guide RNA, sgRNA)。这个sgRNA足以帮助Cas9内切酶对DNA进行定点切割。最新的报道称,在多种类型的细胞和生物体内,这种RNA介导的Cas9酶切作用能够正常地行使功能,在完整基因组上的特定位点完成切割反应。这样就可以方便地进行后续的基因组改造工作了。细胞通常会通过两种方式对发生双链断裂的DNA进行修复,这两种方式分别是同源重组修复机制
(homologous recombination, HR)和非同源末端连接修复机制(non-homologous end joining, NHEJ),不过在修复的过程中细胞有可能会对修复位点进行修饰,或者插入新的遗传信息。
◆YORK/文
Cas 9系统作用于人类细胞
一直以来,在向导RNA的指引下,Cas 9内切酶能够对各种入侵的外源DNA分子进行定点切割,不过主要识别的还是保守的间隔相邻基序(PAM基序)。如果要形成一个有功能的DNA切割复合体,还需要CRISPR RNA(crRNA)和反式作用CRISPR RNA(tracrRNA)这两个RNA分子的帮助。
不过,这两种RNA可被“改装”成一个向导RNA(sgRNA),而sgRNA足以帮助Cas 9对DNA进行定点切割。通常情况下,细胞会通过同源重组修复机制(HR)和非同源末端连接修复机制(NHEJ)这两种方式对发生双链断裂的DNA进行修复。
多项研究均表明,这种RNA介导的Cas 9系统在人类细胞中同样能够正常地发挥作用。具体而言,对化脓性链球菌编码的Cas 9内切酶进行改造后,可让它们在人类细胞的细胞核中被活化,之后再搭配针对人体DNA序列设计的大约20bp长的双RNA复合体或者sgRNA,进而对人体基因组进行定点切割和改造。科研人员们在多种人体细胞内共表达了这种专用于人体的Cas 9和向导RNA,结果都在预定的DNA位点观察到了基因组双链DNA切割,以及后续的修复现象,成功率高达38%,
并且Cas 9对细胞几乎没有毒性。研究认为,这套Cas 9系统能够在人体细胞内以非常高的效率对普通的基因组位点进行定向基因替换的操作。
与此同时,另一组研究发现这套RNA介导的Cas 9系统能够在人体细胞内诱发位点特异性的基因组修饰动作,且Cas 9蛋白与向导RNA结合、组装的动作是这套位点特异性的基因组修饰过程里的限速步骤。
之前的研究发现,细胞更倾向于使用同源重组机制对单链DNA损伤进行修复,因此引入的突变也会更少。而新的研究发现,各种不同的、只能够形成单链DNA断裂的Cas 9在细胞内引发NHEJ修复的机率的确更低,但它们在引发基因替换的效率方面与野生型的Cas 9内切酶不相上下。不仅如此,这套Cas 9系统还具有多重靶向功能,如能与基因组中两个不同的序列(位点)结合,形成多处断裂。此外,研究者还认为,分别表达tracrRNA和crRNA还可以进一步提高切割的效率,即如果进一步改进sgRNA的设计方案,使其更接近双RNA复合体的结构,将会进一步提高Cas 9系统的基因组编辑效率。
多领域的遗传学改造功能
除了这些细胞学的研究成果外,科学家们还发现这套Cas 9系统同样可以对生物体进行基因组改造的操作。如在细菌内表达多种向导RNA之后,Cas 9内切酶可以对细菌基因组的多个位点进行修饰操作。借助这一技术,可以对各种微生物进行遗传学改造,打造出符合我们人类需要的工程微生物,使其造福人类,在生物能源或者生物制药等诸多领域具有极大的应用潜力。
与此同时,相关研究还使用单细胞斑马鱼胚胎进行了试验,他们将编码Cas 9蛋白的mRNA和特定的向导RNA(与斑马鱼基因组DNA的匹配机率高达24-59%)注射到斑马鱼胚胎内,结果取得了成功:在所有被注射的斑马鱼胚胎内,10个切割位点中有8个位点都发生了切割,并且引入了插入或者缺失突变。
这一试验结果表明,Cas 9切割活性完全可以应用于生物体水平,哺乳动物和植物都可以使用这种技术进行遗传学改造。而目前最有价值的应用就是使用这种技术为各种人类疾病构建出动物模型。
除此以外,这种基因组改造技术还可被应用于合成生物学、基因定向干扰或者多重基因干扰和基因治疗等领域。专家认为,接下来的研究难点应该就是如何克服脱靶效应,如何提高
基因组改造的效率和特异性,以及如何将这项技术应用于更多的物种等方面。所以接下来的研究也需要对这种Cas 9平台与其它的基因组改造技术,比如巨核酶技术、锌指核酶技术以及TALEN技术等进行深入和全面的对比。
除了在基因组改造方面的应用之外,使用Cas 9平台还可以进行基因沉默等方面的操作(比如使Cas 9蛋白失活),或者赋予Cas 9蛋白更多新的功能(比如使其具有转录因子样的转录活性等)。其实除了这种Cas 9系统之外,细菌还为我们贡献了很多其它的工具,比如限制性内切酶、热稳定的聚合酶等,极大促进了分子生物学的发展。
年初以来,一种新的基因组修饰的技术CRISPR/Cas 受到人们的高度重视。CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats)是细菌用来抵御病毒侵袭/躲避哺乳动物免疫反应的基因系统。科学家们利用RNA引导Cas9核酸酶可在多种细胞(包括iPS)的特定的基因组位点上进行切割,修饰。Rudolf Jaenisch 研究组将Cas9与Te1和Tet2特异的sgRNA共注射到小鼠的受精卵中,成功得到双基因敲除的纯合子小鼠,效率高达80%。他们将Cas9/sgRNA 与带突变序列的引物共注射,能准确在小鼠两个基因引入所要的点突变。在ES细胞中他们更是成功的一次敲除了五个
基因。与ZFN/TALEN相比,CRISPR/Cas更易于操作,效率更高,更容易得到纯合子突变体,而且可以在不同的位点同时引入多个突变。但该系统是否有脱靶效应尚需进一步的研究。
传统的转基因和基因打靶技术,由于技术稳定成熟,可以对小鼠和大鼠的基因组序列进行各种修饰,目前仍将是模式动物的构建的主要技术。核酸酶ZFN/TALEN 尤其是CRISPR/Cas技术如果能解决脱靶效应的话,有可能会广泛应用于小鼠,大鼠及其他模式动物的制备和研究中,成为传统的转基因和基因打靶技术的重要补充。
1概念编辑
基因敲除(knockout)是指一种遗传工程技术,针对某个序列已知但功能未知的序列,改变生物的遗传基因,令特定的基因功能丧失作用,从而使部分功能被屏障,并可进一步对生物体造成影响,进而推测出该基因的生物学功能。
2简介编辑
基因敲除
除和基因嵌入技术是上个世纪90年代出现的最新外源DNA导入技术。基因敲除是基因打靶技术的一种,类似于基因的同源重组。指外源DNA与受体细胞基因组中序列相同或相近的基因发生同源重组,从而代替受体细胞基因组中的相同/相似的基因序列,整合入受体细胞的基因组中。此法可产生精确的基因突变,也可正确纠正机体的基因突变。基因嵌入又称基因置换,它是利用内源基因序列两侧或外面的断裂点,用同源序列的目的基因整个置换内源基因。用于基因敲除和基因嵌入的技术有Cre/Lox P系统、FLPI系统等。
基因敲除(knock-out)
基因敲除技术是20世纪80年代发展起来的,是建立在基因同源重组技术基础以及胚胎干细胞技术基础上的一种新分子生物学技术。所谓胚胎干细胞(EmbryonicStem cell,ES)是从着床前胚胎(孕3—5天)分离出的内细胞团(Inner cellmass,ICM)细胞,它具有向各种组织细胞分化的多分化潜能,能在体外培养并保留发育的全能性。在体外进行遗传操作后,将它重新植回小鼠胚胎,它能发育成胚胎的各种组织。而基因同源重组是指当外源DNA片段大且与宿主基因片段同源性强者并互补结合时,结合区的任何部分都有与宿主的相应片段发生交换(即重组)的可能,这种重组称为同源重组。
基因敲除就是通过同源重组将外源基因定点整合入靶细胞基因
组上某一确定的位点,以达到定点修饰改造染色体上某一基因的目的的一种技术。它克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。这项技术的诞生可以说是分子生物学
技术上继转基因技术后的又一革命。尤其是条件性、诱导性基因打靶系统的建立,使得对基因靶位时间和空间上的操作更加明确、效果更加精确、可靠,它的发展将为发育生物学、分子遗传学、免疫学及医学等学科提供了一个全新的、强有力的研究、治疗手段,具有广泛的应用前景和商业价值。基因敲除技术主要应用于动物模型的建立,而最成熟的实验动物是小鼠,对于大型哺乳动物的基因敲除模型还处于探索阶段。
简单的说基因敲除是指将目标基因从基因组中删除。举一个简单的例子:比如有一段"序列":"1234567890"(原基因),敲除后为:"123
7890",一般一个敲除载体还会在其中插入一段外源基因,如"ABC",则新的基因为:"123ABC7890";或者不插入基因直接连接,则为
“1237890”。
基因敲除基本步骤示意图
利用基因打靶技术产生转基因动物的程序一般为:3基因敲除基本步骤编辑
ES细胞的获得
基因敲除一般应用于鼠,而最常用的鼠的种系是129及其杂合体,因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向,是基因敲除的理想实验动物。而其他遗传背景的胚胎干细胞系逐渐被发展应用,最来自于C57BL/6×CBN/JNCrjF1小鼠的胚胎干细胞系成功地用于基因敲除。由于这些远交系遗传背景复杂,所得到的模式小鼠往往不能得到重复性好的实验结果,所以也需要在C57BL/6等近交系小鼠上做回交。另一方面,因为回交次数不一样,也会造成实验结果重复性差。这对生物科研,尤其是医药企业,安评中心,药检部门等,是一个很大的缺点。这对开发制作标准模式动物也是一个很大的缺陷。所以,如果能够直接用C57BL/6 ES细胞进行基因打靶,就将直接获得C57BL/6品系的模式小鼠。c57BL/6小鼠种系等已经广泛的应用于免疫学,神经学,癌症,等几乎所有研究领域。已经有一些公
司或科研机构已经开始用C57BL/6遗传背景的ES细胞进行基因打靶。
基因载体的构建
把目的基因和与细胞内靶基因特异片段同源的DNA分子都重组到带有标记基因(如neo基因,TK基因等)的载体上,此重组载体即为打靶载体。因基因打靶的目的不同,此载体有不同的设计方法,可分为替换性载体和插入型载体。如为了把某一外源基因引入染色体DNA的某一位点上,这种情况下应设计的插入型载体要包括外源基因(即目的基因)、同源基因片段及标记基因等部分。如为了使某一基因失去其生理功能,这时所要设计的替换型打靶载体,应包括含有此靶基因的启动子及第一外显子的DNA片段及标记基因等诸成分。根据实验目的不同,打靶载体分为全基因敲除,条件性基因敲除,基因敲进,诱导性基因敲除等打靶载体。
目的基因导入
将基因打靶载体通过一定的方式(常用电穿孔法)导入同源的胚胎干细胞(EScell)中,使外源DNA与胚胎干细胞基因组中相应部分发生同源重组,将打靶载体中的DNA序列整合到内源基因组中从而得以表达。一般地,显微注射命中率较高,但技术难度较大,电穿孔命中率比显微注射低,但便于使用。
用选择性培养基筛选已击中的细胞
一般地,筛选使用正、负选择法,比如用G418筛选所有能表达neo基因的细胞,然后用Ganciclovir淘汰所有HSV-TK正常表达的细胞,剩下的细胞为命中的细胞。由于用于TK筛选的Gancyclovir 对小鼠的种系传递有影响,一般采用DTA(白喉毒素A亚基)进行阴性筛选。将筛选出来的靶细胞导入鼠的囊胚中,再将此囊胚植人假孕母鼠体内,使其发育成嵌合体小鼠。
2.1.1利用同源重组构建基因敲除动物模型的基本步骤(图1):a.基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA 分子都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组载体。基因敲除是为了使某一基因失去其生理功能,所以一般设计为替换型载体。
b.ES 细胞的获得:现在基因敲除一般采用是胚胎干细胞,最常用的是鼠,而兔,猪,鸡等的胚胎干细胞也有使用。常用的鼠的种系是129及其杂合体,因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向,是基因敲除的理想实验动物。而其他遗传背景的胚胎干细胞系也逐渐被发展应用。[2,3]
入同源的胚胎干细胞(ES cell)中,使外源DNA与胚胎干细胞基因组中相应部分发生同源重组,将重组载体中的DNA序列整合到内源基因组中,从而得以表达。一般地,显微注射命中率较高,但技术难度
d.选择筛选已击中的细胞:由于基因转移的同源重组自然发生率极低,动物的重组概率为10-2~10-5,植物的概率为10-4~10-5。因此如何从众多细胞中筛出真正发生了同源重组的胚胎干细胞非常重要。目前常用的方法是正负筛选法(PNS法),标记基因的特异位点表达法以及PCR法。其中应用最多的是PNS法。[6]
e.表型研究:通过观察嵌和体小鼠的生物学形状的变化进而了解目的基因变化前后对小鼠的生物学形状的改变,达到研究目的基因的目的。[2,3,7]
f.得到纯合体:由于同源重组常常发生在一对染色体上中一条染色体中,所以如果要得到稳定遗传的纯合体基因敲除模型,需要进行至少两代遗传。
转基因技术是将人工分离和修饰过的基因导入到生物体基因组中,由于导入基因的表达,引起生物体的性状的可遗传的修饰,这一技术称之为转基因技术(Transgenic technology)。人们常说的"遗传工程"、"基因工程"、"遗传转化"均为转基因的同义词。经转基因技术修饰的生物体在媒体上常被称为"遗传修饰过的生物体"(Genetically modified organism,简称GMO)。Genetically Modified--转基因,简称GM。是指运用科学手段从某种生物中提取所需要的基因,将其转入另一种生物中,使与另一种生物的基因进行重组,从而产生特定的
具有变异遗传性状的物质。利用转基因技术可以改变动植物性状,培育新品种。也可以利用其它生物体培育出期望的生物制品,用于医药、食品等方面。基因敲除技术是20世纪80年代发展起来的,是建立在基因同源重组技术基础以及胚胎干细胞技术基础上的一种新分子生物学技术。所谓胚胎干细胞(EmbryonicStem cell,ES)是从着床前胚胎(孕3-5天)分离出的内细胞团(Inner cellmass,ICM)细胞,它具有向各种组织细胞分化的多分化潜能,能在体外培养并保留发育的全能性。在体外进行遗传操作后,将它重新植回小鼠胚胎,它能发育成胚胎的各种组织。而基因同源重组是指当外源DNA片段大且与宿主基因片段同源性强者并互补结合时,结合区的任何部分都有与宿主的相应片段发生交换(即重组)的可能,这种重组称为同源重组。基因敲除就是通过同源重组将外源基因定点整合入靶细胞基因组上某一确定的位点,以达到定点修饰改造染色体上某一基因的目的的一种技术。它克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。这项技术的诞生可以说是分子生物学技术上继转基因技术后的又一革命。尤其是条件性、诱导性基因打靶系统的建立,使得对基因靶位时间和空间上的操作更加明确、效果更加精确、可靠,它的发展将为发育生物学、分子遗传学、免疫学及医学等学科提供了一个全新的、强有力的研究、治疗手段,具有广泛的应用前景和商业价值。现在基因敲除技术主要应用于动物模型的建立,而最成熟的实验动物是小鼠,对于大型哺乳动物的基因敲除模型还处于探索阶段。
i
基因工程制药 姓名:惠霞 学号:2011506024 班级:2011级生技1 班
基因工程制药 一.基因工程制药常用的工具酶: 基因工程的重要特点之—是在体外实行DNA分子的切割和重新连接。例如要取得所需药物之目的基因并要将此特定目的基因与载体DNA连接在—起,在很大程度上要依赖于某些工具酶。 (一) 限制酶(Restriction enzymes) 限制酶即限制性核酸切酶的简称,是一类专一性很强的核酸切酶。与一般的DNA水解酶不同之处在于它们对碱基作用的专一性上及对磷酸二酯键的断裂方式上具有一些特殊的性质。限制酶的种类 Ⅰ型酶:早期提取的酶类,是一类复杂的多功能酶,在基因工程上的应用价值不大。 Ⅱ型酶:相对分子质量较小,为20000~100000,是简单的单功能酶,作用时无需辅助因子或只需Mg2+。能识别双链DNA上特异的核苷酸序列,底物作用的专一性强,而且其识别序列与切断序列相一致。这类酶对基因工程中的生化操作特别重要。 (二) DNA聚合酶(DNA polymerase) DNA聚合酶是能够催化DNA复制和修复DNA分子损伤的一类酶,这类酶作用时大多数需要DNA模板并且优先作用于DNA模板,也可作用于RNA模板,但效率较低。 1.大肠杆菌DNA聚合酶Ⅰ 2. 大肠杆菌DNA聚合酶Ⅰ大片断Klenow 片断 3. T4噬菌体DNA聚合酶 4. 经修饰的T7噬菌体DNA聚合酶(测序酶) 5. T aqDNA聚合酶及AmpiTaqTMDNA聚合酶 6. 反转录酶
(三)DNA连接酶(DNA ligase):能将两段DNA拼接起来的酶。 1. T4噬菌体DNA连接酶:催化DNA的5'羟基之间形成磷酸二酯键。 2. 大肠杆菌DNA连接酶:用途较窄,不常用。 (四)基因工程中常用的其他酶 1. 末端脱氧核苷酸转移酶(末端转移酶或TDT酶) 2. T4噬菌体多核苷酸酶 3. 核酸酶(Nuclease) 4. 碱性磷酸酯酶(Alkaline phosphodiesterase):能催化去除单链或双链DNA和RNA 分子中的5' 磷酸基(脱磷酸作用)。分为细菌碱性磷酸酯酶(BAP),牛小肠碱性磷酸酯酶(CIP)。 二.基因工程制药中常用的克隆载体 载体:能在细胞进行自我复制的DNA分子就是外源DNA片段(基因)的运载体(Vector),又可称为分子载体或无性繁殖载体。基因工程制药中常用的目的基因克隆载体主要有:质粒、λ噬菌体、M13噬菌体和粘粒。 (一)质粒 1.质粒(Plasmid)是一些存在于微生物细胞染色体外的闭合环状双链的小型DNA分子,是能进行独立复制并保持恒定遗传的辅助性遗传单位。 2 常用的几种质粒载体 (1)pBR322及其衍生载体 pBR322 最早构建成功的较理想载体,分子质量2.6×106u,4.36kb,属松弛型复制,含有两个抗性基因(Tetr和Ampr),已确定32个限制酶切割位点的相对位置。BamH I
第23卷武 夷 科 学V o.l23 2007年12月WUY I SCIENCE J OURNA L D ec.2007 文章编号:1001 4276 (2007)01 0187 04 几种常用的基因敲除技术 李今煜,陈健铭,彭振坤 (福建农林大学生命科学学院,福建福州350002) 摘要: 摘要:随着功能基因组学研究的深入发展,基因敲除技术逐渐成为基因功能研究的重要手段,本文就常用的三种基因敲除技术,即同源重组、插入突变、RNA干扰各自的原理、适用的范围和优缺点作简要介绍。关键词: 基因敲除;同源重组;插入突变;RNA干扰 中图分类号: Q343.1 文献标识码: A 随着越来越多生物的全基因组被测序,功能基因组学成为时下研究的热点。研究基因功能的方法主要有两种思路,一是通过增强其表达,取得表达产物进行研究,二是减弱或者终止其表达,观察整体功能的变化,进而推测相应的基因功能。前者因为不能反映基因产物的真实表达情况,而逐渐被抛弃。后者将基因与生物的整体功能联系起来考察,并能为基因的功能提供直接证据,因而其技术不断得到发展和完善,其中最常用的就是基因敲除(gene knockou t)技术。 基因敲除技术除最早的同源重组技术外,新的原理和技术也逐渐被应用,比较成功的有基因的插入突变和RNA,i它们同样可以达到基因敲除的目的。下面就这几种基因敲除技术简要进行介绍。 1 利用同源重组进行基因敲除 基因敲除是在同源重组技术及胚胎干细胞(e mbryon i c ste m cel,l ES细胞)技术的基础上逐步完善发展起来,主要是利用DNA转化技术,将含有目的基因和靶基因同源片段的重组载体导入靶细胞,通过载体与靶细胞染色体上同源序列间的重组,将外源基因整合入内源基因组内,使外源基因得以表达。通过研究靶细胞或者个体在目的基因插入前后遗传特性的改变,达到研究基因功能的目的[1]。 基因敲除技术已从最初简单的完全敲除发展到条件敲除阶段,现正朝着特定组织基因敲除、特定时间基因敲除的可调控敲除方向发展。完全基因敲除是通过同源重组直接将靶基因在细胞或者动物个体中的活性完全消除;而条件基因敲除则是将某个基因的修饰限制于特定类型的细胞或个体发育特定的阶段,即通过位点特异的重组系统实现特定基因敲除[2],现阶段以噬菌体的C re/Loxp系统和酿酒质粒的FLP/FRT系统应用得最为广泛[3]。 虽然基因敲除技术的广泛使用使其成为研究基因功能重要的技术手段,但目前仍然存在 收稿日期:2007-09-26 基金项目:福建省自然科学基金计划资助项目(项目编号:2006J0052)。 作者简介:李金煜(1976-),女,硕士,研究方向:主要从事生物化学与分子生物学领域的研究。
兰州交通大学化学与生物工程学院综合能力训练Ⅰ——文献综述 题目:基因敲除技术研究进展 作者:王振宇 学号:201207744 指导教师:谢放 完成日期:2014-7-16
基因敲除技术研究进展 摘要基因敲除是自20世纪80年代末以来发展起来的一种新型分子生物学技术,是通过一定的途径使机体特定的基因失活或缺失的技术。在总结已有研究成果的基础上,本文对基因敲除技术的概况、原理方法应用以及近年来基因敲除技术的研究进展作一个简单的综述。 关键词基因敲除 RNA i生物模型基因置换基因打靶同源重组1. 基因敲除技术简介 基因敲除(Gene knockout)是指一种遗传工程技术,针对某个序列已知但功能未知的序列,改变生物的遗传基因,令特定的基因功能丧失作用,从而使部分功能被屏障,并可进一步对生物体造成影响,进而推测出该基因的生物学功能。 它克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。基因敲除借助分子生物学、细胞生物学和动物胚胎学的方法,通过胚胎干细胞这一特殊的中间环节将小鼠的正常功能基因的编码区破坏,使特定基因失活,以研究该基因的功能;或者通过外源基因来替换宿主基因组中相应部分,以便测定它们是否具有相同的功能,或将正常基因引入宿主基因组中置换突变基因以达到靶向基因治疗的目的。基因敲除是揭示基因功能最直接的手段之一。通常意义上的基因敲除主要是应用DNA同源重组原理,用设计的同源片段替代靶基因片段(即基因打靶),从而达到基因敲除的目的。随着基因敲除技术的发展,除了基因打靶技术外,近年来新的原理和技术也逐渐被应用,比较成功的有RNA干扰技术,同样也可以达到基因敲除的目的。简单的说基因敲除是指将目标基因从基因组中删除。基因敲除技术主要应用于动物模型的建立,而最成熟的实验动物是小鼠,对于大型哺乳动物的基因敲除模型还处于探索阶段。这项技术的诞生可以说是分子生物学技术上继转基因技术后的又一革命。尤其是条件性、诱导性基因打靶系统的建立,使得对基因靶位时间和空间上的操作更加明确、效果更加精确、
CRISPR/Cas9基因敲除原理及其应用 CRISPR(clustered,regularly interspaced,short palindromic repeats)是一种来自细菌降解入侵的病毒DNA或其他外源DNA的免疫机制。在细菌及古细菌中,CRISPR系统共分成3类,其中Ⅰ类和Ⅲ类需要多种CRISPR相关蛋白(Cas蛋白)共同发挥作用,而Ⅱ类系统只需要一种Cas蛋白即可,这为其能够广泛应用提供了便利条件[1]。 目前,来自Streptococcus pyogenes的CRISPR-Cas9系统应用最为广泛。Cas9蛋白(含有两个核酸酶结构域,可以分别切割DNA两条单链。Cas9首先与crRNA及tracrRNA结合成复合物,然后通过PAM序列结合并侵入DNA,形成RNA-DNA复合结构,进而对目的DNA双链进行切割,使DNA双链断裂。 由于PAM序列结构简单(5’-NGG-3’),几乎可以在所有的基因中找到大量靶点,因此得到广泛的应用。CRISPR-Cas9系统已经成功应用于植物、细菌、酵母、鱼类及哺乳动物细胞,是目前最高效的基因组编辑系统[1]。 通过基因工程手段对crRNA和tracrRNA进行改造,将其连接在一起得到sgRNA(single guide RNA)。融合的RNA具有与野生型RNA类似的活力,但因为结构得到了简化更方便研究者使用。通过将表达sgRNA的原件与表达Cas9的原件相连接,得到可以同时表达两者的质粒,将其转染细胞,便能够对目的基因进行操作[2,3]。
目前常用的CAS9研究方法是通过普通质粒,质粒构建流程如下:Cas9质粒构建 设计2条单链oligo序列; 退火形成双链DNA pGK1.1 将双链DNA连接到载体 中 转化G10competent cell 筛选阳性克隆;测序验证 序列;质粒大提;电转染 靶细胞 在细胞内crRNA识别靶 位点,Cas9对靶位点进行 随机剪切 Cruiser TM酶切细胞池,计 算突变率;Cruiser TM酶切 初筛阳性克隆;将阳性克 隆测序验证;做敲除序列 比对分析。
The following protocols take MLCK (myosin light chain kinase) as an example. General steps: 1.BAC extraction (It is necessary for us to identify the BAC by PCR) 2.Transform BAC to EL350 ( Cm+) 3.Retrieving (Cm+ Amp+) 4. Targeting 1st lox P (Amp+ Amp+ and K+) 5. Transform MLCK 1st lox P to EL350 to get purify MLCK 1st lox P ( Amp+ and K+) 6. MLCK 1st lox P pop out (Amp+ and K+ AmP+) 7. Transform MLCK 1st lox P pop out to EL250 (Amp+) 8. Targeting 2nd lox P (Amp+ Amp+ and K+) 9. Transform MLCK 2nd lox P to DH-5α or XL1-Blue ( Amp+ and K+) 10. Linearization 1. BAC extraction Solution I: Tris.Cl 0.025 M EDTA 0.01M Glucose 0.05M pH 8.0 Solution II: SDS 1 % NaOH 0.2M fresh prepared (1Volume 2% SDS + 1Volume 0.4M NaOH) Solution III: (120 ml 5 M KAc + 23 ml HAc + 57 ml H2O) / 200 ml
第一步:目的基因的获取 1.目的基因是指:编码蛋白质的结构基因。 2.原核基因采取直接分离获得,真核基因是人工合成。人工合成目的基因的常用方法有反转录法_和化学合成法_。 3.PCR技术扩增目的基因 (1)原理:DNA双链复制 (2)过程: 第一步:加热至90~95℃DNA解链; 第二步:冷却到55~60℃,引物结合到互补DNA链; 第三步:加热至70~75℃,热稳定DNA聚合酶从引物起始互补链的合成。 第二步:基因表达载体的构建 1.目的:使目的基因在受体细胞中稳定存在,并且可以遗传至下一代,使目的基因能够表达和发挥作用。 2.组成:目的基因+启动子+终止子+标记基因 (1)启动子:是一段有特殊结构的DNA片段,位于基因的首端,是RNA聚合酶识别和结合的部位,能驱动基因转录出mRNA,最终获得所需的蛋白质。 (2)终止子:也是一段有特殊结构的DNA片段,位于基因的尾端。 (3)标记基因的作用:是为了鉴定受体细胞中是否含有目的基因,从而将含有目的基因的细胞筛选出来。常用的标记基因是抗生素基因。 第三步:将目的基因导入受体细胞_ 1. 转化的概念: 是目的基因进入受体细胞内,并且在受体细胞内维持稳定和表达的过程。 2.常用的转化方法: 将目的基因导入植物细胞:采用最多的方法是农杆菌转化法,其次还有基因枪法和花粉管通道法等。 将目的基因导入动物细胞:最常用的方法是显微注射技术。此方法的受体细胞多是受精卵。 将目的基因导入微生物细胞:原核生物作为受体细胞的原因是繁殖快、多为单细胞、遗传物质相对较少,最常用的原核细胞是大肠杆菌,其转化方法是:先用Ca2+ 处理细胞,使其成为感受态细胞,再将重组表达载体DNA分子溶于缓冲液中与感受态细胞混合,在一定的温度下促进感受态细胞吸收DNA分子,完成转化过程。 3.重组细胞导入受体细胞后,筛选含有基因表达载体受体细胞的依据是标记基因是否表达。 第四步:目的基因的检测和表达 1.首先要检测转基因生物的染色体DNA上是否插入了目的基因,方法是采用DNA
.. 一、常规基因敲除鼠(Conventional Knockout) 常规基因敲除是通过基因打靶,把需要敲除的基因的几个重要的外显子或者功能区域用Neo Cassette 替换掉。这样的小鼠其全身所有的组织和细胞中都不表达该基因产物。此类基因敲除鼠一般用于研究某个基因在对小鼠全身生理病理的影响,而且这个基因没有胚胎致死性。 二、条件性基因敲除小鼠(Conditional Knockout) 条件性基因敲除小鼠是通过基因打靶,把两个loxP 位点放到目的基因一个或几个重要的外显子的两边。该小鼠和表达Cre酶小鼠杂交之前,其目的基因表达完全正常。当和组织特异性表达Cre酶的小鼠进行杂交后,可以在特定的组织或细胞中敲除该基因,而该基因在其他组织或细胞表达正常。 条件性基因敲除鼠适用范围为:(1)该基因有胚胎致死性;(2)用于研究该基因在特定的组织或细胞中的生理病理功能。 三、基因敲入小鼠(Knockin) 基因敲入小鼠是通过基因打靶,把目的基因序列敲入到小鼠的相应基因位点,使用小鼠的表达调控元件指导目的基因表达。 此类基因敲入鼠一般用于药物的筛选,信号通路的研究等。 获得嵌合体及之后品系纯化详细流程: 基因敲除其他方法: 一、ZFN技术制作基因敲除鼠 ZFN能够识别并结合指定的基因序列位点,并高效精确地切断。随后细胞利用天然的DNA 修复过程来实现DNA的插入、删除和修改,这样研究人员就能够随心所欲地进行基因组编辑。这在过去是无法想象的,传统的基因敲除技术依赖细胞内自然发生的同源重组,其效率只有百万分之一,而ZFN的基因敲除效率能达到10%。利用这些技术进行小鼠基因的定点敲除和敲入,可以把时间从一年缩短到几个月。 这项技术中设计特异性的ZFN是最关键的环节,目前研究者采用计算生物学方法设计高特异性的ZFN,但ZFN的脱靶(off target),也就是把不该切的地方切了的问题仍是一个挑战。也正因为这个原因,利用ZFN技术进行小鼠的基因修饰还无法完全取代传统技术。 二、TALEN技术制作基因敲除鼠 TALEN 技术是一种崭新的分子生物学工具。科学家发现,来自一种植物细菌的TAL蛋白的核酸结合域的氨基酸序列与其靶位点的核酸序列有恒定的对应关系。利用TAL的序列模块,可组装成特异结合任意DNA序列的模块化蛋白,从而达到靶向操作内源性基因的目的,它克服了ZFN方法不能识别任意目标基因序列,以及识别序列经常受上下游序列影响等问题,而具有ZFN相等或更好的灵活性,使基因操作变得更加简单方便。然而同样因为脱靶的问题,利用TALEN技术进行小鼠的基因修饰仍然无法取代传统技术。 ;.
基因敲除技术的最新进展 yunfenglin 干细胞与组织工程讨论版 【摘要】 自从上世纪80年代初的胚胎干细胞技术的成熟,在短短的20年里,关于基因敲除动物模型的报道呈几何数增长。现在的技术已经可以产生在时间和空间上都可以人为控制的,从点突变到染色体组大片段的删除和重排的各种基因突变小鼠,这样就可以让研究每个基因的具体功能成为可能。本文将首先简介基因敲除技术的技术背景、基本原理、基本步骤;然后将重点介绍现在基因敲除的常用策略及其利弊;接着将探讨基因打靶结果不理想的常见因素,包括基因背景、基因重复、基因补偿、和基因补充;最后介绍基因打靶技术的技术热点,包括组织特异性打靶、诱导性打靶。并探讨基因打靶技术在颌面外科的应用前景。 【关键词】基因敲除、条件性基因打靶、组织特异性基因打靶、诱导性基因打靶 技术背景 基因打靶技术是20世纪80年代发展起来的[1],是建立在基因同源重组技术基础以及胚胎干细胞技术基础上的一种新分子生物学技术。所谓胚胎干细胞(Embryonic Stem cell,ES)是从着床前胚胎(孕3—5天)分离出的内细胞团(Inner cell mass,ICM)细胞[2],它具有向各种组织细胞分化的多分化潜能,能在体外培养并保留发育的全能性。在体外进行遗传操作后,将它重新植回小鼠胚胎,它能发育成胚胎的各种组织。而基因同源重组是指当外源DNA片段大且与宿主基因片段同源性强者并互补结合时,结合区的任何部分都有与宿主的相应片段发生交换(即重组)的可能,这种重组称为同源重组。[3] 基因打靶就是通过同源重组将外源基因定点整合入靶细胞基因组上某一确定的位点,以达到定点修饰改造染色体上某一基因的目的的一种技术[4]。它克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。这项技术的诞生可以说是分子生物学技术上继转基因技术后的又一革命。尤其是条件性、诱导性基因打靶系统的建立,使得对基因靶位时间和空间上的操作更加明确、效果更加精确、可靠,它的发展将为发育生物学、分子遗传学、免疫学及医学等学科提供了一个全新的、强有力的研究、治疗手段,具有广泛的应用前景和商业价值。现在基因敲除技术主要应用于动物模型的建立,而最成熟的实验动物是鼠,对于大型哺乳动物的基因敲除模型还处于探索阶段。2000年初的敲除了决定表面抗原的猪的模型的成功建立更是为异种器官移植排除了一道重要的障碍,展示了基因敲除技术的美好前景。 基本步骤 利用基因打靶技术产生转基因动物的程序一般为: a.ES细胞的获得:现在基因敲除一般应用于鼠,而最常用的鼠的种系是129及其杂合体,因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向,是基因敲除的理想实验动物。而其他遗传背景的胚胎干细胞系逐渐被发展应用,最近来自于C57BL/6×CBN/JNCrj F1小鼠的胚胎干细胞系成功地用于基因敲除。c57BL/6小鼠种系等已经广泛的应用于免疫学领域,并以此为背景建立了许多成功的转基因模型。[5,9,11] b.基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA分子都重组到带有标记基因(如neo基因,TK基因等)的载体上,此重组载体即为打靶载体。因基因打靶的目的不同,此载体有不同的设计方法,可分为替换性载体和插入型载体[6,7]。如为了把某一外源基因引入染色体DNA的某一位点上,这种情况下应设计的插入型载体要包括外源
基因敲除技术的原理、方法和应用 2010-01-24 17:03:43 来源:易生物实验浏览次数:6302 网友评论 0 条 1.基因敲除概述 2.实现基因敲除的多种原理和方法: 2.1.利用基因同源重组进行基因敲除 2.2利用随机插入突变进行基因敲 除。 2.3.RNAi引起的基因敲除。 3.基因敲除技术的应用及前景 4.基因敲除技术的缺陷 关键词:基因敲除 1.基因敲除概述: 基因敲除是自80年代末以来发展起来的一种新型分子生物学技术,是通过一定的途径使机体特定的基因失活或缺失的技术。通常意义上的基因敲除主要是应用DNA同源重组原理,用设计的同源片段替代靶基因片段,从而达到基因敲除的目的。随着基因敲除技术的发展,除了同源重组外,新的原理和技术也逐渐被应用,比较成功的有基因的插入突变和iRNA,它们同样可以达到基因敲除的目的。 2.实现基因敲除的多种原理和方法: 2.1.利用基因同源重组进行基因敲除 基因敲除是80年代后半期应用DNA同源重组原理发展起来的。80年代初,胚胎干细胞(ES细胞)分离和体外培养的成功奠定了基因敲除的技术基础。1985 年,首次证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。到1987年,Thompsson首次建立了完整的ES细胞基因敲除的小鼠模型 [1]。直到现在,运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中最普遍的使用方法。 2.1.1利用同源重组构建基因敲除动物模型的基本步骤(图1): a.基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA 分子都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组载体。基因敲除是为了使某一基因失去其生理功能,所以一般设计为替换型载体。
基因敲除技术 点击次数: 2605 发布日期: -5-25 来源: 本站仅供参考, 谢 绝转载, 否则责任自负 1.概述: 基因敲除是自80年代末以来发展起来的一种新型分子生物学技术, 是经过一定的途径使机体特定的基因失活或缺失的技术。一般意义上的基因敲除主要是应用DNA同源重组原理, 用设计的同源片段替代靶基因片段, 从而达到基因敲除的 目的。随着基因敲除技术的发展, 除了同源重组外, 新的原理和技术也逐渐被应用, 比较成功的有基因的插入突变和iRNA, 它们同样能够达到基因敲除的目的。2.实现基因敲除的多种原理和方法: 2.1.利用基因同源重组进行基因敲除 基因敲除是80年代后半期应用DNA同源重组原理发展起来的。80年代初, 胚胎干细胞( ES细胞) 分离和体外培养的成功奠定了基因敲除的技术基础。1985年, 首次证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。到 1987年, Thompsson首次建立了完整的ES细胞基因敲除的小鼠模型[1]。直到现在, 运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中最普遍的 使用方法。 2.1.1利用同源重组构建基因敲除动物模型的基本步骤(图1):
图1.基因同源重组法敲除靶基因的基本步骤 a.基因载体的构建: 把目的基因和与细胞内靶基因特异片段同源的DNA 分子 都重组到带有标记基因(如neo 基因, TK 基因等)的载体上, 成为重组载体。基因敲除是为了使某一基因失去其生理功能, 因此一般设计为替换型载体。 b.ES 细胞的获得: 现在基因敲除一般采用是胚胎干细胞, 最常见的是鼠, 而兔, 猪, 鸡等的胚胎干细胞也有使用。常见的鼠的种系是129及其杂合体, 因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向, 是基因敲除的理想实验动物。而其它遗传背景的胚胎干细胞系也逐渐被发展应用。[2, 3] c.同源重组: 将重组载体经过一定的方式(电穿孔法或显微注射)导入同源的胚胎干细胞(ES cell)中, 使外源DNA与胚胎干细胞基因组中相应部分发生同源重组, 将重组载体中的DNA序列整合到内源基因组中, 从而得以表示。一般地, 显微注射命中率较高, 但技术难度较大, 电穿孔命中率比显微注射低, 但便于使用。[4,5] d.选择筛选已击中的细胞: 由于基因转移的同源重组自然发生率极低, 动物的重组概率为10-2~10-5, 植物的概率为10-4~10-5。因此如何从众多细胞中筛出真正发生了同源重组的胚胎干细胞非常重要。当前常见的方法是正负筛选法( PNS法) , 标记基因的特异位点表示法以及PCR法。其中应用最多的是PNS法。[6]
转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,并逐渐从基 础研究实验室转向商业模式,成为一项高度标准化的新兴产业 一、技术介绍与研究进展 转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生 以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等 常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。尽管 如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN等新技术的出现,或有可能将这一局面彻底改变。 二、同源重组技术原理 基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基 因打靶"(gene targeting)或"基因敲除"(gene knockout),利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi 和Smithies于2007年与Evans分享了诺贝尔医学奖。 同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的
基因敲除的新技术——RNAi 作者:金美芳, 朱雪明 作者单位:江苏省苏州大学附属儿童医院中心实验室,215003 刊名: 国际检验医学杂志 英文刊名:INTERNATIONAL JOURNAL OF LABORATORY MEDICINE 年,卷(期):2007,28(11) 参考文献(22条) 1.Elbashir SM;Harborth J;Lendeckel W Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells[外文期刊] 2001(6836) 2.Yu JY;DeRuiter SL;Turner DL RNA interference by expression of short-interfering RNAs and hairpin RNAs in mammalian cells 2002(09) 3.Hannon GJ RNA interference[外文期刊] 2002(6894) 4.Zhang L;Yang N;Mohamed-Hadley A Vector-based RNAi,a novel tool for isoform-specific knock-down of VEGF and anti-angiogenesis gene therapy of cancer[外文期刊] 2003(04) 5.Castanotto D;Li H;Rossi JJ Functional siRNA expression from transfected PCR products 2002(11) 6.DasGupta R;Kaykas A;Moon RT Functional genomic analysis of the Wnt-wingless signaling pathway[外文期刊] 2005(5723) 7.Wilds M;Fuchs U;W(o)ssmann W Killing of leukemic cells with a BCR/ABL fusion gene by RNA interference(RNAi)[外文期刊] 2002(37) 8.Reid G;Wielinga P;Zelcer N The human multidrug resistance protein MRP4 functions as a prostaglandin efflux transporter and is inhibited by nonsteroidal antiinflammatory drugs 2003(16) 9.Fan QW;Weiss WA RNA interference against a glioma-derived allele of EGFR induces blockade at G2M [外文期刊] 2005(05) 10.Plasterk RH RNA silencing:the genome's immune system[外文期刊] 2002(5571) 11.Randall G;Grakoui A;Rice CM Clearance of replicating hepatitis C virus replicon RNAs in cell culture by small interfering RNAs 2003(01) 12.Wilson JA;Jayasena S;Khvorova A RNA interference blocks gene expression and RNA synthesis from hepatitis C replicons propagated in human liver cells 2003(05) 13.Moore MD;McGarvey MJ;Russell RA Stable inhibition of hepatitis B virus proteins by small interfering RNA expressed from viral vectors[外文期刊] 2005(07) 14.Uprichard SL;Boyd B;Althage A Clearance of hepatitis B virus from the liver of transgenic mice by short hairpin RNAs[外文期刊] 2005(03) 15.Novina CD;Murray MF;Dykxhoorn DM siRNA-directed inhibition of HIV-1 infection[外文期刊] 2002(07) 16.Anderson J;Banerjea A;Planelles V Potent suppression of HIV type 1 infection by a short hairpin anti-CXCR4 siRNA[外文期刊] 2003(08) 17.Song E;Lee SK;Dykxhoorn DM Sustained small interfering RNA-mediated human immunodeficiency virus type 1 inhibition in primary macrophages[外文期刊] 2003(13) 18.Gitlin L;Karelsky S;Andino R Short interfering RNA confers intracellular antiviral immunity in
C R I S P R C a s基因敲除原 理及其应用 The Standardization Office was revised on the afternoon of December 13, 2020
CRISPR/Cas9基因敲除原理及其应用 CRISPR(clustered,regularlyinterspaced,shortpalindromicrepeats)是一种来自细菌降解 入侵的病毒DNA或其他外源DNA的免疫机制。在细菌及古细菌中,CRISPR 系统共分成3类,其中Ⅰ类和Ⅲ类需要多种CRISPR相关蛋白(Cas蛋白)共同发挥作用,而Ⅱ类系统只需要一种Cas蛋白即可,这为其能够广泛应用提供了便利条件[1]。 目前,来自Streptococcuspyogenes的CRISPR-Cas9系统应用最为广泛。Cas9蛋白(含有两个核酸酶结构域,可以分别切割DNA两条单链。Cas9首先与crRNA及tracrRNA结合成复合物,然后通过PAM序列结合并侵入DNA,形成RNA-DNA复合结构,进而对目的DNA双链进行切割,使DNA双链断裂。 由于PAM序列结构简单(5’-NGG-3’),几乎可以在所有的基因中找到大量靶点,因此得到广泛的应用。CRISPR-Cas9系统已经成功应用于植物、细菌、酵母、鱼类及哺乳动物细胞,是目前最高效的基因组编辑系统[1]。 通过基因工程手段对crRNA和tracrRNA进行改造,将其连接在一起得到sgRNA(singleguideRNA)。融合的RNA具有与野生型RNA类似的活力,但因为结构得到了简化更方便研究者使用。通过将表达sgRNA的原件与表达Cas9的原件相连接,得到可以同时表达两者的质粒,将其转染细胞,便能够对目的基因进行操作[2,3]。 目前常用的CAS9研究方法是通过普通质粒,质粒构建流程如下: Cas9质粒构建 设计2条单链oligo序列;退火形成双链DNA
基因工程的基本过程 基因工程主要包括几个过程: 1、目的基因的制备; 2、选择合适的载体,将目的基因与载体相连接生成重组DNA分子; 3、将重组DNA片段导入受体; 4、选择目的基因; 5、目的基因的表达。 对于整个基因过程来讲,目的基因的获取是关键,它直接涉及到产物,而且还影响到产物的量。很多在基因操作过程中,目的基因是很难获得的,所以通常采取先生成基因文库的方法,然后从基因文库中筛选。如果目的基因的序列以及它的调控等信息很清楚,可以直接通过PCR或cDNA获取,这样就大大减少了选择目的基因的盲目性,可以将整个过程简化为以下步骤: 图10-3-8 基因工程过程
(1)目的基因的分离和制备 目的基因是指准备导入受体细胞内的,以研究或应用为目的所需要的外源基因称目的基因。获得目的基因的方法很多,但也是十分困难的一步。目前获得目的基因有4条途径: 1.从生物基因组群体中分离目的基因 原核生物基因组较小,基因容易定位,用限制性内切酶将基因组切成若干段后,用带有标记的核酸探针,从中选出目的基因。真核生物一般通过基因组文库的方法获得目的基因。 图10-3-1 限制性内切酶
限制性内切酶(restrictive enzyme)是20世纪60年代末在细菌中发现的,能水解DNA分子骨架的磷酸二酯键,使一个完整的DNA分子切成若干段,每一种限制酶,都有自己特定的作用位点,而且切口或切下来的序列,往往是回文结构(palindromes)。例如Eco RI把GAATTC在GA之间切开,形成粘性末端。也有一些限制酶作用的结果产生不含粘性末端的平整末端,如HapI。多在原核生物中存在,能识别4~6个特苷酸特定的碱基序列。限制酶对细菌有保护作用,某些入侵的噬菌体可因DNA链被限制性酶切断而不能在细菌中繁殖,“限制”因此而得名。限制酶不能切开细菌本身的DNA,这是因为细菌DNA的腺嘌呤和胞嘧啶甲基化(-CH3)而受到保护之故。 这样就可以用限制性内切酶把一个基因组DNA分成很多片段,对于原核生物比较小的基因组来说,可以直接用标记地探针来获取在通过特定的方法,对于比较大的基因组,可以先制作基因文库,然后钓取所需要的带有目的基因的片段。 2.人工合成目的基因DNA片段 人工合成目的基因DNA片段有化学合成和酶促合成法两条途径。一般是采用DNA合成仪来合成长度不是很大的DNA片段。 3.PCR反应合成DNA 聚合酶链式反应(PCR)是以DNA变性、复制的某些特性为原理设计的。通过PCR技术获取所需要的特异DNA片段在实际应用用得非常多,但是前提条件是必须对目的基因有一定的了解,需要设计引物。PCR技术的原理如下:
水寨中学生物自主探究学案 内容:基因工程的基本操作程序课时:2课时年级:高二编号64 一、教学目标 1.知识目标: 了解基因工程原理及基本操作程序。 2.能力目标: 尝试设计某一转基因生物的研制过程。 3.情感、态度和价值观目标: (1)了解基因工程的发展。 (2)认同基因工程的诞生和发展离不开理论研究和技术创新。 二、教学重点和难点 1、教学重点 基因工程基本操作程序的四个步骤。 2、教学难点 (1)从基因文库中获取目的基因 (2)利用PCR技术扩增目的基因 第一课时 三、教学过程 (一)复习上节内容 1、什么是基因工程?DNA重组技术的基本工具有哪些?运载体需要具备哪些条件? 以上问题可以不展示 (二)讲授新课 1、基因工程的基本步骤包括那四步? 2、第一步:目的基因的获取 (1)为什么要有目的基因的获取这一步骤? (2)目的基因的获取方法有哪些? (3)为什么要建立基因文库?怎么建立的?
(4)如何从基因文库中获取目的基因? (5)为什么要建立cDNA文库?如何获取cDNA? (5)PCR技术的原理是什么?利用PCR技术扩增目的基因的前提是什么? (6)如何获取引物? (7)请你用文字和箭头描述PCR技术扩增的过程? 3、第二步:基因表达载体的构建(基因工程的核心步骤) (1)在基因工程的操作过程中,为什么要构建基因表达载体?单独的DNA片段能不能稳定遗传? (2)参考课本P11页图1—10基因表达载体模式图,在学案上绘出基因表达载体的模式图,并标出其组成部分。并了解什么是启动子、终止子?他们位于哪里?有什么作用?标记基因的作用是什么?
思考:1、作为基因工程的表达载体,只需含有目的基因就可以完成任务吗?为什么 2、完成教材P11页的“寻根问底” 第二课时 4、第三步:将目的基因导入受体细胞 (1)为什么要把目的基因导入受体细胞而不是在外界培养让其维持稳定和表达?(2)什么是转化? (3)将目的基因导入植物细胞的方法有哪些?最常用的方法是哪种?(结合示意图,了解农杆菌转化法的基本过程) (4)将目的基因导入动物细胞的基本操作程序是怎样的?要用到什么技术? (5)早期的基因工程为什么选择原核生物作为受体细胞?大肠杆菌细胞最常用的转化方法是?
基因敲除技术 1.概述: 基因敲除是自80年代末以来发展起来的一种新型分子生物学技术,是通过一定的途径使机体特定的基因失活或缺失的技术。通常意义上的基因敲除主要是应用DNA同源重组原理,用设计的同源片段替代靶基因片段,从而达到基因敲除的目的。随着基因敲除技术的发展,除了同源重组外,新的原理和技术也逐渐被应用,比较成功的有基因的插入突变和iRNA,它们同样可以达到基因敲除的目的。 2.实现基因敲除的多种原理和方法: 2.1. 利用基因同源重组进行基因敲除 基因敲除是80年代后半期应用DNA同源重组原理发展起来的。80年代初,胚胎干细胞(ES细胞)分离和体外培养的成功奠定了基因敲除的技术基础。1985年,首次证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。到1987年,Thompsson首次建立了完整的ES细胞基因敲除的小鼠模型[1]。直到现在,运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中最普遍的使用方法。 2.1.1利用同源重组构建基因敲除动物模型的基本步骤(图1): a. 基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA 分子都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组载体。基因敲除是为了使某一基因失去其生理功能,所以一般设计为替换型载体。 b.ES 细胞的获得:现在基因敲除一般采用是胚胎干细胞,最常用的是鼠,而兔,猪,鸡等的胚胎干细胞也有使用。常用的鼠的种系是129及其杂合体,因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向,是基因敲除的理想实验动物。而其他遗传背景的胚胎干细胞系也逐渐被发展应用。[2,3] c.同源重组:将重组载体通过一定的方式(电穿孔法或显微注射)导入同源的胚胎干细胞(ES cell)中,使外源DNA与胚胎干细胞基因组中相应部分发生同源重
基因敲除三大技术对比 技术名称优势局限性可提供服务类型 基于胚胎干细胞的同源重组技术成熟、可靠、精细是目前 为止唯一一个可以满足所 有要求的打靶技术 1)需要ES细胞,目前只有 小鼠有高效的ES细胞,其它 模式动物的ESC还不能实现 大规模应用。 2)周期长、工作量大、费用 相对比较高 1)全基因敲除模式小鼠 2)条件性基因敲除模式小鼠 3)先全敲除再条件性敲除模 式小鼠 4)基因敲入模式小鼠 5)ROSA位点定点转基因 TALEN技术基因敲除效率高,速度快, 可实现多物种基因敲除基因敲入效率较低,多基因敲 除困难,系统构建相对复杂, 存在脱靶风险 1)全基因敲除大/小鼠 2)全基因敲除细胞系 EGE系统基因敲除/敲入效率高,速 度快,可实现多基因、多 物种基因敲除/敲入,系统 构建简单存在脱靶风险,但通过选择合 适的sgRNA可以有效降低脱 靶率,In vivo脱靶可通过传 代去除 1)全基因/条件性基因敲除大 /小鼠 2)全基因/条件性报告基因敲 除/敲入大/小鼠 3)CRISPR/Cas9粒构建 4)细胞系敲除/敲入
免疫类 B-NSG小鼠:Biocytogen-NOD-SCID-IL2rg B-NSG小鼠是NOD遗传背景,Prkdc和IL2rg双基因敲除的小鼠,是目前国际公认的免疫缺陷程度最高、最适合人源细胞或组织移植的工具小鼠。 基本特征 ?NOD(non-obese diabetes)遗传背景:自发I型糖尿病;其巨噬细胞对人源细胞吞噬作用弱;先天免疫系统,如补体系统和树突状细胞功能降低。 ?Prkdcscid :Prkdc(protein kinase DNA-activated catalytic)基因突变,小鼠的功能性T 和B细胞缺失,淋巴细胞减少,表现为细胞免疫和体液免疫的重度联合免疫缺陷(severe combined immune deficiency, scid)。 ?Il2rgnull:Interleukin-2受体的gamma链(IL-2R γc,又称CD132)位于小鼠X染色体上,是具有重要免疫功能的细胞因子Il2、Il-4、Il-7、Il-9、Il-15和I-21的共同受体亚基,该基因敲除后的小鼠机体免疫功能严重降低,尤其是NK细胞的活性几乎丧失。 B-NSG小鼠:综合了NOD-SCID-IL2rg背景特征,具有重度免疫缺陷表型,无成熟T细胞、B 细胞和功能性NK细胞,细胞因子信号传递能力缺失等。非常适合人造血干细胞及外周血单核细胞的移植和生长。 优点 ?迄今世界上免疫缺陷程度最高的工具小鼠; ?与NOD-scid小鼠相比寿命更长,平均长达1.5年; ?对人源细胞和组织几乎没有排斥反应; ?少量细胞即可成瘤,依赖于细胞系或细胞类型; ?无B淋巴细胞泄漏。