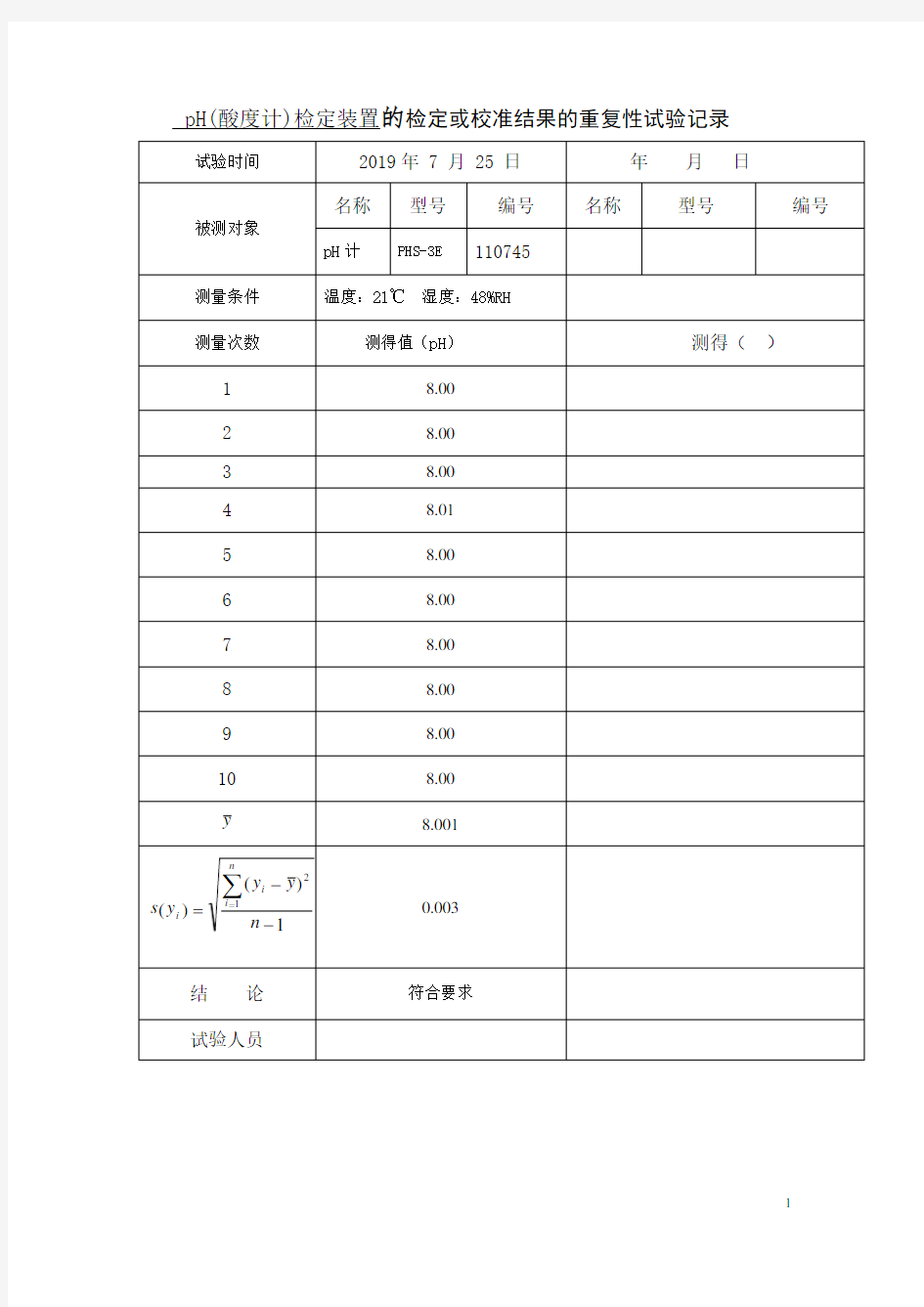

pH(酸度计)检定装置的检定或校准结果的重复性试验记录
pH(酸度计)检定装置的稳定性考核记录
电子天平 验证报告 河北化工医药制药有限公司 2014年5月
电子天平 验证方案方案制订 方案审核 方案批准
目录 1 引言 (3) 2验证的人员及职责 (3) 3 安装验证 (3) 4 运行确认 (5) 5性能确认 (6) 6 再验证周期 (6) 7 验证结果评定与结论 (7)
一、引言 1.1 概述:该天平除了称量,去皮和校准外,在基本称量操作中还具有可激活计件、百分比称量、动态称量功能。 1.2 使用条件 使用环境温湿度温度:10--30℃。湿度:15%--80% 1.3 技术数据: 1.3.1最大称量范围。 1.3.2重复性。 1.4验证目的及合格标准 1.4.1最大允许误差测定:新品或修理后天平,分度值0.1mg,最大允许误差为0.5mg,分度值为0.01mg,最打允许误差为0.05mg。使用中的天平最大允许误差可以放宽1倍。 1.4.2重复性误差测定:同一载荷多次衡量结果之间的差值不得超过天平在该载荷时的最大允许误差的绝对值。 1.4.3死角误差测定:砝码加在秤盘不同位置上,天平的视值应保持在最大允许误差之内。及分度值为0.1mg者,四角误差不应大于0.5mg,分度值为0.01mg 者,四角误差应不大于0.05mg。 三、安装验证: 3.1 包装验证:
验证人:验证时间:年月日 验证人:验证时间:年月日3.4 仪器有关文件
3.5 验证结论: 验证人:验证日期:年月日四、运行验证: 4.1标准操作程序验证 4.2 操作验证 4.2.1 接通电源 4.2.2 天平的校正 4.2.3 验证结论: 验证人:验证日期:年月日
稳定性-重复性
压力计计量装置的重复性试验记录 试验时间2015年 2月17日2015年8月16日 被测对象 名称型号编号名称型号编号 压力变 送器 EJA530A S4NC04780 压力变 送器 EJA530A S4NC04780 测量条件符合要求符合要求测量次数测量值(mA)测量值(mA) 1 11.9775 11.9814 2 11.9779 11.9816 3 11.9776 11.9814 4 11.9774 11.9813 5 11.9778 11.9814 6 11.9773 11.9816 7 11.9781 11.9815 8 11.9785 11.9812 9 11.9780 11.9813 10 11.9781 11.9814 y11.9778 11.9814 1) ( ) (1 2 - - =∑ = n y y y s n i i i 0.3702μA0.1291μA 结论符合要求符合要求试验人员孙成霖孙成霖 注:已建计量标准,至少每年进行一次重复性试验,测得的重复性应满足检定或校准结果的测量不确定度的
压力表计量装置的重复性试验记录 试验时间2016年 2月16日2016年8月18日 被测对象 名称型号编号名称型号编号 压力变 送器 EJA530 A S4NC04780 压力变 送器 EJA530 A S4NC04780 测量条件符合要求符合要求测量次数测量值(mA)测量值(mA) 1 11.9814 11.9813 2 11.9812 11.9817 3 11.9815 11.9816 4 11.9814 11.9815 5 11.9813 11.9816 6 11.9815 11.9817 7 11.9813 11.9815 8 11.9818 11.9815
电子天平期间核查规程 及记录 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
物理检测组电子天平期间核查规程 1. 编制目的 保障检测中心电子天平的正常运行,在两次检定/校准之间,进行期间核查,验证该设备是否保持检定/校准时的状态,确保其检验数据数据的有效性和准确性。 2. 适用范围 适用于本中心内部适用AG204AR2140等电子天平的期间核查。 3. 检查项目 电子天平示值误差、重复性误差、偏载误差与最大称量。 4. 检查依据 4.1 JJG1036-2008《电子天平鉴定规程》电子天平使用说明书 5. 标准器具 2F 等级标准砝码:1mg ~500g 6.检验方法 天平的示值误差 在仪器正常工作条件下,记录不同载荷点时天平示值。并按下式计算天平示值误差。 0E E -=天平示值误差(1) E —加载时天平示值;0E —加载的标准砝码质量。 天平重复性误差 在仪器正常工作条件下,用规定载荷的标准砝码重复称量10次,记录天平示值,并按下式计算天平重复性误差。 min max E E -=天平重复性误差(2) max E —加载时天平示值误差的最大值;min E —加载时天平示值误差的最小值。
天平偏载误差 在仪器正常工作条件下,将规定载荷点的标准砝码分别置于天平四个边角及中心位置,记录天平的示值,并按式(1)计算天平的偏载误差。 天平最大称量 在仪器正常工作条件下,添加210g标准砝码,记录天平示值。 7.评定 天平核查项目符合表1要求,则判定天平正常。 8.核查周期 在两次检定/校准之间,建议每隔两个月核查一次。 9.相关记录 电子天平期间核查记录。 表1电子天平技术要求 编制:审核:批准: 物理检测组 电子天平期间核查记录
产品稳定性考察管理规程 1.目的 建立一个产品稳定性考察管理规程,使能在产品有效期内监控已上市药品的质量,以发现药品与生产相关的稳定性问题,并确定药品能够在标示的贮存条件下,符合质量的各项要求。 2.范围 已获准上市的市售包装药品。 3.责任 QC部负责执行本规程。 4.内容 4.1 由够资格的专业技术人员制定稳定性计划,报主管部门负责人批准后执行。 4.2 由授权人担任稳定性试验的全面工作。 4.3稳定性分类 4.3.1影响因素试验 4.3.2加速试验 4.3.3长期试验 考察产品分为以下四类: A类:新产品头3批产品做长期稳定性考察;直至转正后。 B类:当影响产品质量的主要因素,如工艺改进、设备变更、改变内包装形 式、主要原辅料供应商变更的头三批产品做长期稳定性考察; C类:生产过程中遇到特殊情况,可能会影响质量稳定性的产品,如返工、或 有回收操作的批次,该批产品做长期稳定性考察。 D类:除上述A、B、C类之外的产品,长期生产的产品每年选择至少1批产品 做长期稳定性考察,除当年未生产 4.4考察原则 4.4.1 正常批量生产的最初一批产品应当列入持续稳定性考察计划,以进一步确认有效 期。 4.4.2 正常情况下,每一品种的每一规格、每一内包装形式的药品每年考察一个批次。 4.4.3 特殊情况下,重大变更或生产和包装有重大偏差的药品以及重新加工、返工或回 收的批次应列入稳定性考察,并增加考察批次,一般应不少于三批。 4.6制定稳定性计划 4.6.1质量保证部QA人员于每年年初依据本年度的生产计划制订年度稳定性试验计划, 确定本年度将进行的和可能要增加进入稳定性试验程序的品种,并于每年年终
物理检测组电子天平期间核查规程 1. 编制目的 保障检测中心电子天平的正常运行,在两次检定/校准之间,进行期间核查,验证该设备是否保持检定/校准时的状态,确保其检验数据数据的有效性和准确性。 2. 适用范围 适用于本中心内部适用AG204 AR2140 等电子天平的期间核查。 3. 检查项目 电子天平示值误差、重复性误差、偏载误差与最大称量。 4. 检查依据 4.1 JJG 1036-2008《电子天平鉴定规程》 电子天平使用说明书 5. 标准器具 2F 等级标准砝码:1mg ~500g 6. 检验方法 天平的示值误差 在仪器正常工作条件下,记录不同载荷点时天平示值。并按下式计算天平示值误差。 0E E -=天平示值误差 (1) E —加载时天平示值; 0E —加载的标准砝码质量。
天平重复性误差 在仪器正常工作条件下,用规定载荷的标准砝码重复称量10次,记录天平示值,并按下式计算天平重复性误差。 min max E E -=天平重复性误差 (2) max E —加载时天平示值误差的最大值; min E —加载时天平示值误差的最小值。 天平偏载误差 在仪器正常工作条件下,将规定载荷点的标准砝码分别置于天平四个边角及中心位置,记录天平的示值,并按式(1)计算天平的偏载误差。 天平最大称量 在仪器正常工作条件下,添加210g 标准砝码,记录天平示值。 7. 评定 天平核查项目符合表1要求,则判定天平正常。 8. 核查周期 在两次检定/校准之间,建议每隔两个月核查一次。 9. 相关记录 电子天平期间核查记录。 表1 电子天平技术要求
编制: 审核: 批准: 物理检测组 电子天平期间核查记录 1 天平的示值误差 从零载开始逐渐加到天平的最大加法配衡(能达到最大载荷最好)再逐渐地 卸下荷载直至零在下表中记载相关数据。并按公式: 0E E -=天平示值误差计算,式中:E —加载时天平示值;0E —加载的标准砝码质量。
稳定性考察方案 制定人:日期: 审核人:日期: 批准人:日期: 北京远策药业有限公司 目录 一、目的 二、范围 三、职责 四、产品介绍 五、药品稳定性考察信息表和检测方法依据 六、具体方案 1.产品批量的选择 2.考察条件、时间 3.样品测试时限的要求 七、稳定性考察报告 1.考察报告内容的要求 2.偏差处理 3.报告的时限要求 4.报告程序 5.记录管理要求 6.档案保存期限 一、目的 药品的稳定性是指原料药及其制剂保持其物理、化学、生物学和微生物学性质的能力。稳定性试验的目的是考察原料药、中间产品或制剂的性质在温度、湿度、光线等条件的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件和有效期的确定提供科学依据,以保障临床用药的安全有效。并且通过持续稳定性考察可以监测在有效期内药品的质量,并确定药品可以或预期可以在标示的贮存条件下,符合质量标准的各项要求。
二、范围 适用于公司所有成品及原液的考察。药品稳定性考察包括:加速试验和长期(持续)稳定性试验。长期(持续)稳定性考察主要针对市售包装产品,但也需兼顾待包装产品。例如,当待包装产品在完成包装前,还需要长期贮存时,应当在相应环境条件下,评估其对包装后产品稳定性的影响。此外,还应考虑到对贮存时间较长的中间产品进行考察。加速试验主要针对批量放大及上市后变更(如生产设备变更、原辅料变更、工艺调整等)时生产的产品的稳定性试验。 三、职责 质量保证部负责药品稳定性考察方案的起草、审核、实施过程的监督、数据的收集与报告的撰写; 质量控制部:负责药品稳定性考察的检验工作; 质量受权人:负责药品稳定性考察方案及报告的批准。 四、产品介绍: 将本年度需要做稳定性考察产品的信息如:产品名称、批号、规格、包装规格、考察数量、生产日期、有效期等详细信息填入《药品稳定性考察信息表》。
电子分析天平核查记录 环境温度(℃):环境湿度(%): 天平信息 使用标准砝码信息 各分度值下天平的最大允许误差见下表 按下式计算示值误差(E) E=I-L, 式中:I---天平示值; E---示值误差;L---载荷值(即校正值=标准砝码标示值+修正值)。 1.偏载误差核查 (1)载荷在不同位置的示值误差必须满足相应载荷最大允许误差的要求,即E≤MPE。 (2)试验载荷选择1/3最大称量的砝码。优选个数较少的砝码,如果不是单个砝码,允许砝码叠放 使用。单个砝码应放置在测量区域的中心位置,若使用多个砝码,应均匀分布在测量区域内。 ⑶选用标准砝码加在称量盘的不同位置上(秤盘的位置及编号见下图),读出天平示值。计算误差。 ①百分之一天平选用标准砝码:200g+100g;②万分之一天平选用标准砝码:50g;③十万分之一天平选用标准砝码:20g。
⑷按下式计算示值误差(E) E=I-L, 式中:I---天平示值;E---示值误差 L---载荷值(即校正值=标准砝码标示值+修正值)标准砝码标示值(g):①②砝码修正值(g):①② 试验载荷L(g):最大允许误差MPE(mg): 2倍最大允许误差MPE(mg): 2.示值误差核查 ⑴各载荷点的示值误差(E)不得超过该天平在该载荷时的最大允许误差,既,E≤MPE。 ⑵测试时,载荷应从零载荷开始,逐渐地往上加载,直至加到天平的最大称量,然后逐渐的卸下载荷,直到零载荷为止。 ⑶试验载荷必须包括下述载荷点; A 空载; B最小称量; C 最大允许误差转换点所对应的载荷(或接近最大允许误差转换点); D最大称量。 ⑷无论加载或卸载,应保证有足够的测量点数,对于使用中检定的天平,测量点数不得少于6点;
1计量标准的重复性、稳定性考核 一、概述 计量标准是准确度低于计量基准,用于检定或校准其他计量标准或者工作计量器具的计量器具,它处于国家量值传递(溯源)体系的中间环节,起承上启下的作用。因此,计量标准在使用前必须依照JJF1033《计量标准考核规范》的要求,进行各项技术准备,使计量标准符合规范的要求并通过考核。下面主要介绍计量标准的重复性、稳定性考核的内容。 二、计量标准的重复性考核 1.计量标准的重复性 计量标准的重复性即在相同测量条件下,重复测量同一被测量,计量标准提供相近示值的能力。计量标准的重复性通常用测量结果的分散性来定量表示,即用单次测量结果y的实验标准差s(y i)来表示。 计量标准的重复性通常是检定或校准结果的一个不确定度来源。 新建计量标准应当进行重复性试验,并提供试验的数据;已建计量标准,至少每年进行一次重复性 试验,测得的重复性应满足检定或校准结果的测量不确定度的要求。 在计量标准考核中,计量标准的重复性是指在重复性条件(这些条件包括测量程序、人员、仪器、环境等方面)下用该计量标准测量一常规的被测对象时,所得到的测量结果的一致性。为保证在尽量相同的条件下进行测量必须在尽量短的时间内完成重复性测量。 2.重复性的试验方法在重复性条件下,用计量标准对常规的被检定或被校准对象进行 结果为y i(i=1,2,…,n),则其重复性s(y i)为式中:y —n次测量结果的 算术平均值; n—重复测量次数,n应尽可能大,一般应不少于10次。 重复性试验结果也会受被测对象不稳定的影响,所以在进行计量标准的重复性试验时,选择的测量对象应为常规的被检定或被校准计量器具,而不是本身重复性和稳定性都是最佳的被检定或被校准计量器具,这样评定得到的不确定度可以用于大多数的检定或校准结果。 3?计量标准的重复性考核对于新建计量标准,只要按照要求进行重复性试验,并提供试验的重复性数据即可;对于已建计量标准, 至少每年进行一次重复性试验,如果重复性试验结果不大于新建计量标准时的重复性,则重复性符合要求;如果重复性试验结果大于新建计量标准时的重复性时,应按照新的重复性结果重新进行检定或校准结果的测量不确定度评定,并判断检定或校准结果的测量不确定度是否满足被检定或校准对象的需要。 4?《计量标准的重复性试验记录》参考格式及填写说明 (1)《计量标准的重复性试验记录》参考格式申请考核单位原则上应当按照本参考格式填写。如果本参考格式不适用,申请计量标准考核单位可 以自行设计《计量标准的重复性试验记录》格式,但是不应少于参考格式规定的内容。 《计量标准的重复性试验记录》参考格式: 的重复性试验记录 n次独立重复测量,若得到的测量 试验时间、、测量值()月日年年 月日 年 月日 年 月日 年 月日 试验条件 1 2
SQP型电子天平(十万分之一天平) 确认报告 新疆全安药业股份有限公司 目录 一、引言 (3) 1概述 (3)
2确认目的 (3) 3确认范围 (3) 二、确认准备 (3) 1确认小组成员及职责 (3) 2确认方案培训的确认 (4) 3确认相关文件 (4) 4仪器仪表校验的确认 (4) 5确认项目的的风险评估分析及控制措施 (4) 三、确认实施 (7) 1设计确认 (7) 2安装确认 (7) 3运行确认 (8) 4性能确认 (9) 四、偏差处理 (9) 五、最终评价与建议 (9) 六、再确认周期 (9) 七、附件 (10) 一、引言 1.概述 该天平最大称量为30g,使用内置校准砝码,一键式全自动校准。 2.确认目的 确认该仪器的称量示值误差、重复性、及其自动校准功能等技术指标经过一年的使用后仍旧能够符合要求。
3.确认范围 本方案适用于SQP型电子天平(十万分之一天平) 的确认。 二、确认准备 1.确认小组成员及职责 设备部 负责所需仪器 负责建立设备档案 负责设备的安装、调式并做好相应的记录 质量管理部 负责确认方案和确认报告的审核 负责确认工作实施监督检查 负责设备标准SOP及有关管理制度的起草 负责确认文件的归档保管 负责确认实施中的取样及检验 负责仪器、仪表的校验 QC化验室 负责设备的操作 负责设备的维修和保养 负责设备确认过程的记录,数据的收集 2.确认方案培训的确认 验证方案培训的确认:年月日,(培训讲师)在(培训地点)给参与验证的所有人员进行了培训,并对被培训者现场提问和笔试作答,详见员工培训记录表。
5.确认项目的风险评估分析及控制措施 风险评估的目的 为保证检验结果的准确,需要对SQP型电子天平(十万分之一天平)进行相关的风险评定,并制定出超控情况下进行补救的计划。风险评估将对设备的日常运行产生影响,并为各类计划制度制定提供必要的依据。控制措施的有效性将在验证和生产中得到累积证实。 风险识别:是进行质量风险管理的基础,即根据确定的风险,系统地收集、利用相关信息和经验((如:历史数据、理论分析、已知的见解、多方意见和风险承受者的利害关系)来确认存在的风险, 指出将会出现的问题,即:“什么可能出现问题”。 风险分析:运用有用的信息和工具对已识别的风险及其问题进行分析、估计(影响因素、范围、关联、趋势;额外的信息资料;根本原因等),进而确认将会出现问题的可能性有多大出现的问题是否能够被及时地发现以及造成后果的严重性。 风险等级划分 通过分析每个风险的严重程度(S)、发生频率(P)和可检测性(D),对风险进行评分,评分实行3分制,即从低到高依次评分为1、2、3分。采用RPN(风险优先系数)进行计算,将严重程度、可能性及可检测性三种因素的分值相乘获得风险优先系数(RPN=S×P×D),从而确认风险的等级,本验证的风险估见下表: 表一:风险等级划分表
标题持续稳定性考察管理规程 编制记载分发记载 起草人:年月日文件编码:发布号: 审核人:年月日分发部门:复印号: 批准人:年月日 质量部发布 生效日:年月日 目的:建立持续稳定性考察管理规程,对上市后生产的药品继续进行稳定性考察和研究,监测在有效期内药品的质量,为规范此项工作而建立管理规程。 范围:主要适用于市售包装药品以及待包装产品。 主责:质量部、质量控制实验室。 释义: 关联: 正文: 1 持续稳定性考察的目的: 是在有效期内监控药品质量,以发现药品与生产相关的稳定性问题(如杂质含量或溶出度特性的变化),并确定药品能够在标示的贮存条件下,符合质量标准的各项要求。 2 持续稳定性考察对象: 主要针对市售包装药品。但也需兼顾待包装产品。还应当考虑对贮存时间较长的中间产品进行考察。 3 稳定性考察方案:每个品种需要制定考察方案,考察方案应由质量受权人批准执行。 3.1 考察方案应涵盖药品有效期; 3.2 每种规格、每个生产批量药品的考察批次数;
3.3 制定考察项目、检验方法依据及合格标准; 3.4 容器密封系统的描述; 3.5 考察周期及检验频次; 3.6 贮存条件(采用与药品标示贮存条件相对应的《中华人民共和国药典》规定的 长期稳定性试验标准条件)。 4 稳定性考察留样原则及批次数量: 4.1 产品批准上市后首次生产的前三批验证产品,对不同包装材料及包装规格的销售产品均要分别留样进行长期稳定性考察。 4.2 生产第二年起各年的产品,对生产的每种规格、每种内包装形式的药品,至少每年应当留取一批进行持续稳定性考察。 4.3 有重大变更或生产和包装有重大偏差的药品应当列入稳定性考察。改变原辅料、与药品直接接触的包装材料变更、生产工艺、主要生产设备及其他影响药品质量的主要因素变更时,应当对变更实施后生产的药品留样三批进行加速试验和长期稳定性试验。 4.4 重新加工、返工或回收的批次,也应当留样进行加速试验和长期稳定性试验。 4.5 考察样品留样数量:按照取样频次、考察项目、考察期内所需的全检量。 5 产品稳定性考察试验计划: 5.1 根据每年的生产情况,按要求填写每个品种“产品稳定性考察试验计划表”,按照计划进行稳定性试验管理。 5.2 产品稳定性考察试验计划表内容,产品名称、批号、规格、生产日期、有效期至、取样日期、检验时间、检验用量、考察目的、考察周期、考察期至。 5.3 样品提取要求: 5.3.1 样品必须按照稳定性试验计划从恒温恒湿箱和其他储存条件下按时取出,样品取样时间偏差范围:
持续稳定性考察方案 1.对各品种生产的前三批进行稳定性考察每批拟计划一定量进行 考察其余批次只做一般留样考察留样量为三次复检的全项检验量 2.考察项目:依据《中国药典》 XX版二部中《原料药与药物制剂稳定性试验指导原则》进行确定 3.考察方法: 3.1加速试验: 3.1.1按市售包装在温度40℃± 2℃、相对湿度 75%±5%的条件下放置六个月在试验期间第 1 个月、 2 个月、 3 个月、 6 个月末分别取样一次按稳定性考察要点项目进行检验 3.1.2 在上述条件下如 6 个月内供试品经检测不符合制定的质量标准则应在如下条件温度 30℃± 2℃、相对湿度 65%±5%情况下进行加速试验时间仍为六个月 3.2长期试验: 按市售包装在温度 18~26℃、相对湿度 60%±15%的条件下放置12 个月. 每 3 个月取样一次分别于 0 个月 3 个月 6 个月 9 个月 12个 月末取样按各剂型品种具体的稳定性考察要点项目进行检验12 个月后仍继续考察分别于18 个月 24 个月 36 个月(以此类推)末取样检测将结果与 0 月比较以确定药品有效期 3.3高温试验:
供试品置密封洁净容器中在60℃条件下放置 10 天于第 5 天和第10 天取样检测有关指标如供试品发生显著变化则在40℃下同法进行试验如 60℃无显著变化则不必进行40℃试验 3.4高湿试验: 试品置恒温密闭容器中于25℃相对湿度为 90%±5%条件下放置 10天在第 5 天和第 10 天取样检测检测项目应包括吸湿增重项若吸湿增 重 5%以上则应在 25℃RH75%±5%下同法进行试验;若吸湿增重 5%以 下且其他考察项目符合要求则不再进行此项试验液体可不进行高湿 试验 3.5光照试验:供试品置光照箱或其它适宜的光照容器内于照度 不< 5000Lx 的条件下放置 10 天在第 5 天和第 10 天取样检测 3.6以上为影响因素稳定性研究的一般要求根据药品的性质必要 时可以设计其他试验如酸、碱及氧化降解等 3.7检测时间的规定: 3.7.1取出时间:1个月加速绝不允许提前和推迟;两个月允许±1 天;三个月允许± 1 周;六个月允许± 2 周;一年后允许±四周 3.7.2样品取出先放在常温下一般要求一周内完成检测;温湿度 敏感的产品要及时检测 3.8恒湿条件的获得方式 恒湿条件可以通过在密闭容器如干燥器下部放置饱和盐溶液而获 得根据不同湿度要求可以选择NaCl 饱和溶液 [ 相对湿度为( 75±1)%15.5℃~60℃] 、KNO3饱和溶液 [ 相对湿度为 92.5%25℃] 、NaNO3
文件编号SMP-11-014 稳定性考察标准管理规程 版本号01 黑龙江宝庆隆生物技术有限责任公司 文件名称稳定性考察管理规程 文件编号SMP-11-014 版本号01 拷贝号 起草人起草日期年月日审核人审核日期年月日审核人审核日期年月日批准人批准日期年月日颁发部门质量管理部执行日期年月日分发部门中心化验室 1目的 为产品稳定性考察提供原则及依据,考察药品(包括原料、成品等)在温度、湿度、 光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件和有效期的确定提 供科学依据,同时通过考察建立产品的有效期;并在有效期内监控已上市药品的质量, 以发现药品与生产相关的稳定性问题,确定药品能够在标示的贮存条件下,符合质量标准的各项要求,确保产品质量。 2范围 适用于成品、原料的稳定性考察。 3责任者 中心化验室、质量管理部、质量受权人
文件编号SMP-11-014 稳定性考察标准管理规程 版本号 01 4职责 4.1 中心化验室副主任负责本标准管理规程的起草。 4.2 中心化验室主任负责本标准管理规程的审核。 4.3 质量管理部部长负责本标准管理规程的审核。 4.4 质量受权人负责本标准管理规程的批准。 5依据 《中国药典》2010 年版二部及《药品 GMP 指南》-质量控制实验室与物料系统 6内容 6.1 稳定性考察的类别 6.1.1 上市前阶段:影响因素试验、加速试验、长期试验。 6.1.2 上市后阶段:上市后持续稳定性考察(条件等同于长期稳定性试验)、承诺稳定性试验(条件等同于为加速试验和长期稳定性试验)。 6.1.3 其他稳定性试验:中间产品放置时间稳定性试验、批量放大及上市后变更(如生产设备变更,原辅料变更,工艺调整等 )稳定性试验、特殊目的稳定性试验,例如对偏差调查等的支持性试验。此类稳定性试验的条件均可参考上市前试验的条件,根据不同产品特性和稳定性试验的目的选择。 6.2 已上市阶段稳定性试验的目的 6.2.1 监控已上市药品在有效期内的质量,以发现药品与生产相关的稳定性问题(如含量、有关物质变化),并确定药品可以或预期可以在标示的贮存条件下,符合质量标准的各项 要求。考察产品上市后在生产、包装、质控、使用条件等诸多方面重大的变更对产品稳定 性的影响,考察变更后药品的稳定性趋势,以评价变更的合理性。
美泰科技(青岛)有限公司 MEITEK TECHNOLOGY (QINGDAO)CO. ,LTD. 十万分之一电子天平再验证方案 One hundred thousandth electronic balance Validation Protocol
目录 Table of Contents 1 概述Overview (3) 2 再验证目的Validation Purpose s (3) 3 再验证要求Validation Conditions... (3) 4 再验证合格标准Validation Criterion ......... (3) 5 方案实施Implementation of the protocol (3) 6 采用文件Reference Documents (3) 7 再验证内容与方法Contents and Methods of Validation (3) 8 再验证数据分析The analysis of validation dat a (4) 9 验证结果与结论Result and conclusion of validation (5) 10 附件Appendix (5)
1.概述Overview 1.1电子天平型号Electronic Balance Model:BT25S 设备编号Equipment No.:QC62Y011 1.2该设备由德国赛多利斯股份公司制造,安装在天平室。 This equipment which Installed in the balance room is produced by Germany Sartorius AG 2.再验证目的Validation Purposes 确认该仪器的称量示值误差、重复性、及其自动校准功能等技术指标经过一年的使用后仍旧能够符合要求。 Confirm that the largest weighing range, repeatability, error range of the equipment meet the required technical specifications and in accordance with the inspection requirements. 3.再验证要求Validation requirements 3.1验证前检查该设备的使用记录及其日常维护保养测试记录。 Before the validation,Confirm the equipment documents and spare parts are complete. 3.2验证前必须对BT25S型电子天平进行每年一次的校验。 Before the validation, Confirm the installation, operation of BT25S-type electronic balance and in accordance with the requirements of inspection weighing . 3.3验证前必须对所用的校准砝码确定有效。 Before the validation, Confirm the process of calibration weight of the trial used to effective 4.再验证合格标准The validation Criterion 4.1BT25S型电子天平的称量示值误差范围为20.0000g±1mg。 BT25S-type electronic balance sensitivity test weight is 20.0000g ± 1mg. 4.2BT25S型电子天平的重复性实验合格标准:标准偏差≤0.02mg BT25S-type electronic balance's eligibility criteria of reproducibility experimental: standard deviation is not more than 0.02mg. 4.3BT25S型电子天平的自动校准功能正常。 5.方案实施Implementation of the protocol 本验证方案计划于2010年01月04日-01月 05日进行验证 The validation program is planned for verifying in December 21, 2008 to December 24 由验证小组:杨平、钟迪仕、李霄、吴晓飞负责实施。 By the validation team: Yang Ping, Liu Qiang,Liu Xiangwen,WuXiaofei, is responsible to implement. 6.采用文件Reference Documents SOP-SB-QC022 7.再验证内容与方法Contents and Methods of Validation 7.1日常使用记录检查及运行测试。 7.1.1目的:根据设备SOP-SB-QC022进行操作,确认该设备运行正常。 Objective: operate the equipment in accordance with the equipment SOP-SB-QC022 。 7.1.2检查项目(检查结果在□划“√”)Check the item (the results in the □ zoned "√") 7.1.2.1按键功能、显示器Button functions, display
标准文件 qqqq药业有限责任公司 文件名称稳定性考察管理规程 起草人审核 人 批准 人 起草日期审核日 期 批准日 期 生效日期文件编 号 09SM1600-003页码1/5 分发部门QA、QC 1. 范围:适用于原料、辅料、内包材、中间产品、成品的稳定性考察试验。 2. 职责 留样管理员:负责原料、辅料、中间产品、成品的稳定性考察,对试验到期品种的稳定性进行评价,并对相关记录归档。 化验员:负责原料、辅料、中间产品、成品的检验。 QC负责人:负责对稳定性试验中出现的异常情况进行处理和总结的审核,监督、检查执行情况。 质量管理部长:对总结的审核和批准。 3. 内容 3.1. 试验前的准备 3.1.1. 计划
由QC化验员起草制订稳定性试验计划表,包括:品名、规格、实验批次、批号、考察条件、考察方式、考察项目及方法、实施部门等。稳定性试验计划表须经QC主任汇审,交质量管理部长审核、批准方可生效。 3.1.2. 包装 成品包装与销售包装一致,原辅料与实际保存包装一致或相似。中间体模拟生产周转包装,与生产保持一致或相似。 3.2. 原辅料稳定性试验 3.2.1. 观察项目:性状、鉴别、含量测定等。 3.2.2. 贮存条件:与该物料规定贮存条件相一致。 3.2.3. 贮存时间:按《留样管理规程》执行。 3.2. 4. 考察方式 编 号09SM1600-003 稳定性考察管理规程页 码 2/5 3.2. 4.1. 影响因素试验 将检品除去包装以后,平放在称量瓶或培养皿中摊成≤5mm厚的薄层,疏松样品摊成≤10mm厚薄层,在以下条件下贮存、观察、检测,考察各项指标变化情况。 高温条件下,温度分别为40℃、6 0℃2个温度水平。将供试品在60℃温度下放置10天,于第5天和第10天取样,按重点考察项目进行检测,若供试品无明显变化则不再进行40℃条件下试验;若供试品有明显变化(如含量下降5%、鉴别不明显、外观色泽变化大等),则须在40℃条件下用同样的方法进行试验。 高湿条件下,相对湿度分别为75%±5%、90%±5%2个湿度水平(温度为25℃)。将供试品置于相对湿度90%±5%湿度下(装有KNO3饱和溶液的干燥器中,用封口胶密封)放置10天,于第5天和第10天取样,按考察项目进行检测,同时准确称定试验前后供试
5[1].6计量标准的重复性及稳定性考核记录 91、8022 91、8032 91、8242 91、8052 91、8062 91、8272 91、8082 91、8092 91、80102 91、822 91、806其标准偏差:= 2、33μm注:已建计量标准,至少每年进行一次重复性试验,测得的重复性应满足检定或校准结果的测量不确定度的要求。 计量标准的稳定性考核记录参考格式检定游标量具标准组的稳定性考核记录用此套标准装置对300mm游标卡尺1 21、80点测量,编号0061,在规定的间隔时间内,进行4次等精度测量,测量数据如下: 测量时间xx年6月xx年8月xx年10月xx年12月测量次数10次10次10次10次测量值(单位:mm)11
21、801 21、801 21、8021 21、801 21、801 21、801 21、8031 21、801 21、801 21、801 21、8041 21、801 21、801 21、801 21、8051 21、801 21、801 21、801 21、8061 21、801 21、801
21、8071 21、801 21、801 21、801 21、8081 21、801 21、801 21、801 21、8091 21、801 21、801 21、801 21、80101 21、801 21、801 21、801 21、80平均值1 21、801 21、801 21、801 21、80考核人员罗琦郑义罗琦郑义最大值与最小值之差:
0mm根据上述测量数据可知,测量结果的最大值与最小值之差为1 21、80-1 21、80=0mm,其值小于本计量标准的最大允许误差的绝对值0、02mm结论: 该计量标准的稳定性符合要求。注:若计量标准在使用中采用标称值或示值,则稳定性应小于计量标准的最大允许误差的绝对值;如加修正值使用,则应小于修正值的扩展不确定度。计量标准的重复性试验记录参考格式衡器检定装置的重复性试验记录选取一台100kg台秤在装置正常工作的条件下,50kg重量等精度重复测量10次,各次测量值如下:序号 Xi (kg)U=Xi-U21 50、0 30、0 30、00092 50、0 20、0 20、00043 50、00004 50、00005 50、00006 49、97-0、0 30、00097
需要稳定性考察报告怎么打 篇一:稳定性考察范本 一、目的: 为公司新产品以及合同加工产品确定有效期和贮存运输条件提供科学依据;对公司产品以及合同加工产品进行持续稳定性考察,以监控在有效期内药品的质量;由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 二、 适用范围:适用于公司新产品和合同加工产品的投产稳定性考察、公司产品和合同加工产品的持续稳定性考察、 由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 三、责任: 质量保证部、质量检验部。 四、内容: 1.产品稳定性考察的一般规定 1.1产品稳定性考察分类 1.1.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察; 1.1.2为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察;
1.1.3由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 1.1.3.1重大变更或生产和包装有重大偏差的药品; 1.1.3.2任何采用非常规工艺重新加工、返工、或有回收操作的批次; 1.1.3.3改变主要物料供应商时所作验证的批次。 1.2产品稳定性考察样品批次的规定 1.2.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察,这种情况的稳定性考察需要连续试制的三批样品; 1.2.2公司新产品和合同加工产品正常批量生产的最初三批产品应列入持续稳定性考察计划,以进一步确认有效期。 1.2.3为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察批次按产品不同规格每年考察一批, 除当年没有生产外。所考察批次采取随机抽取的方式; 1.2.4重大变更或生产和包装有重大偏差的药品批次; 1.2.5任何采用非常规工艺重新加工、返工、或有回收操作的批次; 1.2.6改变主要物料供应商时所作验证的批次。 1.2.7有效期短的原料药,在进行稳定性考察时应适当增加检验频次。
计量标准的重复性试验记录参考格式 检定游标量具标准组的重复性试验记录 选一把分度值0.02mm ,量程为(0-300)mm 的游标卡尺,在标准器组正常工作的条件下,等精度测量重复5次,各次测量值如下: 其标准偏差: S = =2.33μm 注:已建计量标准,至少每年进行一次重复性试验,测得的重复性应满足检定或校准结果的测量不确定度的要求。
计量标准的稳定性考核记录参考格式 检定游标量具标准组的稳定性考核记录用此套标准装置对300mm游标卡尺121.80点测量,编号0061,在规定的间隔时间内,进行4次等精度测量,测量数据如下: 根据上述测量数据可知,测量结果的最大值与最小值之差为121.80-121.80=0mm,其值小于本计量标准的最大允许误差的绝对值0.02mm 结论: 该计量标准的稳定性符合要求。 注:若计量标准在使用中采用标称值或示值,则稳定性应小于计量标准的最大允许误差的绝对值;如加修正值使用,则应小于修正值的扩展不确定度。
计量标准的重复性试验记录参考格式 衡器检定装置的重复性试验记录 选取一台100kg 台秤在装置正常工作的条件下,50kg 重量等精度重复测量10次,各次测量值如下: X =50kg n i 1 =∑U 2=0.0058 S=±1 ) (1 2 --∑=n X X n i i =± 9 0058.0=±0.025kg=±25g 该装置的最大重复性误差为25g 注:已建计量标准,至少每年进行一次重复性试验,测得的重复性应满足检定或校准结果的测量不确定度的要求。
计量标准的稳定性考核记录参考格式 衡器检定装置的稳定性考核记录 选取一台100kg台秤分度值为0.05kg,在装置正常工作的条件下称量50kg重量,在规定的间隔时间内,进行4次等精度测量,测量数据如下: 根据上述测量数据可知,测量结果的最大值与最小值之差为50.00-50.00=0kg,其值小于本计量标准的最大允许误差的绝对值。 结论: 该计量标准的稳定性符合要求。 注:若计量标准在使用中采用标称值或示值,则稳定性应小于计量标准的最大允许误差的绝对值;如加修正值使用,则应小于修正值的扩展不确定度。
1 目的范围 1.1目的:保障公司电子天平的正常运行,在两次检定/校准之间,进行期间核查,验证该设备是否保持检定/校准时的状态,确保其检验数据数据的有效性和准确性。 1.2范围:适用于本公司内部 ESJ200-4 电子天平的期间核查。 2 职责和责任 质检员执行本制度,质量管理部部长负责监督执行。 3检查项目 电子天平示值误差、重复性误差、偏载误差与最大称量。 4检查依据 4.1 JJG 1036-2008《电子天平鉴定规程》 电子天平使用说明书 5标准器具 2F 等级标准砝码:1mg ~500g 6检验方法 6.1 天平的示值误差 在仪器正常工作条件下,记录不同载荷点时天平示值。并按下式计算天平示值误差。 公司
0E E -=天平示值误差 (1) E —加载时天平示值; 0E —加载的标准砝码质量。 6.2 天平重复性误差 在仪器正常工作条件下,用规定载荷的标准砝码重复称量10次,记录天平示值,并按下式计算天平重复性误差。 min max E E -=天平重复性误差 (2) max E —加载时天平示值误差的最大值; min E —加载时天平示值误差的最小值。 6.3 天平偏载误差 在仪器正常工作条件下,将规定载荷点的标准砝码分别置于天平四个边角及中心位置,记录天平的示值,并按式(1)计算天平的偏载误差。 6.4 天平最大称量 在仪器正常工作条件下,添加205g 标准砝码,记录天平示值。 7 评定 天平核查项目符合表1要求,则判定天平正常。 8 核查周期 在两次检定/校准之间,建议每隔一个季度核查一次。 9 相关记录 电子天平期间核查记录。
表1 电子天平技术要求
一、目的: 为公司新产品以及合同加工产品确定有效期和贮存运输条件提供科学依据;对公司产品以及合同加工产品进行持续稳定性考察,以监控在有效期内药品的质量;由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 二、 适用范围:适用于公司新产品和合同加工产品的投产稳定性考察、公司产品和合同加工产品的持续稳定性考察、 由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 三、责任: 质量保证部、质量检验部。 四、内容: 1.产品稳定性考察的一般规定 1.1产品稳定性考察分类 1.1.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察;
1.1.2为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察; 1.1.3由其他原因引起公司产品和合同加工产品需要进行的稳定性考察。 1.1.3.1重大变更或生产和包装有重大偏差的药品; 1.1.3.2任何采用非常规工艺重新加工、返工、或有回收操作的批次; 1.1.3.3改变主要物料供应商时所作验证的批次。 1.2产品稳定性考察样品批次的规定 1.2.1为公司新产品以及合同加工产品确定有效期与贮存运输条件提供科学数据所进行的稳定性考察,这种情况的稳定性考察需要连续试制的三批样品; 1.2.2公司新产品和合同加工产品正常批量生产的最初三批产品 应列入持续稳定性考察计划,以进一步确认有效期。 1.2.3为监控公司产品以及合同加工产品在有效期内质量所进行的持续稳定性考察批次按产品不同规格每年考察一批, 除当年没有生产外。所考察批次采取随机抽取的方式; 1.2.4重大变更或生产和包装有重大偏差的药品批次;