第十三章含氮有机化合物
【教学目的】
1、掌握一般胺和酰胺的命名,胺的碱性与酰胺的水解,
2、了解重要的杂环母核
【教学重点】
胺和酰胺的命名,胺的碱性与酰胺的水解
【教学难点】
酰胺的水解
【教学方法】
讲解,练习
【教学内容】
含氮有机化合物通常是指氮原子和碳原子直接相连而构成的有机化合物。主要有胺、酰胺、偶氮化合物、生物碱、含氮杂环化合物、氨基酸、硝基和亚硝基化合物等。
第一节胺
一、胺的结构和分类
(一)胺的结构
胺(amine)是氨(NH3)分子中的氢原子被烃基取代的产物。胺的结构与氨相似,氮原子为不等性sp3杂化,胺分子中的氮原子与碳的四面体结构相类似,但不是正四面体。
(二)胺的分类
胺分子中的氮原子上连有1个、2个和3个烃基的胺分别称为伯胺(1°胺)、仲胺(2°胺)和叔胺(3°胺)。
NH3 RNH2 R2NH R3N
氨伯胺(1°) 仲胺(2°) 叔胺(3°)
胺分子中的氮原子与脂肪烃基相连的为脂肪胺(aliphatic amine),与芳环直接相连的为芳香胺(aromatic amine)。例如:
脂肪胺:CH3NH2CH2NH CH3
CH2CH3
CH2CH3
N
CH3
芳香胺:H2N NH2NH N(CH3)2
H3C
伯胺仲胺叔胺
氨基 (一NH2)、亚氨基(NH
)和次氨基(
N
),分别是伯、仲、叔胺的官能团。
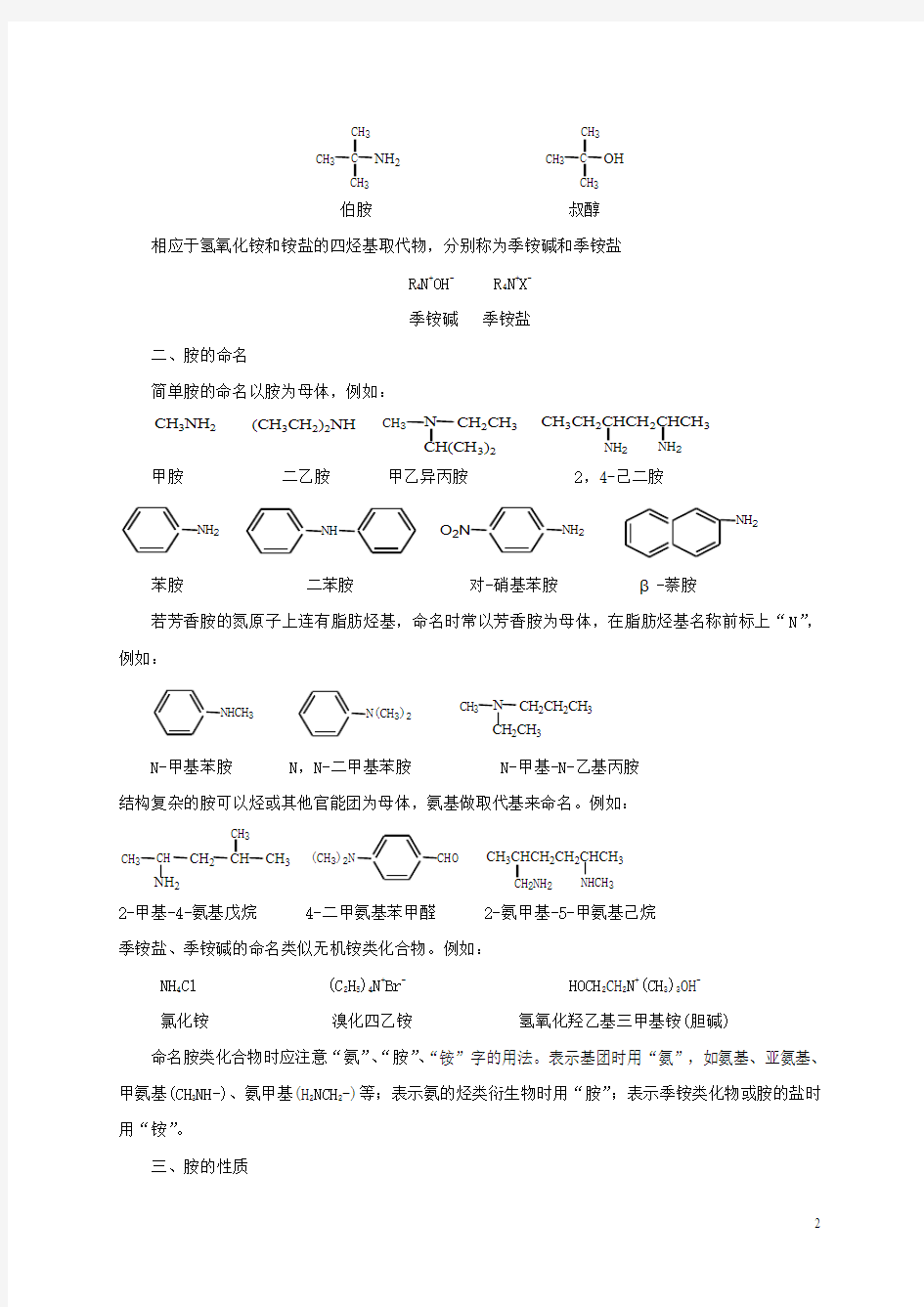
胺的伯、仲、叔胺的分类与醇的伯、仲、叔醇的分类有差异。叔胺指氮原子上连有3个烃基,而叔醇是指羟基与叔碳原子相连。例如:
C CH 3
CH 3
CH 3
NH 2
C CH 3
CH 3CH 3
OH
伯胺 叔醇
相应于氢氧化铵和铵盐的四烃基取代物,分别称为季铵碱和季铵盐
R 4N +
OH - R 4N +X -
季铵碱 季铵盐
二、胺的命名
简单胺的命名以胺为母体,例如:
CH 3NH 2
(CH 3CH 2)2NH
N
CH(CH 3)2
CH 3
CH 2CH 3
CH 3CH 2CHCH 2CHCH 3
2
2
甲胺 二乙胺 甲乙异丙胺 2,4-己二胺
NH 2
NH
NH 2
O 2N
NH 2
苯胺 二苯胺 对-硝基苯胺 β-萘胺
若芳香胺的氮原子上连有脂肪烃基,命名时常以芳香胺为母体,在脂肪烃基名称前标上“N ”,例如:
NHCH 3
N(CH 3)2
N
CH 2CH 3
CH 3
CH 2CH 2CH 3
N-甲基苯胺 N ,N-二甲基苯胺 N-甲基-N-乙基丙胺 结构复杂的胺可以烃或其他官能团为母体,氨基做取代基来命名。例如:
CH NH 2
CH 3
CH 2
CH
CH 3
CH 3
(CH 3)2N
CHO
CH 3CHCH 2CH 2CHCH 3
NHCH 3
2NH 2
2-甲基-4-氨基戊烷 4-二甲氨基苯甲醛 2-氨甲基-5-甲氨基己烷 季铵盐、季铵碱的命名类似无机铵类化合物。例如:
NH 4C1 (C 2H 5)4N +
Br -
HOCH 2CH 2N +
(CH 3)3OH
-
氯化铵 溴化四乙铵 氢氧化羟乙基三甲基铵(胆碱)
命名胺类化合物时应注意“氨”、“胺”、“铵”字的用法。表示基团时用“氨”,如氨基、亚氨基、甲氨基(CH 3NH-)、氨甲基(H 2NCH 2-)等;表示氨的烃类衍生物时用“胺”;表示季铵类化物或胺的盐时用“铵”。
三、胺的性质
(一)物理性质
低级脂肪胺为无色气体,丙胺至十一胺是液体,十一胺以上均为固体。低级胺具有氨的气味。胺和氨相似,为极性分子,除叔胺外,都能形成分子间氢键,所以它们的沸点比相对分子质量相近的烷烃要高。另外,由于氮的电负性比氧小,胺分子间的氢键较醇分子间的氢键弱,所以胺的沸点比相应的醇要低。
叔胺不能形成分子间氢键,其沸点就与相对分子质量相近的烷烃差不多了。而所有的三类胺都能与水形成氢键,因此低级胺(含6个碳原子以下)能溶于水,但随着相对分子质量的增加,其溶解度迅速降低。
芳香胺毒性较大。例如苯胺可通过消化道、呼吸道或经皮肤吸收而引起中毒,有些胺如3,4-二甲基苯胺、β-萘胺、联苯胺等具有致癌作用。
(二)胺的化学性质
1.碱性与成盐反应与氨相似,胺分子中氮原子上的孤对电子能接受质子,呈碱性。
胺的碱性强弱主要受电子效应和空间效应两方面因素的影响。氮原子上电子云密度越大,氮原子接受质子的能力越强,胺的碱性就越强;氮原子周围空间位阻越大,氮原子接受质子越困难,胺的碱性就越小。对脂肪族胺,因脂肪烃基是供电子基,能提高氮原子上的电子云密度,使氮原子接受质子能力增强,所以脂肪胺碱性比氨强。氮原子上所连脂肪烃基越多,其电子云密度越大,所以脂肪族仲胺碱性大于伯胺,这是电子效应起主导作用。但当氮原子上连有3个脂肪烃基时,空间效应比电子效应更显著,使氮原子不易接受质子,所以叔胺的碱性比伯胺还要弱。而芳香胺因氮原子上孤对电子离域到苯环,发生吸电子共轭效应,降低了氮原子的电子云密度,同时阻碍氮原子接受质子的空间效应增大,因此碱性显著降低。脂肪胺能使湿润的红色石蕊试纸变蓝,而芳香胺不能。常见的几种胺的碱性强弱为:
二甲胺>甲胺>三甲胺>氨>苯胺
p K b 3.27 3.36 4.24 4.75 9.4
与胺类不同的是,季铵化合物分子中的氮原子已连接四个烃基并带正电荷,再也不能接受质子,这类化合物的碱性由与季铵正离子结合的负离子来决定。对于季铵碱R4N+与OH-之间是典型的离子键,季铵碱的碱性就表现为0H-的碱性,故季铵碱为强碱,其碱性与Na0H相近。季铵碱与酸作用生成季铵盐:
R4N+0H-+HCl→R4N+Cl-+H20
R4N+C1-为强酸强碱盐,与强碱作用后不会置换出游离的季铵碱,而是建立如下平衡:
R4NCl+NaOH R4NOH+NaCl
胺类一般为弱碱,可与酸反应生成铵盐(ammonium salts),但遇强碱又重新游离析出:
CH 3NH
2
HC l
OH -CH 3N +Cl -+H 2O
氯化甲铵 (或写作 CH 3NH 2·HCl 甲胺盐酸盐)
NH 2
3Cl -
( NH 2?HCl
)
氯化苯铵 苯胺盐酸盐
胺与酸形成的盐一般都是易溶于水和乙醇的晶形固体。实验室中,常常利用胺的盐易溶于水而遇强碱又重新游离析出的性质来分离和提纯胺。
胺(特别是芳胺)易被氧化,而胺的盐则很稳定。医药上常将难溶于水的胺类药物制成盐, 以增加其水溶性和稳定性。例如将局部麻醉药普鲁卡因制成盐酸普鲁卡因。
H 2N
C
O
O
CH 2CH 2N(C 2H 5)2+HCl
[H 2N
C
O CH 2CH 2N(C 2H 5)]C l -H
+
盐酸普鲁卡因(procaine hydrochloride)
2.酰化反应 伯胺和仲胺能与酰卤、酸酐等酰化剂作用生成酰胺。叔胺氮上没有可以被取代的氢原子,不能起酰化反应。
CH 2
CH 2NH 2+
C
O
Cl
吡 啶
CH 2
CH 2NH
C
O
NHCH 3+£
(CH 3CO)2O
CH 3N CH 3
CH 3COOH
+
N-甲基乙酰苯胺
胺的酰化反应实际上就是羧酸衍生物的氨解反应。生成的酰胺为具有一定熔点的晶形固体,利用此性质可鉴定胺类。酰胺在酸或碱催化下水解,可以除去酰基恢复氨基,因此常用酰基化反应来保护氨基以避免芳胺在进行某些反应时氨基被氧化破坏。例如:
NH 2
乙 酐
NHCCH 3
O 90%HNO 3°
NHCCH 3
O
O 2N
+
NH 2
2N
苯胺不能直接硝化制备对-硝基苯胺,乙酰化后由于酰基的吸电子作用,使苯环的电子云密度有所下降,从而增强了抗氧化能力,提高了稳定性。
3.与亚硝酸的反应 伯、仲、叔胺与亚硝酸反应各不相同,脂肪胺和芳香胺也有差异。由于亚硝酸不稳定,一般在反应过程中由亚硝酸钠和盐酸或硫酸作用制得。
(1)伯胺 芳香伯胺与亚硝酸在低温(一般<5℃)及过量强酸水溶液中反应生成芳香重氮盐,这个反应称为重氮化反应(diazotization)。
NH 2+NaNO 2+HCl
NCl -N
+
+NaCl+2H 2O
0~5°C
氯化重氮苯(重氮苯盐酸盐)
芳香重氮盐易溶于水,只有在水溶液和较低温度时才稳定,加热时即分解放出氮气。
干燥的重氮盐稳定性很差,易爆炸。因此,重氮盐的制备和使用都要在温度较低的酸性介质中进行。
脂肪伯胺与亚硝酸反应生成的脂肪重氮盐极不稳定,即使在低温下也立即分解放出氮气,生成正碳离子。活泼的正碳离子继续起反应生成醇、烯及卤烃等混合物。
醇、烯、卤烃等混合物
由于该反应定量地放出氮气,因此可用作氨基的定量测定。
(2)仲胺 脂肪仲胺和芳香仲胺与亚硝酸反应,都是在氮上进行亚硝化,生成N-亚硝基化合物。
(CH 3CH 2)2N H+HO
NO
(C 2H 5)2N -NO +H 2O
N-亚硝基二乙胺
NHCH 3+HNO 2
N
N
O CH 3+H 2O
N-甲基-N-亚硝基苯胺
N-亚硝基胺为中性的黄色油状物或固体,绝大多数不溶于水,而溶于有机溶剂。亚硝基胺类(nitrosoamines)化合物主要用于实验室、橡胶和化工生产中。一系列的动物实验已证实亚硝胺化合
物有强烈的致癌作用,可引起动物多种器官和组织的肿瘤,现已被列为化学致癌物。
某些食品防腐剂中的亚硝酸盐,以及天然存在的硝酸盐还原为亚硝酸盐后,在胃肠道会和仲胺作用生成亚硝胺。因此,亚硝酸盐、硝酸盐和能发生亚硝基化的胺类化合物进入人体内,都将是潜在的危险因素。实验表明,维生素C 能对亚硝酸钠起还原作用,阻断亚硝胺在体内的合成。
(3)叔胺 脂肪叔胺与亚硝酸作用生成不稳定易水解的盐,若以强碱处理,则重新游离析出叔胺。
R 3N +HNO 3NHNO 2+
NaOH
3N +NaNO 2+H 2O
芳香叔胺因为氨基的强活化作用,使芳环易于发生亲电取代,与亚硝酸作用生成对-亚硝基胺,如对位被占据,则亚硝基取代在邻位。
NO(90%)
(CH 3)2N +HNO 2
3)2N
N ,N-二甲基-4-亚硝基苯胺(翠绿色)
在强酸性条件下实际形成的是一个具有醌式结构的橘黄色的盐,只有用碱中和后才会得到翠绿色的C
—亚硝基化合物。
(CH 3)2N
N O
+3)2N
+
N
OH]Cl -
翠绿色 橘黄色
综上所述,可以利用亚硝酸与脂肪族及芳香族伯、仲、叔胺的不同反应来鉴别胺类。 四、重要的胺及其衍生物
(一)苯胺
苯胺是最简单、最重要的芳香胺,为无色油状液体,长时间放置于空气中会逐渐变黄、红、棕、甚至黑色;微溶于水,易容于乙醇、乙醚等有机溶剂。苯胺有毒,能透过皮肤或吸入蒸气使人中毒,苯胺中毒症状为皮肤苍白、四肢无力、头晕等。苯胺是重要的化学试剂和化工原料,广泛应用于制药工业。
苯胺的碱性很弱,只能和盐酸、硫酸等强酸生成盐。
苯胺分子中氨基的供电子共扼效应使苯环上的电子云密度升高,所以芳胺的苯环上容易进行亲电取代反应。如苯胺和溴水在常温下立即定量生成2,4,6-三溴苯胺白色沉淀。利用此性质可鉴别和定量分析苯胺。
—NH 2
NH 2+3Br 2(水)
NH 2
Br
Br Br
+3HBr
2,4,6-三溴苯胺(白色)
(二)苯丙胺类
苯丙胺类包括苯异丙胺和甲基苯异丙胺,前者化学名为1-苯基-2-丙胺,于1887年首次合成,是第一个人工合成的兴奋剂。后者的化学名为N-甲基-1-苯基-2-丙胺,它是无色透明晶体,形状像冰(或冰糖),故称“冰毒”。它的致幻性和成瘾性极强,对人体的损害更甚于海洛因,吸食1~2周即产生严重的依赖性,并对心、脑、肺、肝、肾及神经系统产生严重的毒害作用,吸、食或注射0.2g 即可致死,是严禁的毒品。甲基苯丙胺近几年又以“摇头丸”、“蓝精灵”等商品名出现,在青少年中造成极大的危害。
CH
CH 2NH
CH 3CH 3
CH
CH 2NH 2
CH 3
N-甲基苯异丙胺 苯异丙胺
(三)生源胺
生源胺是指在人体中担负神经冲动传导作用的胺类化合物,主要有肾上腺素、去甲肾上腺素、多巴胺、5-羟基色胺、胆碱和乙酰胆碱等。
1. 肾上腺素和去甲肾上腺素 肾上腺素和去甲肾上腺素是肾上腺髓质分泌的两种激素。
HO HO
CH 2
CH NH
CH 3
OH
HO
HO
CH 2
CH NH 2
OH
肾上腺素 去甲肾上腺素
它们都有儿茶酚核,属儿茶酚胺类物质。主要作用是加强心肌收缩,增加心输出量,收缩血管,升高血压,加强代谢,消除支气管平滑肌痉挛。肾上腺素的盐酸盐是临床上常用的升压药物,去甲肾上腺素的酒石酸盐在临床上用于周围循环功能不全时低血压的急救。
2.多巴胺 多巴胺是去甲肾上腺素生物合成的前体,又是中枢神经和传出神经的一种递质,为白色或类白色有光泽晶体。临床上使用其盐酸盐治疗各类型休克,特别对伴有肾功能不全的患者尤为适宜。结构式如下:
HO HO
CH 2
CH NH 2
OH
多巴胺
3.5-羟基色胺 5-羟基色胺与多巴胺同为神经系统的生源胺,它是脑中的神经传递质。结构式如下:
N H
HO
CH 2
CH 2NH 2
5-羟基色胺
4.胆碱和乙酰胆碱 胆碱因最初从胆汁中发现,且具有碱性故称胆碱。它广泛分布于生物体内,是卵磷脂的组成部分,在脑组织和蛋黄中含量较高。胆碱在体内与脂肪代谢密切相关,能促进油脂生成磷脂,防止脂肪在肝内沉积,有抗脂肪肝作用。
乙酰胆碱是传出神经末梢释放的神经递质。体内乙酰胆碱代谢障碍,会引起神经系统错乱,造成严重后果,甚至死亡。
N +CH 3
CH 3
CH 3
CH 2CH 2OH OH - N +CH 3
CH 3
CH 3
CH 2CH 2O OH
-C
O CH 3
胆碱 乙酰胆碱
第二节 酰胺
一、酰胺的结构和命名 (一)结构
酰胺(anide )在结构上可以看做是氨或胺分子中氮原子上的氢原子被酰基C
R
O
(acyl group)
取代后生成的化合物,即氨或胺的酰基衍生物;也可以看做是羧酸分子中羧基上的羟基被氨基(-NH 2)或烃氨基(-NHR 、-NR 2)取代后生成的化合物,即羧酸衍生物(derivatives of carborylic acid)。通式为:
C
R
O N
H(R')
(二)命名
对于氮原子上没有烃基的酰胺,根据氨基所连的酰基名称来命名,称为某酰胺。例如:
C
O
CH 3
NH 2
C
O NH 2
乙酰胺 苯甲酰胺
对于氮原子上连有烃基的酰胺,则将烃基的名称写在某酰胺之前,并加上“N-”或“N ,N-”,以表示该烃基是与氮原子相连的。例如:
C
CH
3
O N
H(R'')
C
O CH 3
NH
N ,N-二甲基乙酰胺 N-甲基苯甲酰胺
二、酰胺的化学性质 (一)酸碱性
在酰胺分子中,由于酰基与氮原子直接相连,氮原子的未共用电子对与羧基的л键发生了p-л共轭,使氮原子上的电子云密度降低,使其结合质子的能力减弱,碱性减弱,因此酰胺是近乎中性的化合物。
(二)水解反应
酰胺在酸或碱的作用下,加热可发生水解反应,在酸催化下水解,生成羧酸和无机盐,在碱催化下水解生成羧酸盐并放出氨气。
C
O R
NH 2+HCl+H 2加热
C
R
O OH +NH 4Cl
加热
C
R
O ONa C
O R
NH 2+NH 3
三、重要的酰胺及其衍生物 (一)尿素
尿素简称脲(urea ),从结构上可以看做是碳酸分子中的两个羟基被氨基取代的化合物,又称碳酰二胺。结构式如下:
C
O HO
OH
C O
NH 2
NH 2
碳酸 尿素
尿素是白色晶体,熔点133℃,易溶于水和乙醇。它是哺乳动物和人体内蛋白质代谢的最终产物,存在于尿液中,成人每天经尿排出25~30g ,故称尿素。尿素是农业上重要的氮肥也是生产药物和塑料的重要原料。尿素注射液对降低脑颅内压和眼压有显著疗效,可用于治疗急性青光眼和脑外伤引起的脑水肿等疾病。
尿素的化学性质如下:
1.弱碱性 尿素具有酰胺的结构,但其分子有两个氨基,所以呈弱碱性,能与强酸作用生成盐。
C
O
NH 2
NH 2+HNO 3
C
O 2
NH 3
尿素的硝酸盐和草酸盐都是良好的结晶,不溶于水,利用这个性质,可以从尿液中分离提取尿素。
2.水解反应 尿素在酸、碱或尿素酶的作用下可发生水解反应。
+H 2O+HCl
C
O
NH 2
NH 2加热
4Cl
O
NH 2
NH 2+H 2加 热
2NH
+CO
3.缩二脲反应 将尿素加热到150℃~160℃时,发生双分子缩合,两分子尿素间脱去一分子氨生成缩二脲。
缩二脲不溶于水,易溶于碱液中,在缩二脲的碱性溶液中,滴加少量的稀硫酸铜溶液,呈现紫红色,这个反应叫缩二脲反应(biuret reaction )。凡分子中含有2个或2个以上酰胺键(-CO —NH-)的化合物,如多肽、蛋白质等都能发生缩二脲反应。
(二)丙二酰脲
丙二酰脲是脲和丙二酰氯或丙二酰酯通过酰化反应而生成的化合物。
O Cl C Cl
O
H 2C
+
C
H
N
H N O C N H 2C
O
O
H
H C O +2HCl
丙二酰氯 脲 丙二酰脲
丙二酰脲分子中具有2个二酰亚氨基(O
NH
O )和1个活泼的亚甲基结构,在溶液中能
发生酮式和烯醇式互变异构现象:
C N C N H 2C
O H H C
O
C
N C
H 2C
OH H
H C
OH
酮式巴比妥酸 烯醇式巴比妥酸
烯醇型羟基上的氢在水溶液中易电离出H +
,因而显弱酸性,故又称巴比妥酸。巴比妥酸本身并无治疗作用,但它的活泼亚甲基上的两个氢原子都被烃基取代后的衍生物是一类重要的催眠镇静药物,称为巴比妥类药物,其通式为:
C
N C C O O
H
H
C O
4
35
612R '
R
临床上常用的巴比妥类药物有:
C
N C O O
H H C
O
C 2H 5C 2H 5 C
N C
N C O O
H H C
O
C 2H 5C 6H 5
C
N C
N C
O O
H
H C O
C 2H 5CH 3CHCH 22CH 3
巴比妥 苯巴比妥 异戊巴比妥
这类药物有成瘾性,用药过量会危及生命。 (三)磺胺类药物
磺胺类药物是一类化学抗菌药物,在化学治疗史上占有很重要的地位,它控制了许多危害人类健康的疾病,如肺炎、败血症、脑膜炎和丹毒等。磺胺类药物是对氨基苯磺酰胺的衍生物,其中对氨基苯磺酰基是基本结构,对氨基苯磺酰基的结构如下:
H 2N
SO 2
NH
1
当N l 上连接某些基团,特别是某些杂环时,其抗菌作用增强,因此大多数磺胺类药物是N l 上的一个氢原子被取代的化合物,重要的磺胺类药物如下:
1.磺胺嘧啶(SD)
H 2N
SO
2
NH
N
N
2.新诺明(SMZ)
3.长效磺胺(SMP)
H 2N
SO 2NH
N
N
OCH 3
第三节 含氮杂环化合物
在环状有机化合物中,构成环的原子除碳原子外,还含有其它原子,这类环状化合物称为杂环
化合物。组成环的非碳原子叫做杂原子,常见的杂原子有氧、硫和氮原子等。杂环化合物的环比较稳定,在结构上是一个闭合共轭体系,至于环醚、内酯和环状酸酐等化合物,它们易开环形成链状化合物,而且它们的性质与脂肪族化合物相似,因此,通常不把它们列为杂环化合物。
杂环化合物的种类繁多,在自然界中分布很广,其数量约占已知有机化合物的三分之一。例如,植物体内的叶绿素和动物体内的血红素,组成蛋白质的某些氨基酸和组成核昔酸的碱基等都是杂环化合物。此外,有许多药物、染料和香料等也属于杂环化合物。
一、杂环化合物的分类和命名 (一)分类
杂环化合物的数量很大,其分类方法主要根据环的大小和环的数目进行分类,杂环化合物可分为单杂环和稠杂环两大类。常见的单杂环有五元和六元杂环,稠杂环分为苯稠杂环(由苯环与单杂环稠合)和稠杂环(两个单杂环相互间稠合)。常见的杂环化合物的结构及名称见表13-1。
表13-1 常见的杂环化合物的结构及名称
(二)命名
杂环化合物的命名,目前我国已经统一采用“音译法”,即把杂环化合物的英文名称的汉字译音加上“口”字旁表示杂环名称,如呋喃(furan)、吡咯(pyrrile)、吡啶(pyridine)、噻吩(thiazo1e)等。
当杂环上有取代基时,应首先对杂环母体进行编号,当杂环母体的名称及编号确定后,参照芳香化合物的命名方法,以杂环为母体名称,将环上取代基的位置、数目及名称写在环名的前面。编号规则如下:
1.除个别稠杂环外,只有一个杂原子的杂环,一般从杂原子开始编号。 例如:
N
2
3456
O CH
3
1
2345
吡啶 2-甲基呋喃
2.当环上有2个或2个以上相同杂原子时,应从连有氢或取代基的杂原子开始编号,
并使杂原子的位次最小。例如:
N H N 12
345H 3C
4-甲基嘧啶 4-甲基咪唑
3.如含有几个不相同的杂原子时,则以氧、硫、氮的顺序编号。例如:
S CH
3
1
2345
2-甲基噻唑
4.有几个稠杂环,通常按照特定的顺序编号。例如:
N 7
5
49H 8
12
3
6N N
习惯上常对只有1个杂原子的杂环用希腊字母α、β和γ来编号,靠近杂原子的碳为α-位,其次为β-位等。例如:
N CH 3
H
可以叫做3-甲基吡咯,又可叫做β-甲基吡咯。 二、吡咯和吡啶的结构 (一)吡咯的结构
吡咯是最简单的五元杂环化合物之一,它是由4个碳原子和1个氮原子组成的一个平面五元环,这5个原子之间均以sp 2
杂化轨道重叠形成。键构成环平面,而每个碳原子还有一个含单电子的p 轨道,氮原子上有一个含有一对未共用电子的p 轨道,这5个p 轨道垂直于环的平面,通过“肩并肩”的方式重叠;形成6个л电子的闭合共轭体系,所以吡咯具有芳香性,如图13-3所示。
(二)吡啶的结构
吡啶是最简单的六元杂环化合物之一。它的结构和苯相似,吡啶环上的5个碳原子和1个氮原子均以sp 2
杂化轨道形成σ键,组成六元平面环状结构。由于氮原子的未共用电子对占据sp 2
杂化轨道,不参与环上的共轭体系,所以氮原子上的1个p 电子与5个碳原子的5个p 电子共轭,形成具有6个电子的闭合共轭体系,见图13-3。
三、吡咯和吡啶的性质 (一)碱性
吡咯是仲胺类化合物。由于氮原子上的未共用电子对与环上的л电子形成共轭体系,降低了氮原子上的电子云密度,使它不易接受质子,所以吡咯碱性很弱(p K b =13.6),比苯胺还弱,不能与
稀酸或弱酸成盐。而氮原子上的氢显弱酸性,能与氢氧化钠或氢氧化钾成盐。其钾盐容易水解,这也说明吡咯的酸性较弱。
N H +KOH(固体)
N-
K+
+H2O
吡啶环上的氮原子具有叔胺的结构,氮原子上的未共用电子对没有参与闭合共轭体系,电子云密度较高,能与质子结合,显弱碱性(p K b=8.8),能与强酸成盐。
N
+HCl+HCl-
(二)取代反应
吡咯分子中氮原子的未共用电子对参与环的共轭体系,使环上的碳原子电子云密度比苯大,所以亲电取代反应比苯容易进行,其中α位的电子云密度较大,反应主要发生在α位上。
吡啶分子中氮原子的未共用电子对末参与环共扼体系,同时氮原子的吸电子作用使环上电子云密度降低,很难发生亲电取代反应。其中β位降低较少,所以亲电取代反应主要发生在β位上。
3-溴吡啶
吡啶环由于电子密度比苯环小,所以较易发生亲核取代反应,主要生成α位取代产物。
四、重要的含氮杂环化合物
(一)吡咯及其衍生物
吡咯存在于煤焦油中,为无色液体,沸点131℃,不溶于水,溶于有机溶剂。吡咯的蒸气能使浸有盐酸的松木片产生红色,称为吡咯的松木片反应,此反应可以鉴定吡咯的存在。
吡咯的许多衍生物广泛分布于自然界中,如血红素和叶绿素等,都具有卟吩的基本骨架。卟吩本身在自然界中不存在,它的取代物称为卟吩类化合物,却广泛存在。
在卟吩的4个吡咯环中间的空隙里,可以共价键及配位键的形式与金属离子结合成配合物,血红素中结合的是亚铁离子,同时4个吡咯环的β位还有各自不同的取代基。
血红素与蛋白质结合为血红蛋白而存在于红细胞中,在人体内起着运输氧气的作用。一氧化碳会使人中毒,其原因之一是因为它与血红蛋白结合的能力强于氧,从而阻止了血红蛋白与氧的结合,
造成人体缺氧而引起窒息。
卟吩和血红素的结构式如下:
卟吩血红素
(二)咪唑及其衍生物
咪唑为无色结晶,熔点90℃,易溶于水和乙醇,碱性比吡唑强,能和酸作用生成稳定的盐。
咪唑的重要衍生物之一组氨酸是蛋白质水解的产物,组氨酸经细菌的腐败作用,在人体内经脱羧而成为组胺。组胺有降低血压、扩张血管和促进胃液分泌的作用,人体内组胺过多可发生过敏反应。
组氨酸组胺
(三)噻唑及其衍生物
噻唑是无色的液体,沸点117℃,具有弱碱性,对氧化剂和还原剂都稳定。它的衍生物在医药上很重要,如磺胺噻唑及青霉素等。
青霉素具有消炎杀菌作用,对大多数因细菌感染而引起的炎症有较好的疗效,临床应用较广。天然青霉素有7种,它们均具有一个共同的基本结构,在这个基本结构中含有一个内酰胺和一个含硫杂环,各种青霉素的区别取决于结构式中R取代基的不同。例如青霉素G中R为苯甲基(苄基)。青霉素G为无色或淡黄色结晶或粉末,它难溶于水,一般制成钠盐和钾盐使用。7种青霉素具有的共同的基本结构为:
C R
O NH
CH
CH CH
O
65
4
7
C
CH3
CH3
COOH
2
1
S
3
(四)吡啶及其衍生物
吡啶又称氮杂苯,是具有特殊臭味的液体,沸点 l15℃,溶于水、乙醇和乙醚等,能和酸作用成盐。
吡啶的衍生物在医药上作用很广,如维生素B 6、维生素PP 、异烟肼和尼可刹米等。 1. 异烟肼(雷米封
)
它是吡啶的衍生物,为白色结晶或白色结晶性粉末,无臭,味略苦,易溶于水,它对结核杆菌有强烈的抑制及杀灭作用,是广泛使用的抗结核药。
2.维生素B 6
N
OH
CH 2
OH CH 2
HO
CH 3
N
OH
CH 2
NH 2CH 2
HO
CH 3
N
OH
CH 2
CHO
HO
CH 3
吡哆醇 吡多胺 吡哆醛
维生素B 6是维持蛋白质正常代谢的必要物质,主要存在于蔬菜、鱼、肉、谷类和蛋类食品之中,它包括吡哆醇、吡哆胺和吡哆醛三种,都是吡啶的衍生物。
(五)嘧啶及其衍生物
嘧啶是无色结晶,熔点22℃,易溶于水,有弱碱性。具有嘧啶环结构的化合物在自然界分布甚广。如胞嘧啶(cyeosine )、尿嘧啶(uracil)和胸腺嘧啶(thymine)等是构成核酸的三个碱基。
胞嘧啶(C ) 尿嘧啶(U ) 胸腺嘧啶(T )
嘧啶的衍生物有些是重要的药物。如磺胺嘧啶、抗癌药物5-氟尿嘧啶和维生素B l 等。 维生素B 1由嘧啶及噻唑通过亚甲基连接而成的化合物,在医药上叫做硫胺素,常用它的盐酸盐。它是白色结晶,易溶于水,对酸稳定,遇碱则分解。体内若缺乏维生素B 1,则可引起多发性神经炎、脚气病及食欲不振等。结构式如下:
N
CH 3N NH 2NH 2
CH 2N
Cl -+
S
CH 3
CH 2CH 2
OH
(六)嘌呤及其衍生物
嘌呤是由嘧啶和咪唑稠合而成,嘌呤为白色固体,熔点216~217℃,易溶于水及酒精。嘌呤呈中性,但可分别与酸或碱成盐。嘌呤在水溶液中可发生互变异构现象。
(a) (b)
药物分子中多为(a )式,在生物体中(b )式常见。
嘌呤本身在自然界中不存在,但它的衍生物广泛分布于动植物中,其中腺嘌呤(sadenine)和鸟嘌呤(guanine)是嘌呤的两个重要的衍生物,均为核酸的碱基。
N H
N
N
N
NH 2N H
N
N
N
OH
H 2N
腺嘌呤(6-氨基嘌呤) 鸟嘌呤(2-氨基-6-羟基嘌呤)
尿酸是核蛋白的代谢产物,存在于哺乳动物的尿和血中,它有酮式和烯醇式两种互变异构体。
2,6,8-三氧嘌呤(酮式) 2,6,8-三羟嘌呤(烯醇式)
尿酸是白色结晶,难溶于水,具有弱酸性,可与碱成盐。在正常代谢时,尿中含少量尿酸,若代谢紊乱时,尿中的尿酸含量增加,严重时可形成尿结石。血液中尿酸含量过多时,可沉淀在关节、耳垂和皮肤处,形成痛风石。
习 题
一、选择题
1.下列有机化合物能与盐酸反应的是( )
A .丙胺
B .苯酚
C .乙酸乙酯
D .乙烷 2.下列物质不能发生酰化反应的是( )
A .二乙胺
B .三丙胺
C .甲乙胺
D .乙丙胺 3.下列物质中,碱性最弱的是( )
A .氨
B .乙胺
C .乙酰胺
D .二乙胺 4.下列物质不能使红色石蕊试纸变蓝色的是( )
A .乙酰胺
B .甲胺
C .三甲胺
D .氨水 二、写出下列化合物的结构式
CH 3—CH —CH 2—NH 2
|
CH 3
—C —NH —CH 3
O
CH 3CH 2—C —NHCH 3O
1. N ,N-二甲基甲酰胺
2. 甲乙胺
3. 邻-甲基苯胺
4. 丙二酰脲
5. 对氨基苯甲酰胺
6. 氢氧化四甲铵
7. 对硝基苯胺盐酸盐
8. 4-甲基嘧啶
9. 嘌呤 10. 3-乙基吡啶 三、用系统命名法命名下列化合物 1. CH 3—NH —CH 2CH 3 2.
3. 4. CH 3—N —CH 2—CH 3
|
CH 2—CH 2—CH 3
5. —N —CH 3
CH 3
|
6.
7.
8. 9. 10. N
H
N
N
N
OH
四、完成下列反应式 1. CH 3CH 2NH 2+HNO 2
强 酸
2.
NHCH 3+HNO 2
3.
NH 2CH 3
C
Cl
O
+
4. C R O
NH 2+H 2O H +
5. C
H 2N
O
NH 2+150~160°C
C
H 2N
O
NH
五、用化学方法鉴别下列各组化合物 1. 乙胺、二甲胺和三甲胺
—NH —CH 3
N —CH 3
CH 3—C —NH —
O
2. 苯胺和N-甲基苯胺
3. 尿素和乙酸胺
六、下列化合物碱性按由强到弱顺序排列
苯胺、氨、甲胺、尿素、甲酰胺、氢氧化四甲铵
七、某化合物的分子式为(C7H7NO2(A)、无碱性,还原Fe得到C7H9N(B),具有碱性,在低温及浓硫酸作用下,和亚硝酸作用生成C7H7N2+HSO4-(C),加热C放出氮气,并生成对甲基酚。推测A、B、C的结构式。
第一节 胺 一、分类和命名 1.定义:氨分子中的氢原子被氨基取代后所得到的化合物。 2.分类:根据氨分子中的一个、二个和三个氢原子被烃基取 代分成伯胺(10胺)、仲胺(20胺)和叔胺(30胺)。相当于 氢氧化铵NH 4OH 和卤化铵NH 4X 的四个氢全被烃基取代所 成的化合物叫做季铵碱和季铵盐。根据氨基所连的烃基不同 可分为脂肪胺(R-NH 2)和芳香胺(Ar-NH 2)。根据氨基的 数目又可分成一元胺和多元胺。应当注意的是: NH 3 → R-NH 2 伯胺 → R 2NH 仲胺 → R 3N 叔胺 NH 4OH → R 4NOH 季铵碱 NH 4X → R 4NX 季铵盐 伯、仲、叔胺与伯、仲、叔醇的分级依据不同。胺的分 级着眼于氮原子上烃基的数目;醇的分级立足于羟基所连的 碳原子的级别。例如叔丁醇是叔醇而叔丁胺属于伯胺。 叔丁醇 (30醇) 叔丁胺(10胺) 要掌握氨、胺和铵的用法。氨是NH 3氨分子从形式上去 掉一个氢原子,剩余部分叫做氨基-NH 2,(去掉二个氢原子 叫亚氨基=NH)。氨分子中氢原子被烃基取代生成有机化合 物的胺。季铵类的名称用铵,表示它与NH 4的关系。 3.命名:对于简单的胺,命名时在“胺”字之前加上烃基的 名称即可。仲胺和叔胺中,当烃基相同时,在烃基名称之前 加词头“二”或“三”。例如: CH 3NH 2 甲胺 (CH 3)2NH 二甲胺 OH CH 3CH 3CH 3C CH 3CH 3CH 3 C NH 2
(CH3)3N 三甲胺C6H5NH2苯胺 (C6H5)2NH 二苯胺(C6H5)3N 三苯胺 而仲胺或叔胺分子中烃基不同时,命名时选最复杂的烃基作为母体伯胺,小烃基作为取代基,并在前面冠以“N”,突出它是连在氮原子上。例如: CH3CH2CH2N(CH3)CH2CH3N-甲基-N-乙基丙胺 (或甲乙丙胺) C6H5CH(CH3)NHCH3N-甲基-1-苯基乙胺 C6H5N(CH3)2N,N-二甲基苯胺季铵盐和季铵碱,如4个烃基相同时,其命名与卤化铵和氢氧化铵的命名相似,称为卤化四某铵和氢氧化四某铵;若烃基不同时,烃基名称由小到大依次排列。例如:(CH3)4N+Cl-氯化四甲铵 (CH3)4N+OH-氢氧化四甲铵[HOCH2CH2N+(CH3)3]OH-氢氧化三甲基-2-羟乙基铵(胆碱) [C6H5CH2N+(CH3)2C12H25]Br-溴化二甲基十二烷基苄基铵 二、物理性质 1.状态:低级脂肪胺,如甲胺、二甲胺和三甲胺等,在常温下是气体,丙胺以上是液体,十二胺以上为固体。芳香胺是无色高沸点的液体或低熔点的固体,并有毒性。 2.沸点:同分异构体的伯、仲、叔胺,其沸点依次降低。这是因伯、仲胺分子之间可形成氢键,叔胺则不能。例如丙胺、甲乙胺和三甲胺的沸点分别为48.7℃、36.5℃和2.5℃。 3.水溶性:低级的伯、仲、叔胺都有较好的水溶性。因为它们都能与水形成氢键。随着分子量的增加,其水溶性迅速减小。 三、化学性质
第十四章含氮有机化合物 1.给出下列化合物名称或写出结构式。 (CH3)2CH NH2(CH3)2NCH2CH3 NH CH2CH3 CH3 NH CH3O2N NC N+NCl- O2N N N OH OH H32 H 对硝基氯化苄苦味酸 1,4,6-三硝基萘 答案: 3-氨基戊烷异丙基胺二甲基乙基胺 N-乙基苯胺N-甲基-3-甲基苯胺氯化-3-氰-5-硝基重氮苯 4-硝基-2,4-二羟基偶氮苯顺-4-甲基-1-环己胺 2.按其碱性的强弱排列下列各组化合物,并说明理由。 (1)
a b c NH 2 NH 2NH 2 NO 2 3 (2) CH 3C O NH 2 CH 3NH 2NH 3 a b c 答案: (1)c > a > b 苯环上存在推电子基团如甲基,可增加N 原子上的电子云密度,使其碱性增强;当苯环上连有拉电子基团如硝基,则降低N 上的电子云密度,使其碱性降低。 (2)b > c > a 在CH 3NH 2中由于—CH3的推电子作用,增强了碱性。在CH 3CONH 2中,由于p -π共轭而降低了N 上的电子云密度,使其碱性减弱。 3.比较正丙醇、正丙胺、甲乙胺、三甲胺和正丁烷的沸点高低并说明理由。 答案: 正丙醇 > 正丙胺 > 甲乙胺 > 三甲胺 > 正丁烷 分子间的氢键导致沸点升高。由于氧的电负性大于氮的电负性,因而正丁醇分子间能形成较强的氢键,沸点较高;正丙胺的氮原子上有两个氢可以形成氢键,甲已胺只有一个,而三甲胺氮原子上没有氢原子,因而不能形成氢键;正丁烷是非极性分子,分子间只存在较弱的色散力,因而沸点最低。 4. 如何完成下列的转变: (1) CH 2 CHCH 2Br CH 2 CHCH 2NH 2
第十四章含氮有机化合物学习要求 1 ?掌握芳香族硝基化合物的制法,性质。理解硝基对苯环邻对位取代基(质的影响。 2 ?掌握胺的分类、命名和制法。 3 ?熟练掌握胺的性质及胺的碱性强弱次序,理解影响胺的碱性强弱的因素。 4 ?掌握区别伯、仲、叔胺的方法及氨基保护在有机合成中的应用。 5 ?掌握重氮盐的反应和偶联反应在有机合成中的应用。 6 ?了解季铵盐、季铵碱的性质和应用,初步了解偶氮染料。 7?学习、掌握重要的分子重排反应。 分子中含有C-N键的有机化合物称为含氮有机化合物。简单讨 论硝基化合物,重点讨论胺、重氮盐和分子重排反应。 § 14-1硝基化合物 硝基化合物一般写为R-NO2 , Ar-NO 2,不能写成R-ONO (R-ONO表示硝酸酯) 一、分类、命名、结构 1 ?分类(略) 2 ?命名(与卤代烃相次似) 3 ?硝基的结构 一般表示为N:;Q(由一个N=O和一个N T O配位键组成) 物理测试表明,两个N —O键键长相等,这说明硝基为sp1 2杂化 成键的,其结构表示如下: 、硝基化合物的制备X、OH )性 含氮有机化合物种类很多,本章P- n共轭体系(N原子是以
例如: 10% NaOH (3) 与羰基化合物缩合 有a -H 的硝基化合物在碱性条件下能与某些羰基化合物起缩合反应。 O - OH H R -CH 2 N O 2 + R'f ----- R'-C —C_NO 2 H 2O H 1 (R'' ) H R' 一 (R'') 其缩合过程是:硝基烷在碱的作用下脱去a -H 形成碳负离子, 物发生缩合反应。 (4) 与亚硝酸的反应 NaOH R 2-C~NO 2 不溶于NaOH 蓝色不变 NO 蓝色结晶 第三硝基烷与亚硝酸不起反应。此性质可用于区别三类硝基化合物。 3 ?芳香族硝基化合物的化学性质 (1 )还原反应 硝基苯在酸性条件下用 Zn 或Fe 为还原剂还原,其最终产物是伯胺。 HCl 若选用适当的还原剂,可使硝基苯还原成各种不同的中间还原产物,这些中间产物又 在一定的条件下互相转化。见 P 432 (2)硝基对苯环上其它基团的影响 硝基同苯环相连后,对苯环呈现出强的吸电子诱导效应和吸电子共轭效应,使苯环上 的电子云密度大为降低,亲电取代反应变得困难,但硝基可使邻位基团的反应活性(亲核 取代)增加。 1 °使卤苯易水解、氨解、烷基化 R_CH 2-N O 假酸式(主) — OH R —CH ——N _ O _ 酸式(较少) NaOH ---- ” R-CH =N[°_ | Na* O 1 R'— C^^C- NO 2 H R' (R'') 碳负离子再与羰基化合 R-CH 2-NO 2 + HONO NaOH R-CH-NO 2 1 NO 蓝色结晶 R —C —NO 2 1 NO 溶于NaOH 呈红色溶液 Na 十 R 2-CH —N02 + HONO Fe or Zn 400 c 32MPa 130 C
第十四章 含氮有机化合物 ● 教学基本要求 1、了解芳香族硝基化合物的性质及其制法; 2、掌握胺的性质及其制法; 3、掌握重氮盐的性质及其在合成上的应用; 4、了解偶氮化合物和偶氮染料。 ● 教学重点 芳香族硝基化合物的性质及其制法;胺的性质及其制法;重氮盐的性质及其在合成上的应用。 ● 教学难点 芳香族硝基化合物的性质及其制法;胺的性质及其制法;重氮盐的性质及其在合成上的应用。 ● 教学时数: ● 教学方法与手段 1、讲授与练习相结合; 2、传统教学方法与与现代教学手段相结合; 3、启发式教学。 ● 教学内容 第一节 硝基化合物 硝基化合物是指分子中含有硝基(-NO 2)的化合物,可以看作是烃分子中的氢原子被硝基取代后得到的化合物,常用RNO 2或ArNO 2表示。 1.1 硝基化合物的结构和命名 硝基是一个强吸电子基团,因此硝基化合物都有较高的偶极矩。通过键长的测定发现,硝基中的氮原子和两个氧原子之间的距离相同。根据杂化轨道理论,硝基中的氮原子是sp 2杂化的,它以三个sp 2杂化轨道与两个氧原子和一个碳原子形成三个共平面的σ键,未参于杂化的一对p 电子所在的p 轨道与每个氧原子的一个p 轨道形成一个共轭π键体系。硝基化合物的分子结构可以表示如下: 共振结构式: 硝基化合物的命名与卤代烃相似,通常硝基作为取代基。例如: CH 3NO 2 硝基甲烷 2-硝基丙烷 对硝基苯甲酸 CH 3CHCH 3NO 2 HOOC NO 2
2,4,6-三硝基苯酚(苦味酸) 2,4,6-三硝基甲苯(T N T ) 1,3,5-三硝基苯(T N B ) 1.2 硝基化合物的性质 1、物理性质 硝基化合物由于具有较强的极性,因此硝基化合物的熔点、沸点比相应的卤代烃高,多为高沸点的液体或固体。多硝基化合物具有爆炸性。液态的硝基化合物是许多有机化合物的优良溶剂,但硝基化合物有毒,它的蒸气能透过皮肤使人中毒,因此应尽量避免使用硝基化合物做溶剂。 2、化学性质 ①脂肪族硝基化合物的化学性质 (1)还原: (2)酸性: 脂肪族硝基化合物中,硝基的α碳原子上有氢原子时,能产生互变异构现象。 CH 2 N OH R R O 硝基式 酸式 与硝基相连的碳原子上的氢原子(α-氢),在硝基的影响下,容易失去α-氢显酸性,能和氢氧化钠作用生成盐,这种盐的溶液酸化后生成一种不稳定的硝基甲烷异构体,具有强的酸性,称作酸式,后者缓慢的转变成较稳定的硝基式(即假酸式)。 硝基化合物的酸式-假酸式互变显然与羰基化合物的酮式-烯醇式互变异构现象相似,两者主要的差别是酸式存在的时间较烯醇式要长。 (3) 与卤代烃作用: CH 3NO 2 2.RX RCH 2NO 2 (4) 与羰基化合物缩合: OH O 2N NO 2 2 CH 3 O 2N NO 2 NO 2 O 2N NO 2 NO 2
第十四章 含氮有机化合物 学习要求 1.掌握芳香族硝基化合物的制法,性质。理解硝基对苯环邻对位取代基(X 、OH ) 性质的影响。 2.掌握胺的分类、命名和制法。 3.熟练掌握胺的性质及胺的碱性强弱次序,理解影响胺的碱性强弱的因素。 4.掌握区别伯、仲、叔胺的方法及氨基保护在有机合成中的应用。 5.掌握重氮盐的反应和偶联反应在有机合成中的应用。 6.了解季铵盐、季铵碱的性质和应用,初步了解偶氮染料。 7.学习、掌握重要的分子重排反应。 分子中含有C-N 键的有机化合物称为含氮有机化合物。含氮有机化合物种类很多, 本章简单讨论硝基化合物,重点讨论胺、重氮盐和分子重排反应。 §14.1 硝基化合物 硝基化合物一般写为R-NO 2 ,Ar-NO 2 ,不能写成R-ONO (R-ONO 表示硝酸酯)。 14.1.1 分类、命名、结构 1.分类 (略) 2.命名 (与卤代烃相次似) 3.硝基的结构 一般表示为N=O 和一个N →O 配位键组成)物理测试表明,两个 N —O 键键长相等,这说明硝基为一P-π共轭体系(N 原子是以sp 2杂化成键的,其结构表 示如下: N O R
14.1.2 硝基化合物的制备 见P 430。 1.卤代烃与亚硝酸盐反应。 2.芳烃的硝化。 14.1.3 硝基化合物的性质 1.物理性质 (略) 2.脂肪族硝基化合物的化学性质 (1)还原 硝基化合物可在酸性还原系统中(Fe 、Zn 、Sn 和盐酸)或催化氢化为 胺。 (2)酸性 硝基为强吸电子基,能活泼α- H ,所以有α- H 的硝基化合物能产生假酸式-酸式互 变异构,从而具有一定的酸性。例如硝基甲烷、硝基乙烷、硝基丙烷的pKa 值分别为: 10.2、8.5、7.8 。 (3)与羰基化合物缩合 有α- H 的硝基化合物在碱性条件下能与某些羰基化合物起缩合反应。 R CH 2N O O R CH N OH O NaOH R CH N O O Na 假酸式 酸式(主)(较少) R CH 2NO 2R'C O H (R'' ) +OH R'C OH H (R'' ) C NO 2 R'H R'C H (R'' ) C NO 2 R'
第十四章含氮有机化合物(P125-129) 1.给出下列化合物的名称或写出结构式: (1)(2)(3)(4)(5)(6) (7)对硝基氯化苄 (9)(8) (10)苦味酸(11)1,4,6-三硝基萘 2.按其碱性的强弱排列下列各组化合物,并说明理由: (1) NH2NH 2 NH2 O2N H3C (2) 乙酰胺、甲胺和氨 3.比较正丙醇、正丙胺、甲乙胺、三甲胺和正丁烷的沸点高低并说明理由: 4.如何完成下列转变: (1) (2)由到 (3) 由到 (4) 由到
5.完成下列反应,并指出最后产物的构型是(R)或 (S): (1) SOCl 23 2- 6.完成下列反应: (1) N H CH 3 322? 加热 ? ? (1) CH 3I (2)Ag 2O,H 2O (3) 加热 CH 3CH 3 O 2N Fe+HCl ?(CH 3CO)2O ? ? H +,H 2O ? NaNO 2,HCl ?? O 2N CH 3 (2) (3) OCH 3 OCH 3 H 2N (4) (5) 2 (6) CH 3 CH 2CH 2NH 2 (7) NH-COCH 3 Br HNO AcOH ? (8) NO 2F O 2N + N H CH 3O 2 ?
(9) N H + CH 3 H + ? CH 2=CHCOOEt ? H + ? (10) N + 3 CH3 H 3C - ? 加热 7 .指出下列重排反应的产物: (1) (2) (3 (4) (5) (6) ? ? ?
(7) ? ? (8) 8.解释下述实验现象: (1) 对溴甲苯与NaOH在高温下反应,生成几乎等量的对和间甲苯酚。 (2) 2,4-二硝基氯苯可以由氯苯硝化得到,但如果反应产物用NaHCO3水溶液洗 涤除酸则得不到产品。 9.请判断下述霍夫曼重排反应能否实现,为什么? 9. 完成下列反应,并为该反应提供一个合理的反应机理。 (3) 解:
第十四章 含氮有机化合物 1. 给出下列化合物名称或写出结构式。 (CH 3)2CH NH 2 (CH 3)2NCH 2CH 3 NH CH 2CH 3 CH 3 NH CH 3 O 2N NC N + NCl - O 2N N N OH OH H 3C NH 2H H 对硝基氯化苄 苦味酸 1,4,6-三硝基萘 答案: 3-氨基戊烷 异丙胺 二甲乙胺 N -乙基苯胺 3-甲基-N -甲基苯胺 2-氰-4-硝基氯化重氮苯 O 2N CH 2CL NO 2 O 2N NO 2 OH NO 2 NO 2 NO 2 2. 按其碱性的强弱排列下列各组化合物,并说明理由。 (1) a b c NH 2 NH 2NH 2 NO 2CH 3 (2) CH 3C O NH 2 CH 3NH 2NH 3 a b c 答案: (1)吸电子基使碱性降低,供电子基使碱性增强,所以有:b > a > c (2)吸电子基使碱性降低,供电子基使碱性增强,所以有:b > c > a 3.比较正丙醇、正丙胺、甲乙胺、三甲胺和正丁烷的沸点高低并说明理由。 答案: 五种化合物中,按形成氢键的可能、能力可推知其沸点从高到低的次序是:
正丙醇 > 正丙胺 > 甲乙胺 > 三甲胺 > 正丁烷 分子间形成分子间氢键沸点高,醇分子中的羟基极性强于胺的官能团,胺三级大于二级又大于一级。 4. 如何完成下列的转变: (1)CH2CHCH2Br CH2CHCH 2 NH2 (2) NHCH3 O (3) (CH3)3C C OH O O C (CH3)3C CH2Cl (4) CH3CH2CH2CH2Br CH3CH2CHCH3 NH2 答案: (1) CHCH2Br CH2 NaCN CH3CH2OH CH2CHCH2CN LiAlH4CHCH2NH2 CH2 (2) O NH3+(H) NH2 CH3Br NHCH3 (3) (4) CH3CH2CH2CH2Br KOH,CH3CH2OH CH 3 CH2CH CH2 HBr CH3CH2CHCH3 Br 3 CH3CH2CHCH3 NH2 5. 完成下列各步反应,并指出最后产物的构型是(R)或(S)。 C6H5CH2CHCOOH CH3 (1)SOCl (2)NH3 (3)Br2,OH- C6H5CH2CHNH2 CH3 S-(+)(-)