
燃料电池-正负极专题习题
(总2页)
本页仅作为文档页封面,使用时可以删除
This document is for reference only-rar21year.March
燃料电池-巩固加强
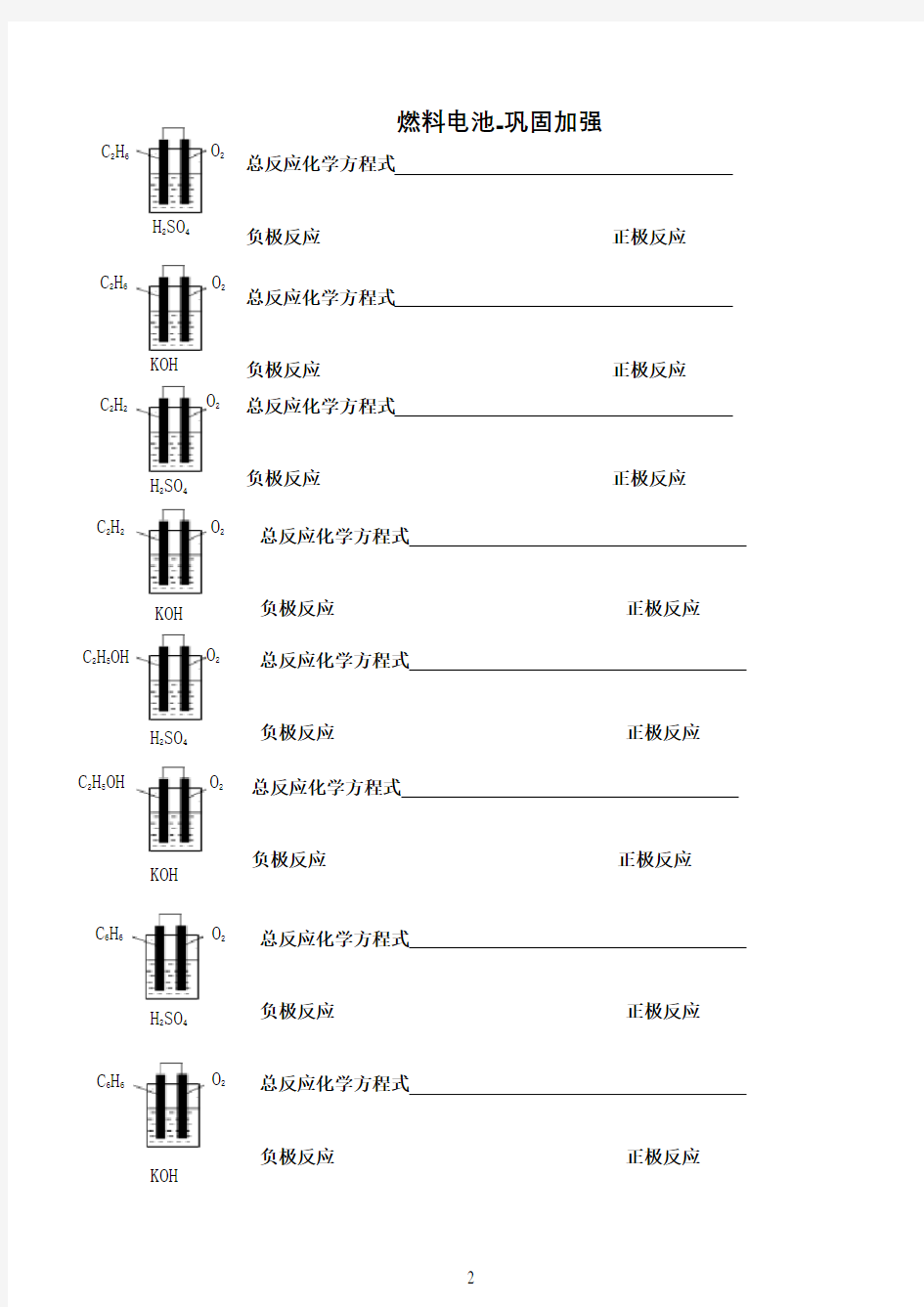
总反应化学方程式 总反应离子
负极反应 正极反应 总反应化学方程式 总反应离子
负极反应 正极反应 总反应化学方程式 总反应离子
负极反应 正极反应 总反应化学方程式 总反应离子
负极反应 正极反应 总反应化学方程式 总反应离子
负极反应 正极反应 总反应化学方程式 总反应离子
负极反应 正极反应
总反应化学方程式 总反应离子
负极反应 正极反应
总反应化学方程式 总反应离子
负极反应 正极反应
O 2
O 2
O 2
O 2
O 2
O 2
O 2
O 2
C 2H 6 C 2H 6 C 2H 2 C 2H 2 C 2H 5OH
C 2H 5OH
C 6H 6C 6H 6 KOH
H 2SO 4
H 2SO 4
H 2SO 4
H 2SO 4
KOH
KOH
KOH
1、熔融盐燃料电池因具有高效率而受重视。可用Li
2CO
3
和Na
2
CO
3
熔融盐混合物作电解
质,CO为阳极燃气,空气与CO
2
的混合气作为阴极助燃气,制得在650℃下工作的燃料电池。完成有关的电池反应式。
阳极反应式:2CO+2CO
32-=4CO
2
+4e-
阴极反应式:___________________________________。
2、(多选)肼(N
2H
4
)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是
20%~30%的KOH溶液。电池总反应为:N
2H
4
+O
2
=N
2
↑+2H
2
O。下列关于该燃料电池工
作时的说法正确的是()
A.负极的电极反应式是:N
2H
4
+4OH--4e-=4H
2
O+N
2
↑
B.正极的电极反应式是:O
2+4H++4e-=2H
2
O
C.溶液中阴离子向正极移动
D.溶液中阴离子物质的量基本不变
3、我国首创的以铝—空气—海水电池为能源的新型海水标志灯已研制成功.这种灯以取之不尽的海水为电解质溶液,靠空气中的氧使铝不断氧化而源源产生电流.只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍.试推测此种新型电池可能的基本结构及电极反应式:
(1)__________是负极,电极反应式为___________________________.
(2)__________是正极,电极反应式为___________________________.
4、某原电池中,电解质溶液为KOH(aq),分别向负极通入C
2H
4
、C
2
H
2
或Al(g),分别向
正极通入
O 2或Cl
2
.试完成下列问题:
(1)当分别通入C
2H
4
和O
2
时:
①正极反应:______ _______;②负极反应:______ _________;
③电池总反应:_____________________;④溶液pH的变化:__________
(2)当分别通入C
2H
2
和O
2
时:
①正极反应:____ ___________;②负极反应:____
___________;
③电池总反应:_____________________;④溶液pH的变化:_______________.
(3)当分别通入Al(g)和Cl
2
时:
①正极反应:_____________ _;②负极反应:
_________________________;
③电池总反应:_____________________;④溶液pH的变化:_______________.
5、据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个
月充电一次。假定放电过程中,甲醇完全氧化产生的CO
2被充分吸收生成CO
3
2-
(1)该电池反应的总离子方程式为
__________________________________________。
(2)甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将________(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO
4
溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的
O
2
________升。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极
通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y
2O
3
(Y:钇)的ZrO
2
(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷
(C
4H
10
)代表汽油。
①电池的正极反应式为____________________________________________。
②放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
关于地方时与区时的计算 一.地方时计算的一般步骤:某地地方时=已知地方时±4分钟×两地经度差 1.找两地的经度差: (1)若两地同在东经或同在西经,则: 经度差=经度大的度数—经度小的度数 (2)若两地不同是东经或西经,则: 经度数相加 a)若和小于180°时,则经度差=两经度和 b)若和大于180°时,则经度差=180°—两经度和 2.把经度差转化为地方时差,(1°=4分钟;15°=1小时) 地方时差=经度差÷15°/H 3.根据要求地在已知地的东西位置关系, 东加西减——所求地在已知地的东边用加号,在已知地的西边用减号。 二.东西位置关系的判断: (1)同是东经,度数越大越靠东。 即:度数大的在东。 (2)是西经,度数越大越靠西。 即:度数大的在西。 (3)一个东经一个西经, 如果和小180°,东经在东西经在西; 如果和大于180°,则经度差=(360°—和),东经在西,西经在东 三.应用举例: 1、固定点计算 【例1】两地同在东经或西经 已知:A点120°E,地方时为10:00,求B点60°E的地方时。 分析:因为A、B两点同是东经,所以,A、B两点的经度差=120°-60°=60° 地方时差=60°÷15°/H=4小时 因为A、B两点同是东经,度数越大越靠东,要求B点60°E比A点120°E小,所以,B 点在A点的西方,应减地方时差。 所以,B点地方时为10:00—4小时=6:00 【例2】两地分属东西经 A、已知:A点110°E的地方时为10:00,求B点30°W的地方时. 分析:A在东经,B在西经,110°+30°=140°<180°,所以经度差=140°,且A点东经在东,B点西经在西,A、B两点的地方时差=140°÷15°/H=9小时20分,B点在西方,所以,B点的地方时为10:00—9小时20分=00:40。 B、已知A点100°E的地方时为8:00,求B点90°W的地方时。 分析:A点为东经,B点为西经,100°+90°=190°>180°, 则A、,B两点的经度差=360°—190°=170°,且A点东经在西,B点西经在东。 所以,A、B两点的地方时差=170°÷15°/H=11小时20分,B点在A点的东方, 所以B点的地方时为8:00+11小时20分=19:20。 C、已知A点100°E的地方 8:00,求B点80°W的地方时。 分析:A点为100°E,B点为80°W,则100°+80°=180°,亦东亦西,即:可以说B点在A点的东方,也可以说B点在A点的西方,A,B两点的地方时差为180÷15/H=12小时。
氢能与质子交换膜燃料电池 1序言 为解决能源短缺、环境污染等问题,开发清洁、高效的新能源和可再生能源已十分紧迫。氢能因燃烧热值高、污染小、资源丰富成为新能源的对象,氢燃料电池作为氢能利用的有效手段,已被美国《时代》周刊评为21世纪有重要影响的十大技术之一。 2氢燃料电池工作原理 燃料电池本质是水电解的“逆”装置,主要由3部分组成,即阳极、阴极、电解质,如图13。其阳极为氢电极,阴极为氧电极。通常,阳极和阴极上都含有一定量的催化剂,用来加速电极上发生的电化学反应。两极之间是电解质。 以质子交换膜燃料电池(pemfc)为例,其工作原理如下: (1)氢气通过管道或导气板到达阳极; (2)在阳极催化剂的作用下,1个氢分子解离为2个氢质子,并释放出2个电子,阳极反应为: h2→2h++2e。 (3)在电池的另一端,氧气(或空气)通过管道或导气板到达阴极,在阴极催化剂的作用下,氧分子和氢离子与通过外电路到达阴极的电子发生反应生成水,阴极反应为:1/2o2+2h++2e→h2o 总的化学反应为:h2+1/2o2=h2o 电子在外电路形成直流电。因此,只要源源持续地向燃料电池阳极和阴极供给氢气和氧气,就可以向外电路的负载连续地输出电能。 3pemfc的特点及研发应用现状
燃料电池种类较多,pemfc以其工作温度低、启动快、能量密度高、 寿命长等优点特别适宜作为便携式电源、机动车电源和中、小型发电 系统。 pemfc发电机由本体及其附属系统构成。本体结构除上述核心单元外,还包括单体电池层叠时为防止汽、水泄漏而设置的密封件,以及压紧 各单体电池所需的紧固件等。附属系统包括:燃料及氧化剂贮存及其 循环单元,电池湿度、温度调节单元,功率变换单元及系统控制单元。图2是一个典型的pemfc发电系统示意图4。 (1)pemfc作为移动式电源的应用 pemfc作为移动式电源的应用领域分为两大类:一是可用作便携式电源、小型移动电源、车载电源等。适用于军事、通讯、计算机等领域,以满足应急供电和高可靠性、高稳定性供电的需要。实际应用是手机 电池、笔记本电脑等便携电子设备、军用背负式通讯电源、卫星通讯 车载电源等。二是用作自行车、摩托车、汽车等交通工具的动力电源,以满足环保对车辆排放的要求。从目前发展情况看,pemfc是技术最成熟的电动车动力电源。国际上,pemfc研究开发领域的权威机构是加拿大ballard能源系统公司。美国h-power公司于1996年研制出世界上 第一辆以pemfc发电机为动力源的大巴士5。近年来,我国对燃料电池电动车的研发也极为重视,被列入国家重点科技攻关计划。上海神力 公司、富原燃料电池有限公司、清华大学、中科院大连化物所已分别 研制出游览观光车、中巴车样车,其性能接近或达到国际先进水平。 (2)pemfc作为固定式电源的应用 pemfc除适用于作为交通电源外,也非常适合用于固定式电源。既可 与电网系统互联,用于调峰;也可作为独立电源,用作海岛、山区、 边远地区、或作为国防(人防)发供电系统电源。 采用多台pemfc发电机联网还可构成分散式供电系统。分散式供电系 统有很多优点:①可省去电网线路及配电调度控制系统;②有利于热 电联供(因为pemfc电站无噪声,可就近安装,pemfc发电所产生的热
高中化学需要掌握的8个燃料电池的方程式 几种常见的“燃料电池”的电极反应式的书写 燃料电池是原电池中一种比较特殊的电池,它与原电池形成条件有一点相悖,就是不一定两极是两根活动性不同的电极,也可以用相同的两根电极。燃料电池有很多,下面主要介绍几种常见的燃料电池,希望达到举一反三的目的。 一、氢氧燃料电池 氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入O2,总反应为:2H2 + O2===2H2O 电极反应特别要注意电解质,有下列三种情况: 1.电解质是KOH溶液(碱性电解质) 负极发生的反应为:H2+ 2e-=== 2H+,2H++ 2OH- === 2H2O,所以: 负极的电极反应式为:H2– 2e-+ 2OH-=== 2H2O; 正极是O2得到电子,即:O2+4e-=== 2O2-,O2- 在碱性条件下不能单独存在,只能结合H2O生成OH-即:2O2-+2H2O === 4OH- ,因此, 正极的电极反应式为:O2 +H2O +4e- ===4OH- 。 2.电解质是H2SO4溶液(酸性电解质) 负极的电极反应式为:H2+2e- ===2H+ 正极是O2得到电子,即:O2 +4e-=== 2O2-,O2-在酸性条件下不能单独存在,只能结合H+生成H2O即:O2- +2 H+ === H2O,因此 正极的电极反应式为:O2 + 4H+ +4e-=== 2H2O(O2+ 4e- ===2O2-,2O2- + 4H+ === 2H2O) 3. 电解质是NaCl溶液(中性电解质) 负极的电极反应式为:H2+2e-=== 2H+ 正极的电极反应式为:O2 + H2O + 4e-=== 4OH- 说明:1.碱性溶液反应物、生成物中均无H+ 2.酸性溶液反应物、生成物中均无OH- 3.中性溶液反应物中无H+和OH- 4.水溶液中不能出现O2- 二、甲醇燃料电池 甲醇燃料电池以铂为两极,用碱或酸作为电解质:
2020届届届届届届届届届届届届届 ——届届届届 1.尿素[CO(NH2)2]与NO在碱性条件下可形成燃料电池(如图),电池总反应方程式为2CO(NH2)2+6NO +4NaOH=5N2+2Na2CO3+6H2O。下列说法正确的是() A.甲电极为电池的负极,发生还原反应 B.电池工作时,电子经负载、乙电极、电解质又流向甲电极 C.电池工作一段时间后,乙电极周围溶液酸性增强 D.甲电极的电极反应式为CO(NH2)2?6e?+8OH?=CO32?+N2↑+6H2O 2.以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已 知:a电扱的反应式为O2+4H++4e-=2HO,下列说法不正确的是( ) A.b电极的反应式为CH3OCH3+3H2O?12e?=2CO2↑+12H+ B.试剂A为饱和食盐水,试剂B为NaOH稀溶液 C.阳极生成1 mol气体时,有1mol离子通过离子交换膜 D.阴极生成1 mol气体时,理论上导线中流过2mole?
3.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是() A.反应,每消耗1mol CH4转移12mol电子 B.电极A上H2参与的电极反应为:H2+CO32??2e??=H2O+CO2 C.电池工作时,CO32?向电极B移动 D.电极B上发生的电极反应为:O2+2CO2+4e??=2CO32? 某种燃料电池是以甲烷(CH4)和空气为原料,以KOH为电解质溶液构成的原电池。电池的总反应类似甲烷在氧气中的燃烧。下列说法正确的是( ) ①每消耗1molCH4可以向外电路提供8mole- ②CH4在负极发生氧化反应,电极反应式是:CH4 + 10OH- - 8e- = CO32- + 7H2O ③燃料电池把化学能直接转化为电能,而不经过热能这一种中间形式,所以它的能量转化效率高,并且 减少了对环境的污染 ④这种燃料电池要定期更换电解质溶液 A.①② B.①②③④ C.①③④ D.②④ 4.探索二氧化碳在海洋中转移和归宿,是当今海洋科学研究的前沿领域。研究表明,溶于海水的二氧化碳 主要以无机碳形式存在,其中HCO3-占95%。科学家利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。下列说法不正确的是( ) A.a室中OH?在电极板上被氧化 B.b室发生反应的离子方程式为:H++HCO3?=CO2↑+H2O C.电路中每有0.2mol电子通过时,就有0.2mol阳离子从c室移至b室 D.若用氢氧燃料电池供电,则电池负极可能发生的反应为:H2+ 2OH??2e?=2H2O
汽车新能源技术应用与发展毕业论文 目录 第1章研究汽车新能源技术的目的与意义 (1) §1.1研究的目的 (1) §1.2研究意义 (1) 第2章国外汽车新能源技术研究现状 (2) §2.1国外的相关研究 (2) §2.1.1政府高度重视汽车新能源的开发利用 (2) §2.1.2政府推动电动汽车研发和推广 (2) §2.2国的相关研究 (3) §2.2.1政府大力支持新能源汽车产业 (3) §2.2.2国新能源汽车取得重大发展 (3) 第3章汽车新能源的类型 (5) §3.1纯电动汽车 (5) §3.1.1纯电动汽车的类型 (5) §3.1.2纯电动汽车的结构原理 (6) §3.2混合动力电动汽车 (6) §3.2.1混合动力电动汽车的结构类型 (6) §3.2.2不同类型的混合动力电动汽车的比较 (8) §3.3燃料电池电动汽车 (9) §3.3.1 燃料电池电动汽车的类型 (9) §3.3.2燃料电池电动汽车的结构原理 (10) §3.4气体燃料汽车 (11) §3.4.1天然气汽车 (11) §3.4.2液化石油气汽车 (11) §3.5生物燃料汽车 (12) §3.5.1甲醇燃料汽车 (12) §3.5.2乙醇燃料汽车 (12)
§3.5.3二甲醚燃料汽车 (12) §3.6氢燃料汽车 (12) §3.7太阳能汽车 (13) 第4章汽车新能源的主要比较与发展 (14) §4.1各种新能源汽车技术的特点分析与展望 (14) §4.1.1纯电动汽车 (14) §4.1.2混合动力电动汽车 (14) §4.1.3燃料电池电动汽车 (15) §4.1.4 气体燃料汽车 (15) §4.1.5生物燃料汽车 (16) §4.1.6氢燃料汽车 (16) §4.1.7太阳能汽车 (16) §4.2能量转换效率的比较 (17) §4.3减少耗油量的比较 (17) §4.4减少碳排放的比较 (18) §4.5各种能源方案优缺点中和分析 (18) §4.6电动汽车的应用缺陷和瓶颈 (19) 第5章电动汽车应用的解决方式 (20) §5.1整车充电模式 (20) §5.1.1常规充电 (20) §5.1.2快速充电 (20) §5.2更换电池模式 (21) §5.2.1电池租赁 (21) §5.2.2电池的快速更换 (21) §5.2.3电池的维护 (21) 第6章未来电动汽车充电技术的发展方向 (23) §6.1整车充电中的慢速充电方式可以充分利用 (23) §6.2换电池模式属于能源新物流模式 (23) §6.3无线快速充电将成为最理想充电方式 (23) §6.4快速充电大量发展将带来电网谐波污染 (23) 结论 (24)
地方时、区时和时区计算练习 一.选择题(共14小题) () .下列有关北京时间的说法,不正确的是1 中国标准时间东八区区时地方时D.A.北京的地方时B.() 时,北京的地方时为:002.当北京时间1256 ::::00 16 3.右图中的两条虚线,一条是晨昏线,另一条两侧大部分地区日期不同;()? 8日,则甲地为此时地球公转速度较慢。若图中的时间为7日和时8日4时.7日8 D.日7A.日4时 B.88时C135°5ˊE),最西端位于新疆帕中国幅员辽阔,最东端位于黑龙江与乌苏里江主航道汇合处(约题。4~6米尔高原(约73°40ˊE)。据此回答() 日,中国最东端日出时,北京时间约为月214.300 :00 :00 ::() 21日,中国最东端日出时,最西端帕米尔高原的地方时约为5.3月55 ::00 ::55 () 6.当中国最西端到达正午时,北京时间约为05 :::55 :00 题。~10读下图(阴影部分表示黑夜),据此回答7() .此时太阳直射点的地理坐标是7 B.(30°E,30°W)A.(0°,60°E) (0°,30°E)(0°,120°E)C. D.() 是.此时有两条经线两侧日期不同,这两条经线8 (0°,150°W)B.A.(0°,180°)(180°,150°E)D.(150°W,180°)C. () .此时,北京时间为9. :00 ::00 :00 10.当昏线与本初子午线重合时,北京时间可能为() 月24日2时月22日2时月21日10时月23日10时 2007年10月24日北京时间(东八区)18时05分,举世瞩目的“嫦娥一号”卫星在中国西昌卫星发射中心成功发射。据此回答11~12题: 11.“嫦娥一号”观测的目标天体是()A.太阳 B.月球C.金星D.火星 12.此时,美国纽约(西五区)的区时是() 日5时05分日13时05分日10时05分日11时05分
高二化学燃料电池专题 Document number:WTWYT-WYWY-BTGTT-YTTYU-2018GT
燃料电池专题我在这里给同学们梳理一下燃料电池的原理,主要是解决正负极电极方程式书写的问题。 一、预备知识(如果你必修阶段掌握良好可跳过这一部分) 燃料电池说到底还是原电池,我们在这里先复习下必修2中Cu-Zn原电池的原理。1. 看构造 如上图,原电池主要由Cu片、Zn片、稀H2SO4、导线等构成。 2. 谈现象 Zn片是银白色的,在放电过程中溶解。 Cu片是紫红色的,在放电过程中表面有气泡冒出。 3. 说原理 Zn比Cu金属性强(更活泼),即更容易失去电子,导线连接之后,Zn的电子优先选择沿着导线跑到铜片表面去排队1而不是直接跳到溶液里。 Zn由于失去电子被氧化形成Zn2+,就脱离了Zn片表面溶解在了溶液里,Zn片就不断变薄变细。我们把Zn这一极称为负极,电极方程式是Zn-2e-=Zn2+。 与此同时,另一极Cu的表面由于有电子在那儿排队,而显负电,就会吸引溶液中的阳离子H+向该极移动,这些阳离子获得那些排队的电子生成H2,于是就有气泡冒出。我们把Cu这一极称为正极,电极方程式是2H++2e-=H2↑ 4. 小结 Cu-Zn原电池(稀H2SO4作为电解质) Zn是负极,失去电子,被氧化,电极方程式Zn-2e-=Zn2+。
Cu是正极,H+在其表面得电子,被还原,电极方程式2H++2e-=H2↑。 总反应式是Zn+2H+=Zn2++H2↑ 要小心,不要想当然地认为Zn失去电子则Cu得电子,Cu虽然金属性不强但毕竟仍然是金属,且是电的良导体(家里的电线、电话线、网线),说明了它表面的电子还是很容易移动的,因此它不会自己得电子形成带负电的离子。 1:注意,我这里说电子排队只是形象地打个比方便于理解,给中学生讲课是可以这么讲的,实际上只有当回路接通的时候才会有电子跑到铜片上去。而之所以有这样的一个接通回路就会定向移动应该是电势差U造成的。 二、氢氧燃料电池——最简单的燃料电池 下面是该电池的原理图: 1. 看构造 这个电池由两个惰性电极Pt(金属铂)、导线等构成。左右两半溶液槽用隔膜隔开(允许部分离子通过,如阴离子半透膜只允许阴离子通过,不会完全隔断,否则就行不成闭合回路了)。 2. 谈原理 左右分别有一条导气管,将H2和O2输送到Pt电极附近。由于Pt的特性——如表面多孔,可以吸附气体,所以这些输送进去的气体不会立刻浮出水面,而是附着在Pt电极表面。 我们知道H2跟O2相比,前者是还原性气体,后者是氧化性气体。也就是说前者容易失去电子,后者容易得到电子。于是,跟我们之前Cu-Zn原电池类似就有: H2作负极反应物,失去电子,被氧化,生成H+。但是电极方程式却不一定是H2-2e-=2H+。为什么呢因为电解液的酸碱性不知道。如果电解液为酸性或者中性,这些H+
> 燃料电池-巩固加强 )— ·- ? 总反应化学方程式 负极反应正极反应 总反应化学方程式总反应离子方程式: 负极反应正极反应 总反应化学方程式总反应离子方程式负极反应正极反应 总反应化学方程式总反应离子方程式负极反应正极反应 总反应化学方程式总反应离子方程式. 负极反应正极反应 总反应化学方程式总反应离子方程式负极反应正极反应 总反应化学方程式总反应离子方程式、 负极反应正极反应 O2 O2 O2 O2 O2 O2 O2 C2H6 C2H6 ! C H C2H2 C2H5OH C2H5OH C6H6KOH H2SO4 ( H SO H2SO4 H2SO4 KOH KOH
( 1、熔融盐燃料电池因具有高效率而受重视。可用Li 2CO 3和Na 2CO 3熔融盐混合物作电解质,CO 为阳极燃气,空气与CO 2的混合气作为阴极助燃气,制得在650℃下工作的燃料电池。完成有关的电池反应式。 阳极反应式:2CO +2CO 32-=4CO 2+4e - 阴极反应式:___________________________________。 2、(多选)肼(N 2H 4)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH 溶液。电池总反应为:N 2H 4+O 2=N 2↑+2H 2O 。下列关于该燃料电池工作时的说法正确的是( ) A .负极的电极反应式是:N 2H 4+4OH --4e -=4H 2O +N 2↑ B .正极的电极反应式是:O 2+4H ++4e -=2H 2O C .溶液中阴离子向正极移动 D .溶液中阴离子物质的量基本不变 3、我国首创的以铝—空气—海水电池为能源的新型海水标志灯已研制成功.这种灯以取之不尽的海水为电解质溶液,靠空气中的氧使铝不断氧化而源源产生电流.只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20~50倍.试推测此种新型电池可能的基本结构及电极反应式: (1)__________是负极,电极反应式为___________________________. (2)__________是正极,电极反应式为___________________________. 4、某原电池中,电解质溶液为KOH(aq),分别向负极通入C 2H 4、C 2H 2或Al(g),分别向正极通入 O 2或Cl 2.试完成下列问题: (1)当分别通入C 2H 4和O 2时: ①正极反应:______ _______;②负极反应:______ _________; ③电池总反应:_____________________;④溶液pH 的变化:__________ (2)当分别通入C 2H 2和O 2时: ①正极反应:____ ___________;②负极反应:____ ___________; ③电池总反应:_____________________;④溶液pH 的变化:_______________. (3)当分别通入Al(g)和Cl 2时: ①正极反应:_____________ _;②负极反应:_________________________; ③电池总反应:_____________________;④溶液pH 的变化:_______________. 5、据报道,最近摩托罗拉(MOTOROLA )公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO 2被充分吸收生成CO 32- (1)该电池反应的总离子方程式为__________________________________________。 (2)甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH 将________ (填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO 4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O 2________升。 (3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y 2O 3(Y :钇)的ZrO 2(Zr : 总反应化学方程式 总反应离子方程式 负极反应 正极反应 O 2 C 6H 6KOH
图1 时区和区时的计算专题试卷一 6月22日,当太阳同时位于北半球甲、乙两地上中天(在天空中的位置最高)时,测得甲地太阳高度角为60°,乙地太阳高度角为36°;甲、乙两地在某地图上的距离是44.4厘米(不考虑地形因素)。据此回答1-2题。 1.关于甲、乙两地的说法,正确的是 A .甲、乙两地任何一天均不可能同时看到日出 B .甲地正午太阳高度总是大于乙地 C .甲、乙两地昼夜长短总是相同 D .甲、乙两地均可能出现极昼现象 2.该地图的比例尺为 A .1:24 000 000 B .图上1厘米代表实际距离30千米 C .六十万分之一 D .1:6000 000 3.当我国某城市(30.5°N ,115°E)市中心的标志性建筑物正午阴影面积达一年中最大时,下列四幅昼夜 分布局部图(图1)与之相符的是(阴影表示夜半球) 由图为某群岛示意图,此季节该群岛北侧附近的洋流流向是自西向东,M 线为晨昏线。据此回答4-6题: 4.此时北京时间为 A .21时 B .9时 C .13时 D .23时 5.当图中夹角a 为20?时,下列叙述正确的是 A .南极圈上出现极夜现象 B .此时北京寒冷干燥 C .北半球各地昼长正逐渐加大 D .该地区正午时的物体影子朝南 6.危及到该群岛国家经济发展和生存的主要环境问题是: A .火山、地震 B .全球性气候变暖 C .泥石流、滑坡 D .海洋环境污染 北京时间2005年7月4日13点57分,由美国发起,中、俄、德、法、加等多国科学家参与的“深度撞击号”航天器,经过半年太空遨游,成功地对太阳系中“坦普尔一号”彗星实施了撞击。据此回答7—8题。 7.下列光照图中,与深度撞击号”撞击彗星的时刻最接近的是 8.撞击彗星的瞬间,美国加州大部分地区(西八区)正值日落后3小时左右,天空完全暗 下来,许多天文爱好者目睹了“太空焰火”奇观。此日该地昼长大约为 A .10小时 B .12小时 C .14小时 D . 16小时 9.在某地24时看到北极星的仰角是40o,这时格林尼治时间是当日 18时,那么,这个地点的地理坐标是 A .90oE ,40oN B100oE ,50oN C .90oW ,50oN D .100oW ,40oN
氢能的利用及其环境效应 题目氢能的利用及其环境效应 专业过程装备与控制工程 姓名曹维褀 学号 3013207186 2014年1月 摘要:伴随21世纪的到来,世界各国都面临着亟待解决的能源问题。氢能是高效清洁环保型新能源,在二十一世纪有望成为世界能源舞台上举足轻重的二次能源。文章总结了氢能的特点,氢的开发与利用,结合氢能的环境效应提出了关于氢能源未来发展趋势的一些见解。 关键词:氢能的开发环境效应氢能的利用
1. 氢能的特点 (1)氢是自然界存在最普遍的元素,据估计它构成了宇宙质量的75%,除空气中含有氢气外,它主要以化合物的形态贮存于水中,而水是地球上最广泛的物质(2)所有气体中,氢气的导热性最好,比大多数气体的导热系数高出10倍,因此在能源工业中氢是极好的传热载体 (3)氢燃烧性能好,点燃快,与空气混合时有广泛的可燃范围,3%-97%范围内均可燃。而且燃点高,燃烧速度快 (4)除核燃料外,氢的发热值是所有化石燃料、化工燃料和生物燃料中最高的,达142.35lkJ/kg,每千克氢燃烧后的热量,约为汽油的3倍,酒精的3.9倍,焦炭的4.5倍 (5)所有元素中,氢重量最轻。在标准状态下,它的密度为0.0899g/L;氢可以以气态、液态或固态的金属氢化物出现,能适应贮运及各种应用环境的不同要求(6)氢本身无毒,与其他燃料相比氢燃烧时最清洁,除生成水和少量氮化氢外不会产生诸如一氧化碳、二氧化碳、碳氢化合物、铅化物和粉尘颗粒等对环境有害的污染物质,少量的氮化氢经过适当处理也不会污染环境,而且燃烧生成的水还可继续制氢,反复循环使用 2. 氢能开发与利用 由以上特点可以看出氢是一种理想的新型能源。目前,虽然液氢已广泛用作航天动力的燃料,但氢能大规模的商业应用还面临着许多问题,氢能否被广泛使用,制氢工艺是基础。因为水分子中氢和氧的结合非常牢固,要把它们分开,需花费很大的力气。为了避开这个难点,目前实际上主要还是利用天然气、煤炭和石油产品作原料来制取氢气。 (1)矿物燃料制氢是利用化学方法将矿物中的氢元素提取出来的方法。 ①煤的焦化。 ②水煤气转化。
高中化学需要掌握的8个燃料电池的方程式 一、氢氧燃料电池 氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入O2,总反应为:2H2 + O2 === 2H2O 电极反应特别要注意电解质,有下列三种情况: 1.电解质是KOH溶液(碱性电解质) 负极发生的反应为:H2 + 2e- === 2H+ ,2H+ + 2OH- === 2H2O,所以: 负极的电极反应式为:H2 – 2e- + 2OH- === 2H2O; 正极是O2得到电子,即:O2 + 4e- === 2O2- ,O2- 在碱性条件下不能单独存在,只能结合H2O生成OH-即:2O2- + 2H2O === 4OH- ,因此, 正极的电极反应式为:O2 + H2O + 4e- === 4OH- 。 2.电解质是H2SO4溶液(酸性电解质) 负极的电极反应式为:H2 +2e- === 2H+ 正极是O2得到电子,即:O2 + 4e- === 2O2- ,O2- 在酸性条件下不能单独存在,只能结合H+生成H2O即:O2- + 2 H+ === H2O,因此 正极的电极反应式为:O2 + 4H+ + 4e- === 2H2O(O2 + 4e- === 2O2- ,2O2- + 4H+ === 2H2O) 3. 电解质是NaCl溶液(中性电解质) 负极的电极反应式为:H2 +2e- === 2H+ 正极的电极反应式为:O2 + H2O + 4e- === 4OH- 说明:1.碱性溶液反应物、生成物中均无H+ 2.酸性溶液反应物、生成物中均无OH- 3.中性溶液反应物中无H+ 和OH- 4.水溶液中不能出现O2- 二、甲醇燃料电池 甲醇燃料电池以铂为两极,用碱或酸作为电解质: 1.碱性电解质(KOH溶液为例) 总反应式:2CH4O + 3O2 +4KOH=== 2K2CO3 + 6H2O 正极的电极反应式为:3O2+12e- + 6H20===12OH-
毕业设计(论文)题目名称:新型燃料电池的研究
新型燃料电池的研究Research on new type fuel cells
摘要 能源是经济的的基础。人类为了更有效的的利用能源,一直进行着不懈的努力。利用能源的方式历史上有过多次革命性的变革,每一次变革都极大的推进了社会文明的发展。二次能源中,蒸汽由于传输距离短,难以存储而应用受限;电能虽然传输快、传输距离远,但存在传输过程中存在能量损耗大,难于存储的缺点;而氢能既能远距离传输、又能方便存储,因而成为二十一世纪的理想能源,二十一世纪也被称为氢世纪。多年来人们一直努力寻找既有较高能源效率又不污染环境的能源方式,因而引导出燃料电池发电技术。燃料电池是不经燃烧过程直接把燃料的化学能转化为电能的装置,具有能量转换效率高、污染物排放量少的独特优点。燃料电池凭借着它独特的优势应用在各个领域,加速了社社会的发展,推进了社会的文明。本文简述了燃料电池技术,各类燃料电池的原理以及它们各自的特点,并介绍目前燃料电池在国内外的应用现状,同时指出目前影响燃料电池商品化的主要因素。 关键词:新能源;燃料电池;高效率;环境保护。
Abstract Energy is the basis of the economy. Human beings in order to make more effective use of energy, has been making unremitting efforts. The history of the use of energy, there have been several revolutionary changes each time changes are greatly promoted the development of our society. Secondary energy in the steam due to short transmission distance, it is difficult to store and the application is limited; electricity transmission faster, the transmission distance, but there is energy loss in the transmission process, difficult to store shortcomings; hydrogen both long-distance transmission. can facilitate the storage, and thus become the ideal energy of the twenty-first century, the twenty-first century is also known as a hydrogen century. Over the years people have been trying to find the energy efficiency of higher energy without polluting the environment, and thus lead to a fuel cell power generation technology. The fuel cell is not directly by the combustion process the fuel chemical energy converted into electrical energy, with the unique advantages of high energy conversion efficiency of the discharge of pollutants. The fuel cell by virtue of its unique advantages of application in various fields to accelerate the social development of society, and promote the social civilization. In this paper, the fuel cell technology, the principle of various types of fuel cells and their respective characteristics, and describes the application of fuel cells at home and abroad, noting that the main factors affecting the commercialization of fuel cell. Keywords: new energy; fuel cell; high efficiency; environmental protection.
专题训练——地方时区时的计算 一、有关地方时的计算 1.已知A 、B 两地经度和A 地的地方时,求B 地的地方时: B 地地方时=A 地地方时±分钟经度差41 0? 如果B 地在A 地的东面用“+”;如果B 地在A 地的西面用“-”。 例1:当东经115°的地方时为9时30分时,东经125°的地方时为多少? 解析:因为东经125°位于东经115°的东面,所以: 东经125°地方时=9时30分+4)1 115125(00 0?-分钟=9时30分+40分=10时10分, 也就是说,当东经115°为9时30分的时候,东经125°的地方时为10时10分。 例2:A 地为东经120°当时的时间为10:20,B 地为东经90°,求B 地的地方时。 解析:因为B 在A 的西面,所以: B 地地方时=10:20-41901200 0?-分钟 =10:20-120分钟 =8:20 2.已知两地的地方时和其中一地的经度,求另一地经度 所求经度=已知经度±014?分钟 地方时差 例1.当伦敦为正午时,区时为20:00的城市是…………………………………( ) A 、悉尼(150°E ) B 、上海(120°E ) C 、洛杉矶(120°W ) D 、阿克拉(0°经线附近) 解析:伦敦正午时为12:00,经度为0°;而区时为20:00的地方应该在伦敦的东部,则: 所求经度=已知经度±014?分钟地方时差=0°+014 1220?-=120°E 二、时区和区时的计算
1.已知A、B两地的时区和A地的区时,求B地的区时: B地区时=A地区时±时区差 如果B地在A地的东面用“+”;如果B地在A地的西面用“-”。 计算结果小于24时,那么日期不变,时间取计算结果; 计算结果大于24时,那么日期增加1日,时间取计算结果减24; 计算结果是负数,那么日期减1日,时间取计算结果加24; 从东向西每过一个时区减1小时;过日界线(180经线°),日期加1天; 从西向东每过一个时区加1小时;过日界线(180经线°),日期减1天。 2行程时间的计算: 由出发时间求到达时间,须加上行程时间; 由到达时间求出发时间,须减去行程时间。 例1.圣诞节(12月25日)前夜当地时间19:00时,英格兰足球超级联赛的一场比赛将在伦敦开赛。香港李先生要去伦敦观看这场比赛。自香港至伦敦,飞机飞行时间约为17小时。试回答下列问题。 (1) 开赛的时候,我国北京时间应为。 解析:A地伦敦(中时区)时间12月24日19:00,B地北京(东八区),时区差=8,B位于A 的东面,所以向东计算时: B地区时=A地区时+时区差=19:00+8:00=27:00 则:日期为12月24日+1日(12月25日),时间为27:00-24:00=3:00 即:开赛时对应的北京时间为12月25日凌晨3:00 (2)在下列香港——伦敦的航班起飞时间中,李先生选择较为合适。 A.23日15:00时B.23日18:00时C.24日7:00时D.24日10:00时 解析:这是由达到时间求出发时间,用以上计算结果再减去行程时间得: 出发时间=A地区时+时差-行程时间=19:00+8:00-17:00=10:00 即李先生本应在12月24日上午10:00出发,但不可能一下飞机就能观看比赛,还需要
燃料电池专利报告 1 总体发展趋势 1.1 申请量年度趋势分析 专利数量是技术产出的直接反映。通过揭示历年专利申请情况,可以了解该行业的技术发展情况和所处阶段,并预测未来发展趋势,可协助企业评估此时或未来是否应积极投入研发。 上图显示了目标技术领域内总体申请量变化趋势。专利数量较少的时期为该技术的起步阶段;专利数量大幅度提升的为成长阶段;专利数量继续增加的为成熟阶段;专利数量维持不变的为停滞期;申请量开始降低的阶段为下降期。 1.2 公开量年度趋势分析 通过揭示历年专利公开情况,了解该行业的技术发展情况并预测未来发展趋势。
上图显示了目标技术领域内总体公开量变化趋势。 1.3 产出规模指数预警 通过揭示目标技术领域内最近6年专利数量相对增长变化情况,了解不同时期技术研发的重点和方向,给企业预测该技术领域未来发展趋势提供依据。 时间专利数量比上月增长与近6年年均增 幅比较与整体年均增幅比较 2012 179 -76.01% 下降上升 2011 746 4.34% 下降上升 2010 715 10.34% 下降上升 2009 648 -4.42% 下降上升 2008 678 3.04% 下降上升 2007 658 35.67% 下降上升上表显示了发明公开专利近6年专利的产出数量情况。一些年份的专利产出增幅高于/低于近6年年均增幅,且高于/低于整体年均增幅。 1.4 产出质量指数预警 由于发明专利的创造性水平要高于实用新型专利和外观专利,因此一般来说发明专利的申请数量是专利质量的最好体现。通过揭示目标技术领域内最近6年专利类型比重和有效专利比重的相对增长变化情况,可以更好地了解不同时期内技术研发的重点和方向,预测该技术领域未来的发展趋势。
专题练习(原电池电解池) 一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个 ....选项符合题意)1.原电池的正极和电解池的阴极所发生的反应分别是:() A.氧化、还原B.还原、氧化C.氧化、氧化D.还原、还原 2.在盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后:()A.溶液的pH增大B.Na+和CO32-的浓度减小 C.溶液的浓度增大D.溶液的浓度不变,有晶体析出 3.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是:() A.CuCl2(CuSO4) B.NaOH(NaOH) C.NaCl(盐酸) D.CuSO4(CuO) AlCl溶液时,下图所示的电解变化曲线合理的是() 4.用石墨作电极电解 3 A.①④B.②④C.②③D.①③ 5.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是() 6.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是 A.上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质 B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用 C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-=2CO2↑+3H2O D.甲烷燃料电池的正极反应为O2+2H2O+4e-=4OH- 7.通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1,则下列表述正确的是() A.在两个阴极上得到的银和汞的物质的量之比n(硝酸银)∶n(硝酸亚汞)=2∶1 B.在两个阳极上得到的产物的物质的量不相等 C.硝酸亚汞的分子式为HgNO3 D.硝酸亚汞的分子式为Hg2(NO3)2 8.某工厂以碳棒为阳极的材料电解熔解于熔融冰晶石(NaAlF6)中的Al2O3,每产生1molAl,同时消耗1mol阳极的材料C,则阳极收集得到的气体为() A.CO与CO2物质的量之比为 1:2 B.CO与CO2物质的量之比为 1:1 C.CO2与O2物质的量之比为 2:1 D.F2与O2 物质的量之比为 1:1
燃料电池专题 1.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法正确的是 A.该电池工作时电能转化为化学能 B.该电池中电极a是正极 C.外电路中电子由电极b通过导线流向电极a D.该电池的总反应:2H2+O2=2H2O 2.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是 A.a电极是负极 B.b电极的电极反应为:4OH-— 4e-= 2H2O + O2↑ C.氢氧燃料电池是一种具有应用前景的绿色电源 D.氢氧燃料电池是一种不需要将还原剂和氧化剂 全部储藏在电池内的新型发电装置 3.据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供腺务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是 A.正极反应式为:O2+2H2O+4e-=4OH- B.工作一段时间后,电解液中KOH的物质的量不变 C.该燃料电池的总反应方程式为:2H2+O2=2H2O D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 4.氢氧燃料电池用于航天飞船,电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应如下:
负极:2H2+4OH—-4e—4H2O 正极:O2+2H2O+4e—4OH— 当得到1.8L饮用水时,电池内转移的电子数约为 A.1.8mol B.3.6mol C.100mol D.200mol 5.航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2= 2H2O,酸式氢燃料电池的电解质是酸、其负极反应为:2H2-4e-= 4H+,则正极反应为;碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-= 4OH-,则负极反应 为:。 6.美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型电源,其构造如图所示:a、b 两个电极均由多孔的碳块组成,通人的氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电。 (1)该燃料电池发生的总的化学方程式 是:,其电极分别为a 是极,b是极(填正或负),其电极反应分别是:a极:b极: (2)氢氧燃料电池能量转换率高,无污染,最终产物只有水,阿波罗宇宙飞船上的宇航员的生活用水均由燃料电池提供,已知燃料电池发一度电生成396g水,其热化学方程式是2H2(g)+O2(g) ===2H2O(l)+572kJ,则发出一度电时,产生能量kJ,此燃料电池的能量转换率是。 (3)燃料电池的输出电压为1.2V,要使标有1.2V、1.5W的小灯泡连续发光1小时,则共消耗H2的物质的量为mo1. 7.氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答: