
总蛋白(TP)测定试剂盒(双缩脲法)
适用范围:用于体外定量测定人体血清中总蛋白的含量。
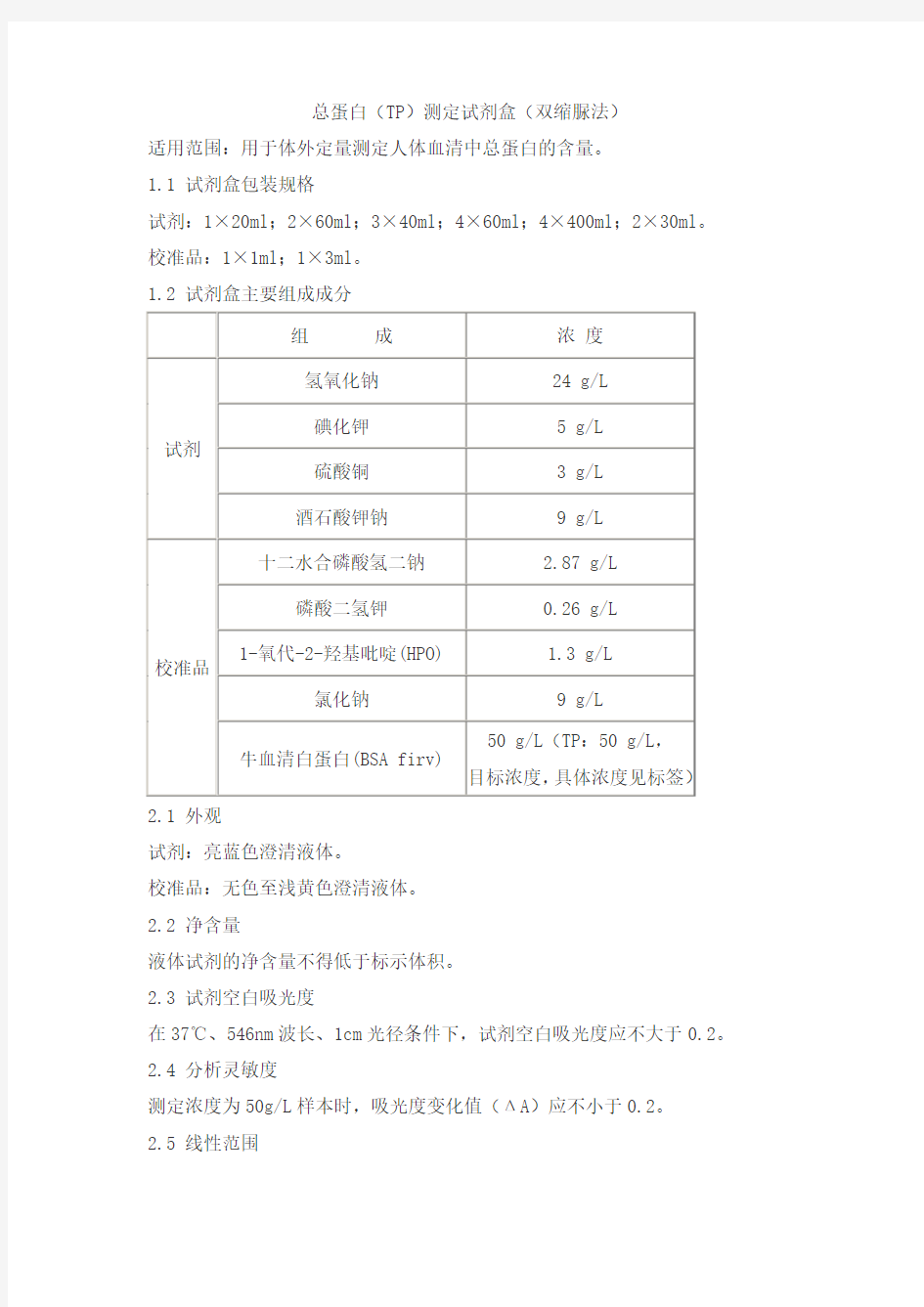
1.1 试剂盒包装规格
试剂:1×20ml;2×60ml;3×40ml;4×60ml;4×400ml;2×30ml。校准品:1×1ml;1×3ml。
1.2 试剂盒主要组成成分
2.1 外观
试剂:亮蓝色澄清液体。
校准品:无色至浅黄色澄清液体。
2.2 净含量
液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度
在37℃、546nm波长、1cm光径条件下,试剂空白吸光度应不大于0.2。
2.4 分析灵敏度
测定浓度为50g/L样本时,吸光度变化值(ΔA)应不小于0.2。
2.5 线性范围
在(10,100)g/L线性范围内,线性相关系数r应不小于0.990。在[30,100)g/L范围内的线性相对偏差应不大于±10%;在(10,30)g/L范围内的线性绝对偏差应不大于±3.0g/L。
2.6 重复
性
重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于3%。
2.7 批间差
不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于5%。
2.8 准确度
相对偏差:相对偏差应不超过±10%。
2.9 校准品溯源性
依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至NIST生产的有证参考物质(SRM927)。
2.10 稳定性
效期稳定性:试剂盒在2℃~8℃下有效期为12个月,取失效期的试剂盒进行检测,试验结果应满足2.1、2.3、2.4、2.5、2.6、2.8要求。
特异性生长因子测定试剂盒(化学法) 适用范围:用于体外定量测定人血清中特异性生长因子的含量。 1.1 包装规格 包装规格见表1。 表1 包装规格 。
2.1 外观 试剂1为无色澄清液体,目测不得有任何沉淀及絮状悬浮物; 试剂2为无色或淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;校准品为无色到淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;质控品为无色到淡黄色澄清液体,目测不得有任何沉淀及絮状悬浮物;试剂盒标签标识清晰,外包装完整无损。 2.2 净含量 试剂的净含量应不少于标称量。
2.3 试剂空白吸光度 试剂空白:A570nm下测定空白吸光度应≤0.1000。 2.4 准确度 与已上市产品进行比对试验:在SGF 浓度[60,400]U/mL区间内,相关系数r 当量 ≥0.990,在[60,200]U/mL区间内测定的绝对偏差应不超过±20U/mL,在(200,400]U/mL区间内测定的相对偏差应不超过±10%。 2.5 分析灵敏度 浓度200 U/mL时,其吸光度变化率在0.0050~0.0300之间。 样本SGF 当量 2.6 线性区间 浓度[60,400]U/mL区间内,线性相关系数r≥0.990,在[60,200]U/mL 在SGF 当量 区间内测定的线性绝对偏差应不超过±20U/mL,在(200,400]U/mL区间内测定的线性相对偏差应不超过±10%。 2.7 测量精密度 2.7.1 重复性 对高、低不同浓度的血清样本或质控品重复测定10次,其测定值的变异系数(CV%)应不大于10%。 2.7.2 批间差 随机抽取三批试剂盒的批间相对极差(R)应不大于10%。 2.8 质控品赋值有效性 使用质控品进行测定,所得结果应在靶值范围内。 2.9 稳定性
产品技术规范书 设备名称:SF6气体定性检漏仪 型号:XP-1A 数量:1台套 一、产品应用: XP-1A SF6气体定性检漏仪是30年以来检漏仪制造经验的顶点。作为迄今制造的最稳定与最灵敏的负电晕检漏仪,我们为提供此种工具而骄傲。我们把所有的经验及多年客户的反馈溶入到此产品中,希望为用户提供最好的一切:价格、性能及可靠性。 XP-1A SF6气体定性检漏仪的核心是一台先进的微处理机。它采用的数字信号处理技术使得它比采用的操纵电路及传感头信号更好成为可能。此外,电路中使用的元件数量约减少40%,从而提高了可靠性及性能。微处理机实时监视传感头和电池电压值,每秒钟可达4000次,能及时补偿即使是最微小变动的信号脉动。这使得该仪表在几乎一切环境的应用中,成为一种稳定而可靠的检测工具。 XP-1A SF6气体定性检漏仪在设计上增加了许多方便用户使用的性能。灵敏度的七级自由设置,使仪表从一级到七级增加64倍的灵敏度;独特的三色发光二极管把渐进的及广范围的泄漏大小的指示出来;指示灵敏度的等级;并提供有关电池电量的实际电压指示。触摸式键盘控制所有使用功能;新颖的外壳设计供使用者紧握,方便操作;安装使用时目视的直观指示器。 二、采用标准 本SF6气体定性检漏仪的制造、试验和验收除了应满足本技术要求外,还应符合如下标准: ●GB191 包装储运图示标志EQVISO780:1997 ●GB/T5048防潮包装 ●GB/T5832.2—1986 气体中微量水分的测定露点法 ●GB/T6388 运输包装收发货标志 ●GB/T6587.1—1986 电子测量仪器环境试验总纲 ●GB/T6587.2 电子测量仪器温度试验 ●GB/T6587.3 电子测量仪器湿度试验 ●GB/T6587.4 电子测量仪器振动试验 ●GB/T6587.5 电子测量仪器冲击试验
磷脂测定试剂盒(氧化酶法)适用范围:用于体外定量测定人血清中磷脂的含量。 1.1规格 校准品(选配):1×1mL; 质控品(选配):水平1:1×1mL,水平2:1×1mL。1.2 组成
品靶值、质控品质控范围详见包装标签。 2.1 外观 2.1.1试剂1:无色至淡黄色液体,无可见不溶物。 2.1.2试剂2:无色至淡黄色液体。 2.1.3校准品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。 2.1.4质控品:冻干粉,复溶后为无色至淡黄色液体,无可见不溶物。 2.1.5包装外观应整洁,标签字迹清晰,不易脱落。 2.2 净含量 液体试剂的净含量不低于标示体积。 2.3 试剂空白吸光度
试剂空白吸光度≤0.7。 2.4 分析灵敏度 样本浓度为200 mg/dL时,吸光度差值应≥0.05。 2.5 线性 在[20,1000] mg/dL的范围内,线性相关系数r≥0.990。测试浓度在[20,300] mg/dL 时,绝对偏差应不超过±30 mg/dL;测试浓度在(300,1000] mg/dL 时,相对偏差应不超过±10%。 2.6 精密度 2.6.1重复性 用高、低2个浓度的样本测试试剂盒,各重复测试10次,其变异系数(CV)应不大于6%。 2.6.2批间差 用样本分别测试3个不同批次的试剂盒,每个批次测试3次,其相对极差(R)应不大于10%。 2.7 准确度 与已上市产品进行对比试验,在[20,1000] mg/dL的范围内,线性相关系数r≥0.975。测试浓度在[20,300] mg/dL 时,绝对偏差应不超过±30 mg/dL;测试浓度在(300,1000] mg/dL 时,相对偏差应不超过±10%。 2.8 质控品赋值有效性 测试结果在质控范围内。 2.9 校准品/质控品瓶内重复性 校准品/质控品瓶内重复性(CV)应不大于6%。
采购产品技术要求和验收标准 1.0 元器件入库前检验 1.1 严格执行采购控制程序,从合格的供方采购合格产品。 1.2 对进厂的采购产品都要按下面的检验项目、方法和标准进行 检验,。对安全件,至少应抽取10%的样品按表中的检验项目进行检验和试验:对关键元器件,至少应抽取5%的样品进行检验:对一般材料,只须进行确认。 检验/验证项目、方法和标准: 1.2.1 断路器: 依据标准:GB14048.2《低压断路器》 1.2.2 隔离开关、熔断器: 依据标准:GB14048.3《低压开关、隔离器、隔离开关及熔断器组合电器》
1.2.3 接触器: 依据标准:GB14048.6《接触器和电动机起动器》 1.2.4电流互感器: 依据标准:GB1208《电流互感器》 依据标准:GB14048.5《控制电路电器和开关元件》
检验/验证项目、方法和标准: 1.2.6母线: 依据标准:GB5585《电工用铜、铝及其合金母线》检验/验证项目、方法和标准:
依据标准:GB5023《额定电压450/750V及以下聚氯乙烯绝缘电缆》检验/验证项目、方法和标准: 1.2.8绝缘支撑件、母线框、母线夹板 依据标准:GB1408《固体绝缘材料工频电气强度试验方法》 检验/验证项目、方法和标准:
1.3凡符合1.2条的初步判定为合格品,如有一项不符即为不合格品,并 填 写入库前的检验记录。出现不合格则全检,合格放行,不合格退货。 1.4 如在出厂检验中出现机械或性能或电性能的缺陷时,最终判定为不合 格产 品,在出厂检验中作记录。 2.0 外协件入库前检验 2.1 外协的各种零部件必须按图纸检验相关尺寸及外观。 2.2 各种型号的低压柜柜体,到厂后都必须按图纸检验外型尺寸、漆的表面、 门的开启、接地螺栓的焊接、防护等级等,合格后方可入库。 3.0 生产过程中的自检 3.1 操作者在生产工程中应严格执行工艺文件,不得擅自更改或降低工艺标准,也不得随意执行未经批准而制定的其他标准。 3.2 在每个工序完成后,转入下道工序前,操作人应进行自检,确认该工序 合格后,在产品随工卡上加盖自己的工序章,并向检验员口头报验,检验员检验 合格,在随工卡盖章后,方可转入下道工序。 3.3 若检验人员检验后,判定某一项不合格,应进行返工,返工后必须重新检验,直到判定合格为止,加盖检验章,方可转入下道工序 4.0 对不合格品的处理方法 4.1 对采购产品和外协件初步判定为不合格品的,由检验员将检验结果(缺 陷描述)等,填写在采购产品进厂检验单中,做出标识,另行存放,按不合格品 控制程序执行。 4.2 过程产品发生不合格时,由检验员通知操作工返修,并在随工卡上作记 录,返工返修的产品重新报验合格为止,若产品确定为不合格,则应作好标识, 另行存放,按不合格品控制程序执行。 4.3 过程产品发生不合格时,由检验员将检验结果,填写在成品检验记录中, 按不合格品控制程序执行。
双缩脲法测定蛋白质含量 实验二十蛋白质含量测定-—双缩脲法测定蛋白质含量一、实验目的 学习和掌握用双缩脲法测定蛋白质含量的原理和方法。 二、实验原理 在碱性溶液中,双缩脲(H2N—CO-NH-CO—NH2)与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。凡分子中含二个或二个以上酰胺基(-CO—NH2),或与此相似的基团[如—CH2—NH2,—CS—NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。蛋白质分子含有众多肽键(-CO—NH—),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。测定范围为1~10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。...文档交流仅供参考... 此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。...文档交流仅供参考... 三、实验试剂和器材 [试剂] 1.双缩脲试剂: 取CuSO4·5H20(c。P。)1.5g和酒石酸钾钠(c.P.)6.0g以少量蒸馏水溶解,再加2.5m ol/L NaOH溶液300ml,KI 1。0g,然后加水至1000ml.棕色瓶中避光保存。长期放置后若有暗红色沉淀
出现,即不能使用。...文档交流仅供参考... 2。标准蛋白质溶液: 用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10g/L的标准蛋白溶液,可用BSA浓度1g/L的A280为0。66来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0。05mol/L NaOH配制. ...文档交流仅供参考... [器材] 1.试管:15×150mm试管7只; 2.1ml,5ml移液管; 3.坐标纸; 4.721分光光度计。 四、实验操作 取试管7支,编号,按下表操作: 试剂(m l)\管号空白 管 12345测定 管 蛋白 标准 液(1 0g/ L) —0。10.20.30.40.5–
医疗器械产品技术要求编号: 葡萄糖检测试剂盒(电极法) 1.产品型号/规格及其划分说明 序号规格 1500ml 22×2000ml 2.性能指标 2.1外观 试剂R溶液黄色、无颗粒、无杂质。 2.2净含量 试剂盒各试剂装量应不小于标示值。 2.3分析灵敏度 灵敏度(检测限)应≤3.31mmol/L。 2.4线性范围 在(0~20)mmol/L范围内,其线性相关系数r≥0.990;浓度≥5.0mmol/L时,相对偏差≤20%;浓度<5.0mmol/L时,绝对偏差≤1.0mmol/L。 2.5测量精密度 2.5.1重复性 用控制血清重复测试所得结果的重复性(变异系数,CV)应≤6.0%。 2.5.2批间差 批间差应≤10.0%。 2.6准确度 用参考物质进行测试,其相对偏差应≤10.0%。 3.检验方法 仪器基本要求 a)恒温装置温度:37℃±1℃。 b)全自动生化分析仪。
测试方法按说明书规定,因不同机型使用试剂最终浓度相同。在此推荐以本公司BECKMAN全自动生化分析仪进行测试。 3.1外观和性状 目测检查,试剂R溶液性状应符合2.1的要求。 3.2净含量 用通用量具进行测量,应符合2.2的要求。 3.3分析灵敏度 用蒸馏水作为空白,测定20次,计算空白平均值和SD,按式(1)计算,结果应符合2.3的规定。 检测低限(LLD)=空白的平均值+2SD (1) 注:参照冯仁丰《临床检验质量管理技术基础》58页分析灵敏度(检测限)的操作。 3.4线性范围 用接近线性范围上限高浓度(活性)的样品和接近线性范围下限低浓度(活性)的样品,混合成5个稀释浓度(xi)。分别测试试剂(盒),每个稀释浓度测试3次,分别求出检测结果的均值(yi)。以稀释浓度(xi)为自变量,以测定结果均值(yi)为因变量求出线性回归方程。计算线性回归的相关系数(r)。稀释浓度(xi)代入线性回归方程,计算yi的估计值及yi与估计值的相对偏差或绝对偏差,应符合2.4的要求。 3.5测量精密度 3.5.1重复性 在重复性条件下,用控制物质测试试剂(盒),重复测试至少10次(n≥10),分别计算测量值的平均值(x)和标准差(s),按公式(2)计算变异系数(CV),应符合2.5.1的要求。 =x CV (2) S /? 100 % 式中: CV--变异系数; S--标准差; x--测量值的平均值。 3.5.2批间差
保健食品产品技术要求规范(国食药监许[2010]423号) 发布日期:2011-02-10 来源:国家食品药品监督管理局 【发布单位】国家食品药品监督管理局 【发布文号】国食药监许[2010]423号 【发布日期】 2010-10-22 【生效日期】 2011-02-01 【效力】 【备注】各省、自治区、直辖市食品药品监督管理局(药品监督管理局):根据《食品安全法》及其实施条例对保健食品实行严格监管的要求,为进一步规范保健食品行政许可工作,提高保健食品质量安全控制水平,加强保健食品生产经营监督,指导保健食品产品技术要求编制工作,国家食品药品监督管理局组织制定了《保健食品产品技术要求规范》,现予印发,请遵照执行。国家食品药品监督管理局二○一○年十月二十二日 保健食品产品技术要求规范 一、根据《食品安全法》及其实施条例对保健食品实行严格监管的要求,为进一步规范保健食品行政许可工作,提高保健食品质量安全控制水平,加强保健食品生产经营监督,保障消费者食用安全,制定本规范。 二、国家食品药品监督管理局负责批准保健食品产品技术要求,并监督其执行。 三、保健食品产品技术要求应当符合国家有关法律法规、标准规范。 四、保健食品产品技术要求文本格式应当包括产品名称、配方、生产工艺、感官要求、鉴别、理化指标、微生物指标、功效或标志性成分含量测定、保健功能、适宜人群、不适宜人群、食用量及食用方法、规格、贮藏、保质期等序列(见附件1),并按照保健食品产品技术要求编制指南(见附件2)编制。 五、保健食品产品技术要求是产品质量安全的技术保障。生产企业应当按照保健食品产品技术要求组织生产经营,食品药品监督管理部门应当将保健食品产品技术要求作为开展监督执法的重要依据。 六、保健食品产品技术要求适用于保健食品新产品的注册申请和产品的再注册。
实验二十蛋白质含量测定——双缩脲法测定蛋白质含量一、实验目的 学习和掌握用双缩脲法测定蛋白质含量的原理和方法。 二、实验原理 在碱性溶液中,双缩脲(H2N-CO-NH-CO-NH2) 与二价铜离子作用形成紫红色的络合物,这一反应称双缩脲反应。凡分子中含二个或二个以上酰胺基(—CO-NH2) ,或与此相似的基团[如—CH2-NH2 ,—CS-NH2,—C(NH)NH2]的任何化合物,无论这类基团直接相连还是通过一个碳或氮原子间接相连,均可发生上述反应。蛋白质分子含有众多肽键(—CO-NH —),可发生双缩脲反应,且呈色强度在一定浓度范围内与肽键数量即与蛋白质含量成正比,可用比色法测定蛋白含量。测定范围为1?10mg蛋白质。干扰这一测定 的物质主要有:硫酸铵、Tris 缓冲液和某些氨基酸等。 此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于快速,但并不需要十分精确的蛋白质测定。 三、实验试剂和器材 [试剂] 1 ?双缩脲试剂:取CuSO4 ?5H20.)和酒石酸钾钠.)以少量蒸馏水溶解,再加/ L NaOH 溶液300ml, KI ,然后加水至1000ml。棕色瓶中避光保存。长期放置后若有暗红色沉淀出现,即不能使用。 2. 标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成 10g/L 的标准蛋白溶液,可用BSA 浓度1g/L 的A280 为来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O或%NaCl配制,酪蛋白用L NaOH配 制。 [器材] 1. 试管:15X 150mm试管7只; 2. 1ml,5ml 移液管; 3. 坐标纸;
铁测定试剂盒(亚铁嗪法) 适用范围:用于体外定量测定人血清中铁的浓度。1.1规格 试剂1: 1×30mL,试剂2: 1×10mL; 试剂1: 2×60mL,试剂2: 2×20mL; 试剂1: 1×50mL,试剂2: 1×10mL; 试剂1: 1×40mL,试剂2: 1×10mL; 试剂1: 2×40mL,试剂2: 1×20mL; 试剂1: 2×40mL,试剂2: 2×10mL; 试剂1:3×28mL,试剂2:3×7mL; 试剂1:1×4L,试剂2:1×1L; 试剂1:2×4L,试剂2:1×2L。 1.2主要组成成分 试剂1主要组分: 试剂2主要组分: 2.1 净含量
应不低于试剂瓶标示装量。 2.2 外观 试剂1应为无色或浅色澄清液体,试剂2应为浅色或橙色澄清液体。外包装完好、无破损,标签完好、字迹清晰。 2.3 试剂空白 在600nm处测定试剂空白吸光度,应≤1.5; 2.4 分析灵敏度 测试25μmol/L的被测物时,吸光度变化(ΔA)应不低于0.005. 2.5 准确度 用参考物质(GBW09152)对试剂(盒)进行测试,相对偏差不超过±5%。 2.6 重复性 批内变异系数(CV)应不超过5%。 2.7 线性 2.7.1在[1,100]μmol/L 区间内,线性相关系数r应不低于0.990; 2.7.2[1,8)μmol/L区间内绝对偏差不超过±0.64μmol/L;[8,100]μmol/L区间内相对偏差不超过±8%。 2.8 批间差 对同一份样品进行重复测定,相对极差≤6%。 2.9 稳定性 取在2℃~8℃条件下贮存达到12个月后的试剂进行检测,应符合本标准2.2、2.3、2.4、2.5、2.6、2.7之规定。
附件5 医疗软件产品技术审评规范(2017版) 本规范旨在指导企业提交医疗器械软件注册申报资料,同时规范医疗器械软件的技术审评要求。 本规范是对医疗器械软件的一般性要求,企业应根据医疗器械软件的特性提交注册申报资料,判断指导原则中的具体内容是否适用,不适用内容详述理由。企业也可采用其他满足法规要求的替代方法,但应提供详尽的研究资料和验证资料。 本规范是在现行法规和标准体系以及当前认知水平下、并参考了国外法规与指南、国际标准与技术报告制定的。随着法规和标准的不断完善,以及认知水平和技术能力的不断提高,相关内容也将适时进行修订。 本规范是对企业和审查人员的指导性文件,不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本规范。 本规范针对软件的特殊性,在现行法规要求下进一步明确了对医疗器械软件的要求,特别是对软件更新、软件版本的要求。本规范是医疗器械软件的通用规范,其他涉及软件医疗器械产品的规范可在本规范基础上进行有针对性的调整、修改和完善。 一、适用范围 本规范适用于第二类医疗器械软件的注册申报,适用的软件开发方式包括自主开发、部分采用现成软件和全部采用现成
软件。 医疗器械软件包括独立软件和软件组件。独立软件:作为医疗器械或其附件的软件;软件组件:作为医疗器械或其部件、附件组成的软件。 独立软件应同时具备以下三个特征:具有一个或多个医疗用途,无需医疗器械硬件即可完成预期用途,运行于通用计算平台。独立软件包括通用型软件和专用型软件,其中通用型软件基于通用数据接口与多个医疗器械产品联合使用,如PACS、中央监护软件等;而专用型软件基于通用、专用的数据接口与特定医疗器械产品联合使用,如Holter数据分析软件、眼科显微镜图像处理软件等。 软件组件应同时具备以下两个特征:具有一个或多个医疗用途,控制(驱动)医疗器械硬件或运行于专用(医用)计算平台。软件组件包括嵌入式软件和控制型软件,其中嵌入式软件(即固件)运行于专用(医用)计算平台,控制(驱动)医疗器械硬件,如心电图机所含软件、脑电图机所含软件等;而控制型软件运行于通用计算平台,控制(驱动)医疗器械硬件。 软件组件也可兼具处理功能。专用型独立软件可单独注册,也可随医疗器械产品注册,此时视为软件组件。 二、技术审查要点 (一)产品名称和结构组成的要求 1.独立软件 产品名称应为通用名称,并符合相关法规、规范性文件的要求,可以结合人体部位(如胸部、心脏等)、临床科室(如骨科、神经外科等)、处理对象(如CT图像、MRI图像、心电数
总蛋白(TP)测定试剂盒(双缩脲法) 适用范围:该试剂盒用于体外定量测定人血清中总蛋白的浓度。 1.1 产品规格 1.2 组成成分 该试剂盒由试剂1(R1)和校准品(选配)组成。 1.2.1试剂组成 试剂1: 硫酸铜≥6.0mmol/L 酒石酸钾钠≥50.0mmol/L 碘化钾≥15.0mmol/L
NaOH ≥100.0mmol/L 1.2.2 校准品组成 总蛋白目标浓度:60.0g/L 该校准品为水基质液体校准品 2.1 外观 a) R1应为蓝色溶液,无混浊,无未溶解物。 b) 校准品应为无色至暗黄色溶液,无混浊,无未溶解物。 2.2 净含量 液体组分不少于标示值。 2.3 试剂空白 2.3.1试剂空白吸光度 应不大于0.200。 2.4 分析灵敏度 TP试剂盒测定浓度50.0g/L的被测物时,吸光度差值(ΔA)应不小于0.150。 2.5 准确度 测试参考物质,相对偏差应不超过±10%。 2.6 精密度 2.6.1重复性 变异系数应不大于5%。 2.6.2批间差 批间相对极差(R)应不大于10%。
2.7 线性 在(0,120.0]g/L范围内,TP试剂盒的线性相关系数r应不低于0.9900;在(0,40.0]范围内绝对偏差应不超过4.0g/L,在(40.0,120.0]范围内相对偏差应不超过±10%。 2.8校准品溯源性 依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品控制物质赋值的计量学溯源性》及有关规定提供总蛋白校准品的来源、赋值过程以及测量不确定度等内容。校准品溯源至国家标准物质GBW09815。 2.9稳定性 原包装的TP试剂盒在2℃~8℃避光保存,有效期为24个月。试剂在规定的条件下保存到有效期末,产品的性能应符合2.3、2.4、2.5、2.6.1和2.7的要求。
医疗器械产品技术要求编号: XXXXXX 1产品型号/规格及其划分说明 1.1型号命名 P200 设计序号 产品代号 1.2结构组成(不同型号如有结构组成的差异,应分型号列明) XXXXXX(以下简称XX)主要由X射线管组件(组合式)、限束器、操作台、影像处 理系统、C形臂及可移动机架、医用X射线影像增强器组成。 1.3型号说明(如有多个型号此条适用,列表标明型号间差异) 表1型号说明 1.4工作条件 a)环境温度:10℃~40℃; b)相对湿度:30%~75%; c)大气压力:700hPa~1060hPa。 d)电源:AC220V±22V;50Hz±1Hz e)额定输入功率:xx VA。 2性能指标 2.1外观 2.2XXX ...... 2.X安全要求 XXX安全要求应符合GB9706.1-2007的要求,产品主要特征见附录C。(9706.1适用设备) XXX安全要求应符合GB4793.1-2007的要求,产品主要特征见附录C。(4793.1适用设备)
间(h )间(h ) 条件 中间 24 试验后通电 ※ 2.x 、2.x 、... - 2.x 、2.x 、... 72 试验后通电 ※ 2.X 电磁兼容 (9706.1适用设备) 电磁兼容应符合YY 0505-2012 的要求。 2.X 电磁兼容 (479 3.1适用设备) 电磁兼容应符合GB/T 18268.1-2010 的要求。 2.X 电磁兼容 (体外诊断类适用设备) 电磁兼容应符合GB/T 18268.1-2010及 GB/T 18268.26-2010 的要求。 2.X 环境试验 按 GB/T 14710-2009 中规定的气候环境Ⅱ组、机械环境Ⅱ组的要求及表 X 进行试验, 应符合要求。 表 X 试验要求及检验项目 试验要求 检测项目 电源电压(V ) 试验项目 持续时 恢复时 试验 通电 状态 初始检测 检测 最后 检测 额定值 额定值 -10% +10% 额定工作 低温试验 2 --- 试验时通电 ※ 全性能 - 2.x 、2.x 、... √ --- 低温贮 存试验 4 --- - AC220 额定工作 高温试验 2 --- 试验时通电 ※ --- 2.x 、2.x 、... --- √ 运行试验 4 --- 试验时通电 ※ --- 2.x 、2.x 、... --- √ 高温贮 存试验 4 4 试验后通电 ※ --- 2.x 、2.x 、... AC220 额定工作 湿热试验 4 --- 试验时通电 ※ --- AC220 湿热贮存 试验 48 --- 2.x 、2.x 、... AC220 振动试验 碰撞试验 运输试验 --- --- --- 试验后通电 ※ 试验后通电 ※ 试验后通电 ※ --- --- --- --- --- --- 2.x 、2.x 、... 2.x 、2.x 、... 2.x 、2.x 、... AC220 AC220 AC220 注:表中“※ ”按GB/T14710-2009的规定 3 检验方法 3.1 外观 用正常或矫正视力观察以及用手感检查,结果应符合2.1的要求。 1
一)实验原理 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。 紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1~10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、Tris 缓冲液和某些氨基酸等。 此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。 (二)试剂与器材 1.试剂: (1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10mg/ml 的标准蛋白溶液,可用BSA浓度1mg/ml的A280为0.66来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05N NaOH配制。 (2)双缩脲试剂:称以1.50克硫酸铜(CuSO4?5H2O)和6.0克酒石酸钾钠(KNaC4H4O6?4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。此试剂可长期保存。若贮存瓶中有黑色沉淀出现,则需要重新配制。 2.器材: 可见光分光光度计、大试管15支、旋涡混合器等。 (三)操作方法 1.标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0毫升的标准蛋白质溶液,用水补足到1毫升,然后加入4毫升双缩脲试剂。充分摇匀后,在室温(20~25℃)下放置30分钟,于540nm处进行比色测定。用未加蛋白质溶液的第一支试管作为空白对照液。取两组测定的平均值,以蛋白质的含量为横座标,光吸收值为纵座标绘制标准曲线。 2、样品的测定:取2~3个试管,用上述同样的方法,测定未知样品的蛋白质浓度。注意样品浓度不要超过10mg/ml。 三、Folin—酚试剂法(Lowry法) (一)实验原理
葡萄糖测定试剂盒(葡萄糖氧化酶法) 适用范围:本试剂盒用于体外定量测定人血清中葡萄糖的含量。 1.1 产品型号/规格 1.2. 产品组成 葡萄糖氧化酶15KU/L,过氧化物酶1.5KU/L,变旋酶2.0KU/L,苯酚0.75mmol/L,4-氨基安替比林0.25mmol/L。 2.1 外观 试剂为无色或略带红色透明溶液;试剂盒各组分齐全、完整,液体无渗漏,包装标签文字符号清晰牢固不易脱落,外包装完整无破损。 2.2 装量 液体试剂的净含量应不少于标示值。 2.3 试剂空白吸光度 在500nm波长、1cm光径条件下,试剂空白吸光度应不大于0.10。 2.4 分析灵敏度 测定10.2mmol/L葡萄糖时,吸光度的变化在0.408±0.1001范围内。 2.5准确度 测定标准品,当浓度≤4.16mmol/L,实测值与标示值偏差应不超过± 0.833mmol/L;当浓度>4.16mmol/L时,实测值与标示值的偏差应在±10%范围内。 2.6 精密度
2.6.1 重复性 用血清样品或质控样品重复测试所得的变异系数(CV)应不大于2.0%。 2.6.2 批间差 试剂(盒)批间相对极差应不大于3.0%。 2.7 线性区间 测试血清样本,试剂线性在[0.1,27.8] mmol/L区间内: a) 线性相关系数|r|应不小于0.990; b) [0.1,3.0] mmol/L区间内,线性绝对偏差应不超过±0.3mmol/L;(3.0, 27.8] mmol/L区间内,线性相对偏差应不超过±10%。 2.8稳定性 原包装试剂2~8℃避光保存有效期18个月,到效期末的样品检测,检测结果应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
关于印发化妆品产品技术要求规范的通知 国食药监许[2010]454 号 2010 年11 月26 日发 布各省、自治区、直辖市食品药品监督管理局(药品监督管理局): 为进一步规范化妆品行政许可工作,提高化妆品卫生质量安全控制水平,加强化妆品生产经营卫生监督,指导化妆品 产品技术要求编制工作,国家食品药品监督管理局组织制定了《化妆品产品技术要求规范》,现予印发,请遵照执行。 附件:1.国家食品药品监督管理局化妆品产品技术要求(文本格式) 2.化妆品产品技术要求编制指南 国家食品药品监督管理局 二0一0年十一月二十六日 化妆品产品技术要求规范 一、根据《化妆品卫生监督条例》,为进一步规范化妆品行政许可工作,提高化妆品卫生质量安全控制水平,加强化妆品生产经营卫生监督,保障消费者使用安全,制定本规范。
二、国家食品药品监督管理局负责批准化妆品产品技术要求,并监督其执行。 三、化妆品产品技术要求应当符合国家有关法律法规、标准规范。 四、化妆品产品技术要求应符合其文本格式的规定。文本格式应当包括产品名称、配方成分、生产工艺、感官指标、卫生化学指标、微生物指标、检验方法、使用说明、贮存条件、保质期等序列(见附件1),并按照《化妆品产品技术要 求编制指南》(见附件2 )编制。 五、化妆品产品技术要求是产品卫生质量安全的技术保障。生产企业应当按照化妆品产品技术要求组织生产经营,食品药品监督管理部门应当将化妆品产品技术要求作为开展卫生监督执法的重要依据。 六、化妆品产品技术要求适用于化妆品新产品的许可和产品延续。 七、化妆品产品技术要求编号。国产特殊用途化妆品按照HZ+GT+ 年份+0000 编制;进口特殊用途化妆品按照HZ+JT +年份+0000编制;进口非特殊用途化妆品按照HZ+JF+年份+0000编制。"HZ"表示"化妆品”,"GT"表示"国产特殊用途”, "JT"表示"进口特殊用途”,”JF"表示"进口非特殊用途”,"年份+0000"为化妆品批准文号(或备案号)的年份和顺序号。 八、本规范自2011 年4 月1 日起施行。 附件1 国家食品药品监督管理局 化妆品产品技术要求(文本格式) 产品技术要求编号)
保健食品产品技术要求规范 一、根据《食品安全法》及其实施条例对保健食品实行严格监管的要求,为进一步规范保健食品行政许可工作,提高保健食品质量安全控制水平,加强保健食品生产经营监督,保障消费者食用安全,制定本规范。 二、国家食品药品监督管理局负责批准保健食品产品技术要求,并监督其执行。 三、保健食品产品技术要求应当符合国家有关法律法规、标准规范。 四、保健食品产品技术要求文本格式应当包括产品名称、配方、生产工艺、感官要求、鉴别、理化指标、微生物指标、功效或标志性成分含量测定、保健功能、适宜人群、不适宜人群、食用量及食用方法、规格、贮藏、保质期等序列(见附件1),并按照保健食品产品技术要求编制指南(见附件2)编制。 五、保健食品产品技术要求是产品质量安全的技术保障。生产企业应当按照保健食品产品技术要求组织生产经营,食品药品监督管理部门应当将保健食品产品技术要求作为开展监督执法的重要依据。
六、保健食品产品技术要求适用于保健食品新产品的注册申请和产品的再注册。 七、保健食品产品技术要求编号按照BJ+G(或J)+年份+0000编制。“BJ”表示“保健食品”,“G(或J)”表示国产或进口,“年份+0000”为保健食品批准文号的年份和顺序号。 八、本规范自2011年2月1日起施行。 附件:1.国家食品药品监督管理局保健食品产品技术要求(文本格式) 2.保健食品产品技术要求编制指南
附件1: 国家食品药品监督管理局 保健食品产品技术要求(文本格式)(产品技术要求编号) 中文名称 汉语拼音名 【配方】 【生产工艺】 【感官要求】 【鉴别】 【理化指标】 【微生物指标】 【功效或标志性成分含量测定】 【保健功能】 【适宜人群】 【不适宜人群】 【食用量及食用方法】 【规格】 【贮藏】 【保质期】 ─────────────────────────────
双缩脲法蛋白质含量检测试剂盒说明书微量法 注意:正式测定前务必取2-3个预期差异较大的样本做预测定。 货号:BC3185 规格:100T/96S 产品简介: 样品可溶性蛋白质含量常常用于酶活性计算。此外,可溶性蛋白质含量也用于食品等质量分析。 强碱性溶液中,双缩脲与CuSO 形成紫色络合物;紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋 4 白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。该方法测定范围为1~10mg蛋白质,适用于蛋白质浓度高的样品,尤其是动物材料。 自备仪器和用品: 可见分光光度计/酶标仪、移液器、微量玻璃比色皿/96孔板和蒸馏水。 试剂组成和配制: 试剂一:液体20mL×1瓶,4℃保存。 标准品:液体1mL×1支,5mg/mL,-20℃保存。 样品中可溶性蛋白质提取: 1.液体样品:澄清无色液体样品可以直接测定。 2.组织样品:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL 提取液(自备,根据需要选用酶提取缓冲液或者蒸馏水或者生理盐水))冰浴匀浆,10000rpm,4℃离心10min,取上清,即待测液。(动物样品常常需要稀释) 3.细菌、真菌:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入
1mL提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000rpm,4℃,离心10min,取上清置于冰上待测。 测定步骤: 1.分光光度计/酶标仪预热30min以上,调节波长到540nm,蒸馏水调零。 2.空白管:取0.5mLEP管,加入40μL蒸馏水,200μL试剂一,混匀后室温静置15min,取200μL于 微量玻璃比色皿/96孔板,540nm比色,记为A1空白管。 3.标准管:取0.5mLEP管,加入40μL标准液,200μL试剂一,混匀后室温静置15min,取200μL于 微量玻璃比色皿/96孔板,540nm比色,记为A2标准管。 4.测定管:取0.5mLEP管,加入40μL待测液,200μL试剂一,混匀后室温静置15min,取200μL于 微量玻璃比色皿/96孔板,540nm比色,记为A3测定管。 样品中蛋白质浓度计算: 1、按液体体积计算: 蛋白质(mg/mL)=C标准管÷(A标准管-A空白管)×(A测定管-A空白管) =5÷(A标准管-A空白管)×(A测定管-A空白管) 2、按样本鲜重计算: 蛋白质(mg/g鲜重)=C标准管÷(A标准管-A空白管)×(A测定管-A空白管)×V样总÷W =5÷(A标准管-A空白管)×(A测定管-A空白管)÷W 3、按细胞数量计算: 蛋白质(mg/104cell)=C标准管÷(A标准管-A空白管)×(A测定管-A空白管)×V样总÷500 =0.01÷(A标准管-A空白管)×(A测定管-A空白管)
总胆红素测定试剂盒(重氮盐法) 适用范围:用于体外定量测定人血清中总胆红素的含量。 1.1 包装规格 a) 试剂1:1×20mL 试剂2:1×5mL b) 试剂1:2×40mL 试剂2:1×20mL c) 试剂1:4×60mL 试剂2:2×30mL d) 试剂1:2×80mL 试剂2:2×20mL 1.2 主要组成成分 1.2.1试剂1主要组分 三羟甲基氨基甲烷缓冲液100 mmol/L 氨基磺酸30 mmol/L 二甲基亚砜10 mmol/L 表面活性剂及稳定剂适量 1.2.2试剂2主要组分 三羟甲基氨基甲烷缓冲液100 mmol/L 亚硝酸钠60 mmol/L 表面活性剂及稳定剂适量 2.1 外观 试剂1应为无色透明液体,试剂2应为无色或淡黄色透明液体。 2.2 试剂装量 应不低于试剂瓶标示装量。
2.3 试剂空白吸光度 在546nm处测定试剂空白吸光度,应≤0.5。 2.4 分析灵敏度 测定TBIL含量为100 μmol/L样本时,其△A应≥0.01。 2.5 线性范围 2.5.1在(0,500)μmol/L范围内,线性回归的确定系数应不低于0.990; 2.5.2测试浓度在(0,50] μmol/L范围内,线性绝对偏差应不超过±5 μmol/L; 测试浓度在(50,500)μmol/L范围内,线性相对偏差应不超过±10%。 2.6 测量精密度 2.6.1重复性:用两个水平质控血清重复测试其变异系数(CV)应不超过5%。 2.6.2批间差:抽取3个不同批号试剂,对同一份样本进行重复测定,相对极差≤10%。 2.7 准确度 在样本中加入一定量的纯品,计算回收率,应在85%~115% 范围内。 2.8 稳定性 取在2℃~8℃条件下贮存达到12个月的试剂进行检测,应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
关于印发化妆品产品技术要求规X的通知 国食药监许[2010]454号 各省、自治区、直辖市食品药品监督管理局(药品监督管理局): 为进一步规X化妆品行政许可工作,提高化妆品卫生质量安全控制水平,加强化妆品生产经营卫生监督,指导化妆品产品技术要求编制工作,国家食品药品监督管理局组织制定了《化妆品产品技术要求规X》,现予印发,请遵照执行。 附件:1.国家食品药品监督管理局化妆品产品技术要求(文本格式)2.化妆品产品技术要求编制指南 国家食品药品监督管理局二○一○年十一月二十六日 化妆品产品技术要求规X 一、根据《化妆品卫生监督条例》,为进一步规X化妆品行政许可工作,提高化妆品卫生质量
安全控制水平,加强化妆品生产经营卫生监督,保障消费者使用安全,制定本规X。 二、国家食品药品监督管理局负责批准化妆品产品技术要求,并监督其执行。 三、化妆品产品技术要求应当符合国家有关法律法规、标准规X。 四、化妆品产品技术要求应符合其文本格式的规定。文本格式应当包括产品名称、配方成分、生产工艺、感官指标、卫生化学指标、微生物指标、检验方法、使用说明、贮存条件、保质期等序列(见附件1),并按照《化妆品产品技术要求编制指南》(见附件2)编制。 五、化妆品产品技术要求是产品卫生质量安全的技术保障。生产企业应当按照化妆品产品技术要求组织生产经营,食品药品监督管理部门应当将化妆品产品技术要求作为开展卫生监督执法的重要依据。 六、化妆品产品技术要求适用于化妆品新产品的许可和产品延续。 七、化妆品产品技术要求编号。国产特殊用途化妆品按照HZ+GT+年份+0000编制;进口特殊用途化妆品按照HZ+JT+年份+0000编制;进口非特殊用途化妆品按照HZ+JF+年份+0000编制。"HZ"表示"化妆品","GT"表示"国产特殊用途","JT"表示"进口特殊用途","JF"表示"进口非特殊用途","年份+0000"为化妆品批准文号(或备案号)的年份和顺序号。 八、本规X自2011年4月1日起施行。 附件1 国家食品药品监督管理局化妆品产品技术要求(文本格式)(产品技术要求编号)_______
医疗器械产品技术要求编号: XXXX检测试剂盒(xxx法) 1产品型号/规格及其划分说明 1.1产品规格 卡型:1人份/盒、5人份/盒、25人份/盒、50人份/盒。 1.2主要组成成分 1.3划分说明 本产品用于体外定性检测人全血/血清/血浆样本中×××,临床上主要用于××××的辅助诊断。本产品采用单人份铝箔袋密封包装,以不同的单人份装盒量来划分产品规格。2性能指标 2.1物理检查 2.1.1外观检查 外观应平整,标识应清晰,各组份应牢固附着,内容应齐全,液体无渗漏。 2.1.2液体移行速度 液体移行速度应不低于10mm/min。 2.1.3膜条宽度 膜条宽度应不小于2.5mm。 2.2阴性参考品符合率 采用国家阴性参考品或经标化的企业阴性参考品进行检测。阴性参考品符合率应为10/10。 2.3阳性参考品符合率
采用国家阳性参考品或经标化的企业阳性参考品进行检测。阳性参考品符合率应为10/10。 2.4最低检测限 采用国家最低检测限参考品或经标化的企业最低检测限参考品进行检测。DL1、DL2应均为阳性,DL3为阴性。 2.5重复性 采用国家重复性参考品或经标化的企业重复性参考品进行检测,平行检测10次,C1结果应均为阳性,且显色度均一,C2结果应均为阳性,且显色度均一。 2.6批间差 采用不同生产批号试剂对同一重复性参考品各重复检测10次,C1结果应均为阳性,且显色度均一,C2结果应均为阳性,且显色度均一。 2.7稳定性 将检测试剂在37℃的条件下放置7天,取出平衡至室温后,分别检测2.2~2.5项,检测结果应符合相应要求。 3检验方法 3.1物理检查 3.1.1外观检查: 取本产品1人份,在自然光下目视检查,结果应符合2.1.1要求。 3.1.2液体移行速度: 取本产品2人份,按说明书操作,加2滴稀释液至加样孔,以秒表计时,计算液体移行速度,结果应符合2.1.2的要求。 计算公式:v=l/t 式中: v—液体移行速度; l—加样孔中间位置至观察窗口上沿之间的距离; t—以滴加稀释液于加样孔时开始计时,沿反应膜移行至观察窗口上沿所需的时间。 3.1.3膜条宽度 取本产品3人份,使用游标卡尺检测,取检测结果的平均值,结果应符合2.1.3的要求。 3.2阴性参考品符合率