51批奥美拉唑肠溶胶囊含量均匀度的评价与研究
- 格式:doc
- 大小:191.50 KB
- 文档页数:6

医药界 2020年02月第03期—50—医药与临床奥美拉唑肠溶胶囊新工艺研究张胜军1 苏跃林1 梁胜群1 叶家强1 利春凤1 罗 习2(1.桂林华信制药有限公司,广西 桂林 541299 2.桂林四维科技有限公司,广西 桂林 541001)【摘要】目的:公司现有奥美拉唑肠溶胶囊生产为购买奥美拉唑微丸后进行胶囊填充。
品种质量完全依赖于微丸厂家的工艺稳定性及质量控制,质量可控性较低。
其临床疗效达不到阿利斯康的国际先进水平,故需对现有奥美拉唑肠溶胶囊生产技术进行创新和改进。
本文介绍了奥美拉唑肠溶胶囊新工艺的关键技术、主要技术指标、技术创新点等。
【关键词】奥美拉唑;肠溶胶囊;新工艺【中图分类号】R 573 【文献标识码】A 【文章编号】2095-4808(2020)03-050-011.概述对于胃溃疡的治疗常常采用质子泵抑制剂,而奥美拉唑作为重要的质子泵抑制剂具有价格低廉、效果较好、副作用小且抑酸效果强,对于各种原因引起的胃溃疡均具有较好的效果,由于其良好的治疗效果和低廉的价格使得奥美拉唑成为了胃溃疡治疗的首选药物[1]。
奥美拉唑结构中含有磺酰基苯并咪唑化学结构,属于弱碱性化合物,亚砜基的存在使其稳定性较差,易受光照、温度、湿度等因素影响,对酸十分敏感,在酸性条件下会快速分解失去活性。
因此,奥美拉唑多制备成肠溶制剂[2]。
我公司有奥美拉唑肠溶胶囊生产批件(批准文号:国药准字H 20143204),该品种为购买奥美拉唑微丸后进行胶囊填充。
品种质量完全依赖于微丸厂家的工艺稳定性及质量控制,质量可控性较低。
其临床疗效达也不到阿利斯康的国际先进水平,故需对现有奥美拉唑肠溶胶囊生产技术进行二次创新和改进。
2.关键技术及主要技术指标目前国内外的奥美拉唑肠溶胶囊生产工艺多为挤出滚圆法制备含药丸芯、丸芯干燥后再通过底喷流化床包隔离层和肠溶衣的方法制备奥美拉唑肠溶微丸,该生产工艺存在不足:(1)以大量的甘露醇为填充剂通过挤出滚圆法制备所得到的含药微丸圆整度差,短条状的丸子较多,丸子粒径差异较大,从而导致最终肠溶包衣的均匀性较差,导致肠溶衣厚度不均、微丸耐酸力较差,微丸稳定性较差;通过增加肠溶包衣厚度的方法虽然可以提高耐酸力,但衣膜厚度不均匀,在肠道中肠溶衣的溶解速率差异大,导致药物吸收变异性增大。

建立奥美拉唑肠溶胶囊质量一致性评价方法
顾玉兰;沈琦
【期刊名称】《药学与临床研究》
【年(卷),期】2018(26)6
【摘要】目的:建立奥美拉唑肠溶胶囊质量一致性评价方法,为其仿制制剂的开发提供合理有效的技术手段.方法:采用物理特性、质量属性和体外溶出曲线评价方法,对仿制药和原研药进行对比研究.结果:仿制药和原研药质量属性一致.物理属性和体外溶出曲线区分力强,可用于\"肢解\"和\"剖析\"产品.结论:在进行一致性评价研究时,需要结合品种自身的特点,从物理特性、质量属性和体外溶出曲线等方面与原研药进行全面的、深入的对比研究,从而首先保证体外药学一致,进一步保障体内生物等效和临床安全有效.
【总页数】4页(P401-404)
【作者】顾玉兰;沈琦
【作者单位】上海交通大学药学院,上海 200030;上海微丸医药开发有限公司,上海200131;上海交通大学药学院,上海 200030
【正文语种】中文
【中图分类】R926
【相关文献】
1.基于过程能力指数的电子元器件质量一致性综合评价方法 [J], 余永涛;王小强;支越;罗宏伟;蔡志刚
2.基于质量功能屋的产品服务系统模块划分一致性检验评价方法 [J], 吴占超;李浩;密尚华
3.奥美拉唑肠溶胶囊生产质量风险评价系统的建立 [J], 徐万魁;岳青阳;潘阳
4.基于粉体学性质的流化床制粒质量一致性评价方法 [J], 赵洁; 瞿海斌; 田埂; 魏燕定
5.盐酸雷尼替丁胶囊体外溶出一致性评价方法的建立 [J], 邓回香;王西凤
因版权原因,仅展示原文概要,查看原文内容请购买。

34中国处方药 第17卷 第7期·实验研究·艾司奥美拉唑化学名称为S-5-甲氧基-2-{[(4-甲氧基-3,5-二甲基-2-吡啶基)甲基]亚磺酰基}-1H-苯并咪唑,是奥美拉唑的左旋异构体[1],分子式为C17H19N3O3S,分子量为345.416 00。
它是第一种被发现的光学异构体质子泵抑制剂,与其他质子泵抑制剂一样,埃索美拉唑通过抑制胃壁细胞的H+/K+-ATP酶来降低胃酸分泌,防止胃酸形成[2]。
在治疗胃溃疡时,效果比奥美拉唑治疗更为明显,能有效改善患者临床症状,缓解疼痛感,且不良反应发生率低[3]。
目前,关于艾司奥美拉唑的分析报道主要是对其临床使用疗效的分析。
陈刚[4]研究了艾司奥美拉唑胶囊剂和片剂具有生物等效性;刘亿托等研究了艾司奥美拉唑、左氧氟沙星、阿莫西林联合治疗幽门螺杆菌(Hp)阳性胃溃疡患者的疗效[5]。
还未见有报道考察艾司奥美拉唑肠溶胶囊在不同温度下不同时间点稳定性影响的报道。
为此,我们通过HPLC方法测定了艾司奥美拉唑肠溶胶囊的含量,发现在25℃和30℃下放置90 d、35℃和40℃下放置60 d时艾司奥美拉唑的含量,均符合标示量百分含量的要求(90.0%~110.0%),含量保持稳定。
1 材料与方法仪器和试剂Waters UPLC-TUV-QDa液质联用仪。
乙腈为色谱纯,水为纯水(Milipore),其他化学试剂均为分析纯。
艾司奥美拉唑对照品(购自深圳菲斯生物科技有限公司,>98%),艾司奥美拉唑肠溶胶囊(重庆莱美药业股份有限公司生产,批号G180522)。
色谱条件:色谱柱Waters XTerra MS C18反相柱(150 mm×4.6 mm,3.5 μm),流动相A:20 mmol/L醋酸铵缓冲液(pH 7.6),流动相B:乙腈,流速0.6 ml/min,梯度洗脱(见表1),检测波长302 nm (含量测定)和280 nm(有关物质检查),柱温35 ℃,进样体积20 μl。

一致性评价案例展示——奥美拉唑肠溶胶囊-片制剂处方根据原研产品的信息以及相关文献报道,原研产品采用的为微丸包衣膜控肠溶工艺,工艺较为复杂,对生产设备要求也比较高。
溶出曲线奥美拉唑肠溶胶囊的设计思路是使制剂在pH 值为 1.2 的介质溶出2h释放量≤5%,而在pH值为6.8 的介质中在规定的时间内释放量≥85%,考虑到溃疡患者肠道pH 值降低以及奥美拉唑在酸性条件下的不稳定性,故制备的肠溶制剂应该是在pH值为6.0 的介质中能缓慢释放药物。
肠溶制剂的释药行为与其处方、工艺密切相关。
因此,考察不同释放介质和条件下的药物释放行为对研究肠溶制剂的质量尤为重要。
文献“国产奥美拉唑肠溶胶囊与原研制剂的体外释放度比较”报道了五种国产奥美拉唑肠溶胶囊和原研制剂的溶出曲线对比,具体如下:在pH 为1.2 的氯化钠盐酸溶液中,5 个生产厂家的奥美拉唑肠溶胶囊均具有较好的耐酸性。
在纯化水中,Losec、A、C 在纯化水中释放度小于10%,释放度较小,B 和D 在纯化水中的释放度较大。
在pH 6.0 的磷酸盐缓冲液中,结果表明,在pH为6.0 的磷酸盐缓冲液中,在两种转速条件下,Losec 的释放速度最快,释放曲线最早达到平台期;其中样品A和C在60 min时的累积释放度低于5%;在100 r·min-1条件下样品B、D 在45 min时的累积释放度与Losec相近,但在50 r·min-1条件下国产制剂的累积释放度均低于Losec。
在pH 6.8 的磷酸盐缓冲液中,结果表明,在pH为6.8 的磷酸盐缓冲液中,在两种转速条件下,Losec 的释放速度最快,释放曲线最早达到平台期;在100 r·min-1条件下,样品A、C、D 在45 min时的累积释放度高于Losec,而在50 r·min-1条件下国产制剂的累积释放度均低于Losec。
部分国产奥美拉唑肠溶胶囊的体外释放行为与原研制剂相比存在一定的差异,这可能会导致制剂在体内生物利用度的差异。

复方奥美拉唑胶囊质量控制方法的研究胡晨;邓紫薇;王旭;房志仲;朱立勤【摘要】目的:建立复方奥美拉唑胶囊的质量控制方法.方法:紫外分光光度法和高效液相色谱法测定复方奥美拉唑胶囊中奥美拉唑的含量.结果:分光光度法在302 nm波长下测定奥美拉唑的吸光度,在2~17 μg/mL的浓度范围内,线性关系良好.回收率试验为100.63%,RSD为1.12%(n=9);高效液相色谱法,色谱柱:Kromasil-C18柱(200 mm×4.6 mm,5μm),流动相为甲醇-水-磷酸-三乙胺=60∶40∶0.12∶0.3,流速为0.8 mL/min,检测波长为302 nm,奥美拉唑在2~30 μg/mL的浓度范围内线性良好,回收率试验100.64%,RSD为1.1%,含量为标示量的99.36%,RSD为0.57%.结论:所建立的分析方法可用于复方奥美拉唑胶囊的质量控制.【期刊名称】《天津医科大学学报》【年(卷),期】2014(020)003【总页数】5页(P243-246,251)【关键词】奥美拉唑;复方胶囊;含量测定;质量控制【作者】胡晨;邓紫薇;王旭;房志仲;朱立勤【作者单位】天津医科大学一中心临床学院,天津300192;天津市第一中心医院药学部,天津300192;天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070;天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070;天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070;天津医科大学一中心临床学院,天津300192;天津市第一中心医院药学部,天津300192【正文语种】中文【中图分类】R927.11奥美拉唑(o meprazole,OMP)是一种H+-K+-ATP酶(质子泵)抑制剂,OMP与特异性H+-K+-ATP酶有两个结合位点,对胃酸分泌有明显抑制作用,起效迅速,适用于消化性溃疡(胃、十二指肠溃疡)、反流性食管炎和胃泌素瘤[1-2]。


HEALTH OPERATION AND MANAGEMENT卫生经营管理奥美拉唑作为处方药,能选择性地抑制胃酸分泌,在国内外运用广泛[1],近些年在儿科方面的研究更是方兴未艾[2-3]。
奥美拉唑属于质子泵抑制剂,有很强抑制胃酸分泌的作用,它能使壁细胞中的H+-K+-ATP酶的活性减低,从而阻止胃壁细胞内的氢离子,使其无法转移到胃腔中,由于氢离子的缺乏,生成的胃酸将大大减少,从而起到治疗溃疡的作用[4]。
将其制成胶囊剂型,具有成分稳定、不易被污染、生物利用度高、密封性好、可以遮盖不良气味等的特点[4]奥美拉唑肠溶胶囊除中国药典外,英美药典也有收录[5]。
2017年,在随机抽取的11个厂家生产的17批次奥美拉唑肠溶胶囊(规格:20mg)中,以中国药典2015年版该品种项下的溶出度和耐酸力作为标准,考察了该项下的溶出度和耐酸力情况,以期为患者安全用药,为临床提供优质服务提供科学依据。
1仪器与试药1.1仪器RC806型溶出试验仪;LC-2010CHT型高效液相色谱仪;FE28型pH计;BS2202S电子天平;CPA225D型分析天平;XMTD-4000数显恒温水浴锅。
1.2试药奥美拉唑对照品,乙腈,磷酸氢二钠,氯化钠,磷酸,磷酸钠、盐酸,氢氧化钠,其中,乙腈为色谱纯,其余试剂均为分析纯,水为纯化水。
待检样品(规格:20mg,为随机抽取辽宁地区上市销售的17批样品,)。
2方法采用《中国药典》2015年版二部奥美拉唑肠溶胶囊溶出度和耐酸力项下方法[6]。
2.1色谱条件色谱柱:辛烷基硅烷键合硅胶(C8柱,4.6mm×200mm, 5μm);流动相:0.01mol/L磷酸氢二钠溶液-乙腈(75:25), 0.01mol/L磷酸氢二钠溶液配制:取磷酸氢二钠约3.58g,加水1000mL使溶解,用磷酸调节pH值至7.58;DOI:10.16659/ki.1672-5654.2018.13.024对奥美拉唑肠溶胶囊溶出度和耐酸力的检验周燕1,李文韬2,杜一男21.锦州市药品检验检测中心检验一室,辽宁锦州121001;2.锦州市药品检验检测中心检验三室,辽宁锦州121001[摘要]目的考察奥美拉唑肠溶胶囊,按照中国药典2015年版该品种项下的溶出度和耐酸力检查情况。
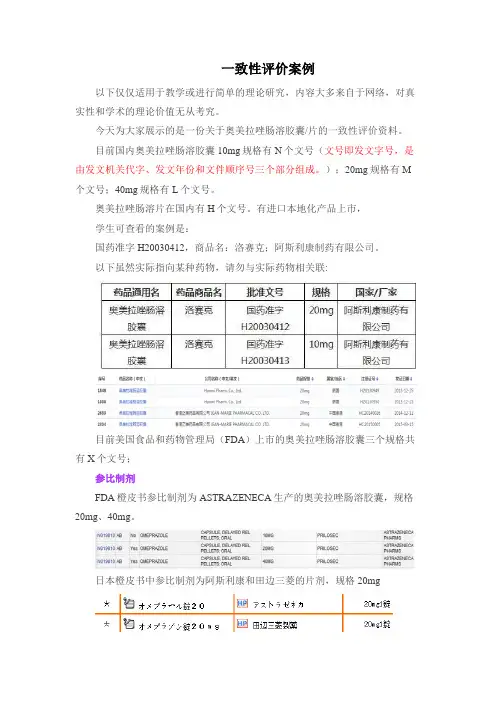
一致性评价案例以下仅仅适用于教学或进行简单的理论研究,内容大多来自于网络,对真实性和学术的理论价值无从考究。
今天为大家展示的是一份关于奥美拉唑肠溶胶囊/片的一致性评价资料。
目前国内奥美拉唑肠溶胶囊10mg规格有N个文号(文号即发文字号,是由发文机关代字、发文年份和文件顺序号三个部分组成。
);20mg规格有M 个文号;40mg规格有L个文号。
奥美拉唑肠溶片在国内有H个文号。
有进口本地化产品上市,学生可查看的案例是:国药准字H20030412,商品名:洛赛克;阿斯利康制药有限公司。
以下虽然实际指向某种药物,请勿与实际药物相关联:目前美国食品和药物管理局(FDA)上市的奥美拉唑肠溶胶囊三个规格共有X个文号;参比制剂FDA橙皮书参比制剂为ASTRAZENECA生产的奥美拉唑肠溶胶囊,规格20mg、40mg。
日本橙皮书中参比制剂为阿斯利康和田边三菱的片剂,规格20mg对原料药的药理介绍,以下为从说明书上获得的一些资料:性状:本品为白色结晶性粉末溶解度:易溶于N,N-二甲基甲酰胺中,微溶于乙醇(95%)溶液,几乎不溶于水。
解离常数(室温):pKa1(一般来说,较大的Ka值(或较少的pKa值)代表较强的酸,这是由于在同一的浓度下,离解的能力较强。
) = 4.5(针对吡啶环、采用吸光度法测定);pKa1 = 8.9(针对苯并咪唑环、采用吸光度法测定在各溶出介质中的溶解度(37℃):pH 1.2:33.0mg/mlpH 6.0:0.079mg/mlpH 6.8:0.078mg/ml水:0.091mg/ml在各溶出介质的稳定性:水:37℃条件下,2小时降解14%,6小时降解43%。
在各pH值溶出介质中:在pH1.2、pH6.0和pH6.8各溶出介质中,37℃/2小时分别降解83%、97%和8%。
光:未测定。
熔点:约150℃制剂处方根据原研产品的信息以及相关文献报道,原研产品采用的为微丸包衣膜控肠溶工艺,包衣通常味甜,但是区别于常用的胶囊的制作工艺,工艺一般比较复杂,对生产设备要求也较高。



不同厂家奥美拉唑肠溶胶囊释放曲线评价王震红;杨永刚;薛娇;王新意【摘要】Objective To evaluate the quality of omeprazole enteric-coated capsules overall by analyzing release curve. Methods Release curve of omeprazole enteric-coated capsules in 52 manufactures was determined to stud-y single batch consistency, consistency between batches and similarity of release curve. Results Single batch consistency of 32 manufactures was lack in 52 manufactures. Consistency between batches of 2 manufactures was bad in 5 manufactures. The similarity of release curve of 11 manufactures was poor in 20 manufactures of good RSD comparing with first investigative manufacture. Conclusion The release curve should be evaluated by centralized operating to promote standard work and to ensure the equivalence with first investigative manufacture.%目的通过分析奥美拉唑肠溶胶囊释放曲线,全面评价国产奥美拉唑肠溶胶囊的质量.方法测定52家生产企业的奥美拉唑肠溶胶囊的释放曲线,进行批内均一性、批间均一性及释放曲线相似性比较.结果 52家生产企业中32家批内均一性较差;5家生产企业中2家生产企业批间均一性较差;20家RSD符合要求的生产企业中,11家企业的产品与原研制剂释放曲线相似度较差.结论上市后的产品可采用集中抽验方式进行释放曲线评价,促进生产企业严格规范的生产,保证国内产品与原研产品质量的一致性和等效性.【期刊名称】《实用药物与临床》【年(卷),期】2013(016)003【总页数】3页(P237-239)【关键词】奥美拉唑肠溶胶囊;释放曲线【作者】王震红;杨永刚;薛娇;王新意【作者单位】辽宁省食品药品检验所,沈阳110023【正文语种】中文奥美拉唑是一种质子泵抑制剂,口服后在十二指肠吸收,选择性地聚集在胃壁细胞的酸性环境中,通过特异性地抑制胃壁细胞的H+-K+-ATP酶,减少胃酸分泌,促进溃疡愈合,作用持久。
中国药师2008年第11卷第3期ChinaPhaHnacist2008,V01.11No.3
奥美拉唑肠溶胶囊人体相对生物利用度和生物等效性研究陈薇邓俊刚(桂林医学院附属医院药剂科广西桂林541001)
摘要目的:比较两种奥美拉唑肠溶胶囊的人体相对生物利用度,并做出生物等效性评价,以考察试验制剂的药品质量。方法:按照两制剂两周期随机交叉设计,19名男性健康志愿者单剂量口服试验胶囊(20mg×2)和参比胶囊(40ms)。采用HPLC法测定血浆奥美拉唑浓度。运用DAS2.0软件计算药动学参数,并进行统计学分析。结果:单剂量1:7服40mg的奥美拉唑肠溶试验胶囊和参比胶囊后,AUCo_+12分别为(3184。81±2055.44)ng·h·ml“和(3062.46±1957.74)ng·h·ml~,
AUCo一。分另4为(3361.55±2370.29)ng·h·ml一1和(3186.89±2042.69)ng·h·ml一1;C。。分别为(1066.44±482.99)ng·ml一1
和(1072.99±472.30)ng·ml~;Tm。。分别为(2.504-0.82)h和(2.374-0.72)h;受试胶囊对参比胶囊平均相对生物利用度为(107.334-23.44)%。结论:试验胶囊与参比胶囊具生物等效性。关键词奥美拉唑肠溶胶囊;生物利用度;生物等效性;HPLC中图分类号:R969.1文献标识码:A文章编号:1008-049X(2008)03-0299-03
RelativeBioavailabilityandBioequivalenceofOmeprazoleEntericCapsulesinHealthyVolunteersChenWei,DengJungang(AffiliatedHospital,GuilinMedicalCollege,Guangxi,Guilin
541001,China)
ABSTRACTObjective:Toevaluatethequalityoftwoomeprazoleentericcapsules,andcomparedtherelativebioavailabilityandbioequivalence.Method:Followedthecrossed—designway,19healthymalevolunteersweregivenexperimentalcapsules(20mg×2)andcomparedones(40mg)insingledoseorally.TheconcentrationofomeprazoleinplasmawasdeterminedbyHPLC,andthedatasweredealedwithDAS2.0soft—waretogettheparameters,withthestatisticsanalysisundertakenatthesametime.Reset:Resultsoftestgroupandcontrolgroupwereinfollowing:AUCo。12(3184.814-2055.44)ng‘h‘ml~,(3062.464-1957.74)ng·h·ml~;AUC¨。
51批奥美拉唑肠溶胶囊含量均匀度的评价与研究目的对17个厂家51批奥美拉唑肠溶胶囊“含量均匀度”检查项进行评价与
研究。
方法按照《中国药典》2015年版二部奥美拉唑肠溶胶囊“含量均匀度”方法检查,并进行去胶囊壳、统一乙醇量及具体实验细节进行修正。
结果去胶囊壳的51批奥美拉唑肠溶胶囊含量均匀度全部合格,使用流化床工艺的两个厂家含量均匀度均匀性較好。
结论检查时必须去胶囊壳取内容物进行,10 mg与20 mg规格都加入20 mL乙醇进行溶解,建议标准进行修订;建议推广使用流化床工艺的应用,保证药品的均匀性。
标签:奥美拉唑;含量均匀度;胶囊壳;工艺
[Abstract] Objective To evaluate and research the uniformity of content of 51 batches of omeprazole enteric-coated capsules from 17 factories. Methods The examination was based on the content uniformity of omeprazole enteric-coated capsules of Chinese Pharmacopoeia (2015 Edition)volume Ⅱ,and some aspects of capsule shelling,unifying the ethanol content and specific experimental details were revised. Results The uniformity of content of 51 batches of omeprazole enteric-coated capsules was qualified,and the content uniformity of two factories using the circulating fluid bed reactor was better. Conclusion We must take contents at examination after capsule shelling,and 10mg and 20mg should be dissolved after adding 20ml ethanol,and it is suggested to promote the application of circulating fluid bed reactor thus ensuring the drug uniformity.
[Key words] Omeprazole;Content uniformity;Capsules shell;Craft
奥美拉唑肠溶胶囊现行质量标准为《中国药典》2015年版二部,2005年版药典奥美拉唑肠溶胶囊“含量均匀度”只对10 mg规格的检查,自2010年版药典开始新增对20 mg规格做检查。
《中国药典》2015年版四部对含量均匀度检查法进行了调整,提高了对药品含量均匀度的要求[1-4]。
为客观衡量该品种含量均匀度质量情况,该中心承担了山东省生产、经营、流通领域“奥美拉唑肠溶胶囊”的专项品种的质量评价工作,现将17个厂家、51批次奥美拉唑肠溶胶囊(其中49批次规格为20 mg,2批次规格为10 mg)“含量均匀度”的检查情况及实际检验中发现的问题汇报如下。
1 仪器与试药
1.1 仪器
LC-20高效液相色谱仪,XS-205型电子分析天平,色谱柱:Agilent 5 hc- C8(150 mm×4.6 mm,5 μm)。
1.2 試药
奥美拉唑对照品(中国食品药品鉴定研究院,批号100367-201305含量:99.9% 使用前不需干燥处理);奥美拉唑肠溶胶囊[A~Q17家生产企业,51个批次,规格为20 mg(49批次);10 mg(2批次)];甲醇、乙腈均为色谱纯,水为超纯水,其余试剂均为分析纯。
2 实验方法与结果
2.1 色谱条件
色谱柱为Agilent 5 hc- C8(150 mm×4.6 mm,5 μm);采用药典方法流动相:0.01 mol/L磷酸氢二钠(用磷酸调pH至7.6)-乙腈(75:25);检测波长302 nm;柱温35℃;进样量20 μL;流速1.0 mL/min。
2.2 溶液制备
2.2.1供试品溶液的制备取该品1粒去胶囊壳取内容物置50 mL量瓶中(10 mg规格)或100 mL量瓶(20 mg规格)中,加磷酸盐缓冲液(PH11.0)适量,超声使崩解,加乙醇10 mL,超声处理15 min,放冷,用磷酸盐缓冲液(pH=11.0)稀释至刻度,摇匀,滤过,精密取续滤液5 mL,置50 mL量瓶中,用水稀释至刻度;摇匀,精密量取20 μL注入液相色谱仪,记录色谱图;按外标法以峰面积计算,应符合规定[1]。
2.2.2 对照品溶液的制备精密称取对照品约20 mg,置100 mL量瓶中,加乙醇20 mL与磷酸盐缓冲液(pH=11.0)稀释至刻度,摇匀,滤过,精密取续滤液5 mL,置50 mL量瓶中,用水稀释至刻度;摇匀,同上述“供试品溶液”测定,按外标法以峰面积计算,即得[1]。
2.3 结果
按照《中国药典》2015年版二部对A~Q17厂家、51批次奥美拉唑进行了全检,经检验51批次“含量均匀度”检查项均符合规定;现将实验结果进行了数据归纳与分析,结果见表1。
3 评价性发现和探索性研究
3.1 51批样品结果总体评价
由含量均匀度与含量的比较,可以看出:51批次含量均匀度测定结果比含量的测定整体偏大。
通过A值可以看出不同厂家喷丸工艺有差别[5-6],反映有些厂家投料高于100%(J、M厂家应加以注意),其他大部分厂家投料接近100%;通过S值可以看出不同厂家的喷丸均匀性,各厂家均匀性大部分都小于4.0,但G、P两厂家S值高于4.0,说明喷丸工艺还有待提高。
由表2可以看出A厂家18批含量均匀度分布在100.0~106.0之间,S值均小于4.0,说明A厂家在生产奥美拉唑肠溶胶囊中喷丸工艺稳定,喷丸均匀性良
好。
由表3可以看出F厂家12批含量均匀度分布在98.0~103.0之间,S值均小于4.0,说明F厂家在生产奥美拉唑肠溶胶囊中工艺稳定,含量均匀度的均匀性良好。
由A厂家跟F厂家含量均匀度的实验结果进一步验证了两厂家使用流化床工艺的优势,为提高奥美拉唑肠溶胶囊含量均匀度的均匀性,保证药品质量,建议推广使用流化床工艺。
3.2 试验中胶囊壳的处理
在药典标准中及现有文献资料中均没有提及胶囊壳在均匀度检查方面怎么处理,是将胶囊及内容物一体投入容量瓶中崩解分析,还是只做内容物分析。
通过此次试验得出,包含胶囊壳分析,在超聲溶解过程中肠溶小丸与胶囊壳粘附在一起,不能完全崩解,导致测定结果偏低[7-8]。
该次做的51批次样本结果,均将胶囊内容物倾出试验。
该研究认为胶囊壳中装的是肠溶的光滑小丸,而不是药物细粉,只要将小丸完全倾出分析,就不会影响结果的准确性;如若是有部分小丸破裂成细粉,粘附于囊壳内壁,也因为主药成分的裸漏,而使主药在贮存、胃酸环境下失去活性被认为是非有效成分故不必分析这些细粉。
3.3 标准中含量方法
取相当于20 mg的主药成分,溶解过程中加20 mL乙醇,而在含量均匀度检查项下,不分10 mg和20 mg规格均加入10 mL乙醇。
通过实验对比,对于20 mg规格的样本,加10 mL乙醇和20 mL乙醇测定结果没有一致性的趋向差异。
建议今后检验以加20 mL乙醇较为合适。
3.4 溶解的问题
该品种含量均匀度项下要求,取1粒加入容量瓶直接超声15 min使崩解,然后加乙醇溶解。
然而实验过程中用的是500 W功率的超声波,自容量瓶放入超声波计时,至小丸完全崩解,需要30~45 min时间,此时水温达40°以上,还要加入乙醇继续超声15 min,水温已经很高,实不是一种科学的处理方式。
该研究通过研磨转移和先浸泡1~2 h后超声溶解的办法,结果分析3种处理方式的测定结果没有明显不同,肠溶小丸较硬且研磨费力,转移又容易损失,故不选择;以先浸泡1~2 h为标准,较易崩解,且方便处理。
3.5 过滤的问题
该实验比较了样品的第一步溶解后用滤纸过滤取样再稀释测量的做法和取第一步上清液稀释最后用针头滤膜(0.45 μm尼龙或水膜均可)过滤直接测定的办法。
两者测定结果无差异,但因该品种工艺复杂,辅料所用种类较多,第一步滤纸过滤比较慢,在高温天容易挥发损失,建议以采用第二种方法作为检测标准更为合适。
[参考文献]
[1] 国家药典委员会.中国药典(二部)[S].2015版.北京:中国医药科技出版社,2015:1413.
[2] 国家药典委员会.中国药典(四部)[S]. 2015版.北京:中药医药科技出版社,2015:通则0941.
[3] 国家药典委员会.中国药典(二部)[S].2010版.北京:中药医药科技出版社,2010:1040.
[4] 国家药典委员会.中国药典(二部)[S].2005版. 北京:中药医药科技出版社,2005:784.
[5] 周欣,张晶,王娟.奥美拉唑肠溶微丸的制备[J].解放軍药学学报,2012,1(28):32-33.
[6] 胡海洋,宋华先,陈大为.奥美拉唑肠溶微丸的制备及其处方优化[J].中国药学杂志,2003.10(38):780.
[7] 张爱华,陈新菊,李绍吉.奥美拉唑胶囊含量均匀度测定方法的探讨[J].中国药事,1998,12(3):173.
[8] 张迪.奥美拉唑肠溶胶囊含量均匀度考查分析[J].中国药品标准,2011,12(3):169-171.
(收稿日期:2017-03-2。