
第20章d区金属(二)
第五、第六周期d区金属
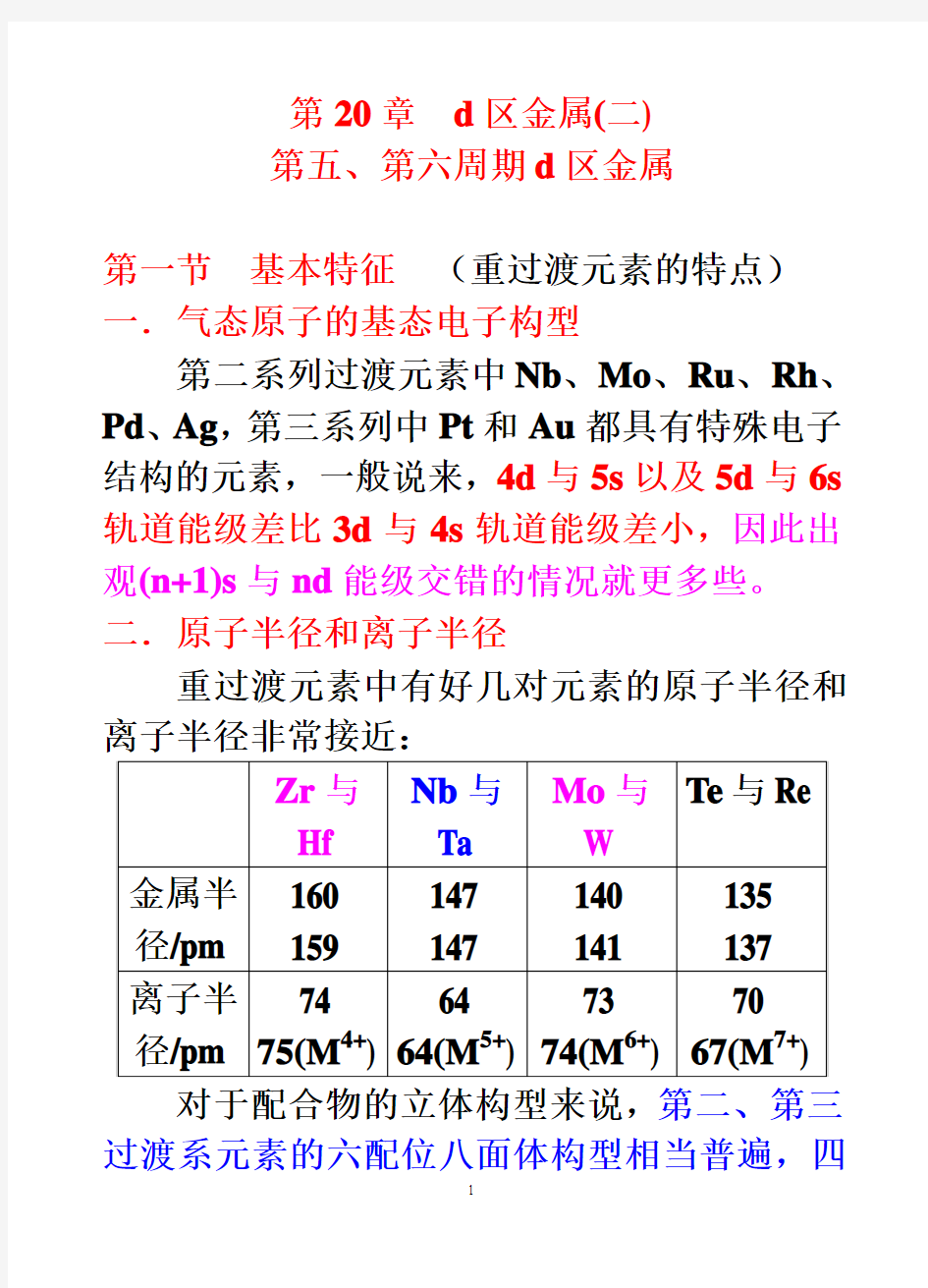
第一节基本特征(重过渡元素的特点)一.气态原子的基态电子构型
第二系列过渡元素中Nb、Mo、Ru、Rh、Pd、Ag,第三系列中Pt和Au都具有特殊电子结构的元素,一般说来,4d与5s以及5d与6s 轨道能级差比3d与4s轨道能级差小,因此出观(n+1)s与nd能级交错的情况就更多些。二.原子半径和离子半径
重过渡元素中有好几对元素的原子半径和离子半径非常接近:
对于配合物的立体构型来说,第二、第三过渡系元素的六配位八面体构型相当普遍,四
面体构型较少,平面正方形的结构只有d8组态的Pd2+和Pt2+中存在。
三、高氧化态与低氧化态的稳定性
与第一系列过渡金属元素相反,第二、三系列过渡金属元素高氧化态稳定,低氧化态不稳定。例如Cr2O72-、MnO4-是很强的氧化剂,但MoO42-、ReO4-的氧化性很弱。当H+ = mol·L-1时,
1/2 Cr2O72- + 7 H+ + 3e == Cr3+ +7/2H2O
?θ = 1.33V
H2MoO4 + 6 H+ +3e == Mo3+ + 4H2O
?θ= 0.1V
四、d4—d7构型形成配合物的特征
d4—d7构型的第一系列过渡金属既可以形成低自旋,也可以形成高自旋八面体配合物,而第二、三系列过渡金属离子一般只形成低自旋配合物。这说明第二、三系列过渡金属离子
?大于第一系列过渡金属离的配合物分裂能o
子,或是成对能P小于第一过渡系金属离子的。
第二节锆和铪
这两种元素的化学行为极其相似,比任何其它同族的一对元素更近似。
ZrSiO4 + 4C ??→
?电弧炉ZrC + SiO2 + CO
ZrC +2Cl2 ??
623ZrCl4+ C (与Ti相似)
?-723
?→
ZrO2 + 2C + 2Cl2 ??→
1173ZrCl4 + 2CO
?K
ZrCl4(g) + 2Mg(l) ??
11502MgCl2(s) + Zr(粗)
?→
?KAr
Zr(粗) + 2I2 ??→
473ZrI4
?K
ZrI4??→
1673Zr + 2I2
?K
第二节铌和钽(Niobium and Tantalum)
铌、钽在空气中很稳定,能抵抗除氢氟酸以外的一切无机酸,包括王水。钽对酸有特殊的稳定性,是所有金属中最耐腐蚀的,即使加热到1200K左右的高温,在熔融的K、Na中也不受腐蚀。但溶解在硝酸和氢氟酸的混合液中。
Nb和Ta的分离是非常困难的,最初使用制得的Nb2O5和Ta2O5溶于KF和HF的溶液中,由于生成的K2TaF7是难溶的,而K3NbOF5·2H2O是可溶的,所以可以利用分步
结晶法将它们分离开。
Nb2O5和Ta2O5为白色粉末。它们溶于HF 生成五氟化物,与碱共熔生成铌(钽)酸盐,可以认为是两性化合物,更显著特点是化学惰性:Nb2O5 + 10HF======= 2NbF5 + 5H2O
Nb2O5 +10NaOH??→
?共熔2Na2NbO3 + 5H2O
第三节钼和钨(Molybdenum and Tungsten) 一.冶炼
以辉钼矿为原料冶炼金属钼的主要过程如下:
(1) 将辉钼矿的精砂在820-920K时焙烧,使其转变成MoO3:
2MoS2 + 7O2 ======= MoO3 + 4SO2
(2) 用氨水浸出可溶性的钼酸铵溶液:MoO3 + 2NH3·H2O ====(NH4)2MoO4 + H2O
(3) 热分解钼酸铵
(NH4)2MoO4?→
??MoO3 + 2NH3 + H2O
(4) 用H2还原制得高纯金属钼粉,压紧后在H2气流中热至熔点制得钼块:
MoO 3 + H 2 ======= Mo + 3H 2O
由黑钨矿提取金属钨的碱熔法过程和反应如下:
黑钨矿用重力或磁力法得到精矿
(Fe ,
Mn)WO 4?????→?空气;焙烧;32CO Na Na 2WO 4
???→?浸出
;2O H Na 2WO 4溶液???→?酸化;HCl WO 3·xH 2O ?→??WO 3 ???→?还原
;2H W 4FeWO 4 + 4Na 2CO 3 + O 2 ?→?
? 4Na 2WO 4 + 2Fe 2O 3 + 4CO 2
2MnWO 4+2Na 2CO 3 + O 2 ?→??
4 Na 2WO 4 + 2MnO 2 + 2CO 2
Na 2WO 4 + 2HCl ===== H 2WO 4 + 2NaCl
H 2WO 4?→?
?WO 3 + H 2O WO 3 + H 2?→??W + 3H 2O
二.性质
钼和钨的化合物可以表现+II 到+VI 的氧化态,最稳定的是钼和钨VI 。从钼和钨的性质以及元素电势图可以看出:VIB 族按Cr 、Mo 、
W顺序金属活泼性逐渐降低;最高氧化态由Cr到W逐渐趋于稳定,如Cr(VI)具有强氧化性,Mo(VI)氧化性很弱,而W(VI)氧化性更弱;在酸性介质中,Cr(III)最稳定,而W(VI)最稳定。
三.重要化合物
1.三氧化钼和三氧化钨
和CrO3不同,MoO3和WO3都是酸性氧化物,难溶于水,没有明显的氧化性,溶于氨水和碱的水溶液生成含MoO42-离子的盐。MoO3 + 2NH3·H2O === (NH4)2MoO4 + H2O WO3 + 2NaOH ===Na2WO4 + H2O 2.钼酸和钨酸及其盐
(NH4)2MoO4 + 2HCl === H2MoO4 + 2NH4Cl
MoO3 + H2O
H2MoO4?→
??
在钼和钨含MO42-离子的盐中,只有碱金属、铵、铍、镁、铊的盐是可溶的,其它金属的盐都难溶于水。
钼酸盐和钨酸盐的氧化性比铬酸盐弱得多。在酸性溶液中,只有用强还原剂才能将H2MoO4还原到Mo3+。例如(NH4)2MoO4在浓
盐酸溶液中,锌做还原剂,溶液最初显蓝色[钼蓝为Mo(VI)、Mo(V)混合氧化态化合物],然后还原为红棕色的MoO2+,再到绿色的[MoOCl5]2-,最后生成棕色的MoCl3:
2 MoO42- + Zn + 8H+ ===
2MoO2+ + Zn2+ + 4H2O 2MoO42-+Zn+ 12 H+ +10Cl- ==
2[MoOCl5]2-+Zn2++6H2O 2 MoO42- +3Zn+16H+ + 6Cl- ===
2MCl3 + 3Zn2+ + 8H2O 钨酸的氧化性就更弱了。
当将钼酸铵和磷酸盐的溶液进行酸化时,得到一种黄色沉淀就是12—磷钼酸铵。它是制得的第一个杂多酸盐,可用于磷酸盐的定量测定:
3NH4+ +12MoO42- + PO43- + 24H+ ===
(NH4)3[PMo12O40] ·6H2O +6H2O
1.下列何种物质聚合度最低?
A. H4SiO4 ;
B. H3PO4;
C. H2SO4;
D. HClO4
2.为什么含氧酸越弱,越易形成多酸?
现象:一般地,含氧单酸越弱,缩合酸越强;
含氧单酸越强,则缩合酸越弱. 例如:H4SiO4H3PO4 H2SO4 HClO4酸性强
缩合性弱
解释:一般说来,缩合酸的强度是与成酸元素的电负性有关,弱酸中成酸元素的电负性小,容易缩合。如SiO44-中,Si 的电负性小,Si —O 之间电负性差值大,使Si —O 键中的O 有高的负电荷,即O 原子上的电荷密度大,阴离子有最大失去O2- 的倾向,缩合成多聚阴离子,使其电荷密度降低。因此,硅酸盐的缩合方式最多。
4.钼和钨的原子簇化合物
金属—金属(M—M)之间形成键的化合物,称原子簇化合物。Mo、W、Nb、Ta等金属均可形成原子簇化合物。
关于M—M成键,大体上有两个通则,一
是低价态的金属较易生成M-M键,至今末发现氧化态为+ 5或更高的金属原子簇络合物。可能因为高电荷使金属价轨道收缩,使金属价轨道之间的重叠太少而未能有效生成金属—金属键。
第二条通则是,同一族的较重元素有生成M—M键的较大倾向。但是,这两个通则都可能有例外,使用时要谨慎。
第四节锝和铼(Technetium and Rhenium) 一.单质
锝(Tc)和铼(Re)与锰(Mn)同属VIIB族元素。Tc是过渡金属中唯一的人造元素。
大量制作Pt—Re催化剂,用于生产低铅、高辛烷值的汽油。
铼能溶于过氧化氢的氨溶液中生成含氧酸盐,而锝不溶解:
2Re + 7H2O2 + 2NH3 === 2 (NH4)ReO4 + 6H2O
(表明高氧化态稳定)二.氧化物和含氧酸盐
锝的氧化物是Tc2O7和稳定的TcO2。铼的
氧化物是Re2O7、ReO3和ReO2。
Tc2O7和Re2O7都能溶于水得到无色的高锝酸HTcO4和高铼酸HReO4。
HTcO4和HReO4与HMnO4一样都是强酸,但其氧化性比HMnO4弱得多,在碱性溶液中,HTcO4和HReO4是稳定的。
三.锝和铼的配合物
铼能生成高配位数化合物和形成Re—C 键的有机金属化合物的特色。例如:具有三冠三棱柱结构的[Re2H9]2-配合物,具有多重Re—Re金属键的铼配合物[Re2Cl8]2-、具有Re—C 键的羰基化合物Rc2(CO)10等。
第六节铂系金属简介
一.铂系元素的通性
铂系元素是指VIII族中的钌、铑、钯和饿、铱、铂六种元素,铂系元素彼此之间的性质非常相似。其共性和变化规律主要有:
(1) 都是稀有金属
(2)气态原子的电子构型特例多铂系元素中除锇铱的n s为2,钌、铑、铂为1,
而Pd为零。这说明铂系元素原子的最外层电子有从n s层填人(n-1)d层的强烈趋势,
(3) 氧化态变化与铁系元素相似,和副族元素一样铂系元素的氧化态变化和铁、钴、镍相似,即每一个三元素组形成高氧化态的倾向都是从左到右逐渐降低;和其它各副族情况一样,重铂系元素形成高氧化态的倾向较轻铂系相应各元素大。
(4) 都是难熔的金属在每一个三元素组中,金属的熔点、沸点从左到右逐渐降低,其中锇的熔点最高,钯的熔点最低。这也可从n d轨道中成单电子数从左到右逐渐减少,形成金属键逐渐减弱得到解释。
(5) 形成多种类型的配合物由于铂系金属离子是富d电子离子,所以铂系元素的重要特性是与许多配体形成配合物。特别是易与π酸配位体如CO、CN-、NO等形成反馈π键的配合物,与不饱和烯、炔配体形成有机金属化合物。
二.单质
大多数铂系金属能吸收气体,钯的吸氢能
力是所有金属中最大的。
铂系金属的化学稳定性很高,常温下和氧、硫、氟、氯、氮等非金属不作用。抗腐蚀性强,钌、锇不与非氧化性酸以及王水作用,铑、铱对酸及王水呈极端惰性,铂不与无机酸作用,但溶于王水。钯可缓慢溶于氧化性酸中,如热浓硝酸、硫酸,在有氧化剂如KNO3,KClO3,Na2O2做助熔剂时,铂系金属与碱共熔可生成可溶性化合物,如钌酸盐[RuO4]2-,锇酸盐[OsO2(OH)4]2-等。
Ru+3KNO3+2KOH===K2RuO4+3KNO2 + H2O RuO2+KNO3+2KOH===K2RuO4+KNO2+ H2O
四.化合物
有实际应用的是PtF6,具有挥发性,它是已知的最强的氧化剂之一。它既能将O2氧化到O2[PtF6],又能将Xe氧化到XePtF6。
五.配合物
铂系元素的重要特征性质是能形成多种类型的配合物。如卤配合物、含氮和含氧的配合
物、含磷的配合物,与CO形成羰基配合物,与不属饱和的烯、炔形成有机金属化合物等。多数情况下,这些配合物是配位数为6的八面体结构。氧化态为+II的钯和铂离子都是d8构型,可形成平面正方形配合物。
重要的是H2PtCl6及其盐,棕红色的氯铂酸—H2PtCl6是Pt(IV)化学中最常用的起始物料。将海绵状金属铂溶于王水或氯化铂溶于盐酸都可生成氯铂酸:
3Pt+4HNO3+18HCl ==3H2PtCl6 + 4NO + 8H2O PtCl4 + 2HCl === H2PtCl6
在铂(IV)化合物中加碱可以制氢氧化铂,它具有两性,溶于盐酸得氯铂酸溶于碱得铂酸盐:
PtCl4 + 4NaOH === Pt(OH)4 + 6NaCl
Pt(OH)4 + 6HCl === H2PtCl6 + 4H2O
Pt(OH)4 + 2NaOH === Na2[Pt(OH)6]
将氯铂酸沉淀转变成微溶的K2PtCl6,然后用肼还原,或在铂黑催化下,用草酸钾、二氧化硫等还原剂可制得K2PtCl4,由此提供了一条通向制备铂(II)化合物的路线。
K2PtCl6 + K2C2O4 === K2PtCl4 + 2KCl + 2CO2将NH+、K+、Rb+、Cs+等氯化物加到氯铂酸中生成难溶于水的黄色氯铂酸盐,分析化学中常用H2PtCl6检验NH+、K+、Rb+、Cs+等离子。
将K2PtCl4与醋酸铵作用或用NH3处理[PtCl4]2-可得顺式二氯二氨合铂(II),常称为“顺铂’’,符号表示为cis-Pt(NH3)2Cl2。
K2PtCl4 + 2NH4Ac ===
Pt(NH3)2Cl2 + 2KAc + 2HCl 1969年罗森博格(B.Roscnberg)及其合作者发现了顺铂具有抗癌活性,从而引起了人们对铂配合物的极大兴趣,现在,顺铂与[PtCl2(en)]一起已成为现代最好的抗癌药物之一,曾给美国的抗癌药业带来极大的经济效益。实验表明,顺铂具有抑制细胞分裂,特别是抑制癌细胞增生的作用。现已证实,顺铂的抗癌活性是由于它与癌细胞DNA(脱氧核糖核酸)分子结合,破坏了DNA的复制,因而抑制了癌细胞增长过程中所固有的细胞分裂。但是,顺铂作为一种药物的主要问题是水溶性较小,毒
性较大,铂化合物对肾脏有毒害作用。目前,人们正在致力于提高抗癌活性,降低毒性的研究工作。
1、在下列溶液中加入NaOH溶液,无沉淀生
成,仅能使溶液改变颜色的是:
A、FeSO4;
B、KMnO4;
C、K2Cr2O7;
D、CuSO4。
2、下列氢氧化物最易脱水的是:
A、Fe(OH)2;
B、Hg(OH)2;
C、Fe(OH)3;
D、Cr(OH)3。
3、王水溶解贵金属时,HCl的主要作用是什么:
A、增加氢离子浓度;
B、提供比HNO3更强的氧化性;
C、将金属转化为易溶于HNO3的状态;
D、提供Cl-作络合剂。
4、CO和金属形成配合物要比N2容易得多,
这是因为:
A、孤对电子多;
B、有一个 配键;
C、有三电子键;
D、分子轨道的电子排布不同。
5、下列各离子或化合物中具有顺磁性的是:
A、Ni(CN)42-;
B、CoCl42-;
C、Co(NH3)63+;
D、Ni(CO)4。
6、在酸性介质中,欲使Mn2+离子氧化到紫色
的MnO4-离子,下列氧化剂中不能用于这类反应的是
A、KClO4;
B、(NH4)2S2O8;
C、NaBiO3;
D、PbO2。
7、下列分子式正确的是
A、Fe(CO)6;
B、Fe(CO)5;
C、Fe(CO)4;
D、Fe(CO)3。
8、下列分子式正确的是
A、Co(CO)4;
B、Co(CO)5;
C、Co(CO)6;
D、Co2(CO)8。
9、下列硝酸盐加强热时,其分子中各元素都参
加氧化还原反应的是
A、NH4NO2;
B、Pb(NO3)2;
C、AgNO3;
D、NH4NO3。
10、下列呈显黄颜色的硫化物是
A、CdS和ZnS;
B、PbS和FeS;
C、As2S3和CdS;
D、As2S5和Sb2S5。
11、一般碱的碱性强弱,可以用下列哪个数值
大小来判断
A、阳离子元素的电离势;
B、阳离子元素的电负性;
C、离子势;
D、溶解热。
12、用稀盐酸处理含有ZnS、CuS、HgS和FeS
不溶物,经过滤后,滤纸上留有哪组的不
溶物
A、CuS和HgS;
B、ZnS和HgS;
C、FeS和CuS;
D、ZnS和FeS。
13、下列化学药品中,广泛用作涂料颜色用的
是
A、Al2O3;
B、MgO;
C、ZnO;
D、TiO2。
14、下列各组离子在水溶液中的稳定性强弱顺
序不正确的是
A、Fe3+>Fe2+;
B、Co3+>Co2+;
C、Cu2+>Cu+;
D、[Co(NH3)6]3+>[Co(NH3)6]2+。
15、在[H+]=0.3mol/L的溶液中,含有Hg2+、
Mn2+、Fe2+、Cd2+、Cu2+离子,通入H2S
达到饱和,生成下列哪组硫化物沉淀
A、HgS、MnS、FeS;
B、HgS、CuS、CdS;
C、CdS、FeS、CuS;
D、HgS、CdS、MnS。
16、PbO2具有强氧化性,造成的主要原因是
A、惰性电子对效应;
B、极化作用;
C、螯合效应;
D、屏蔽效应和钻穿效应。
17、用氢氧化钠熔融法分解某矿石时最合适用:
A、铂坩埚;
B、石英坩埚;
C、镍坩埚;
D、瓷坩埚。
18、下列关于(CN)2的反应中,哪一种不象卤素
的反应:
A、在碱性溶液中生成CN-和OCN-;
B、可在空气中燃烧;
C、与卤素反应生成CNCl、CNBr等;
D、与银、汞、铅反应得难溶盐。
19、下列离子中无色的是
A、[Cu(NH3)2]+;
B、[Cr(H2O)6]3+;
C、[Co(SCN)4]2-;
D、[Fe(CN)6]3-。
20、比较下列各对配合物的稳定性,正确的是
A、[Fe(SCN)6]3->[Fe(CN)6]3-;
B、[HgI4]2->[HgCl4]2-;
C、[CdI4]2->[HgI4]2-;
D、[AlBr6]3->[AlF6]3-。
21、下列元素是属于稀土元素组的是
A、Ti和Sc;
B、Sm和Os;
C、Y和Ce;
D、La和U。
比较下列各组物质性质的强弱或大小(可重排)1.共价性:
A. CCl4GeCl4;
B. SnCl2SnCl4;
2.溶解性:
A. NaClO4CsClO4;
B. CaF2CaS;
3.水解性:
A. PO43-HPO42-H2PO4-;
第12章d区元素和f区元素 【12-1】试用d区元素价电子层结构的特点来说明d区元素的特性。 解:d 区元素最后一个电子填充到d 轨道上,其价层电子组态为:(n-1)d1-8ns1-2,位于周期表的中部,包括ⅢB -ⅦB和Ⅷ族元素,它们都是过渡元素,每个元素都有多种氧化值。同周期过渡元素的原子半径随着原子序数的增加而缓慢地依次减小,到了第Ⅷ族元素后又缓慢增大。同族过渡元素的原子半径,除了ⅢB外,自上而下随着原子序数的增大而增大。各过渡系元素电离能随原子序数的增大,总的变化趋势是逐渐增大的。同副族过渡元素的电离能递变不很规则。熔点、沸点高, 密度大, 导电性、导热性、延展性好。在化学性质方面,第一过渡系元素的单质比第二、三过渡系元素的单质活泼。化学性质变化总趋势是同一过渡系单质的活泼性从左到右降低。 或:d 区元素价电子层结构是(n-1)d1-8ns1-2。它们ns轨道上的电子数几乎保持不变,主要差别在于(n-1)d 轨道上的电子数不同。又因(n-1)d轨道和ns轨道的能量相近,d电子可以全部或部分参与成键,由此构成了d区元素的一些特性:全部是金属,原子半径小,密度大,熔、沸点高,有良好的导热、导电性能,化学性质相近。大多具有可变的氧化态。由于d轨道有未成对电子,水合离子一般具有颜色。由于所带电荷高,离子半径小,且往往具有未充满的d电子轨道,所以容易形成配合物。【12-2】完成下列反应式: (1)TiO2+H2SO4(浓)→ (2)TiO2++Zn+H+→ (3)TiO2+C+Cl2→ (4)V2O5+NaOH→ (5)V2O5+H2SO4→ (6)V2O5+HCl→ (7)VO2++H2C2O4+H+→ 解:(1)TiO2 + H2SO4 (浓) = TiOSO4 + H2O (2)2TiO2+ + Zn + 4 H+ = 2 Ti3+ + Zn2+ +2 H2O (3)TiO2 + 2 C + 2 Cl2 (加热) = TiCl4 + 2 CO (4)V2O5 + 6 NaOH = 2 Na3VO4 + 3 H2O (5)V2O5 + H2SO4 = (VO2)2SO4 + H2O (6)V2O5 + 6 HCl = 2 VOCl2 + Cl2 + 3 H2O (7)2VO+ + H2C2O4 + 2 H+ = 2VO2+ + 2CO2 +2H2O 【12-3】在酸性溶液中钒的电势图为
第12章 d区元素和f区元素 【12-1】试用d区元素价电子层结构的特点来说明d区元素的特性。 解:d区元素最后一个电子填充到d轨道上,其价层电子组态为:(n-1)d1-8ns1-2,位于周期表的中部,包括ⅢB-ⅦB和Ⅷ族元素,它们都是过渡元素,每个元素都有多种氧化值。同周期过渡元素的原子半径随着原子序数的增加而缓慢地依次减小,到了第Ⅷ族元素后又缓慢增大。同族过渡元素的原子半径,除了ⅢB外,自上而下随着原子序数的增大而增大。各过渡系元素电离能随原子序数的增大,总的变化趋势是逐渐增大的。同副族过渡元素的电离能递变不很规则。熔点、沸点高,密度大,导电性、导热性、延展性好。在化学性质方面,第一过渡系元素的单质比第二、三过渡系元素的单质活泼。化学性质变化总趋势是同一过渡系单质的活泼性从左到右降低。 或:d区元素价电子层结构是(n-1)d1-8ns1-2。它们ns轨道上的电子数几乎保持不变,主要差别在于(n-1)d轨道上的电子数不同。又因(n-1)d轨道和ns轨道的能量相近,d电子可以全部或部分参与成键,由此构成了d区元素的一些特性:全部是金属,原子半径小,密度大,熔、沸点高,有良好的导热、导电性能,化学性质相近。大多具有可变的氧化态。由于d轨道有未成对电子,水合离子一般具有颜色。由于所带电荷高,离子半径小,且往往具有未充满的d电子轨道,所以容易形成配合物。 【12-2】完成下列反应式: (1)TiO2+H2SO4(浓)→ (2)TiO2++Zn+H+→ (3)TiO2+C+Cl2→ (4)V2O5+NaOH→ (5)V2O5+H2SO4→ (6)V2O5+HCl→ (7)VO2++H2C2O4+H+→ 解:(1)TiO2 + H2SO4 (浓) = TiOSO4 + H2O (2)2TiO2+ + Zn + 4 H+ = 2 Ti3+ + Zn2+ +2 H2O (3)TiO2 + 2 C + 2 Cl2 (加热) = TiCl4 + 2 CO (4)V2O5 + 6 NaOH = 2 Na3VO4 + 3 H2O (5)V2O5 + H2SO4 = (VO2)2SO4 + H2O (6)V2O5 + 6 HCl = 2 VOCl2 + Cl2 + 3 H2O
1、三个过渡系: 第一过渡系——第四周期元素从钪(Sc)到锌(Zn); 第二过渡系——第五周期元素从钇(Y)到镉(Cd); 第三过渡系——第六周期元素从镥(Lu)到汞(Hg); 2、d区元素除 B族外,过渡元素的单质都是高熔点、高沸点、 密度大、导电性和导热性良好的金属; 3、第一过渡系元素的单质比第二、三过渡系元素的单质活泼; 4、d区元素的颜色: 第一过渡系金属水合离子的颜色: 由d10和d0构型的中心离子所形成的配合物,在可见光照射下不发生d-d跃迁; 而d1~d9构型的中心离子所形成的配合物,在可见光的照射下会发生d-d跃迁;
对于某些具有颜色的含氧酸根离子,如:VO 43-(淡黄色)、CrO 42-(黄色)、MnO 4-(紫色)等,它们的颜色被认为是由电荷迁移引起的; 5、(1)钛(Ti)是银白色金属,其表面易形成致密的氧化物保护膜,使其具有良好的抗腐蚀性,特别是对湿的氯气和海水具有良好的抗腐蚀性能; (2)加热TiO 22nH O 可得到白色粉末状的TiO 2: 3002222C TiO nH O TiO nH O ???→+ ; (3)自然界中存在的金红石是TiO 2的另一种存在形式,由于含少量的铁、铌、钒、钽等而呈红色或黄色; (4)TiO 2在工业上用作白色涂料和制造钛的其他化合物; (5) TiO 2+H 2SO 4(浓)=TiOSO 4+H 2O ; TiO 2+2C(s)=Ti(s)+2CO(s) ; (6)制取Ti 的方法: 通常用TiO 2、碳和氯气在800C~900C 时进行反应: 800~900224222C C TiO C Cl TiCl CO ++????→+ ; 用Mg 还原TiCl 4: TiCl 4+2Mg=Ti+2MgCl 2 ; (7)TiCl 4在加热的情况下: 2TiCl 4+H 2=2TiCl 3+2HCl ; (8)Ti 4+由于电荷多,半径小,使它具有强烈的水解作用,甚至在强酸溶液中也未发现有[Ti(H 2O)6]4+的存在,Ti 4+在水溶液中是以钛氧离子(TiO 2+)的形式存在; (9)在中等酸度的Ti 4+的盐溶液中加入H 2O 2:
第十二章ds区元素 12.1 铜族元素 (1) 12.2 锌族元素 (10) 12.1 铜族元素 12.1.1 铜族元素通性 铜族元素 1.铜族元素通性 铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高。 对于Cu、Ag、Au,Δ(I2-I1)Au < Δ(I2-I1)Cu < Δ(I2-I1)Ag 所以常见氧化态物+3,+2,+1。 铜、银、金的标准电势图如下所示: 12.1.2 铜族元素金属单质 2.铜族元素金属单质 (1).物理性质 铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。这可能与d电子也参与形成金属键有关。由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的
碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。 (2).化学性质 铜族元素的化学活性远较碱金属低,并按Cu--Ag--Au的顺序递减。 在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。铜绿可防止金属进一步腐蚀,其组成是可变的。银和金不会发生该反应。 空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。() 在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。但当有空气存在时,铜可缓慢溶解于这些稀酸中: 浓盐酸在加热时也能与铜反应,这是因为Cl-和Cu+形成了较稳定的配离子[CuCl4]3-,使Cu == Cu++e-的平衡向右移动: 铜易为HNO3、热浓硫酸等氧化性酸氧化而溶解 银与酸的反应与铜相似,但更困难一些;而金只能溶解在王水中:
第11章 s、ds、d区常见元素及其主要化合物 CHAP.11 s,ds,d BLOCK ELEMENTS AND THEIR MAIN COMPOUNDS 11.1 s区常见元素及其主要化合物 s BLOCK MAIN ELEMENTS THEIR MAIN COMPOUNDS 11.1.1 s区元素的通性 1. s区元素的特点: (1) 碱金属金属性最强,碱土金属次之.IA、IIA元素原子的价电子层构型分别为: ns1、ns2 (2)常见氧化值为+1、+2; (3)所生成的化合物多数是离子型;只有Li、Be所形成的化合物具一定共价性. (4)锂与镁两元素性质相近;钙、锶、钡的性质也很接近 (5)锂与同族元素相比具许多特殊性质. 2. s区的单质: (1)物理性质: 有金属光泽; 密度小(密度 < 5 g·cm-3为轻金属); 熔点低; 硬度小; 导电、导热性好; 光电效应. (2)化学性质: 与氧、硫、氮、卤素反应. 如:单质在空气中燃烧,能形成相应的氧化物. 与水作用: 2M + 2H2O → 2MOH + H2(g) 碱金属与水的作用: 11.1.2 s区元素的主要化合物 1.氧化物: (1)三类氧化物: 正常氧化物(O2-): 过氧化物(O22-): 超氧化物(O2-): (2)形成条件: 直接形成 间接形成 正常氧化物 Li,Be,Mg,Ca,Sr,Ba s区所有元素 过氧化物 Na,(Ba) 除Be外s区元素 超氧化物 (Na),K,Rb,Cs 除Be,Mg,Li外s区元素 (3)结构与稳定性: O2-: s22s22p6 O22-: KK(s2s)2(s *2s)2(s2px)2(p2p)4(p*2p)4 O2-: KK(s2s)2(s *2s)2(s2px)2(p2p)4(p*2p)3 键级 键能/ kΦ ·mol-1 O2-: 498 O22-: 1 142
第十六章 d区元素(一) 1、在所有过渡元素中,熔点最高的金属是,熔点最低的是,硬度最大的是。密度最大的是,导电性最好的是,耐海水腐蚀的是。 2、分别写出下列离子的的颜色:[Fe(H 2O) 6 ]2+色,FeO 4 2-色, [FeCl 4]-色,[Fe(H 2 O) 6 ]3+色,[Ti(H 2 O) 6 ]3+色,VO 4 3-色, [Co(H 2O) 6 ]2+色,[Mn(H 2 O) 6 ]2+色,[Ni(H 2 O) 6 ]2+色。 3、CrCl 3 溶液与氨水反应生成色的沉淀,该产物与NaOH溶液反应生成色的。 4、锰在自然界主要以的形式存在,在强氧化剂(如KClO 3 )作用下碱熔时只能得到价锰的化合物,而得不到酸盐,这是因为后者。 5、K 2Cr 2 O 7 (s)与浓H 2 SO 4 反应生成的氧化物为,它为色,遇 酒精立即着火,生成铬的一种色氧化物,其化学式为。高锰酸钾与浓硫酸作用生成的氧化物为;二氧化锰和浓硫酸反应生成的气体是。 6、高锰酸钾是剂,它在酸性溶液中与H 2O 2 反应的主要产物是 和,它在中性或弱碱性溶液中与Na 2SO 3 反应的主要产物为 和。 7、在强碱性条件下,高锰酸钾溶液与二氧化锰反应生成色的;在该产物中加入硫酸后生成色的和色的。
8、三氯化铁蒸汽中含有的聚合分子化学式为,其结构与金属的 氯化物相似。三氯化铁溶于有机溶剂。 9、即可用于鉴定Fe3+,又可用于鉴定Co2+的试剂是;当Fe3+存在时,能 干扰Co2+的鉴定,可加入因生成而将Fe3+掩蔽起来,消除对Co2+鉴定的干扰。 10、用于鉴定Ni2+的试剂是,鉴定反应需要在性溶液中进行, 反应生成了色沉淀。 11、实验室中使用的变色硅胶中含有少量的,烘干后的硅胶呈色, 这实际上呈现的是的颜色。吸水后的硅胶呈现色,这是的颜色。若于烘箱中将吸水硅胶转变成无水硅胶,烘干温度为℃左右。 12、第一过渡系的元素是() (A)第四周期ⅢB~Ⅷ~ⅡB (B)第五周期ⅢB~Ⅷ~ⅡB (C)镧系元素(D)锕系元素 13、作为颜料使用的钛的化合物是() (A)TiCl 4 (B)TiOSO 4 (C)TiO 2 (D)TiF 4 14、关于V 2O 5 的下列叙述中错误的是() (A)是酸性氧化物(B)是无色晶体(C)具有强氧化性(D)可作为催化剂15、下列离子不能被金属锌还原的是()(A)TiO2+ (B)VO2+ (C)Fe3+ (D)V2+ 16、下列离子与Na 2CO 3 溶液反应生成碳酸盐沉淀的是( ) (A)Ti3+ (B)Mn2+ (C)Fe3+ (D)V2+
第12-16章P区元素习题目录 一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题 (返回目录) 1 硼在自然界主要以含氧化合物的形式存在。() 2 在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。() 3 硼酸是三元酸。() 4 硼是非金属元素,但它的电负性比氢小。() 5 由于B-O键键能大,所以硼的含氧化合物很稳定。() 6 硼砂的化学式为Na2B2O7。() 7 B2H6为平面形分子。() 8 硼是缺电子原子,在乙硼烷中含有配位键。() 9 三卤化硼熔点的高低次序为BF3 第十六章d区元素(一)预习提纲 1、d区元素性质变化的一般规律,包括原子半径,电离能,物理性质,化学性质,氧化态及颜色。 2、钛,钒及其化合物。 3、铬的化合物,铬离子的反应,多酸型配合物结构。 4、锰的重要化合物性质。水溶液中锰离子的反应。 5、铁,钴,镍重要化合物性质及相应反应。 第十六章复习题 一、是非题: 1、从元素钪开始,原子轨道上填3d电子,因此第一过渡系列元素原子序数的个位数等于3d上的电子数。 2、除ⅢB外,所有过渡元素在化合物中的氧化态都是可变的,这个结论也符合与ⅠB族元素。 3、ⅢB族是副族元素中最活泼的元素,它们的氧化物碱性最强,接近于对应的碱土金属氧化物。 4、第一过渡系列的稳定氧化态变化,自左向右,先是逐渐升高,而后又有所下降,这是由于d轨道半充满以后倾向于稳定而产生的现象。 5、元素的金属性愈强,则其相应氧化物水合物的碱性就愈强;元素的非金属性愈强,则其相应氧化物水合物的酸性就愈强。 6、低自旋型配合物的磁性一般来说比高自旋型配合物的磁性相当要弱一些。 二、选择题: 1、过渡元素原子的电子能级往往是(n-1)d > ns,但氧化后首先失去电子的是ns 轨道上的,这是因为: A、能量最低原理仅适合于单质原子的电子排布。 B、次外层d上的电子是一个整体,不能部分丢失。 C、只有最外层的电子或轨道才能成键。 D、生成离子或化合物,各轨道的能级顺序可以变化。 2、下列哪一种元素的(Ⅴ)氧化态在通常条件下都不稳定 A、Cr(Ⅴ) B、Mn(Ⅴ) C、Fe(Ⅴ) D、都不稳定 3、Cr2O3,MnO2,Fe2O3在碱性条件下都可以氧化到(Ⅵ)的酸根,完成各自的氧化过程所要求的氧化剂和碱性条件上 A、三者基本相同 B、对于铬要求最苛刻 C、对于锰要求最苛刻 D、对于铁要求最苛刻 4、下列哪一体系可以自发发生同化反应而产生中间氧化态离子? A、Cu(s) + Cu2+(aq) B、Fe(s) + Fe3+(aq) 第12章 氮族、碳族和硼族元素 习题参考答案 1. (1)解: NH 4 (NH 4)2SO 4HSO 4(NH 4)2Cr 2O 2O 3 + N 2 O (2)解: 2KNO 32 + O 2Cu(NO 3) 222 2AgNO 3 2.解:(1) 5NO 2-+ 2MnO 4- + 6H 5NO 3- + 2Mn 2+ + 3H 2O 3NO 2-+ Cr 2O 27 + 8H + →3NO 3- +2Cr 3+ +7H 2O (2) 2NO 2- + 2I - + 4H +2NO↑+ I 2 + 2H 2O (3) HNO 2+NH 2+ 2H 2O 3.解:(1) NH 4(NH 4)2SO 产生白色沉淀(BaSO 4) (2) KNO KNO 产生蓝色溶液(N 2O 3)、红棕色气体(NO 2) (3) AsCl BiCl SbCl 产生黄色沉淀(As 2S 3) Sb 2S 3)产生黑色沉淀(Bi 2S 3) 4.解:(1)S + 2HNO 3(浓) H 2SO 4 + 2NO↑ (2)4Zn + 10HNO 3(很稀) 4Zn(NO 3)2 + NH 4NO 3 + 3H 2 O (3)3CuS + 8HNO 3 3Cu(NO 3)2 + 3S↓ + 2NO↑ + 4H 2O (4)PCl 5+4H 2H 3PO 4+ 5HCl (5)2AsO 33- + 3H 2S + 6H As 2S 3↓ + 6H 2O (6)AsO 43- + 2I - + 5H +H 3AsO 3 + I 2 + H 2O (7)2Mn 2+ + 5NaBiO 3 + 14H 2MnO 4- + 5Bi 3+ + 5Na + + 7H 2O (8)Sb 2S 3 + 3S 2-2SbS 33- 5.解:(1) NH 4 NH 3 O 2 Pt NO O 2 NO O 2H 2(Fe) N 2 2 2 NH 3 43 H 2SO 4( H 2SO 2 3 NH 3 (2) AsCl H 2As 23 2Na 3AsS 3 H 3AsO 3 H 4 2S(HCl)2S 5 Na 3AsS 4 (3) Na 3SbO Sb(OH) 3 SbOCl 2S 2S Na 3SbS 3 (4) 3 43) 3)3 Bi(OH)BiONO 3 6.解:A 是AsCl 3,B 是AgCl ,C 是[Ag(NH 3)2]Cl ,D 是As 2S 3,E 是(NH 4)3AsS 4,F 是As 2S 5,G 是H 2S 。有关反应式如下: 第十二章 群论简介习题 §12.1 群的定义和例子 1.设G为一切不等于零的有理数所成的集合,证明G对于数的乘法作成一个群. 【证明】1)任意两个非零的有理数的乘积为非零有理数,故G对数的乘法封闭; 2)数的乘法结合律对一切数都成立,自然对G也成立; 3)01≠是非零有理数,且对任何一个非零有理数a , 011≠=?=?a a a , 说明1是G的单位元素; 4)对任意的非零有理数a ,则 a 1 是非零有理数,且 11 1=?=? a a a a , 说明a 的逆元是a 1 , 根据群的定义,即知集合G对数的乘法作成一个群. 2.G是由a ,b ,c 三个元素所作成的集合,它的乘法表是 判别G是否成群? 【解】由乘法表容易看到,G对规定的乘法是封闭的,a 是G的单位元素, a 、 b 、 c 的逆元分别是a 、c 、b . 以下只要证明结合律成立即可. 因为(ab)c =bc =a ,a(bc)=aa =a ,故(ab)c =a(bc); 同法可知a(cb)=(ac)b =a ,(ba)c =b(ac)=a ,(bc)a =b(ca)=a , (ca)b =c(ab)=a ,(cb)a =c(ba)=a , 以上6个式子说明结合律对规定的乘法是成立的, 因此G对规定的乘法作成一个群. 3.证明下列四个方阵A,B,C,D对于矩阵乘法作成一个群V,写出的V乘法表.V是 否循环群?V是否交换群? ???? ??=1001A ,???? ??-=1001B ,???? ??-=1001C ,??? ? ??--=1001D . 【证明】先写出乘法表. 由乘法表看出,集合V={A,B,C,D}对矩阵乘法封闭,结合律对任何矩阵 的乘法满足,自然对V中的矩阵也满足,而矩阵A是单位元,元素A、B、C、D的逆 第十二章d区元素和f区元素 1.试用d区元素家电子层结构的特点来说明d区元素的特性。 2.完成下列反应式: (1)TiO2+H2SO4(浓)→ (2)TiO2++Zn+H+→ (3)TiO2+C+Cl2→ (4)V2O5+NaOH→ (5)V2O5+H2SO4→ (6)V2O5+HCl→ (7)VO2++H2C2O4+H+→ 3.在酸性溶液中钒的电势图为 已知φθ(Zn2+/Zn)=-0.76V, φθ(Sn2+/Sn)=-0.14V, φθ(Fe3+/Fe2+)=0.77V.问实现下列变化,各使用什么还原剂为宜? (1)VO2+→V2+ (2) VO2+→V3+ (3)VO2+→VO2+ 4.完成下列反应式: (1)(NH4)2Cr2O7→ (2)Cr2O3+NaOH→ (3)Cr3++NH3·H2O→ (4)Cr(OH)4-+Br2+OH-→ (5)Cr2O72-+Pb2++H2O→ (6)MoO42-+NH4++PO43-+H+→ (7)Na2WO4+HCl→ 5.BaCrO4和BaSO4的溶度积相近,为什么BaCrO4可溶于强酸,而BaSO4则不溶? 6.以K2Cr2O7为主要原料制备K2CrO4,CrCl3和Cr2O3,用方程式表示各步的反应。 7.试用热力学原理判断,(NH4)2Cr2O7的下列两种分解过程,哪种反应趋势更大? (1)(NH4)2Cr2O7(s)=Cr2O3(s)+N2(g)+4H2O(g) (2) (NH4)2Cr2O7(s)=2Cr2O3(s)+NH3(g)+H2O(g) 8.完成下列反应式: ?? (1)MnO2+KOH+KClO3?→ (2)MnO4-+H2O2+H+→ (3)MnO4-+NO2-+H2O→ (4)MnO4-+NO2-+OH-→ (5)K2MnO4+HAc→ 9.以MnO2为主要原料制备MnCl2,K2MnO4和KMnO4,用方程式来表示各步反应。 10.完成下列反应式: (1)FeCl3+NaF→ (2)Co(OH)3+H2SO4→ (3)Co2++SCN- (4)Ni(OH)2+Br2+OH-→ (5)Ni+CO→ 第十六章d区元素(一) [教学要求] 1.了解过渡元素的原子结构特征和通性。 2.了解钛、钒及其重要化合物的性质。 3.了解铬单质的性质。掌握Cr(Ⅲ)、Cr(Ⅵ)化合物的酸碱性、氧化还原性及其相互转化。*了解钼、钨的重要化合物。 4.掌握Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的性质。 5.掌握Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)重要化合物的性质及其变化规律。掌握Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)重要化合物的性质及其变化规律。熟悉铁、钴、镍的重要配合物。 [教学重点] 1.过渡元素的价电子构型特点及其与元素通性的关系。 2.Ti、V、Cr、Mn、Fe、Co、Ni的单质及化合物的性质。 [教学难点] 第四周期d区金属元素氧化态、最高氧化态氧化物及其水合氧化物的酸碱性、氧化还原稳定性、水合离子以及含氧酸根颜色等变化规律。 [教学时数]10学时 [主要内容] 1.第一过渡系元素的基本性质。 2.Ti、TiO 2、H 4 TiO 4 、TiCl 4 、TiCl 3 的性质。 3.V、V 2O 5 、钒酸盐和多钒酸盐的性质。 4.Cr的性质,Cr(III)、Cr(VI)化合物的性质。 5.Mn的性质,Mn(II)、Mn(IV)、Mn(VI)、Mn(VII)化合物的性质。 6.Fe、Co、Ni的单质及化合物的性质和用途。 [教学内容] §16.1 d区元素概述 16.1.1 d区元素概述 1.d区元素在周期表中的位置 d区元素(d区金属):周期表中具有部分填充d壳层电子的元素. 第一过渡系:周期表中第四周期的d区(3d)元素包括Sc、 Ti、V、Cr、Mn、Fe、Co、Ni. 第二过渡系:周期表中第五周期的d区(4d)元素包括Zr、 Nb、Mo、Tc、Ru、Rh、Pd. 第三过渡系:周期表中第六周期的d区(5d)元素包括Hf、 Ta、W、Re、Os、Ir、Pt. 第四过渡系:周期表中锕(89号)到112号元素。 镧系元素:镧(57号)和镥( 71号)之间的15种元素。 锕系元素:锕(89号)和铹(102号)之间的15种元素。 f区元素:镧系元素和锕系元素的总称(f区金属,内过渡元素. d区元素显示出许多区别于主族元素的性质: a.熔、沸点高,硬度、密度大的金属大都集中在这一区 b.不少元素形成有颜色的化合物 c.许多元素形成多种氧化态从而导致丰富的氧化还原行为 d.形成配合物的能力比较强,包括形成经典的维尔纳配合物和金属有机配 合物 e.参与工业催化过程和酶催化过程的能力强 d 区元素所有这些特征不同程度上与价层d 电子的存在有关,因而有人将 d 区元素的化学归结为d 电子的化学. 2. d区元素原子的价电子层构型 (n-1)d1-10ns1-2(Pd为5s0) 3. d区元素的原子半径 普化无机试卷(d区元素二)答案一、选择题 1. (4607) (A) 2. (4654) (A) 3. (4659) (B) 4. (4603) (C) 5. (4608) (C) 6. (4609) (D) 7. (4610) (C) 8. (4663) (A) 9. (4670) (D) 10. (4605) (B) 11. (4645) (C) 12. (4601) (B) 13. (4604) (A) 14. (4606) (C) 15. (4616) (B) 16. (4617) (D) 17. (4636) (D) 18. (4643) (C) 19. (4646) (C) 20. (4648) (A) 21. (4653) (D) 22. (4671) (D) 23. (4672) (B) 24. (4673) (A) 25. (4677) (B) 26. (4678) (B) 27. (4679) (A) 28. (4680) (C) 29. (4681) (B) 30. (4682) (C) 二、填空题( 共2题94分) 31. (4622) FeCl3,CoCl2,NiCl2;Fe(III) 32. (4655) V2O5 + H2SO4= (VO2)2SO4 + H2O,[V(O2)]3+。 33. (4657) (1) C > B > A (2) A > B > C 34. (4660) Ti + 6HF = TiF-26+ 2H+ + 2H2↑ 3Ti(OH)3 + 7HNO3(稀) = 3TiO(NO3)2 + NO↑+ 8H2O 35. (4661) (1) 2TiCl4 + Na2īO4 ?→ ?2TiCl3 + 2NaCl + 2SO2 (2) 2Ti3+ + 2Cu2+ + 2Cl-+ 2H2O?→ ?2TiO2+ + 2CuCl↓+ 4H+ 36. (4674) 钒酸根V2O5CrO3 37. (4600) CoCl2(蓝) + 6H2O CoCl2·6H2O(粉红) 38. (4612) 强氧化性,橙红,绿色,Cr(VI)已还原成Cr(III) 9. (4631) 二价钴,Co3+,强氧化剂,H2O氧化并放出氧气,还原为Co2+。 40. (4647) 2VO2Cl + 3Zn + 8HCl = 2VCl2 + 3ZnCl2 + 4H2O 41. (4658) (1) C > B > A (2) A > B > C 42. (4667) Ni2+,VIII,s1p3 d s p2,四面体形平面正方形。 43. (4668) VOSO4 + KMnO4 + 4KOH = KVO3 + K2MnO4 + K2SO4 + 2H2O 普化无机试卷(d 区元素一) 答案 一、选择题 ( 共17题 ) 1. (1607) (D) 2. (1622) (B) 3. (1627) (A) 4. (1637) (A) 5. (1638) (D) 6. (1644) (C) 7. (1654) (B) 8. (1655) (D) 9. (1657) (B) 10. (165) (B) 11. (1660) (D) 12. (1661) (A) 13. (1664) (D) 14. (1674) (A) 15. (1694) (B) 16. (1695) (D) 17. (1699) (B) 二、填空题 ( 共32题 93分 ) 18. (1600) (1) C (2) D (3) A (4) B (5) B 19. (1602) V 2O 5 + 6HCl(浓) = 2VOCl 2 + Cl 2↑+ 3H 2O 20. (1603) Ti(CO 3)2 Ti(NO 3)4 21. (1608) 灰绿 Cr 2O 3·n H 2O ↓ 肉色 MnS ↓; 棕 MnO(OH)2↓ 22. (1609) -24M n O 和Mn 3+ 23. (1610) MoS 2 (Fe II , Mn II )WO 4 24. (1611) -272O Cr + 14H + + 6e - 2Cr 3+ + 7H 2O -24C r O + 4H 2O + 3e --4Cr(OH)+ 4OH - 或 -24CrO + 4H 2O + 3e - Cr(OH)3 + 5OH - 25. (1612) 2Cr 3+ + 3-282O S + 7H 2O = -272O Cr + 6-24SO +14H + 2-4Cr(OH) + 3- 2 HO = 2-24 CrO + OH - + 5H 2O 26. (1613) (1)Cr(OH)3 (2)Cr(OH)3 (3)Cr(OH)3 NaCr(OH)4 27. (1624) Mn + FeO == MnO + Fe Mn + FeS == MnS + Fe 28. (1625) (1) (NH 4)2MoO 4 == 2NH 3 + MoO 3 + H 2 O (2) MoO 3 +3H 2 == Mo + 3H 2 O 29. (1626) 5NaBiO 3 + 2Mn 2++14H + = 5Na + + 5Bi 3+ + 2-4MnO + 7H 2O 30. (1628) △ △ 第十二章ds区元素 12.1 铜族元素.................................................................................................. 错误!未定义书签。 12.2 锌族元素.................................................................................................. 错误!未定义书签。 12.1 铜族元素 12.1.1 铜族元素通性 铜族元素 1.铜族元素通性 铜族元素的氧化态有+1,+2,+3三种,这是由于铜族元素最外层ns电子和次外层(n-1)d电子能量相差不大。有人认为在本族元素中,元素第二电离能与第一电离能的差值越小,它的常见氧化值就越高。 对于Cu、Ag、Au,Δ(I2-I1)Au < Δ(I2-I1)Cu < Δ(I2-I1)Ag 所以常见氧化态物+3,+2,+1。 铜、银、金的标准电势图如下所示: 12.1.2 铜族元素金属单质 2.铜族元素金属单质 (1).物理性质 铜和金是所有金属中仅有的呈现特殊颜色的二种金属,铜族元素的熔点、沸点、硬度均比相应的碱金属高。这可能与d电子也参与形成金属键有关。由于铜族金属均是面心立方晶体(如下图),它们不仅堆积最密而且存在较多可以滑动的高密度原子层,因而比相应的碱金属(多为体心立方晶体)密度高得多,且有很好的延展性,其中以金最佳。铜族元素的导电性和传热性在所有金属中都是最好的,银占首位,铜次之。 (2).化学性质 铜族元素的化学活性远较碱金属低,并按Cu--Ag--Au的顺序递减。 在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿。铜绿可防止金属进一步腐蚀,其组成是可变的。银和金不会发生该反应。 空气中如含有H2S气体与银接触后,银的表面上很快生成一层Ag2S的黑色薄膜而使银失去银白色光泽。() 在电位序中,铜族元素都在氢以后,所以不能置换稀酸中的氢。但当有空气存在时,铜可缓慢溶解于这些稀酸中: d 区元素练习 一、选择题 ( 共38题 59分 ) 1.(4603) 下列物质不能大量在溶液中共存的是……………………………………( ) (A)-3 6Fe(CN)和OH - (B)-36Fe(CN)和I - (C)-46Fe(CN)和I 2 (D) Fe 3+ 和Br - 2. (4601) 在硝酸介质中,欲使 Mn 2+ 氧化为- 4MnO 可加的氧化剂是……………( ) (A) KClO 3 (B) (NH 4)2S 2O 8(Ag +催化) (C) K 2Cr 2O 7 (D) 王水 3. (1699) CrO 5中Cr 的氧化数为 ……………………………………………………( ) (A) 4 (B) 6 (C) 8 (D) 10 4. (1695) 在强碱性介质中,钒(Ⅴ)存在的形式是………………………………… ( ) (A) VO (B) VO 3+ (C) V 2O 5·n H 2O (D)-3 4VO 5. (7644)下列物质中,不为黄色的是…………………………………………………( ) (A) PbI 2 (B) HgI 2 (C) CdS (D) K 3[Co(NO 2)6] 6. (7643)与Na 2CO 3溶液作用全部都生成碱式盐沉淀的一组离子是…………………( ) (A) Mg 2+,Al 3+,Co 2+,Zn 2+ (B) Fe 3+,Co 2+,Ni 2+,Cu 2+ (C) Mg 2+,Mn 2+,Ba 2+,Zn 2+ (D) Mg 2+,Mn 2+,Co 2+,Ni 2+ 7. (7642)下列硫化物中,溶解度最大的是……………………………………………( ) (A) MnS (B) SnS (C) PbS (D) CuS 8. (4681) 用Cr 2O 3为原料制备铬酸盐应选用的试剂是……………………………( ) (A) 浓硝酸 (B) KOH(s) + KClO 3(s) (C) KMnO 4 (D) H 2O 2 9. (4679) 性质最相似的两种元素是…………………………………………………( ) (A) Zr 和Hf (B) Ru 和Rh (C) Mn 和Mg (D) Cu 和Cr 10. (4677) 在水溶液中不能存在的离子是…………………………………………… ( ) (A) [Ti(H 2O)6]3+ (B) [Ti(H 2O)6]4+ (C) [Ti(OH)2(H 2O)4]2+ (D) [Ti(O 2)OH(H 2O)4] 11. (4604) 根据价层电子的排布,下列化合物中为无色的是………………………( ) (A) CuCl (B) CuCl 2 (C) FeCl 3 (D) FeCl 2 12. (4606) 下列离子中磁性最大的是…………………………………………………( ) (A) V 2+ (B) Cr 3+ (C) Mn 2+ (D) Fe 2+ 13. (4609) 对第四周期的过渡元素,不具备的性质是………………………………( ) (A) 形成多种氧化态 (B) 形成配位化合物 (C) 配位数为4或6 (D) 形成的离子必具有4s 23d n 的电子排布 14. (4610) 下列化合物中显反磁性的是………………………………………………( ) (A) NiCl 2 (B) CoSO 4 (C) VOCl 3 (D) TiF 3 15. (4616) 在某种酸化的黄色溶液中,加入锌粒,溶液颜色从黄经过蓝、绿直到变为紫色,该溶液中含有……………………………………………………………………………( ) (A) Fe 3+ (B) + 2VO (C)-24CrO (D) Fe (CN)-46 16. (4617) 下列离子中氧化性最强的是……………………………………………( ) (A) CoF -3 6 (B) Co(NH 3)+33 (C) Co(CN)-36 (D) Co 3+ 17. (7688)在酸性介质中,下列物质与H 2O 2作用不可能形成过氧化物的是…………( ) (A) Na 4TiO 4 (B) (NH 4)3VO 4 (C) K 2Cr 2O 7 (D) KMnO 4 第17章 d 区元素(二) 一是非题 1. 向CuSO4溶液中滴加KI溶液,生成棕色的CuI沉淀。() 2. 由酸性溶液中的电势图Au3+ 1.29 Au2+ 1.53 Au+ 1.86 Au说明在酸性溶液中能稳定存在的是Au3+和Au。() 3. 用AgNO3溶液这一试剂不能将NaCl、Na2S、K2CrO4、Na2S2O3、Na2HPO4五种物质区分开来。() 4. HgCl2、BeCl2均为直线型分子,其中心金属原子均以sp杂化轨道形式成键。() 5 [CuCl2]-离子是反磁性的,而[CuCl4]2-却是顺磁性的。()二选择题 1. 下列离子在水溶液中不能稳定存在的是() ⑴Cu2+⑵Cu+⑶Au3+ ⑷Hg22+ 2. 下列物种在氨水中不能将HCHO氧化的是() ⑴Ag2O ⑵AgCl⑶[Ag(NH3)2]+ ⑷AgI 3. 下列离子与过量KI溶液反应只能得到澄清的无色溶液的是() ⑴Cu2+⑵Fe3+⑶Hg2+ ⑷Hg22+ 4. 在含有下列物种的各溶液中,分别加入Na2S溶液,发生特征反应用于离子鉴定的是() ⑴[Cu(NH3)4]2+⑵Hg2+⑶ Zn2+⑷Cd2+ 5. 除去ZnSO4溶液中所含有的少量CuSO4,最好选用下列物种中 的() ⑴NH3·H2O ⑵NaOH ⑶ Zn ⑷H2S 6. 下列金属不能溶于浓NaOH的是() ⑴Be ⑵Ag ⑶Zn ⑷Al 7. 下列硫酸盐与适量氨水反应不生成氢氧化物沉淀而生成碱式盐沉淀的 是() ⑴CuSO4⑵ZnSO4⑶CdSO4 ⑷Cr2(SO4)3 8. 下列氢氧化物不是两性的是() ⑴Cd(OH)2⑵Cu(OH)2⑶Zn(OH)2 ⑷Cr(OH)3 9. 下列配离子的空间构型不是正四面体的是() ⑴[Cd(NH3)4]2+⑵[Cu(NH3)4]2+ ⑶[Hg(NH3)4]2+⑷[HgI4]2- 10 在下列各组离子的溶液中,加入稀HCl溶液,组内离子均能生成沉淀的是() ⑴Ag+,Cu2+⑵Al3+, Hg22+ ⑶Ag+,Hg22+⑷Ba2+,Al3+ 三完成并配平反应方程式 ⑴AgNO3+NaOH→ ⑵Cu2O+ HI→ ⑶Cu+NH3+O2 + H2O→ ⑷Au+ O2 +CN-+ H2O → 四简答题 第14章过渡金属(Ⅰ) Chapter 14 Transition Metal (Ⅰ) 引言 具有部分充填d或f电子元素为过渡元素。过渡元素分为外过渡族元素(d 区元素)及内过渡元素(f区元素)。钪Sc,钇Y,镧La和镧系元素在性质上非常相似,常被总称为稀土元素。 d 区: ⅢB ~ Ⅷ(n-1)d1-9ns1-2 (Pd例外4d105s0 ⅢB 钪Sc 钇Y 镧La ⅣB 钛Ti 锆Zr 铪Hf ⅤB 钒V 铌Nb 钽Ta ⅥB 铬Cr 钼Mo 钨W ⅦB 锰Mn锝Tc 铼Re 14.2 过渡元素基本性质 1、都有较大的硬度、熔点和沸点。它们的导电性、导热性好,相互间可形成合金。 2、大多数溶于酸,只是有些“贵”金属电极电势较大,难与普通的酸反应。 3、除IIIB族外,都有多种氧化态,水合离子和酸根离子常呈现一定颜色。 4、d区元素原子的价电子层构型 5、原子半径从左到右逐渐减小 6、d区元素的第一电离能 总趋势:同周期左?右由小?大,幅度不大同副族不规律 d区元素的物理性质 熔点、沸点高熔点最高的单质:钨 硬度大硬度最大的金属:铬 密度大密度最大的单质:锇 导电性,导热性,延展性好。 单质的化学性质 IIIB族是它们中最活泼的金属,性质与碱土金属接近。同族元素的活泼性从上到下依次减弱。总趋势:从左至右活泼性降低。 d区元素离子的颜色 氧化物及其水合物的酸碱性 同种元素,不同氧化态的氧化物,其酸碱性随氧化数的降低酸性减弱,碱性增强 Mn2O7MnO3MnO2Mn2O3MnO 这是由于其水合物中非羟基氧的数目减少。 同一过渡系内各元素的最高氧化态的氧化物及水合物,从左到右碱性减弱,酸性增强。 Sc2O3TiO2CrO3Mn2O7 同族元素,自上而下各元素相同氧化态的氧化物及其水合物,通常是酸性减弱,碱性增强。H2CrO4H2MoO4H2WO4 配合能力强,易形成一系列配合。它们的电负性较大,金属离子与配体间的相互作用加强,形成较稳定的配合物。中心离子半径在0.075~0.06nm范围内的配合物表现的较突出,主要表现在配位体交换慢,有些很慢。如:CrCl3·6H2O在水溶液中长期放置:第十六章 d区元素复习提纲,及试题
第12章 氮族、碳族和硼族元素 习题参考答案
第十二章群论初步习题
第十二章习题d区元素和f区元
第十六章d区元素一
d区元素二
d区元素一
厦门大学无机化学第12章ds区元素
普化无机d区元素
第17章d区元素(二)
第十四章 D区元素