
第三节分子轨道理论(MOT)
一、概述
要点:
A、配体原子轨道通过线性组合,构筑与中心原子轨道对称性匹配的配体群轨道。
B、中心原子轨道与配体群轨道组成分子轨道。
形成LCAO-MO的三原则:
二、金属与配体间σ分子轨道(d轨道能级分裂)
1.可形成σ分子轨道的中心原子轨
(n-1)d x2-y2, (n-1)d z2, ns, np x, np y, np z (可形成σ分子轨道)
三、ABn型分子构筑分子轨道的方法
1、步骤
1)列出中心原子A及配位原子B中参与形成分子轨道的原子轨道;
2)将中心原子轨道按照以它们为基的不可约表示分类;
3)将B原子轨道按等价轨道集合分类(由对称操作可彼此交换的轨道称为等价轨道);
4)将每一等价轨道集合作为表示的基,给出表示;再将其分解为不可约表示;
5)用每一组等价轨道集合构筑出对应于上一步所求出的不可约表示的配体群轨道;
6)将对称性相同的配体群轨道与中心原子轨道组合得分子轨道。
2、以AB6(O h群)为例
1)A原子用ns、np、(n-1)d 9个轨道,每个B原子用3个p(p x、p y、p z)轨道,共27个轨道形成分子轨道。
C、规定p z向量指向中心原子,则p x、p y向量应存在于垂直于p z向量的平面内;
D、规定第一个B原子的p x向量与y 轴平行(* 方向相同),则该B原子的p y向量应与z轴平行(* 方向相同);
E、其余(6-1)个B原子的p x和p y 向量的方向由O h群对称性决定。
2)A原子价轨道在O h群对称下,属于下列表示:
A1g: s
E g: d x2-y2,d z2
T1u: p x,p y,p z
T2g: d xy,d xz,dyz
3)O h群将B原子的18个轨道分为
如下等价轨道的集合:
I、6个p z轨道(可用于形成σ
分子轨道)
II、12个p x或p y轨道
4)以上述轨道集合I为基,得出在
O h群中的表示,并进行约化:
Гσ = A1g + E g + T1u
5)求出与中心原子价轨道相关的配
体群轨道(用投影算符):
中
心原子轨道
ψ(A1g) = (1/6)1/2(p z1+p z2+p z3+p z4+p z5+p z6) 匹配s
ψ(E g) = (1/12)1/2(2p z5+2p z6-p z1-p z2-p z3-p z4) d z2
1/2(p z1-p z2+p z3-p z4) 匹配d x2-y2
ψ(T1u) = (1/2)1/2(p z1-p z3) p x
(1/2)1/2(p z2-p z4) 匹配p y
(1/2)1/2(p z5-p z6) p z
6)按照上述对应关系,构成分子轨道。
四、金属与配体间π分子轨道(强、弱场配合物)
1.配体π群轨道构筑
1)形成π分子轨道的原子轨道
A1g:s E g:d x2-y2,d z2T1u:p x,p y,p z
已用于形成σ分子轨道
只剩余T2g:d xy,d xz,d yz
B原子用于形成π分子轨道的原子轨道集合:12个p x或p y轨道。
以其为基求出表示,并约化:
Гπ = T1g+T2g+T1u+T2u
用投影算符构筑π群轨道:
子接受者
弱σ电子提供者强σ电子提供者
五、晶体场理论与分子轨道理论的比较
1、相同之处::
1)都可得到d轨道能级分裂的结果;2)都可对配合物的磁性给予解释。
2、区别:
1)t2g、e g轨道的性质不同
CFT:t2g、e g为纯原子轨道;
MOT:不考虑π成键时,八面体配合物中t2g虽可看作是原子轨道,但e g*中包含了配体群轨道的成分。
2)d轨道能级分裂原因不同
CFT认为是由于中心原子轨道与配体静电场相互作用所致;
MOT认为是原子轨道组合成分子轨道所致。
3)对配合物稳定性的解释不同
CFT认为,配合物稳定性是由中心离子与配体间静电相互吸引贡献。
MOT认为,配体的对孤对电子进入成键分子轨道释放的能量是决定配合物稳定性的主要因素。
############################################## #######
第四节角重叠模型
对于配合物的化学键理论,MO理论可以得出好的结果。但MO计算量大。近年来又发展了角重叠模型(AMO),使问题简化,计算量小。
1、AOM是一种简易的仍然把焦点集中于d轨道的MO法;
2、AOM比CFT更详细和优越,但不是完整的MO 法;
3、AOM体现了金属与配体相互作用的主要特征,是理解配合物结构、磁性和光谱的成功模型;
4、AOM可估计配体轨道的稳定化作用及金属d轨道的不稳定作用。
一.基本原理
分子轨道理论的基本要点→分子轨道的概念 分子轨道的概念分子轨道理论的基本要点 在介绍分子轨道理论的基本要点之前,首先了解一下分子轨道的概念。 通过原子结构理论的学习,我们知道原子中的电子是处于原子核及其它电子所形成的势场中运动的,每个电子都具有一定的空间运动状态和能量。原子中存在着若干种空间运动状态ψ、ψ、ψ……,这些空间运动状态俗称原子轨道,即原子中存在1s、2s、2p……等原子轨道。分子轨道理论设想,在多原子分子中,组成分子的每个电子并不属于某个特定的原子,而是在整个分子的范围内运动。分子中的电子处于所有原子核和其它电子的作用之下,分子中电子的空间运动状态也可以用波函数来描述,这些波函数俗称分子轨道,即分子中电子的空间运动状态叫分子轨道(Molecular orbit),简称MO。 正如原子中存在对应能量的若干原子轨道一样,在分子中也存在对应一定能量的若干分子轨道。像原子结构那样遵循“能量最低原理”将分子中所有电子依次填入各分子轨道中,则可得到分子的电子构型,并由此说明分子的性质,这就是分子轨道理论的基本思路。现将其要点介绍如下。分子轨道理论的基本要点→分子轨道理论的基本要点★★ 分子轨道的概念分子轨道理论的基本要点 1.分子轨道是由原子轨道线性组合而成(linear combination of atomic orbital,简称LCAO),n个原子轨道组合成n个分子轨道。在组合形成的分子轨道中,比组合前原子轨道能量低的称为成键分子轨道,用ψ表示;能量高于组合前原子轨道的称为反键分子轨道,用ψ表示。 例如两个氢原子的1s原子轨道ψA与ψB线性组合,可产生两个分子轨道: ψ=C1(ΨA+ΨB)ψ=C2(ψA-ψB)(式中C1、C2为常数)
21世纪的化学前沿 人们经常说:化学无所不在,所以化学的对象也几乎无所不包。传统上,根据研究对象和方法的不同一般把化学分为5个分支领域,即无机化学、有机化学、分析化学、物理化学和高分子化学。下面逐一介绍。 1无机化学 无机化学是研究无机化合物的性质及反应的化学分支。无机化合物包括除碳链和碳环化合物之外的所有化合物,因此,无机化合物种类众多,内容丰富。人类自古以来就开始了制陶、炼铜、冶铁等与无机化学相关的活动,到18世纪末,由于冶金工业的发展,人们逐步掌握了无机矿物的冶炼、提取和合成技术,同时也发现了很多新元素。到19世纪中叶,已经有了统一的原子量数据,从而结束了原子量的混乱局面。虽然当时人们已经积累了63种元素及其化合物的化学及物理性质的丰富资料,但是这些资料仍然零散而缺乏系统。为此,德国学者D6bereiner,Meyer、法国学者deChancourrois以及英国学者Newlands,Odling等先后做了许多元素分类的研究工作。至1871年,俄国学者Mendeleev发表了“化学元素的周期性依赖关系”一文并公布了与现行周期表形式相似的Mendeleev周期表。元素周期律的发现奠定了现代无机化学的基础。元素的周期性质是人们在长期科学实践活动中通过大量的感性材料积累总结出来的自然规律,它把自然界的化学元素看做一个有内在联系的整体。正确的理论用于实践会显示出其科学预见性。按周期律预言过的15种未知元素,后来均陆续被发现;
按周期律修改的某些当时公认的原子量,后来也都得到证实,如In,La,Y,Er,Ce,Th等。至1961年,原子序数由1-103的元素全部被发现,它们填满了周期表的第一至第六周期的全部以及第七周期的前面16个位置。尔后,又依次发现了元素104(1969年),105(1970 年),106(1974年),107(1981年),108(1986年),109(1982年),110(1994年),111(2019年),112(2019年)和114(2019年)等。人类究竟还能发现多少新元素?据核物理理论的预测,175号元素可以稳定存在,当然这种预测是否正确还需要实验的验证。至今耕耘周期系来发现和合成新化合物仍是化学科学的传统工作。 20世纪以来,由于化学工业及其他相关产业的兴起,无机化学又有了更广阔的舞台。如航空航天、能源石化、信息科学以及生命科学等领域的出现和发展,推动了无机化学的革新步伐。在过去30年里,新兴的无机化学领域有无机材料化学、生物无机化学、有机金属化学、理论无机化学等等。这些新兴领域的出现,使传统的无机化学再次焕发出勃勃生机。 2有机化学 有机化学是一门研究碳氢化合物及其衍生物的化学分支,也可以说有机化学就是有关碳的化学。在19世纪初期,碳元素的化学远比金属以及其他常见元素(如硫、磷和氮)的化学落后。1828年,德国化学家FeiderichWohler发现用无机化合物NH4Cl和AgOCN氰酸银)作用生成NH4OCN(氰酸钱),蒸发该溶液所得白色结晶是它的异构体CO(NH)2(尿素),后者是动物体内的有机物。人工合成尿素是有史
第三节分子轨道理论(MOT) 一、概述 要点: A、配体原子轨道通过线性组合,构筑与中心原子轨道对称性匹配的配体群轨道。 B、中心原子轨道与配体群轨道组成分子轨道。 C、电子按照能量由低到高的顺序,依次排在分子轨道中。 形成LCAO-MO的三原则: 二、ABn型分子构筑分子轨道的方法
1、步骤 1)列出中心原子A及配位原子B中参与形成分子轨道的原子轨道; 2)将B原子轨道按等价轨道集合分类(由对称操作可彼此交换的轨道称为等价轨道); 3)将每一等价轨道集合作为表示的基,给出表示;再将其分解为不可约表示; 4)用每一组等价轨道集合构筑出对应于上一步所求出的不可约表示的配体群轨道;
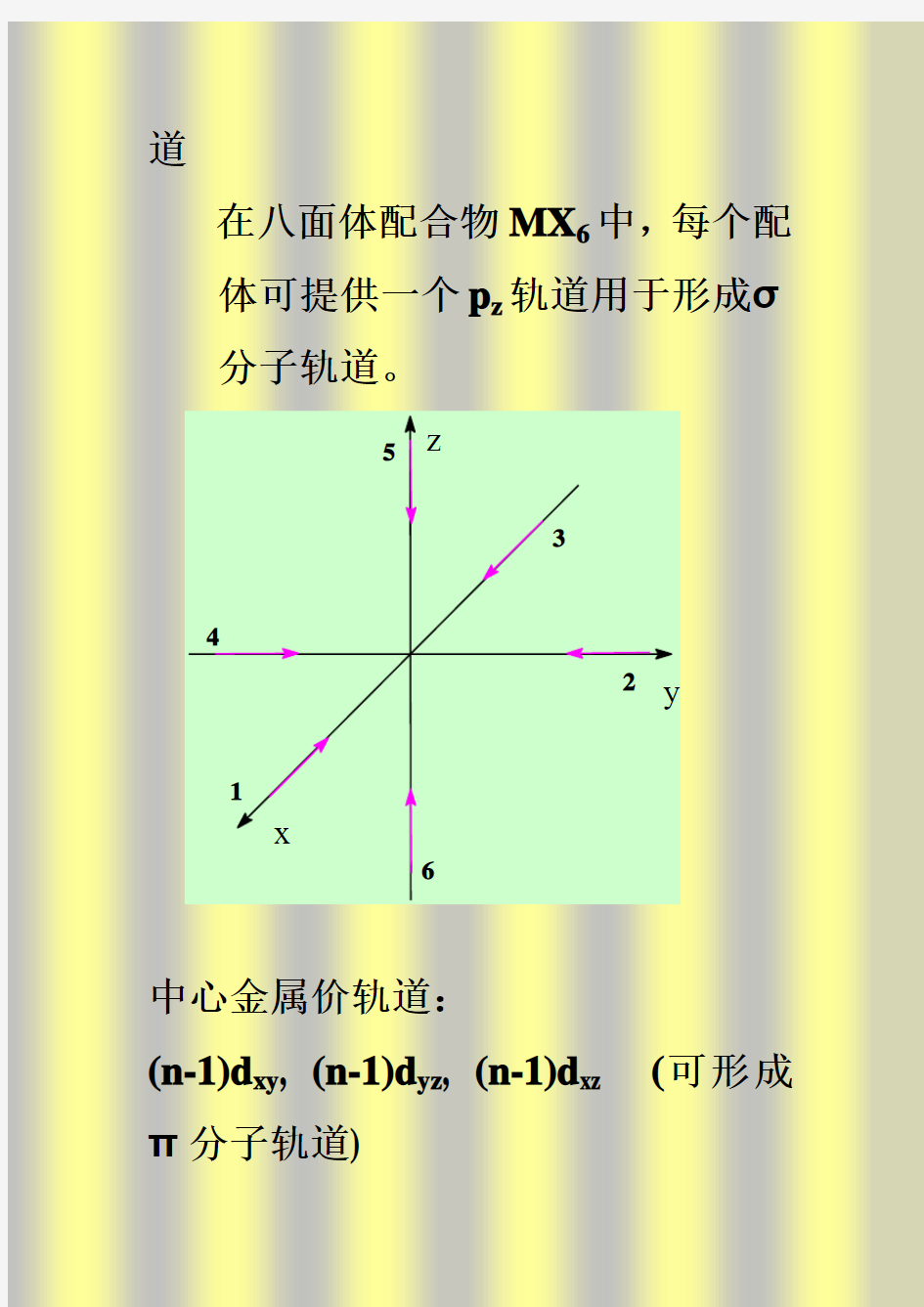
5)将对称性相同的配体群轨道与中心原子轨道组合得分子轨道。 三、金属与配体间σ分子轨道(d轨道能级分裂) 1)A原子用ns、np、(n-1)d 9个轨道,每个B原子用3个p(p x、p y、p z)轨道,共27个轨道形成分子轨道。 * 坐标系选择及配体编号
x y z 1 2 3 5 4 6 p x p y p z A 、中心原子取右手坐标系,配体取左手坐标系; B 、每个B 原子上三个p 轨道各用一个向量表示,方向指向波函数正值方向; C 、规定p z 向量指向中心原子,则p x 、p y 向量应存在于垂直于p z 向量的平
面内; D、规定第一个B原子的p x向量与y 轴平行(* 方向相同),则该B原子的p y向量应与z轴平行(* 方向相同); E、其余(6-1)个B原子的p x和p y 向量的方向由O h群对称性决定。 2)O h群将B原子的18个轨道分为如下等价轨道的集合: I、6个p z轨道(可用于形成σ分子轨道) II、12个p x或p y轨道(可用于形成π分子轨道)
金属有机化学的产生、发展及应用 ——一门交叉学科的兴起 著名的物理学家普朗克曾说过:“科学是内在的整体。它被分解为单独的部门不是取决于物质的本质,而是取决于人类认识的局限性。”作为“中心的,实用的和创造性的科学”的化学,其发展过程中由于客观条件所限制而形成的认识上的局限性同样理所当然地导致了其内部学科的分化。但是人类认识的进步是必然的历史趋势,同时,科学技术的高度分化和高度综合的整体化趋势也促成了当初分化了的学科之间的交叉和渗透。金属有机化学作为化学中无机化学和有机化学两大学科的交叉从产生到发展直到今天逐渐地现代化,它始终处于化学学科和化工学科的最前线,生机勃勃,硕果累累。 化学主要是研究物质地组成、结构和性质;研究物质在各种不同聚集态下,在分子与原子水平上的变化和反应规律、结构和各种性质之间的相互关系;以及变化和反应过程中的结构变化,能量关系和对各种性质的影响的科学。金属有机化学所研究的对象一般是指其结构中存在金属-碳键的化合物。在目前为止人类发现的110多种化学元素中,金属元素占绝大部分,而碳元素所衍生出的有机物不仅数量庞大,而且增长速度也很快,将这两类以前人们认为互不相干的物质组合起来形成的金属有机化合物不仅仅是两者简单的加和关系,而应是乘积倍数关系。其中的许多金属有机化合物已经为人类进步和国民生产做出了特殊的贡献,更重要的是,金属有机化学是一门年轻的科学,是一座刚刚开始发掘的宝藏,发展及应用潜力不可估量。下面就按时间顺序来说明金属有机化学产生和发展及其规律以及在实践中的应用,并探讨学科的研究方法。 一. 金属有机化学的产生与基本成形阶段(1823~1950年) 1827年,丹麦药剂师蔡司(W.C.Zeise)在加热PtCl2/KCl的乙醇溶液时无意中得到了一种黄色的沉淀,由于当时的条件所限,他未能表征出这种黄色沉淀物质的结构。现已证明,这个化合物为金属有机化合物。蔡司可能不会想到,他无意中得到的这第一个技术有机化合物标志着的无机化学与有机化学的交叉学科金属
分子轨道理论 简介 一种化学键理论,是原子轨道理论对分子的自然推广。其基本观点是:物理上存在单个电子的自 身行为,只受分子中的原子核和其他电子平均场的作用,以及泡利不相容原理的制约;数学上则企图将难解的多电子运动方程简化为单电子方程处理。因此,分子轨道理论是一种以单电子近 似为基础的化学键理论。描写单电子行为的波函数称轨道(或轨函),所对应的单电子能量称能级。对于任何分子,如果求得了它的系列分子轨道和能级,就可以像讨论原子结构那样讨论分 子结构,并联系到分子性质的系统解释。有时,即便根据用粗糙的计算方案所得到的部分近似分子轨道和能级,也能分析出很有用处的定性结果。 理论 1. 原子在形成分子时,所有电子都有贡献,分子中的电子不再从属于某个原子,而是在整个分 子空间范围内运动。在分子中电子的空间运动状态可用相应的分子轨道波函数书(称为分子轨道)来描述。分子轨道和原子轨道的主要区别在于: ⑴在原子中,电子的运动只受1个原子核的作用,原子轨道是单核系统;而在分子中,电子则在所有原子核势场作用下运动,分子轨道是多核系统。 分子轨道理论⑵原子轨道的名称用s、p、d…符号表示,而分 子轨道的名称则相应地用c、n、A…符号表示。 2. 分子轨道可以由分子中原子轨道波函数的线性组合(linearcombinationofatomicorbitals , LCAO而得到。有几个原子轨道就可以可组合成几个分子轨道,其中有一部分分子轨道分别由对称性匹配的两个原子轨道叠加而成,两核间电子的概率密度增大,其能量较原来的原子轨道能量低,有利于成键,称为成键分子轨道(bondingmolecularorbital),女口c、n轨道(轴对称轨
习 题 1. 用VSEPR 理论简要说明下列分子和离子中价电子空间分布情况以及分子和离子的几何构型。 (1) AsH 3; (2)ClF 3; (3) SO 3; (4) SO 32-; (5) CH 3+; (6) CH 3- 2. 用VSEPR 理论推测下列分子或离子的形状。 (1) AlF 63-; (2) TaI 4-; (3) CaBr 4; (4) NO 3-; (5) NCO -; (6) ClNO 3. 指出下列每种分子的中心原子价轨道的杂化类型和分子构型。 (1) CS 2; (2) NO 2+; (3) SO 3; (4) BF 3; (5) CBr 4; (6) SiH 4; (7) MnO 4-; (8) SeF 6; (9) AlF 63-; (10) PF 4+; (11) IF 6+; (12) (CH 3)2SnF 2 4. 根据图示的各轨道的位向关系,遵循杂化原则求出dsp 2 等性杂化轨道的表达式。 5. 写出下列分子的休克尔行列式: CH CH 2 123 4 56781 2 34 6. 某富烯的久期行列式如下,试画出分子骨架,并给碳原子编号。 0100001100101100001100 001101001 x x x x x x 7. 用HMO 法计算烯丙基自由基的正离子和负离子的π能级和π分子轨道,讨论它们的稳定
性,并与烯丙基自由基相比较。 8. 用HMO法讨论环丙烯基自由基C3H3·的离域π分子轨道并画出图形,观察轨道节面数目和分布特点;计算各碳原子的π电荷密度,键级和自由价,画出分子图。 9. 判断下列分子中的离域π键类型: (1) CO2(2) BF3(3) C6H6(4) CH2=CH-CH=O (5) NO3-(6) C6H5COO-(7) O3(8) C6H5NO2 (9) CH2=CH-O-CH=CH2(10) CH2=C=CH2 10. 比较CO2, CO和丙酮中C—O键的相对长度,并说明理由。 11. 试分析下列分子中的成键情况,比较氯的活泼性并说明理由: CH3CH2Cl, CH2=CHCl, CH2=CH-CH2Cl, C6H5Cl, C6H5CH2Cl, (C6H5)2CHCl, (C6H5)3CCl 12. 苯胺的紫外可见光谱和苯差别很大,但其盐酸盐的光谱却和苯很接近,试解释此现象。 13. 试分析下列分子中的成键情况,比较其碱性的强弱,说明理由。 NH3, N(CH3)2, C6H5NH2, CH3CONH2 14. 用前线分子轨道理论乙烯环加成变为环丁烷的反应条件及轨道叠加情况。 15. 分别用前线分子轨道理论和分子轨道对称性守恒原理讨论己三烯衍生物的电环化反应 在加热或者光照的条件下的环合方式,以及产物的立体构型。 参考文献: 1. 周公度,段连运. 结构化学基础(第三版). 北京:北京大学出版社,2002 2. 张季爽,申成. 基础结构化学(第二版). 北京:科学出版社,2006 3. 李炳瑞.结构化学(多媒体版).北京:高等教育出版社,2004 4. 林梦海,林银中. 结构化学. 北京:科学出版社,2004 5. 邓存,刘怡春. 结构化学基础(第二版). 北京:高等教育出版社,1995 6.王荣顺. 结构化学(第二版). 北京:高等教育出版社,2003 7. 夏少武. 简明结构化学教程(第二版). 北京:化学工业出版社,2001 8. 麦松威,周公度,李伟基. 高等无机结构化学. 北京:北京大学出版社,2001 9. 潘道皑. 物质结构(第二版). 北京:高等教育出版社,1989 10. 谢有畅,邵美成. 结构化学. 北京:高等教育出版社,1979 11. 周公度,段连运. 结构化学基础习题解析(第三版). 北京:北京大学出版社,2002 12. 倪行,高剑南. 物质结构学习指导. 北京:科学出版社,1999 13. 夏树伟,夏少武. 简明结构化学学习指导. 北京:化学工业出版社,2004 14. 徐光宪,王祥云. 物质结构(第二版). 北京:科学出版社,1987 15. 周公度. 结构和物性:化学原理的应用(第二版). 北京:高等教育出版社,2000
分子轨道理论 通过原子的壳层结构和玻尔的氢原子理论可以很好的从微观角度认识化学规律,并能用电子因素和空间因素阐明化学物质的结构、性能和应用。原子的成键理论就是基于此而建立的,有助于了解物质的基本物理和化学性质。下面对分子轨道理论做一简要介绍。 由两个原子轨道形成的分子轨道,能级低于原子轨道的称为成键轨道;而能级高于原子轨道的称为反成键轨道。当两个符号相同的s轨道相互靠拢,正重叠可形成σ成键轨道;负 重叠时,则形成σ反键轨道。两个符号相同的p轨道肩并肩排列时,相互靠拢正重叠可形成π成键轨道;负重叠时,则形成π反键轨道。在形成分子的过程中,其他原子靠近某原 子时,该原子能级发生重新排列组合,以有利于形成稳定的分子,这一过程叫轨道杂化。如sp杂化是由一个s轨道与一个p轨道组合而成的两个sp杂化轨道。 不同原子有不同的电子结构,它们利用不同的原子轨道进行组合。例如,分子 原子的1s轨道能级低至-64.87eV,无法与氢原子的1s轨道(-13.6eV)成键,因此1σ基本还是原子的1s内层电子,的2s轨道与H的1s轨道能量相近,对称性匹配,可有效形 成σ键。两个原子间还可形成。 有机化合物的分子大部分是由其所含原子的s和p轨道的价电子结合而成。下图简单表示 图(H的成键和反成键轨道)为两个氢原子以s价电子结合,并以σ键组成氢分子,分子 轨道应有σ成键轨道和σ反键轨道。在基态时两个电子占据σ成键轨道,吸收能量后跃迁至激发态σ反键轨道。图(b),表示碳—碳的成键轨道和反键轨道。 下图为乙烯分子的成键轨道示意图。在该分子中每个C原子用sp轨道和其它三个原子相连,C原子和H原子结合成两个sp—s的σ键,C原子间由sp—sp结合成另一个
《催化化学》课程学习报告 专题:MOF的制备、结构表征及催化应用 学院名称:材料化学与化工学院 学生姓名: 学生学号: 教师姓名: 考核时间:
MOF的制备、结构表征及催化应用 摘要:金属有机骨架(MOFs)配位化合物作为一种新型有机无机杂化材料,具有高空隙率、孔道尺寸形状可调性、易于功能化等优点,在气体存储和分离、催化、载药、光电磁性材料等领域展示了良好的应用前景。本文介绍了MOFS 材料的常用制备方法和结构表征方法,综述了近年来MOFS材料在催化领域的应用,特别是以MOFS材料中骨架金属作为活性中心骨架有机配体作为活性中心和负载催化活性组分的催化反应,并对MOFS 材料的催化应用趋势做了展望,以期对MOFS 材料的催化性能有比较全面的认识。 关键词金属-有机骨架合成结构表征催化应用 1.引言 金属-有机骨架(metal-organic frameworks,MOFs)材料是由金属离子与有机配体通过自组装过程杂化生成的一类具有周期性多维网状结构的多孔晶体材料,具有纳米级的骨架型规整的孔道结构,大的比表面积和孔隙率以及小的固体密度,在吸附、分离、催化等方面均表现出了优异的性能,已成为新材料领域的研究热点与前沿。MOFs材料的出现可以追溯到1989年以Robson和Hoskins为主要代表的工作,他们通过4,4′,4′′,4′′′-四氰基苯基甲烷和正一价铜盐[Cu(CH3CN)4].BF4在硝基甲烷中反应,制备出了具有类似金刚石结构的三维网状配位聚合物[1],同时预测了该材料可能产生出比沸石分子筛更大的孔道和空穴,从此开始了MOFs材料的研究热潮。但早期合成的MOFs材料的骨架和孔结构不够稳定,容易变形。直到1995年Yaghi等合成出了具有稳定孔结构的MOFs[2],才使其具有了实用价值。 由于MOFs材料具有大的比表面积和规整的孔道结构,并且孔尺寸的可调
分子轨道理论 量子力学处理氢分子共价键的方法,推广到比较复杂分子的另一种理论是分子轨道理论,其主要内容如下: 分子中电子的运动状态,即分子轨道,用波函数ψ表示。分子轨道理论中目前最广泛应用的是原子轨道线性组合法。这种方法假定分子轨道也有不同能层,每一轨道也只能容纳两个自旋相反的电子,电子也是首先占据能量最低的轨道,按能量的增高,依次排上去。按照分子轨道理论,原子轨道的数目与形成的分子轨道数目是相等的,例如两个原子轨道组成两个分子轨道,其中一个分子轨道是由两个原子轨道的波函数相加组成,另一个分子轨道是由两个原子轨道的波函数相减组成: ψ1=φ1+φ2ψ2=φ1-φ2 ψ 1与ψ 2 分别表示两个分子轨道的波函数,φ 1 与φ 2 分别表示两个原子轨 道的波函数。 在分子轨道ψ 1 中,两个原子轨道的波函数的符号相同,亦即波相相同,它们之间的作用犹如波峰与波峰相遇相互加强一样,见图1-17: 在分子轨道ψ 2 中,两个原子轨道的波函数符号不同,亦即波相不同,它们之间的作用犹如波峰与波谷相遇相互减弱一样,波峰与波谷相遇处出现节点(见图1-18)。
两个分子轨道波函数的平方,即为分子轨道电子云密度分布,如图1-19所示。 ,在核间的电子云密度很大,这种轨道从图1-19可以看出,分子轨道ψ 1 ,在核间的电子云密度很小,这种轨道称为反键轨称为成键轨道。分子轨道ψ 1 道。成键轨道和反键轨道的电子云密度分布亦可用等密度线表示,如图1-20所示。 图1-20为截面图,沿键轴旋转一周,即得立体图。图中数字是ψ2数值,由外往里,数字逐渐增大,电子云密度亦逐渐增大。反键轨道在中间有一节面,节面两侧波函数符号相反,在节面上电子云密度为零。 成键轨道与反键轨道对于键轴均呈圆柱形对称,因此它们所形成的键是σ键,成键轨道用σ表示,反键轨道用σ*表示。例如氢分子是由
第五章分子轨道理论 5.1 Hatree-Fock 方程 Hatree-Fock 近似,也就是分子轨道近似,是量子化学中心之一,分子中的电子占据轨道,这是化学家头脑中很容易想到的。 首先,我们推导一下Hatree-Fock 方程。 由于绝大多数分子都是闭壳层的,因此我们都可以用单slater 行列式作为其波函数,即 12N C f f f ψ= 设我们有正交集i j ij f f δ= 则一、二阶约化密度矩阵为: '*'11111''1111 12'' 21212''112122(,)()() (,)(,)1(,;,)2 (,)(,) i i i x x f x f x x x x x x x x x x x x x ρρρρρρ∧ ∧ ∧∧ ∧∧==∑ 改写一下(Dirac ): *'*'11122*'*'2122 ''1212()()()()1 2 ()() ()()1[()()()()] 2N N i i i i i i N N j j j j j j N i j i j i j j i i j f x f x f x f x f x f x f x f x f x f x f x f x f f f f ρ∧ ≠= =-∑ ∑ ∑ ∑ ∑ 12(1)(1,2)1(1)[(1,2)(1,2)] 2(1,2)(1,2)1[] 2r r N i i i j i j i j j i i i j i i i i i i i i N i i i j i j i j j i i ij E T h T g f h f f f g f f f f g f f f f g f f f f g f f E f h f f f g f f f f g f f ρρ∧∧ ∧ ∧ ≠=+=+--=+-∑ ∑∑ ∑因为i=j 时,=0不影响上式因此 现在就是要利用变分法,看在限制i j ij f f δ=下,什么样i f 的会使E 最小,所以要利用Lagrange 乘子法:
前线轨道理论及其应用 摘要:前线轨道理论是一种简化且有效的分子轨道理论。它能成功地说明大量反应事实和规律。本文综合了数篇文献的研究内容,介绍前线轨道理论及其应用情况。 关键词:前线轨道理论; 应用 1.前言 前线轨道理论是由福井谦一教授于五十年代初提出的一种化学理论,它以分子轨道理论为理论基础,但是没有超越实验化学家的经验和理论范围,以其简单、有效和化学概念明确的特点,赢得了众多科学工作者的关注。本文综合了数篇文献的研究内容,将 2.理论思想 早在1952年福井[1]就在HMO理论的基础上提出了最高占据轨道(highest occupied MO)、最低空轨道(lowest unoccupied MO)的概念。并称HOMO, LUMO 这两种特殊的分子轨道为“前线轨道”[2]。考虑到在化学反应中原子的价电子起着关键作用,可以联想到,在分子的所有MO中,能量最高的HOMO上的电子最活泼最易失去;能量最低的LUMO最易接受电子。因此,有理由认为在分子反应中,这些特殊的MO贡献最大,对反应起主导作用。这一概念和观点,起初只引起了极少数人的注意。但是福井等人却注意到了这一点,并且进行了深入的研究。他们将“前线轨道及各种前线轨道间的相互作用”发展成为了解分子反应能力和预测反应机理的强有力的理沦方法—“前线轨道理论”,35年来前线轨道理论大致经过了七个重要发展阶段[3]。前线电子密度基本概念的提出和研究;前线电子密度在共轭化合物中应用的研究;在饱和化合物中应用的研究;在立体选择反应中推广应用的研究;解释,说明化学反应中的HOMO-LUMO的相互作用;建立化学反应途径的极限反应坐标理论(简称IRC);提出化学反应的相互作用前线轨道理论(简称IFO)。今天,这一理论已成为讨论化学问题的必不可少的工具,对于人们的化学实践具有重要的指导意义。
第十八章分子轨道理论简介 一、教学目的和要求 (1)了解分子轨道理论的原理。 (1)了解周环反应的一般规律。 (2)了解分子轨道对称守恒原理在有机合成中的作用。 二、教学重点与难点 分子轨道理论的原理,周环反应的理论。 三、教学方法和教学学时 1、教学方法:以课堂讲授为主,结合必要的课堂讨论。教学手段以板书和多媒体相结合。 2、教学学时:2学时 四、教学内容 第一节电环化反应 第二节环加成反应 第三节σ迁移反应 第四节周环反应的理论 一、电环化反应机理 二、环加成反应机理 三、σ键迁移反应机理 五、课后作业、思考题 习题:1、2、4、6、11。 §18-1 周环反应的理论 一、周环反应 前面各章讨论的有机化学反应从机理上看主要有两种,一种是离子型反应,另一种是自由基型反应,它们都生成稳定的或不稳定的中间体。还有另一种机理,在反应中不形成离子或自由基中间体,而是由电子重新组织经过四或六中心环的过渡态而进行的。这类反应表明化学键的断裂和生成是同时发生的,它们都对过渡态作出贡献。这种一步完成的多中心反应称为周环反应。 周环反应:反应中无中间体生成,而是通过形成过渡态一步完成的多中心反应。 反应物——→产物
周环反应的特征: (1) 多中心的一步反应,反应进行时键的断裂和生成是同时进行的(协同反 应)。 例如: (2) 反应进行的动力是加热或光照。不受溶剂极性影响,不被酸碱所催化,不受任何引发剂的引发。 (3) 反应有突出的立体选择性,生成空间定向产物。 例如: 二、周环反应的理论 (一) 轨道和成键 周环反应的过程,广泛的应用轨道来描述,这些轨道往往是用图形来表示。有机化学中涉及最多的原子轨道为1p 轨道和2s 轨道。 原子轨道线形组合成分子轨道。当两个等价原子轨道组合时,总是形成两个新的分子轨道,一个是能量比原子轨道低的成键轨道,另一个是能量比原子轨道高的反键轨道。 (二)分子轨道对称守恒原理 原子轨道组合成分子轨道时,遵守轨道对称守恒原理。即当两个原子轨道的对称性相同(位相相同)的则给出成键轨道,两个原子轨道的对称性不同(位相不同)的则给出反键轨道。 CHO + CHO R h υ R = -COOCH 3 成键轨道 原子轨道 X 1 2
第五章 多原子分子的化学键 1. (东北师大98)离域π键有几种类型? (三种) 正常离域π键,多电子离域π键,缺电子离域π键 2. 用HMO 法计算环丙烯基π体系能量。 1 1 1 10 1 1 x x x =展开x 3-3x+2=0 (x-1)2(x+2)=0 解得 x 1=-2,x 2=x 3=1 E 1=α+2β E 2= E 3=α-β E D π=2E 1+E 2=3α+3β 3. NO 2+为直线型, NO 3-为平面三角型,指出它们中心原子杂化类型,成键情况和所属分子点群。 ..4.3O-N-O : 2 D h O N N SP π+ ??∞??.杂化 2643h N SP D O O π?????? ???????????? : 4. (东北师大99)推出y 轴的等性sp 2杂化轨道波函数 解: 等性杂化:c 112=c 212=c 312=1/3, Ψ1中只有p y 成分:c 112+c 12 2=1 1s py ψ 123k k s k px k py c c c ψφφφ=+ +11c =12c
2s py px 3s py px ψψ 5. (东北师大2000)乙烯中∠HCH=11 6.6。 ,其中含-C-H 键指向x 轴的正向,试求形成该键的杂化轨道波函数和杂化指数。 解: x 两个C -H 键夹角为116.6。 cos 0.3091kl αθαα==-=- p 成分/s 成分=(1- α)/α=2.236 所以在C-H 方向上的杂化轨道为:sp 2.236 1111222122233313233=c =c =c s px s px py s px py c c c c c ψφφψφφφψφφφ+++++ 22 213123y 232 22223 33 23 33 2333222221222322220.309 , p , =1 +=1 0.191 c c c c c c c c c c c c c αψψψψ====++==等价,轨道对有相同的贡献
结构化学第五章习题 及答案 https://www.doczj.com/doc/ce7602295.html,work Information Technology Company.2020YEAR
习 题 1. 用VSEPR 理论简要说明下列分子和离子中价电子空间分布情况以及分子和离子的几何构型。 (1) AsH 3; (2)ClF 3; (3) SO 3; (4) SO 32-; (5) CH 3+; (6) CH 3- 2. 用VSEPR 理论推测下列分子或离子的形状。 (1) AlF 63-; (2) TaI 4-; (3) CaBr 4; (4) NO 3-; (5) NCO -; (6) ClNO 3. 指出下列每种分子的中心原子价轨道的杂化类型和分子构型。 (1) CS 2; (2) NO 2+; (3) SO 3; (4) BF 3; (5) CBr 4; (6) SiH 4; (7) MnO 4-; (8) SeF 6; (9) AlF 63-; (10) PF 4+; (11) IF 6+; (12) (CH 3)2SnF 2 4. 根据图示的各轨道的位向关系,遵循杂化原则求出dsp 2等性杂化轨道的表达 式。 5. 写出下列分子的休克尔行列式: CH CH 2 123 4 56781 2 34 6. 某富烯的久期行列式如下,试画出分子骨架,并给碳原子编号。 0100001100101100001100 001101001 x x x x x x
7. 用HMO法计算烯丙基自由基的正离子和负离子的π能级和π分子轨道,讨论它们的稳定性,并与烯丙基自由基相比较。 8. 用HMO法讨论环丙烯基自由基C3H3·的离域π分子轨道并画出图形,观察轨道节面数目和分布特点;计算各碳原子的π电荷密度,键级和自由价,画出分子图。 9. 判断下列分子中的离域π键类型: (1) CO2 (2) BF3 (3) C6H6 (4) CH2=CH-CH=O (5) NO3- (6) C6H5COO- (7) O3 (8) C6H5NO2 (9) CH2=CH-O-CH=CH2 (10) CH2=C=CH2 10. 比较CO2, CO和丙酮中C—O键的相对长度,并说明理由。 11. 试分析下列分子中的成键情况,比较氯的活泼性并说明理由: CH3CH2Cl, CH2=CHCl, CH2=CH-CH2Cl, C6H5Cl, C6H5CH2Cl, (C6H5)2CHCl, (C6H5)3CCl 12. 苯胺的紫外可见光谱和苯差别很大,但其盐酸盐的光谱却和苯很接近,试解释此现象。 13. 试分析下列分子中的成键情况,比较其碱性的强弱,说明理由。 NH3, N(CH3)2, C6H5NH2, CH3CONH2 14. 用前线分子轨道理论乙烯环加成变为环丁烷的反应条件及轨道叠加情况。 15. 分别用前线分子轨道理论和分子轨道对称性守恒原理讨论己三烯衍生物的电环化反应在 加热或者光照的条件下的环合方式,以及产物的立体构型。 参考文献: 1. 周公度,段连运. 结构化学基础(第三版). 北京:北京大学出版社,2002 2. 张季爽,申成. 基础结构化学(第二版). 北京:科学出版社,2006 3. 李炳瑞.结构化学(多媒体版).北京:高等教育出版社,2004 4. 林梦海,林银中. 结构化学. 北京:科学出版社,2004 5. 邓存,刘怡春. 结构化学基础(第二版). 北京:高等教育出版社,1995 6.王荣顺. 结构化学(第二版). 北京:高等教育出版社,2003 7. 夏少武. 简明结构化学教程(第二版). 北京:化学工业出版社,2001 8. 麦松威,周公度,李伟基. 高等无机结构化学. 北京:北京大学出版社,2001 9. 潘道皑. 物质结构(第二版). 北京:高等教育出版社,1989 10. 谢有畅,邵美成. 结构化学. 北京:高等教育出版社,1979 11. 周公度,段连运. 结构化学基础习题解析(第三版). 北京:北京大学出版社,2002 12. 倪行,高剑南. 物质结构学习指导. 北京:科学出版社,1999 13. 夏树伟,夏少武. 简明结构化学学习指导. 北京:化学工业出版社,2004
π络合吸附分离技术的研究进展及应用 周艳平 (江南大学食品科学与工程学号:6150112117) 摘要:随着经济迅猛的发展,吸附分离技术在当今社会已受到科学家们广泛的关注。吸附分离技术在工业化生产以及环境保护中起着关键性的作用,该技术已经蔓延至食品、医药等综合领域,并在这些领域中扮演着相当重要的角色。本文着重介绍了π络合吸附分离技术、吸附剂的研究进展以及其应用特点,并对其作相应的评价。 关键词:π络合吸附分离;吸附剂;研究进展;应用 1、前言 吸附技术很早就为人们发现和利用。古代用新烧好的木炭,利用其吸湿吸臭的功效来去除某些异味,也包括在日常生活中,将烧尽的木炭放在冰箱里从而达到去除异味的目的,这些都说明吸附技术在人类生活中已有悠久历史[1]。然而,在近代工业中,人们对吸附的知识还停留在直接开发使用,如空气和工业废气的净化,防毒面具里活性炭吸附有毒气体,硬水软化用到离子交换树脂等[2],吸附分离技术仅仅以辅助的作用出现在化工单元操作中。吸附分离的研究进展之所以受到一定的限制是由于固体吸附剂的吸附容量小,吸附剂耗用量大,使分离设备体积庞大,同时因固体的热容量大,传热系数小,升温、降温速度慢,循环周期长,效率低,因此发展较缓慢。直至五十年代初,随着工业的发展特别是石油化工开发,新型吸附剂的开发为吸附分离技术的进一步应用打下了基础,相继许多吸附分离技术应用于各个行业,推动了工业化的发展,其中π络合吸附分离技术占有十分重要的作用,显示出巨大的潜力。 2、吸附分离技术简介 早期的吸附分离技术主要用于吸附净化方面,随着20世纪50年代合成沸石分子筛的出现,使吸附分离技术得到快速发展,也因此使得吸附分离技术在化工、石化、生化和环保等领域得到广泛应用[3]。吸附技术在现代生活中的应用与Lowitz的实验结果有着必然的联系,Lowitz利用木炭去脱除有机物中的杂质[4]。对吸附技术的系统学习要追溯至1814年de Saussure的研究,他得出的结论是多
《催化化学》课程学习报告 专题:MOF得制备、结构表征及催化应用 学院名称:材料化学与化工学院 学生姓名: 学生学号: 教师姓名: 考核时间: MOF得制备、结构表征及催化应用 摘要:金属有机骨架(MOFs)配位化合物作为一种新型有机无机杂化材料,具有高空隙率、孔道尺寸形状可调性、易于功能化等优点,在气体存储与分离、催化、载药、光电磁性材料等领域展示了良好得应用前景。本文介绍了MOFS材料得常用制备方法与结构表征方法,综述了近年来MOFS材料在催化领域得应用,特别就是以MOFS材料中骨架金属作为活性中心骨架有机配体作为活性中心与负载催化活性组分得催化反应,并对MOFS 材料得催化应用趋势做了展望,以期对MOFS 材料得催化性能有比较全面得认识。 关键词金属-有机骨架合成结构表征催化应用 1、引言 金属-有机骨架 (metal-organic frameworks,MOFs)材料就是由金属离子与有机配体通过自组装过程杂化生成得一类具有周期性多维网状结构得多孔晶体材料,具有纳米级得骨架型规整得孔道结构,大得比表面积与孔隙率以及小得固体密度,在吸附、分离、催化等方面均表现出了优异得性能,已成为新材料领域得研究热点与前沿。MOFs材料得出现可以追溯到1989年以Robson与 Hoskins为主要代表得工作,她们通过 4,4′,4′′,4′′′-四氰基苯基甲烷与正一价铜盐 [Cu(CH 3CN) 4 ]、BF 4 在硝基甲烷中反应,制备出了具有类似金刚石结构得三维网状
配位聚合物[1],同时预测了该材料可能产生出比沸石分子筛更大得孔道与空穴,从此开始了MOFs材料得研究热潮。但早期合成得MOFs材料得骨架与孔结构不够稳定,容易变形。直到1995年Yaghi等合成出了具有稳定孔结构得MOFs[2],才使其具有了实用价值。 由于MOFs材料具有大得比表面积与规整得孔道结构,并且孔尺寸得可调控性强,骨架金属离子与有机配体易实现功能化,因此在催化研究、气体吸附、磁学性能、生物医学以及光电材料等领域得到了广泛应用。作为一种新型多孔固态材料,由于其广泛得应用价值,更加应该深入了解其结构特性,从其微观得分子间作用及排布开始,深刻理解某些规则聚集所表现出来得特殊性质,利用分子间得作用力,有目得得设计金属有机骨架得结构,使其表现出一定得物理化学性质。而有效得结构表征方法无疑就是最为重要得环节之一。在催化应用方面,MOFs材料中得金属离子得不饱与配位点可以作为相应催化反应得活性中心; MOFs骨架上还可以引入多种具有催化性能得有机配体,尤其就是可引入手性配体从而实现不对称催化反应; 而且MOFs骨架孔尺寸可以在微孔与介孔之间调节,具有手性螺旋轴得孔道还可以提供不对称催化微环境; 除此之外,大比表面积得MOFs材料还可负载高分散得纳米金属活性组分等,因此MOFs材料具有区别于其她催化剂材料得独特结构特征。 2、金属有机骨架一配位化学得前沿 金属有机骨架就是配位化学延伸,配位化学就是研究金得原子或离子与无机、 有机得离子或分子相互反应形成配位化合物得特点以及它们得成鍵、结构、反应、分类与制备得学科。研究金得原子或离子与无机、有机得离子或分子相互反应形成配位化合物得特点以及它们得成鍵、结构、反应、分类与制备得学科。最早有记载得配合物就是18世纪初用作颜料得普魯士蓝,化学式为K[Fe(CN) 6 Fe]。 1798年发现CoCl 3、6NH 3 。CoCl 3 与NH 3 都就是稳定得化合物,在它们结合成新得化 合物后,其性质与组分化合物不同。这一发现开创了配位化学得研究。1893年,端士化学 家A、韦尔纳首先提出这类化合物得正确化学式与配位理论,在配位化合物中引进副价概念,提出元素在主价以外还有副价,从而解释了配位化合物得存在以及
我们把原子通过共用电子对结合的化学键成为共价键(covalent bond)。路易斯(G.N.Lewis)曾经提出原子共用电子对成键的概念,也就是俗称的“八隅律”(高中阶段也只是停留于此) 然而,我们知道很多现实情况都无法用八隅率解释,包括:PCl5,SCl6分子。更重要的是,八隅率从来没有本质上说明共价键的成因:为什么带负电荷的两个分子不会排斥反而是互相配对? 随着近代的量子力学(quantum mechanics)的建立,近代形成了两种现代共价键理论,即是:现代价键理(valence bond theory)简称VB(又叫作电子配对法)以及分子轨道理论(molecular orbital theory)简称MO。价键理论强调了电子对键和成键电子的离域,有了明确的键的概念。也成功的给出了一些键的性质以及分子结构的直观图像。但是在解释H2+氢分子离子的单电子键的存在以及氧分子等有顺磁性或者大Π键的某些分子结构时感到困难。而分子轨道理论可以完美的进行解释,这里我就主要阐述MO法的相关理论。 洪特(Hund)和密里肯(R.S Mulliken)等人提出了新的化学键理论,即是分子轨道理论。这是人们利用量子力学处理氢分子离子而发展起来的。 (一)氢分子离子的成键理论氢分子离子(H2+)是由两个核以及一个电子组成的最简单分子,虽然不稳定,但是确实存在。如何从理论上说明氢分子离子的形成呢?分子轨道理论把氢分子离子作为一个整体处理,认为电子是在两个氢核a和b组成的势场当中运动。电子运动的轨道既不局限在氢核a的周围,也不会局限于氢核b 的周围,而是遍及氢核a和b。这种遍及分子所有核的周围的电子轨道,成为“分子轨道”。 如何形成这样的分子轨道呢?我们必须通过波函数来描述原子当中的运动状态,而波函数是薛定谔方程的解。因为得到精确的薛定谔方程的解很困难,因此我们才取了近似方法,假设分子轨道是各个原子轨道的组成。仍然以氢分子离子为例:当这个单电子出现了一个氢原子核a附近时候,分子轨道Ψ很近似于一个院子轨道Ψa。同样,这个电子出现在另外一个氢原子b附近时候,分子轨道Ψ也很像原子轨道Ψb。不过这个只是两种极端情况,合理的应该是两种极端情况的组合即是Ψa与Ψb的组合。分子轨道理论假定了分子轨道是所属原子轨道的线性组合(linear combination of atomic orbital,简称LCAO),即是相加相减而得得。例如氢分子离子当中就有: ΨI=Ψa+Ψb ΨII=Ψa-Ψb 其中Ψa和Ψb分别是氢原子a以及氢原子b的1s原子轨道。它们的相加相减分别可以得到ΨI以及ΨII。相加可以看出处在相同相位的两个电子波组合时候波峰叠加,这样可以使得波增强。如果两个波函数相减,等于加上一个负的波函
教案 2008 - 2009 学年第 2学期 学院系室化学与环境工程系 课程名称物理化学 计划学时 68 专业年级 07环境工程 主讲教师贾庆超 安阳工学院
绪论 教学目的: 掌握理想气体状态方程的应用,理想气体的微观模型 掌握混合理想气体的分压定律及分体积定律 掌握饱和蒸气压的概念,熟悉物质在临界状态的特性教学重点:理想气体状态方程、分压定律及分体积定律 教学难点:饱和蒸气压 教学方法:多媒体 教学课时:2 1、什麽是物理化学 物理化学是从物质的物理现象和化学现象的联系入手,来探求化学变化及相关的物理变化基本规律的一门科学。 ---付献彩物理化学——是化学科学中的一个重要分支学科。它是借助数学、物理等基础科学的理论及其提供的实验手段,研究化学科学中的原理和方法,研究化学体系行为最一般的宏观、微观规律和理论的学科,是化学的理论基础。 2、物理化学的研究内容 (1)化学反应的方向、限度和能量效应 -化学体系的平衡性 质 (2) 化学反应的速率和反应机理 - 化学体系的动态性质 (3) 化学体系的微观结构和性质 物理化学的分支学科 化学热力学统计力学结构化学 化学动力学 其他分支学科:电化学、表面及胶体化学、催化化学等。 物理化学原理应用于不同的体系,则产生了物理有机化学、生物物理化学、材料物理化学、冶金物理化学等。 3、物理化学的建立与发展 第一阶段: 1887-1920 s—化学平衡和化学反应速率的唯象规律的建立19世纪中叶—热力学第一定律和热力学第二定律的提出
1850—Wilhelmy 第一次定量测定反应速率 1879—质量作用定律建立 1889—Arrhenius 公式的建立和活化能概念1887—德文“物理化学”杂志创刊 1906 1912—Nernst热定理和热力学第三定律的建立 第二阶段: 1920 s - 1960 s——结构化学和量子化学的蓬勃发展和化学 变化规律的微观探索 1926——量子力学建立 1927——求解氢分子的薛定谔方程 1931——价键理论建立 1932——分子轨道理论建立 1935——共振理论建立 1918——提出双分子反应的碰撞理论 1935——建立过渡态理论 1930——提出链反应的动力学理论 第三阶段: 1960 s ---由于激光技术和计算机技术的发展,物理化学各领域向更深度和广度发展 宏观微观 静态动态 体相表相 平衡态非平衡态 物理化学的主要发展趋势与前沿 强化了在分子水平上的强化了对特殊集合态 的 精细物理化学的研究物理化学的研究 分子动态分子设计工程; 表面界面非平衡态 (分子反应动力学; 物理化学物理化学 分子激发态谱学) 4、物理化学学科的战略地位 (1)物理化学是化学科学的理论基础及重要组成学科