
坐标系与参数方程 知识点
1.平面直角坐标系中的坐标伸缩变换
设点P(x,y)是平面直角坐标系中的任意一点,在变换(0):(0)
x x
y y
λλ?μμ'=>??
'=>?的作用
下,点P(x,y)对应到点(,)P x y ''',称?为平面直角坐标系中的坐标伸缩变换,简称伸缩变换.
2.极坐标系的概念 (1)极坐标系
如图所示
,在平面内取一个定点O ,叫做极点,自极点O 引一条射
线Ox ,叫做极轴;再选定一个长度单位,一个角度单位(通常取弧度)及其正方向(通常取逆时针方向),这样就建立了一个极坐标系.
注:极坐标系以角这一平面图形为几何背景,而平面直角坐标系以互相垂直的两条数轴为几何背景;平面直角坐标系内的点与坐标能建立一一对应的关系,而极坐标系则不可.但极坐标系和平面直角坐标系都是平面坐标系.
(2)极坐标
设M 是平面内一点,极点O 与点M 的距离|OM|叫做点M 的极径,记为ρ;以极轴Ox 为始边,射线OM 为终边的角xOM ∠叫做点M 的极角,记为θ.有序数对(,)ρθ叫做点M 的极坐标,记作(,)M ρθ.
一般地,不作特殊说明时,我们认为0,ρ≥θ可取任意实数.
特别地,当点M 在极点时,它的极坐标为(0,θ)(θ∈R).和直角坐标不同,平面内一个点的极坐标有无数种表示.
如果规定0,02ρθπ>≤<,那么除极点外,平面内的点可用唯一的极坐标(,)ρθ表示;同时,极坐标(,)ρθ表示的点也是唯一确定的.
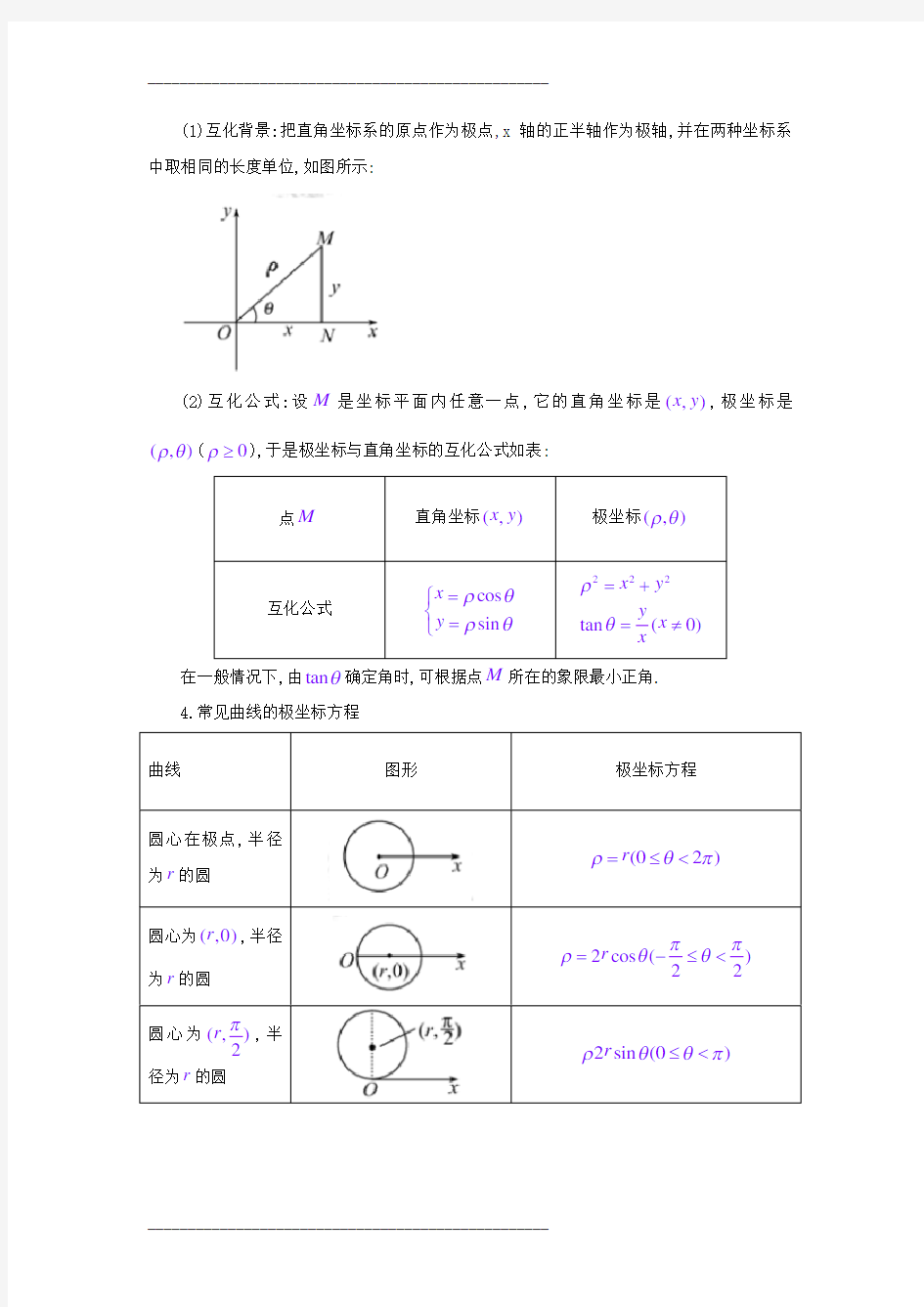
3.极坐标和直角坐标的互化
(1)互化背景:把直角坐标系的原点作为极点,x 轴的正半轴作为极轴,并在两种坐标系中取相同的长度单位,如图所示
:
(2)互化公式:设M 是坐标平面内任意一点,它的直角坐标是(,)x y ,极坐标是
(,)ρθ(0ρ≥),于是极坐标与直角坐标的互化公式如表:
点M
直角坐标(,)x y
极坐标(,)ρθ
互化公式
cos sin x y ρθ
ρθ=??
=?
222
tan (0)x y y
x x
ρθ=+=
≠ 在一般情况下,由tan θ确定角时,可根据点M 所在的象限最小正角. 4.常见曲线的极坐标方程
曲线 图形 极坐标方程
圆心在极点,半径为r 的圆
(02)r ρθπ=≤<
圆心为(,0)r ,半径为r 的圆
2cos ()2
2
r π
π
ρθθ=-
≤<
圆心为(,
)2
r π
,半
径为r 的圆
2sin (0)r ρθθπ≤<
过极点,倾斜角为
α的直线
(1)()()R R θαρθπαρ=∈=+∈或 (2)(0)(0)θαρθπαρ=≥=+≥和
过点(,0)a ,与极轴垂直的直线
cos ()2
2
a π
π
ρθθ=-
<<
过点(,
)2
a π,与极
轴平行的直线
sin (0)a ρθθπ=<<
注:由于平面上点的极坐标的表示形式不唯一,即
(,),(,2),(,),(,),ρθρπθρπθρπθ+-+--+都表示同一点的坐标,这与点的直角坐标的
唯一性明显不同.所以对于曲线上的点的极坐标的多种表示形式,只要求至少有一个能满足极坐标方程即可.例如对于极坐标方程,ρθ=点(
,)44
M ππ
可以表示为5(,2)(,2),444444ππππππππ+-或或(-)等多种形式,其中,只有(,)44
ππ的极坐标满足方程ρθ=.
二、参数方程 1.参数方程的概念
一般地,在平面直角坐标系中,如果曲线上任意一点的坐标,x y 都是某个变数t 的函数
()
()x f t y g t =??
=?
①,并且对于t 的每一个允许值,由方程组①所确定的点(,)M x y 都在这条曲线上,那么方程①就叫做这条曲线的参数方程,联系变数,x y 的变数t 叫做参变数,简称参数,相对于参数方程而言,直接给出点的坐标间关系的方程叫做普通方程.
2.参数方程和普通方程的互化
(1)曲线的参数方程和普通方程是曲线方程的不同形式,一般地可以通过消去参数而从
参数方程得到普通方程.
(2)如果知道变数,x y 中的一个与参数t 的关系,例如()x f t =,把它代入普通方程,求
出另一个变数与参数的关系()y g t =,那么()
()x f t y g t =??
=?
就是曲线的参数方程,在参数方程与
普通方程的互化中,必须使,x y 的取值范围保持一致.
注:普通方程化为参数方程,参数方程的形式不一定唯一。应用参数方程解轨迹问题,关键在于适当地设参数,如果选用的参数不同,那么所求得的曲线的参数方程的形式也不同。
3.圆的参数
如图所示,设圆O 的半径为r ,点M 从初始位置0M 出发,按逆时针方向在圆O 上作匀速圆周运动,设(,)M x y ,则cos ()sin x r y r θ
θθ
=??
=?为参数。
这就是圆心在原点O ,半径为r 的圆的参数方程,其中θ的几何意义是0OM 转过的角度。
圆心为(,)a b ,半径为r 的圆的普通方程是2
2
2
()()x a y b r -+-=,
它的参数方程为:cos ()sin x a r y b r θ
θθ
=+??
=+?为参数。
4.椭圆的参数方程
以坐标原点O 为中心,焦点在x 轴上的椭圆的标准方程为22
221(0),x y a b a b
+=>>其参
数方程为cos ()sin x a y b ?
??=??
=?
为参数,其中参数?称为离心角;焦点在y 轴上的椭圆的标准方
程是22
221(0),y x a b a b +=>>其参数方程为cos (),sin x b y a ???
=??=?为参数其中参数?仍为离心
角,通常规定参数?的范围为?∈[0,2π)。
注:椭圆的参数方程中,参数?的几何意义为椭圆上任一点的离心角,要把它和这一点的旋转角α区分开来,除了在四个顶点处,离心角和旋转角数值可相等外(即在0到2π的范围内),在其他任何一点,两个角的数值都不相等。但当02
πα≤≤
时,相应地也有
选修3—3考点汇编 1、物质是由大量分子组成的 (2)1mol 任何物质含有的微粒数相同2316.0210A N mol -=? (3)对微观量的估算 ①分子的两种模型:球形和立方体(固体液体通常看成球形,空气分子占据的空间看成立方体) ②利用阿伏伽德罗常数联系宏观量与微观量 a.分子质量:mol A M m N = b.分子体积:mol A V v N = c.分子数量:A A A A mol mol mol mol M v M v n N N N N M M V V ρρ= === 2、分子永不停息的做无规则的热运动(布朗运动 扩散现象) (1)扩散现象:不同物质能够彼此进入对方的现象,说明了物质分子在不停地运动,同时还说明分子间有间隙,温度越高扩散越快 (2)布朗运动:它是悬浮在液体中的固体微粒的无规则运动,是在显微镜下观察到的。 ①布朗运动的三个主要特点:永不停息地无规则运动;颗粒越小,布朗运动越明显;温度越高,布朗运动越明显。 ②产生布朗运动的原因:它是由于液体分子无规则运动对固体微小颗粒各个方向撞击的不均匀性造成的。 ③布朗运动间接地反映了液体分子的无规则运动,布朗运动、扩散现象都有力地说明物体内大量的分子都在永不停息地做无规则运动。 (3)热运动:分子的无规则运动与温度有关,简称热运动,温度 越高,运动越剧烈 3、分子间的相互作用力 分子之间的引力和斥力都随分子间距离增大而减小。但是分子 间斥力随分子间距离加大而减小得更快些,如图1中两条虚线 所示。分子间同时存在引力和斥力,两种力的合力又叫做分子 力。在图1图象中实线曲线表示引力和斥力的合力(即分子力) 随距离变化的情况。当两个分子间距在图象横坐标0r 距离时, 分子间的引力与斥力平衡,分子间作用力为零,0r 的数量级为 1010-m ,相当于0r 位置叫做平衡位置。当分子距离的数量级大于 m 时,分子间的作用力变得十 分微弱,可以忽略不计了 4、温度
化学选修4化学反应与原理 第一章化学反应与能量 一、焓变反应热 1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应 (1).符号:△H(2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热)△H为“-”或△H<0 吸收热量的化学反应。(吸热>放热)△H为“+”或△H>0 ☆常见的放热反应:①所有的燃烧反应②酸碱中和反应③大多数的化合反应④金属与酸的反应⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等 ☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl②大多数的分解反应 ③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。 ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 三、燃烧热
1.概念:25℃,101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101kPa②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1mol④研究内容:放出的热量。(ΔH<0,单位kJ/mol) 四、中和热 1.概念:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热。 2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJ/mol 3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。4.中和热的测定实验 五、盖斯定律 1.内容:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的反应热是相同的。 第二章化学反应速率和化学平衡 一、化学反应速率 1.化学反应速率(v) ⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化 ⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示 ⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L·s)
高中物理选修3-4知识及讲义目录: 一、简谐运动 二、机械波 三、电磁波电磁波的传播 四、电磁振荡电磁波的发射和接收 五、振动和波(机械振动与机械振动的传播) 一.简谐运动 1、机械振动: 物体(或物体的一部分)在某一中心位置两侧来回做往复运动,叫做机械振动。机械振动产生的条件是:(1)回复力不为零。(2)阻力很小。使振动物体回到平衡位置的力叫做回复力,回复力属于效果力,在具体问题中要注意分析什么力提供了回复力。 2、简谐振动: 在机械振动中最简单的一种理想化的振动。对简谐振动可以从两个方面进行定义或理解: (1)物体在跟位移大小成正比,并且总是指向平衡位置的回复力作用下的振动,叫做简谐振动。 (2)物体的振动参量,随时间按正弦或余弦规律变化的振动,叫做简谐振动,在高中物理教材中是以弹簧振子和单摆这两个特例来认识和掌握简谐振动规律的。 3、描述振动的物理量 描述振动的物理量,研究振动除了要用到位移、速度、加速度、动能、势能等物理量以外,为适应振动特点还要引入一些新的物理量。 (1)位移x:由平衡位置指向振动质点所在位置的有向线段叫做位移。位移是矢量,其最大值等于振幅。 (2)振幅A:做机械振动的物体离开平衡位置的最大距离叫做振幅,振幅是标量,表示振动的强弱。振幅越大表示振动的机械能越大,做简揩振动物体的振幅大小不影响简揩振动的周期和频率。 (3)周期T:振动物体完成一次余振动所经历的时间叫做周期。所谓全振动是指物体从某一位置开始计时,物体第一次以相同的速度方向回到初始位置,叫做完成了一次全振动。 (4)频率f:振动物体单位时间内完成全振动的次数。 (5)角频率:角频率也叫角速度,即圆周运动物体单位时间转过的弧度数。引入这个参量来描述振动的原因是人们在研究质点做匀速圆周运动的射影的运动规律时,发现质点射影做的是简谐振动。因此处理复杂的简谐振动问题时,可以将其转化为匀速圆周运动的射影进行处理,这种方法高考大纲不要求掌握。 周期、频率、角频率的关系是:。 (6)相位:表示振动步调的物理量。现行中学教材中只要求知道同相和反相两种情况。 4、研究简谐振动规律的几个思路:
部编人教版三年级上册语文知识点归纳总结 第一单元 一、易读错的字。 坪坝(bà)汉族(hàn)鲜艳(yàn)打扮(bàn) 飘扬(yáng)摔跤(shuāi jiāo) 凤尾竹(fèng)洁白(jié) 荒野(huāng)口笛(dí) 罚站(fá)放假(jià) 衣裳(shang)背诵(sòng) 照例(lì)段落(duàn) 练习(liàn)吓呆(dāi)戒尺(jiè) 挨打(ái) 清楚(chǔ) 二、词语听写。 早晨汉族鲜艳服装打扮朗读安静停下粗壮影子落下荒野口笛跳舞狂欢处罚放假互相所以能够猜出扬起双臂绒球花 三、形近字组词。 晨(早晨) 服(服装) 粗(粗壮) 辰(星辰) 报(报纸) 组(小组) 扮(打扮) 扬(扬起) 猜(猜测) 纷(纷纷) 杨(杨树) 情(情况) 荒(荒原) 静(静止) 球(气球) 慌(惊慌) 净(干净) 救(求救) 四、近反义词及多音字。
近义词: 鲜艳——艳丽打扮——装扮绚丽——绚烂 敬爱——敬重飘扬—--飘荡安静——寂静 湿润——潮湿碰触——碰撞欢快——欢乐 一定——肯定流利——流畅霎时——顿时 详细——仔细鸦雀无声—悄然无声 反义词: 安静——热闹古老——年轻粗壮——纤细 洁白——乌黑落下——升起润湿——干燥 详细——简略清楚——模糊糊里糊涂——明明白白鸦雀无声——人声鼎沸 多音字: 更:gèng(更加) gēng(更换) 假:jiǎ(真假) jià(暑假) 背:(bèi)(背诵)(bēi)(背包) 圈:(quān)(圆圈)(juàn)(羊圈) 五、词语积累。 1.成语。 摇头晃脑披头散发张牙舞爪提心吊胆 面红耳赤手忙脚乱眼疾手快口千舌燥 鸦雀无声糊里糊涂绚丽多彩
化学选修4化学反应与原理知识点详解 一、本模块内容的特点 1.理论性、规律性强 2.定量 3.知识的综合性强 4.知识的内容较深 二、本模块内容详细分析 第一章化学反应与能量 一、焓变反应热 1.反应热:化学反应过程中所放出或吸收的热量,任何化学反应都有反应热,因为任何化学反应都会存在热量变化,即要么吸热要么放热。反应热可以分为(燃烧热、中和热、溶解热)2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应.符号:△H.单位:kJ/mol ,即:恒压下:焓变=反应热,都可用ΔH表示,单位都是kJ/mol。 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0 吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0 也可以利用计算△H来判断是吸热还是放热。△H=生成物所具有的总能量—反应物所具有的总能量=反应物的总键能—生成物的总键能=反应物的活化能—生成物的活化能 ☆常见的放热反应:①所有的燃烧反应②所有的酸碱中和反应③大多数的化合反应④金属与水或酸的反应⑤生石灰(氧化钙)和水反应⑥铝热反应等 ☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl②大多数的分解反应③条件一般是加热或高温的反应 ☆区分是现象(物理变化)还是反应(生成新物质是化学变化),一般铵盐溶解是吸热现象,别的物质溶于水是放热。 4.能量与键能的关系:物质具有的能量越低,物质越稳定,能量和键能成反比。 5.同种物质不同状态时所具有的能量:气态>液态>固态 6.常温是指25,101.标况是指0,101. 7.比较△H时必须连同符号一起比较。 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化,即反应热△H,△H对应的正负号都不能省。 ②热化学方程式中必须标明反应物和生成物的聚集状态(s,l, g分别表示固态,液态,气态,水溶液中溶质用aq表示)
高中化学选修4知识点归纳总结 高中化学选修4知识点归纳总结 高中化学选修4知识 化学守恒 守恒是化学反应过程中所遵循的基本原则,在水溶液中的化学反应,会存在多种守恒关系,如电荷守恒、物料守恒、质子守恒等。 1.电荷守恒关系: 电荷守恒是指电解质溶液中,无论存在多少种离子,电解质溶液必须保持电中性,即溶液中阳离子所带的正电荷总数与阴离子所带的负电荷总数相等,用离子浓度代替电荷浓度可列等式。常用于溶液中离子浓度大小的比较或计算某离子的浓度等,例如: ①在NaHCO3溶液中:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-); ②在(NH4)2SO4溶液中:c(NH4+)+c(H+)=c(OH-)+c(SO42—)。 2.物料守恒关系: 物料守恒也就是元素守恒,电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的'。 可从加入电解质的化学式角度分析,各元素的原子存在守恒关系,要同时考虑盐本身的电离、盐的水解及离子配比关系。例如: ①在NaHCO3溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3);
②在NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)。 3.质子守恒关系: 酸碱反应达到平衡时,酸(含广义酸)失去质子(H+)的总数等于碱(或广义碱)得到的质子(H+)总数,这种得失质子(H+)数相等的关系就称为质子守恒。 在盐溶液中,溶剂水也发生电离:H2OH++OH-,从水分子角度分析:H2O电离出来的H+总数与H2O电离出来的OH—总数相等(这里包括已被其它离子结合的部分),可由电荷守恒和物料守恒推导,例如: ①在NaHCO3溶液中:c(OH-)=c(H+)+c(CO32-)+c(H2CO3); ②在NH4Cl溶液中:c(H+)=c(OH-)+c(NH3·H2O)。 综上所述,化学守恒的观念是分析溶液中存在的微粒关系的重要观念,也是解决溶液中微粒浓度关系问题的重要依据。 高中化学选修4必背知识 电解的原理 (1)电解的概念: 在直流电作用下,电解质在两上电极上分别发生氧化反应和还原反应的过程叫做电解.电能转化为化学能的装置叫做电解池. (2)电极反应:以电解熔融的NaCl为例: 阳极:与电源正极相连的电极称为阳极,阳极发生氧化反应:2Cl-→Cl2↑+2e-. 阴极:与电源负极相连的电极称为阴极,阴极发生还原反应:Na++e-→Na.
S S 光的直线传播.光的反射 一、光源 1.定义:能够自行发光的物体. 2.特点:光源具有能量且能将其它形式的能量转化为光能,光在介质中传播就是能量的传播. 二、光的直线传播 1.光在同一种均匀透明的介质中沿直线传播,各种频率的光在真空中传播速度:C =3×108 m/s ; 各种频率的光在介质中的传播速度均小于在真空中的传播速度,即 v 第一章 电场基本知识点总结 (一)电荷间的相互作用 1.电荷间有相互作用力,同种电荷互相排斥,异种电荷相互吸引,两电荷间的相互作用力大小相等,方向相反,作用在同一直线上。 2.库仑定律:在真空中两个点电荷间的作用力大小为F= kQ1Q2/r2, 静电力常量k=9.0×109N ·m2/C2。 (二)电场强度 1.定义式:E=F/q ,该式适用于任何电场. E 与 F 、q 无关只取决于电场本身,与密度ρ类似,密度ρ定义为V m =ρ ,而ρ与m 和V 均无关,只与物质本身的性质有关. (1)场强E 与电场线的关系:电场线越密的地方表示场强越大,电场线上每点的切线方向表示该点的场强方向,电场线的方向与场强E 的大小无直接关系。 (2)场强的合成:场强E 是矢量,求合场强时应遵守矢量合成的平行四边形法则。 (3)电场力:F=qE ,F 与q 、E 都有关。 2.决定式 (1)E=kQ/ r2,仅适用于在真空中点电荷Q 形成的电场,E 的大小与Q 成正比, 与r2成反比。 (2)E=U/d ,仅适用于匀强电场。 d 是沿场强方向的距离,或初末两个位置等势面 间的距离。 3.电场强度是矢量,其大小等于F 与q 的比值,反映电场的强弱; 其方向规定为正电荷受力的方向. 4. 电场强度的叠加是矢量的叠加 空间中若存在着几个电荷,它们在P 点都激发电场,则P 点的电场为这几个电荷单独 在P 点产生电场的场强的矢量合. (三)电势能 1.电场力做功的特点:电场力对移动电荷做功与路径无关,只与始末位的电势差有关,Wab=qUab 2.判断电势能变化的方法 (1)根据电场力做功的正负来判断,不管正负电荷,电场力对电荷做正功,该电荷的 电势能一定减少;电场力对电荷做负功,该电荷的电势能一定增加。 (2)根据电势的定义式U=ε/q 来确定。 (3)利用W=q(Ua-Ub)来确定电势的高低 (四)电势与电势差 1.电场中两点间的电势差公式(两个):U AB =W AB /q ;U AB = 2、电场中某点的电势公式: =W A ∞/q = E A (电势能)/ q (五)静电平衡 把金属导体放入电场中时,导体中的电荷重新分布,当感应电荷产生的附加电场E '与原场强E0叠加后合场强E 为零时,即E= E0 +E '=0,金属中的自由电子停止定向移B A ??-A ?A ? 高二化学选修 4 知识点归纳总结大全 高二部分理科生可能觉得学习化学知识点归纳不重要,可一到考试就不知道怎么去复习了。为了方便大家的时间, 第 1 章、化学反应与能量转化 化学反应的实质是反应物化学键的断裂和生成物化学键的形 成,化学反应过程中伴随着能量的释放或吸收。 一、化学反应的热效应 1、化学反应的反应热 (1)反应热的概念: 当化学反应在一定的温度下进行时,反应所释放或吸收的热量 称为该反应在此温度下的热效应,简称反应热。用符号Q 表示。 (2)反应热与吸热反应、放热反应的关系。 Q0 时,反应为吸热反应;Q0 时,反应为放热反应。 (3)反应热的测定 测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下: Q=-C(T2-T1) 式中C 表示体系的热容,T1、T2 分别表示反应前和反应后体系的温度。实验室经常测定中和反应的反应热。 2、化学反应的焓变 (1)反应焓变 物质所具有的能量是物质固有的性质,可以用称为焓的物理量 来描述,符号为H,单位为kJmol-1。 反应产物的总焓与反应物的总焓之差称为反应焓变,用H 表示。 (2)反应焓变H 与反应热Q 的关系。 对于等压条件下进行的化学反应,若反应中物质的能量变化全 部转化为热能,则该反应的反应热等于反应焓变,其数学表达式为: Qp=H=H( 反应产物)-H( 反应物)。 (3)反应焓变与吸热反应,放热反应的关系: H0,反应吸收能量,为吸热反应。 H0,反应释放能量,为放热反应。 (4)反应焓变与热化学方程式: 把一个化学反应中物质的变化和反应焓变同时表示出来的化学 方程式称为热化学方程式,如:H2(g)+ O2(g)=H2O(l);H(298K)=-285.8kJmol-1 书写热化学方程式应注意以下几点: ①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态 (g)、溶液(aq)。 ②化学方程式后面写上反应焓变H,H 的单位是Jmol-1 或kJmol-1,且H 后注明反应温度。 ③热化学方程式中物质的系数加倍,H 的数值也相应加倍。 3、反应焓变的计算 (1)盖斯定律 对于一个化学反应,无论是一步完成,还是分几步完成,其反 密 线 密 封 线 内 不 得 答 题 七年级下册语文第一单元单元知识点总结 1、邓稼先 一、字音梳理。 懈怠xiè dài 癌症ái 署名sh? 奠基diàn 元勋xūn 孕育yùn 选聘pìn 无垠yín 难堪kān 夐xiòng 黯淡àn 鲜为人知xi ǎn 日曛xūn 挚友zhì 妇孺皆知rú 宰割z ǎi 凛若霜晨l ǐn 铤而走险t ǐng 殷实yīn 殷红yān 彷徨páng huáng 鞠躬尽瘁jū cuì 筹划chóu 邓稼先jià 二、词语解释。 1. 可歌可泣:值得歌颂,使人感动得流泪。 2. 鞠躬尽瘁,死而后已:小心谨慎,贡献出全部精力,直到死为止。 3. 当之无愧:指完全承受某种荣誉或称号,没有什么可以惭愧的。 4. 锋芒毕露:锐气、才干显露无遗。 5. 家喻户晓:家家户户都知道。 6. 马革裹尸:用马匹把尸体包裹起来,指军人战死于战场。 7. 至死不懈:到死都不松懈,形容坚持到底。 8. 截然不同:断然不一样,形容毫无共同之处。 9. 任人宰割:比喻任凭别人欺压,不图反抗。 10. 鲜为人知:很少有人知道。 11. 妇孺皆知:妇女和小孩子都知道,指某件事物众所周知,流传很广。 12. 层出不穷:各种各样的事物和现象没有间断地出现。 13. 燕然勒功:指建立或成就功勋。 三、文学常识。 1.邓稼先,我国研制和发展核武器的重要技术领导人,为我国研制原子弹、氢弹和新型核武器作出了巨大的贡献。1999年,中共中央、国务院、中央军委给他追授了“两弹一星”功勋奖章。 2.杨振宁,美籍华裔物理学家,获1957年诺贝尔物理学奖。 四、重点阅读理解阅读《邓稼先与奥本海默》 1.邓稼先先生喜欢“纯”字,你认为“纯”字代表着什么意思? 朴质、忠厚、无私、没有杂念 2.文革期间发生在邓稼先先生身上有两件什么事情?作者为什么选取文革期间发生的两件事?这对于表现邓稼先有什么作用? 说服两派群众,组织开始工作;说服军宣队和工宣队。 用这两件别人不可能办成的事,来印证“人们知道他没有私心,大们绝对相信他”,强调突出邓稼先朴实的气质、无私的品格。 3.邓稼先是怎样的一个人? 最不引人注目,忠厚平实,真诚坦白,从不骄人,没有小心眼,是“最有中国农民的朴实气质的人”。 4.奥本海模式怎样的一个人?为什么要写他? 他是美国的一个锋芒毕露的拔尖的人物,又是一个复杂的人,通过对比来反衬邓稼先的气质与品格。 5. “人们绝对相信他”的原因是什么? 人们知道他没有私心。 6.文中第5、6两段中都使用了“竟”一词,试品析“竟”的表达作用。 “竟”有出乎意料的意味,表达作者的惊异、钦佩之情,也再次突出邓稼先的性格。 7.“邓稼先是中国几千年传统文化所孕育出来的有最高奉献精神的儿子。” “邓稼先是中国共产党的理想党员。”试阐释这两句话。这两句话在文中有什么作用? 理解:中国几千年的文化讲究人与人之间的和谐,邓稼先正是汲取了这些最优秀的部分,变成自己的气质品格;中国共产党的宗旨是全心全意为人民服务,而邓稼先把这些奉为自己的行为准则因此他是最理想的党员。 作用:赞扬评价邓稼先的奉献精神和崇高品质。 阅读《我不能走》 1.本文段叙述了邓稼先的一件什么事,表现了他的什么精神? 一次实验出现意外,别人劝他离开,他却不愿离开。表现他献身国防科技,无私奉献的精神。 2.一句"我不能走"体现出邓稼先什么样的性格和精神? 坚韧不拔的性格和身先士卒、乐于奉献的精神。 3. "古今多少奇丈夫"中"奇丈夫",作者用以借指邓稼先。 4.这段文字开头的《吊古战场文》渲染了怎样的气氛?对于表现邓稼先的形象有什么作用? 悲壮、凄凉;表现邓稼先工作环境艰苦,突出他为国不辞辛劳、不畏艰难的精神 (文章引用《吊古战场文》有什么作用? 借此暗示邓稼先的工作环境极其艰苦,变现了邓稼先不畏艰难的精神。) 5.请找出文章里有关环境描写的句子,并说说它的作用。 “戈壁滩上常风沙呼啸,气温往往在零下三十多摄氏度。” 作用:渲染了工作环境的恶劣,烘托了以邓稼先为代表的中国核科学家坚强的意志、坚定的信念。 6.结尾部分引"五四"时代的一首歌,作用是什么? 这首歌是邓稼先一生的写照,突出他对中华民族贡献之大。 7.最后为什么要补充"我"父亲喜欢五四时代的那首歌? 写出了父亲在中华民族任人宰割时希望中华振兴,也写出“我”的爱国之情受到了父亲的影响。 8.简答:下面两句话蕴含着作者怎样的感情。 ⑴也不知道稼先在蓬断草枯的沙漠中埋葬同事、埋葬下属的时候是什么心情? 对同事的悼念,对完成遗愿的决心。 ⑵不知稼先在关键性的方案上签字的时候,手有没有颤抖? 一个细腻的询问,充满了对老友真诚的关怀与担忧。 阅读《“两弹”元勋》 1.张爱萍将军称邓稼先为“两弹元勋”,请你列举几条之所以如此称呼的理由。 邓稼先始终站在中国原子武器设计制造和研究的第一线,领导许多学者和技术人员成功地设计了中国的原子弹和氢弹,把中华民族国防自卫武器引导到了世界先进水平。 2.“他得到博士学位后立即回国”一句中“立即”一词表现了邓稼先怎样的思想品质? 热爱祖国 3.摘录段中语句回答: ①概括邓稼先一生的语句是:鞠躬尽瘁,死而后已 ②对邓稼先功绩给予高度评价的词语是:两弹元勋 ③能表明邓稼先为国防武器做出巨大贡献的语句是:把中华民族国防自卫武器引导到了世界先进水平 ④能表明“两弹”爆炸对于中华民族的意义的一句话是:是中华民族完全摆脱任人宰割危机的新生日子。 4.从上文中找出具体的事实,以表明邓稼先真是“鞠躬尽瘁,死而后已”。 临死前还和于敏共同写了一份关于中华人民共和国核武器发展的建议书。 5.段中写邓稼先二次手术期间和于敏写关于中华人民共和国核武器发展建议书这一情节的目的是什么? 用以表现邓稼先的“鞠躬尽瘁,死而后已”的崇高品质。 高中化学选修4知识点分类总结 第一章化学反应与能量 一、焓变反应热 1.反应热:一定条件下,一定物质的量的反应物之 间完全反应所放出或吸收的热量 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应(1).符号:△ H (2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热放出热量的化学反应。(放热>吸热) △H 为“—”或△H <0吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0☆常见的放热反应:①所有的燃烧反应②酸碱中和反应③大多数的化合反 应④金属与酸的反应⑤生石灰和水反 应⑥浓硫酸稀释、氢氧化钠固体溶解等☆常见的吸热反应:①晶体Ba(OH) 2?8H2O与NH4Cl ②大多数的分解反应③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等二、热化学方程式书写化学方程式注意要点: ①热化学方程式必须标出能量变化。②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示)③热化学反应方程式要指明反应时的温度和压强。④热化学方程式中的化学计量数可以是整数,也可以是分数⑤各物质系数加倍,△H 加倍;反应逆向进行,△H改变符号,数值不变三、燃烧热1.概念:25 ℃,101 kPa 时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。※注意以下几点:①研究条件:101 kPa②反应程度:完全燃烧,产物是稳定的氧化物。③燃烧物的物质的量:1 mol④研究内容:放出的热量。(ΔH<0,单位kJ/mol)四、中和热1.概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为:H+(aq) +OH-(aq) =H2O(l) ,ΔH=-57.3kJ/mol3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热 小于57.3kJ/mol。 4.中和热的测定实验五、盖斯定律1.内容:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成的 反应热是相同的。 第二章化学反应速率和化学平衡 一、化学反应速率1. 化学反应速率(v)⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L?s)⑷影响因素:①决定因素(内因):反应物的性质(决定因素)②条件因素(外因):反应所处的条 件 外因对化学反应速率影响的变化规律 电化学基础 一、原电池 课标要求 1、掌握原电池的工作原理 2、熟练书写电极反应式和电池反应方程式 要点精讲 1、原电池的工作原理 (1)原电池概念:化学能转化为电能的装置,叫做原电池。 若化学反应的过程中有电子转移,我们就可以把这个过程中的电子转移设计成定向的移动,即形成电流。只有氧化还原反应中的能量变化才能被转化成电能;非氧化还原反应的能量变化不能设计成电池的形式被人类利用,但可以以光能、热能等其他形式的能量被人类应用。 (2)原电池装置的构成 ①有两种活动性不同的金属(或一种是非金属导体)作电极。 ②电极材料均插入电解质溶液中。 ③两极相连形成闭合电路。 (3)原电池的工作原理 原电池是将一个能自发进行的氧化还原反应的氧化反应和还原反应分别在原电池的负极和正极上发生,从而在外电路中产生电流。负极发生氧化反应,正极发生还原反应,简易记法:负失氧,正得还。 2、原电池原理的应用 (1)依据原电池原理比较金属活动性强弱 ①电子由负极流向正极,由活泼金属流向不活泼金属,而电流方向是由正极流向负极,二者是相反的。 ②在原电池中,活泼金属作负极,发生氧化反应;不活泼金属作正极,发生还原反应。 ③原电池的正极通常有气体生成,或质量增加;负极通常不断溶解,质量减少。 (2)原电池中离子移动的方向 ①构成原电池后,原电池溶液中的阳离子向原电池的正极移动,溶液中的阴离子向原电池的负极移动; ②原电池的外电路电子从负极流向正极,电流从正极流向负极。 注:外电路:电子由负极流向正极,电流由正极流向负极; 内电路:阳离子移向正极,阴离子移向负极。 3、原电池正、负极的判断方法: (1)由组成原电池的两极材料判断 一般是活泼的金属为负极,活泼性较弱的金属或能导电的非金属为正极。 (2)根据电流方向或电子流动方向判断。 电流由正极流向负极;电子由负极流向正极。 (3)根据原电池里电解质溶液内离子的流动方向判断 在原电池的电解质溶液内,阳离子移向正极,阴离子移向负极。 (4)根据原电池两极发生的变化来判断 原电池的负极失电子发生氧化反应,其正极得电子发生还原反应。 (5)根据电极质量增重或减少来判断。 工作后,电极质量增加,说明溶液中的阳离子在电极(正极)放电,电极活动性弱;反之,电极质量减小,说明电极金属溶解,电极为负极,活动性强。 (6)根据有无气泡冒出判断 电极上有气泡冒出,是因为发生了析出H2的电极反应,说明电极为正极,活动性弱。 本节知识树 光的直线传播的考点分析 考点:平面镜的特点: ①光线的角度变化关系 入射角改变多少,反射角改变多少 平面镜转动θ角,入射角改变θ,反射光线的反射角改变2θ角。 ②运动关系 镜不动,物像移动的速度大小相等,方向相反。 当物不动,平面镜与物像的连线的夹角为θ时,平面镜移动的速度V1和像移动的速度V2的关系为:V2=2V1sin θ。 ③物像关系(透视关系) 大小相等,正立的虚像,像、物关于平面镜对称,左右颠倒 (平面镜内成的像,若在平面镜后面透视,看到即为实际) ④光源在两相交的平面镜内的成像个数 1 2-= θ π n 考点:平面镜成像作图 物像对称定光路,入射、反射两角度;光路可逆巧应用,虚实、箭头尺规图。 考点:发生折射的两个面平行,则出射光线与入射光线平行。 考点:介质的折射率测定的方法 1、用折射法测定 1、如图所示,一储油桶,底面直径与高均为d ,当桶内无油时,从某点A 恰能看到桶底边缘上的某点B 。当桶内油的深度等于桶高一半时,由A 沿AB 方向看去,看到桶底上的点C ,两点C 、B 相距d/4,求油的折射率和光在油中传播速度。 答案: B C 图 A 如图所示,因底面直径与桶高相等,由此可知 ∠AOF=∠ABG=450;由OD=2CD 可知∠COD 的正弦 51sin 2 2 = += ∠OD CD CD COD 油的折射率 210 5/12/1sin sin = =∠∠= COD AOF n 油中的传播速度 s m s m n c v /109.1/2/10100.388?=?== 2、如图所示,将刻度尺直立在装满某种透明液体的广口瓶中,从刻度尺上A 和B 两点射出的光线AC 和BC 在C 点被折射和反射都沿直线CD 传播,已知刻度尺上两相邻两根刻度线间的距离为10cm ,刻度尺在右边缘与广口瓶右内壁之间的距离d=25cm ,则瓶内流体的折射率为多少? 2、全反射法测定液体的折射率 考点:全反射的应用—光导纤维 光在光导纤维中传播时,光程为纤维长度的n 倍,其中n 为纤维的折射率。S=nL 1、如图所示,长为L 、折射率为n 的玻璃砖,若光线从A 射入恰好在其中发生全反射,经过多次全反射后恰好从B 端射出。光在真空中的速度为c ,求光从A 到B 的时间。 光线通信是一种现代化的通信手段,它可以提供大容量、高速度、高质量的通信服务,为了研究问题的方便,我们将光导纤维简化为一根长直的玻 B C 图 A G O D E F B C D 图 1 2 3 4 A A A L 图 科学八年级下册第一章知识要点归纳整理 1、磁极间的相互作用是:同名磁极互相排斥,异名磁极互相吸引。 2、磁体可分为天然磁体和人造磁体,通常我们看到和使用的磁体都是人造磁体,它们都能长期保持磁性,通称为永磁体。 3、磁化:使原来没有磁性的物体得到磁性的过程。 4、磁性:磁铁能吸引铁、钴、镍等物质,磁铁的这种性质叫做磁性。 5、磁体:具有磁性的物质叫做磁体。 6、磁极;磁体各部分的磁性强弱不同,磁体上磁性最强的部分叫做磁极,它的位置在磁体的两端。 可以自由转动的磁体,静止后恒指南北。为了区别这两个磁极,我们就把指南的磁极叫南极,或称S 极;另一个指北的磁极叫北极,或称N极。 铁棒被磁化后,磁性容易消失,称为软磁体。钢被磁化后,磁性能够长期保持,称为硬磁体或永磁体,钢是制造永磁体的好材料。人造磁体就是永磁体。 7、磁场: 磁场的基本性质:它对放入其中的磁体产生磁力的作用,磁体间的相互作用是通过磁场而发生的。磁场的方向:在磁场中某一点,小磁针静止时北极所指的方向就是该点的磁场方向。 磁场的方向:在磁场中某一点,小磁针静止时北极所指的方向就是该点的磁场方向。 8、磁感线: 为了形象地描述磁体周围的磁场,英国物理学家法拉第引入了磁感 线:依照铁屑排列情况,画出一些带箭头的曲线。方向都跟放在该点的 磁针北极所指的方向一致,这些曲线叫磁感应线、简称磁感线。 9、磁感线的特点: (1)在磁体外部,磁感线由磁体的北极(N极)到磁体的南极(S极)。 (2)磁感线的方向就是该点小磁针北极受力的方向,也就是小磁针静止后北极所指的方向。 (3)磁感线密的地方表示该点磁场强,即磁感线的疏密表示磁场的强弱。 (4)在空间每一点只有一个磁场方向,所以磁感线不相交。 10、地磁场 地磁场:地球产生的磁场。 地磁北极在地理南极附近,地磁南极在地理北极附近。 地球南北极与地磁的南北极并不重合,它们之间存在的一个50夹角, 叫磁偏角。 11、奥斯特实验 现象:导线通电,周围小磁针发生偏转;通电电流方向改变,小磁 针偏转方向相反. 结论:通电导线周围存在磁场;磁场方向与电流方向有关. 12、直线电流的磁场 直线电流的磁场的分布规律: 以导线上各点为圆心的一个 个同心圆,离直线电流越近,磁 性越强,反之越弱。 13、安培定则(一) 化学选修4化学反应与原理 章节知识点梳理 第一章化学反应与能量 一、焓变反应热 1.反应热:化学反应过程中所放出或吸收的热量,任何化学反应都有反应热, 因为任何化学反应都会存在热量变化,即要么吸热要么放热。反应热可以分为(燃烧热、中和热、溶解热) 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应.符号:△H.单位:kJ/mol ,即:恒压下:焓变=反应热,都可用ΔH表示,单位都是kJ/mol。 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0 吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0 也可以利用计算△H来判断是吸热还是放热。△H=生成物所具有的总能量-反应物所具有的总能量=反应物的总键能-生成物的总键能 ☆常见的放热反应:①所有的燃烧反应②所有的酸碱中和反应③大多数的化合反应④金属与水或酸的反应⑤生石灰(氧化钙)和水反应⑥铝热反应等 ☆常见的吸热反应:①晶体Ba(OH)2·8H2O与NH4Cl②大多数的分解反应③条件一般是加热或高温的反应 ☆区分是现象(物理变化)还是反应(生成新物质是化学变化),一般铵盐溶解是吸热现象,别的物质溶于水是放热。 4.能量与键能的关系:物质具有的能量越低,物质越稳定,能量和键能成反比。 5.同种物质不同状态时所具有的能量:气态>液态>固态 6.常温是指25,101.标况是指0,101. 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化,即反应热△H,△H对应的正负号都不能省。 ②热化学方程式中必须标明反应物和生成物的聚集状态(s,l, g分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式不标条件,除非题中特别指出反应时的温度和压强。 ④热化学方程式中的化学计量数表示物质的量,不表示个数和体积,可以是整 数,也可以是分数 ⑤各物质系数加倍,△H加倍,即:△H和计量数成比例;反应逆向进行,△H 改变符号,数值不变。 6.表示意义:物质的量—物质—状态—吸收或放出*热量。 三、燃烧热 1.概念: 101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物(二氧化碳、二 氧化硫、液态水H2O)时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101 kPa ②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量: 1 mol ④研究内容:放出的热量。(ΔH<0,单位kJ/mol) 2.燃烧热和中和热的表示方法都是有ΔH时才有负号。 3.石墨和金刚石的燃烧热不同。不同的物质燃烧热不同。 高考物理选修3-4知识点浓缩总结 选修3-4知识点67—81为选修3-3知识点(本地区不选,略)82.简谐运动简谐运动的表达式和图象Ⅱ1、机械振动:物体(或物体的一部分)在某一中心位置两侧来回做往复运动,叫做机械振动。机械振动产生的条件是... 82.简谐运动简谐运动的表达式和图象Ⅱ1、机械振动:物体(或物体的一部分)在某一中心位置两侧来回做往复运动,叫做机械振动。机械振动产生的条件是:(1)回复力不为零。(2)阻力很小。使振动物体回到平衡位置的力叫做回复力,回复力属于效果力,在具体问题中要注意分析什么力提供了回复力。2、简谐振动:在机械振动中最简单的一种理想化的振动。对简谐振动可以从两个方面进行定义或理解:(1)物体在跟位移大小成正比,并且总是指向平衡位置的回复力作用下的振动,叫做简谐振动。(2)物体的振动参量,随时间按正弦或余弦规律变化的振动,叫做简谐振动,在高中物理教材中是以弹簧振子和单摆这两个特例来认识和掌握简谐振动规律的。3、描述振动的物理量,研究振动除了要用到位移、速度、加速度、动能、势能等物理量以外,为适应振动特点还要引入一些新的物理量。(1)位移x:由平衡位置指向振动质点所在位置的有向线段叫做位移。位移是矢量,其最大值等于振幅。(2)振幅A:做机械振动的物体离开平衡位置的最大距离叫做振幅,振幅是标量,表示振动的强弱。振幅越大表示振动的机械能越大,做简揩振动物体的振幅大小不影响简揩振动的周期和频率。(3)周期T:振动物体完成一次余振动所经历的时间叫做周期。所谓全振动是指物体从某一位置开始计时,物体第一次以相同的速度方向回到初始位置,叫做完成了一次全振动。(4)频率f:振动物体单位时间内完成全振动的次数。(5)角频率:角频率也叫角速度,即圆周运动物体单位时间转过的弧度数。引入这个参量来描述振动的原因是人们在研究质点做匀速圆周运动的射影的运本.文,来.源,于.贵,州.学,习.网, 动规律时,发现质点射影做的是简谐振动。因此处理复杂的简谐振动问题时,可以将其转化为匀速圆周运动的射影进行处理,这种方法高考大纲不要求掌握。 第一章导论 1. 宏观描述方法和微观描述方法 热力学是热物理学的宏观理论,而统计物理学则是热物理学的微观理论. 2. 热力学系统的平衡态 在不受外界条件的影响下,经过足够长时间后系统必将达到一个宏观上看来不随时间变化的状态,这才是平衡态 判断是否平衡态的标准:有无热流与粒子流. 力学平衡条件:通常情况下,表现为压强处处相等 热学平衡条件:温度处处相等(无热流) 化学平衡条件:无外场作用下,系统各部分的化学组成处处相同 只有在外界条件不变的情况下同时满足力学平衡条件、热学平衡条件和化学平衡条件的系统,才不会存在热流与粒子流,才处于平衡态。 3.热力学第零定律和温标 热力学第零定律的物理意义:互为热平衡的物体之间必存在一个相同的特征-----它们的温度是相同的 温标是温度的数值表示法 建立经验温标的三个要素: (1)选择某种测温物质,确定它的测温属性(某种属性随着冷热程度的改变而单调、显著的改变) (2)选定固定点(如水的沸点为100℃,冰的正常熔点是0℃) (3)进行分度 水的三相点温度为273.16k,冰点温度为273.15k 热力学温标为基本温标 摄氏温标、理想气体温标和热力学温标 4、物态方程 处于平衡态的某种物质的热力学参量(如压强、体积、温度)之间所满足的函数关系称为这种物质的物态方程,或称状态方程。物态方程都显含有温度T。 只有在压强趋于零时的气体才是理想气体,在理想气体条件下,一切不同化学组成的气体在热学性质上的差异趋于消失。 理想气体物态方程:R=8.31普适气体常量另一形式:p=nkT 能严格满足理想气体物态方程的气体才是理想气体,理想气体虽然是一种理想模型,但常温 选修3—3期末复习知识点汇总 1、物质是由大量分子组成的 (1)单分子油膜法测量分子直径-V=Sd V 是滴入浅水盘中纯油酸的体积,等于油酸溶液的体积乘以浓度。S 是单分子油膜在水面上形成的面积。 (2)1mol 任何物质含有的微粒数相同2316.0210A N mol -=? (3)对微观量的估算 ①分子的两种模型:球形和立方体(固体液体通常看成球形,空气分子占据的空间看成立方体) ②利用阿伏伽德罗常数联系宏观量与微观量 a.分子质量:mol A M m N = b.分子体积:mol A V v N =【固体和液体-分子体积,气体--分子平均占有空间体积】 c.分子数量:A A A A mol mol mol mol M v M v n N N N N M M V V ρρ= ===【M-任意质量;v--任意体积】 2、分子永不停息的做无规则的热运动(布朗运动 扩散现象) (1)扩散现象:不同物质能够彼此进入对方的现象,说明了物质分子在不停地运动,同 时还说明分子间有间隙,温度越高扩散越快 (2)布朗运动:它是悬浮在液体中的固体颗粒的无规则运动,不是分子热运动,但颗粒很小,是在显微镜下才能观察到的。 ①布朗运动的三个主要特点:永不停息地无规则运动;颗粒越小,布朗运动越明 显;温度越高,布朗运动越明显。 ②产生布朗运动的原因:它是由于液体分子无规则运动对固体微小颗粒各个方向 撞击的不均匀性造成的。 ③布朗运动间接地反映了液体分子的无规则运动,扩散现象的产生原因是物体分 子做无规则热运动。两者都有力地说明分子在永不停息地做无规则运动。 (3)热运动:分子的无规则运动与温度有关,简称热运动,温度越高,运动越剧烈。 布朗运动不是分子热运动,扩散现象是分子热运动。 3、分子间的相互作用力 分子之间的引力和斥力都随分子间距离增大而减小。但是分子间 斥力随分子间距离加大而减小得更快些,如图1中两条虚线所示。 分子间同时存在引力和斥力,两种力的合力又叫做分子力,随距 离的增加,分子力先减小,后增加,再减小。。在图1图象中实 线曲线表示引力和斥力的合力(即分子力)随距离变化的情况。当 两个分子间距在图象横坐标0r 距离时,分子间的引力与斥力平 衡,分子间作用力为零,0r 的数量级为1010-m ,相当于0r 位置叫物理选修31第一章知识点总结
最全面高二化学选修4知识点归纳总结大全(精华版)
七年级下册语文第一单元单元知识点总结31445教学内容
高中化学选修4知识点分类总结
新人教版高中化学选修4知识点总结:第四章电化学基础
选修34和35知识点总结
浙教版科学八年级下册第一章知识点归纳教学提纲
【最新】高中化学选修4知识点分类总结(1)
高考物理选修3-4知识点浓缩总结
大学物理热学第一章知识点整理
高中物理选修3-3知识点整理