初中化学酸碱盐溶解性表
- 格式:doc
- 大小:61.50 KB
- 文档页数:4


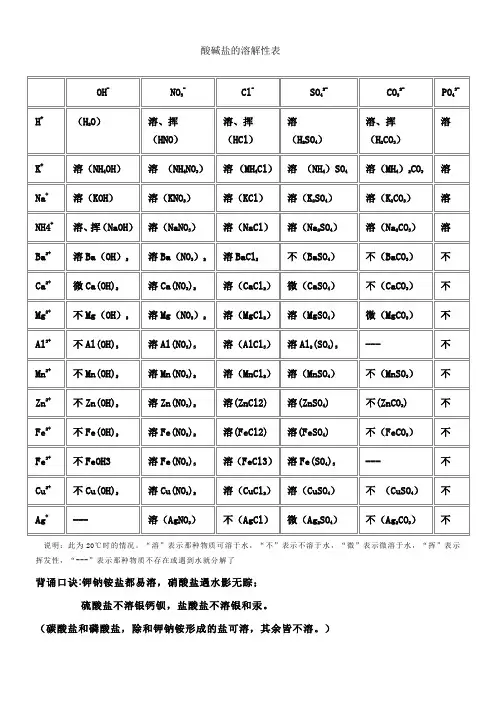
第 1 页 决战2019中考:酸碱盐溶解性表 阴离子(横) 阳离子(纵) OH+ NO3+ Cl+ SO4 2- CO3 2- H+ 溶、挥 溶、挥【无色溶液】 溶 溶、挥【无色溶液】 NH4+ 溶、挥 溶 溶【白粉末】 溶【无色结晶体、溶液】 溶 K+ 溶 溶 第 2 页
溶【白固体】 溶【无色结晶体、溶液】 溶【白色固体】 Na+ 溶 溶 溶【白色固体】 溶【无色溶液,白色晶体】 溶【白粉末】 Ba2+ 溶 溶 溶【白色粉末】 不【白,不溶于硝酸】 不【白】 Ca2+ 微【白】 溶 溶【白色固体】 微【白】 不【白】 Mg2+ 第 3 页
不【白】 溶 溶【白色固体】 溶【无色溶液】 微【无色溶液白色粉末】 Al3+ 不【白】 溶 溶【白色粉末】 溶【无色溶液,灰色粒状结晶体】 Mn2+ 不【白色到浅桃红色结晶】 溶 溶【浅粉溶液,粉红固体】 溶【白色至浅红色粉末,浅红溶液】 不【白】 Zn2+ 不【无色斜方晶体】 溶 溶【白色粉末,无色溶液】 溶【无色溶液】 不【白】 第 4 页
Fe2+ 不【白】 溶 溶【浅绿色溶液】 溶【白色粉末,浅绿色溶液】 不【土黄色粉末】 Fe3+ 不【红褐色】 溶 溶【黄色溶液】 溶【黄色溶液】 Cu2+ 不【蓝】 溶 溶【蓝色溶液】 溶【蓝色溶液】 不【绿】 Ag+ ——【白,遇水分解】 溶 不【白,不溶于硝酸】 微【白灰色】 第 5 页
不【白】



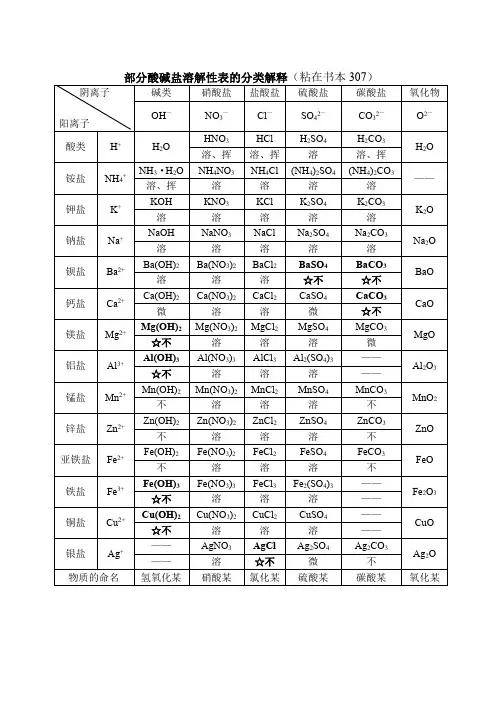
部分酸碱盐溶解性表的分类解释(粘在书本307)阴离子阳离子碱类硝酸盐盐酸盐硫酸盐碳酸盐氧化物
OH—NO3—Cl—SO42—CO32—O2
—
酸类H+H2OHNO3HClH2SO4H2CO3H2O溶、挥溶、挥溶溶、挥
铵盐NH4+NH3·H2ONH4NO3NH4Cl(NH4)2SO4(NH4)2CO3——溶、挥溶溶溶溶
钾盐K+KOHKNO3KClK2SO4K2CO3K2O
溶溶溶溶溶
钠盐Na+NaOHNaNO3NaClNa2SO4Na2CO3Na2O
溶溶溶溶溶
钡盐Ba2+Ba(OH)2Ba(NO3)2BaCl2BaSO4BaCO3BaO
溶溶溶☆不☆不
钙盐Ca2+Ca(OH)2Ca(NO3)2CaCl2CaSO4CaCO3CaO
微溶溶微☆不
镁盐Mg2+Mg(OH)2Mg(NO3)2MgCl2MgSO4MgCO3MgO
☆不溶溶溶微
铝盐Al3+Al(OH)3Al(NO3)3AlCl3Al2(SO4)3——
Al2O3☆不溶溶溶——
锰盐Mn2+Mn(OH)2Mn(NO3)2MnCl2MnSO4MnCO3MnO
2不溶溶溶不
锌盐Zn2+Zn(OH)2Zn(NO3)2ZnCl2ZnSO4ZnCO3ZnO
不溶溶溶不
亚铁盐Fe2+Fe(OH)2Fe(NO3)2FeCl2FeSO4FeCO3FeO
不溶溶溶不
铁盐Fe3+Fe(OH)3Fe(NO3)3FeCl3Fe2(SO4)3——
Fe2O3☆不溶溶溶——
铜盐Cu2+Cu(OH)2Cu(NO3)2CuCl2CuSO4——
CuO☆不溶溶溶——
银盐Ag+——AgNO3AgClAg2SO4Ag2CO3Ag2O
——溶☆不微不
物质的命名氢氧化某硝酸某氯化某硫酸某碳酸某氧化某多功能备注
1、元素化合价口诀:一价氢氯钾钠银;二价氧钙钡镁锌;三铝四硅五氮磷;二三铁二四碳;二四六硫全都齐;铜以二价最常见。金正非负单质零,正负总价和为零。原子团化合价口诀:负一硝酸氢氧根,负二硫酸碳酸根。负三记住磷酸根,正一价的是铵根。2、溶解性口诀:钾钠铵,硝与酸,全都溶,影无终;氯化物,银不溶,硫酸物,钡不溶;碳酸物,钾钠铵,其余都不溶;碱类物,钾钠铵,还加钡,余不溶3、溶液颜色口诀:铜蓝、亚铁绿、铁黄、高锰酸钾紫4、复分解反应的特点:双交换、价不变5、复分解反应的条件:产物中有水、气体或沉淀6、酸碱盐溶解性口诀:八大沉淀——“一蓝一红褐六白”●蓝色:Cu(OH)2●红褐色:Fe(OH)3
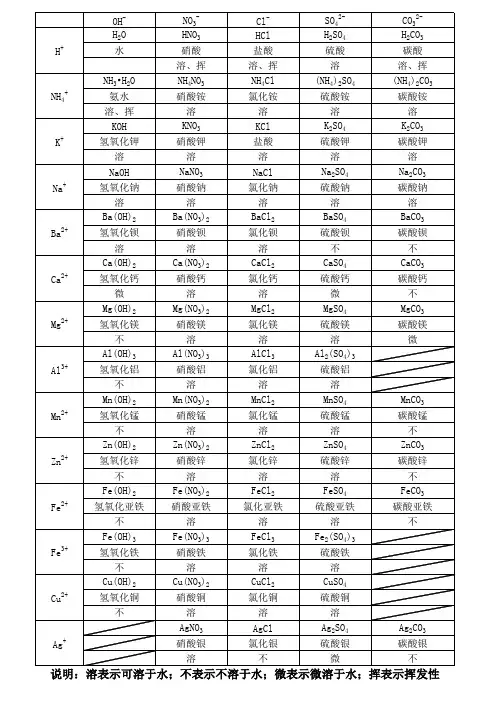

《酸、碱、盐溶解性表》兴山县古夫镇初级中学袁书宏设计思路:常见酸、碱、盐的溶解性表是中学化学教学和学习一张十分重要的工具表,酸、碱、盐溶解性表提供的信息十分丰富:认识初中化学常见的阴离子、阳离子、酸根离子、金属离子,认识阴、阳离子两两结合构成的常见化合物——酸、碱、盐、氧化物,可溶性的酸、碱、盐在溶液中解离出的阴、阳离子,查常见酸、碱、盐的溶解性,多角度对酸、碱、盐分类,离子的性质等信息。
新课的教学中,学生对酸、碱、盐溶解性表只经历了初步接触和识记→初步应用。
人教版初中化学《酸和碱》、《盐化肥》两个单元教材内容起点低、落点高,知识点多,涉及面广,综合性强、易混淆易忘记、应用更难等特点,导致学生学习酸、碱、盐知识时觉得乱,心里没信心,错误率高。
仔细分析学生错误的原因,关键是学生在学习酸碱盐的内容时,对以下几个难点没有掌握好:①酸、碱、盐概念的理解;②酸、碱、盐的分类;③复分解反应实质的掌握和应用;④常见物质的检验。
这些问题的解决在溶解性表中都有很好的体现,因此,对酸、碱、盐的溶解性表要进行专题学习,全面理解溶解性表提供的信息,加深记忆,扩大应用,使它更好的为教学服务,突破学生在学习酸、碱、盐知识时的难点。
通过对溶解性表的全面认识和理解,还可以帮学生建立离子观、物质观、分类观等化学基本观念,用化学知识和化学观念解决实际问题,逐步形成化学思想。
教学目标:1.认识常见的离子,建立离子观,从离子的观点加深对酸碱盐的概念。
2.从多角度对酸碱盐分类,建立分类观。
3.根据溶液中离子的反应规律,记住酸碱盐溶解性表,能用酸碱盐的溶解性表解决实际问题。
教学过程:板书设计:《酸、碱和盐溶解性表》一、认识酸、碱、盐1.酸→H++ 酸根离子2.碱→金属离子 + OH-3.盐→金属离子 + 酸根离子二、溶液中离子间的反应规律NH4+Ba2+ CO32Mg2+Ca2-Al3+Zn2+OH-H+CO32-Zn2+Fe2+Fe3+Fe2+Cu2+Ag+ Cl-附:检测反馈酸碱盐溶解性表是学习化学的重要工具,下表列出了部分酸碱盐在20℃的溶解性,我能完成下列各题:1.查:Ba(OH)2溶解性是;2.写:按要求写出下列物质的化学式①一种挥发性的酸;②不溶于水的碱;③微溶于水的盐。
一、干燥剂 1. 使用干燥剂的目的是除去气体中混有的水蒸气。
2.我们学过的干燥剂有氢氧化钠、浓硫酸、氧化钙、氯化钙等。
氢氧化钠易潮解;浓硫酸具有吸水性;而氧化钙可以与水反应:CaO+H 2O=Ca(OH)2 3.氢氧化钠氢氧化钠等碱性干燥剂不能干燥氯化氢、二氧化碳、二氧化硫等酸性气体。
4. 浓硫酸浓硫酸等酸性干燥剂不能干燥氨气等碱性气体。
二、酸的定义和分类酸:物质溶于水时,形成的阳离子全部是H +的化合物。
由于酸、碱、盐溶于水时会电离出阴、阳离子,所以酸、碱、盐的水溶液具有导电性。
酸的电离:HCl=H ++Cl -,H 2SO 4=2H ++SO 42-三、碱的定义和分类碱:物质溶于水时,形成的阳离子全部是OH -的化合物。
四、氢氧化钠和氢氧化钙部分变质 1.氢氧化钠部分变质的证明方法:① 取样,(如果是固体,就需要加适量水,使固体完全溶解),加过量的氯化钙(或硝酸钙)溶液,如果有白色沉淀产生,说明碳酸钠存在:Na 2CO 3+CaCl 2=2NaCl+CaCO 3↓ 或 Na 2CO 3+Ca(NO 3)2=2NaNO 3+CaCO 3↓② 过滤,向滤液中滴加酚酞溶液,如果滤液变红,说明氢氧化钠存在,氢氧化钠部分变质。
2.氢氧化钙固体部分变质的证明方法:① 取样,加适量水使固体完全溶解,加入过量的稀盐酸,如果有气泡产生,说明碳酸钙存在:CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑② 另取少量固体,加氯化铵(或硫酸铵)研磨,如果闻到刺激性氨味,说明氢氧化钙存在,氢氧化钙部分变质:Ca(OH)2+2NH 4Cl=CaCl 2+2NH 3↑+2H 2O 或 Ca(OH)2+(NH 4)2SO 4=CaSO 4+2NH 3↑+2H 2O 3.在所有的复分解反应中,中和反应优先发生,并且反应可以瞬时完成。
中和反应是放热的反应。
中和反应同氧化反应、还原反应一样,是特征反应,不属于四大基本反应类型。
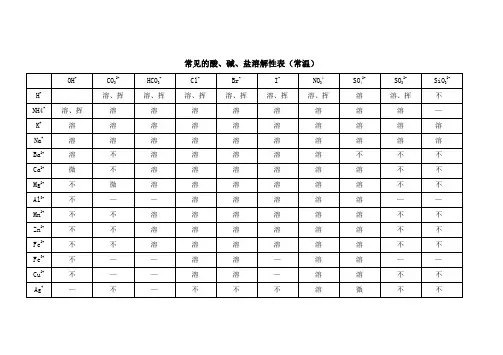
阳离子
阴离子
OH- NO3 Cl-
SO4 S SO3 CO3 SiO3 PO4
H+ 溶、挥 溶、挥 溶 溶、挥 溶、挥 溶、挥 不 溶
NH4
溶、挥 溶 溶 溶 溶 溶 溶 溶 溶
K+
溶 溶 溶 溶 溶 溶 溶 溶 溶
Na+
溶 溶 溶 溶 溶 溶 溶 溶 溶
Ba2+
溶 溶 溶 不 溶 不 不 不 不
Ca2+
微 溶 溶 微 微 不 不 不 不
Mg2+
不 溶 溶 溶 溶 微 微 不 不
Al3+
不 溶 溶 溶 - - - 不 不
Mn2+
不 溶 溶 溶 不 不 不 不 不
Zn2+
不 溶 溶 溶 不 不 不 不 不
Cr3+
不 溶 溶 溶 - - - 不 不
Fe2+
不 溶 溶 溶 不 不 不 不 不
Fe3+
不 溶 溶 溶 - - - 不 不
Sn2+
不 溶 溶 溶 不 - - - 不
Pb2+
不 溶 微 不 不 不 不 不 不
Bi3+
不 溶 - 溶 不 不 不 - 不
Cu2+
不 溶 溶 溶 不 不 不 不 不
Hg+
- 溶 不 微 不 不 不 - 不
Hg2+
- 溶 溶 溶 不 不 不 - 不
Ag+
- 溶 不 微 不 不 不 不 不
+
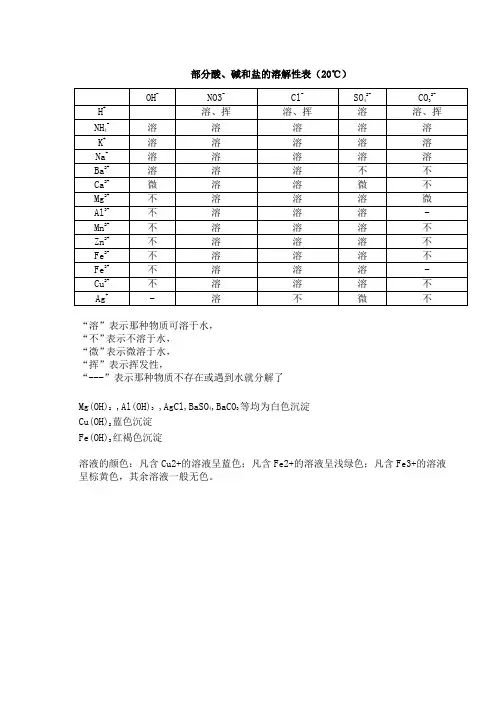
酸、碱、盐溶解性表(20℃)
-
2- 2- 2- 2- 2- 3-
溶解性口诀一
钾,钠,铵,盐,硝酸盐
,
都能溶解水中间
.
盐酸盐不溶银,亚汞
,
硫酸盐不溶钡和铅, 微溶有钙银
碳酸盐多不溶,溶者只有钾钠铵 (除了镁,微溶)
钾,钠,铵,钡碱都溶(钙微溶)
溶解性口诀二
钾钠铵盐溶水快 , ① 硫酸盐除去钡铅钙。 ② 氯化物不溶氯化银, 硝酸盐溶液都透明。 ③ 口诀
中未有皆下沉。 ④ 注: ①钾钠铵盐都溶于水; ②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶; ③硝
酸盐都溶于水; ④口诀中没有涉及的盐类都不溶于水;
溶解性口诀三
钾、钠、铵盐、硝酸盐; 氯化物除银、亚汞; 硫酸盐除钡和铅; 碳酸、磷酸盐,只溶钾、钠、铵。
说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀四
钾钠铵硝皆可溶、盐酸盐不溶银亚汞;
硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶
溶解性口诀五
钾、钠、硝酸溶, (钾盐、钠盐和硝酸盐都溶于水。)
盐酸除银(亚)汞, (盐酸盐里除氯化银和氯化亚汞外都溶。)
再说硫酸盐,不容有钡、铅, (硫酸盐中不溶的是硫酸钡和硫酸铅。)
其余几类盐, (碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)
只溶钾、钠、铵, (只有相应的钾盐、钠盐和铵盐可溶)
最后说碱类,钾、钠、铵和钡。 (氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住。
溶解性口诀六
钾钠铵盐硝酸盐
完全溶解不困难
氯化亚汞氯化银
硫酸钡和硫酸铅
生成沉淀记心间
氢硫酸盐和碱类
碳酸磷酸硝酸盐
可溶只有钾钠铵
溶解性口诀七(仅适用于初中)
硝酸盐可溶钾,钠,铵
硝酸盐入水无踪影
氯化物不溶氯化银
硫酸盐不溶硫酸钡
碳酸盐只溶钾,钠,铵
碱溶钡和钾,钠,铵
溶解性口诀八(可适用于初中)
钾钠硝铵皆可溶 (化合物中含钾、钠、硝酸、铵根,都可溶解)
盐酸不溶银亚汞 (氯化银,氯化亚汞沉淀)
硫酸铅钡不溶解 (硫酸铅,硫酸钡沉淀)
钙银亚汞是微溶 (硫酸钙、银、亚汞微溶)
可溶之碱有五位
钾钠钡铵钙微溶 (氢氧化钾、钠、钡、铵可溶,氢氧化钙微溶)
氢硫亚硫溶三位(钾 钠 铵)
碳硅磷酸与上同
溶解性口诀九(可适用于初中)
钾钠铵盐硝酸盐
全部溶于水中间
盐酸盐除氯化银
硫酸盐出硫酸钡
其余全溶
碳酸盐 磷酸盐 除钾钠铵盐溶以外
其余都不溶
溶解性口诀十(可适用于初中)
钾盐钠盐铵盐硝酸盐 完全溶解不困难
(氯化物)盐酸盐 不溶只有氯化银
硫酸盐 不溶只有硫酸钡
碳酸盐 磷酸盐 只溶钾钠铵
碱只溶钾钠钡铵
溶解性口诀十一(适用于初中)
钾钠铵盐硝酸盐,
放入水中易溶完
.
硫酸盐类也易溶,
但要除去钙钡银
.
盐酸盐除银亚贡
.
碳酸、磷酸盐只有钾钠铵溶
溶解性口诀十二(适用于初中)
钾钠铵钡四碱溶
钾钠铵硝盐全溶
盐酸盐,除银盐
硫酸盐,除钡盐
碳酸盐,唯有钾钠铵可溶
或
钾、钠、硝酸溶,
盐酸除银(亚)汞,
再说硫酸盐,不容有钡、铅,
其余几类盐,
只溶钾、钠、铵,
最后说碱类,钾、钠、铵和钡。
(另有几种微溶物,可单独记住。)