
十一章 生物有机化合物
一 基本要求
掌握:糖、氨基酸、蛋白质、核酸的基本结构与性质 熟悉:糖、氨基酸、蛋白质基本性质与生理功能的关系 了解:蛋白质、核酸的结构与性质及功能
11.1 碳水化合物
碳水化合物(即糖类),按其能否水解和水解的产物情况可分为以下三类:
(1) (1) 单 糖:不能水解的多羟基醛或多羟基酮。例如葡萄糖、果糖和核糖。 (2) (2) 低聚糖: 水解后能生成2~10个分子单糖的化合物。其中最重要的是二糖,
例如蔗糖、
麦芽糖、纤维二糖等。
(3) (3) 多 糖:水解后生成10个以上单糖分子的化合物。例如淀粉、纤维素等。
11.1.1 单 糖
11.1.1.1 单糖的结构
通过对单糖化学性质的研究得知单糖既有开链式结构,又有环状结构。 1、开链式结构
化学事实得知葡萄糖的开链式结构为:
CH 2OH
CH CH OH
OH
CH OH
CH OH
CHO
用类似的化学方法证明果糖的开链式结构为五羟基-2-己酮。
CH 2OH CH CH OH OH CH OH C O CH 2
OH
在书写单糖的开链式结构时,一般将碳链竖写,羰基位于上端,碳链的编号从靠近羰基的一端开始。单糖的开链式结构常用Fischer 投影式或更简单的式子表示。
右旋葡萄糖的结构可用Fischer 投影式或更简单的式子表示如下:
或
H CHO *OH *H HO *OH H *
OH
H
CH 2OH CHO *OH
*HO
*OH *
OH
CH 2OH
CHO
**
**
CH 2OH 或
2、 2、 构型和标记法
在碳水化合物中存在立体异构体,为了确定其构型一般采用D 、L 相对标记法和R 、S 绝对标记法。
D-(+)-甘油醛D-(+)-葡萄糖D-(-)-果糖
L-(-)-甘油醛L-(-)-葡萄糖L-(+)-阿拉伯糖
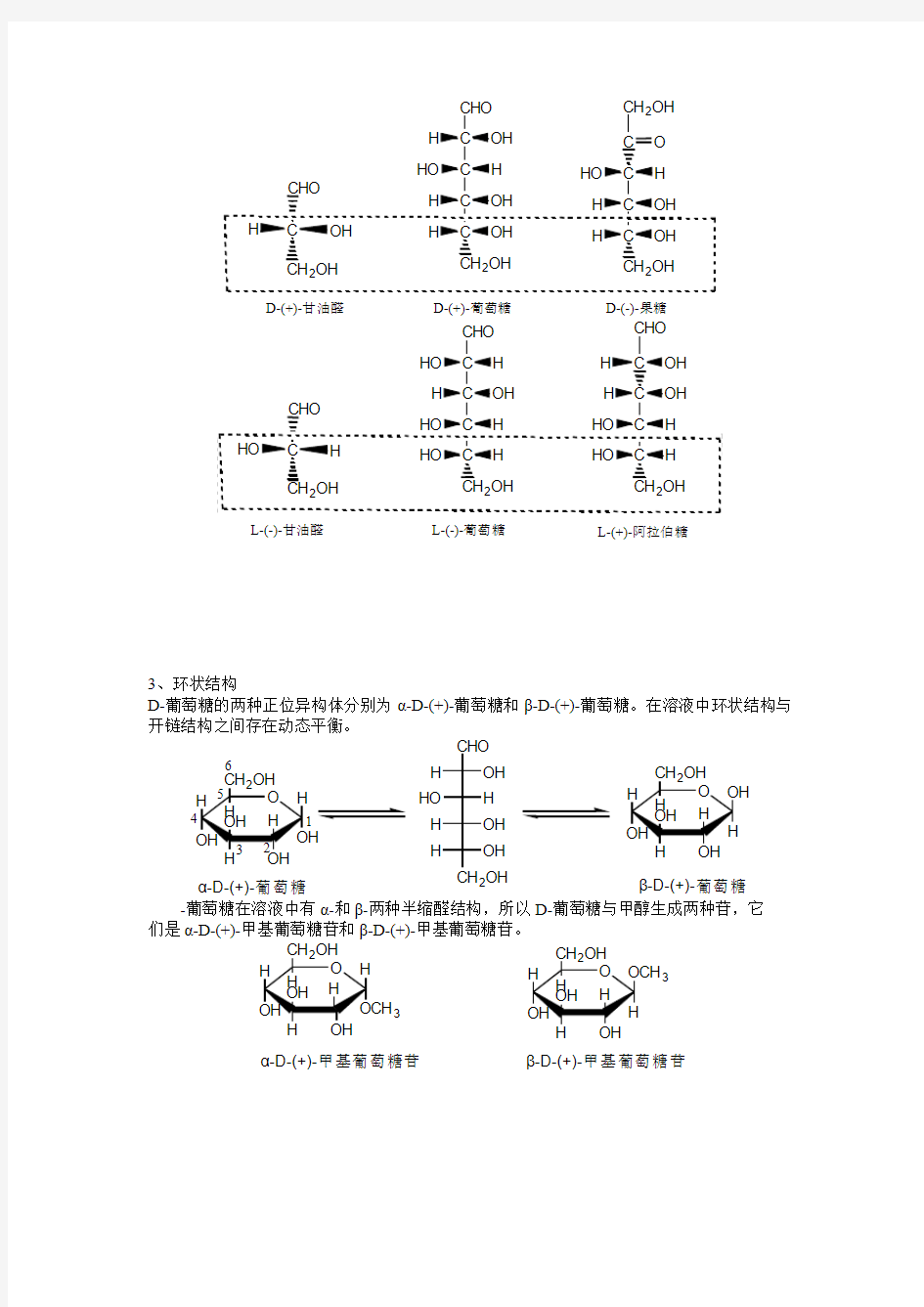
3、环状结构
D-葡萄糖的两种正位异构体分别为α-D-(+)-葡萄糖和β-D-(+)-葡萄糖。在溶液中环状结构与开链结构之间存在动态平衡。
H
CHO
OH
HO H
H OH
H OH
CH2OH
6
α-D-(+)-葡萄糖β-D-(+)-葡萄糖-葡萄糖在溶液中有α-和β-两种半缩醛结构,所以D-葡萄糖与甲醇生成两种苷,它们是α-D-(+)-甲基葡萄糖苷和β-D-(+)-甲基葡萄糖苷。
3
3
α-D-(+)-甲基葡萄糖苷β-D-(+)-甲基葡萄糖苷
CH 2OH
O
O
1
4α-D-(+)-葡萄糖
β-D-(+)-葡萄糖
糖的这种环状结构称为哈沃史(Howorth)式。有时不需要指出糖的正位异构体,就把异头碳上羟基写在环平面上,且异头碳原子上的H 也可以省去:
或
单糖分子中的半缩醛环并不都是六员环,也有的是五员环。例如D-(-)-果糖:
β-D-(-)-呋喃果糖
CH 2OH 2OH 2OH
D-(-)-果糖
4、 4、 构象
糖的哈沃史式能清楚地表示出环上各原子和原子团之间相互关系,但吡喃环上的原子并不在同一平面内,而是类似于环己烷,具有椅式构象,例如β-D-葡萄糖的两种椅式构象为:
β-D-甘露糖
β-D-阿洛糖
β-D-半乳糖
D-果糖也有变旋光现象。在水溶液中果糖主要为吡喃型环状结构(分为α-型和β-型)。而果糖苷主要以呋喃型环状结构(分为α-型和β-型)形式存在。X-射线分析表明,呋喃型糖中五员环在同一平面上;吡喃型糖中六员环主要为椅式构象。
10.1.1.2 10.1.1.2 单糖的反应
单糖是多羟基醛酮,含有羰基和羟基,能发生这些官能团的特性反应,如还原反应、氧化反应、加成反应、成醚反应、成酯反应等。单糖还含有相邻的醇羟基结构,故还能发生邻二醇的特性反应,如被高碘酸氧化。 1、还原反应
单糖用还原剂或催化加氢将羰基还原为羟基生成糖醇(即多元醇)。例如,D-葡萄糖还原生成D-葡萄糖醇(又叫D-山梨醇),L-古洛糖还原也生成D-山梨醇:
H CHO OH HO H H OH H
OH CH 2OH [H]
H CH 2OH OH HO H H OH H
OH CH 2OH H CH 2OH OH H H OH H
OH CHO [H]HO CHO H HO H H OH HO
H CH 2OH
即:
D-葡萄糖
D-山梨醇
L-古洛糖
D-甘露糖还原为D-甘露醇,D-果糖的羰基在2位,故还原产生新的手性中心,生成非对映异构体D-甘露醇和D-山梨醇:
HO CHO H HO H H OH H
OH CH 2OH HO CH 2OH
H HO H H OH H
OH CH 2OH CH 2OH CO
HO H H OH H
OH CH 2OH H CH 2OH
OH HO H H OH H
OH CH 2OH D-甘露糖
D-山梨醇D-果糖
[H]
[H]
[H]
D-甘露醇
2、 2、 氧化反应
单糖被不同的氧化剂氧化生成氧化程度不同的产物。醛糖或酮糖与弱氧化剂Tollens 试剂和Fehling 试剂均发生反应,与Tollens 试剂作用都产生银镜,与Fehling 试剂一起加热时生成氧化亚铜的砖红色沉淀。
Cu 2
+
醛糖或酮糖氧化产物Cu 2O +
Tollens 试剂和Fehling 试剂都是碱性溶液。醛糖含有醛基,能被弱氧化剂氧化;酮糖都是α-碳上有羟基的酮,在碱性溶液中,存在开链式醛糖与开链式酮糖通过烯二醇而进行互变异构的平衡。例如:
CHO CHOH HO H H OH H
OH CH 2OH CHOH C
H H OH H
OH CH 2OH CH 2OH C
HO H H OH H
OH CH 2OH OH O 醛糖
烯二醇
酮糖
因此,酮糖也能被弱氧化剂(Tollens 试剂和Fehling 试剂)氧化。许多糖在生物体内的代谢都包括有烯醇化反应。
酮糖在同样氧化条件下不反应。因此,可用溴水作为试剂区别醛糖和酮糖。β-D-葡萄糖苷用臭氧氧化生成葡萄糖酸酯,α-异构体活性较低,不易被臭氧氧化。 硝酸是强氧化剂,能使醛糖氧化为糖二酸。例如:
H
CHO
OH
HO H
H OH
H OH
CH2OH
H
COOH
OH
HO H
H OH
H OH
COOH
HNO3
D-葡萄糖
D-葡萄糖二酸内酯D-葡萄糖二酸有旋光性。将醛糖氧化为糖二酸,然后测其旋光性,这些性质可用于推
测糖的构型。糖二酸也容易生成γ-内酯和δ-内酯。D-果糖用硝酸氧化时,发生碳链的断裂,
生成D-阿拉伯糖二酸及其它小分子氧化产物。
CH2OH
C
HO H
H OH
H OH
CH2OH
O
CO2H
HO H
H OH
H OH
CO2H
+
CO2H
H OH
H OH
CO2H
3
+......
生物体内由酶催化进行醛糖的氧化反应,醛基不受影响,而末端-CH2OH氧化为羧基,
生成糖醛酸。这是一个重要的生化反应。生成的糖醛酸衍生物可由尿液从动物体内排出,起
到排毒作用。
高碘酸氧化糖类时,邻二醇结构的碳链处及羰基与羰基α-碳链处均发生断裂得到醛及
酸:
2
+2IO4HCHO2HCOOH
+
反应常是定量的,断裂一个碳-碳键消耗一摩尔IO4-,产生一摩尔IO3-。用银盐溶液滴
定反应生成的IO3-,可以知道反应中C-C键断裂的数目。
例如氧化D-葡萄糖时,消耗5摩尔高碘酸,生成5摩尔甲酸和1摩尔甲醛,表明葡萄
糖中有5个C-C键,共6个碳原子,且这6个碳原子或为羰基碳,或与羟基相连。
CHO
C
HO H
H OH
H OH
CH2OH
OH
H
+5IO4HCHO5HCOOH
+
糖苷中也存在邻二醇结构,故也可被高碘酸氧化。例如:D-甲基吡喃葡萄糖苷氧化时
消耗2摩尔高碘酸,生成1摩尔甲酸和1摩尔二醛,从后者的结构可以得知糖苷分子中成
环情况及三个相邻羟基的存在。
3
+2IO4HCOOH
+
H
C
O
O
H
OCH3
H
CH2OH
H
3、成脎反应
H CHO *OH **HO H *
H OH H
OH
CH 2OH
D-(+)-葡萄糖652
NNHC 6H 5
**HO H *
H OH H
OH
CH 2OH
NNHC 6H 5HO
CHO *H **HO H *
H OH H
OH
CH 2OH
652
D-(+)-葡萄糖脎
D-(+)-甘露糖
265
23
-C 6H 5NH 2
CH 2OH C R
265H 2NNHC 6H 5
2CH C R
NNHC 6H 5
NNHC 6H 5
NNHC 6H 5
CHO C R NNHC 6H CH 2OH C R
O
4、醚化和酯化反应
CHOH
O
HO HO
HOH 2C OH
32232CHOCH 3O
CH 3O CH 3O
CH 3OH 2C
OCH 3
D-葡萄糖
D-五甲基葡萄糖
D-葡萄糖与乙酸酐发生酯化反应生成D-五乙酸葡萄糖酯(又叫D-五乙酰基葡萄糖)。 (CH 3CO)2O CHOOCCH 3O
CH 2
OOCCH 3
CH 3COO
CH 3COO CH 3COO
CHOH O
HO HO
HOH 2C OH D-葡萄糖
D-五乙酸葡萄酯糖
糖的磷酸酯在生物体内有重要作用。它们是许多代谢过程的中间体。例如,在肝糖的
生物合成和生物降解过程中,都含有α-D-1-磷酸葡萄糖酯和D-6-磷酸葡萄糖酯。
O
HO HO
HOH 2C OH
OPO 3H 2
CHOH O
HO HO
H 2C
OH
OPO 3H 2α-D-1-磷酸葡萄糖酯
D-6-磷酸葡萄糖酯
核酸在生物体内起着极其重要的作用,β-D-核糖和β-D-2-脱氧核糖的磷酸酯是核酸的组成部分。
O HOH 2C
H
H OH H OH
OH
H O HOH 2C
H
H OH H H
OH
H β-D-核糖
β-D -2 -脱氧核糖
β-D-核糖和β-D-2-脱氧核糖为呋喃型环状结构,3-和5-位上的羟基与磷酸形成酯,同时1-位上的羟基与嘧啶或嘌呤缩合后形成核酸的基本单位──核苷酸(见11.3.1)。 5、 5、 差向异构化(epimerization)
差向异构化作用就是在差向异构体之间进行的一种直接可逆的转化过程。在碱性条件 下,醛糖通过烯醇式转化为差向异构体,同时发生醛糖与酮糖间的相互转化。
H
CHO R
OH
CH C HO
CHO
R
H CH 2OH C
R
O
OH OH
例如:在8×10-3
mol·L -1
氢氧化钠溶液中,35℃下D-葡萄糖反应4昼夜后生成D-果糖(28%),D-甘露糖(3%)和D-葡萄糖的混合物。
D-葡萄糖与D-甘露糖的差向异构化也可通过下列反应实现。
H CHO OH HO H H OH H
OH CH 2OH
H CO 2H OH HO H H OH H
OH CH 2OH
HO CO 2H H HO H H OH H
OH CH 2OH
HO
CHO
H HO H H OH H
OH CH 2OH
HO
C H HO H H
H
OH CH 2OH
O
O
Br 2吡啶
分离Na/Hg
2△ 1)2)
醛糖还可以通过下列反应转化为酮糖。
265
3O
CHO CHOH R
CH C R NNHC 6H 5NNHC 6H 5
C C
R
O O
H
CH 2OH C R O
醛糖
邻酮醛糖
糖脎
酮糖
6、 6、 醛糖的递升和递降
CHO HO H H OH H
OH CH OH HO
CN H H H
OH H
OH CH 2OH
HO
COOH H HO H H H
OH CH 2OH
HO
CHO H HO H H
OH H
OH CH 2OH
H CN OH H H OH H
OH CH 2OH
H
COOH OH HO H H OH H
OH CH 2OH
H
CHO OH H H
OH H
OH
CH 2OH PH=3~5
2PH=3~5Na-Hg,H 2O D-(+)-甘露糖
D-(+)-葡萄糖
醛糖递降一般有两种方法。其一是将醛糖用电解法氧化或经溴水氧化后与氢氧化钙作用生成糖酸钙,后者用过氧化氢及铁盐处理变成低一级的醛糖。此法称为Ruff 降解法。例如将D-(+)-葡萄糖降解为D-(-)-阿拉伯糖。
H CHO OH HO H H H
CH 2D-(+)-葡萄糖
H COO OH HO H H OH H
OH CH 2OH
COOH O
HO H H OH H
OH CH 2OH
CHO
H H OH H
OH
CH 2OH Ca 2
2
2
2D-(-)-阿拉伯糖
其二是将醛糖与羟胺反应生成的肟与乙酐反应使分子中羟基乙酰化并脱去一分子水得到腈。腈在银氨溶液中失去氰基,然后在稀酸溶液中水解生成少一个碳原子的醛糖。此法称为Wohl 降解法。例如:
稀HCl
-H 2O
-HOAc
H 2NOH
Ac 2O, ZnCl 2Ag(NH 3)2+
H CHO OH HO H H OH H
OH CH 2OH
H CH OH H H OH H
OH CH 2OH
NOH H
C
OAc AcO
H H OAc H
OAc CH 2OAc N CH(NHCOCH 3)2
HO H H OH H OH CH 2OH
CHO
HO H H OH H
OH
CH 2OH
10.1.2.1 10.1.2.1 麦芽糖
麦芽糖是由一分子葡萄糖的α-苷羟基与另一分子的葡萄糖C(4)上的醇羟基脱水经α-1,4-苷键连接而成的二糖。即为4-O-(α-D-吡喃葡萄糖基)-D-吡喃葡萄糖。
CH 333CH 33
3
2,H 2O
麦糖酸
3)2SO 4
H 3O
+
八基麦芽糖酸
2,3,5,6-四-O-甲基葡萄糖酸2,3,4,6-四-O-甲基葡萄糖
α-麦芽糖与β-麦芽糖的构象式为:
α-麦芽糖
β-麦芽糖
人及哺乳动物消化道中麦芽糖酶可将食入的麦芽糖水解为葡萄糖。葡萄糖透过细胞膜而被消化吸收。
11.1.2.2 纤维二糖
:纤维二糖是由一分子吡喃型环状葡萄糖的β-苷羟基与另一分子吡喃型环状葡萄糖C(4)上的醇羟基脱水经β-1,4-苷键连接而成的二糖,即为4-O-(β-D-吡喃葡萄糖基)-D-吡喃葡萄糖。
纤维二糖
虽然纤维二糖与麦芽糖在结构上的唯一区别是苷键类型不同,但它们在生理上的作用有
很大差别,如人体能消化麦芽糖,却不能消化纤维二糖;但许多动物,如牛、马等能以纤维素为食料营养。
11.1.2.3乳糖
乳糖是一种β-半乳糖苷。用甲基化及水解等方法证明:乳糖是由一分子吡喃型环状半乳糖的β-苷羟基与一分子吡喃型环状葡萄糖C(4)上的醇羟基脱水经β-1,4-苷键连接而成的二糖,即为4-O-(β-D-吡喃半乳糖基)-D-吡喃葡萄糖。
乳糖
乳糖在人体内经乳糖酶作用水解为能被人体吸收利用的半乳糖和葡萄糖。
11.1.2.4蔗糖
蔗糖的分子式也是C12H22O11。它水解时生成一分子D-(+)-葡萄糖和一分子D-(-)-果糖。蔗糖是右旋的,水解后生成的等量葡萄糖和果糖的混合物则是左旋的。由于蔗糖的水解使旋光的方向发生了转变,一般把蔗糖的水解反应称为转化反应,而水解生成的葡萄糖和果糖的混合物叫做转化糖,蜂蜜的主要组成就是转化糖。
C12H22O11H2O C6H12O6C6H12O6
++
蔗糖D-(+)-葡萄糖D-(-)-果糖
[α]20
D =+66.5°[α]
20
D
=+52.7°[α]
20
D
=-92°
[α]20
D
=-20°
转化糖
。
为了确定蔗糖中两个单糖的成环大小,将八甲基蔗糖水解,生成2,3,4,6-四-O-甲基葡萄糖和1,3,4,6-四-O-甲基果糖
:
2
OH
1
(CH3)2SO4
2
OCH3
3
CH3
3
CH3
3
CH3OCH
2
OCH3
3
+
H3O
2,3,4,6-四-O-甲基葡萄糖1,3,4,6-四-O-甲基果糖
因此,在蔗糖分子中葡萄糖部分为吡喃型环,而果糖部分为呋喃型环。酶水解和X-射线晶体分析结果表明蔗糖是一种β-果糖苷。总之,蔗糖是一分子吡喃型环状葡萄糖的α-苷羟基与一分子呋喃型环状果糖的β-苷羟基脱水连接而成的二糖(含有由α-1,2-苷键和β-2,1-苷键),其构象如下:
22OH
蔗糖分子的结构得以确定,它的全合成工作于1953年完成。蔗糖在人体内经蔗糖酶作用水解为能被人体消化吸收的葡萄糖和果糖。 11.1.2.5 棉子糖
其结构为:
2OH 乳糖
α-1,6-苷键
果糖
棉子糖
11.2 多 糖
11.2.1纤维素
纤维素是D-(+)-葡萄糖的同多糖聚合体。纤维素用硫酸和乙酸酐处理得到八-O-乙酰基纤维二糖。这表明纤维素是由许多葡萄糖结构单位通过β-1,4-苷键连接起来的直链分子。
O
[C 6H 7O 2(OH)3][C 6H 7O 2(OH)2ONa]nClCH 2CO 2H
[C 6H 7O 2(OH)2OCH 2CO 2H]n NaOH
11.2.2淀粉
淀粉的分子式为[C 6H 10O 5]n ,水解时可生成分子量较低的多葡萄糖混合物——糊精(dextrin),进一步水解生成麦芽糖,最终水解产物都是D-(+)-葡萄糖。
[C 6H 10O 5]n [C 6H 10O 5]x
C 12H 22O 11C 6H 12O 6淀粉
糊精
麦芽糖
D-葡萄糖
淀粉在淀粉酶的作用下水解得到麦芽糖。因此淀粉可以看成麦芽糖的聚合物,其中苷键为α-型。
直链淀粉经甲基化和水解后,主要产物为2,3,6-三-O-甲基葡萄糖,说明直链淀粉是由
D-(+)-吡喃葡萄糖通过α-1,4-苷键结合而成的长链分子。同时水解还得到极少量(如0.3%)的2,3,4,6-四-O-甲基葡萄糖,后者来源于链上无还原性的一端。因此,可根据最终水解产物中三甲基葡萄糖与四甲基葡萄糖的比例计算淀粉的键长和分子量。大多数直链淀粉的分子量为几万到几十万。
直链淀粉
11.3 氨基酸蛋白质
11.3.1 氨基酸
11.3.1.1氨基酸的分类和命名
表11.1 一些常见的蛋白质氨基酸
而显酸性。氨基酸分子中可以有多个氨基或羧基。氨基和羧基数目相同的氨基酸近于中性,叫中性氨基酸;氨基数目多于羧基的呈碱性,叫碱性氨基酸;羧基数目多于氨基的呈现酸性,叫酸性氨基酸。
11.3.1.2氨基酸的性质
由蛋白质水解所得的α-氨基酸,除甘氨酸外,都具有旋光性。它们的α-碳原子的构型都与L-甘油醛相同,故都属于L型。例如:
H 2N
COOH
C
H
CH 2OH NH COOH C H
CH 2
2
CH 2
HO
CHO C
H
CH 2OH L-丝氨酸
L-脯氨酸
L-甘油醛
若用R-S 标记法,这些α-碳原子的构型都是S 型。但氨基酸习惯于以俗名命名,故常用D-L 标记法标记其构型。
氨基酸中的氨基与羧基还相互影响,使氨基酸具有一些特殊性质。
1、 1、 酸碱性:氨基酸既含有氨基又含有羧基,它可以和酸反应生成盐,也可以和碱反应
生成
盐,所以氨基酸是两性物质。
多数α-氨基酸含有一个氨基和一个羧基,可以用通式H 2N-CHR-COOH 表示。但实际上,由于氨基显碱性,能接受质子,而羧基显酸性,能提供质子,因此,氨基酸中氨基接受分子内羧基的质子,成为偶极离子:
H 3N
H C COO
R
这种偶极离子又叫内盐。氨基酸之所以具有相当高的熔点,难溶于有机溶剂等等,都与它们是内盐因而具有盐的性质有关。为简便起见,常用非离子形式H 2N-CHR-COOH 表示氨基酸。
氨基酸的偶极离子中存在显碱性的羧酸根负离子,又存在显酸性的铵离子,故在水溶液
中,既可以作为碱与一个H + 结合成为正离子,又可以作为酸失去一个H +
成为负离子。这三种离子在水溶液中互相转换而同时存在。
负离子
偶极离子
正离子
OH
H 2N CH
R COO
H 3+N
CH R
COO
-
++H 3+N CH
R COOH
图11.1甘氨酸盐酸盐的滴定曲线
在强酸性溶液中,碱性氨基酸赖氨酸的两个氨基都质子化,生成赖氨酸双正离子,当溶液pH 值增大时,依羧基、α-铵离子和ε-铵离子次序失去质子,它们的平衡为:
NH 3(CH 2)4CHCO 2NH 3(CH 2)4CHCO 3(CH 2)4CHCO OH
NH 3
NH 3
NH 2双正离子
偶极离子
单正离子
2(CH 2)4CHCO 2
NH 2OH OH 负离子
其PI 是pKa 2和pKa 3的平均值:
PI =
8.96 + 10.53
2= 9.75
(2)水合茚三酮显色反应
在弱酸性溶液中,α-氨基酸与水合茚三酮加热时,即可进行反应生成一般为蓝紫色的产物。其反应过程可能为:
O
O OH OH O
O
O O
O
NCHCO 22O
H 2NCHCO 2H
R -CO 2
O
O NCH 2R O
O N CHR H 2O -RCHO
O
O NH 2
O O
O
O
O N
O
O
OH
O
N
O
O
蓝紫色
R
(3)消除反应
氨基酸受热后发生消除反应。消除方法以生成较稳定结构产物(如五、六员环、共轭体系等)为主。一般α-氨基酸受热后,能在两分子之间发生脱水反应,生成较稳定的六员环交酰胺。例如:
H 2C CH 2
N CO △
N H H N
O O
+ H 2O
交酰胺
β-氨基酸受热后,分子内容易脱去一分子氨,生成α,β-不饱和羧酸。例如:
CH 3HC
NH 2CHCOOH
H
△
3HC
CHCOOH
γ-或δ-氨基酸受热后,容易分子内脱去一分子水生成五员或六员内酰胺。例如:
△
NH
O
+
H 2O
分子中氨基和羧基相隔更远的氨基酸,受热后既不能形成五、六员环,又不能形成共轭 体系,故发生多分子间脱水,生成聚酰胺。
nNH 2(CH 2)x COOH △
NH 2(CH 2)x CO NH(CH 2)x CO n - 2NH(CH 2)x COOH +(n-1)H 2O 11.3.1.4 氨基酸的拆分
一般合成的α-氨基酸为外消旋体,需要将其拆分得到有较大实际用途的L-α-氨基酸。常用的拆分方法有结晶法和酶法。
1、结晶法 将外消旋α-氨基酸酰化生成N-酰基-DL-氨基酸,后者与一种旋光的碱作用生成互为非对映异构体的两种盐。然后选择适当的溶剂和条件,可以使其中一种盐从溶液中结晶析出。重结晶提纯后,加酸分解得到旋光的N-酰基氨基酸。若选择适当的酰基,得到的N-酰基-L-α-氨基酸可直接用于多肽的合成。若需要α-氨基酸,将N-酰基氨基酸水解。例如:
DL-苯甲酸酐
N-苯甲酰基-DL-1)马钱子碱2)分离苯甲酰基-L-丙氨酸的马钱子碱盐
苯甲酰基-L-丙氨酸
L-丙氨酸
-22)H 3O
H 3O +
2、酶法 将外消旋α-氨基酸酰化或酯化为其衍生物。在酶作用下,只有L-氨基酸衍生物被分解成游离的氨基酸,然后用溶剂提取法或离子交换层析法把L-α-氨基酸分离出来。 通常将外消旋氨基酸转变为N-乙酰基或N-氯乙酰基衍生物,在酰基转移酶(由哺乳动物的肾脏中提取得到)的作用下,N-酰基-L-氨基酸分解成游离的L-α-氨基酸,然后分离提纯。
α-氨基酸广泛用于食品、医药及饲料等工业中,L-谷氨酸单钠盐(味精)大量用作调味品。L-天冬氨酸钠、甘氨酸钠、丙氨酸钠等也可增强食品鲜味。常在食品及饲料中加入一些必需氨基酸,可增强营养效果。由氨基酸配制的输液常用来补充外科手术前后病人的营养。不少氨基酸及其衍生物有药理作用。
11.3.2多肽
一分子α-氨基酸的羧基与另一分子α-氨基酸的氨基之间脱水形成的酰胺键称为肽键(peptide linkage), 生成的产物称为肽(peptide)。
H 2NCHCO 2H
+H 2NCHCO 2H
R R'
H 2NCHCNHCHCO 2H
R O
R'
+H 2NCHCNHCHCO 2H
R'O
R
由二分子α-氨基酸形成的肽称为二肽,由多个α-氨基酸形成的肽称为多肽(polypeptide)。
在肽链中,有氨基的一端叫做N 端;有羧基的一端叫做C 端。在写多肽结构时,通常把N 端写在左边,C 端写在右边。命名时从N 端开始,称为某氨酰(基)某氨酸。为书写简便起见,也常用缩写符号来表示。例如:
H 2NCHCONHCH 2CO 2H CH 3
H 2NCHCONHCHCONHCH
2CONHCHCOOH
CH 3
CH 2C 6H 52OH
丙氨酰甘氨酸, 丙-甘, 丙·甘
丙· 苯丙· 甘· 丝Ala - Gly, Ala·Gly
Ala·Phe·Gly·Ser
天然多肽都是由不同的氨基酸组成的。相对分子质量一般在10000以下。有些多肽在生物体内起着很重要的作用。例如,存在于血浆中,与调节血压有关的舒缓激肽是一个九肽。能使子宫收缩的垂体后叶催产素也是一个九肽。在它的分子中,氨基酸单元之间除以肽键相连外,还有一个二硫键(-S -S -)。
Ala - P ro - P ro - Gly - P he - Ser - P ro - P he - Arg
舒缓激肽(bradykinin)
催产素(oxytocin)
Cys - Tyr - Ile - Gln - Asn - Cys - Pro - Leu - Gly
S
S
11.3.3 蛋白质
11.3.3.1 蛋白质的结构和分类
C
N
CH 2CH 2
CH 2
α-螺旋
β-折叠
图11.3肽链中相邻两个肽键之间的关系,α-螺旋和β-折叠
11.4 核酸
111.4.1 核酸的结构
蛋白质
核酸
氨基酸核苷酸
磷酸
核苷酸中有两类戊糖:D-核糖和2-脱氧-D-核糖。
O HOH 2C H OH OH H H OH
H
1'
2'3'
5'
4'O HOH 2C H OH H H H OH
H
1'
2'3'
5'
4'核糖
脱氧核糖
核苷酸中的碱基有嘌呤和嘧啶两大类,它们是腺嘌呤(Adenine, A)、鸟嘌呤(Guanine, G)和胞嘧啶(Cytosine, C)、脲嘧啶(Uridine, U)、胸腺嘧啶(Thymine , T)共五种。后面四种都有酮式和烯醇式的互变异构存在。在pH 值为7±2的生理条件下,它们主要以酮式结构存在。
N N NH 2N N 12
53
96
748
12536
4
N N O N N 125
3
9
6
748
H H H H 2N
N N NH 2O
H 1253
6
4
N N O O
H H 125
36
4N N O O
H H
CH 3
A
G
C
U
T
图11.6为由4个核苷酸组成的DNA 或RNA 中的一段多核苷酸链的结构示意图。多核苷酸链也可用简单表示法(见图11.7),还可以分别被简写为―A ―C ―G ―T ―和―A ―C ―G ―U ―,因为在DNA 或RNA 链中核苷酸的的区别只在于碱基不同。
N
N
NH 2
N N O CH 2H O R H
1'2'3'5'4'P
HO O
O
O
CH 2
H
O R H
N
N
NH 2
H
O
P HO O
O O
CH 2H
O R H P HO O
O O
CH 2H
O R H N
N
O
H
O
N
N
O
N N H
NH 2
R'
P HO O
O DNA R: H , R': CH 3
RNA R: OH , R': H
图11.6 DNA 和RNA 链示意图
2'3'5'H P
H P
H P
H
P
P
A C
G
T
2'3'
5'
OH
P
OH
P
OH
P
OH P
P
A C G U
图11.7 DNA 和RNA 链的简单表示法
习 题
10.1 指出下列碳水化合物哪些有还原性。
(1)D-甘露糖(2)D-阿拉伯糖(3)甲基-β-D-葡萄糖(4)淀粉(5)蔗糖(6)纤维素
10.2 试以葡萄糖为例,说明醛糖构型的表示方法。
10.3 试写果糖与下列试剂反应的主要产物。
(1)苯肼(2)NaCN/H+ (3)Na-Hg/H2O/OH-(4)CH3OH/HCl (5)(CH3O)2/ZnCl2(6)(CH3)2SO4
10.4 试写出甘氨酸与下列试剂反应的主要产物。
(1)KOH水溶液(2)HCl水溶液(3)C2H5OH+HCl (4)CH3COCl (5)NaNO2+HCl(低温) (6)LiAlH4
10.5 写出下列化合物的哈沃斯的透析结构式。
(1)β-D-吡喃丰乳糖(2)β-L-吡喃葡萄糖
(3)α-D-呋喃甘露糖(4)α-L-呋喃阿拉伯糖
10.6 请写出下列多肽的结构式或名称:
(1)(1)甘-甘-丙-苯丙-亮(2)丝氨酰蛋氨酰脯氨酸
(3)
(4)
H2N(CH2)4CH
NH2
CONHCH
CH3
CONHCH
CH2SH
COOH
H2N CH
CH
CONHCH
(CH2)4NH2
CONHCH
CH2
COOH CH3CH2
CH3
OH
10.7 用化学方法鉴别下列化合物。
(1)纤维二糖(2)淀粉(3)纤维素(4)α-氨基酸(5)β-氨基酸
10.8 试用简单的化学实验区分下列各组化合物:
(1)D-葡萄糖和D-葡萄醇(2)D-葡萄醇和D-葡萄二酸
(3)D-葡萄糖和D-果糖(4)D-葡萄糖和D-丰乳糖
(5)蔗糖和麦芽糖(6)麦芽糖和麦芽糖酸
(7)-β-D-吡喃葡萄酸甲酯和2,3,4,6-四-O-甲基-β-D-吡喃葡糖
(8)-α-D-呋喃核糖甲酯A和2-脱氧-α-D-呋喃核糖酸甲酯B
10.9 写出甲基-β-D-吡喃脱氧核糖苷及甲基-β-D-吡喃葡萄糖苷和高碘酸氧化后的产物。
10.10 推导化合物的结构。
(1)某己醛糖A经过Wohl降级反应生成戊醛糖B,后者经HNO3氧化得到旋光性的三羟基二羧酸。B再用Wohl降级法降级,然后再经过HNO3氧化得到(-)-(2S,3S)-洒石酸。试写出A、B的结构式。
(2)化合物A(C7H13O4N3),是一个三肽,在甲醛存在下滴定A可消耗1mol的NaOH;
将A用HNO2处理时放出1mol的N2并生成化合物B(C7H12O5N2)。B与稀NaOH共热后再酸化可得到乳酸和甘氨酸。试写出A和B结构式。
10.11 某D型单糖(Ⅰ)的化学式为C5H10O4,能还原斐林试剂,能生成脎与发生变旋现象。
用溴水氧化(Ⅰ)得到一元酸(Ⅱ),有光活性;如用稀硝酸使(Ⅰ)氧化,得到二元酸(Ⅲ),无光活性。(Ⅰ)与甲醇并含有HCl气的溶液作用,得到α-及β-糖苷(Ⅳ)、(Ⅴ),再用(CH3O)2SO2-NaOH使之完全甲基化,得到多甲基衍生物(Ⅵ)、(Ⅶ),其化学式为C8H16O4。将(Ⅵ)、(Ⅶ)进行酸水解,然后用浓硝酸氧化,得到最长碳链的二元酸,化学式为C5H8O5,均有旋光性。试推断该单糖的反应并写出各步反应式。
10.12 试合成甘氨酰-丙氨酰-缬氨酸(甘-丙-缬)。
10.13 合成下列化合物(试剂任选)
(1)由丙烯醛合成蛋氨酸(2)由丙烯酸甲酯合成谷氨酸
(3)由CHO
OH
OH
合成OCH3
CH2CHCO2
CH3O
10.14 给混合酸酐下一个定义,写出几种混合酸酐。
10.15 组氨酸N
N CH2CHCO2
H NH3分子中含有咪唑基。咪唑
N
H(1)是一种两性化合物,其共
扼酸N
H(2)的pKa大约等于7,写出咪唑及其共轭酸、共扼碱
N
(3)的共振
式。
湖南大学商业银行管理学 模拟试卷A 一、不定项选择题(每题2分,共20分) 1.新巴塞尔协议规定的信用风险计量方法包括() ①内部评级法②基本指标法③标准法④VaR法 2.商业银行的核心资本充足率应不少于() ① 8%② 6%③ 4%④10% 3.中长期贷款展期不得超过原贷款期限的一半,并且最长不得超过()① 2年②3年③5年④10年4.能够同城、异地均可使用的结算方式是() ①托收承付②银行支票③ 银行本票④委托收款5.下列具有短期贷款性质的国际业务是() ①进出口押汇②福费廷③出口信贷④银团贷款6.表外业务的特点是() ①规模庞大②交易集中③盈亏巨大④灵活性大7.融资性租赁的主要特征包括() ①设备的使用权和所有权分离②资金与物资运动的紧密结合 ③承租人对设备具有选择的权利④租金一次性支付 8.下列能衡量商业银行盈利性的指标是() ① ROA②ROE③现金股利/利润④营业利润率9.下列既属于中间业务又属于表外业务的是()
① 信用证业务②担保业务③ 互换业务④远期利率协议10.短期借款的主要渠道包括() ①同业借款②向中央银行借款③ 转贴现④回购协议 二、判断题(每题1分,共10分) 1.一般企业管理常用的最优化经济原理同样适用于银行管理。() 2.政府放松金融管制与加强金融监管是相互统一的。() 3.巴塞尔协议规定,附属资本的合计金额不得超过其核心资本的50%。()4.质押贷款的质物主要指借款人或第三人的不动产。() 5.补偿性余额实际上是银行变相提高贷款利率的一种表现形式。()6.商业银行等金融中介自身也不能完全消除金融交易双方的信息不对称。()7.敏感性缺口为负,市场利率上涨时,银行净利息收入呈上升的趋势。()8.速动比率与银行偿债能力成正比。() 9.商业银行证券投资中的梯形期限策略多为中小银行采用。() 10.银行承兑汇票属于银行汇票的一种。() 三、名词解释题(每题3分,共12分) 1.福费廷 2.次级贷款 3.利率互换 4.操作风险 四、简答题(每题4分,共16分) 1.简述银行抵押贷款和质押贷款的主要区别。 2.商业银行证券投资的方法有哪些。 3.衡量商业银行流动性的市场信号指标有哪些。 4.商业银行兼并与收购的动机是什么。
目录 第一章绪论 (1) 第二章饱和烃 (2) 第三章不饱和烃 (6) 第四章环烃 (14) 第五章旋光异构 (23) 第六章卤代烃 (28) 第七章波谱法在有机化学中的应用 (33) 第八章醇酚醚 (43) 第九章醛、酮、醌 (52) 第十章羧酸及其衍生物 (63) 第十一章取代酸 (71) 第十二章含氮化合物 (77) 第十三章含硫和含磷有机化合物 (85) 第十四章碳水化合物 (88) 第十五章氨基酸、多肽与蛋白质 (99) 第十六章类脂化合物 (104) 第十七章杂环化合物 (113) Fulin 湛师
第一章 绪论 1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。 答案: 1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么? 答案: NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。因为两者溶液中均为Na + ,K + ,Br - , Cl - 离子各1mol 。由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。 1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。当四个氢原子与 一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。 答案: C +6 2 4 H C CH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构 CH 4 SP 3杂化 2p y 2p z 2p x 2s H 1.4写出下列化合物的Lewis 电子式。 a.C 2H 4 b.CH 3Cl c.NH 3 d.H 2S e.HNO 3 f.HCHO g.H 3PO 4 h.C 2H 6 i.C 2H 2 j.H 2SO 4 答案: a. C C H H H H C C H H H H 或 b. H C H c. H N H d. H S H e. H O N O f. O C H H g. O P O O H H H h.H C C H H H H H O P O O H H H 或 i. H C C H j. O S O H H O H H 或
第11章 羧酸及其衍生物 11-1 将下列各组化合物按酸性由强至弱排列成序。 CH 3COOH ClCH 2COOH Cl 3CCOOH OH A. B. C. D.A. B. C. D. COOH Br COOH NO 2COOH OCH 3 COOH NO 2NO 2 COOH OH COOH COOH OH A. B. C. (1) (2) (3) (1)D >B >A >C ; (2)C >B >A >D ; (3)B >A >C 。 知识点:羧酸的酸性。 11-2 将下列各组化合物按水解反应速率由大至小排列成序。 CH 3COCl (CH 3CO)2O CH 3CONHCH 3 A. B. C. D.COOCH 3 NO 2 COOCH 3 CH 3 COOCH 3 A. B. C. (1) (2)CH 3COOC 2H 5 (1)A >B >D >C ; (2)A >C >B 。 知识点:羧酸衍生物水解反应活性。水解反应是亲核加成-消除反应,连有吸电子基有利于反应进行。 11-3 比较下列酸在H + 催化下进行酯化反应的速率。 HCOOH CH 3COOH CH 3CH 2COOH (1)(2)(3)(CH 3)2CHCOOH (4) (1)>(2)>(3)>(4) 知识点:酸酯化反应活性。 11-4 完成下列反应。
(1) COOH OH OH O O O + (1) LiAlH 4(2)H 2C COOH 2H 2C CH 2OH SOCl 2 (3)H 3C CH 2CH 23C CH 2CH 2COCl H 3C O AlCl 3 (分子内酰基化) (1) Zn, CH 3CH(Cl)COOEt (Reformasky 反应) (4) (2) H 2O O OH CHCOOC 2H 5CH 3 (5) Br 2/红磷 CH 2 COOH CHCOOH Br (酰胺还原) (6) N H O (Hofmann 降解) (7) 2 2 C 6H 5 H 32 C 6H 5 H 3 (8) H 3O (Claisen 酯缩合反应, Wittig 反应, Mannich 反应) 32(9) △ COOH O (10) 3 (酯与格氏试剂反应,羟醛缩合反应)
湖南大学 2013年硕士研究生入学考试模拟试题(一) 科目代码:832科目名称:物理化学所有答案必须做在答案题纸上,做在试题纸上无效! 一、选择题(25*1) 1、一定量的液态环己烷在其正常沸点时变为同温同压下的蒸气,则:() (A)ΔU=ΔH,ΔA=ΔG,ΔS>0 (B)ΔU<ΔH,ΔA<ΔG,ΔS>0 (C)ΔU>ΔH,ΔA>ΔG,ΔS<0 (D)ΔU<ΔH,ΔA<ΔG,ΔS<0 2、某溶液由2mol A和1.5mol B混合而成,其体积为420cm3,此溶液中组分A的偏摩尔体积为30cm3?mol-1,则组分B的偏摩尔体积:() (A)200cm3?mol-1(B)300cm3?mol-1 (C)240cm3?mol-1(D)280cm3?mol-1 3.合成了一个新化合物B(s)的质量为1.5g,溶于1.0kg纯水中形成非电解质溶液,测得出现冰的温度比纯水凝固点下降了0.015K,已知水的凝固点降低常数 k f =1.86K?mol-1?kg,则该化合物的摩尔质量M B () (A)100g?mol-1(B)150g?mol-1(C)186g?mol-1(D)200g?mol-1 以冲入容器内的气体为系统,环境对它做功,系统热力学能升高 4.ΔH=Q p ,此式适用于下列哪个过程:() (A)理想气体从106Pa反抗外压105Pa膨胀 (B)0℃,105Pa下冰融化成水 (C)电解CuSO 4 水溶液 (D)气体从(298K,105Pa)可逆变化到(373K,104Pa) 5.一定量的液态环己烷在其正常沸点时变为同温同压下的蒸气,则:() (A)ΔU=ΔH,ΔA=ΔG,ΔS>0
有机化学习题与答案(厦门大学) 第一章绪论习题 一、根据下列电负性数据: 判断下列键中哪个极性最强?为什么? 答案 <请点击> 二、(a) F2、HF、BrCl、CH4、CHCl3、CH3OH诸分子中哪些具有极性键? (b) 哪些是极性分子?答案 <请点击> 三、下列各化合物有无偶极矩?指出其方向。 答案 <请点击> 四、根据O和S的电负性差别,H2O和H2S相比,哪个的偶极-偶极吸引力较强,哪个的氢键较强?答案 <请点击> 五、写出下列化合物的路易斯电子式。 答案 <请点击> 六、把下列化合物由键线式改写成结构简式。 七、下面记录了化合物的元素定量分析和相对分子质量测定的结果,请计算它们的化学式。 (1) C:%,H:%,相对分子质量 110 (2) C:%,H:%,相对分子质量 188 (3) C:%,H:%,N:%,相对分子质量 230 (4) C:%,H:%,N:%,相对分子质量 131 (5) C:%,H:%,Cl:%,相对分子质量 (6) C:%,H:%,N:%,Cl:%,相对分子质量答案 <请点击> 八、写出下列化学式的所有的构造异构式。 答案 <请点击>
第一章绪论习题(1) 1、什么是烃、饱和烃和不饱和烃?点击这里看结果 2、什么是烷基?写出常见的烷基及相应的名称。点击这里看结果 3、给下列直链烷烃用系统命名法命名 点击这里看结果 4、什么是伯、仲、叔、季碳原子,什么是伯、仲、叔氢原子?点击这里看结果 5、写出己烷的所有异构体,并用系统命名法命名。点击这里看结果 6、写出符合下列条件的烷烃构造式,并用系统命名法命名: 1.只含有伯氢原子的戊烷 2.含有一个叔氢原子的戊烷 3.只含有伯氢和仲氢原子的已烷 4.含有一个叔碳原子的已烷 5.含有一个季碳原子的已烷 6.只含有一种一氯取代的戊烷 7.只有三种一氯取代的戊烷8.有四种一氯取代的戊烷9.只有二种二氯取代的戊烷 点击这里看结果 7、写出2-甲基丁烷和2,2,4-三甲基戊烷的可能一氯取代物的结构式,并用系统命名法命名。点击这里看结果 8、写出分子中仅含一个季碳原子、一个叔碳原子和一个仲碳原子及多个伯碳原子的最简单的烷烃的可能异构体。点击这里看结果 9、用折线简式表示下列化合物的构造: 1.丙烷 2.丁烷 2.异丙烷 4. 2,2-二甲基丙烷 5. 2,3-二甲基丁烷 6. 3-乙基戊烷 7. 3-甲基-1-氯丁烷
第十一章酚和醌 一、用系统命名法命名下列化合物: 间甲酚 4-乙基-1,3-苯二酚 2,3-二甲基苯酚 2,4,6-三硝基苯酚2-甲氧基苯酚 1-甲基-2-萘酚 4-羟基苯磺酸 9-蒽酚 1,2,3-苯三酚 5-甲基-2-异丙基苯酚 5-硝基-1-萘酚 2-氯-9,10-蒽醌 二、写出下列化合物的结构式: 1.对硝基苯酚 2,对氨基苯酚 3,2,4-二氯苯氧乙酸 4.2,4,6-三溴苯酚 5。邻羟基苯乙酮 6,邻羟基乙酰苯
7, 4-甲基-2,4- 8,1,4-萘醌- 9,2,6-蒽醌二磺酸二叔丁基苯酚-2-磺酸钠 10.醌氢醌 11,2,2-(4,4‘-二羟基 12,对苯醌单肟 苯基)丙烷 三、写出邻甲基苯酚与下列试剂作用的反应式:
四、用化学方法区别下列化合物: 五、分离下列各组化合物: 1,苯和苯酚 解:加入氢氧化钠水溶液,分出苯,水相用盐酸酸化,分出苯酚 2,环己醇中含有少量苯酚。 解:用氢氧化钠水溶液萃取,分出少量苯酚。 3,苯甲醚和对甲苯酚 解:用氢氧化钠水溶液处理,对甲苯酚溶于氢氧化钠水溶液,苯甲醚不溶分出,水相用盐酸酸化分出对甲苯酚。 4,β-萘酚和正辛醇 解:用氢氧化钠水溶液处理,β-萘酚溶于氢氧化钠水溶液,分出正辛醇,水相用盐酸酸化,分出β-萘酚。 六、比较下列各化合物的酸性强弱,并解释之。
硝基是吸电子基团,具有-R,-I效应,但是硝基的吸电子的效应对间位的影响比邻对位小。而羟基上电子云密度越小,酸性越强。七、如何能够证明邻羟基苯甲醇中含有一个酚羟基和一个醇羟基?解:加入三氯化铁水溶液,有显色反应,说明具有酚羟基。加入三氯化磷能够发生反应,说明具有醇羟基。或者加入卢卡斯试剂,立即反应变浑,说明具有醇羟基。 八、在下列化合物中,那些形成分子内氢键,那些形成分子间氢键? 1.对硝基苯酚 2.邻硝基苯酚 3.邻甲苯酚 4.邻氟苯酚 解:1.对硝基苯酚形成分子间氢键2.邻硝基苯酚形成分子内氢键3.邻甲苯酚形成分子间氢键 4.邻氟苯酚形成分子内氢键。 九、由苯或甲苯和必要的无机或有机试剂合成下列化合物: 1.间苯三酚 2.4-乙基-1-3-苯二酚 3.对亚硝基苯酚
第十三章 羧酸及其衍生物 一、 用系统命名法命名下列化合物: 1. CH 3(CH 2)4COOH 2.CH 3CH(CH 3)C(CH 3)2COOH 3.CH 3CHClCOOH 4. COOH 5. CH 2=CHCH 2COOH 6. COOH 7. CH 3 COOCH 3 8. HOOC COOH 9. CH 2COOH 10. (CH 3CO)2O 11. CO O CO CH 3 12. HCON(CH 3)2 13. COOH O 2N O 2N 14. CO NH CO 3,5-二硝基苯甲酸 邻苯二甲酰亚胺 15. CH 3CHCHCOOH CH 3 OH 16. OH COOH 2-甲基-3-羟基丁酸 1-羟基-环己基甲酸 二、 写出下列化合物的构造式: 1.草酸 2,马来酸 3 ,肉桂酸 4,硬脂酸
HOOCCOOH C C H H COOH COOH CH=CHCOOH CH 3(CH 2)16COOH 5.α-甲基丙烯酸甲酯 6,邻苯二甲酸酐 7,乙酰苯胺 8,过氧化苯甲酰胺 CH 2=C CH 3COOCH 3 CO O CO NHCOCH 3 C O C O O O NH C O H 2NCOOC 2H 5 C C NH C NH O O H 2N C NH 2 NH CO O CO n CH 2 CH O C O CH 3[]n 三、写出分子式为C 5H 6O 4的不饱和二元酸的所有异构体(包括顺反异构)的结构式,并指出那些容易生成酸酐: 解:有三种异构体:2-戊烯-1,5-二酸;2-甲基-顺丁烯二酸;2-甲基-反丁烯二酸。其中2-甲基-顺丁烯二酸易于生成酸酐。 C C H COOH COOH C C H COOH CH 3HOOC CH 3HOOC CH=CHCH 2 COOH 2-戊烯-1,5-二酸; 2-甲基-顺丁烯二酸; 2-甲基-反丁烯二酸 四、比较下列各组化合物的酸性强度: 1,醋酸, 丙二酸, 草酸, 苯酚, 甲酸
第十一章 醛和酮习题答案(最新版) 1. 用系统命名法命名下列醛、酮。 C O CH 3CH 2 CH(CH 3)2(1) (2) CH 3CH 2CHCH 2CH CH 3 C 2H 5 CHO H 3C H H CH 2CH 2CHO (3) C C H 3C O H CH 3H 3C (4) CHO OH OCH 3 (5) COCH 3 OCH 3(6) CH 3 H CHO H (7) H COCH 3 CH 3 Br (8) OHCCH 2CHCH 2CHO CHO (9) O (10)
解:(1)2-甲基-3-戊酮(2)4-甲基-2-乙基己醛(3)反-4己烯醛(4)Z-3-甲基-2庚烯-5-炔-4-酮(5)3-甲氧基-4-羟基苯甲醛(6)对甲氧基苯乙酮 (7)反-2-甲基环己基甲醛(8)3R-3-溴-2-丁酮 (9)3-甲酰基戊二醛(10)螺[4.5]癸-8-酮 2. 比较下列羰基化合物与HCN加成时的平衡常数K值大小。(1)Ph2CO (2)PhCOCH3(3)Cl3CHO (4)ClCH2CHO (5)PhCHO(6)CH3CHO 解:(1)<(2)<(5)<(6)<(4)<(3) 原因: HCN对羰基加成是亲核加成,能降低羰基碳原子上电子云密度的结构因素将会使K值增大,故K值顺序是:(6)<(4)<(3),而羰基碳原子的空间位阻愈小,则K值增大,故K 值的顺序是:(1)<(2)<(5)<(6) ,综合考虑:则K值顺序是:(1)<(2)<(5)<(6)<(4)<(3)。 6. 完成下列反应式(对于有2种产物的请标明主次产物)。 CHO+H2N (1) (2) HC CH+2CH2O
金融硕士MF金融学综合(商业银行)历年真题试卷汇编2 (总分:44.00,做题时间:90分钟) 一、单项选择题(总题数:5,分数:10.00) 1.商业银行吸收存款,必须考虑( )。(上海财经大学2012真题) (分数:2.00) A.加强吸收活期存款,以降低资金成本√ B.加强吸收储蓄存款,以降低体系内通货膨胀压力 C.定期存款利率弹性大于活期存款,所以前者利率较高 D.活期存款的提款风险显著低于定期存款 解析:解析:活期存款虽然需要有较高比例的准备金,但同时它的成本更低。 2.以下不属于贷款风险五级分类管理中的类型的是( )。(中国人民大学2012真题) (分数:2.00) A.正常 B.次级 C.不良√ D.损失 解析:解析:商业银行应至少将贷款划分为正常、关注、次级、可疑和损失五类,后三类合称为不良贷款。 3.下列不属于商业银行现金资产的是( )。(中国人民大学2012真题) (分数:2.00) A.库存现金 B.准备金 C.存放同业款项 D.应付款项√ 解析:解析:应付款项是一项负债。 4.商业银行在经营中,由于借款人不能按时还贷而遭受损失的风险是( )。(中国人民大学2012真题) (分数:2.00) A.国家风险 B.信用风险√ C.利率风险 D.汇率风险 解析:解析:也称为违约风险。 5.银行监管指标不能反映银行流动性风险状况的是( )。(清华大学2017真题) (分数:2.00) A.流动性覆盖率 B.流动性比例 C.拨备覆盖率√ D.存贷款比例 解析:解析:A项,流动性覆盖率旨在确保商业银行在设定的严重流动性压力情景下,能够保持充足的、无变现障碍的优质流动性资产,并通过变现这些资产来满足未来30日的流动性需求。流动性覆盖率=优质流动性资产储备/未来30日的资金净流出量 B项,流动性比率是最常用的财务指标,它用于测量企业偿还短期债务的能力。其计算公式为:流动性比率=流动资产/流动负债,其计算数据来自于资产负债表。一般说来,流动性比率越高,企业偿还短期债务的能力越强。一般情况下,营业周期、流动资产中应收账款数额和存货的周转速度是影响流动性比率的主要因素。 C项,拨备覆盖率(也称为“拨备充足率”)是实际上银行贷款可能发生的呆、坏账准备金的使用比率。不良贷款拨备覆盖率是衡量商业银行贷款损失准备金计提是否充足的一个重要指标。该项指标从宏观上反映银行贷款的风险程度及社会经济环境、诚信等方面的情况。依据《股份制商业银行风险评级体系(暂行)》,拨备覆盖率是实际计提贷款损失准备对不良贷款的比率,该比率最佳状态为100%。拨备覆盖率是银行的重要指标,这个指标考察的是银行财务是否稳健,
第十一章 教学要点和复习 一.重要反应纵横 C OR OR 保护羰基 CH O X 2/NaOH CHX 3+ O O -卤仿反应 条件:含三个α-H 黄色沉淀,鉴别 NaOH 稀 CH CH OH CH 2O CH CH CH O 羟醛缩合:自身亲核加成条件:含α-H 增长碳链、产生双键 O C 二.重要概念和原理 1. 亲核加成反应及其活性规律 过程: +C O 快 H +C O -SP 2 3 C OH Nu SP 3 影响活性的因素:空间效应 电子效应 活性规律:(1)醛比酮活泼 (2)脂肪族比芳香族活泼 (3)羰基连吸电子基团的比连供电子基团的活泼。 注意:亲核加成反应是一类重要的有机反应类型,在不同的含羰基化合物中经常遇到,必须很好理解反应过程及其影响因素,并能够用于解释一些有机反应的基本规律。进一步思考碳碳双键主要发生亲电加成,而羰基发生亲核加成的原因,可以促进有机化学学习的系统化。
2. 酸碱性对亲核加成反应的影响 碱性:亲核试剂浓度提高,有利于亲核加成。 酸性:对于一些弱亲核性的试剂,酸性条件下羰基质子化,有利于羰基正电性提高,促进亲核加成。 注意:酸碱性对有机反应有比较重要影响,基于基础课程的教学,本课程没有系统讨论这方面的内容。但是,亲核加成中,酸性或碱性条件均有利反应,但原因不同。 3. 亲核加成反应的实际应用 亲核加成反应有不同的实际应用,比如: (1)用于鉴别:与饱和亚硫酸氢钠反应、与氨衍生物反应、卤仿反应(特定条件)、与Tollens试剂、Fehling试剂——只限于鉴别醛和酮。 (2)用于分离:与饱和亚硫酸氢钠反应、与氨衍生物反应。 (3)用于官能团转化:氧化和还原。 (4)用于增长碳链、官能团转化:与格氏试剂反应、羟醛缩合。 (5)用于减少碳链、官能团转化:卤仿反应 (6)用于保护羰基:与醇反应 4. 羟醛缩合反应 过程: O C H OH- O C -+ H+ C O C O C - +CH C H OH CH2 O 本质:一分子醛或酮作为亲核试剂,与另一分子醛或酮发生亲核加成反应 注意:(1)二分子相同的醛或酮缩合产物比较专一;(2)三个碳原子以上的醛或酮发生缩合,一定产生支链;(3)交叉缩合:一分子醛或酮不含α-H,产物唯一;(4)缩合产物受热易脱水形成烯醛或烯酮。(与简单醇的脱水条件不同)(5)酮之间的缩合比醛之间的缩合难。 三.重要考点示范 1. 命名: CH2CH2CHO OCH3 CH3O HO 答案:3-(5-羟基-2,4-二甲氧基苯基)丙醛 注意:对于比较复杂的有机物,其遵守的命名原则依然成立。 2. 下列化合物中哪些可以发生自身羟醛缩合、哪些可以发生碘仿反应、哪些可以发生歧化反应、哪些可以与Fehling试剂反应? (A)CHO (B) HCHO (C) (CH3CH2)2CHCHO (D) (CH3)3CCHO (E) ICH2CHO (F)CH3CH2CHO (G) CH3CH2CH(OH)CH3(H) COCH3
有机化学第五版第十一章-醛和酮-课后习题答案
第十一章 醛和酮习题答案(最新版) 1. 用系统命名法命名下列醛、酮。 O CH 3CH 2 CH(CH 3)2(1) (2) CH 3CH 22CH 3 C 2H 5 CHO H 3C H H CH 2CH 2CHO (3) C C H 3C O H CH 3H 3C (4) CHO OCH 3 (5) COCH 3 3 (6) CH 3 H H (7)
H COCH 3 3 Br (8) OHCCH 2CHCH 2CHO (9) O (10) 解:(1) 2-甲基-3-戊酮 (2)4-甲基-2-乙基己醛 (3)反-4己烯醛 (4)Z-3-甲基-2庚烯-5-炔-4-酮 (5)3-甲氧基-4-羟基苯甲醛 (6)对甲氧基苯乙酮 (7)反-2-甲基环己基甲醛 (8)3R-3-溴-2-丁酮 (9)3-甲酰基戊二醛 (10)螺[4.5]癸-8-酮 2. 比较下列羰基化合物与HCN 加成时的平衡常数K 值大小。 (1)Ph 2CO (2)PhCOCH 3 (3)Cl 3CHO (4)ClCH 2CHO (5)PhCHO (6)CH 3CHO 解:(1)<(2)<(5)<(6)<(4)<(3) 原因: HCN 对羰基加成是亲核加成,能降低羰基碳原子上电子云密度的结构因素将会使K 值增大,故K 值顺序是:(6)<(4)<(3),而羰基碳原子的空间位阻愈小,则K 值增大,
故K 值的顺序是:(1)<(2)<(5)<(6) ,综合考虑:则K 值顺序是:(1)<(2)<(5)<(6)<(4)<(3)。 6. 完成下列反应式(对于有2种产物的请标明主次产物)。 CHO + H 2N (1) HC CH + 2CH 2O (2) O N +(3) 苯 , 加热 O + (4) NH 2 HCN/OH -H 2O/H + ? (5)
一、学校介绍 湖南大学地处长沙,是国家教育部直属的全国重点综合性大学,是国家“211工程”“985工程”重点建设的高水平大学,是国家“世界一流大学建设高校”。湖南大学金融学是中国人民银行首批重点建设学科,被誉为中国金融人才培养的“黄埔军校”。湖南大学金融专硕考“396经济类联考”,“431金融学综合”有自己的考试大纲,记得一定要参照考试大纲复习备考哦。 二、招生学院简介 金融学院现设有货币金融、应用金融、金融工程、保险学、统计学5个教学系,2个省部级重点研究基地,1个国际合作研究机构,11个校级跨学科研究中心(所),3个专业实验室;学院拥有金融学、金融工程学、保险学、统计学4个本科专业,金融学(含保险学)、金融工程学、统计学、数量经济学、国民经济学5个科学学位硕士点,金融学、应用统计学、保险学、金融MBA、软件工程(金融信息化方向)等5个专业学位硕士点,应用经济学(含金融学、金融工程学、国民经济学、数量经济学二级学科)、统计学2个一级学科博士学位点,应用经济学、统计学2个博士后科研部流动站,已形成学士—硕士—博士—博士后四级完备的人才培养体系。学院拥有1个国家级教学团队、1个国家级特色专业、3门国家精品课程、2门国家双语示范课程、1名国家级教学名师,在教育教学改革与创新人才培养方面处于国内领先水平。 金融学科是中国人民银行首批重点建设学科、湖南省重点建设学科、国家“211工程”重点建设学科、国家“985工程”哲学社会科学创新基地主要支撑学科。统计学科中部地区一流,在宏观经济统计、金融统计、风险管理与精算等领域基础雄厚,已经建成中部唯一的国家统计局统计科研(湖南大学)基地。经教育主管部门批准,在全国较早接受统计学博士学位国际留学生,培养具有全球视野的具有国际竞争力的高级统计人才。 三、历年分数线与报录比 2020计划招生全日制42人、非全日制 从历年的数据可以看出,湖南大学金融专硕录取分数线不高,但这并代表着湖大就很容易考
2011年湖南大学431金融学综合试题 一、名词解释(每题4分,共20分) 1.贴现 2.经济资本 3.汇率制度 4.金融互换 5.操作风险 二、单选题(每题1.5分,共30分) 1.GNP deflator是指 A.按当年价格计算的报告期GNP与按基期价格计算的报告期GNP的比率 B.按当年价格计算的报告期GNP与按基期价格计算的基期GNP的比率 C.按基期价格计算的报告期GNP与按基期价格计算的基期GNP的比率 D.按当年价格计算的报告期GNP与按当年价格计算的基期GNP的比率 2.银行间外汇市场的交易均采用 A.美元标价法 B.直接标价法 C.间接标价法 D.英镑标价法 3.一下不是证券市场的特征的是 A.价值直接交换的场所 B.财产权利直接交换的场所 C.风险直接交换的场所 D.收益直接交换的场所 4. 弗里德曼货币需求理论具有一个显著的特征是 A.强调恒久性收入对货币需求的重大影响 B.强调货币需求的动机 C.强调人们的流动性偏好 D.强调资产的多样性组合 5.商业银行的负债由()三部分组成 A. 存款、同业拆借和发行债券 B. 存款、向中央银行借款和转贴现 C. 存款、向中央银行借款和发型债券
D. 存款、借入资金和其他负债 6. A. W 7.变金融排斥为金融倾斜的成功经验是 A.格莱珉银行 B.英格兰银行 C.欧洲中央银行 D.中国银行 8.再贴现属于中央银行的 A. 负债业务 B. 资产业务 C. 中间业务 D. 表外业务 9.当政府采取强有力的宏观调控政策,紧缩银根,则 A. 公司通常受惠于政府调控,盈利上升 B. 投资者对上市公司盈利预期上升,股价上扬 C. 居民手语由于声息二提高,将促使股价上涨 D. 公司的资金使用成本增加,业绩下降 10. 从本质上说,回购协议是一种()协议 A. 担保贷款 B. 信用贷款 C. 抵押贷款 D. 质押贷款 11. 具有“先存款后消费”特点的银行卡是 A. 贷记卡 B. 准贷记卡 C. 借记卡 D. 信用卡 12. 可转换债券实质上是一种 A. 债券的看涨期权 B. 债券的看跌期权 C. 股票的看涨期权 D. 股票的看跌期权 13. 本位货币在商品流通和债务支付中具有 A. 有限发偿 B. 无限发偿 C. 债权人可以选择是否接受 D. 债务人必须支付 14. 银行的可用头寸是由()构成 A. 基础头寸和在途资金 B. 基础头寸和在中央银行存款
装订钱(答案不得超过此线) 湖 南大学教务处考试中心 第 1 页,(共 页) 第 2 页,(共 页) 大的是过程 ,最小的是过程 。 3、298K 气相反应CO(g)+2 1 O 2(g)=CO 2(g)该反应的?G ?A ,?U ?H (填>,<,=)。 4、Al 2(SO 4)3的不饱和溶液,此体系最大物种数为 ,自由度数为 。 5、由两种液体所形成的溶液中,组分的蒸气压对拉乌尔定律产生不大的正偏差,如果浓度用摩尔分数表示,且选取纯液体为标准态,组分的活度系数值必定 于1。如果以组分在极稀溶液中服从亨利定律为参考态,则组分的活度系数必定 于1(填大或小)。 二、单项选择填空(每题2分,共20分) 1、有一真空绝热瓶子,通过阀门和大气相隔。当阀门打开时,大气(视为理想气体)进入瓶内, 此时瓶内气体的温度将( ) A 、升高 B 、降低 C 、不变 D 、不确定 2、某气体的状态方程为bp RT pV +=m (b 大于零的常数),此气体向真空绝热膨胀后的温度 A 、不变 B 、上升 C 、下降 D 、不确定 3、某化学反应若在300K ,p 下在试管中进行时放热6×104J ,若在相同条件下通过可逆电池进行 反应,则吸热6×103J ,该化学反应的熵变?S 体为 ( ) A 、-200 J ?K -1 B 、200 J ?K -1 C 、-20 J ?K -1 D 、20 J ?K -1 4、1mol 范氏气体的T V S ??? ????应等于 ( ) A 、b V R -m B 、m V R C 、0 D 、b V R --m 5、下列关系式中能适用于一切体系的是( ) A 、p T V S p d d ??? ????-= B 、T Q S R δ=d C 、()()d d d S S S =+内外 D 、surr syst d d d S S S += 6、一封闭钟罩中放一杯纯水A 和一杯糖水B ,静置足够长时间后发现 A 、A 杯水减少, B 杯水满后不再变化; B 、A 杯变成空杯,B 杯水满后溢出 C 、B 杯水减少,A 杯水满后不再变化 D 、B 杯水减少至空杯,A 杯水满后溢出 7、保持压力不变,在稀溶液中溶剂的化学势μ随温度降低而( ) A 、降低 B 、不变 C 、增大 D 、不确定 8、298K 时蔗糖水溶液与纯水达渗透平衡时,整个体系的组分数、相数、自由度数为( ) A 、C =2 P =2 f *=1 B 、 C =2 P =2 f *=2 C 、C =2 P =1 f *=2 D 、C =2 P =1 f *=3 9、单组分体系的固液平衡线的斜率d p /d T 的值( ) A 、大于零 B 、等于零 C 、小于零 D 、不确定 10、下列过程中能适用方程2 d ln d RT H T p ?= 的是( ) A 、22I (s)I (g)= B 、C (石墨)=C (金刚石) C 、2HgCl(g)(s)Cl Hg 22= D 、),,g (N ),,g (N 222112p T p T = 三、 1 mol 、300 K 1.013 ×105 Pa 的单原子理想气体,在定外压下定温膨胀至内外压相等后,使其定 容升温至 1000 K ,压力为 6.678×104 Pa ,计算过程的Q , W ,ΔU ,ΔH 。 (20分) 四、 绝热的杜瓦瓶中装有303 K 的水200 g 。往瓶中投入273 K 的冰20 g 。以瓶内为参考系统,求此 过程的熵变。已知冰在273 K 的摩尔熔化热为80×4.184×18.016 J·mol -1,水的等压摩尔热容为4.184×18.016 J·K -1·mol -1,H 2O 的摩尔质量为18.016×10-3 kg·mol -1。假定瓶壁的温度不改变。 (20分) 五、 298.15K 时,一种摩尔质量为120×10-3 kg·mol -1的液体A 在水中的溶解度为0.12 g·kg -1 (水)。 设水在此液体中不溶解,试计算298.15 K 时该液体A 在水的饱和溶液中的活度及活度系数。设以纯液A 为标准态。(15分) 六、 某A-B 二组分凝聚系统如下图所示。 (1)写出图中各相区的稳定相。 (2)写出图中三相线的平衡关系式。 (3)绘出图中状态点a 、b 、c 三个 样品的步冷曲线。 (15分)
《有机化学》(第五版,李景宁主编)习题答案 第十一章 1、用系统命名法命名下列醛、酮。 (1)CH 3CH 2O CH(CH 3)2 (3) H 3CH 2CHO H 3C H 2-甲基-3-戊酮 E-4-己烯醛 (4) H 3C-C C O CH 3H H 3C (5) OH OCH 3 CHO Z-3-甲基-2-庚烯-5-炔- 4-酮 3-甲氧基-4-羟基苯甲醛 (10) O 螺[4,5]癸-8-酮 3、将下列各组化合物按羰基活性排序。 (1)A 、CH 3CH 2CHO B 、PhCHO C 、Cl 3CCHO C >A >B (2)A 、O B 、O C 、O D 、 O CF 3
D >C >B >A (3)A 、 O B 、O C 、 O C >B >A 5、下列羰基化合物都存在酮-烯醇式互变异构体,请按烯醇式含量大小排列。 (1)CH 32CH 3 O (2) CH 3CCH 23 O O (3) CH 3CCH 2CO 2C 2H 5O (4) CH 3CCHCCH 3 O COCH 3 O (5) CH 3CCHCOOC 2H 5 O COCH 3 (4)>(5)>(2)>(3) >(1) 6、完成下列反应式(对于有两种产物的请标明主、次产物) (1)CHO +H 2N CH N (亲核加成) (2)HC CH + 2CH 2O HOH 2CC CCH 2OH (亲核加成) (4) O +NH 2OH NOH (亲核加成) (5)HCN/OH - CN OH H 2O COOH (亲核加成,后水解) (8) O CH 3 + C H 3O C 2H 5O -2O C H 3
第十二章 醛酮和核磁共振 一、 命名下列化合物: 1. CH 3CHCH 2CHO CH 2CH 3 2. (CH 3)2CH C O CH 2CH 3 3. C O CH 34. CH 3O C O H 5. CHO 6. C O CH 37. CH 2=CH C O CH 2CH 3 8. CH 3CH 2CH OC 2H 5OC 2H 5 9. NOH 10. CH 3 CH 2 CH 3 C O C O 11. (CH 3)2C=N NO 2 NH 2 二、 写出下列化合物的构造式: 1、2-丁烯醛 2、二苯甲酮 3、2,2-二甲基环戊酮 C O CH 3CH 3 CH 3CH=CHCHO C O 4、3-(间羟基苯基)丙醛 5、甲醛苯腙 6、丙酮缩氨脲 CH 2CH 2CHO OH H 2C=NNH CH 3 CH 3 C=N NH C O NH 2
7、苄基丙酮 8、α-溴代丙醛 CH 2CH 2CH 2CH 3 C O CH 3CH CHO Br 9、三聚甲醛(P292) 10、邻羟基苯甲醛 CH 2O CH 2 O CH 2O CHO OH 三、 写出分子式为C 5H 10O 的醛酮的同分异构体,并命名之。 CH 3CH 2CH 2CH 2CHO CH 3 CH 3CHCH 2CHO CH 3CH 2CHCHO CH 3 (CH 3)CCHO CH 3 CH 2CH 2CH 3CH 3CH 2CH 2CH 3 CH 3 CH(CH 3)2C O C O C O 酮: 2-戊酮 3-戊酮 3-甲基-2-丁酮 四、 写出丙醛与下列各试剂反应所生成的主要产物: 1,NaBH 4在氢氧化钠水溶液中 2,C 6H 5MgBr 然后加H 3O + CH 3CH 2CH 2OH CH 3CH 2CHC 6H 5OH 3.LiAlH 4 ,然后加水 4,NaHSO 3 5, NaHSO 3然后加NaCN CH 3CH 2CH 2OH OH CH 3CH 23Na CH 3CH 2CHCN OH 6,稀碱 7,稀碱,然后加热 8,催化加氢 9,乙二醇,酸 OH CH 3CH 2CHCHCHO CH 3 CH 3CH 2CH=CCHO 3 CH 3CH 2CH 2OH CH 3CH 2O O CH 2CH 2 10,溴在乙酸中 11,硝酸银氨溶液 12,NH 2OH 13,苯肼 Br CH 3CH 3CH 2COONH 4 CH 3CH 2CH=NOH CH 3CH 2CH=NNH 五、 对甲基苯甲醛在下列反应中得到什么产物? 1.(P287)
湖南大学研究生院硕士研究生入学考试 《物理化学》(工科)考试大纲 本考试大纲适用于报考湖南大学研究生院化工与应化学类专业的硕士研究生入学考试。《物理化学》是大学本科化工与应化专业的一门重要基础理论课。它是从物质的物理现象和化学现象的联系入手探求化学变化基本规律的一门科学。物理化学课程的主要内容包括化学热力学、化学动力学、电化学、界面化学与胶体化学等。要求考生熟练掌握物理化学的基本概念、基本原理及计算方法,并具有综合运用所学知识分析和解决实际问题的能力。 一、指导思想及大纲依据 1、指导思想 为正确、客观、真实、公平的考核研究生入学前本科层次的物理化学基础,为研究生入学选拔和今后的研究生教育提供依据,采用此大纲对考生进行物理化学知识水平考试。 2、大纲依据 (1)天津大学物理化学教研室编,物理化学(第五版)。高等教育出版社出版:北京,2009年 (2)中华人民共和国国家标准GB3102·8物理化学和分子物理学的量和单位。 二、考试题型 主要题型可能有:是非题、选择题、填空题、简答题、计算题、综合题、作图与析图题等。 三、考试方式、考试所需时间和改卷方式 1、考试方式:书面笔答形式。 2、卷面总分:150分。 3、考试时间:3小时。 4、改卷方式:封闭流水改卷。 四、考试内容
(一)热力学第一定律及其应用 1、热力学概论 2、热力学第一定律 3、准静态过程与可逆过程 4、焓 5、热容 6、热力学第一定律对理想气体的应用 7、实际气体 8、热化学 9、赫斯定律 10、几种热效应 11、反应热和温度的关系—基尔霍夫定律 (二)热力学第二定律 1、自发过程的共同特征—不可逆性 2、热力学第二定律 3、卡诺定理 4、熵的概念 5、克劳修斯不等式与熵增加原理 6、熵变的计算 7、热力学第二定律的本质和熵统计意义 8、亥姆霍兹自由能和吉布斯自由能 9、变化的方向和平衡条件 10、 G的计算示例 11、几个热力学函数间的关系 12、单组分体系的两相平衡—热力学对单组分体系的应用 13、多组分体系中物质的偏摩尔量和化学势 14、热力学第三定律与规定熵 (三)溶液—多组分体系热力学在溶液中的应用 1、溶液组成的表示法 2、稀溶液中的两个经验定律 3、混合气体中各组分的化学势 4、理想溶液的定义、通性及各组分的化学势 5、稀溶液中各组分的化学势 6、理想溶液和稀溶液的微观说明
第十一章 1.用系统命名法给下列化合物命名 (1)2-羟基己酸 (2)N-乙基-6-苯基辛酰胺 (3)(E )-辛-6-烯酸甲酯 (4)3,3-二甲基-1,5-戊酸酐 (5)3-氯丙酸酐 (6) 3-溴丁酰氯 (7) (3S )-3-甲基-4-丁内酯 (8) 2-氯-4-硝基本甲酰氯 (9) (2S )-2-羟基丁二酸 2.比较下列各组化合物酸性的大小 (1) 乙酸>乙醇>乙烷 (2) 苯甲酸>苄醇>苯 (3) 丙二酸>丙醇>>1,3-丙二醛 (4)三氟乙酸>三氯乙酸>乙酸>2,2,2-三氯乙醇>乙醇 (5)五氟苯甲酸>苯甲酸 (6)苯甲酸>环己酸 (7)邻羟基苯甲酸>对羟基苯甲酸 (8)2-丁炔酸>丁酸 (9)对硝基苯甲酸>苯甲酸>对甲基苯甲酸>对甲氧基苯甲酸 (10)3,3,3-三氟丙酸>4,4,4-三氟丙酸 3.完成下列反应 (1) F 3C Br Mg, Et O CO 2, H 3O + F 3C CO 2H (2) CO 2H 4H 2O CD 2OH (3) C C H Me CO 2H Me H 2SO 4 C C H Me CO 2C 2H 5Me (4)
C 6H 52CH 2CH 3 CN H 2O H 2SO 4 △ C 6H 52CH 2CH 3 COOH (5) N O CH 3 HCl, H O △ MeNHCH 2CH 2CH 2COOH (6) Me Br KOH, C 2H 5OH Me KMnO HO 2C O Me 4 HO 2C OH Me + O O CH 3 (7) MeO 2C Me CO 2CMe 3 MeO 2C Me CO 2H OH -(1 mol)H 2O (8) (9) CH 3 3CH 3 O NaCN CH 3 OH CN Py CN H PO (85%) CH 3 COOH SOCl CH 3 COOCl
复习习题 1. 某理想气体反应过程的)g (B ∑ν=1,反应过程的m ,r V C ?=5.6 J ?mol -1?k -1 , m ,r p C ?=( 13.914 ) J ?mol -1?k -1 2.( 系统内部及系统与环境之间发生的一系列无限接近平衡的 )过程称为可逆过程。 3. 状态函数E 的微小变量应记为( d E )。 4.一定量理想气体节流膨胀过程中:μJ -T =( 0 );△H =( 0 ); △U =( 0 )。 5.任一不可逆循环过程的热温商的总和,可表示为;?(δQ /T )不可逆( > ) 0。 6.△A 与△G 分别代表(等温、等容、可逆过程中,系统对外所作的最大非体积等于系统亥姆霍兹函数的减少值;等温、等压、可逆过程中,系统对外所作的最大非体积等于系统吉布斯函数的减少值)。 7.在恒温恒压下,一切化学变化必然是朝着化学势(降低)的方向自动的进行。 8. 在80℃下,将过量的NH 4HCO 3(s )放人真空密闭容器内,NH 4HCO 3(s)按下式进行分 解: NH 4HCO 3(s )= NH 3(g )+CO 2(g )+H 2O (g ) 达平衡后,系统的C =(1);F =(0)。 9.在一定温度下,一定量理想气体所进行的可逆过程与不可逆过程,体积功的大小相比较 可知: 可逆过程系统对环境作(a ); 环境对系统做(b)功。 选择填入:(a )最大;(b )最小;(c )大小无法确定。 10.在25℃的标准状态下,反应 C 2H 6(g )+3 .5O 2 → 2CO 2(g )+3H 2O (l ) 此反应过程的△H m (b ); △U m (b ); W (a )。 选择填入:(a )>0;(b )<0;(c )=0;(d )无法确定。 11.在恒压、绝热、W ’=0的条件下发生某化学反应,使系统的温度上升、体积变大,则此 过程的△H (b );△U (c );W (c )。 选择填入:(a )>0;(b )=0;(c )<0;(d )无法确定。 12.在同一温度下,W ′=0,同一个化学反应的Q p ,m (d )Q V ,m 。 选择填入:(a )>;(b )<;(c )=;(d )无法确定。 13. 在隔离系统内自动发生某过程,则此过程系统总的熵变△iso S (a )。