(2)向(1)的滤液中加入足量的 NaOH 溶液,加热,产生能使湿润的红色石 蕊试纸变蓝的气体 1.12 L(已换算成标准状况,假定产生的气体全部逸出), 由此可以得出关于原溶液组成的正确结论是( )
实验现象
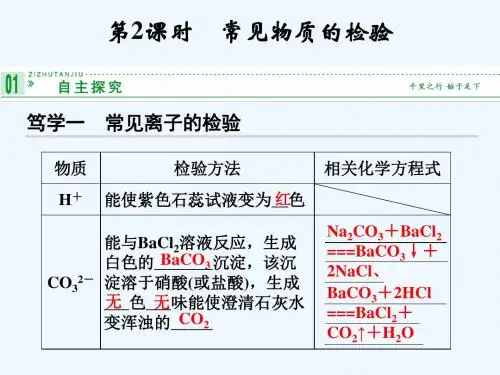
加入 BaCl2 溶液后 生成白色沉淀,沉淀 溶于稀盐酸,并放出 无色、无味气体
化学方程式(举一例) (1)BaCl2+Na2CO3
BaCO3↓+2NaCl
(2)BaCO3+2HCl BaCl2 +CO2↑+H2O
SO42-
BaCl2 溶 液、稀盐
酸
取少许溶液于试 管中,向其中加 入稀盐酸,再加 入 BaCl2 溶液
(2)检验 SO42-:向第二支试管中滴入几滴用盐酸酸化的 BaCl2 溶液。有 白色沉淀生成,说明成分中含有 SO42-。
如果被检验的物质可溶于水,一般要先配成溶液。另外,进行
检验的文字说明时,要按照实验操作→实验现象→实验结论的顺序来记录。
探究点一 探究点二
探究点二 离子存在的综合推断 1.从颜色推断。溶液如果是无色,则一定不存在有颜色的离子,如 Cu2+(蓝色)、MnO4- (紫色)等。 2.有阳必有阴。如题给信息规定的几种离子中,当推断出几种阳离子能 大量存在,那么该溶液中至少存在一种能大量存在的阴离子;同理,当推断溶 液中一定存在几种阴离子时,那么该溶液中至少存在一种能大量存在的阳 离子。 3.阴、阳离子必须能大量共存。某种离子如一定大量存在,则与之反应 的离子则一定不能大量存在。 4.电解质溶液中离子电荷守恒。即阳离子所带的正电荷之和等于阴离 子所带的负电荷之和。
探究点一 探究点二
【例题 2】某溶液中可能含有下列 6 种离子中的某几种:Cl-、SO42-、CO32-、 NH4+、Na+、K+。为确认溶液组成进行如下实验:









![高中化学 常见物质的检验课件 苏教版必修1[001]](https://uimg.taocdn.com/94d8860033d4b14e84246827.webp)