氯化钠溶液的密度
- 格式:docx
- 大小:8.84 KB
- 文档页数:2

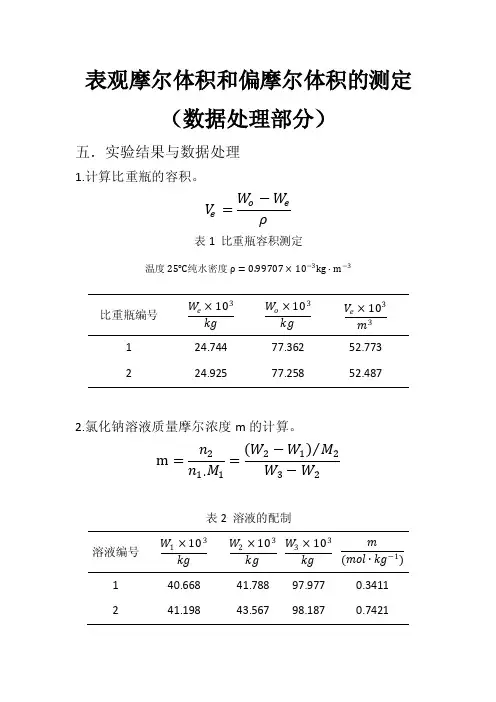
表观摩尔体积和偏摩尔体积的测定(数据处理部分)五.实验结果与数据处理1.计算比重瓶的容积。
V e=W o−W eρ表1 比重瓶容积测定温度25℃纯水密度ρ=0.99707×10−3kg∙m−3比重瓶编号W e×103kgW o×103kgV e×103m31 24.744 77.362 52.7732 24.925 77.258 52.487 2.氯化钠溶液质量摩尔浓度m的计算。
m=n2n1∙M1=(W2−W1)M2W3−W2表2 溶液的配制溶液编号W1×103kgW2×103kgW3×103kgm(mol∙kg−1)1 40.668 41.788 97.977 0.34112 41.198 43.567 98.187 0.74213 56.054 60.928 115.005 1.54224 36.355 43.925 98.404 2.37765 44.902 55.423 109.718 3.3156 3.氯化钠溶液密度的计算。
ρ=W−W eV e表3 溶液的密度测定溶液编号比重瓶编号W×103kgρ×103(kg∙m−3)1 1 78.034 1.00982 2 78.760 1.02573 1 80.442 1.05544 2 81.886 1.08525 1 83.634 1.1159 4.氯化钠表观摩尔体积φ的计算。
φ=M2ρ+1mρ−1mρ1表4m (mol∙kg−1)ρ×103(kg∙m−3)φ×10−6(m3∙mol−1)0.3411 1.0098 20.809 0.7421 1.0257 19.2551.5422 1.0554 19.4332.3776 1.0852 19.5983.3156 1.1159 20.1615.作φ−m图,求出直线的斜率dφd m和截距φ°,并计算溶质与溶剂的偏摩尔体积。



饱和氯化钠溶液浓度
饱和氯化钠溶液浓度是指溶液中氯化钠的质量分数,以mass%单位
来表示。
浓度是指溶液中溶质物质质量在固定体积内的含量。
一般情
况下,饱和氯化钠溶液的浓度可以用密度和温度来表示。
具体来说,
根据浓度的不同,氯化钠溶液的密度和温度也有所不同。
当温度为25℃时,一般来说,0.1mol/L的氯化钠溶液的浓度为
20.05%,0.2mol/L的氯化钠溶液的浓度为40.10%,0.5mol/L的氯化钠
溶液的浓度为100.25%,1mol/L的氯化钠溶液的浓度为200.50%,
2mol/L的氯化钠溶液的浓度为400.95%,5mol/L的氯化钠溶液的浓度
为1001.20%,10mol/L的氯化钠溶液的浓度为2002.50%。
因此,当温度为25℃时,饱和氯化钠溶液的浓度大概为600%左右,如果是6mol/L的氯化钠溶液,浓度就是1203.00%。
需要注意的是,不同温度下,饱和氯化钠溶液的浓度是不一样的,随着温度的升高,溶液的浓度会减少,反之,随着温度的降低,溶液
的浓度会增加。

饱和食盐水密度
常温常压下,饱和食盐水的密度是1.33g/cm^3。
食盐的主要成分是氯化钠,因此食盐水主要由氯化钠溶液组成。
工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠、氢气和氯气,并以它们为原料生产一系列化工产品,称为氯碱工业。
比重为2.165(25/4℃)。
熔点801℃,沸点1442℃,相对密度为2.165克/立方厘米,味咸,含杂质时易潮解;溶于水或甘油,难溶于乙醇,不溶于盐酸,水溶液中性并且导电。
食盐的主要成分是氯化钠(NaCl),所以食盐水主要是由氯化钠溶液组成的。
氯碱工业是最基本的化学工业之一,其产品除应用于化学工业外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
食盐水还可以用来卸妆、消毒杀菌、补水、治电解质紊乱等。
另外酶中加食盐水对酶的有催化作用。
实验活动5 一定溶质质量分数的氯化钠溶液的配制【学习目标】1.练习配制一定溶质质量分数的溶液。
2.加深对溶质的质量分数概念的理解。
【学习重点】配制溶液的操作步骤与注意事项。
【学习难点】配制溶液时的误差分析。
【学习过程】一、自主学习1.溶液在稀释前后,溶质的质量不变。
2.溶液的配制(1)固体作溶质配制一定质量分数的溶液步骤为计算、称量、量取、溶解;(2)液体作溶质配制一定质量分数的溶液步骤为计算、量取、混匀。
二、新知导学实验目的1.练习配制一定溶质质量分数的溶液。
2.加深对溶质的质量分数概念的理解。
实验用品托盘天平、烧杯、药匙、量筒、玻璃棒、胶头滴管、氯化钠、蒸馏水。
实验步骤1.配制质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠3g;水47g。
(2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。
【注意事项】①检查天平是否平衡,若不平衡则调节平衡螺母使天平平衡;②托盘上各放大小相同、质量相等的干净的纸;③用药匙取NaCl,用过的药匙立刻用干净的纸擦拭干净;④左物右码,正确放置砝码并调节游码至所需质量,然后添加氯化钠固体直至天平平衡;⑤称量完毕,把游码移回0处。
(3)量取:用50 mL量筒量取所需的水,倒入盛有氯化钠的烧杯中。
【注意事项】①倾倒液体时,瓶口紧挨着量筒口;②接近所需体积刻度时,量筒应放在水平面上,视线与凹液面最低处保持水平,用胶头滴管添加液体至所需刻度。
(4)溶解:用玻璃棒搅拌,使氯化钠溶解。
【注意事项】①使用玻璃棒在烧杯内搅拌,不得用玻璃棒在烧杯中研磨固体。
2.配制质量分数为3%的氯化钠溶液。
用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/mL),配制50g质量分数为3%的氯化钠溶液。
(1)计算:配制50g质量分数为3%的氧化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:氯化钠溶液25 g(体积24mL);水25 g;(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
实验名称:一定溶质质量分数的氯化钠溶液的配制一、实验目的 1.练习配制一定溶质质量分数的溶液。
2.加深对溶质的质量分数概念的理解。
二、实验用品托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管、氯化钠、蒸馏水。
三、实验原理1、溶质的质量分数=溶质的质量除以溶液的质量乘以百分之百2、溶液稀释前后溶质的质量不变。
四、实验步骤及现象 (1)配制质量分数为6%的氯化钠溶液①计算:配制50 g质量分数为6%的氯化钠溶液所需氯化钠和水的质量②称量:用托盘天平称量所需的氯化钠,放入烧杯中③量取:用量筒量取所需的水(水的密度可近似看作1 g/cm3),倒入盛有氯化钠的烧杯中④溶解:用玻璃棒搅拌,使氯化钠溶解氯化钠3 g;水47 g(2)配制质量分数为3%的氯化钠溶液用已配好的质量分数为6%的氯化钠溶液(密度约为1.04 g/cm3)配制50 g质量分数为3%的氯化钠溶液①计算:配制50 g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液和水的质量②量取:用量筒量取所需氯化钠溶液和水,倒入烧杯中③混匀:用玻璃棒搅拌,使溶液混合均匀由浓溶液配制稀溶液时,计算的依据是: 稀释前后溶液中溶质质量不变 6%的氯化钠溶液25 g(体积约24 mL);水25 g (3)把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖标签(应包括药品名称和溶液好瓶塞并贴上标签,放到试剂柜中中溶质的质量分数)五、实验结论1、配制质量分数为6%的氯化钠溶液需氯化钠3g;水47g。
2、用已配好的质量分数为6%的氯化钠溶液配制50 g质量分数为3%的氯化钠溶液需6%的氯化钠溶液25g (体积24ml);水25g。
六、问题与讨论1.用托盘天平称量氯化钠时,有哪些注意事项? 答案:左物右码,在托盘上放两张质量相等的纸片。
2.用量筒量取液体,读数时应注意什么? 答案:眼睛视线和量筒内液体凹液面的最低处保持水平。
3.准确配制一定溶质质量分数的溶液,在实际应用中有什么重要意义?请举例说明。
教学方案教师:
③实验前请先检查实验仪器是否齐全。
实验结束后,列举出你们用到的仪器、药品的清单。
④回顾实验过程,你们哪些操作是不当的,或者有什么失误的地方?
展示学生实验过程照片,点评。
【课堂练习】下图为配制一定质量分数的KCl溶液的流程图,请圈出图中错误的地方:
【小结归纳】
配制50g质量分数为6%的NaCl溶液用6%的NaCl溶液配制50g 3%的NaCl 溶液
m(NaCl)=50g×6%=3g
m(H2O)=50g-3g=47g
称:3g NaCl
量:47mL水
溶解
装瓶贴签
【问题探讨】用6%的NaCl溶液配制50g 3%的NaCl溶液
提示:
① 6%的NaCl溶液密度为1.04g/mL。
②由浓溶液稀释成稀溶液的过程中,溶质的质量保持不变。
即:m(浓)·ω(浓)=m(稀)·ω(稀)。