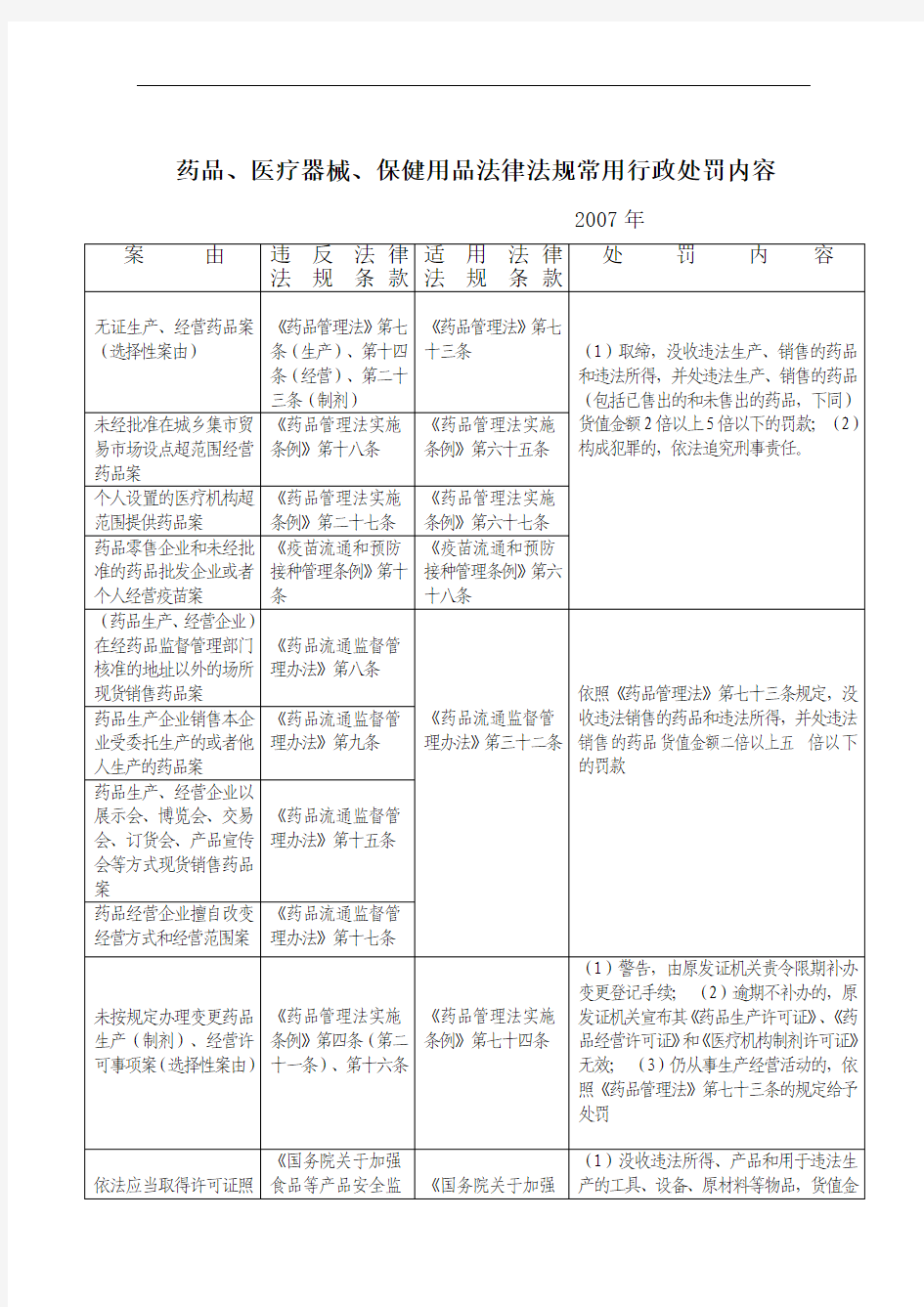
药品、医疗器械、保健用品法律法规常用行政处罚内容
2007年
案由违反法律
法规条款适用法律
法规条款
处罚内容
无证生产、经营药品案(选择性案由)《药品管理法》第七
条(生产)、第十四
条(经营)、第二十
三条(制剂)
《药品管理法》第七
十三条(1)取缔,没收违法生产、销售的药品
和违法所得,并处违法生产、销售的药品
(包括已售出的和未售出的药品,下同)
货值金额2倍以上5倍以下的罚款;(2)
构成犯罪的,依法追究刑事责任。
未经批准在城乡集市贸易市场设点超范围经营药品案《药品管理法实施
条例》第十八条
《药品管理法实施
条例》第六十五条
个人设置的医疗机构超范围提供药品案《药品管理法实施
条例》第二十七条
《药品管理法实施
条例》第六十七条
药品零售企业和未经批准的药品批发企业或者个人经营疫苗案《疫苗流通和预防
接种管理条例》第十
条
《疫苗流通和预防
接种管理条例》第六
十八条
(药品生产、经营企业)
在经药品监督管理部门核准的地址以外的场所现货销售药品案《药品流通监督管
理办法》第八条
《药品流通监督管
理办法》第三十二条
依照《药品管理法》第七十三条规定,没
收违法销售的药品和违法所得,并处违法
销售的药品货值金额二倍以上五倍以下
的罚款
药品生产企业销售本企业受委托生产的或者他人生产的药品案《药品流通监督管理办法》第九条
药品生产、经营企业以
展示会、博览会、交易会、订货会、产品宣传会等方式现货销售药品案《药品流通监督管理办法》第十五条
药品经营企业擅自改变经营方式和经营范围案《药品流通监督管理办法》第十七条
未按规定办理变更药品生产(制剂)、经营许可事项案(选择性案由)《药品管理法实施
条例》第四条(第二
十一条)、第十六条
《药品管理法实施
条例》第七十四条
(1)警告,由原发证机关责令限期补办
变更登记手续;(2)逾期不补办的,原
发证机关宣布其《药品生产许可证》、《药
品经营许可证》和《医疗机构制剂许可证》
无效;(3)仍从事生产经营活动的,依
照《药品管理法》第七十三条的规定给予
处罚
依法应当取得许可证照《国务院关于加强
食品等产品安全监《国务院关于加强
(1)没收违法所得、产品和用于违法生
产的工具、设备、原材料等物品,货值金
而未取得许可证照从事生产经营活动案督管理的特别规定
(中华人民共和国
国务院令第503号)》
第三条
食品等产品安全监
督管理的特别规定》
第三条
额不足1万元的,并处10万元罚款;货
值金额1万元以上的,并处货值金额10
倍以上20倍以下的罚款;(2)构成非法
经营罪的,依法追究刑事责任。
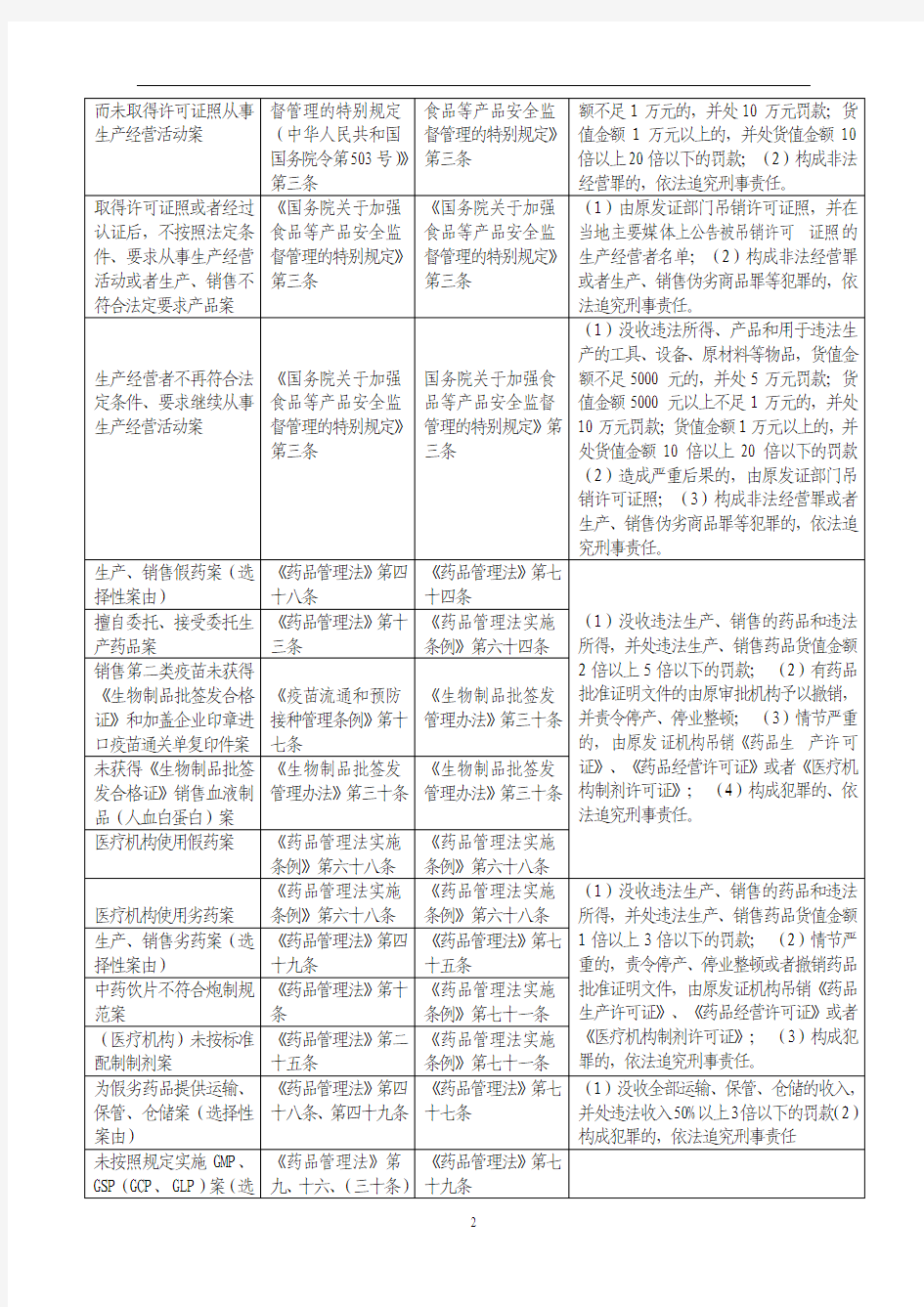
取得许可证照或者经过认证后,不按照法定条件、要求从事生产经营活动或者生产、销售不符合法定要求产品案《国务院关于加强
食品等产品安全监
督管理的特别规定》
第三条
《国务院关于加强
食品等产品安全监
督管理的特别规定》
第三条
(1)由原发证部门吊销许可证照,并在
当地主要媒体上公告被吊销许可证照的
生产经营者名单;(2)构成非法经营罪
或者生产、销售伪劣商品罪等犯罪的,依
法追究刑事责任。
生产经营者不再符合法定条件、要求继续从事生产经营活动案《国务院关于加强
食品等产品安全监
督管理的特别规定》
第三条
国务院关于加强食
品等产品安全监督
管理的特别规定》第
三条
(1)没收违法所得、产品和用于违法生
产的工具、设备、原材料等物品,货值金
额不足5000元的,并处5万元罚款;货
值金额5000元以上不足1万元的,并处
10万元罚款;货值金额1万元以上的,并
处货值金额10倍以上20倍以下的罚款
(2)造成严重后果的,由原发证部门吊
销许可证照;(3)构成非法经营罪或者
生产、销售伪劣商品罪等犯罪的,依法追
究刑事责任。
生产、销售假药案(选择性案由)《药品管理法》第四
十八条
《药品管理法》第七
十四条
(1)没收违法生产、销售的药品和违法
所得,并处违法生产、销售药品货值金额
2倍以上5倍以下的罚款;(2)有药品
批准证明文件的由原审批机构予以撤销,
并责令停产、停业整顿;(3)情节严重
的,由原发证机构吊销《药品生产许可
证》、《药品经营许可证》或者《医疗机
构制剂许可证》;(4)构成犯罪的、依
法追究刑事责任。
擅自委托、接受委托生产药品案《药品管理法》第十
三条
《药品管理法实施
条例》第六十四条
销售第二类疫苗未获得
《生物制品批签发合格证》和加盖企业印章进口疫苗通关单复印件案《疫苗流通和预防
接种管理条例》第十
七条
《生物制品批签发
管理办法》第三十条
未获得《生物制品批签发合格证》销售血液制品(人血白蛋白)案《生物制品批签发
管理办法》第三十条
《生物制品批签发
管理办法》第三十条
医疗机构使用假药案《药品管理法实施
条例》第六十八条《药品管理法实施条例》第六十八条
医疗机构使用劣药案《药品管理法实施
条例》第六十八条
《药品管理法实施
条例》第六十八条
(1)没收违法生产、销售的药品和违法
所得,并处违法生产、销售药品货值金额
1倍以上3倍以下的罚款;(2)情节严
重的,责令停产、停业整顿或者撤销药品
批准证明文件,由原发证机构吊销《药品
生产许可证》、《药品经营许可证》或者
《医疗机构制剂许可证》;(3)构成犯
罪的,依法追究刑事责任。
生产、销售劣药案(选择性案由)《药品管理法》第四
十九条
《药品管理法》第七
十五条
中药饮片不符合炮制规范案《药品管理法》第十
条
《药品管理法实施
条例》第七十一条
(医疗机构)未按标准配制制剂案《药品管理法》第二
十五条
《药品管理法实施
条例》第七十一条
为假劣药品提供运输、保管、仓储案(选择性案由)《药品管理法》第四
十八条、第四十九条
《药品管理法》第七
十七条
(1)没收全部运输、保管、仓储的收入,
并处违法收入50%以上3倍以下的罚款(2)
构成犯罪的,依法追究刑事责任
未按照规定实施GMP、GSP(GCP、GLP)案(选《药品管理法》第
九、十六、(三十条)
《药品管理法》第七
十九条
择性案由)
(1)警告,责令限期整改; (2)逾期不
改正的,
责令停产、停业整顿,并处5000元以上2万元以下的罚款; (3)情节严
重的,由原发证机构吊销《药品生产许可证》、《药品经营许可证》和药物临床试验机构的资格。 未按期通过认证生产、经营药品案(选择性案由)
《药品管理法实施条例》第六条、第十三条
《药品管理法实施条例》第六十三条 疫苗生产企业未按规定建立并保存销售或者购销记录案
《疫苗流通和预防接种管理条例》第十八条 《疫苗流通和预防接种管理条例》第六十一条 (临床试验机构)擅自进行药品临床试验案 《药品管理法》第二十九条 《药品管理法实施条例》第三十条 《药品管理法实施条例》第六十三条 (药品申报者)报送虚假材料申报药品临床试验案
《药品管理法实施条例》第七十条 1)审批机构不予审批,对药品申报者给予警告2)情节严重的,3年内不受理该
药品申报者申报该品种的临床试验申请
从非法渠道购进药品案
《药品管理法》第三十四条 《药品管理法》第八十条 (1)责令改正,没收违法购进的药品,并处违法购进药品货值金额2倍以上5倍
以下的罚款; (2)有违法所得的,没收违法所得; (3)情节严重的,由原发证
机构吊销《药品生产许可证》、《药品经营许可证》
或者《医疗机构制剂许可证》。 (药品经营企业)购进和销售医疗机构配制的制剂案
《药品流通监督管理办法》第十六条 《药品流通监督管理办法》第三十七条 (医疗机构)擅自使用其他医疗机构配制的制剂案 《药品管理法》第二十五条 《药品管理法实施条例》第六十六条
《陕西省医疗机构药品和医疗械管理办法》第十五条二款 《陕西省医疗机构药品和医疗械管理办法》第三十一条
责令整改,并处1000元以上1万元以下罚款
进口药品未按规定登记备案案
《药品管理法》第四十条
《药品管理法》第八十一条 (1)警告、责令限期整改; (2)逾期不改正的,由原审批机构撤销进口药品注册证书
伪造、变更、买卖、出租、出借许可证或药品批准证明文件案(选择性案由) 《药品管理法》第七条、第十四条、第二十三条、第二十九条
《药品管理法》第八十二条
(1)没收违法所得,并处违法所得1倍以上3倍以下的罚款; (2)没有违法所得,处2万以上10万以下的罚款; (3)情节严重的,并由原发证机构吊销卖方、出租方、出借方的《药品生产许可证》、《药品经营许可证》或者《医疗机构制剂许可证》或者撤销药品批准证明文件;(4)构成犯罪的,依法追究刑事责任。
伪造《生物制品批签发合格证》案
《生物制品批签发管理办法》第三十一
条
《生物制品批签发管理办法》第三十一条
骗取许可证、药品批准证明文件案 《药品管理法》第七条、第十四条、第二十三条、第二十九条 《药品管理法》第八十三条
由原发证机构吊销许可证或者撤销药品批准证明文件,5年内不受理其申请,并处1万元以上3万元以下的罚款。 (医疗机构)违法销售制剂案
《药品管理法》第二十五条
《药品管理法》第八十四条
(1)责令改正,没收违法销售的制剂,并处违法销售制剂货值金额1倍以上3倍以下的罚款; (2)有违法所得的,没收违法所得。
(药品零售企业销售药品时)未按规定开具销售凭证案
《药品流通监督管理办法》第十一条第二款
《药品流通监督管理办法》第三十四条 责令改正,给予警告;逾期不改正的,处以500元以下的罚款 (药品经营企业)无真实完整的药品购销记录
《药品管理法》第十八条
案《药品管理法》第八
十五条(1)责令改正,给予警告(2)情节严重的,由原发证机构吊销《药品经营许可证》
(药品经营企业)违法调配处方案《药品管理法》第十九条第一款
(经营企业)销售中药材不标明产地案《药品管理法》第十九条第二款
疫苗批发企业未按规定建立并保存销售或购销记录案《疫苗流通和预防
接种管理条例》第十
八条
《疫苗流通和预防
接种管理条例》第六
十一条
药品标志不符合规定案
《药品管理法》第五
十四条《药品管理法》第八
十六条
(1)除依法应当按照假药、劣药论处的
外,责令改正,给予警告;(2)情节严
重的,由原审批机构撤销该药品的审批证
明文件
药品包装、标签、说明书不符合规定案(选择性案由)《药品管理法实施条例》第七十三条
违法药品广告案《药品管理法》第六
十条、第六十一条《药品管理法》第九
十二条第一款
(1)移交工商管理部门处罚;(2)并由
发给广告批准文号的药品监督管理部门
撤销广告批准文号,一年内不受理该品种
的广告审批申请;(3)构成犯罪的,依
法追究刑事责任。
销售者没有建立并执行进货检查验收制度,并建立产品进货台账案《国务院关于加强
食品等产品安全监
督管理的特别规定》
第五条
《国务院关于加强
食品等产品安全监
督管理的特别规定》
第五条
责令停止销售;不能提供检验报告或者检
验报告复印件销售产品的,没收违法所得
和违法销售的产品,并处货值金额3倍的
罚款;造成严重后果的,由原发证部门吊
销许可证照。
(药品生产、经营企业)
未对其购销人员进行药品相关的法律、法规和专业知识培训,并未建立培训档案案《药品流通监督管
理办法》第六条
《药品流通监督管
理办法》第三十条
责令限期改正,给予警告;逾期不改正的
处以5000元以上2万元以下的罚款
(药品生产、批发企业)销售药品时未按规定开具销售凭证案《药品流通监督管理办法》第十一条第一款
药品生产、经营企业采
购药品时未按规定索取查验、留存供货企业有关证件资料和销售凭证案《药品流通监督管理办法》第十二条
(药品生产、经营企业)
知道或者应当知道他人从事无证生产、经营药品行为的,而为其提供药品案《药品流通监督管
理办法》第十三条
《药品流通监督管
理办法》第三十五条
给予警告,责令改正,并处一万元以下的
罚款,情节严重的,处一万元以上三万元
以下的罚款
(药品零售企业)未按药品分类管理规定的要求,凭处方销售处方药案《药品流通监督管
理办法》第十八条第
一款
《药品流通监督管
理办法》第三十八条
第一款
责令限期改正,给予警告;逾期不改正或
者情节严重的,处以一千元以下的罚款
(药品零售企业)在认
定的药学技术人员不在岗时,销售处方药或者甲类非处方药案《药品流通监督管
理办法》第十八条第
二款
《药品流通监督管
理办法》第三十八条
第二款
责令限期改正,给予警告;逾期不改正的,
处以一千元以下的罚款
(药品生产批发企业)未按有关规定,在药品说明书规定的低温、冷藏条件下运输药品案《药品流通监督管
理办法》第十九条第
一款
《药品流通监督管
理办法》第三十九条
第一款
给予警告,责令限期改正;逾期不改正的,
处以五千元以上二万元以下的罚款;有关
药品经依法确认属于假劣药品的,按照
《药品管理法》有关规定予以处罚
(药品生产批发企业)未按有关规定,在药品说明书规定的低温、冷藏条件下储存药品案《药品流通监督管
理办法》第十九条第
二款
《药品流通监督管
理办法》第三十九条
第二款
按《药品管理法》第79条规定予以处罚,
有关药品经依法确认属于假劣药品的,按
照《药品管理法》有关规定予以处罚
疾病预防控制机构、接
种单位、疫苗生产企业、疫苗批发企业未在规定条件下运输储存疫苗案《疫苗流通和预防
接种管理条例》第十
六条
《疫苗流通和预防
接种管理条例》第六
十四条
责令改正,给予警告,销毁疫苗
(药品生产、经营企业)
以搭售、买药品赠药品、买商品赠药品等方式向公众赠送处方药或者甲类非处方药案《药品流通监督管
理办法》第二十条
《药品流通监督管
理办法》第四十条
限期改正,给予警告;逾期不改正或者情
节严重的,处以赠送药品货值金额二倍以
下的罚款,但是最高不超过三万元
药品生产、经营企业或医疗机构采用邮售、互联网交易等方式直接向公众销售处方药案《药品流通监督管
理办法》第二十一条
或《药品流通监督管
理办法》第二十八条
《药品流通监督管
理办法》第四十二条
责令改正,给予警告,并处销售药品货值
金额二倍以下的罚款,但是最高不超过三
万元
(医疗机构)无真实完整的药品购进记录案《药品管理法实施
条例》第二十六条、
《药品流通监督管
理办法》第二十五
条、《陕西省医疗机
构药品和医疗械管
理办法》第十条
《药品流通监督管
理办法》第四十一条
责令限期改正,情节严重的给予通报
《陕西省医疗机构
药品和医疗械管理
办法》第二十八条
责令改正,并处500元以上3000元以下
的罚款
(医疗机构)未凭处方
调配药品,以邮寄、伪造处方、柜台开架自选和义诊、义卖、咨询、试用、展销会以及其他方式经营或者变相经营药品案《陕西省医疗机构
药品和医疗械管理
办法》第十一条
《陕西省医疗机构
药品和医疗械管理
办法》第二十九条
责令改正,并处以2000元以上2万元以
下的罚款
取得批准配制中药制剂
的(医院类别)医疗机构,未经省级药监部门批准委托其他单位生产《陕西省医疗机构
药品和医疗械管理
办法》第十四条
《陕西省医疗机构
药品和医疗械管理
办法》第三十条
销毁违法制剂,并处以2000元以上2万
元以下的罚款
医疗机构制剂案
医疗机构内部科室私设药房,医疗机构医务人员私自出售药品和制剂案《陕西省医疗机构
药品和医疗械管理
办法》第十五条一款
《陕西省医疗机构
药品和医疗械管理
办法》第三十一条
责令改正,并处以1000元以上1万元以
下的罚款
在药品使用过程中发现假劣药和质量可疑的药品未停止使用及时向药监部门报告案《陕西省医疗机构
药品和医疗械管理
办法》第十六条二、
三款
《陕西省医疗机构
药品和医疗械管理
办法》第三十二条
予以警告,并处以200元以上1000元以
下的罚款
医疗机构未对直接接触药品的人员每年进行健康检查并建立健康档案《陕西省医疗机构
药品和医疗械管理
办法》第十七条第一
款
《陕西省医疗机构
药品和医疗械管理
办法》第三十三条
责令改正,并处500元以上5000以下罚
款
医疗机构从事药品采购、保管、养护、验收、调配的人员,未接受专业培训和继续教育案《医疗机构药品和医疗械管理办法》第十七条第二款
生产者生产产品不按照法律、行政法规的规定和国家强制性标准使用原料、辅料、添加剂、农业投入品案《国务院关于加强
食品等产品安全监
督管理的特别规定》
第四条
《国务院关于加强
食品等产品安全监
督管理的特别规定》
第四条
没收违法所得,货值金额不足5000元
的,并处2万元罚款;货值金额5000元
以上不足1万元的,并处5万元罚款;货
值金额1万元以上的,并处货值金额5倍
以上10倍以下的罚款;造成严重后果的,
由原发证部门吊销许可证照;构成生产、
销售伪劣商品罪的,依法追究刑事责任。
生产企业和销售者发现
其生产、销售的产品存在安全隐患,可能对人体健康和生命安全造成损害,不履行(《国务院关于加强食品等产品安全监督管理的特别规定》)规定的义务案《国务院关于加强
食品等产品安全监
督管理的特别规定》
第九条
《国务院关于加强
食品等产品安全监
督管理的特别规定》
第九条
责令生产企业召回产品、销售者停止销
售,对生产企业并处货值金额3倍的罚款,
对销售者并处1000元以上5万元以下的
罚款;造成严重后果的,由原发证部门吊
销许可证照。
使用现金进行麻醉药品和精神药品交易案《麻醉药品和精神
药品管理条例》第三
十条
《麻精药品管理条
例》第七十九条
责令改正,给予警告,没收违法交易的药
品,并处5万—10万的罚款
(第二类精神药品零售企业)未按规定储存、销售、销毁二类精神药品案《麻醉药品和精神
药品管理条例》第四
十九条、三十二条、
六十一条
《麻醉药品和精神
药品管理条例》第七
十条
责令限期改正,给予警告,并没收违法所
得和违法销售的药品;逾期不改正的,责
令停业,并处5千以上2万以下元的罚款;
情节严重的,取消其第二类精神药品零售
资格
案由违反法律
法规条款适用法律
法规条款
处罚内容
(保健用品销售者)未建立真实完整的购销记录案《陕西省保健用
品管理条例》二
十七条
《陕西省保健用
品管理条例》第
三十八条
给予警告,责令限期改正;逾期不改正
的,责令停止销售,并处5千—1万元的
罚款.
(保健用品销售者)购进
保健用品时,未按规定索取加盖原件持有者印章的保健用品生产批准文件的复印件案《陕西省保健用品管理条例》第二十六条
以保健用品名义生产销售未经注册的产品或在
本省行政区域内销售的保健用品应当具有省级行政主管部门颁发的产品注册批准证明文件和质量标准,检验报告案《陕西省保健用
品管理条例》第
二十五条
《陕西省保健用
品管理条例》第
三十七条
没收违法生产、销售的产品和违法所得,
并处违法生产、销售的产品货值金额2
—5倍的罚款
未取得保健用品生产批
准书的产品,使用该标志案《陕西省保健用
品管理条例》第
二十四条
《陕西省保健用
品管理条例》第
三十六条
责令改正,处以1千—5千元的罚款.
案由违反法律
法规条款适用法律
法规条款
处罚内容
无注册证生产医疗器械案《医疗器械监督管
理条例》第二十条
《医疗器械监督管
理条例》第三十五条
(1)责令停止生产,没收违法生产的产
品和违法所得,违法所得1万元以上的,
并处违法所得3倍以上5倍以下的罚款;
(2)没收违法所得或者违法所得不足1
万元的,并处1万元以上3万元以下的
罚款;(3)情节严重的,由原发证部
门吊销《医疗器械生产企业许可证》;
(4)构成犯罪的依法追究刑事责任。
无许可证生产第二、三类医疗器械案(选择性案由)《医疗器械监督管
理条例》第二十一条
《医疗器械监督管
理条例》第三十六条
(1)责令停止生产,没收违法生产的产
品和违法所得,违法所得1万元以上的,
并处违法所得3倍以上5倍以下的罚款;
(2)没收违法所得或者违法所得不足1
万元的,并处1万元以上3万元以下的
罚款;(3)构成犯罪的,依法追究刑事
责任。
(1)警告,责令停止生产,没收违法生
产的产品和违法所得,违法所得5000元
以上的,并处违法所得2倍以上5倍以
生产不符合标准的医疗器械案《医疗器械监督管
理条例》第十五条
《医疗器械监督管
理条例》第三十七条
下的罚款;(2)没有违法所得或者违
法所得不足5000元的,并处5000元以
上2万元以下的罚款;(3)情节严重的,
由原发证部门吊销产品生产注册证书;
(4)构成犯罪的,依法追究刑事责任。
无证经营第二、三类医疗器械案(选择性案由)《医疗器械监督管
理条例》第二十四条
《医疗器械监督管
理条例》第三十八条
(1)责令停止经营,没收违法经营的产
品和违法所得,违法所得5000元以上的,
并处违法所得2倍以上5倍以下的罚款;
(2)没有违法所得或者违法所得不足
5000元的,并处5000元以上2万元以下
的罚款(3)构成犯罪的,依法追究刑事
责任。
(医疗器械经营企业)从非法渠道购进医疗器械案《医疗器械监督管
理条例》第二十六条
第一款《医疗器械监督管
理条例》第三十九条(1)责令停止经营,没收违法经营的产
品和违法所得,违法所得5000元以上的,
并处违法所得2倍以上5倍以下的罚款;
(2)没有违法所得或者违法所得不足
5000元的,并处5000元以上2万元以下
的罚款;(3)情节严重的,由原发证
部门吊销《医疗器械经营企业许可证》;
(4)构成犯罪的,依法追究刑事责任。
经营无注册证、无合格证明、过期、失效、淘汰的医疗器械案(选择性案由)《医疗器械监督管理条例》第二十六条第二款
经营未依法办理医疗器
械重新注册而销售的医疗器械,或者销售的器械与注册证书限定内容不同的,或者产品说明书、标签、包装标识等内容与器械注册证书限定内容不同案《医疗器械注册管
理办法》第三十三、
三十四、三十五条
《医疗器械注册管
理办法》第四十八条
(按无注册证处理)
使用未依法办理医疗器械重新注册而销售的医
疗器械,或者销售的器械与注册证书限定内容不同的,或者产品说明书、标签、包装标识等内容与器械注册证书限定内容不同案《医疗器械注册管
理办法》第三十三、
三十四、三十五条
《医疗器械注册管
理办法》第四十八条
(按无注册证处理)
1)责令改正、给予警告,没收违法使用
的产品和违法所得,违法所得5000元以
上的,并处违法所得2倍以上5倍以下
的罚款;(2)没有违法所得或者违法
所得不足5000元的,并处5000元以上2
万元以下的罚款;(3)对主管人员和
其他直接责任人员依法给予纪律处分;
(4)构成犯罪的,依法追究刑事责任。
使用无注册证、无合格证明、过期、失效、淘汰的医疗器械案(选择性案由)《医疗器械监督管
理条例》第二十六条
第三款《医疗器械监督管
理条例》第四十二条
(医疗机构)从非法渠道购进医疗器械案《医疗器械监督管
理条例》第二十六条
第一款
《医疗器械监督管(1)责令整改、给予警告,可以处5000
重复使用一次性使用医疗器械案《医疗器械监督管
理条例》第二十七条
理条例》第四十三条
(按国务院解释:应
由《传染病防治法》
规定的主体处罚)
元以上3万元以下的罚款;(2)情节
严重的,可以对医疗机构处3万元以上5
万元以下的罚款,对主管人员和其他直
接责任人员依法给予纪律处分;(3)
构成犯罪的,依法追究刑事责任。
未按规定销毁一次性使用医疗器械案《医疗器械监督管理条例》第二十七条
涂改、倒卖、出租、出借《器械经营企业许可证》或以其它形式非法
转让《器械经营企业许可证》案《医疗器械经营企
业许可管理办法》第
三十八条
《医疗器械经营企
业许可管理办法》第
三十八条
责令改正,并给予警告;逾期拒不改正
的,处以1万—2万元的罚款.
超越《器械经营企业许可证》列明范围开展经营活动案
在监督检查中隐瞒有关情况、提供虚假材料或者拒绝提供反映其经营情况的真实材料案
未依法办理医疗器械注册证书变更案《医疗器械注册管
理办法》第三十八条
《医疗器械注册管
理办法》第四十九条
责令限期改正或给予警告;逾期不改正,
可以处以5千—1万元以下的罚款.
医疗器械经营企业擅自
变更质量管理人员案
《医疗器械经营企
业许可证管理办法》
第十八条《医疗器械经营企
业许可证管理办法》
第三十三条
责令限期改正;逾期拒不改正的,处以5
千—1万元的罚款.
医疗器械经营企业擅自变更注册地址、仓库地址的《医疗器械经营企
业许可证管理办法》
第三十四条
责令限期改正,予以通报批评,并处5
千—2万元的罚款.
医疗器械经营企业擅自扩大经营范围、降低经营条件案《医疗器械经营企
业许可证管理办法》
第三十五条
责令限期改正,予以通报批评,并处1
—2万元的罚款.
涂改、倒卖、出租、出
借医疗器械注册证书或以其他形式非法转让医疗器械注册证书案《医疗器械注册管
理办法》第四十七条
《医疗器械注册管
理办法》第四十七条
责令改正,可以并处3万元以下罚款
一次性使用无菌医疗
器械的经营企业无购销记录或者伪造购销记录,伪造生产批号、灭菌批号、产品有效期案《一次性使用无菌
医疗器械监督管理
办法(暂行)》第二十
条四、五款
《一次性使用无菌
医疗器械监督管理
办法(暂行)》第三十
九条
警告,责令停止经营,并处5千-2万
罚款
医疗机构储存医疗器械的库房不符合法律、法规、规章或省药监部门规定的条件案《陕西省医疗机构
药品和医疗械管理
办法》第二十一条
《陕西省医疗机构
药品和医疗械管理
办法》第二十八条
责令改正,并处以500元以上3000元以
下的罚款
(医疗机构)购进或者使用不符合注册标准的医疗器械案《陕西省医疗机构
药品和医疗械管理
办法》第二十二条
《陕西省医疗机构
药品和医疗械管理
办法》第三十四条
监督销毁并处以200元以上2000元以下
的罚款
一次性使用无菌医疗器械生产企业将有效证件出租、出借给他人使用案《一次性使用无菌
医疗器械监督管理
办法(暂行)》第十三
条第二项
《一次性使用无菌
医疗器械监督管理
办法(暂行)》第三十
七条
责令改正,警告,并处1-3万罚款
一次性使用无菌医疗器械经营企业将有效证件出租、出借给他人使用案《一次性使用无菌医疗器械监督管理办法(暂行)》第二十条第三项
经营不合格一次性使用无菌医疗器械案《一次性使用无菌医疗器械监督管理办法(暂行)》第十八条、二十条第三款
医疗机构未建立一次性使用无菌医疗器械使用后销毁制度案《一次性使用无菌医疗器械监督管理办法(暂行)》第二十二条
医疗机构伪造一次性使用无菌医疗器械采购、使用后销毁记录案《一次性使用无菌医疗器械监督管理办法(暂行)》第二十一条
(生产企业)向城乡集贸市场提供无菌器械或直接参与集贸市场无菌器械交易案《一次性使用无菌医疗器械监督管理办法(暂行)》第十三条第八项
(经营企业和医疗机构)向城乡集贸市场提供无菌器械或直接参与集贸市场无菌器械交易案《一次性使用无菌医疗器械监督管理办法(暂行)》第二十条七款
特殊情况处罚法律法规规定情节法律法
规依据
规定内容
免除其他行政处罚药品经营企业、医疗机构未违反《药品管理法》
和本条例(《药品管理法实施条例》)的有关规定,
并有充分证据证明其不知道所销售或者使用的药
品是假药、劣药的
《药品管理法
实施条例》第八
十一条
没收其销售或者使用的假
药、劣药和违法所得;但是,
可以免除其他行政处罚。
不再给予行政处罚违法行为在二年内未被发现的《行政处罚法》
第二十九条
不再给予行政处罚。法律另
有规定的除外。前款规定
的期限,从违法行为发生之
日起计算;违法行为有连续
或者继续状态的,从行为终
了之日起计算
不予行政处罚不满十四周岁的人有违法行为的《行政处罚法》
第二十五条
不予行政处罚,责令监护人
加以管教
精神病人在不能辨认或者不能控制自己行为时有
违法行为的
《行政处罚法》
第二十六条
不予行政处罚,但应当责令
其监护人严加看管和治疗
从轻或者减轻行政处罚当事人有下列情形之一的(一)主动消除或者减
轻违法行为危害后果的;(二)受他人胁迫有违法
行为的;(三)配合行政机关查处违法行为有
立功表现的;(四)其他依法从轻或者减轻行
政处罚的。违法行为轻微并及时纠正,没有造成
危害后果的,不予行政处罚。
《行政处罚法》
第二十七条
应当从轻或者减轻行政处罚
已满十四周岁不满十八周岁的人有违法行为的《行政处罚法》
第二十五条
从轻或者减轻行政处罚
特殊行政处罚间歇性精神病人在精神正常时有违法行为的《行政处罚法》
第二十六条
应当给予行政处罚
从重处罚违反《药品管理法》和本条例(《药品管理法实施
条例》)的规定,有下列行为之一的,(一)以麻
醉药品、精神药品、医疗用毒性药品、放射性药
品冒充其他药品,或者以其他药品冒充上述药品
的;(二)生产、销售以孕产妇、婴幼儿及儿童
为主要使用对象的假药、劣药的;(三)生产、
销售的生物制品、血液制品属于假药、劣药的;
(四)生产、销售、使用假药、劣药,造成人员
伤害后果的;(五)生产、销售、使用假药、劣
药,经处理后重犯的;(六)拒绝、逃避监督检
查,或者伪造、销毁、隐匿有关证据材料的,或
者擅自动用查封、扣押物品的。
《药品管理法
实施条例》第七
十九条
在《药品管理法》和本条例
(《药品管理法实施条例》)
规定的处罚幅度内从重处罚
刑事责任违法行为构成犯罪的《行政处罚法》
第二十二条
行政机关必须将案件移送司
法机关,依法追究刑事责任
药品经营 相关法律法规条款汇编 1、销售假药的 依据:《药品管理法》第四十八条第一款“禁止销售假药” 罚则:《药品管理法》第七十四条:(1)、没收违法销售的药品(包括已售出的和未售出的,下同);(2)、没收违法所得;(3)、处以违法销售药品货值金额二倍以上五倍以下的罚款;(4)、责令停业整顿;(5)、情节严重的,吊销《药品经营许可证》;(6)、构成犯罪的,追究刑事责任。 《药品管理法》第七十六条:(7)、情节严重的企业或者其他单位,其直接负责的主管人员和其他直接责任人员十年内不得从事药品生产、经营活动。 《药品管理法》第七十七条:(8)、知道或者应当知道属于假劣药品而为其提供运输、保管、仓储等便利条件的,没收全部运输、保管、仓储的收入,并处违法收入百分之五十以上三倍以下的罚款。 2、销售劣药的 依据:《药品管理法》第四十九条第一款“禁止销售劣药” 罚则:《药品管理法》第七十五条:(1)、没收违法销售的药品(包括已售出的和未售出的,下同);(2)、没收违法所得;(3)、处以违法销售药品货值金额一倍以上三倍以下的罚款;(4)、情节严重的,责令停业整顿;(5)、情节严重的,或吊销《药品经营许可证》;(6)、构成犯罪的,追究刑事责任。 《药品管理法》第七十六条:(7)、情节严重的企业或者其他单位,其直接负责的主管人员和其他直接责任人员十年内不得从事药品生产、经营活动。 《药品管理法》第七十七条:(8)、知道或者应当知道属于假劣药品而为其提供运输、保管、仓储等便利条件的,没收全部运输、保管、仓储的收入,并处违法收入百分之五十以上三倍以下的罚款。
3、未取得《药品经营许可证》经营药品的 依据:《药品管理法》第十四条“无《药品经营许可证》的,不准经营药品。” 罚则:《药品管理法》第七十三条:(1)、依法予以取缔;(2)、没收违法销售的药品(包括已售出的和未售出的,下同);(3)、没收违法所得;(4)、处以违法销售药品货值金额二倍以上五倍以下的罚款;(5)、构成犯罪的,追究刑事责任。 4、在核准的地址以外的场所现货销售药品的 依据:《药品流通监督管理办法》第八条:药品生产、经营企业不得在经药品监督管理部门核准的地址以外的场所储存或者现货销售药品。 罚则:《药品流通监督管理办法》第三十二条:依照《药品管理法》第七十三条规定,没收违法销售的药品和违法所得,并处违法销售的药品货值金额二倍以上五倍以下的罚款。 5、在核准的地址以外的场所储存药品的 依据:《药品流通监督管理办法》第八条:药品生产、经营企业不得在经药品监督管理部门核准的地址以外的场所储存或者现货销售药品。 罚则:《药品流通监督管理办法》第三十三条:药品生产、经营企业违反本办法第八条规定,在经药品监督管理部门核准的地址以外的场所储存药品的,按照《药品管理法实施条例》第七十四条的规定予以处罚。 6、以展示会、博览会、交易会、订货会、产品宣传会等现货销售药品的 依据:《药品流通监督管理办法》第十五条:药品生产、经营企业不得以展示会、博览会、交易会、订货会、产品宣传会等方式现货销售药品。 罚则:《药品流通监督管理办法》第三十二条:依照《药品管理法》第七十三条规定,没收违法销售的药品和违法所得,并处违法销售的药品货值金额二倍以上五倍以下的罚款。
医疗器械经营质量管理制度 为建立符合《医疗器械监督管理条例》650 号令、《医疗器械经营监督管理办法》局令8号、《国家食品药品监督管理总局关于施行医疗器械经营质量管理规范的公告(2014 年第58号)的规范性文件,满足规范本公司设施设备的维护、验证及检定的要求,严格设施设备验证和校准的管理,保证设施设备能安全、有效、规范运行,制定本制度: 一、库房应当配备与经营范围和经营规模相适应的设施设备,包括: (1)医疗器械与地面之间有效隔离的设备,包括货架、托盘等; (2)避光、通风、防潮、防虫、防鼠等设施; (3)符合安全用电要求的照明设备;
(4)包装物料的存放场所;(5)有特殊要求的医疗器械应配备的相应设施设备。 二、库房温度、湿度应当符合所经营医疗器械说明书或者标签标示的要求。对有特殊温湿度贮存要求的医疗器械,应当配备有效调控及监测温湿度的设备或者仪器。 三、计量仪器校正 1、常使用中的设备(温湿度计)每一定周期都要进行相关的检定和校准,在使用过程中发生故障有可能影响测定结果,而又未到检定周期的设备应尽快进行检定、校准。合格后才能使用。 四、质量管理部根据周期检定、校准计划,提前一个月把即将到期的检测、测量和试验设备和器具送法定计量检定机构或政府计量行政部门授权的计量检定机构进行检定、校准。 2、检定、校准有关记录、证书由行政部归档交质量管理部保管。 五、设施的维护 1、对计量量具实行标志管理,给每台检测、测量和试验设备和量具贴上彩色标志,以表明其状态。 2、彩色标志的种类、用途: (1)经检定、校准,证明检测仪器设备性能符合要求;或不必检定、校准,经检查功能正常(如计算机、打印机);或无法检定,校准,经比对等方式验证其性能符合要求的检测仪器设备均用合格(绿色)标识。 (2)经检定、校准,证明其性能在一定量限、功能内符合要求或降级使用的检测仪器设备
高危药品管理规定 一.药品仓库、各调剂点对注射用氯化钾、磷化钾及浓度高于0.9%氯化钠、肌肉松弛剂、细胞毒性等高危药品应单独(橱、架)存放(高危药品目录见附录)。 二.存放高危药品的橱、架上应有醒目的黄地、黑字的“高危药品橱(架)”字样。 三.各高危药品在橱架上应定位放置,每个药品位有醒目的黄地、黑字的药物品名、规格表示。 四.接到高危药品处方后,应认真审核药品名称、规格、用法用量等与临床诊断是否相符,当确定无误后,方可到高危药品橱前取药。取药时,根据处方上药品的规格及数量取药。 五.取药后,再次审核处方上药品的规格及数量与所取药品是否相符。无误后,方可交与发药人员。 六.发药人员审核处方上药品的规格及数量与所取药品是否相符。无误后,认真书写药品的用法与用量,并对药品的不良反应及用药注意事项等向患者交代清楚后,将药品发给患者。 七.当发现高危药品的用法用量等出现异常情况时,应提高警惕,查找原因,及时报告。 高危药品管理制度(修订) 高危药品是指药理作用显著且迅速、易危害人体的药品。为促进该药品的合理使用,减少不良反应,制订如下管理制度。 1、高危药品包括高浓度电解质制剂、肌肉松弛剂及细胞毒化药品等,具体品种见附录。 2、高危药品应设置专门的存放药架,不得与其他药品混合存放。 3、高危药品存放药架应标识醒目,设置黄底黑字的警示牌以提醒药学人员注意。 4、高危药品使用前要进行充分安全性论证,有确切适应症时才能使用。 5、高危药品调配、发药实行双人复核,确保药品调剂准确无误。 6、加强高危药品的效期管理,保持先进先出,保持安全有效。
7、加强高危药品的不良反应监测,药学人员定期与临床医护人员沟通,发现问题及时反馈给临床医护人员。 8、新引进高危药品要经过充分论证,引进后要及时将药品信息告知临床,促进临床合理应用。
二、前期物业管理 (一)选聘物业服务企业 1、《中华人民共和国招标投标法》 2、《前期物业管理招标投标管理暂行办法》 (二)签订合同 1、《中华人民共和国合同法》 2、《中华人民共和国物业服务合同示范文本》(三)接管验收 1、《城市住宅小区竣工综合验收管理办法》 2、《房屋接管验收标准》 (四)质量保修 1、《建设工程质量管理条例》 2、《公有住宅售后维修养护管理暂行办法》 3、《房屋建筑工程质量保修办法》 4、《商品住宅实行质量保修保证书和住宅说明书制度的规定》 (五)装修 《住宅室内装饰装修管理办法》 三、物业管理的日常运作 (一)物业服务企业 1、《物业服务企业资质管理办法》 2、《物业服务企业财务管理规定》
3、《全国物业管理从业人员岗位证书管理办法》(二)业主 1、《物权法》 2、《管理规约》(即《业主公约》) 3、《业主大会规程》 4、《业主大会议事规则》 (三)物业管理服务 1、《城市异产毗连房屋管理规定》 2、《城市新建住宅小区管理办法》(即33号令) 3、《普通住宅小区物业管理等级标准》 4、《全国物业管理示范住宅小区标准及评分细则》(四)物业服务收费 1、《中华人民共和国价格法》 2、《物业服务收费管理办法》 3、《机动车停放服务收费管理办法》 4、《物业服务收费明码标价规定》 (五)公共事业收费 1、《城市供水价格管理办法》 2、《城市电力供应与使用条例》 3、《城市燃气管理办法》 (六)维修基金 《住宅共用部分共用设备设施维修基金管理办法》
(七)法律责任 1、《物业管理条例》 2、《民法》 3、《刑法》 4、《民事诉讼法》
沿河土家族自治县人民医院医疗设备 管理制度 随着医医疗事业的发展,作为医疗、科研、教学的医疗设备已成为医院的重要组成部分。按照国家《医疗器械监督管理条例》和《贵州省药品医疗器械使用监督管理办法》对医疗设备的管理要求,我院特制定此医疗设备管理制度,充分发挥医疗设备的效能,提高设备的使用率、完好率,减少或杜绝人为损坏,保证医疗设备处于最佳运行状态。 设备科职责 设备科是全院医疗设备管理的职能部门,在院长的领导下,参加医院医疗设备管理全过程,负责医疗设备的规划调研、立项论证、申报审批、招标采购、安装验收、维护保养、培训使用、报废鉴定、配合财务部门完成医疗设备的调拨使用及报废报批工作。 医疗设备管理制度 一、医疗设备购前论证制度 二、医疗设备采购管理制度 三、医疗设备安装验收制度 四、医用计量器具及压力容器管理制度 五、医疗设备维护及维修管理制度 六、医疗设备调拨管理制度 七、医疗设备报废管理制度
1、设备科负责全院医疗设备购前综合论证工作。 2、医疗设备购前论证会由相关专家和申报科室负责人参与;3、医疗设备购前论证会每季度组织一次; 4、凡价值人民币10万元以上的医疗设备购置,必须进行购前论证工作。经论证许可后方可进行采购申报; 5、申购科室在申请购置医疗设备论证会上,需从以下几个方面进行论证阐述: ①应用论证:重点说明学科、临床应用必需理由; ②市场论证:重点描述所申购设备的市场应用状况; ③配置论证:提供详细的需求配置清单及功能要求; ④人员和场地基本条件论证; ⑤效益论证:社会效益和经济效益等。 6、设备科负责拟购医疗设备的技术审核。 实行专业技术人员负责、参与采购、安装和验收工作。
高危药品管理规定及标 准操作规程 Document number:BGCG-0857-BTDO-0089-2022
高危药品管理制度 高危药品是指药理作用显着且迅速、易危害人体的药品。特点是出现的差错可能不常见,而一旦发生则后果非常严重,使用不当会对患者造成严重伤害或死亡。为促进该药品的合理使用,减少不良反应,由本院药学部、医务部、护理部联合制订如下管理制度。 1、参考美国医疗安全协会(ISMP)的分类,结合我院实际用药情况,由医务 处、护理部及药剂科共同制定《本院高危药品目录》、《管理制度》和《高危药品滴速要求及注意事项》,并由药事管理与药物治疗委员会通过后执行。 2、定期半年对高危药品目录进行更新,新引进高危险药品要经过充分论证,引进 后要及时将药品信息告知临床,指导临床合理用药和确保用药安全。 3、医院信息系统药品信息备注栏中注明“高危”。 4、药库、各调剂部门、病区小药柜对高危药品应设置专门的存放药架,不得与其 他药品混合存放。高危药品存放架应设置专用标识(“高危药品”)提醒医务工作人员注意。 5、加强高危药品的效期管理,保持先进先出,保持安全有效。药剂人员在调配高 危药品时,要严格审查处方,对不合格的处方,拒绝调配。调配和发放要实行双人复核,确保发放准确无误。发药时做到单独发放。护士领药时单独摆放。 6、高危险药品使用前要进行充分的安全性论证,有确切适应症时才能使用。 7、医生应严格按照法定给药途径和标准给药浓度给药。超出标准给药浓度的医嘱 医生须加签字。 8、护理人员执行高危药品医嘱时应注明高危,双人核对后给药。高危药品在使用 时,护士严格执行给药的三查八对原则。
某医院医疗设备维修制度 一、医疗设备维护保养管理(三级保养): 1、一级保养:使用科室指定专人对所使用的设备,每天进行表面除尘和基本参数校正。 2、二级保养:护理部、后勤处配合并指导使用设备科室专管人员,对设备定期或不定期进行设备内部清洁和技术参数校正。 3、三级保养:护理部、后勤处对所分管的设备,定期进行维护和参数校正,包括内部除尘、机械部位加油、除锈等。 二、设备维修管理 1、分管院领导负责制,护理部总体负责全院日常维修和医疗手术设备紧急维修的外联,及陪同工程师维修,直至解决问题。 2、各医疗科室应将设备维修联系工程师的联系电话汇总,报备护理部,由护理部负责制表,报备综合办及院领导,以便应急时需要。 3、维修实行三级负责制。 一级,日常维修保养,定期保养,由科室、手术室负责。 二级,大型设备出现问题或定期保养,由科室报护理部,护理部协调工程师维修,直至解决问题,报备院领导。 三级,大型设备出现问题,或定期保养中发现维修不好及更换零件,应在事故出现2小时内报院领导,由护理部协助院领导联系公司或厂家来工程师解决疑难问题。 4、实行逐层上报,使用科室提出申请、上报护理部、护理部对将要维修的设备初步筛查,根据情况,上报分管院领导。维修所产生的费用,要有分管院领导协商、商榷、上报院长审批核准。 5、所申请维修的设备,要及时制定责任人,限时完成,原则上在保修期内的设备24小时必须完成,在保修期外的设备72小时必须完成。 6、使用科室负责医疗设备的技术验收、保修期内、外维修登记、保修期到期前设备状况总结、设备维修纪录(自修或外修)、关键零配件来源、使用记录、维修价格登记等。 7、维修中由于故障特别复杂或零配件采购困难,后勤人应及时通知设备使用科室,以便及时采取应急措施。 8、对返修率高的医疗设备,后勤人员也应及时向上级报告。
药品相关法律法规试题及答案
药品相关法律法规试题答案 部门:姓名:成绩: 一、选择题(每空3分,共30分) 1.李某,某药店执业药师,欲变更执业地区,相关的变更申请材料应交与( A ) A.新执业单位所在地省级药品监督管理部门 B.原执业单位所在地省级药品监督管理部门 C.原执业单位所在地设区的市级药品监督管理部门 D.新执业单位所在地设区的市级药品监督管理部门 2.取得博士学历的药学专业人员,参加执业药师考试要求的最低的相关工作年限为( A ) A.直接参加,无需相关工作经验 B.1 年 C.3 年 D.5 年 3.根据《国家药品安全“十二五”规划》与《国家药品安全“十三五”规划》的要求,零售药店和医院药房全部实现营业时有执业药师指导合理用药的年份为( D ) A.2012 年 B.2013 年 C.2014 年 D.2015 年 4.主要负责审定考试科目、考试大纲和试题,会同国家食品药品监督管理总局对考试工作进行监督、指导并确定合格标准的部门是( D ) A.国家食品药品监督管理总局 B.设区的市级食品药品监督管理局
C.省级食品药品监督管理局 D.人力资源和社会保障部 5.根据 GSP,以下关于药品收货与验收做法错误的是( B ) A.在保证质量的前提下,如果生产企业有特殊质量控制要求或打开最小包装可能影响药品质量的,可不打开最小包装 B.外包装及封签完整的原料药、实施批签发管理的生物制品,必须开箱检查 C.验收地产中药材时,如果对到货中药材存在质量疑问,应当将实物与企业中药样品室(柜)中收集的相应样品进行比对,确认后方可收货 D.验收药品应当做好验收记录 6.根据《药品经营质量管理规范》,下列说法错误的是( B ) A.企业进行药品直调的,可委托购货单位进行药品验收 B.对质量可疑的药品应当及时报质量管理部门处理,可以继续销售 C.对存在质量问题的药品应存放于标志明显的专用场所,并有效隔离,不得销售 D.怀疑为假药的,及时报告药品监督管理部门 7.根据《药品经营质量管理规范》,有关药品零售企业药品拆零销售,说法错误的是( B ) A.应做好拆零销售记录 B.必须提供药品说明书复印件 C.负责拆零销售的人员应经过专门培训 D.拆零销售期间,应保留原包装和说明书
质量管理制度目录 一、各部门、各类人员的岗位职责 二、员工法规及质量管理培训考核制度 三、供货企业的资质品种审核管理制度 四、进货验收制度 五、仓库保管制度 六、出库复核制度 七、效期产品管理制度 八、不合格产品的确认和处理制度 九、质量跟踪制度 十、不良事件报告制度 十一、质量事故和投诉处理的管理制度十二、产品售后服务的管理制度 十三、有关记录和凭证的管理制度
各部门、各类人员的岗位职责 一、经理职责 1、组织本经销部所有员工认真学习和执行有关《医疗器械监督管理条例》、《医疗器械经营企业许可证管理办法》,在“质量第一”的思想指导下进行经营管理。 2、组织有关岗位人员建立规章制度和完善质量体系,定期召开质量管理工作会议,研究、解决质量工作方面的问题,对本经销部所经营医疗器械质量负全面责任。 3、指导和监督员工严格按《医疗器械监督管理条例》来规医疗器械经营行为。 4、组织有关人员定期对医疗器械进行检查,做到经营医疗器械帐物相符,严禁变质及过期失效、淘汰医疗器械出售现象发生。 5、检查各级质量责任制度的执行情况,表彰先进,处罚造成质量事故的有关人员。 6、负责组织制定和修订各项质量管理制度。 7、负责质量指导、质量计划的实施,对质量体系的工作质量负责。 8、主持质量问题的调查、分析和处理、落实质量奖惩工作。
二、质量管理负责人职责 1、负责贯彻执行国家有关医疗器械质量管理的法律、法规和行政规章。包括:①组织学习国家有关医疗器械质量管理的法律、法规和行政规章。②宣传、贯彻、执行国家有关医疗器械质量管理的法律、法规和行政规章。③指导企业在医疗器械的购进、验收、储存与养护中严格按有关法律、法规办事。 2、负责起草、编制企业医疗器械质量管理制度,并指导、督促制度的执行。 3、负责首营企业的质量审核。包括参与现场考察首营企业。 4、负责首营品种的质量审核。包括参与现场考察首营品种。 5、负责建立企业所经营品种包含质量标准等容的质量档案。 6、负责医疗器械质量的查询和医疗器械质量事故或质量投诉的调查、处理及报告。 7、负责医疗器械的验收管理。 8、负责指导和监督医疗器械保管、养护和运输中的质量工作。 9、负责质量不合格医疗器械的审核,对不合格医疗器械的处理过程实施监督。包括对不合格医疗器械的确认、处理、报损和监督销毁。 10、负责收集和分析医疗器械质量信息。包括企业的外部信息和部
医疗器械相关法律法规知识培训 医疗器械监督管理条例 第一章总则 第一条为了加强对医疗器械的监督管理,保证医疗器械的安全、有效、保障人体健康的生命安全,制定本条例。 第二条在中华人民共和国境内从事医疗器械的研制、生产、经营、使用、监督管理的单位或者个人,应当遵守本条例。 第三条本条例所称医疗器械,是指单独或者组合使用于人体的仪器、设备、器具、材料或者其他物品,包括所需要的的软件;其用于人体体表及体内 的作用不是用药理学、免疫学或者代谢的手段获得,但是可能有这些手 段参与并一定的辅助作用;其作用旨在达到目的下更预期目的;(一)对疾病的预防、诊断、治疗、监护、缓解; (二)对操作或者残疾的诊断、治疗、监护、缓解、补偿; (三)对解剖或者生理过程的研究、替代、调节; (四)妊娠控制。 第四条国务院药品监督管理部门负责全国的医疗器械监督管理工作。 第五条国家对医疗器械实行分类管理。 第一类是指,通过常规管理足以保证其安全性、有效性的医疗器械。 第二类是指,对其安全性、有效性应当加以控制的医疗器械。 第三类是指,植入人体;用于支持、维持生命;对人体具有潜在危险,对其安全性、有效性必须严格控制的医疗器械。 第六条生产和使用以提供具体量值为目的的医疗器械,应当符合计量法的规
定。具体产品目录由国务院药品监督管理部门会同国务院计量行政管理 部门制定并公布。 第二章医疗器械的管理 第七条国家鼓励研制医疗器械新产品,医疗器械新产品,是指国内市场尚未出现过的或者安全性、有效性及产品机理未得到国内认可的全新的品种。第八条国家对医疗器械实行产品生产注册制度。 生产第一类医疗器械,由设区的市级人民政府药品监督管理部门审查批准,并发给产品生产注册证书。 生产第二类医疗器械,由省、自治区、直辖市人民政府药品监督管理部门审查批准,并发给产品生产注册证书。 生产第三类医疗器械,由国务院药品监督管理部门审查批准,并发给产品生产注册证书。 生产第二类、第三类医疗器械,应当通过临床验证。 第九条省、自治区、直辖市人民政府药品监督管理部门负责审批本行政区域内的第二类医疗器械的临床试用或者临床验证。国务院药品监督管理部门负责审批第三类医疗器械的临床试用或者临床验证。 临床试用或者临床验证应当在省级以上人民政府药品监督管理部门指定的医疗机构进行。医疗机构进地临床试用或者临床验证,应当符合国务院药品监督管理部门的规定。 进行临床试用或者临床验证的医疗机构的资格,由国务院药品监督管理部门会同国务院卫生行政部门认定。 第十条医疗机构根据本单位的临床需要,可以研制医疗器械,在执业医师
药品相关法律、法规和相关知识培训资料 一、有关药品的法律、法规 1、《中华人民共和国药品管理法》(自2001年12月1日起施行), 2、《中华人民共和国药品管理法实施条例》(自2002年9月15日起施行)。 3、《药品经营质量管理规范》简称《GSP》自2000年7月1日施行。 4、《药品经营质量管理规范实施细则》自2000年11月16日施行。 5、《药品流通监督管理办法》(自2007年5月1日起施行)。 二、药品经营企业证照 1、必须获得区级或者市级食品药品监督管理局批准并发给的药品批发企业、零售连锁企业的《药品经营许可证》由区药监局颁发,有效期5年。 2、零售药店的《药品经营许可证》由市药监局颁发,有效期5年。 3、《营业执照》每年需到当地工商部门年审一次。 4、药品经营企业成立3个月内向药监理所部门申请GSP认证,通过认证的,由药监部门颁发《GSP认证证书》,有效期为5年。 三、一般药品经营范围 中成药、中药饮片、化学药制剂、抗生素、生化药品、生物制品(除疫苗)、第二类精神药品、医疗用毒性药品、蛋白同化制剂、肽类激素。其中第二类精神药品、医疗用毒性药品、蛋白同化制剂、肽类激素为特殊管理药品。 四、经营方式 1、药品批发企业只能进行批发业务,不能进行药品零售业务。 2、药品零售企业只能进行药品零售,不能进行批发业务。 五、人员要求 1、企业从事验收、养护、计量和销售工作的人员应具有高中(含)以上文化程度。 2、企业从事验收、养护、计量、销售工作的人员应经岗位培训和地市级(含)以上药品监督管理部门考试合格,取得岗位合格证书后方可上岗。 3、企业从事质量管理、药品检验、验收、养护、保管等直接接触药品的岗位工作的人员,每年应进行健康检查并建立档案。 4、企业应对购销人员进行药品相关的法律、法规和专业知识培训,建立培训档案,培训档案中应当记录培训时间、地点、内容及接受培训的人员。 六、药品采购 1、企业应制定能够确保购进的药品符合质量要求的“药品购进控制程序”。 2、企业对首营企业应进行包括资格和质量保证能力的审核,审核由业务部门会同质管部共同进行。除审核有关资料外,必要时应实地考察。经审核批准后,方可从首营企业进货。 3、企业应审核购入药品的合法性,确保购进的药品为合法企业所生产或经营的药品。 4、企业进货应对与本企业进行业务联系的供货单位销售人员,进行合法资格的验证。 5、采购药品时,应索取、查验、留存下列资料: ①加盖供货企业原印章的《药品生产许可证》或《药品经营许可证》、GMP或GSP证书、当年年审营业执照(副本)、税务登记证、组织机构代码证书等复印件。 ②加盖供货企业原印章的法人授权委托书、销售人员身份证复印件、从业人员上岗证。 ③首营品种相关资料:生产批文、质量标准、包装审批件、药品市售包装、说明书原件、物价批文、商品条码证书、广告批文等复印件。 ④与供货商签定质量保证协议和购销合同。 6、企业编制购货计划时应以药品质量作为重要依据,质管部审核通过后才能购进。
《化妆品标识管理规定》实施指南与释义 第一章总则 第一条为了加强对化妆品标识的监督管理,规范化妆品标识的标注,防止质量欺诈,保护消费者的人身健康和安全,根据《中华人民共和国产品质量法》、《中华人民共和国标准化法》、《中华人民共和国工业产品生产许可证管理条例》、《国务院关于加强食品等产品安全监督管理的特别规定》等法律法规,制定本规定。 第二条在中华人民共和国境内生产(含分装)、销售的化妆品的标识标注和管理,适用本规定。 第三条本规定所称化妆品是指以涂抹、喷、洒或者其他类似方法,施于人体(皮肤、毛发、指趾甲、口唇齿等),以达到清洁、保养、美化、修饰和改变外观,或者修正人体气味,保持良好状态为目的的产品。 本规定所称化妆品标识是指用以表示化妆品名称、品质、功效、使用方法、生产和销售者信息等有关文字、符号、数字、图案以及其他说明的总称。 [释义]本条是有关于化妆品和化妆品标识定义的规定 一、关于化妆品的定义 本次规定的化妆品定义与以往监管工作中的化妆品定义以及国家标准中的定义相比,将牙膏、漱口水等口腔清洁护理用品,以及香皂、浴液、洗手液等清洁产品纳入到化妆品的范畴,对其进行监管。 本条在规定化妆品定义的同时,也概括了化妆品的使用目的和主要作用,具体如下: 1.清洁作用指去除面部、体表、指趾甲、毛发、口唇、口腔、牙齿等的污垢和异味,以达到清洁和消除不良气味的目的。起清洁作用的化妆品包括:卸妆霜(乳、水、啫喱)、磨砂膏、香波、洗面奶、浴液、洗手液、香皂、牙膏和漱口水等。 2.保养作用指对面部、体表、毛发、牙齿等部位进行护理和滋养,抵御外界不良环境因素的损伤、保持肌肤柔润光滑,使头发顺滑光泽,延缓肌肤衰老等,起保养作用的化妆品,包括:各种润肤膏、霜、乳、局油膏、精华素等。 3.美化、修饰和改变外观,或者修正人体气味作用是指美化、修饰面部,体表及毛发、牙齿,或者改善人体气味,散发香气,以达到增强魅力的作用。包括各类彩妆、香水、古龙水、摩丝和喷雾发胶等。仅供艺术、戏剧专用油彩类产品不属于化妆品范畴。 二、关于化妆品标识的定义 化妆品标识是指由生产者提供,帮助消费者了解产品的成分、质量、所招待的标准、说明产品的用途,使用方法、保存条件和期限等的相关信息。 标识的内容一般包括化妆品名称、品质、功效、使用方法、生产和经营者信息等说明性资料,可以由文字、符号、数字、图案等方式组合而成。 第二章化妆品标识的标注内容 第五条化妆品标识应当真实、准确、科学、合法。
浓氯化钠注射液的安全使用管理措施 (一)作用机理:补充能量和液体,药物稀释剂等。 (二)用药后观察要点: 1由于输液过多、过快,可致水钠潴留,甚至出现急性左心衰竭,应严格控制补液速度和量,儿童和老年患者尤应注意。 2根据临床需要协助检查血清中钠、钾、氯浓度变化,血液中酸碱浓度平衡指标、肾功能及血压心肺功能等以指导补液。 3药物过量可导致高钠血症和低钾血症,并能引起碳酸氢盐丢失,应严格控制用量。 (三)不良反应:输液过多过快可导致水钠潴留,弓I起水肿、血压升 高、心率加快、胸闷、呼吸困难。 (四)护理措施 1出现水钠潴留时应改用等渗盐水予5%葡萄糖液。同时用排钠利尿药以增加排钠,可用咲塞米或依他尼酸钠。 2出现水肿时应抬高下肢
多巴胺安全使用管理措施 (一)不良反应与禁忌 1不良反应较轻,常见的有胸痛,呼吸困难,心悸,心律失 常,心博快而有力,心跳缓慢,头痛恶心,呕吐等,停药或减 慢滴数可缓解。 2长期或大量输注时,可引起末梢缺血或坏疽,有时甚至肢端 截除。对肢端循环不良的病人,需严密监测,注意坏死或坏疽 的可能性。 3嗜络细胞瘤患者不宜使用。 4闭塞性血管病,包括动脉栓塞,动脉粥样硬化,血栓闭塞性脉 管炎,冻伤,糖尿病性动脉内膜炎,雷诺病等慎用。 (二)观察要点 1选择粗直弹性好的血管。避开关节,静脉瓣和下肢血管,做 到一针见血,避免反复穿刺血管。 2在滴注本药时,应用输液泵控制,匀速输入,监测血压, r]心率,心律及尿量。 3向患者及家属宣教药物的作用,副作用,注意事项,告知病 人及家属不要随意调节速度,以免发生意外,如有异常及时联 系护士。 4建立输液巡视卡,30分钟巡视一次,观察穿刺血管局部皮肤 颜色有无苍白等缺血表现,有无肿胀疼痛,如有应及时根据严 重程度给予更换穿刺部位,局部封闭一体外渗部位等不同处
药品管理法及相关法律法规培训考试题 岗位:姓名成绩考试日期: 一、填空题(共30分)(每题2分) 1 、开办药品经营企业必须具备以下条件:a具有依法经过资格认定的药学技术人员;b、具有与所经营药品相适应的质量管理机构或者人员;c、具有与所经营药品相适应的营业场所、设备、仓储设施、卫生环境;d、具有保证所经营药品质量的规章制度 2、在中华人民共和国境内从事药品的研制,生产,和经营、使用,和监 督管理单位或个人,必须遵守《中华人民共和国药品管理法》。 3、《药品经营许可证》有效期5年,应当标明有效期和经营范围,到期重新审查发证。 4、药品经营企业必须按照国务院药品监督管理部门依据本法制定的《药品经营质量管理规范》经营药品。 5、药品经营企业购进药品必须建立并执行进货检查验收管理制度。 6、药品入库和出库必须执行出库复核检查管理制度。 7、药品广告的内容必须真实、合法以国务院药品监督管理部门批准的说明书为准,不得含有虚假内容。 &新开办药品批发企业和药品零售企业,应当自取得《药品经营许可证》之日起30 内,向发给其《药品经营许可证》的药品监督管理部门或者药品监督管理机构申请《药品经营质量管理规范》。 9、国务院药品监督管理部门核发的药品批准文号、《进口药品注册证》、《医药产品注册证》的有效期为5年。 10、非药品不得在其包装、标签、说明书及有关宣传资料上进行含有预防、治疗、诊断人体疾病等有关内容的宣传;但是,法律、行政规另有规定的除外。
11、药品经企业必须按照国务院药品监督管理部门依据本法制定的《药品经 营质量管理规范》经营药品。药品监督管理部门按照规定对药品经营企业是否符合《药品经营质量管理规范》的要求进行认证;对认证合格的,发给认证证书。 12、发运中药材必须有包装。在每件包装上,必须注明品名、产地、日期、调出单位,并附有质量合格的标志。 13、药品的药品生产、经营企业、医疗机构违反《合格药品管理法》规定,给药品使用者造成损害的,依法承担赔偿责任。 14、药品,是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射性药品、血清、疫苗、血液制品和诊断药品等。 15、首营企业是指采购药品时,与本企业首次发生供需关系的药品生产企业或经营企业。 二、选择题(共30分)(每题5分) 1、药品经营企业必须实施的质量管理规范是:(B) A、GMP B、GSP C GVP D、GMP和GSP 2、《药品管理法》规定销售药品必须准确无误,并正确说明:(C) A、用法、用量 B、用法、用量和不良反应 C、用法、用量和注意事项D注意事项和使用方法 3、按照《药品管理法》中对药品的分类,体外诊断试剂应该属于哪一项:(K) A、中药材 B、中药饮片 C、中成药D化学原料药及其制剂E、抗生素 F、生化药品G放射性药品H血清I、疫苗J、血液制品K、诊断药品。 4、《药品管理法》对劣药的定义是:(C)
环保相关法律法规汇编 目录 中华人民共和国环境保护法(2015年1月1日起施行) (1) 中华人民共和国水污染防治法(2008年6月1日起施行) (12) 中华人民共和国大气污染防治法(2016年1月1日起施行) (29) 中华人民共和国固体废物污染环境防治法(2005年4月1日起施行) (52) 中华人民共和国环境噪声污染防治法(1997年3月1日起施行) (67) 中华人民共和国环境影响评价法(2016年9月1日起施行) (76) 内蒙古自治区高盐水污染防治指导规范(内政办发【2014】38号) (83) 煤炭工业污染物排放标准(GB20426-2006) (86) 污水综合排放标准(GB8978-1996) (96) 地表水和污水监测技术规范(HJ/T91-2002) (118) 火电厂大气污染物排放标准(GB13223-2011) (165) 大气污染物综合排放标准(GB16297-1996) (172) 固定污染源烟气排放连续监测技术规范(试行)(HJ/T75-2007) (200) 固定源废气监测技术规范(HJ/T397 -2007) (233) 工业企业厂界环境噪声排放标准(GB12348-2008) (272) 一般工业固体废物贮存、处置场污染控制标准(GB18599-2001) (279) 固体废物处理处置工程技术导则(HJ2035-2013) (285) 恶臭污染物排放标准(GB14554-1993) (311) 地下水质量标准(GB/T14848-1993) (318) 煤制天然气单位产品能源消耗限额(GB30179-2013) (322) 建设项目环境影响评价技术导则总纲(HJ2.1-2016) (329) 危险废物鉴别技术规范(HJ/T298-2007) (340) 国家危险废物名录(2016年版) (347)
人民医院高危药品使用注意事项 (2015) 高危药品药理作用显著且迅速、易危害人体,生活中如果不能正确了解哪些药品属于高危药品,就很容易造成危险,为安全着想,下面为大家介绍一下2015高危药品使用注意事项。 一、高浓度电解质制剂 1、10%氯化钾注射液——10ml。 注意事项:禁止直接滴注或推注 2、硫酸镁注射液——2.5g。 注意事项:静脉注射不能过快,用药过程中检查膝腱反射,如出现急性镁中毒可用钙剂解救 二、肌肉松弛剂 1、氯化琥珀胆碱注射液——100mg 2、注射用维库溴铵——4mg 3、注射用阿曲库铵——5mg 注意事项:必须在辅助或控制呼吸的条件下使用 三、细胞毒化学药物 1、注射用环磷酰胺——0.2g 2、注射用顺铂——10mg 3、盐酸表柔比星——10mg 4、氟尿嘧啶注射液——0.25g
5、吉西他滨注射液——0.2g 6、注射用亚叶酸钙——0.1g 7、注射用多西他赛——20mg 8、依托泊苷——100mg 9、注射用紫杉醇——30mg 10、注射用卡铂——0.1g 11、注射用依托泊苷——100mg 12、注射用羟喜树碱——5mg 13、注射用替加氟——0.5g 14、卡培他滨片——0.5g×12 注意事项:本类药品由于具有具有致癌、致畸、生殖毒性、低剂量致系列器官损伤的特点,使用过程及搬运、储存的过程中必须严格、细心管理;暴露于细胞毒性药物的药厂工作人员和肿瘤化疗操作人员可以发生以下几方面的不良反应:接触性皮炎湿疹、荨麻疹和变态反应、恶心、呕吐、头晕、肝肾损害、女性月经紊乱、早产、异位妊娠、子女畸形等。 四、静脉用肾上腺素能受体激动剂 1、肾上腺素注射液——1mg 2、去甲肾上腺素注射液——2mg 注意事项:药液外漏引起局部组织坏死。本品强烈是血管收缩,使重要脏器器官血流减少,肾血流锐减后尿量减少:
二、主要法律法规 1、药品生产许可、新药研发 《中华人民共和国药品管理法》于2001年2月28日由第九届全国人民代表大会常务委员会第二十次会议修订。该法规定: 在我国境内从事药品的研制、生产、经营、使用和监督管理的单位或者个人,必须遵守本法;在我国开办药品生产企业,须经企业所在 地省、自治区、直辖市人民政府药品监督管理部门批准并发给《药品生产许可证》,凭《药品生产许可证》到工商行政管理部门办理登记注册;《药品生产许可证》应当标明有效期和生产范围,到期重新审查发证;药品生产企业必须按照国务院药品监督管理部门依据本法制定的《药品生产质量管理规范》组织生产;药品监督管理部门按照规定对药品生产企业是否符合《药品生产质量管理规范》的要求进行认证(GMP 认证),认证合格发给认证证书。 研制新药,必须按照国务院药品监督管理部门的规定如实报送研 制方法、质量指标、药理及毒理试验结果等有关资料和样品,经国务院药品监督管理部门批准后,方可进行临床试验。药物的非临床安全性评价研究机构和临床试验机构必须分别执行药物非临床研究质量管理规范、药物临床试验质量管理规范。 2、药品生产质量管理 《药品生产监督管理办法》于2004年8月5由国家药监局发布。该管理办法规定:国家对医药行业(包括生物制药行业)采取行业许可 和产品许可制度;药品生产企业必须持有《药品生产许可证》方可从事药品生产活动,取得生产批准文号的药品方可进行生产和销售;药品生产企业必须按照国家药品监督管理局制定的《药品生产质量管理规范》(GMP)组织生产。 《药品生产质量管理规范认证管理办法》于2005年9月7日由国家药监局发布。该管理办法规定:注射剂、放射性药品、国家药监局规
招投标法律法规汇编 一、招投标相关法律法规 《招标投标法》 《招标投标法实施条例》 《工程建设项目招标范围和规模标准规定国家发展计划委员会令第3号》 《通信工程建设项目招标投标管理办法【工信部令27号】》 《中华人民共和国财政部令第74号政府采购非招标采购方式管理办法》 《政府采购评审专家管理办法详细内容》 《评标委员会和评标方法暂行规定》 二、基本原则 1、关于肢解项目规避招标的规定 《招标投标法》第四条任何单位和个人不得将依法必须进行招标的项目化整为零或者以其他任何方式规避招标。 《通信工程建设项目招标投标管理办法【工信部令27号】》第二十二条通信工程建设项目已确定投资计划并落实资金来源的,招标人可以将多个同类通信工程建设项目集中进行招标。招标人进行集中招标的,应当遵守《招标投标法》、《实施条例》和本办法有关依法必须进行招标的项目的规定。 2、关于必须招标范围的规定 《工程建设项目招标范围和规模标准规定国家发展计划委员会令第3号》第二条规定必须招标范围:关系社会公共利益、公众安全的基础设施项目的范围
包括:(三)邮政、电信枢纽、通信、信息网络等邮电通讯项目; 《工程建设项目招标范围和规模标准规定国家发展计划委员会令第3号》第四条规定必须招标范围:使用国有资金投资项目的范围包括: (一)使用各级财政预算资金的项目; (二)使用纳入财政管理的各种政府性专项建设基金的项目; (三)使用国有企业事业单位自有资金,并且国有资产投资者实际拥有控制权的项目。 3、关于必须招标规模的规定 《工程建设项目招标范围和规模标准规定国家发展计划委员会令第3号》第七条,上述5、6条规定的项目;包括项目的勘察、设计、施工、监理以及与工程建设有关的重要设备、材料等的采购,达到下列标准之一的,必须进行招标(一)施工单项合同估算价在200万元人民币以上的; (二)重要设备、材料等货物的采购,单项合同估算价在100万元人民币以上的; (三)勘察、设计、监理等服务的采购,单项合同估算价在50万元人民币以上的; (四)单项合同估算价低于第(一)、(二)、(三)项规定的标准,但项目总投资额在3000万元人民币以上的。 4、一个完整的招投标程序 招标、投标、开标、评标、中标、签订合同及项目实施 三、招标方式分类及相关法律规定 1、招标 《招标投标法》第十条必须招标分为公开招标和邀请招标。 公开招标,是指招标人以招标公告的方式邀请不特定的法人或者其他组织投标。 邀请招标,是指招标人以投标邀请书的方式邀请特定的法人或者其他组织投标。
医疗器械设备管理制度 一、一般管理制度 1、护士长全面负责物品、药品、器材的领取、保管及报损等管理工作。建立账目,定人分类保管,定期检查,做到账物相符。 2、各类物品指定专人管理。贵重物品每天清查核对,一般物品每月清点。 3、凡因违反操作规程而损坏物品,应根据医院赔偿制度处理。 4、管理人员应掌握各类仪器的性能和使用要求,注意保养,提高使用率。 5、借出物品必须办理登记手续,经手人签名。重要物品,经护士长同意后方可借出,抢救器材一般不外借。 6、护士长调动时必须办好移交手续,交接双方共同清点并签名。 二、药品保管制度 1、护理单元药品必须经医院药房检查合格后方可使用。应根据病种和需要保持一定数量。 2、根据药品种类与性质,如针剂、内服、外用、剧毒药等分类定位放置,标志明显,每日检查,专人负责领取及保管。如发现沉淀、变色、过期、标签模糊或经涂改者,及时清理,不得使用。相同颜色的同类口服药和不同剂量的同类针剂药品不得混放。 3、根据药剂科定期检查药品质量的结果,及时处理和改进存在的问题。
4、病人的贵重药品,应写明床号、姓名,加锁存放,不用时及时退回药房。 5、麻醉药品应设固定专柜,定量加锁存放,专人保管,每班清点签名,注射时二人核对,用后登记签名并保留空安瓿,残余量须二人核对后销毁,并双签名。 三、被服管理制度 1、有病房根据床位数确定被服基数与机动数,每月清点。 2、病人出、入院时,护士负责交、收被服,当面点清。 3、脏被服放于污物车,送洗衣房清洗。 4、各类布类物品,每月一次报损,需经护理部、中心仓库、后勤服务中心认同可报损。 四、器械/设备/材料管理制度 1、医疗器械由专人负责保管,督促和协助设备科定期检查、保养、维修,保持性能良好。 2、建立仪器操作程序卡。使用时,必须了解器械的性能,严格遵守操作规程,用毕妥善消毒、保管。 3、精密仪器必须指定专人负责保管,用毕由保管者检查后签名。 曲靖市第一人民医院皮肤科
医疗仪器、设备档案管理制度 为了保证医院设备档案资料的齐全、完整与安全,特制定如下制度: 一、凡医院购置的二千元以上且使用年限在五年以上的仪器、设备必须逐一编号登记,建立完整的技术档案。医疗仪器、设备档案设专人管理。 二、档案的内容包括: 1、购置设备的申请报告。 2、定货合同书、购置设备手续凭证或影印件。 3、仪器、设备全部的技术资料如产品使用说明书、技术图纸等。 4、开箱单、验收报告单。 5、设备运行维修记录或报告。 6、定期巡检情况记录或报告。 7、新添置的设备,开箱验收时要由档案管理员及使用科室人员参加,详细填写验收报告。 三、已建档的仪器设备在管理、使用、维修和改进工作中形成的文件材料应归档,不得随意乱放,以免丢失。 四、归档的文件资料力求完整、系统、准确;改造、更换原部件的图纸必须与实物相符。 各项设备应归档的材料,除随设备带来的产品合格证,技术资料,说明书等外,还应对设备添置时间,必要的性能型号,颜色等登记存档。 五、档案管理人员负责仪器设备档案的收集、整理、统计、建档工作,医疗仪器、设备档案每年要整理、核对一次,做到账物相符。归档文件要编排有序,目录清楚,装订整齐,查找方便。要建立计算机仪器、设备档案台账和检索。 六、医疗仪器、设备的技术档案原件原则上不外借,确因工作需要时: 1、在档案管理人员监督下复印,原件如数收回。 2、写出借阅申请,经院领导批准后,办理借阅手续,时间不得超过一个月。 3、借阅人必须爱护档案,妥善保管按时归还,造成缺损、丢失将给予经济处罚。
七、医疗仪器、设备的档案要保存在安全可靠的地方,注意防潮、防虫咬、防霉变。 感谢您的支持与配合,我们会努力把内容做得更好!