
【志鸿优秀教案】2013-2014学年高中化学第二章化学反应与
能量教案新人教版必修2
从容说课
本节课是复习课,包括第二章全部内容。通过复习使学生熟悉基础知识,重点掌握探究实验中的过程与方法,发展学习化学的兴趣,以及将化学知识应用于生产、生活实践的意识。具体从以下几方面入手:
1.化学键的断裂和形成是化学反应中能量变化的主要原因。
2.了解化学能转化为热能在生产、生活中的应用及其对人类文明发展的贡献。
3.了解化学电池的化学反应基础(氧化还原反应)及研制新型电池的重要性。
4.认识化学反应的速率、化学平衡、反应限度;控制反应条件对生产、生活及科学研究的意义,解决提高燃料燃烧效率等一些实际问题。
5.获得有关化学实验的基础知识和基本技能,学习实验探究的方法,能设计并完成一些化学实验;经历对化学物质及其变化进行探究的过程,进一步理解科学探究的意义,学习科学探究的基本方法,提高科学探究能力。有参与化学科技活动的热情,有将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题做出合理的判断。
三维目标
知识与技能
1.掌握化学能与热能、化学能与电能的关系;化学反应速率与限度的概念及其意义。
2.用探究实验的方法解决化学反应中化学反应的速率和限度、能量的转化等化学问题。
过程与方法
1.学会运用观察、实验、查阅资料等多种手段获取信息,并运用比较、分类、归纳、概括等方法对信息进行加工。
2.通过典型例题的分析学习,掌握分析问题、解决问题的方法。
3.能对自己的化学学习过程进行计划、反思、评价和调控,提高自主学习化学的能力。
情感、态度与价值观
1.有将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题作出合理的判断。
2.赞赏化学科学对个人生活和社会发展的贡献,关注与化学有关的社会热点问题,逐步形成可持续发展的思想。
要点提示
教学重点:运用比较、分类、归纳、概括等方法对信息进行加工。
教学难点:培养举一反三的能力,培养发散思维、创新思维的能力。
教具准备:实物投影仪多媒体课件
教学过程
导入新课
多媒体课件显示:
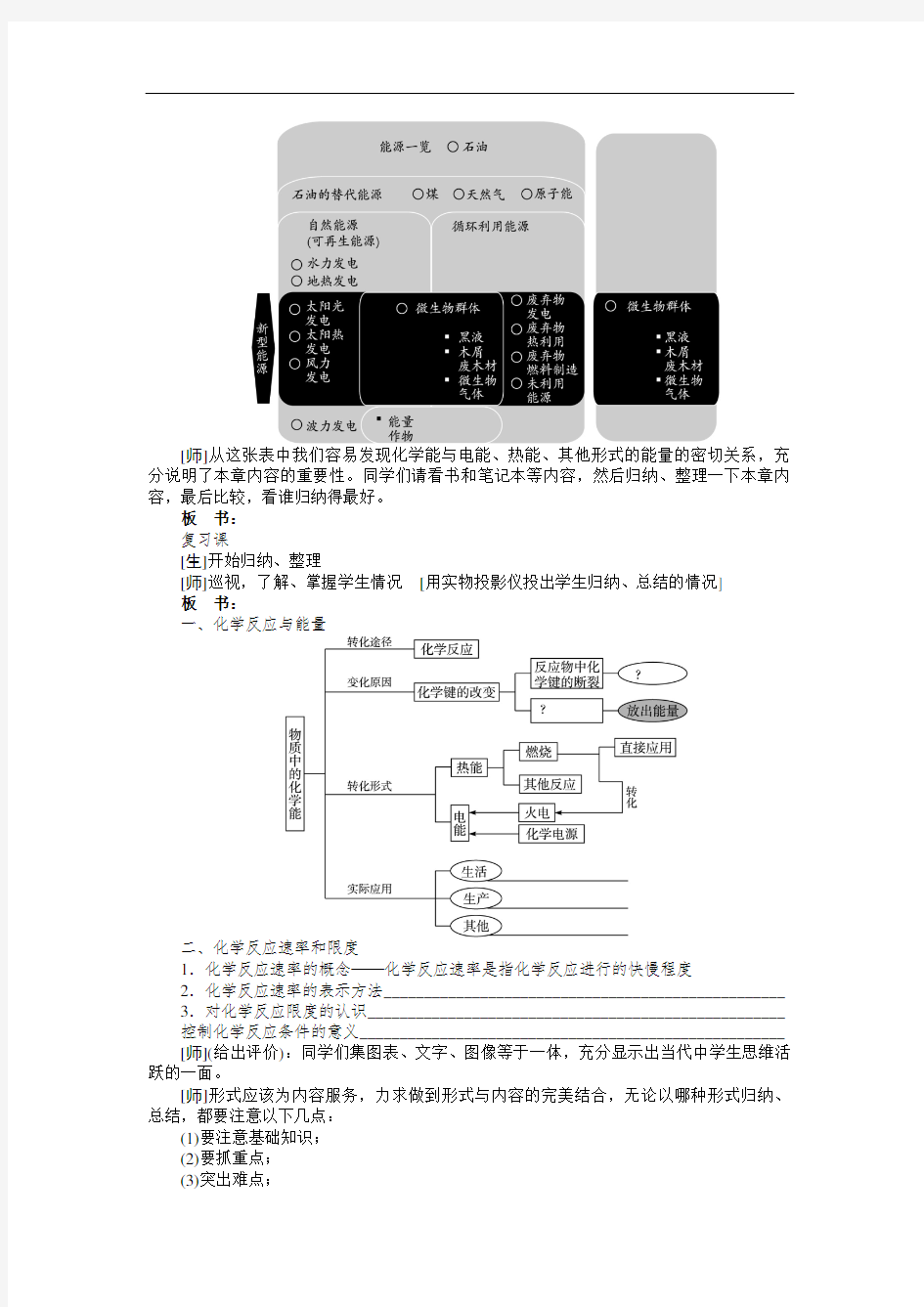
目前人类正在使用的能源一览表
[师]从这张表中我们容易发现化学能与电能、热能、其他形式的能量的密切关系,充分说明了本章内容的重要性。同学们请看书和笔记本等内容,然后归纳、整理一下本章内容,最后比较,看谁归纳得最好。
板书:
复习课
[生]开始归纳、整理
[师]巡视,了解、掌握学生情况[用实物投影仪投出学生归纳、总结的情况]
板书:
一、化学反应与能量
二、化学反应速率和限度
1.化学反应速率的概念——化学反应速率是指化学反应进行的快慢程度
2.化学反应速率的表示方法__________________________________________________ 3.对化学反应限度的认识____________________________________________________ 控制化学反应条件的意义_____________________________________________________ [师](给出评价):同学们集图表、文字、图像等于一体,充分显示出当代中学生思维活跃的一面。
[师]形式应该为内容服务,力求做到形式与内容的完美结合,无论以哪种形式归纳、总结,都要注意以下几点:
(1)要注意基础知识;
(2)要抓重点;
(3)突出难点;
(4)便于掌握、理解。
【例1】某学校设计了一节实验活动课,让学生从废旧干电池中回收碳棒、锌皮、MnO 2、NH 4Cl 、ZnCl 2等物质,整个实验过程如下,请回答有关问题。
干电池示意图
(1)有关干电池的基本构造和工作原理,下图是干电池的基本构造图。干电池工作时负极上的电极反应式是__________________________,MnO 2的作用是除去正极上的产物,本身生成Mn 2O 3,该反应的化学方程式是________________________________。
(2)锌皮和碳棒的回收。用钳子和剪刀剪开回收的干电池的锌筒,将锌皮和碳棒取出,并用毛刷刷洗干净,将电池的黑色粉末移入小烧杯中。
(3)氯化铵、氯化锌的提取、检验和分离。如何从黑色粉末中提取NH 4Cl 、ZnCl 2等晶体的混合物?写出简要的实验步骤(填操作名称)。
____________________________________________。
(4)最后剩余黑色残渣的主要成分是MnO 2,还有炭黑和有机物。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有______________________________。
[师]干电池是同学们熟悉的电源,它的负极是锌片,正极是石墨碳棒。书写电极反应方程式时:1.要根据化合价的变化,确定正负极;2.根据质量守恒、电荷守恒写出电极反应方程式。
答案:(1)Zn -2e -===Zn 2+ 2MnO 2+H 2===Mn 2O 3+H 2O
(3)①溶解、过滤、蒸发、结晶 ②(a)取所得晶体适量于烧杯中,加水溶解
(b)取(a)所得溶液少许于试管中,加NaOH 溶液,加热
(c)产生使湿润红色石蕊试纸变蓝的气体
(d)NH +4+OH -=== NH 3↑+H 2O
(e)取(a)所得少量溶液于试管中,加入NaOH 溶液使全部生成沉淀,将沉淀分成三份,一份加盐酸至过量,一份加NaOH 溶液至过量,一份加氨水至过量
(f)三份白色沉淀均溶解
(4)坩埚、玻璃棒、三脚架、泥三角等
【例2】化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO 3和Na 2CO 3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查)。
请完成下列问题:
(1)各组反应开始时,______________装置中的气球体积先变大,该装置中反应的离子方程式是______________________。 试剂用量 实验现象(气球体积变化)
分析原因 第①组 0.42 g NaHCO 3,0.53 g Na 2CO 3,3 mL 4 mol·L -1盐酸 甲中气球与乙中气球的体积相等 甲、乙盐酸均过量,n (NaHCO 3)=n (Na 2CO 3),V 甲(CO 2)=V 乙(CO 2)
第②组0.3 g NaHCO3,0.3 g
Na2CO3,3 mL 4 mol·L-1
盐酸
甲中气球比乙中气球
的体积大
第③组0.6 g NaHCO3,0.6 g
Na2CO3,3 mL 2 mol·L-1
盐酸
甲中气球比乙中气球
的体积大
片刻后,乙中气球又缩
小,甲中气球的体积基
本不变
(用离子方程式表示)
HCO-3+H+===CO2↑+H2O
试剂用量实验现象(气球体积变化) 分析原因
②
甲、乙盐酸均过量,
n(NaHCO3)>n(Na2CO3),V甲(CO2)> V乙(CO2)
③甲、乙盐酸均不足量,消耗的n(NaHCO3)>n(Na2CO3),V甲(CO2)>V乙(CO2)
CO2+H2O+CO2-3===2HCO-3
本节课我们对本章内容进行了归纳总结,同学们要善于不断总结,不断地将所学知识系统化、网络化,以便记忆、应用。
布置作业
习题1、10
板书设计
复习课
一、化学反应与能量
二、化学反应速率和限度
1.化学反应速率的概念——化学反应速率是指化学反应进行的快慢程度。
化学反应速率的表示方法__________________________________________。
2.对化学反应限度的认识____________________________________________。
3.控制化学反应条件的意义__________________________________________。
活动与探究
2005年10月12日,我国成功发射“神舟”六号载人飞船。这标志着我国在航天领域
的科研水平有重大突破。
(1)肼(N2H4)是发射航天飞船常用的高能燃料。一般将液态N2O4作为火箭的推进剂。已知1 mol液态肼与足量液态N2O4完全反应放出Q kJ的热量,产物是对环境无害的氮气和水蒸气,但实际发射过程中会看到有大量红色的烟雾,除了该反应可能产生少量NO外,产生此现象的原因可能是__________________________________________。
(2)实际上,最理想的燃料是燃烧热值大、体积小、本身毒性小、安全的固态氢,目前人们还不能制得固态氢,因为____________________________________________。
(3)新型无机材料在航天工业中也有广泛应用,如飞船表面覆盖有一种耐高温的氮化硅陶瓷,该物质中各原子均满足最外层8电子结构,则氮化硅的化学式为____________________。
(4)飞船上的能量主要来自于太阳能和燃料电池。常用的燃料电池是氢氧燃料电池,已知负极的反应式为:2H2-4e-+4OH-===4H2O,正极的反应式为__________________,工作时________极pH相对较大。
答案:(1)2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g);部分N2O4转化为NO2
(2)制备时需要极高的压强(其他合理答案均可)
(3)Si3N4
(4)O2+4e-+2H2O===4OH-正
参考练习
1.为迎“绿色奥运”某同学提出了下列环保建议,其中你认为可以采纳的是()
①用气态燃料代替液态和固态燃料作为发动机动力来源
②开发生产无汞电池
③提倡使用一次性发泡塑料餐具和塑料袋
④分类回收垃圾
⑤开发无磷洗涤剂
⑥提倡使用手帕,减少餐巾纸的使用
A.①②③④B.②③④⑤
C.①②④⑤⑥D.全部
2.把锌片和铁片放在有稀食盐水的酚酞溶液的表面皿中,如下图所示经过一段时间后,最先观察到变红的区域是()
A.Ⅰ和ⅢB.Ⅰ和Ⅳ
C.Ⅱ和ⅢD.Ⅱ和Ⅳ
3.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是() A.b电极是正极
B.总反应方程式为:2H2+O2===2H2O
C.负极发生还原反应,正极发生氧化反应
D.氢氧燃料电池是一种具有应用前景的绿色电源
4.航天器的燃料之一是铝粉与高氯酸铵(NH4ClO4)的固体混合物,点燃时铝粉氧化放热引发高氯酸铵反应,其反应式为:
2NH4ClO4===N2↑+4H2O↑+Cl2↑+2O2↑反应放出大量热,下列对该反应的叙述中,错误的是()
A.NH4ClO4既是氧化剂,又是还原剂
B.1 mol NH4ClO4完全反应时,转移14 mol电子
C.反应中只有Cl 元素被还原
D.从能量角度看,化学能主要转变为热能和动能
5.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池
分别在充电和放电时发生的反应:
Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2
下列有关对爱迪生蓄电池的推断错误的是()
A.放电时,Fe是负极,NiO2是正极
B.充电时,阴极上的电极反应式为:Fe(OH)2+2e-===Fe+2OH-
C.放电时电解质溶液中的阴离子是向正极方向移动
D.蓄电池的电极必须浸入碱性电解质溶液中
6.下列说法正确的是()
A.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.中和反应都是放热反应,盐类水解反应都是吸热反应
C.在101 kPa 1 mol碳燃烧所放出的热量一定是碳的燃烧热
D.碳与二氧化碳的反应既是吸热反应,又是化合反应
7.下列说法正确的是()
A.化学反应中的能量变化,通常主要表现为热量的变化
B.反应物的总能量高于生成物的总能量时发生吸热反应
C.Ba(OH)2·8H2O与NH4Cl的反应是放热反应
D.工业法制硫酸的三步主要反应都是放热反应
8.汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4===2PbSO4↓+2H2O,根据此反应判断下列叙述中正确的是() A.PbO2是电池的负极
B.负极的电极反应式为:Pb+SO2-4-2e-===PbSO4↓
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
9.一种新型熔融盐燃料电池具有高发电效率而备受重视。现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2的混合气体,制作650 ℃时工作的燃料电池,其电池总反应是2CO+O2===2CO2。则下列说法中正确的是() A.通CO的一极是电池的正极
B.负极电极反应是O2+2CO2+4e-===2CO2-3
C.熔融盐中CO2-3的物质的量在工作时保持不变
D.正极发生氧化反应
10.100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为减缓反应速率,又不影响生成的氢气的总量,可采用的方法是()
A.加入适量的6 mol·L-1的盐酸
B.加入适量Na2CO3固体
C.加入适量Na2SO4溶液
D.加入适量CH3COOK固体
参考答案
1.C2.B3.C4.B5.C6.BD7.B8.B9.C10.CD
备课资料
原电池正负极的确定
原电池正负极的确定:将铜锌两种金属放在电解质溶液中,用导线连接,便构成原电池的两极,如图。由于Cu、Zn两种金属电势高低不同,所以存在着电势差。电子总是从低电势的极流向高电势的极。电势的高低一般可根据金属的活泼性确定:金属越活泼其电极电势就越低,金属越不活泼其电极电势就越高。由于锌比铜活泼,所以电子总是从锌极流向铜极。电化学上把电子流出的极定为负极,流入的极定为正极。如图所示,锌为负极,铜为正极。
原电池
原电池中主要的反应类型
(1)电极与电解质溶液中的电解质发生氧化还原反应。例如锌、铜和稀硫酸,锌、铜和硫酸铜溶液都可以构成原电池,这些原电池的原理是锌、铜和稀硫酸及硫酸铜溶液能分别发生氧化还原反应。铁、碳棒和三氯化铁溶液也能构成原电池,这是由于铁与三氯化铁能发生氧化还原反应:
Fe+2FeCl3===3FeCl2
(2)电极与电解质溶液中溶解的氧气等物质的反应。如将铁和碳棒插入NaCl溶液,铜和碳棒插入NaCl溶液,都有电流产生,这是因为发生了原电池反应:
负极:2Fe-4e-===2Fe2+2Cu-4e-===2Cu2+
正极:2H2O+O2+4e-===4OH-2H2O+O2+4e-===4OH-
NaCl起着增强溶液导电性的作用,未形成原电池时,在常温下铁与水及铜与水都是不反应的。
但是,将锌和铜插入ZnCl2浓溶液中则不能构成原电池,因为Zn2+的大量存在抑制锌的离子化,使氧化还原反应不易发生。当然,要构成有实际意义的原电池,必须对电极材
料、电解质溶液都有所选择。