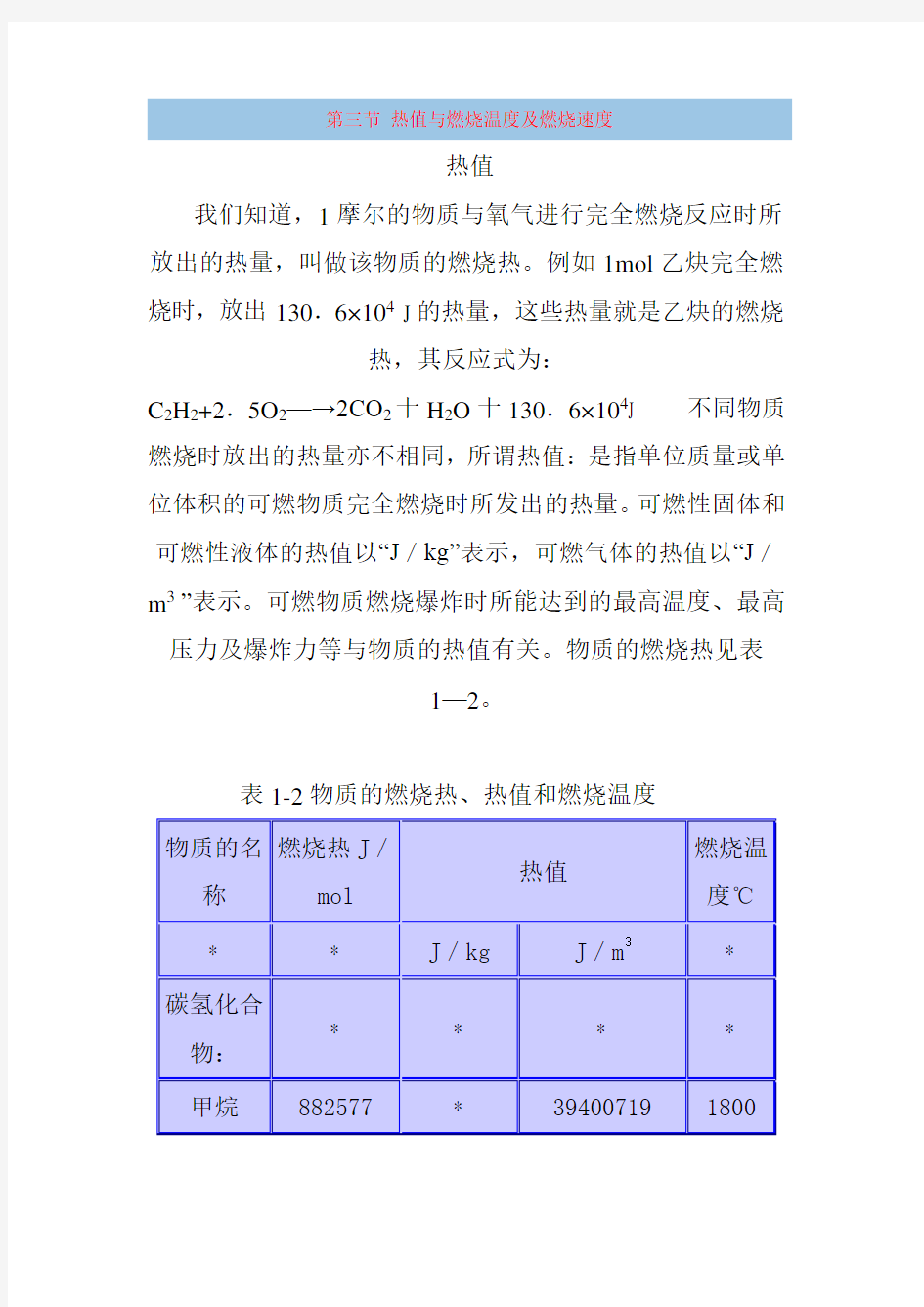
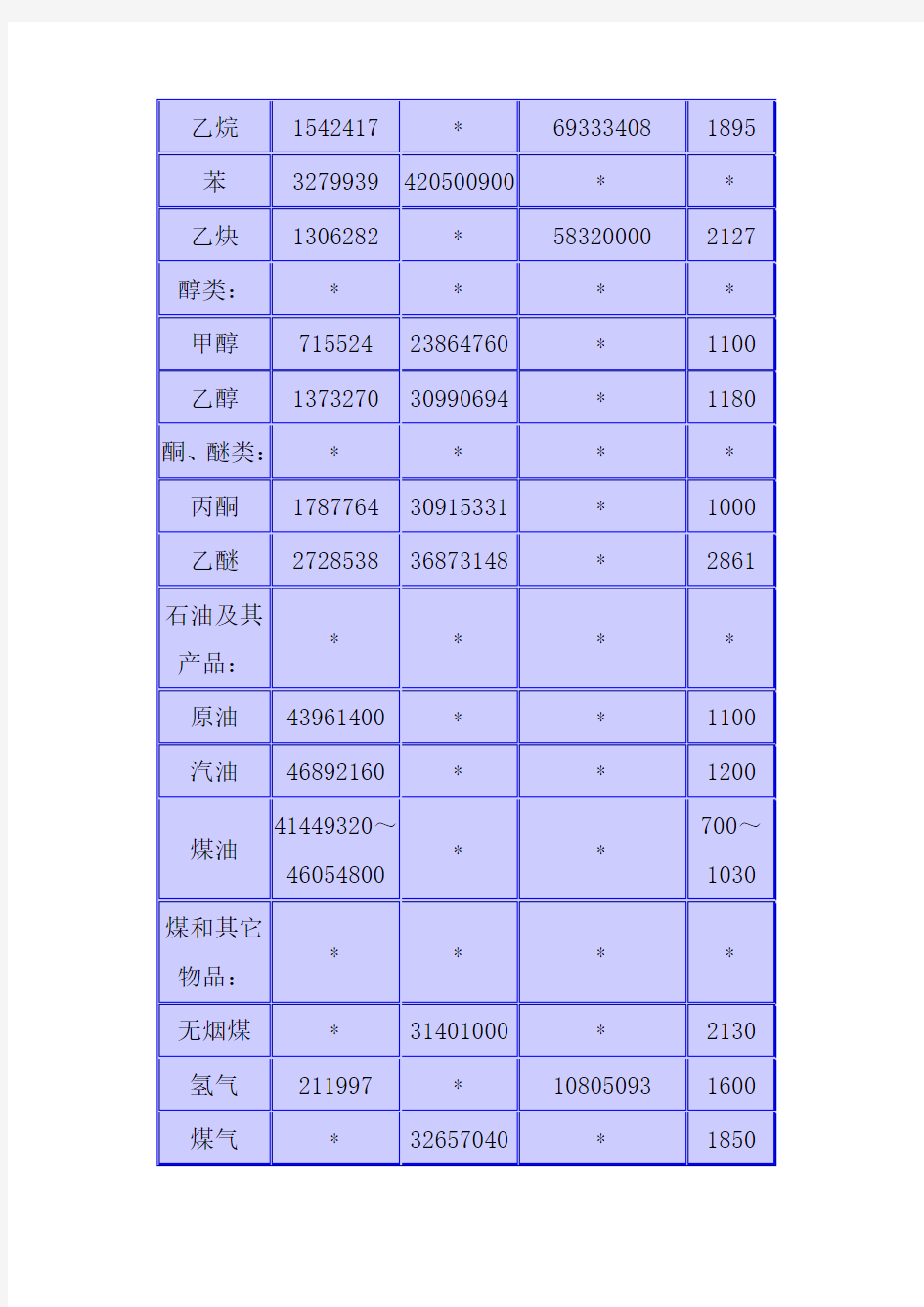
可燃物质的热值是用量热法测定出来的,或者根据物质的元素组成用经验公式计算。Q=(1000*Q燃
烧)/22.4 (1—1)
1.可燃物质如果是气态的单质和化合物,其热值可按下式计
算,
式中:Q——每1m3可燃气体的热值,J/m3;
Q燃烧——每摩尔可燃气体的燃烧热,J/mol。
[例1]试求乙炔的热值。
[解]从表1—2中查得乙炔的燃烧热为130.6×104J/mol;代入
公式(1—1)
答:乙炔的热值为5.83×107J/m3。
2. 可燃物质如果是液态或固态的单质和化合物,其热值可按下
式计算:Q=(1000*Q燃烧)/M (1—2)
式中:M——可燃液体或固体的摩尔质量。
[例2]试求苯的热值;(苯的摩尔质量为78)
[解〕从表1—2查得苯的燃烧热为328X104J/mol,代入公式
(1—2)
答:苯的热值为4.21×107J/kg。
3.对于组成比较复杂的可燃物,如石油、煤炭、木材等,其热值可采用门捷列也夫经验公式计算其高热值和低热值。高热值是指单位质量的燃料完全燃烧,生成的水蒸汽也全部冷凝成水时所放出的热量;低热值是指单位质量的燃料完全燃烧,生成
的水蒸汽不冷凝成水时所放出的热量。门捷列也夫经验公式如
下:
Q高= 81C+300H-26(O-S) (1—3)
Q低= 81C+300H-26(O-S)-6(9H+w) (1—4)
式中,Q高、Q低——可燃物质的高热值和低热值,kcal/kg;
C——可燃物质中碳的含量,%;
H——可燃物质中氢的含量,%;
O—一可燃物质中氧的含量,%;
S——可燃物质中硫的含量,%;
w—一可燃物质中的水分含量,%,
[例] 试求5kg木材的低热值。木材的成分为:C——43%,H—一7%,O——41%,S——2%,
W——7%
[解]将己知物质的百分组成代入公式(1—4)
Q=81×43+300×7-26(41-2)一6(9×7+7)=4149(kcal/
kg)=1735.9×104(J/kg)
则5kg木材的低热值为:
5×1735.9×104=8679.7×104J
答:5kg木材的低热值为8679.7×104J。
可燃物质的热值见表l-2。
二、燃烧温度
可燃物质燃烧时所放出的热量,一部分被火焰辐射散失,而大部分则消耗在加热燃烧产物上。由于可燃物质燃烧所产生的热量是在火焰燃烧区域内析出的,因而火焰温度也就是燃烧温度。可燃物质的燃烧温度见表1—2。
火焰最高温度的计算:
燃烧过程是典型的非等温反应。在这种情况下,可利用图3-5那样的恒压循环过程作计算。如反应物的温度为T1,产物温度为T2,则反应的ΔH为: ΔH=ΔH1+ΔH0298+ΔH2
常温下的反应物,进入火焰后立即变为产物。由于过程是瞬间完成的,可以近似地认为反应是在绝热条件下完成的,反应放出的热全部用来加热产物和掺杂在反应物中的惰性气体,使之升高到火焰温度。根据如此假设计算出的是火焰的最高温度T m。实际上,火焰并不是绝热的化学反应气团,所以温度要低
一些。
例3.9 燃烧水泥的转炉是利用煤粉燃烧加热的。假设喷进转炉的煤粉掺有按燃烧反应计量的空气,试问转炉可能达到多高的
温度?
解煤粉燃烧过程可以用图3.6那样的恒压循环过程表示。假设反应是在绝热条件下进行的,所以ΔH=0。因为循环过程,ΔH1+ΔH2 -ΔH=0,所以ΔH1=ΔH2
ΔH1是煤粉的燃烧热,也就是CO2的生成热,等于-94.05千卡。1摩尔煤粉燃烧需要1摩尔氧气,生成1摩尔二氧化碳,同时还混有4摩尔的氮气(空气中O2:N2=1:4)。所以,ΔH2是l摩尔CO2和4摩尔氮气从298K升温到Tm所需的热量。查表知它
们的热容为
CO2 Cp=6.37十10.10×10-3T-3.41×10-6T2
N2 Cp=6.66十1.02×10-3T
=33.01Tm+7.09×10-3Tm2-1.14×10-6Tm3-10434 又因为ΔH2=ΔH1=94050卡,所以得到关于火焰最高温度的方
程为:
1.14×10-6Tm3-7.09×10-3Tm2-33.01Tm +104484=0
解得Tm=2404(K)
实际上,火焰温度要比Tm低,因为不能达到绝热条件,而且从理论上讲,计算中假设碳和氧完全化合成CO2,这是近似的,在高温下二氧化碳的离解作用也不应忽视。理论上严格计算火
硝化纤维素的制品等,本身含有不稳定的基团,燃烧是分解式的,燃烧比较剧烈、速度很快。对于同一种固体可燃物质其燃烧速度还取决于燃烧比表面积。即燃烧的表面积与体积的比例越大,则燃烧速度越大;反之,燃烧速度越小。
燃煤锅炉的低NO x燃烧技术 NO x是对N 2O、NO 2 、NO、N 2 O 5 以及PAN等氮氧化物的统称。在煤的燃烧过程中, NO x生成物主要是NO和NO 2 ,其中尤以NO是最为重要。实验表明,常规燃煤锅炉中NO生成量占NO x总量的90%以上,NO2只是在高温烟气在急速冷却时由部分NO 转化生成的。N2O之所以引起关注,是由于其在低温燃烧的流化床锅炉中有较高的排放量,同是与地球变暖现象有关,对于N2O的生成和抑制的内容我们将结合流化床燃烧技术进行介绍。 因此在本章的讨论中,NO x即可以理解为NO和NO2。 一、燃煤锅炉NO x的生成机理 根据NO x中氮的来源及生成途径,燃煤锅炉中NO x的生成机理可以分为三类:即热力型、燃料型和快速型,在这三者中,又以燃料型为主。它们各自的生成量和炉膛温度的关系如图3-1所示。试验表明,燃煤过程生成的NO x中NO占总量的90%,NO2只占5%~10%。
1、热力型NO x 热力型NO x是参与燃烧的空气中的氮在高温下氧化产生的,其生成过程是一个不分支的链式反应,又称为捷里多维奇(Zeldovich)机理 →(3-1) O2 O 2 + → NO N N O+ (3-2) 2 + → NO N+ O O (3-3) 2 如考虑下列反应 → +(3-4) OH N+ NO H 则称为扩大的捷里多维奇机理。由于N≡N三键键能很高,因此空气中的氮非常稳定,在室温下,几乎没有NO x生成。但随着温度的升高,根据阿仑尼乌斯 (Arrhenius)定律,化学反应速率按指数规律迅速增加。实验表明,当温度超
过1200℃时,已经有少量的NO x生成,在超过1500℃后,温度每增加100℃,反应速率将增加6~7倍,NO x的生成量也有明显的增加,如图3-1所示。 但总体上来说,热力型NO x的反应速度要比燃烧反应慢,而且温度对其生成起着决定性的影响。对于煤的燃烧过程,通常热力型NO x不是主要的,可以不予考虑。一般来说通过降低火焰温度、控制氧浓度以及缩短煤在高温区的停留时间可以抑制热力型NO x的生成。 2、快速型NO x 快速型NO x中的氮的来源也是空气中的氮,但它是遵循一条不同于捷里多维奇机理的途径而快速生成的。其生成机理十分复杂,如图3-2所示。 通常认为快速型NO x是由燃烧过程中的形成活跃的中间产物CH i与空气中的氮反应形成HCN、NH和N等,再进一步氧化而形成的。在煤的燃烧过程中,煤炭挥发分中的碳氢化合物在高温条件下发生热分解,生成活性很强的碳化氢自由基(CH· ,CH2· ),这些活化的CH i和空气中的氮反应生成中间产物HCN、NH和N,随后又进一步被氧化成NO,实验表明这个过程只需60ms,故称为快速型NO x,这一机理是由费尼莫(Fenimore)发现的,所以又称为费尼莫机理。
输液速度和时间的计算公式 临床护理工作中,常常会有医嘱要求“液体在多长时间内输完”,这就涉及到每分钟滴数的计算。 我国临床常用的输液器滴系数有10、15、20滴/ml三种型号,根据输液器滴系数可进行如下公式推理: 每小时输入的毫升数(ml/h)=(滴/min)×60 min/h)/滴系数(滴/ml)。 因此,当滴系数为10、15、20滴/ml时,分别代入上述公式即可得出:(1)滴系数为10滴/ml,则:每小时输入的毫升数=(滴数/min)×6。 (2)滴系数为15滴/ml,则:每小时输入的毫升数=(滴数/min)×4。 (3)滴系数为20滴/ml,则:每小时输入的毫升数=(滴数/min)×3。 每个输液器其滴系数是固定不变的,故在已知每小时输入的毫升数和每分钟滴数两者之间的任意一个变量时,利用上述3个公式,即可得出另一个变量。 举例: 1. 已知输入液体的总量和预计输完所用的时间,求每分钟滴数。 每分钟滴数=液体的总量(ml)×滴系数(滴/毫升)/输液所用时间(min) 2.已知输入液体的总量和每分钟滴数,求输完液体所用的时间。 输液所用时间(h)=液体的总量(ml)×滴系数(滴/毫升)/[每分钟滴数(滴/分)×60(min)]
或者 输液所用时间(min)=液体的总量(ml)×滴系数(滴/毫升)/每分钟滴数(滴/分) 3.已知每分钟滴数,计算每小时输入量。 每小时输入量(ml)=每分钟滴数×60(min)/每毫升相当滴数(15滴)。 例:每分钟滴数为54滴,计算每小时输入量。解:每小时输入量(ml)=54×60/15=216(ml)。 4.已知输入总量与计划使用时间,计算每分钟滴数。 每分钟滴数=输液总量×每毫升相当滴数(15滴)/输液时间。 例:日输入总量2000ml,需10h输完,求每分钟滴数。 解:每分钟滴数=2000×15/(10×60)=30000/600=50(滴)。
低氮燃烧技术精编 Company number【1089WT-1898YT-1W8CB-9UUT-92108】
低NOx燃烧技术简介 一概述: 用改变燃烧条件的方法来降低NOx的排放,统称为低NOx燃烧技术。在各种降低NOx排放的技术中,低NOx燃烧技术采用最广、相对简单、经济并且有效。 二低NOx燃烧技术方法: 1、空气分级燃烧 空气分级法是将燃烧用的空气分阶段送入,进行“缺氧燃烧”和“富氧燃尽”,使其避开温度过高和大过剩空气系数同时出现,降低NOx的生成。 在“缺氧燃烧”阶段,由于氧气浓度较低,燃料的燃烧速度和温度降低,抑制了热力型NOx生成;由于不能完全燃烧,部分中间产物如HCN 和NH3会将部分已生成的NOx还原成N2,从而抑制了燃料NOx的排放;然后在将燃烧所需空气的剩下部分以二次风形式送入,即“富氧燃尽”阶段,虽然空气量多,但此阶段的温度已经降低,新生成的NOx量十分有限,因此总体上NOx的排放量明显减少。 2、燃料分级燃烧 燃料分级法是把燃料分为两股或多股燃料流,这些燃料流经过三个燃烧区发生燃烧反应。 把80%-85%的燃料送入主燃烧区进行富氧燃烧,余下15%-20%经主燃烧器上部送入再燃烧区,在空气系数小于1的条件下进行缺氧燃烧,主燃
烧区产生的NOx被还原,从而减少NOx的排放量;为减少不完全燃烧需加空气进行燃尽。 3、烟气再循环燃烧 烟气再循环法是在锅炉的空气预热器前抽取一部分低温烟气直接送入炉膛,或渗入一次或二次风中,降低氧浓度、火焰温度,使NOx的生成受到抑制,降低NOx的排放。 将部分低温烟气直接送入炉内或与空气(一次风或与二次风)混合后送入炉内,因烟气的吸热和对氧浓度的稀释作用,会降低燃烧速度和炉内温度,因而减少了热力型NOx。 三低NOx燃烧器 根据上述低NOx燃烧技术,我公司引进开发出以下型号的低NOx燃烧器: 1、HDRB型低NOx燃烧器; 2、HHT-NR型低NOx燃烧器; 3、HXCL型低NOx燃烧器; 4、HWS型低NOx燃烧器; 5、HDS型低NOx燃烧器; 6、HSM型低NOx燃烧器; 7、HPM型低NOx燃烧器。 8、低氮燃烧器分类 燃烧器是工业炉的重要设备,它保证燃料稳定着火燃烧和燃料的完全燃烧等过程,因此,要抑制NOx的生成量就必须从燃烧器入手。根据降低
D t → D D t t ?+=?+ 变化量D ?,所用时间t ? 变化率=t D ?? 设过两点),(11y x 与),(22y x 的直线方程为b kx y +=, 带入得b kx y +=11,b kx y +=22解得 θtan 1212=??=--=x y x x y y k ,称为y 对x 的变化率. 1 212t t v v t t v v t v a --=--=??= 初末初末,称为v 对t 的变化率. 1212t t x x t t x x t x v --=--=??=初末初末 t x v v x t ??==→?→?00lim 瞬 1212t t v v t t v v t v a --=--=??=初末初末 t v a a v t ??==→?→?00lim 瞬 1 212t t x x t t x x t x v --=--=??=初末初末 t x v v x t ??==→?→?0 0lim 瞬 1 212t t v v t t v v t v a --=--=??=初末初末 1 212t t v v t t v v t v a a --=--=??==初末初末瞬 设过两点),(11y x 与),(22y x 的直线方程为b kx y +=, 带入得b kx y +=11,b kx y +=22解得
θtan 1212=??=--=x y x x y y k ,称为y 对x 的变化率. 1212t t x x t t x x t x v --=--=??=初末初末,称为x 对t 的变化率. 1 212t t v v t t v v t v a --=--=??= 初末初末,称为v 对t 的变化率.
常用切削速度計算公式 一、三角函數計算 1.tanθ=b/a θ=tan-1b/a 2.Sinθ=b/c Cos=a/c 二、切削刃上选定点相对于工件的主运动的瞬时速度。 2.1 铣床切削速度的計算 Vc=(π*D*S)/1000 Vc:線速度(m/min) π:圓周率(3.14159) D:刀具直徑(mm) 例題. 使用Φ25的銑刀Vc為(m/min)25 求S=?rpm Vc=πds/1000 25=π*25*S/1000 S=1000*25/ π*25 S=320rpm 2.2 车床切削速度的計算计算公式如下 v c=( π d w n )/1000 (1-1) 式中 v c ——切削速度 (m/s) ; dw ——工件待加工表面直径( mm ); n ——工件转速( r/s )。 S:轉速(rpm) 三、進給量(F值)的計算 F=S*Z*Fz F:進給量(mm/min) S:轉速(rpm) Z:刃數 Fz:(實際每刃進給) 例題.一標準2刃立銑刀以2000rpm)速度切削工件,求進給量(F 值)為多少?(Fz=0.25mm) F=S*Z*Fz F=2000*2*0.25 F=1000(mm/min) 四、殘料高的計算 Scallop=(ae*ae)/8R Scallop:殘料高(mm) ae:XY pitch(mm) R刀具半徑(mm) 例題. Φ20R10精修2枚刃,預殘料高0.002mm,求Pitch為多 少?mm Scallop=ae2/8R 0.002=ae2/8*10 ae=0.4mm 五、逃料孔的計算 Φ=√2R2 X、Y=D/4 Φ:逃料孔直徑(mm) R刀具半徑(mm) D:刀具直徑(mm) 例題. 已知一模穴須逃角加工(如圖), 所用銑刀為ψ10;請問逃角孔最小 為多少?圓心座標多少? Φ=√2R2 Φ=√2*52 Φ=7.1(mm) X、Y=D/4 X、Y=10/4
低氮分级燃烧技术 一.低NO x优化燃烧技术的分类及比较 为了实现清洁燃烧,目前降低燃烧中NO、排放污染的技术措施可分为两大类:一类是炉内脱氮,另一类是尾部脱氮。 1.1炉内脱氮 炉内脱氮就是采用各种燃烧技术手段来控制燃烧过程中NO x的生成,又称低NO x燃烧技术,下表给出了现有几种典型炉内脱氮技术的比较。 表2
1.2尾部脱氮 尾部脱氮又称烟气净化技术,即把尾部烟气中已经生成的氮氧化物还原或吸附,从而降低NO x排放。烟气脱氮的处理方法可分为:催化还原法、液体吸收法和吸附法三大类。 催化还原法是在催化剂作用下,利用还原剂将NO x还原为无害的N2。这种方法虽然投资和运转费用高,且需消耗氨和燃料,但由于对NO x效率很高,设备紧凑,故在国外得到了广泛应用,催化还原法可分为选择性非催化还原法和选择性催化还原法相比,设备简单、运转资金少,是一种有吸引力的技术。 液体吸收法是用水或者其他溶液吸收烟气中的NO x。该法工艺简单,能够以硝酸盐等形式回收N进行综合利用,但是吸收效率不高。 吸附法是用吸附剂对烟气中的NO x进行吸附,然后在一定条件下使被吸附的NO x脱附回收,同时吸附剂再生。此法的NO x脱除率非常高,并且能回收利用。但一次性投资很高。 炉内脱氮与尾部脱氮相比,具有应用广泛、结构简单、经济有效等优点。表2中各种低NO x燃烧技术是降低燃煤锅炉NO x排放最主要也是比较成熟的技术措施。一般情况下,这些措施最多能达到50%的脱除率。当要进一步提高脱除率时,就要考虑采用尾部烟气脱氮的技术措施,SCR和SNCR法能大幅度地把NO x 排放量降低到200mg/m3,但它的设备昂贵、运行费用很高。 根据我国发展现状和当前经济实力还不雄厚的国情,以及相对宽松的国家标准CB13223一2003,在今后相当长一段时间内,我国更适合发展投资少、效果也比较显着的炉内脱氮技术。即使采用烟气净化技术,同时采用低NO x燃煤技术来控制燃烧过程NO x的产生,以尽可能降低化设备的运行和维护费用。 表2中各炉内脱氮技术又以燃料分级效率较高。燃料再燃技术是有效的降低NO x排放的措施,早在1980年日本的三菱公司就将天然气再燃技术应用于实际锅炉,NO x排放减少50%以上。美国能源部的“洁净煤技术”计划也包括再燃技术,其示范项目分别采用煤或天然气作为再燃燃料,NO x排放减少30%到70%。在日本、美国、欧洲再燃技术大量应用于新建电站锅炉和已有电站锅炉的改造,在商业运行中取得良好的环境效益和经济效益。在我国燃料再燃烧技术研究和应用起步较晚,主要是因为我国过去对环保的要求较低,另一方面则是出于技术经
高温空气燃烧技术的节能、环保效益 谢民萧琦 北京神雾热能技术有限公司北京 100083 摘要:本文介绍了高温空气燃烧技术的发展历程和该技术在节能、环保方面的特征。以目前冶金行业部分应用高温空气燃烧技术企业的实际效果为依据,提出在我国应用该项技术具有巨大的节能和环保效益。 关键词:高温空气燃烧技术蓄热式烧嘴节能环保 1 前言 随着工业的迅速发展和人口的不断增长,能源和环境问题成为倍受国人瞩目的两大问题。目前全国的能源有90%以上来自燃烧化石燃料(煤、石油和天然气)所释放的能量。化石燃料在全国的储量是有限的,我们需要开发新能源,而当前更重要的是现有能源的合理利用。相应地,全国70%以上的污染物也来自化石燃料的燃烧产物,如二氧化碳(CO2)、一氧化碳(CO)、二氧化硫(SO2)、氮氧化物(NO X)、未燃碳氢化合物(UHC)和烟尘。二氧化碳、一氧化氮(CO)和甲烷(CH4)是温室气体,引起全球气候恶化;一氧化碳、二氧化硫、氮氧化物、部分未燃碳氢化合物和烟尘可直接对人体和动植物产生危害;大气中的二氧化硫和氮氧化物会产生酸雨,对建筑物和各种材料也会产生直接腐蚀。因此,在我国实施经济可持续性发展战略的关键时期,研究和应用节约能源、提高能源利用效率、减少污染物排放的燃烧技术成为我国工业界的当务之急。 高温空气燃烧技术(High Temperature Air Combustion)是二十世纪八十年代后期发展起来的一种燃烧技术,它的特征是烟气热量被最大限度地回收,助燃空气被预热到1000℃以上,燃料在低氧浓度下燃烧。高温空气燃烧技术可以实现燃料化学能的高效利用和有效控制燃烧主要污染物氮氧化物,是非常适合在我国工业界应用推广的技术,为缓解我国的能源紧 缺、改善自然环境提供了切实可行的方法。 2高温空气燃烧技术的发展历程 最早的炉子,烟气中的热量无法回收利用,高温烟气带走燃料中70~80%的能量,而炉子的热效率只有20~30%。到了二十世纪中期,国内外开始采用在烟道上安装空气预热器的方法来回收烟气中的热量;经过半个世纪的发展和完善,排烟温度大幅度下降,炉子的热效率提高到50%左右。尽管如此,烟气仍然带走燃料中40~50%的能量;而且空气预热 器使用寿命有限,维修困难。 使用蓄热室回收烟气的热量不能算一项新技术;在十九世纪末期英国已经有人采用,我国平炉炼刚用过的格子砖也是一例。当时的蓄热室体积庞大,而且加热空气的效果并不十分理想,因此没有得到广泛应用。进入二十世纪八十年代以后,由于材料科学的飞速发展,在欧洲开发出一种陶瓷球蓄热材料。这种陶瓷球热导率高,比热容大,耐高温;以陶瓷球作为蓄热体吸收烟气热量,空气可以很稳定地预热到1000℃以上。由于蓄热燃烧技术节能效益显著,因此在英国、美国得到应用。然而当时的蓄热燃烧技术并不是真正意义上的高温空气
水泥窑炉空气分级燃烧及SNCR烟气脱硝 技术 江苏省盐城市兰丰环境工程科技有限公司 苗长江 陈森林 224000 摘要:本文从以下几个方面系统介绍了我公司治理水泥窑炉烟气中NOx的烟气脱硝技术,希望能对水泥窑炉NOx治理起到一定的借鉴作用。 关键词: 回转窑 分解炉 NOx 空气分级燃烧 SNCR脱硝技术 引言 近年来,水泥工业随着现代城市建设的需要而得到了快速的发展,但是水泥生产过程中产生的废气对环境的污染也在不断加剧,特别是废气中的NOx对大气环境的影响已非常严重。由此,本文从以下几个方面系统介绍了我公司治理水泥窑炉烟气中NOx的烟气脱硝技术,希望能对水泥窑炉NOx治理起到一定的借鉴作用。 1 水泥窑炉NOx产生机理 在新型干法水泥生产工艺中,回转窑和分解炉是水泥物料烧成的两个关键设备。然而,回转窑和分解炉也是NOx生成的主要来源。 在水泥熟料生产过程中,大约有40%左右的煤粉从回转窑窑头的多通道燃烧器喷入窑内,并进行高温燃烧,为煅烧物料的熔融和矿物重结晶提供足够的温度,但物料温度必须超过1400℃时才会发生物料熔融和矿物重结晶现象,因此通常需要将窑头燃烧器形成的火焰温度控制在1800~2200℃之间,然而这样在回转窑内就会生成热力型NOx和燃料型NOx,且均有较多的形成比例,其中尤以热力NOx为主。同时,大约60%左右的
煤粉进入分解炉,炉内的温度一般在850~1100℃范围内,在此温度下,基本可以不考虑热力型NOx的形成,主要是燃料型NOx。 由此,本文系统介绍了我公司治理水泥窑炉烟气中NOx的空气分级燃烧及SNCR脱硝技术,希望能对水泥窑炉NOx治理起到一定帮助。 2 水泥窑炉空气分级燃烧技术 2.1 基本原理 水泥窑炉空气分级燃烧是目前最为普遍的降低NOx排放的燃烧技术之一。其基本原理如图(一)所示:将燃烧所需的空气量分成两级送入,使第一级燃烧区内过量空气系数小于1,燃料先在缺氧的富燃料条件下燃烧,使得燃烧速度和温度降低,从而降低了热力型NOx的生成。同时,燃烧生成的CO与NOx发生还原反应,以及燃料氮分解成中间产物(如NH、CN、HCN和NHx等)相互作用或NOx还原分解,从而抑制了燃料型NOx的生成,具体反应如下: 2CO + 2NO → 2CO2 + N2 (1) NH + NH → N2 + H2 (2) NH + NO → N + OH (3) 在二级燃烧区(燃尽区内,将燃烧用空气的剩余部分以二次空气的形式输入,成为富氧燃烧区。此时,空气量增多,一些产物被氧化生成NOx,但因温度相对常规燃烧较低,因而总的NOx生成量不高,具体反应如下: CN + O → CO + NO (4)
一、平均速度公式的巧用均速度公式 v平=(v0+v)/2 x=vt 欧阳歌谷(2021.02.01) 1、一辆汽车在4 s内做匀加速直线运动,初速为2 m/s,末速为10 m/s,在这段时间内 (1)汽车的加速度为多少? (2)汽车的位移为多少? (3)汽车的平均速度为多少? 2、从车站开出的汽车,做匀加速直线运动,走了12s时,发现还有乘客没上来,于是立即做匀减速运动直至停车,汽车从开出到停止总共历时20s,行进了50 m。则汽车的最大速度为多少?3.一辆车以10 m/s的速度匀速行驶,在距车站25 m时开始制 动,使车匀减速前进,到车站时恰好停下.求:车从制动到停下来经历的时间. 4、汽车从静止起做匀加速运动,速度达到v时立即做匀减速运动,最后停止,全部时间为t,则汽车通过的全部位移为多少? 二、v-t图象的物理意义及应用 1.某质点沿一直线运动,其v-t图象如图所示,则下列说法中正确的是()
A.第1 s内和第2 s内质点的速度方向相反 B.第1 s内和第4 s内质点的速度方向相同 C.第1 s内质点向前运动,第2 s内质点向后运动,2 s末质点回到出发点 D.第一个2 s内质点向前运动,第二个2 s内质点向后运动,4 s 末质点回到出发点 2、甲、乙两物体同时从同一地点沿同一方向做直线运动的速度时间图象如图所示,则下列说法中正确的是 A. 两物体两次相遇的时刻是2s末和 6s末 B. 4s末甲在乙前面 C. 在内,两物体相距最远的时刻 是1s末D. 乙物体先向前运动2s,随后向后运动 3、甲、乙两个物体在t=0时的 位置如图a所示,它们沿x轴正 方向运动的速度图象分别如图b 中图线甲、乙所示,则() A.t=2s时甲追上乙
4000t/d新型干法水泥生产线分级燃烧+SNCR烟气脱硝 技 术 方 案
目录 1、减排氮氧化物社会效益 (3) 2、本项目脱硝工艺描述 (5) 2.1、分级燃烧技术 (5) 2.2、SNCR脱氮技术 (8) ①卸氨系统 (9) ②罐区 (9) ③加压泵及其控制系统 (9) ④混合系统 (9) ⑤分配和调节系统 (10) ⑥喷雾系统 (10) ⑦水电气供给 (10) ⑧控制系统 (11) ⑨SNCR主要设备与设施 (11) 3、氮氧化物目前排放量 (12) 4、总体性能指标 (12) (1)窑尾分级燃烧脱氮技术(单独使用) (12) (2)SNCR脱氮技术(单独使用) (13) (3)分级燃烧和SNCR结合的脱氮集成技术 (13) 5、主要技术经济指标 (13) 6、经济效益评价 (14) 6.1单位成本分析 (14) 6.2 运行成本分析 (15) 6.3 环境及社会效益分析 (16)
1、减排氮氧化物社会效益 氮氧化物(NOx)是大气的主要污染物之一,包括NO、NO2、N2O、N2O3、N2O5等多种氮的氧化物,燃煤窑炉排放的NOx 中绝大部分是NO。NO的毒性不是很大,但是在大气中NO可以氧化生成NO2。NO2比较稳定,其毒性是NO的4~5倍。空气中NO2的含量在3.5×10‐6(体积分数)持续1h,就开始对人体有影响;含量为(20~50)×10‐6时,对人眼有刺激作用。含量达到150×10‐6时,对人体器官产生强烈的刺激作用。此外,NOx 还导致光化学烟雾和酸雨的形成。由于大气的氧化性,NOx 在大气中可形成硝酸(HNO3)和硝酸盐细颗粒物,同硫酸(H2SO4)和硫酸盐颗粒物一起,易加速区域性酸雨的恶化。 随着我国工业的持续发展,由氮氧化物等污染物引起的臭氧和细粒子污染问题日益突出,严重威胁着人民群众的身体健康,成为当前迫切需要解决的环境问题。2011年全国人大审议通过了“十二五”规划纲要,提出将氮氧化物首次列入约束性指标体系,要求“十二五”期间工业氮氧化物排放减少10%,氮氧化物减排已经成为我国下一阶段污染治理和减排的重点。氮氧化物活性高、氧化性强,是造成我国复合型大气污染的关键污染物。随着国民经济持续快速发展和能源消费总量大幅攀升,我国氮氧化物排放量迅速增长。“十一五”期间,我国氮氧化物排放量逐年增长,2008年达2000 万吨,排放负荷巨大。特别是水泥行业氮氧化物排放量也呈现快速增长趋势,2000年77万吨,2005年136万吨,2010年约200万吨。氮氧化物排放量的迅速增加导致了一系列的城市和区域环境问题。北京到上海之间的工业密集区已成为对流层二氧化氮污染较为严重的地区,“十一五”期间全国降水中硝酸根离子平均浓度较2005年有较大幅度地增长。由氮氧化物等污染物引起的臭氧和细粒子污染问题日益突出,严重威胁着人民群众的身体健康,成为当前迫切需要解决的环境问题。若不严加控
第二章匀变速直线运动的研究 §2.2 匀变速直线运动的速度与时间的关系 一、考点自学 1、匀变速直线运动 (1)由于匀变速直线运动的速度不随时间改变,因而其v-t图象是一条的直线。 (2)沿着一条直线,且不变的运动,叫做匀变速直线运动, 其v-t图象是一条的直线。 (3)速度随时间是匀加速直线运动,而速度随时间是匀减速直线运动。 2、速度与时间的关系 (1)匀变速直线运动中速度与时间的关系式是v= ,其中v0是开始运动的速度叫做,v是运动了t时间后的速度叫做。 (2)关系式中是矢量的物理量是,在运用过程中要规定正方向,与规定正方向相同方向的物理量取,相反方向的物理量则取。 二、典例分析 题型一、匀变速直线运动概念的理解 例题1、下列关于匀变速直线运动的说法正确的是() A.做匀变速直线运动的物体,它的加速度方向和速度方向总是相同的 B.做匀变速直线运动的物体,它的加速度方向和速度变化方向总是相同的 C.做匀变速直线运动的物体,它的速度变化越大,加速度越大 D.做匀变速直线运动的物体,它的速度在单位时间内越大,加速度越大 题型二、公式应用 例2一物体从静止开始以2 m/s2的加速度做匀加速直线运动,经5 s后做匀速直线运动,最后2 s 的时间内物体做匀减速直线运动直至静止.求: (1)物体做匀速直线运动的速度的大小; (2)物体做匀减速直线运动时的加速度. 变式火车沿平直铁轨匀加速前进,通过某一路标时的速度为10.8 km/h,1 min后变成了54 km/h,又需经多少时间,火车的速度才能达到64.8 km/h? 题型三刹车过程中速度与时间的关系 例题3、汽车以54km/h的速度匀速行驶。 (1)若汽车以0.5m/s2的加速度加速,则10s后速度能达到多少?
三大速率测试方法及计算公式 除胶速率 1、方法 取基材板6×6cm (FR4料且四边平滑) 放入出120℃烘箱内干燥15分钟,取出冷却后称重到0.0001(G1)。 将试板随生产板一起挂入膨松缸正常除胶,经中和缸的水洗后取出。将试板再放入出120℃烘箱内干燥15分钟,取出冷却后称重到 0.0001(G2)。 2、计算 除胶速率(mg/cm2)=(G1-G2) ×1000/(6×6×2) 微蚀速率 1、方法 1、取两面铜箔板6×6cm (FR4料且四边平滑) 2、放入出120℃烘箱内干燥15分钟,取出冷却后称重到0.0001(G1)。 3、将试板手动挂入微蚀缸,(微蚀时间与生产板时间一致),经水洗后取出。 4、将试板再放入出120℃烘箱内干燥15分钟,取出冷却后称重到 0.0001(G2)。 2、计算 微蚀速率(um/min)={(G1-G2) /8.9/(6×6×2)} ×10000 三、沉铜速率 A、(称重)方法 1、取取基材板10×10cm (FR4料且四边平滑) 2、放入出120℃烘箱内干燥15分钟,取出冷却后称重到0.0001(G1)。 3、将试板随生产板一起挂入整孔缸正常生产到沉铜,经水洗后取出。 4、将试板再放入出120℃烘箱内干燥15分钟,取出冷却后称重到 0.0001(G2)。 A、计算 沉铜速率(um)=(G2-G1) ×929×39.37/2.12×2 B、(滴定)方法 1、取取基材板6×6cm (FR4料且四边平滑) 2、将试板随生产板一起挂入整孔缸正常生产到沉铜,经水洗后取出。 3、放入500ml的烧杯中,加入PH=10缓冲液30ml,再加入1ml双氧水。将基材板上沉积的铜完全咬蚀下来,倒入250ml的圆口烧瓶中。后加入
路程速度时间公式 路程速度时间公式 速度 = 路程除以时间: u=s/t 路程 = 速度乘以时间: s=ut 时间 = 路程除以速度: t=s/u 1m/s=3.6km/h 1,一辆汽车在 5min 内通过的距离是 36000m ,求汽车的速度? 2,一辆汽车在做匀速运动速度是 30m/s ,它在 3min 内行驶的路程是多少? 3 ,一辆汽车的平均速度是 25m/s ,它行驶了 900m ,求汽车行驶的时间是多少? 4 ,一运动物体在 1min 内行驶了 0.12km ,如果以这样的速度行驶 1km 需要多少时间? 5 ,一个运动物体在 3min 内行驶了 900m ,如果以这样的速度行驶 2h ,物体能运动多远? 6 ,一个运动物体从甲地行驶到乙地,在前一段路用 4min 行驶了 0.72km ,在后段路用了 6min 行驶 900m 刚好到达了乙地,问物体从甲地到达乙地的平均速度是多少? 追激问题:是速度之差:时间 = 路程除以(大速度—小速度)既: t=s/(u1—u2)
例:甲乙两地相距 1km ,甲人从甲地以 9m/s 的速度去追乙人,而乙人从乙地与甲人同时,同向以 7m/s 速度跑,问:甲人追上乙人需要多少时间? 相遇问题:是速度之和:时间 = 路程除以(速度 1 +速度 2 )既: t=s/ ( u1+u2 ) 例:甲乙两地相距 5km ,甲以 20m/s 速度从甲地出发,乙以30m/s 的速度从乙地出发,他们同时同向行驶,问:他们需要多少时间相遇? 9 ,一座大桥全长是 300m ,一列火车长为 200m ,火车以 20m/s 的速度匀速通过大桥,求:火车完全通过大桥需要多少时间? 10 ,一座大桥全长 300m ,一列火车以 20m/s 匀速通过大桥,需要 40s 钟完全通过大桥,问:火车的长度是多少? 11 ,某人在山谷中,大喊一声后, 2s 钟听到第一声回声,再过 1s 后听到第二声回声。求:此人离较近的山有多远?此人离较远的山有多远?两座大山之间的距离是多少?
行程问题公式 行程问题是研究物体运动的,它研究的是物体速度、时间、行程三者之间的关系。 基本公式 路程=速度×时间; 路程÷时间=速度; 路程÷速度=时间 关键问题 确定行程过程中的位置路程相遇路程÷速度和=相遇时间相遇路程÷相遇时间= 速度和 相遇问题(直线) 甲的路程+乙的路程=总路程 相遇问题(环形) 甲的路程 +乙的路程=环形周长 追及问题 追及时间=路程差÷速度差 速度差=路程差÷追及时间 路程差=追及时间×速度差 追及问题(直线) 距离差=追者路程-被追者路程=速度差X追及时间 追及问题(环形) 快的路程-慢的路程=曲线的周长 流水问题 顺水行程=(船速+水速)×顺水时间 逆水行程=(船速-水速)×逆水时间 顺水速度=船速+水速 逆水速度=船速-水速 静水速度=(顺水速度+逆水速度)÷2 水速:(顺水速度-逆水速度)÷2 解题关键 船在江河里航行时,除了本身的前进速度外,还受到流水的推送或顶逆,在这种情况下计算船只的航行速度、时间和所行的路程,叫做流水行船问题。 流水行船问题,是行程问题中的一种,因此行程问题中三个量(速度、时间、路程)的关系在这里将要反复用到.此外,流水行船问题还有以下两个基本公式:
顺水速度=船速+水速,(1) 逆水速度=船速-水速.(2) 这里,船速是指船本身的速度,也就是在静水中单位时间里所走过的路程.水速,是指水在单位时间里流过的路程.顺水速度和逆水速度分别指顺流航行时和逆流航行时船在单位时间里所行的路程。 根据加减法互为逆运算的关系,由公式(l)可以得到: 水速=顺水速度-船速, 船速=顺水速度-水速。 由公式(2)可以得到: 水速=船速-逆水速度, 船速=逆水速度+水速。 这就是说,只要知道了船在静水中的速度,船的实际速度和水速这三个量中的任意两个,就可以求出第 三个量。 另外,已知船的逆水速度和顺水速度,根据公式(1)和公式(2),相加和相减就可以得到: 船速=(顺水速度+逆水速度)÷2, 水速=(顺水速度-逆水速度)÷2。 (一)相遇问题 两个运动物体作相向运动或在环形跑道上作背向运动,随着时间的发展,必然面对面地相遇,这类问题叫做相遇问题。它的特点是两个运动物体共同走完整个路程。 小学数学教材中的行程问题,一般是指相遇问题。 相遇问题根据数量关系可分成三种类型:求路程,求相遇时间,求速度。 它们的基本关系式如下: 总路程=(甲速+乙速)×相遇时间 相遇时间=总路程÷(甲速+乙速) 另一个速度=甲乙速度和-已知的一个速度 (二)追及问题 追及问题的地点可以相同(如环形跑道上的追及问题),也可以不同,但方向一般是相同的。由于速度不同,就发生快的追及慢的问题。 根据速度差、距离差和追及时间三者之间的关系,罕用下面的公式: 距离差=速度差×追及时间 追及时间=距离差÷速度差 速度差=距离差÷追及时间 速度差=快速-慢速 解题的关键是在互相关联、互相对应的距离差、速度差、追及时间三者之中,找出两者,然后运用公式求出第三者来达到解题目的。 (三)相离问题 两个运动物体由于背向运动而相离,就是相离问题。解答相离问题的关键是求出两个运动物体共同趋势的距离(速度和)。 基本公式有: 两地距离=速度和×相离时间 相离时间=两地距离÷速度和 速度和=两地距离÷相离时间 (四)流水问题 顺流而下与逆流而上问题通常称为流水问题,流水问题属于行程问题,仍然利用速度、时间、路程三者之间的关系进
低氮氧化物分级燃烧技术
一、氮氧化物的危害及排放标准 1.1、氮氧化物的危害 在燃料的燃烧过程中,氮氧化物的生成是燃烧反应的一部份:燃烧生成的氮氧化物主要是NO和NO2,统称为NOx。大气中的NOx溶于水后会生成为硝酸雨,酸雨会对环境带来广泛的危害,造成巨大的经济损失,如:腐蚀建筑物和工业设备;破坏露天的文物古迹;损坏植物叶面,导致森林死亡;使湖泊中鱼虾死亡;破坏土壤成分,使农作物减产甚至死亡;饮用酸化物造成的地下水,对人体有害。同样的酸浓度下硝酸雨对树木和农作物的损害是硫酸雨的1倍。NOx还对人的身体健康有直接损害,NOx浓度越大其毒性越强,因为它易于动物血液中的血色素结合,造成血液缺氧而引起中枢神经麻痹。 NOx经太阳紫外线照射与汽车尾气中的碳氢化合物同时存在时,能生成一种浅蓝色的有毒物质硝基化合物会形成光化学烟雾。城市光化学烟雾是指含有碳氢化合物和氮氧化物等一次污染物的城市大气,由于阳光辐射则发生化学反应所产生的生成物与反应物的特殊混合雾。光化学烟雾对人体有很大的刺激性和毒害作用。它刺激人的眼、鼻、气管和肺等器官,产生眼红流泪、气喘咳嗽等症状,长期慢性危害使肺机能减退、支气管发炎,甚至发展成癌。严重时可使人头晕胸痛,恶心呕吐,手足抽搐,血压下降,昏迷致死。光化学烟雾可导致成千上万人受害或死亡,还可使植物褪掉绿色、改变颜色,造成叶伤、叶落、花落和果落,直到减产或绝收。此外,还可使家畜发病率增高,使橡胶制品龟裂老化、腐蚀金属、损坏各种器物、材料和建筑物等。由于城市里氮氧化物和烃类排放量较大以及特有的气候条件,所以容易形成光化学烟雾。 1.2、氮氧化物的排放标准 2000年,我国氮氧化物排放量约为1177万吨,其中约63%源于燃煤。按照目前的排放控制水平,到2020年我国氮氧化物排放量将达到2363一2914万吨,超过美国成为第一大氮氧化物排放国。控制氮氧化物排放的问题已是刻不容缓。 2011年7月29日,国家环保总局发布新版《火电厂大气污染物排放标准》,以下简称“新标准”。新标准适用于使用单台出力65t/h 以上除层燃炉、抛煤机炉外的燃煤发电锅炉;各种容量的煤粉发电锅炉;单台出力65t/h 以上燃油、燃气发电锅
如何巧记弹性碰撞后的速度公式 一、“一动碰一静”的弹性碰撞公式 问题:如图1所示,在光滑水平面上,质量为m1的小球,以速度v1与原来静止的质量为m2的小球发生对心弹性碰撞,试求碰撞后它们各自的速度? 图1 设碰撞后它们的速度分别为v1'和v2',在弹性碰撞过程中,分别根据动量守恒定律、机械能(动能)守恒定律得: m1v1=m1v1'+m2v2'① ② 由①③ 由②④ 由④/③⑤ 联立①⑤解得 ⑥ ⑦ 上面⑥⑦式的右边只有分子不同,但记忆起来容易混。为此可做如下分析:当两球碰撞至球心相距最近时,两球达到瞬时的共同速度v共,由动量守恒定律得:m1v1= (m1+m2) v共
解出v共=m1v1 /(m1+m2)。而两球从球心相距最近到分开过程中,球m2继续受到 向前的弹力作用,因此速度会更大,根据对称可猜想其速度恰好增大一倍即,而这恰好是⑦式,因此⑦式就可上述推理轻松记住,⑥式也就不难写出了。如果⑥式的分子容易写成m2-m1,则可根据质量m1的乒乓球以速度v1去碰原来静止的铅球m2,碰撞后乒乓球被反弹回,因此v1'应当是负的(v1'<0),故分子写成m1-m2才行。在“验证动量守恒定律”的实验中,要求入射球的质量m1大于被碰球的质量m2,也可由⑥式 解释。因为只有m1>m2,才有v1'>0。否则,若v1'<0,即入射球m1返回,由于摩擦,入射球m1再回来时速度已经变小了,不再是原来的v1'了。 另外,若将上面的⑤式变形可得:,即碰撞前两球相互靠近的相对速度v1-0等于碰撞后两球相互分开的相对速度。由此可轻松记住⑤式。再结合①式也可很容易解得⑥⑦式。 二、“一动碰一动”的弹性碰撞公式 问题:如图2所示,在光滑水平面上,质量为m1、m2的两球发生对心弹性碰撞,碰撞前速度分别为v1和v2,求两球碰撞后各自的速度? 图2 设碰撞后速度变为v1'和v2',在弹性碰撞过程中,分别根据动量守恒定律、机械能守恒定律得: m1v1+m2v2=m1v1'+m2v2'① ②
燃煤锅炉的低N O x燃烧技术 NO x是对N 2O、NO 2 、NO、N 2 O 5 以及PAN等氮氧化物的统称。在煤的燃烧过程中,NO x生 成物主要是NO和NO 2 ,其中尤以NO是最为重要。实验表明,常规燃煤锅炉中NO生成量 占NO x总量的90%以上,NO 2只是在高温烟气在急速冷却时由部分NO转化生成的。N 2 O之所 以引起关注,是由于其在低温燃烧的流化床锅炉中有较高的排放量,同是与地球变暖现 象有关,对于N 2 O的生成和抑制的内容我们将结合流化床燃烧技术进行介绍。 因此在本章的讨论中,NO x即可以理解为NO和NO 2 。 一、燃煤锅炉NO x的生成机理 根据NO x中氮的来源及生成途径,燃煤锅炉中NO x的生成机理可以分为三类:即热力型、燃料型和快速型,在这三者中,又以燃料型为主。它们各自的生成量和炉膛温度的 关系如图3-1所示。试验表明,燃煤过程生成的NO x中NO占总量的90%,NO 2 只占5%~10%。 1、热力型NO x 热力型NO x是参与燃烧的空气中的氮在高温下氧化产生的,其生成过程是一个不分支的链式反应,又称为捷里多维奇(Zeldovich)机理 O O2 2 →(3-1) N NO N O+ → + 2 (3-2) O NO O N+ → + 2 (3-3) 如考虑下列反应 H NO OH N+ → +(3-4) 则称为扩大的捷里多维奇机理。由于N≡N三键键能很高,因此空气中的氮非常稳定,在室温下,几乎没有NO x生成。但随着温度的升高,根据阿仑尼乌斯(Arrhenius)定律,化学反应速率按指数规律迅速增加。实验表明,当温度超过1200℃时,已经有少量的NO x 生成,在超过1500℃后,温度每增加100℃,反应速率将增加6~7倍,NO x的生成量也有明显的增加,如图3-1所示。 但总体上来说,热力型NO x的反应速度要比燃烧反应慢,而且温度对其生成起着决定性的影响。对于煤的燃烧过程,通常热力型NO x不是主要的,可以不予考虑。一般来说通过降低火焰温度、控制氧浓度以及缩短煤在高温区的停留时间可以抑制热力型NO x的生
低NOx燃烧器及低氮氧化物燃烧器,是指燃料燃烧过程中NOx排放量低的燃烧器,采用低NOx燃烧器能够降低燃烧过程中氮氧化物的排放。 在燃烧过程中所产生的氮的氧化物主要为NO和NO2,通常把这两种氮的氧化物通称为氮氧化物NOx。大量实验结果表明,燃烧装置排放的氮氧化物主要为NO,平均约占95%,而NO2仅占5%左右。 一般燃料燃烧所生成的NO主要来自两个方面:一是燃烧所用空气(助燃空气)中氮的氧化;二是燃料中所含氮化物在燃烧过程中热分解再氧化。在大多数燃烧装置中,前者是NO的主要来源,我们将此类NO称为“热反应NO”,后者称之为“燃料NO”,另外还有“瞬发NO”。 燃烧时所形成NO可以与含氮原子中间产物反应使NO还原成NO2。实际上除了这些反应外,NO 还可以与各种含氮化合物生成NO2。在实际燃烧装置中反应达到化学平衡时,[NO2]/[NO]比例很小,即NO转变为NO2很少,可以忽略。 降低NOx的燃烧技术 NOx是由燃烧产生的,而燃烧方法和燃烧条件对NOx的生成有较大影响,因此可以通过改进燃烧技术来降低NOx,其主要途径如下: 选用N含量较低的燃料,包括燃料脱氮和转变成低氮燃料; 降低空气过剩系数,组织过浓燃烧,来降低燃料周围氧的浓度; 在过剩空气少的情况下,降低温度峰值以减少“热反应NO”; 在氧浓度较低情况下,增加可燃物在火焰前峰和反应区中停留的时间。 减少NOx的形成和排放通常运用的具体方法为:分级燃烧、再燃烧法、低氧燃烧、浓淡偏差燃烧和烟气再循环等。 一般常用低氮氧化物燃烧器简介 燃烧器是工业炉的重要设备,它保证燃料稳定着火燃烧和燃料的完全燃烧等过程,因此,要抑制NOx的生成量就必须从燃烧器入手。根据降低NOx的燃烧技术,低氮氧化物燃烧器大致分为以下几类: 1.阶段燃烧器 根据分级燃烧原理设计的阶段燃烧器,使燃料与空气分段混合燃烧,由于燃烧偏离理论当量比,故可降低NOx的生成li。 2.自身再循环燃烧器 一种是利用助燃空气的压头,把部分燃烧烟气吸回,进入燃烧器,与空气混合燃烧。由于烟气再循环,燃烧烟气的热容量大,燃烧温度降低,NOx减少。 另一种自身再循环燃烧器是把部分烟气直接在燃烧器内进入再循环,并加入燃烧过程,此种燃烧器有抑制氧化氮和节能双重效果yan。 3.浓淡型燃烧器 其原理是使一部分燃料作过浓燃烧,另一部分燃料作过淡燃烧,但整体上空气量保持不变。由于两部分都在偏离化学当量比下燃烧,因而NOx都很低,这种燃烧又称为偏离燃烧或非化学当量燃烧hong。 4.分割火焰型燃烧器
、路程速度时间公式:s=vt v=s÷t t=s÷v 2、正方形周长公式:C=4a 3、正方形面积公式:S=a2 4、长方形周长公式:C=2(a+b) 5、长方形面积公式:S=ab 6、加法交换律:a+b=b+a 7、加法结合律:a+b+c=a+(b+c) 8、乘法交换律:a·b=b·a 9、乘法结合律:〔a·b〕·c=a·〔b·c〕 10、乘法分配律:〔a+b〕·c=a·c+b·c 11、角的大小分类,从小到大是:锐角、直角、钝角、平角、周角 12、锐角是小于90度的角,直角是90度,钝角是大于90度而小于平角的角,平角是180度的角,周角是360度的角。 13、三角形按角分类:锐角三角形,直角三角形,钝角三角形 14、三个角都是锐角是锐角的三角形叫锐角三角形;有一个角是直角的三角形叫直角三角形;有一个角是钝角的三角形叫钝角三角形。 15、三角形按边分类有:不等边三角形,等腰三角形,等边三角形 16、从三角形的一个顶点到它的对边作一条垂线,顶点和垂足之间的线段叫做三角形的高,这条对边叫做三角形的底。 17、小数的计数单位是十分之一,百分之一,千分之一--------记作0.1,0.01,0.001----- 18、小数的性质:小数的末尾添上“0”或去掉“0”,小数的大小不变。 20、1平角=2直角1周角=2平角=4直角
21、三角形具有稳定性 22、三角形任意两边之和大于第三边 23、三角形的内角和是180度 24、学会画角 25、会比较小数的大小 26、单位换算 长度单位:1米=10分米1分米=10厘米1厘米=10毫米1米=10分米=100厘米=1000毫米 质量单位:1千克=1000克1吨=1000千克=1000000克 钱的换算:1元=10角=100分1角=10分 时间单位:1时=60分=3600秒1分=60秒 1年=12月=365天或366天1天=24小时 一三五七八十腊,三十一天永不差。四六九十一三十,平年二月二十八,闰年二月二十九。 面积单位:1平方米=100平方分米1平方分米=100平方厘米1平方米=10000平方厘米 1公顷=10000平方米 1平方千米=100公顷=1000000平方