
晶体的结构与性质
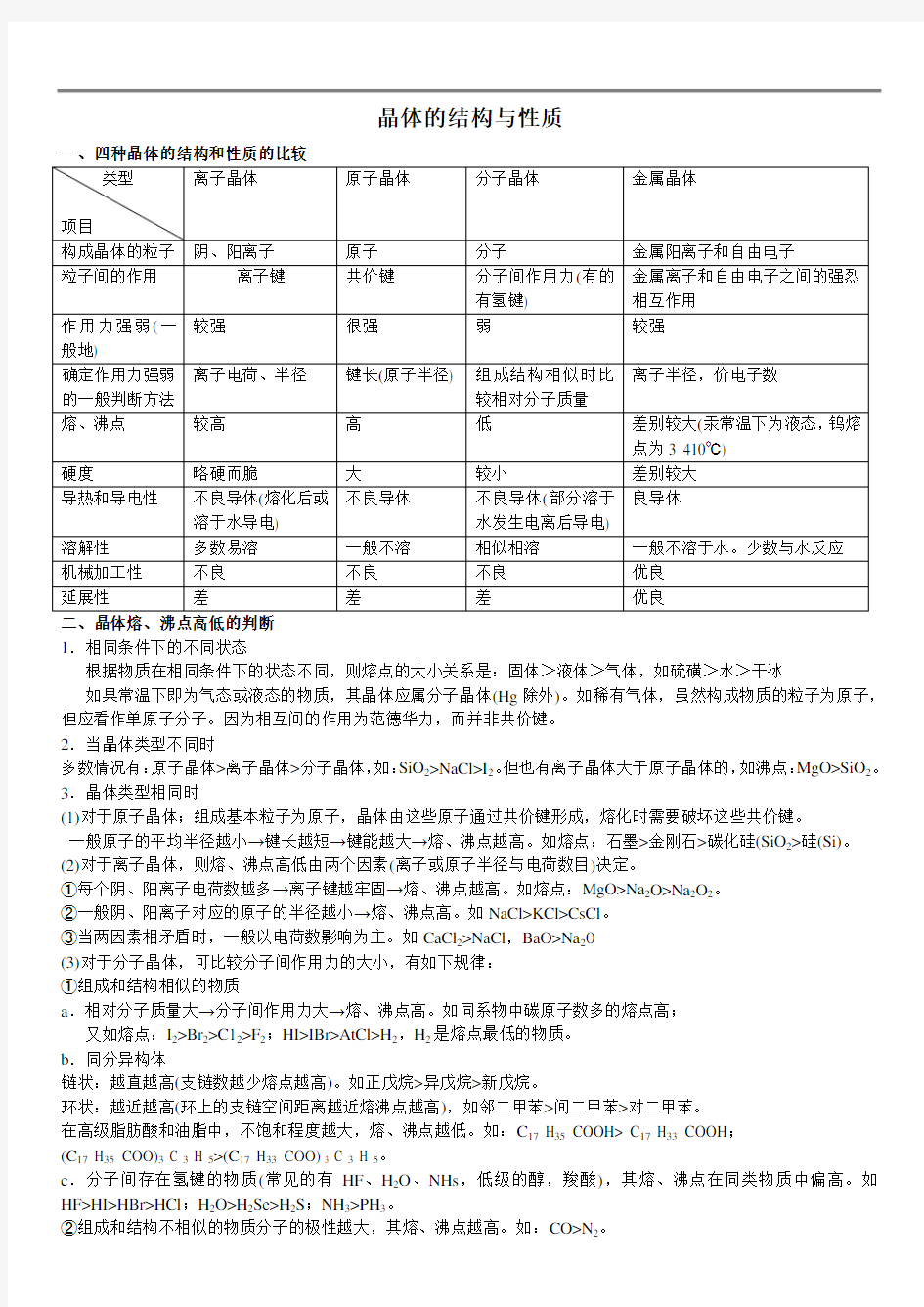
一、四种晶体的结构和性质的比较
类型
项目
离子晶体原子晶体分子晶体金属晶体
构成晶体的粒子阴、阳离子原子分子金属阳离子和自由电子
粒子间的作用离子键共价键分子间作用力(有的
有氢键) 金属离子和自由电子之间的强烈相互作用
作用力强弱(一
般地)
较强很强弱较强
确定作用力强弱的一般判断方法离子电荷、半径键长(原子半径) 组成结构相似时比
较相对分子质量
离子半径,价电子数
熔、沸点较高高低差别较大(汞常温下为液态,钨熔
点为3 410℃)
硬度略硬而脆大较小差别较大
导热和导电性不良导体(熔化后或
溶于水导电) 不良导体不良导体(部分溶于
水发生电离后导电)
良导体
溶解性多数易溶一般不溶相似相溶一般不溶于水。少数与水反应
机械加工性不良不良不良优良
延展性差差差优良
二、晶体熔、沸点高低的判断
1.相同条件下的不同状态
根据物质在相同条件下的状态不同,则熔点的大小关系是:固体>液体>气体,如硫磺>水>干冰
如果常温下即为气态或液态的物质,其晶体应属分子晶体(Hg除外)。如稀有气体,虽然构成物质的粒子为原子,但应看作单原子分子。因为相互间的作用为范德华力,而并非共价键。
2.当晶体类型不同时
多数情况有:原子晶体>离子晶体>分子晶体,如:SiO2>NaCl>I2。但也有离子晶体大于原子晶体的,如沸点:MgO>SiO2。3.晶体类型相同时
(1)对于原子晶体;组成基本粒子为原子,晶体由这些原子通过共价键形成,熔化时需要破坏这些共价键。
一般原子的平均半径越小→键长越短→键能越大→熔、沸点越高。如熔点:石墨>金刚石>碳化硅(SiO2>硅(Si)。
(2)对于离子晶体,则熔、沸点高低由两个因素(离子或原子半径与电荷数目)决定。
①每个阴、阳离子电荷数越多→离子键越牢固→熔、沸点越高。如熔点:MgO>Na2O>Na2O2。
②一般阴、阳离子对应的原子的半径越小→熔、沸点高。如NaCl>KCl>CsCl。
③当两因素相矛盾时,一般以电荷数影响为主。如CaCl2>NaCl,BaO>Na2O
(3)对于分子晶体,可比较分子间作用力的大小,有如下规律:
①组成和结构相似的物质
a.相对分子质量大→分子间作用力大→熔、沸点高。如同系物中碳原子数多的熔点高;
又如熔点:I2>Br2>C12>F2;HI>IBr>AtCl>H2,H2是熔点最低的物质。
b.同分异构体
链状:越直越高(支链数越少熔点越高)。如正戊烷>异戊烷>新戊烷。
环状:越近越高(环上的支链空间距离越近熔沸点越高),如邻二甲苯>间二甲苯>对二甲苯。
在高级脂肪酸和油脂中,不饱和程度越大,熔、沸点越低。如:C17 H35 COOH> C17 H33 COOH;
(C17 H35 COO)3 C 3 H 5>(C17 H33 COO) 3 C 3 H 5。
c.分子间存在氢键的物质(常见的有HF、H2O、NHs,低级的醇,羧酸),其熔、沸点在同类物质中偏高。如HF>HI>HBr>HCl;H2O>H2Se>H2S;NH3>PH3。
②组成和结构不相似的物质分子的极性越大,其熔、沸点越高。如:CO>N2。
(4)对于金属晶体,其影响因素有:核电荷数、价电子数、半径大小。对于主族元素,核电荷数多、价电子数多、半径小→金属的熔、沸点高。如.Na
合金的熔点低于它的各组成成分金属的熔点,如Al>Mg>镁铝合金。 提示注意不同晶体类型物质熔沸点的特殊性:
①离子晶体的熔点不一定低于原子晶体,如MgO 的熔点为3 073℃,SiO 2的熔点为1713℃。 ②金属晶体的熔点不一定低于原子晶体,如w 的熔点高达3 410℃。
③金属晶体的熔点不一定高于分子晶体,如Hg 常温下呈液态,而S 、I 2、P 4常温下呈固态。 三、晶体里的微粒数
(1)晶体结构中具有代表性的最小重复单位叫做晶胞。 常见晶体的结构 物质 晶型 重复单位 微粒数
氯化钠NaCl 离子 立方体 每个Na +周围与它最接近等距的Na +有12个 CsCl 离子 立方体 每个Cs +(或Cl 一
)的等距离Cs + (或Cl 一
)有6个
金刚石C 原子 正四面体 最小环上有6个碳原子 石墨C 混合 正六边形 每个六边形占有2个碳原子 石英SiO 2 原子 硅氧四面体 最小环有12个原子 干冰CO 2
分子
面心立方
等距相邻12个CO 2分子
(2)用均摊法解析晶体的计算
均摊法:是指每个图形平均拥有的粒子数目。如某粒子为n 个图形(晶胞)所共有,则该粒子有n
1
属于一个图形(晶胞)。 ①长方体形(正方形)晶胞中不同位置的粒子对晶胞的贡献。
a .处于顶点的粒子,同时为8个晶胞共有,每个离子对晶胞的贡献为
81。 b .处于棱上的粒子,同时为4个晶胞共有,每个离子对晶胞的贡献为41
。
c .处于面上的粒子,同时为2个晶胞共有,每个离子对晶胞的贡献为2
1
。
d .处于体内的粒子,则完全属于该晶胞,对晶胞的贡献为1。
②非长方体形(正方体)晶胞中粒子对晶胞的贡献视具体情况而定。如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为
3
1。
【高考真题】
【2009年福建高考】30.[化学——物质结构与性质](13分) Q 、R 、X 、Y 、Z 五种元素的原子序数依次递增。已知: ①Z 的原子序数为29,其余的均为短周期主族元素; ②Y 原子价电子(外围电子)排布ms n mp n ③R 原子核外L 层电子数为奇数;
④Q 、X 原子p 轨道的电子数分别为2和4。 请回答下列问题:w.w.w.k.s.5.u.c.o.m
(1)Z 2+ 的核外电子排布式是 。
(2)在[Z(NH 3)4]2+离子中,Z 2+的空间轨道受NH 3分子提供的 形成配位键。 (3)Q 与Y 形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。 a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙 c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q 、R 、Y 三种元素的第一电离能数值由小到大的顺序为 (用元素符号作答) (5)Q 的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为 。 (6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于 。
【2010年福建高考】30、(1)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3+ 3C+S A+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为 ____________ 。
②在生成物中,A的晶体类型为 ________ ,含极性共价键的分子的中心原子轨道杂化类型为 ____ 。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为 ________ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ____________ ,Q2+的未成对电子数是 ________ 。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCl n(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCl n(H2O)6-n]x++xR-H→R x[CrCl n(H2O)6-n]x++xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol [CrCl n(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 ml,可知该配离子的化学式为 ____________________ 。
【2011年福建高考】30、[化学——物质结构与性质](13分)氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________(填标号)
a. 离子键
b. 共价键
c. 配位键
d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_________(填标号)。a. CF4 b. CH4 c. NH4+ d. H2O
【2012年福建高考】30.[化学-物质结构与性质]13分
(1)元素的第一电离能:Al Si(填“>”或:“<”)
(2)基态Mn2+的核外电子排布式为。
(3)硅烷(Si n H2n+2)的沸点与其相对分子质量的变化关系如右图所示,呈现这种变化关系的原因是。
(4)硼砂是含结晶水的四硼酸钠,其阴离子X m—(含B、O、H三种元素)的球棍模型如右下图所示:
①在X m—中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号);
m= (填数字)。
②硼砂晶体由Na+、X m—和H2O构成,它们之间
....存在的作用力有(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
【2013年福建高考】31.[化学—物质结构与性质](13分)
(1)依据第2周期元素第一电离能的变化规律,参照右图B 、F 元素的位置,用小黑点标出C 、N 、O 三种元素的相对位置。
(2)NF 3可由NH 3和F 2在Cu 催化剂存在下反应直接得到: 32
34233Cu
NH F NF NH F ++
①上述化学方程式中的5种物质所属的晶体类型有_________(填序号)。
a.离子晶体
b.分子晶体
c.原子晶体
d.金属晶体 ②基态铜原子的核外电子排布式为_________________。
(3)BF 3与一定量水形成(H 2O)2·BF 3晶体Q ,Q 在一定条件下可转化为R :
①晶体Q 中各种微粒间的作用力不涉及...
___________(填序号)。 a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R 中阳离子的空间构型为___________,阴离子的中心原子轨道采用_______杂化。
(4)已知苯酚()具有弱酸性,其Ka =1.1 ×10-10;水杨酸第一级电离形成的离子能形成分子内氢键。据此判断,相同温度下电离平衡常数Ka 2(水杨酸)_______Ka (苯酚)(填“>”或“<”),其原因是 ___________________________________________。
【2012·山东理综化学卷32】 (8分)[化学一物质结构与性质】 金属镍在电池、合金、催化剂等方面应用广泛。 (1)下列关于金属及金属键的说法正确的是 _。
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光 (2) Ni 是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni 相同且电负性最小的元素是 。
CO 与N 2结构相似,CO 分子内σ键与π键个数之比为 。
(3)过渡金属配合物Ni(CO)n 的中心原子价电子数与配体提供电子总数之和为18,则n= 。
(4)甲醛(H 2C=O)在Ni 催化作用下加氢可得甲醇(CH 3OH )。甲醇分子内C 原子的杂化方式为 ,甲醇分子内的O-C-H 键角 (填“大于”“等于”或“小于”)甲醛分子内的O-C-H 键角。
【2012·全国大纲理综化学卷27】(15分)原子序数依次增大的短周期元素a 、b 、c 、d 和e 中,a 的最外层电子数为其周期数的二倍;b 和d 的A 2B 型氢化物均为V 形分子,c 的+1价离子比e 的-1价离子少8个电子。 回答下列问题:
(1) 元素a 为________;c 为_______
(2) 由这些元素形成的双原子分子为__________________。
(3) 由这些元素形成的三原子分子中,分子的空间结构属于直线形的是_______,非直线形的是
_______________________。(写2种)
(4) 这些元素的单质或由他们形成的AB 型化合物中,其晶体类型属于原子晶体的是_______,离子晶体的
是_______,金属晶体的是_______,分子晶体的是_______;(每空填一种)
(5) 元素a 和b 形成的一种化合物与c 和b 形成的一种化合物发生的反应常用于防毒面具中,该反应的化学方程式为_______________________。
【综合训练】
1. A 、T 、X 、Y 、z 是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
元素 结构或性质信息 T 基态原子的L 层上s 电子数等于p 电子数 X 基态原子最外层未成对电子数在该元素所在周期中最多
Y 基态原子的第一电离能在该元素所在周期中最小 Z 单质常温、常压下是气体。基态原子的M 层上有1个未成对的p 电子 请根据信息回答有关问题(答题时如需表示具体元素,请用相应的元素符号): (1)T 、X 、Z 三种元素的电负性由大到小的顺序是 。
(2)写出与x 单质分子互为等电子体的物质的化学式 、 。
(分子、离子各一种)
(3)元素Q 的原子序数是Y 与Z 的原子序数之和。
①元素Q 与元素T 、x 能形成平面型的[Q (TX )4]2-离子。
TX -中T 原子采用的轨道杂化方式是 。
②Q 单质的晶胞如右图甲所示,Q 单质中Q 原子的配位数为 。
2. 已知X 、Y 、Z 、Q 、E 五种元素的原子序数依次增大,其中X 原子核外电子有6种不同的运动状态,s 能级电子
数是p 能级电子数的两倍;Z 原子L 层上有2对成对电子;Q 是第三周期中电负性最大的元素;E 的单质是常温下唯一呈液态的非金属。请回答下列问题:
(1)X 、Y 、Z 第一电离能由小到大的顺序为 < < (填元素符号)
。 (2)E 元素基态原子的电子排布式为 。 (3)XZ 2分子中含有 个π键。
(4)Z 氢化物的沸点比Q 氢化物的沸点高,理由是 。 (5)X 元素可形成X 60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图 所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X 60与钾原子个数比
为 。
3. 已知A 、B 、C 、D 、E 都是周期表中前四周期的元素,它们的核电荷数A B C D E <<<<。其中A 、B 、C 是同一周期的非金属元素。化合物DC 的晶体为离子晶体,D 的二价正阳离子与C 的阴离子具有相同的电子层结构。2AC 为非极性分子。B 、C 的氢化物地沸点比它们同主族相邻周期元素氢化物的沸点高。E 的原子序数为24,请根据以上情况,回答下列问题:(答题时,A 、B 、C 、D 、E 用所对应的元素符号表示)
(1)A 、B 、C 的第一电离能由小到大的顺序为 。E 的核外电子排布式是 。 (2)B 的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物2AC 的电子式 ;一种由B 、C 组成的化合物与2AC 互为等电子体,其化学式为 。 (4)B 、C 的氢化物的沸点比它们同主族相邻周期元素氢化物的沸点高,其原因是: 。
4. A 、B 、C 、D 、E 、F 为原子序数依次增大的短周期主族元素。 A 、F 原子的最外层电子数均等于其周期序数,F
原子的电子层数是A 的3倍;B 原子核外电子分处3个不同能级,且每个能级上排布的电子数相同;A 与C 形成的最简单分子为三角锥形;D 原子p 轨道上成对电子数等于未成对电子数;E 原子核外每个原子轨道上的电子都已成对,E 电负性小于F 。
⑴写出B 的基态原子的核外电子排布式
⑵A 、C 形成的最简单分子极易溶于水,其主要原因是
;与该最简单分子互为等电子体的阳离子为 。
⑶比较E
、F 的第一电离能:E F (选填“>”或“<”)。 ⑷BD 2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B 原子的杂化形式为 。
⑸光谱证实单质F 与强碱性溶液反应有[F(OH)4]—生成,则[F(OH)4]—中存在 。 a .共价键 b .非极性键 c .配位键 d .σ键 e .π键
5. 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl 4:
2FeTiO 3+7Cl 2+6C
2TiCl 4+2FeCl 3+6CO ; TiO 2+2Cl 2+2C
TiCl 4+2CO
将TiCl 4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl 4+2Mg Ti+2MgCl 2 MgCl 2和过量Mg 用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题: (1)基态钛原子的价电子排布式为 。 (2)与CO 互为等电子体的离子为 (5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH 3)5BrSO 4的两(填化学式)。
(3)在CH 2Cl 2、C 6H 6、CO 2、C 2H 4中,碳原子采取sp 1
杂化的分子有 。
(4)TiCl 4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl 4属于 (填“原子”、“分子”或“离子”)晶体。
种配合物,其中一种化学式为[Co(NH 3)5Br]SO 4,往其溶液中加BaCl 2溶液时,现象是 ;往另一种配合物的溶液中加入BaCl 2溶液时,无明显现象,若加入AgNO 3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
(6)在自然界中TiO 2有金红石、板钛矿、锐钛矿三种晶型,其 中金红石的晶胞如右图所示,则其中Ti 4+的配位数为 。
6. Ⅰ.下列说法正确的是( ) A .基态原子中不一定都有未成对的电子 B .由极性键形成的分子一定是极性分子 C .晶格能大小顺序:NaCl > KCl D .离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子 E .在CaO 和SiO 2晶体中,都不存在单个小分子
Ⅱ.四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
元素 A
B C
D
性质 结构 信息
基态原子核外有两个电子层,最外层有3个未成对的电子
基态原子的M 层有1对成对的p 电子
基态原子核外电子排布为[Ar]3d 104s x ,有+1、+2两种常见化合价
有两种常见氧化物,其中有一种是冶金工业常用的还原剂
(1)写出B 原子的基态电子排布式 。
(2)A 元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低
”),其原
因 。
(3)D 元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 (4)往C 元素的硫酸盐溶液中逐滴加入过量A 元素的氢化物水溶液,可生成的配合物的化学式为 ,简
要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,
“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp 3杂化形成化学键的是 (填写序号)
; 在②的分子中有 个σ键和 个π键。
【参考答案】
(2010年福建高考)(1)①O>N>C>K ②离子晶体;sp ③1:1(2)3d84s2;4 (3)[CrCl(H2O)5]2+(2011年福建高考)30.(1)2s22p3(2)N>O>C (3)①三角锥型sp3 ② 3 ③ d (4)c
(2012年福建高考)30(1)< (2)[Ar]3d5(3)硅烷的相对分子质量越大,分子间的范德华力越强,沸点越高。(4)①sp2、sp3;4,5(或5,4);2 ②ADE。
(2012·山东理综化学卷32)(1)b (2)C (3)4 1:2 (4)sp3>
(2012·全国大纲理综化学卷27)(1)C Na(2)CO (3)CO2 H2O H2S (4)金刚石 NaCl Na S 或CO (5)2Na2O2+2CO2=2Na2CO3+O2
【综合训练】
1:(1)CI>N>C (2)CO CN-(C?2
等合理答案均可)(3)①sp ②12
2
2:(1)C (4)水分子之间存在氢键,导致熔沸点升高。(5)1:3 3: 4:⑴1s22s22p2⑵NH3与H2O间能形成氢键 H3O+⑶>⑷原子 sp3⑸acd 5:(1)3d24s2 (2)CN-(或NO+、C22-)(3)CO2(4)分子 (5)产生白色沉淀、[Co (NH3)5SO4]Br (6)6 6:Ⅰ.ACE Ⅱ.(1)1s22s22p63s23p4(2)高因为A的氢化物分子间存在氢键 (3)低晶体类型不同(4)[Cu(NH3)4]SO4中心原子与配体之间以配位键相结合,内界与外界之间以离子键相结合(5)①③④ 3 2 晶体结构与性质 一、晶体的常识 1.晶体与非晶体 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出 特性:①自范性;②各向异性(强度、导热性、光学性质等) ③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法) 2.晶胞--描述晶体结构的基本单元.即晶体中无限重复的部分 一个晶胞平均占有的原子数=1 8×晶胞顶角上的原子数+1 4×晶胞棱上的原子+1 2×晶胞面上的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I 2)、金刚石(C)晶胞的示意图.它们分别平均含几个原子? eg :1.晶体具有各向异性。如蓝晶(Al 2O 3·SiO 2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在( ) ①硬度 ②导热性 ③导电性 ④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是( ) A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO 2一定是晶体 3.下图是CO 2分子晶体的晶胞结构示意图.其中有多少个原子? 二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体 注意:a.构成分子晶体的粒子是分子 b.分子晶体中.分子内的原子间以共价键结合.相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体.熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂.极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H 2O、H 2 S、NH 3 、CH 4 、HX等 b.酸:H 2SO 4 、HNO 3 、H 3 PO 4 等 c.部分非金属单质::X 2、O 2 、H 2 、S 8 、P 4 、C 60 d.部分非金属氧化物:CO 2、SO 2 、NO 2 、N 2 O 4 、P 4 O 6 、P 4 O 10 等 f.大多数有机物:乙醇.冰醋酸.蔗糖等 ③结构特征 a.只有范德华力--分子密堆积(每个分子周围有12个紧邻的分子) CO 2 晶体结构图 b.有分子间氢键--分子的非密堆积以冰的结构为例.可说明氢键具有方向性 ④笼状化合物--天然气水合物 晶体结构练习题 一、(2005全国初赛)下图是化学家合成的能实现热电效应的一种晶体的晶胞模型。图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII 族元素,如铁。按如上结构图写出这种热电晶体的化学式。给出计算过程。提示:晶胞的6个面的原子数相同。设晶体中锑的氧化态为-1,镧的氧化态为+3,问:铁的平均氧化态多大? 解析:晶胞里有2个La原子(处于晶胞的顶角和体心); 有8个Fe原子(处于锑形成的八面体的中心);锑八面体 是共顶角相连的,平均每个八面体有6/2=3个锑原子,晶 胞中共有8个八面体,8x3=24个锑原子;即:La2Fe8Sb24。 答案:化学式LaFe4Sb12 铁的氧化态9/4 = 2.25 二、(2004年全国初赛)最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行(面心)立方最密堆积(ccp),它们的排列有序,没有相互代换的现象(即没有平均原子或统计原子),它们构成两种八面体空隙,一种由镍原子构成,另一种由镍原子和镁原子一起构成,两种八面体的数量比是1︰3,碳原子只填充在镍原子构成的八面体空隙中。(1)画出该新型超导材料的一个晶胞(碳原子用小球,镍原子用大○球,镁原子用大球)。(2)写出该新型超导材料的化学式。 (1) (在(面心)立方最密堆积-填隙模型中,八面体空隙与堆积球的比例为1︰1,在如图晶胞中,八面体空隙位于体心位置和所有棱的中心位置,它们的比例是1︰3,体心位置的八面体由镍原子构成,可填入碳原子,而棱心位置的八面体由2个镁原子和4个镍原子一起构成,不填碳原子。) (2)MgCNi3(化学式中元素的顺序可不同,但原子数目不能错)。 三、将Nb2O5与苛性钾共熔后,可以生成溶于水的铌酸钾,将其慢慢浓缩可以得到晶体 K p[Nb m O n]·16H2O,同时发现在晶体中存在[Nb m O n]p-离子。该离子结构由6个NbO6正八面体构成的。每个NbO6八面体中的6个氧原子排布如下:4个氧原子分别与4个NbO6八面体共顶点;第5个氧原子与5个八面体共享一个顶点;第6个氧原子单独属于这个八面体的。列式计算并确定该晶体的化学式。计算该离子结构中距离最大的氧原子间的距离是距离最短的铌原子间距离的多少倍? 解析:这是一个涉及正八面体堆积的问题,我们先根据题意来计算。对一个铌氧八面体,有一个氧原子完全属于这个八面体,有四个氧原子分别与一个八面体共用氧原子,即属于这个八面体的氧原子是1/2个,另一个氧原子是六个八面体共用的,自然是1/6了。故对一个铌而言,氧原子数为1+4×1/2+1/6=19/6。 3-1、晶体的常识 一、晶体和非晶体 1、概述——自然界中绝大多数物质是固体,固体分为和两大类。 2、对比—— * 自范性——晶体能自发地呈现多面体外形的性质。本质上,晶体的自范性是晶体中粒子在微观空间里呈现周期性有序排列的宏观表象。 * 晶体不因颗粒大小而改变,许多固体粉末用肉眼看不到规则的晶体外形,但在显微镜下仍可看到。 * 晶体呈现自范性的条件之一是晶体生长的速率适当,熔融态物质凝固速率过快常得到粉末或没有规则外形的块状物。 * 各向异性——晶体的许多物理性质如强度、热导性和光导性等存在各向异性即在各个方向上的性质是不同的 二、晶胞 1、定义——描述晶体结构的基本单元。 2、特征—— (1)习惯采用的晶胞都是体,同种晶体所有的晶胞大小形状及内部的原子种类、个数和几何排列完全相同。 (2)整个晶体可以看作是数量巨大的晶胞“无隙并置”而成。 <1> 所谓“无隙”是指相邻晶胞之间没有任何间隙; <2> 所谓“并置”是指所有晶胞都是平行排列的,取向相同。 3、确定晶胞所含粒子数和晶体的化学式——均摊法分析晶胞与粒子数值的关系 (1)处于内部的粒子,属于晶胞,有几个算几个均属于某一晶胞。 (2)处于面上的粒子,同时为个晶胞共有,每个粒子有属于晶胞。(3)处于90度棱上的粒子,同时为个晶胞共有,每个粒子有属于晶胞。 (4)处于90度顶点的粒子,同时为个晶胞共有,每个粒子有属于晶胞;处于60度垂面顶点的粒子,同时为个晶胞共有,每个粒子有属于晶胞;处于120度垂面顶点的粒子,同时为个晶胞共有,每个粒子有属于晶胞。 4、例举 三、分类 晶体根据组成粒子和粒子之间的作用分为分子晶体、原子晶体、金属晶体和离子晶体四种类型。 3-2、分子晶体和原子晶体 一、分子晶体 1、定义——只含分子的晶体。 2、组成粒子——。 3、存在作用——组成粒子间的作用为(),多原子分子内部原子间的作用为。 * 分子晶体中定含有分子间作用力,定含有共价键。 * 分子间作用力于化学键。 4、物理性质 (1)熔沸点与硬度——融化和变形只需要克服,所以熔沸点、硬度,部分分子晶体还可以升华。熔融一定破坏分子间的和可能存在的键,绝不会破坏分子内部的。 第三章晶体结构与性质 第一节晶体常识 第一课时 教学目标: 1、通过实验探究理解晶体与非晶体的差异。 2、学会分析、理解、归纳和总结的逻辑思维方法,提高发现问题、分析问题和解决问题的能力。 3、了解区别晶体与非晶体的方法,认识化学的实用价值,增强学习化学的兴趣。 教学重难点: 1、晶体与非晶体的区别 2、晶体的特征 教学方法建议:探究法 教学过程设计: [新课引入]:前面我们讨论过原子结构、分子结构,对于化学键的形成也有了初步的了解,同时也知道组成千万种物质的质点可以是离子、原子或分子。又根据物质在不同温度和压强 下,物质主要分为三态:气态、液态和固态,下面我们观察一些固态物质的图片。 [投影]:1、蜡状白磷;2、黄色的硫磺;3、紫黑色的碘;4、高锰酸钾 [讲述]:像上面这一类固体,有着自己有序的排列,我们把它们称为晶体;而像玻璃这一类 固体,本身原子排列杂乱无章,称它为非晶体,今天我们的课题就是一起来探究晶体与非晶体的有关知识。[板书]:—、晶体与非晶体 [板书]:1、晶体与非晶体的本质差异 [提问]:在初中化学中,大家已学过晶体与非晶体,你知道它们之间有没有差异? [回答]:学生:晶体有固定熔点,而非晶体无固定熔点。 [讲解]:晶体有固定熔点,而非晶体无固定熔点,这只是晶体与非晶体的表观现象,那么他 们在本质上有哪些差异呢? [投影]晶体与非晶体的本质差异 [板书]:自范性:晶体能自发性地呈现多面体外形的性质。 [解释]:所谓自范性即“自发”进行,但这里得注意,“自发”过程的实现仍需一定的条件。例如:水能自发地从高处流向低处,但不打开拦截水流的闸门,水库里的水不能下泻。 [板书]:注意:自范性需要一定的条件,其中最重要的条件是晶体的生长速率适当。 [投影]:通过影片播放出,同样是熔融态的二氧化硅,快速的冷却得到玛瑙,而缓慢冷却得到水晶过程。[设问]:那么得到晶体的途径,除了用上述的冷却的方法,还有没有其它途径呢?你能列举 哪些? [板书]:2、晶体形成的一段途径: (1)熔融态物质凝固; (2)气态物质冷却不经液态直接凝固(凝华); (3)溶质从溶液中析出。 晶体学基础与晶体结构习题与答案 1. 由标准的(001)极射赤面投影图指出在立方晶体中属于[110]晶带轴的晶带,除了已在图2-1中标出晶面外,在下列晶面中哪些属于[110]晶带?(1-12),(0-12),(-113),(1-32),(-221)。 图2-1 2. 试证明四方晶系中只有简单立方和体心立方两种点阵类型。 3. 为什么密排六方结构不能称作为一种空间点阵? 4. 标出面心立方晶胞中(111)面上各点的坐标。 5. 标出具有下列密勒指数的晶面和晶向:a)立方晶系(421),(-123),(130),[2-1-1],[311]; b)六方晶系(2-1-11),(1-101),(3-2-12),[2-1-11],[1-213]。 6. 在体心立方晶系中画出{111}晶面族的所有晶面。 7. 在立方晶系中画出以[001]为晶带轴的所有晶面。 8. 已知纯钛有两种同素异构体,密排六方结构的低温稳定的α-Ti和体心立方结构的高温稳定的β-Ti,其同素异构转变温度为882.5℃,使计算纯钛在室温(20℃)和900℃时晶体中(112)和(001)的晶面间距(已知aα20℃=0.29506nm,cα20℃=0.46788nm,aα900℃=0.33065nm)。 9. 试计算面心立方晶体的(100),(110),(111),等晶面的面间距和面致密度,并指出面间距最大的面。 10.平面A在极射赤平面投影图中为通过NS及核电0°N,20°E的大圆,平面B的极点在30°N,50°W处,a)求极射投影图上两极点A、B间的夹角;b)求出A绕B顺时针转过40°的位置。 11. a)说明在fcc的(001)标准极射赤面投影图的外圆上,赤道线上和0°经线上的极点的指数各有何特点,b)在上述极图上标出(-110),(011),(112)极点。 12. 图2-2为α-Fe的x射线衍射谱,所用x光波长λ=0.1542nm,试计算每个峰线所对应晶面间距,并确定其晶格常数。 图2-2 13. 采用Cu kα(λ=0.15418nm)测得Cr的x射线衍射谱为首的三条2θ=44.4°,64.6°和81.8°,若(bcc)Cr的晶格常数a=0.28845nm,试求对应这些谱线的密勒指数。 高二化学晶体结构与性质测试题 高二化学晶体结构与性质 测试题 (2013-4-6) 1、晶体与非晶体的严格判别可采用( D ) A. 有否自范性 B.有否各向同性 C.有否固定熔点 D.有否周期性结构 2、下列式子中,真实表示物质分子组成的是( A ) A 、H 2SO 4 B 、NH 4Cl C 、SiO 2 D 、C 3. 石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数 (D ) A.10个 B.18个 C.24个 D.14个 4、下列各组物质中,化学键类型相同、晶体类型也相同的是(C ) A 、CaCl 2和Na 2O 2 B 、碘、氖 C 、CO 2和H 2O D 、CCl 4和KCl 5、下表列出了有关晶体的说明,有错误的 6 A .在NaCl 晶体中,与一个Na +最近的且距离相等的Cl -的个数 B .在金刚石晶体中,最小的环上的碳原子个数 C .在二氧化硅晶体中,最小的环上的原子个数 D .在石墨晶体的片层结构中,最小的环上的碳原子个数 7、下列说法正确的是(N A 为阿伏加德罗常数) ( B ) A .124 g P 4含有P—P 键的个数为4NA B .12 g 石墨中含有C— C 键的个数为1.5N A C .12 g 金刚石中含有C—C 键的个数为N A D .60gSi02中含Si—O 键的个数为2N A 8. 共价键、离子键和范德华力都是微粒之间 的不同作用力,下列含有两种结合力的是 ( B ) ①Na 2O 2 ②SiO 2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷 A .①②④ B .①③⑥ C .②④⑥ D .③④⑤ 9. 下列数据是对应物质的熔点,有关的判断 A .只要含有阴离子的晶体就一定是离子晶体 B .在共价化合物分子中各原子都形成8电子结构 CO 、 ⑤N 2、⑥H 2沸点由高到低正确的是 ( C ) A .①②③④⑤⑥ B .③②①⑤④⑥ C . ③②①④⑤⑥ D .⑥⑤④③②① 11、晶体结构属于面心结构的是( C ) A .NaCl B 、CsCl C 、CO 2 D 、 Na 12、将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用有:①共价键 ②离子键 ③ 第三章《晶体结构与性质》《晶体的常识》教学设计 一、教学目标 1、知识与技能 (1)知道获得晶体的几种途径 (2)理解晶体的特点和性质及晶体与非晶体的本质区别 (3)初步学会确定一个晶胞中平均所含粒子数的方法 2、过程与方法 (1)收集生活素材,结合已有知识和生活经验对晶体与非晶体进行分类 (2)学生通过观察、实验等方法获取信息 (3)学会运用比较、分类、归纳、概括等方法对获取的信息进行加工 3、情感态度与价值观 (1)培养学生科学探究的方法 (2)培养学生的动手能力、观察能力、自主学习的能力,保持对生活中化学的好奇心和探知欲,增强学生学习化学的兴趣。 二、教学重点 1、晶体的特点和性质及晶体与非晶体的本质区别 2、确定一个晶胞中平均所含粒子数的方法 三、教学难点 1、确定一个晶胞中平均所含粒子数的方法 四、教学用品 课前学生收集的各种固体物质、玛瑙耳坠和水晶项链、蜂巢、晶胞实物模型、乒乓球、铁架台、酒精灯、蒸发皿、圆底烧瓶、碘、水、多媒体等 五、教学过程 1.新课导入: [教师]上课前,我已经请同学们收集了一些身边的固体物质,大家都带来了吗?(学生:带来了)你们都带来了哪些固体呢?(学生七嘴八舌,并展示各自的固体)[教师]同学们带来的固体物质可真是琳琅满目啊!但是,我们每个人可能只带了几样,想知道别人收集了哪些固体物质吗?(学生:想)下面我们请前后四个同学组成一个小组,然后互相交流一下收集的各种固体物质,并讨论如何将这些固体物质进行分类呢? [分组讨论]互相交流各自所带的物品,并分类(教师进行巡视) [教师]:请这组同学将你们带来的固体和交流的结果汇报一下。 [学生汇报]:(我们讨论后觉得将粗盐、明矾、樟脑丸分为一类;塑料、玻璃片、橡胶分为另一类。教师追问:你们为什么会这样分呢?生:根据这些有规则的几何外形,而另一些没有。) [教师总结]这组同学收集的物品很丰富,并通过组内讨论确定了分类依据,然后进行了恰当的分类。其实,同学们也许没有留心观察,我们身边还有许多美丽的固体,当然也有的可能是我们日常生活中不易接触到的。下面,我们就一起欣赏一下这些美丽的固体。 [视频投影]雪花放大后的形状、烟水晶、石膏、毒砂、绿柱石、云母等晶体实物(并配以相应的解说,给学生了解到这些固态物质都有规则的几何外形。) [教师讲述]我们就将这些有规则几何外形的固体称之为晶体,而另一些没有规则几何外形的固体称之为非晶体。 [板书]一、晶体与非晶体 设计意图:课前请同学收集身边的固态物质,然后在课堂上展示,并分组交流讨论,最后进行分类,并在课堂上汇报。这样从学生身边的固体入手,直观、简洁地引入课题,潜移默化 几种常见晶体结构分析文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688] 几种常见晶体结构分析 河北省宣化县第一中学 栾春武 邮编 075131 栾春武:中学高级教师,张家口市中级职称评委会委员。河北省化学学会会员。市骨干教师、市优秀班主任、模范教师、优秀共产党员、劳动模范、县十佳班主任。 联系电话: E-mail : 一、氯化钠、氯化铯晶体——离子晶体 由于离子键无饱和性与方向性,所以离子晶体中无单个分子存在。阴阳离子在晶体中按一定的规则排列,使整个晶体不显电性且能量最低。离子的配位数分析如下: 离子数目的计算:在每一个结构单元(晶胞)中,处于不同位置的微粒在该单元中所占的份额也有所不同,一般的规律是:顶点上的微粒属于该 单元中所占的份额为18,棱上的微粒属于该单元中所占的份额为1 4,面上 的微粒属于该单元中所占的份额为1 2,中心位置上(嚷里边)的微粒才完 全属于该单元,即所占的份额为1。 1.氯化钠晶体中每个Na +周围有6个Cl -,每个Cl -周围有6个Na +,与一个Na +距离最近且相等的Cl -围成的空间构型为正八面体。每个Na +周围与其最近且距离相等的Na +有12个。见图1。 图1 图2 NaCl 晶胞中平均Cl-个数:8×1 8 + 6× 1 2 = 4;晶胞中平均Na+个数:1 + 12×1 4 = 4 因此NaCl的一个晶胞中含有4个NaCl(4个Na+和4个Cl-)。 2.氯化铯晶体中每个Cs+周围有8个Cl-,每个Cl-周围有8个Cs+,与一个Cs+距离最近且相等的Cs+有6个。 晶胞中平均Cs+个数:1;晶胞中平均Cl-个数:8×1 8 = 1。 因此CsCl的一个晶胞中含有1个CsCl(1个Cs+和1个Cl-)。 二、金刚石、二氧化硅——原子晶体 1.金刚石是一种正四面体的空间网状结构。每个C 原子以共价键与4个C原子紧邻,因而整个晶体中无单 个分子存在。由共价键构成的最小环结构中有6个碳原 子,不在同一个平面上,每个C原子被12个六元环共用,每C—C键共6 个环,因此六元环中的平均C原子数为6× 1 12 = 1 2 ,平均C—C键数为 6×1 6 = 1。 C原子数: C—C键键数= 1:2; C原子数: 六元环数= 1:2。 2.二氧化硅晶体结构与金刚石相似,C被Si代替,C与C之间插 氧,即为SiO 2晶体,则SiO 2 晶体中最小环为12环(6个Si,6个O), 图3 CsCl 晶 图4 金刚石晶 第三章晶体结构与性质第一节晶体的常识知识归纳 一、晶体与非晶体 1.晶体与非晶体的本质差异: 2.获得晶体的三条途径 (1)______物质凝固; (2)______物质冷却不经液态直接凝固(______); (3)______从溶液中析出。 3.晶体的特点 (1)自范性 ①定义:在适宜的条件下,晶体能够自发地呈现规则的______,这称为晶体的______。非晶体物质没有这个特性。 ②形成条件:晶体______适当。 ③本质原因:晶体中粒子在______里呈现______的______排列。 (2)晶体在不同的方向上表现出不同的物理特质即______。 (3)晶体的______较固定。 (4)区分晶体和非晶体的最可靠的科学方法是对固体进行______实验。 二、晶胞 1.概念 晶胞是晶体中最小的______。 2.结构 晶胞一般都是______,晶体是由无数晶胞“______”而成。 (1)无隙:相邻晶胞之间无任何______。 (2)并置:所有晶胞都是______排列的,取向______。 (3)所有晶胞的______及内部的原子______及几何排列是完全相同的。 【答案】一、1.有周期性没有相对无序 2.(1)熔融态(2)气态凝华(3)溶质 3.(1)多面体外形性质自范性生长的速率三维空间周期性有序 (2)各向异性(3)熔点(4)X-射线衍射 二、1.结构重复单元 2.平行六面体无隙并置(1)间隙(2)平行相同(3)形状种类 知识重点 与晶体有关的计算 晶体结构的计算常常涉及如下数据:晶体密度、N A、M、晶体体积、微粒间距离、微粒半径、夹角等,密度的表达式往往是列等式的依据。解答这类题时,一要掌握晶体“均摊法”的原理,二要有扎实的立体几何知识,三要熟悉常见晶体的结构特征,并能融会贯通,举一反三。 1.“均摊法”原理 晶胞中任意位置上的一个原子如果被n个晶胞所共有,则每个晶胞对这个原子分得的份额就是1 n 。 非平行六面体形晶胞中粒子数目的计算同样可用“均摊法”,其关键仍然是确定一个粒子为几个晶胞所共 有。例如,石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为1 3 ,那么一个六 边形实际有6×1 3 =2个碳原子。又如,在六棱柱晶胞(如下图所示的MgB2晶胞)中,顶点上的原子为6个 晶胞(同层3个,上层或下层3个)共有,面上的原子为2个晶胞共有,因此镁原子个数为12×1 6 +2× 3-1、晶体的常识 、晶体和非晶体 1、概述一一自然界中绝大多数物质是固体,固体分为_______________ 和_________ 两大类。 2、对比—— 现周期性有序排列的宏观表象。 *晶体不因颗粒大小而改变,许多固体粉末用肉眼看不到规则的晶体外形,但在显微镜下仍可看到。 *晶体呈现自范性的条件之一是晶体生长的速率适当,熔融态物质凝固速率过快常得到粉末或没有规则外形的块状物。 *各向异性一一晶体的许多物理性质如强度、热导性和光导性等存在各向异性即在各个方向上的性质是不同的 二、晶胞 1、定义一一描述晶体结构的基本单元。 2、特征一一 (1)习惯采用的晶胞都是___________ 体,同种晶体所有的晶胞大小形状及内部的原子种类、个数和几何 排列完全相同。 (2 )整个晶体可以看作是数量巨大的晶胞“无隙并置”而成。 <1>所谓“无隙”是指相邻晶胞之间没有任何间隙; <2>所谓“并置”是指所有晶胞都是平行排列的,取向相同。 3、确定晶胞所含粒子数和晶体的化学式一一均摊法分析晶胞与粒子数值的关系 (1)处于内部的粒子,__________ 属于晶胞,有几个算几个均属于某一晶胞。 (2 )处于面上的粒子,同时为______ 个晶胞共有,每个粒子有_______ 属于晶胞。 (3)处于90度棱上的粒子,同时为 ______ 个晶胞共有,每个粒子有 _______ 属于晶胞。 (4)处于90度顶点的粒子,同时为 ______ 个晶胞共有,每个粒子有 _______ 属于晶胞;处于60度垂面顶点 的粒子,同时为—个晶胞共有,每个粒子有—属于晶胞;处于120度垂面顶点的粒子,同时为—个晶胞共有,每个粒子有—属于晶胞。 4、例举 三、分类 第三章晶体结构与性质 第二节分子晶体与原子晶体(第1课时) 【学习目标】 1.说出分子晶体的定义、构成微粒、粒子间的作用力及哪些物质是典型的分 子晶体。 2.以冰和干冰为典型例子描述分子晶体的结构与性质的关系,解释氢键对冰晶 体结构和和物理性质的影响。 【预学能掌握的内容】 【自主学习】 一.分子晶体 1.定义:________________________________ 2.构成微粒________________ 3.粒子间的作用力:____________________ 4. 较典型的分子晶体有:①②_______ 单质 ③氧化物④⑤ 此外,还有少数盐是分子晶体,如 5.分子晶体的物理性质:熔沸点较____、易升华、硬度____。固态和熔融状态 下都。 6.分子间作用力对物质的性质有怎么样的影响? 一般说来,对与组成和结构相似的物质,相对分子量越大,分子间作用力越 ____,物质的熔沸点也越____。但是有些氢化物的熔点和沸点的递变却与此不 完全符合,如:NH 3 ,H 2 O和HF的沸点就出现反常,因 为这些分子间存在____键。 7.分子晶体的结构特征: (1)只有范德华力,无分子间氢键-分子晶体的结构特征 为。如:C60、干冰、I2、O2。 如右图所示,每个CO2分子周围有个紧邻的 CO2分子。 (2)有分子间氢键-不具有分子密堆积特征。如:冰 中每个水分子周围只有个紧邻的水分子,这一 排列使冰晶体中水分子的空间利用率不高,留有相当大 的空隙。 【预学中的疑难问题】 【合作探究】 1.大多数分子晶体的结构特征 (1)大多数分子晶体采用堆积 (2)若用一个小黑点代表一个分子,试画出大多数分子晶体的晶胞图 (3)干冰晶体 ①二氧化碳分子在晶胞中处于什么位置? ②一个干冰晶胞中含有几个分子? ③每个CO2分子周围有几个距它最近的分子? ④干冰晶体中CO 2 分子的排列方向有几种 ④干冰和冰,那种晶体密度大?试从晶体结构特征解释。 高中化学晶体的结构与性质知识点及相关例题 讲解 自然界中的固体可以分为两种存在形式:晶体和非 晶体。晶体是经过结晶过程而形成的具有规则的几何外形的 固体。晶体中原子或分子在空间按一定规律周期性重复的排 列,从而使晶体内部各个部分的宏观性质是相同的,而且具 有固定的熔点和规则的几何外形。 一、晶体 固体可以分为两种存在形式:晶体和非晶体。 晶体的分布非常广泛,自然界的固体物质中,绝大多数 是晶体。气体、液体和非晶体在一定条件下也可转变为晶体。 晶体是经过结晶过程而形成的具有规则的几何外形的 固体。晶体中原子或分子在空间按一定规律周期性重复的排 列,从而使晶体内部各个部分的宏观性质是相同的,而且具 有固定的熔点和规则的几何外形。 二、晶体结构 1.几种晶体的结构、性质比较 2.几种典型的晶体结构: (1)NaCl晶体(如图1):每个Na+周围有6个Cl-,每个Cl-周围有6个Na+,离子个数比为1:1。 (2)CsCl晶体(如图2):每个Cl-周围有8个Cs+,每个Cs+周围有8个Cl-;距离Cs+最近的且距离相等的Cs+ 有6个,距离每个Cl-最近的且距离相等的Cl-也有6个,Cs+和Cl-的离子个数比为1:1。 (3)金刚石(如图3):每个碳原子都被相邻的四个碳原子包围,以共价键结合成为正四面体结构并向空间发展, 键角都是109o28',最小的碳环上有六个碳原子。 (4)石墨(如图4、5):层状结构,每一层内,碳原子以正六边形排列成平面的网状结构,每个正六边形平均拥有 两个碳原子。片层间存在范德华力,是混合型晶体。熔点比 金刚石高。 (5)干冰(如图6):分子晶体,每个CO2分子周围紧邻其他12个CO2分子。 晶体结构练习题 一、(2005 全国初赛)下图是化学家合成的能实现热电效应的一种 晶体的晶胞模型。图中的大原子是稀土原子,如镧;小原子是周期 系第五主族元素,如锑;中等大小的原子是周期系VIII 族元素,如 铁。按如上结构图写出这种热电晶体的化学式。给出计算过程。提 示: 晶胞的 6 个面的原子数相同。设晶体中锑的氧化态为-1,镧的 氧化态为+3,问:铁的平均 氧化态多大? 解析:晶胞里有2个La原子(处于晶胞的顶角和体心); 有8个Fe 原子(处于锑形成的八面体的中心);锑八面体是共 顶角相连的,平均每个八面体有6/2= 3 个锑原子,晶 胞中共有8 个八面体,8x3=24 个锑原子;即:La2Fe8Sb24。 答案:化学式LaFe4Sb12 铁的氧化态9/4 = 2.25 二、(2004 年全国初赛)最近发现,只含镁、镍和碳三种元素的晶 体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广 泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行(面 心)立方最密堆积(ccp ),它们的排列有序,没有相互代换的现象 1) (在(面心)立方最密堆积-填隙模型中,八面体空隙与堆积球的比例为1︰1,在如图晶胞中,八面体空隙位于体心位置和所有棱的中心位置,它们的比例是1︰3,体心位置的八面体由镍原子构成,可填入碳原子,而棱心位置的八面体由2个镁原子和 4 个镍原子一起构成,不填碳原子。) (2)MgCNi 3(化学式中元素的顺序可不同,但原子数目不能错)。 三、将Nb2O5 与苛性钾共熔后,可以生成溶于水的铌酸钾,将其慢慢浓缩可以得到晶体 K p[Nb m O n] ·16H2O,同时发现在晶体中存在[Nb m O n]p-离子。该离子结构由6个NbO 6正八面体构成的。每个NbO6八面体中的6个氧原子排布如下:4个氧原子分别与4个NbO 6八面体共顶点;第5个氧原子与5个八面体共享一个顶点;第6个氧原子单独属于这个八面体的。列式计算并确定该晶体的化学式。计算该离子结构中距离最大的氧原子间的距离是距离最短的铌原子间距离的多少倍? 解析:这是一个涉及正八面体堆积的问题,我们先根据题意来计算。对一个铌氧八面体,有一个氧原子完全属于这个八面体,有四个氧原子分别与一个八面体共用氧原子,即属于这个八面体的氧原子是1/2 个,另一个氧原子是六个八面体共用的,自然是1/6 了。故对一个铌而言,氧原子数为1+4×1/2 +1/6 =19/6 。 晶体结构与性质 一、晶体的常识1.晶体与非晶体 晶体与非晶体的本质差异 晶体非晶体 自范性 有(能自发呈现多面体外形)无(不能自发呈现多面体外形) 微观结构 原子在三维空间里呈周期性有序排列 原子排列相对无序 晶体呈现自范性的条件:晶体生长的速率适当 得到晶体的途径:熔融态物质凝固;凝华;溶质从溶液中析出特性:①自范性;②各向异性(强度、导热性、光学性质等)③固定的熔点;④能使X-射线产生衍射(区分晶体和非晶体最可靠的科学方法)2.晶胞--描述晶体结构的基本单元,即晶体中无限重复的部分 一个晶胞平均占有的原子数=8×晶胞顶角上的原子数+4×晶胞棱上的原子+2×晶胞面上的粒子数+1×晶胞体心内的原子数 思考:下图依次是金属钠(Na)、金属锌(Zn)、碘(I2)、金刚石(C)晶胞的示意图,它们分别平均含几个原子? 1 1 1 eg:1.晶体具有各向异性。如蓝晶(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨与层垂直方向上的电导率和与层平行方向上的电导率之比为1:1000。晶体的各向异性主要表现在() ①硬度②导热性③导电性④光学性质 A.①③ B.②④ C.①②③ D.①②③④ 2.下列关于晶体与非晶体的说法正确的是() A.晶体一定比非晶体的熔点高 B.晶体一定是无色透明的固体 C.非晶体无自范性而且排列无序 D.固体SiO2一定是晶体 3.下图是CO2分子晶体的晶胞结构示意图,其中有多少个原子? 二、分子晶体与原子晶体 1.分子晶体--分子间以分子间作用力(范德华力、氢键)相结合的晶体注意:a.构成分子晶体的粒子是分子 b.分子晶体中,分子内的原子间以共价键结合,相邻分子间以分子间作用力结合 ①物理性质 a.较低的熔、沸点 b.较小的硬度 c.一般都是绝缘体,熔融状态也不导电 d.“相似相溶原理”:非极性分子一般能溶于非极性溶剂,极性分子一般能溶于极性溶剂 ②典型的分子晶体 a.非金属氢化物:H2O、H2S、NH3、CH4、HX等 b.酸:H2SO4 、HNO3、 创作编号: GB8878185555334563BT9125XW 创作者:凤呜大王* 1、【答案】(1)mol-1(2)①8 4 ②48③ 【解析】(1)铜晶胞为面心立方最密堆积,1个晶胞能分摊到4个Cu原子;1个晶胞的体积为a3cm3;一个晶胞的质量为a3ρ g;由=a3ρ g,得N A=mol -1。 (2) ①每个Ca2+周围吸引8个F-,每个F-周围吸收4个Ca2+,所以Ca2+的配位数为8,F-的配位数为4。②F-位于晶胞内部,所以每个晶胞中含有F-8个。含有Ca2+为×8+×6=4个。 ③ρ===a g·cm-3, V=。 2、【解析】 试题分析:本考查学生对知识综合利用能力,要求对晶胞知识能够融会贯通。依题意画出侧面图,设正立方体边长为a,则体积为a3。,AC=4r, 故原子半径,根据均摊法得,每个正立方体包括金属原子 8×1/8+6×1/2=4(个),球体体积共 4×空间利用率为:. 考点:均摊法计算 点评:本题考查相对综合,是学生能力提升的较好选择。 3、(1)34.0% (2)2.36 g/cm3 【解析】(1)该晶胞中Si原子个数=4+8×1/8+6×1/2=8,设Si原子半径为xcm,该晶胞中硅原子总体积=,根据硬球接触模型可知,体对角线四分之一处的原子与顶点上的原子紧贴,设晶胞边长为a,所以,解得a=,晶胞体积=()3,因此空间利用率=×100%=34.0%。(2)根据以上分析可知边长=,所以密度==2.36g/cm3。 4、【答案】(1)4(2)金属原子间相接触,即相切 (3)2d3(4) 【解析】利用均摊法解题,8个顶点上每个金原子有属于该晶胞,6个面上每个金原子有属于该晶胞,故每个晶胞中金原子个数=8×+6×=4。假设金原子间相接 触,则有正方形的对角线为2d。正方形边长为d。所以V晶= (d)3=2d3,V m=N A=d3N A,所以ρ==。 5、【答案】(1)YBa2Cu3O7(2)价n(Cu2+)∶n(Cu3+)=2∶1 【解析】(1)由题图所示晶胞可知:一个晶胞中有1个Y3+,2个Ba2+。晶胞最上方、最下方分别有4个Cu x+,它们分别被8个晶胞所共用;晶胞中间立方体的8个顶点各有一个Cu x+,它们分别被4个晶胞共用,因此该晶胞中的Cu x+为n(Cu x+)=(个)。晶胞最上方、最下方平面的棱边上共有4个氧离子,分别被4个晶胞共用;又在晶胞上的立方体的竖直棱边上和晶胞下方的立方体的竖直棱 1 1. 金刚石晶体结构(硅单质相同) 1mol 金刚石中含有 mol C —C 键, 最小环是 元环,(是、否) 共平面。 每个C-C 键被___个六元环共有,每个C 被_____ 个六元环共有。每个六元环实际拥有的碳原子数为 ______个。C-C 键夹角:_______。C 原子的杂化方式是______ SiO 2晶体中,每个Si 原子与 个O 原子以共价键相结合, 每个O 原子与 个Si 原子以共价键相结合,晶体中Si 原子与 O 原子个数比为 。 晶体中Si 原子与Si —O 键数目之比 为 。最小环由 个原子构成,即有 个O , 个Si ,含有 个Si-O 键,每个Si 原子被 个十二元环,每 个O 被 个十二元环共有,每个Si-O 键被__个十二元环共 有;所以每个十二元环实际拥有的Si 原子数为_____个,O 原子数为____个,Si-O 键为____个。硅原子的杂化方式是______,氧原子的杂化方式是_________. 2 . 在NaCl 晶体中,与每个Na +等距离且最近的Cl -有 个, 这些Cl -围成的几何构型是 ;与每个Na +等距离且最近的 Na +有 个。由均摊法可知该晶胞中实际拥有的Na +数为____个 Cl -数为______个,则次晶胞中含有_______个NaCl 结构单元。 3. CaF 2型晶胞中,含:___个Ca 2+和____个F - Ca 2+的配位数: F -的配位数: Ca 2+周围有______个距离最近且相等的Ca 2+ F - 周围有_______个距离最近且相等的F ——。 2 4.如图为干冰晶胞(面心立方堆积),CO 2分子在晶胞 中的位置为 ;每个晶胞含二氧化碳分子的 个数为 ;与每个二氧化碳分子等距离且最 近的二氧化碳分子有 个。 5.如图为石墨晶体结构示意图, 每层内C 原子以 键与周围的 个C 原子结合,层间作用力为 ; 层内最小环有 _____个C 原子组成;每个C 原子被 个最小环所共用;每个 最小环含有 个C 原子, 个C —C 键;所以C 原子数和C-C 键数之比是_________。C 原子的杂化方式 是__________. 6. 冰晶体结构示意如图 ,冰晶体中位于中心的一个水分子 周围有______个位于四面体顶角方向的水分子,每个水分子通过 ______条氢键与四面体顶点上的水分子相连。每个氢键被_____个 水分子共有,所以平均每个水分子有______条氢键。 7. 金属的简单立方堆积是_________层通过_________对 _________堆积方式形成的,晶胞如图所示:每个金属阳离子的 配位数是_____,代表物质是________________________。 8. 金属的体心立方堆积是__________层通过 ________对________堆积方式形成的,晶胞如图: 每个阳离子的配位数是__________.代表物质是 _____________________ 。 课时作业(四十)晶体结构与性质 一、选择题(本题包括12小题,每小题4分,共48分) 1.下列叙述正确的是() A.分子晶体中的每个分子内一定含有极性共价键 B.原子晶体中的相邻原子间只存在非极性共价键 C.含有阴离子的化合物一定含有阳离子 D.金属晶体的熔点和沸点都很高 2.下列物质形成的晶体中,其中任何一个原子都被相邻的四个原子包围,以共价键形成正四面体,并向空间伸展成网状结构的是() A.四氯化碳B.石墨 C.金刚石D.二氧化硅 3.有下列离子晶体空间结构示意图:?为阳离子,为阴离子。以M代表阳离子,N 代表阴离子,化学式为MN2的晶体结构为() 4.为缓解旱情,有关部门需要选择适宜的条件和方法,向大气中发射催雨剂,其主要成分是干冰(固态CO2)、液氮、碘化银等。下列有关叙述不正确的是() A.干冰和液氮都是由分子构成的晶体 B.干冰和液氮的分子间都存在共价键 C.干冰和液氮催雨的原理都属于物理变化 D.碘化银粒在冷云中产生冰晶,起到催雨作用 5.下列各组物质各自形成晶体,均属于分子晶体的化合物是() A.NH3、HD、C10H8B.PCl3、CO2、H2SO4 C.SO2、SiO2、P2O5D.CCl4、Na2S、H2O2 6.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是() A.液溴和苯分别受热变为气体 B.干冰和氯化铵分别受热变为气体 C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中 7.在通常条件下,下列各组物质的性质排列正确的是() A.熔点:CO2>KCl>SiO2 B.水溶性:HCl>H2S>SO2 C.沸点:乙烷>戊烷>丁烷 D.热稳定性:HF>H2O>NH3 8() A. B.表中只有BCl3和干冰是分子晶体 C.同族元素的氧化物可形成不同类型的晶体 D.不同族元素的氧化物可形成相同类型的晶体 9.下面关于SiO2晶体网状结构的叙述正确的是() A.最小的环上,有3个Si原子和3个O原子 B.最小的环上,Si和O原子数之比为1∶2 C.最小的环上,有6个Si原子和6个O原子 D.存在四面体结构单元,O处于中心,Si处于4个顶角 10. 晶体结构 1、解释下列概念 晶系、晶胞、晶胞参数、空间点阵、米勒指数(晶面指数)、离子晶体的晶格能、原子半径与离子半径、配位数、离子极化、同质多晶与类质同晶、正尖晶石与反正尖晶石、反萤石结构、铁电效应、压电效应. 2、(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求出该晶面的米勒指数;(2)一晶面在x、y、z轴上的截距分别为a/ 3、b/2、c,求出该晶面的米勒指数。 3、在立方晶系的晶胞中画出下列米勒指数的晶面和晶向:(001)与[210],(111)与[112],(110)与[111],(322)与[236],(257)与[111],(123)与[121],(102),(112),(213),[110],[111],[120],[321] 4、写出面心立方格子的单位平行六面体上所有结点的坐标。 5、已知Mg2+半径为0.072nm,O2-半径为0.140nm,计算MgO晶体结构的堆积系数与密度。 6、计算体心立方、面心立方、密排六方晶胞中的原子数、配位数、堆积系数。 7、从理论计算公式计算NaC1与MgO的晶格能。MgO的熔点为2800℃,NaC1为80l℃, 请说明这种差别的原因。 8、根据最密堆积原理,空间利用率越高,结构越稳定,金钢石结构的空间利用率很低(只有34.01%),为什么它也很稳定? 9、证明等径圆球面心立方最密堆积的空隙率为25.9%; 10、金属镁原子作六方密堆积,测得它的密度为1.74克/厘米3,求它的晶胞体积。 11、根据半径比关系,说明下列离子与O2—配位时的配位数各是多? r o2-=0.132nm r Si4+=0.039nm r K+=0.133nm r Al3+=0.057nm r Mg2+=0.078n m 12、为什么石英不同系列变体之间的转化温度比同系列变体之间的转化温度高得多? 13、有效离子半径可通过晶体结构测定算出。在下面NaCl型结构晶体中,测得MgS 和MnS的晶胞参数均为a=0.52nm(在这两种结构中,阴离子是相互接触的)。若CaS(a=0.567nm)、CaO(a=0.48nm)和MgO(a=0.42nm)为一般阳离子——阴离子接触,试求这些晶体中各离子的半径。 14、氟化锂(LiF)为NaCl型结构,测得其密度为2.6g/cm3,根据此数据汁算晶胞参数, 黄石二中2011年化学选修3第三章《晶体结构与性质》单元测试题时间:110分钟满分:120分2011.2.25 命题人:高存勇 选择题(每小题只有一个正确答案。每小题3分,共45分) 1.下列有关金属晶体的判断正确的是 A.简单立方、配位数6、空间利用率68% B.钾型、配位数6、空间利用率68% C.镁型、配位数8、空间利用率74% D.铜型、配位数12、空间利用率74% 2.有关晶格能的叙述正确的是 A.晶格能是气态离子形成1摩离子晶体释放的能量 B.晶格能通常取正值,但是有时也取负值 C.晶格能越大,形成的离子晶体越不稳定 D.晶格能越大,物质的硬度反而越小 3.下列排列方式是镁型堆积方式的是 A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBAABCCBA 4.下列关于粒子结构的描述不正确的是 A.H2S和NH3均是价电子总数为8的极性分子 B.HS-和HCl均是含一个极性键的18电子粒子 C.CH2Cl2和CCl4均是四面体构型的非极性分子 D.1 mol D162O中含中子、质子、电子各10 N A(N A代表阿伏加德罗常数) 5.现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。其 中如图所示是已经合成的最著名的硫-氮化合物的分子结构。 下列说法正确的是 A.该物质的分子式为SN B.该物质的分子中既有极性键又有非极性键 C.该物质具有很高的熔沸点 D.该物质与化合物S2N2互为同素异形体 6.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是 A.配合物中中心原子的电荷数和配位数均为6 B.该配合物可能是平面正方形结构 C.Cl—和NH3分子均与Pt4+配位 D.配合物中Cl—与Pt4+配位,而NH3分子不配 7.石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原 子填充在石墨各层谈原子中。比较常见的石墨间隙化合物 是青铜色的化合物,其化学式可写作CxK,其平面图形见下图,则x值为: A . 8 B. 12 C.24 D.60 8.金属键具有的性质是 A.饱和性B.方向性C.无饱和性和方向性D.既有饱和性又有方向性9.下列说法正确的是 A.124g P4含有的P-P键的个数为6N A B.12g石墨中含有的C-C键的个数为2N A C.12g金刚石中含有的C-C键的个数为1.5N A D.60gSiO2中含Si-O键的个数为2N A 10.长式周期表共有18个纵行,从左到右排为1-18列,即碱金属为第一列,稀有气体元素高中化学选修三_晶体结构与性质
晶体结构练习题答案
晶体结构与性质知识总结(完善)
第三章晶体结构与性质全章教案
晶体学基础与晶体结构习题与答案
整理晶体结构考试(含答案)
第三章《晶体结构与性质》《晶体的常识》教学设计
几种常见晶体结构分析
高中化学晶体结构与性质范文晶体的常识
晶体结构与性质知识总结
第三章晶体结构与性质
。高中化学晶体的结构与性质知识点及相关例题讲解
晶体结构练习题答案
高中化学选修三——晶体结构与性质.doc
晶胞计算习题答案
高中化学选修三选修3物质结构与性质第三章第3章常见晶体结构晶胞分析归纳整理总结
晶体结构和性质
晶体结构课后习题含答案
高中化学选修3第三章《晶体结构与性质》单元测试题