元素化学(部分通性省略)
一.非金属
I.氢(H )
1.单质(H 2)无色,无味,有还原性,燃烧淡蓝色 发展氢能源需要解决的三个问题:(氢气的)发生,储备(运输),利用
2.离子型氢化物LiH,NaH,KH,MgH 2,CaH 2
NaH +H 2O=NaOH +H 2
3.氢是宇宙中最丰富的元素
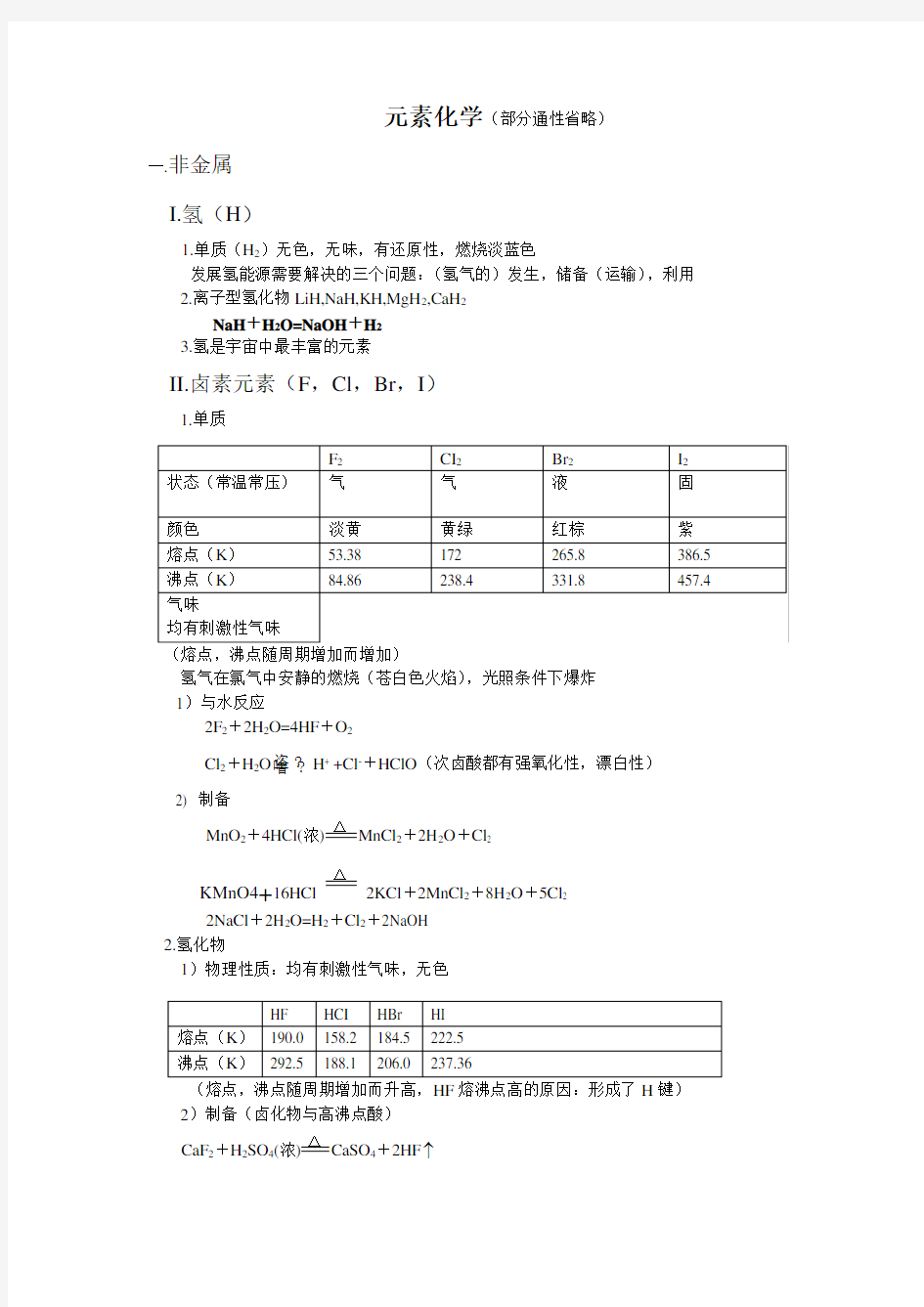
II.卤素元素(F ,Cl ,Br ,I )
1.单质 (熔点,沸点随周期增加而增加)
氢气在氯气中安静的燃烧(苍白色火焰),光照条件下爆炸 1)与水反应
2F 2+2H 2O=4HF +O 2
Cl 2+H 2O 垐?噲?H + +Cl -+HClO (次卤酸都有强氧化性,漂白性)
2) 制备
MnO 2+4HCl(浓
)
MnCl 2+2H 2O +Cl 2
KMnO4+16HCl
2KCl +2MnCl 2+8H 2O +5Cl 2
2NaCl +2H 2O=H 2+Cl 2+2NaOH
2.氢化物
1)物理性质:均有刺激性气味,无色
(熔点,沸点随周期增加而升高,HF 熔沸点高的原因:形成了H 键) 2)制备(卤化物与高沸点酸) CaF 2+H 2SO 4(浓)
CaSO 4+2HF
△ △
△
NaCI +H 2SO 4(浓)=NaHSO 4+HCI ↑
NaBr +H 3PO
4NaH 2PO 4+HBr ↑
NaI +H 3PO 4NaH 2PO 4+HI ↑
3.含氧酸及其盐
2HCIO O 2+2HCI
CI 2+2NaOH=NaCI +NaClO +H 2O (冷水条件) (高氯酸是最强含氧酸)
注:上述物质sp 逐渐降低,2黑色不溶
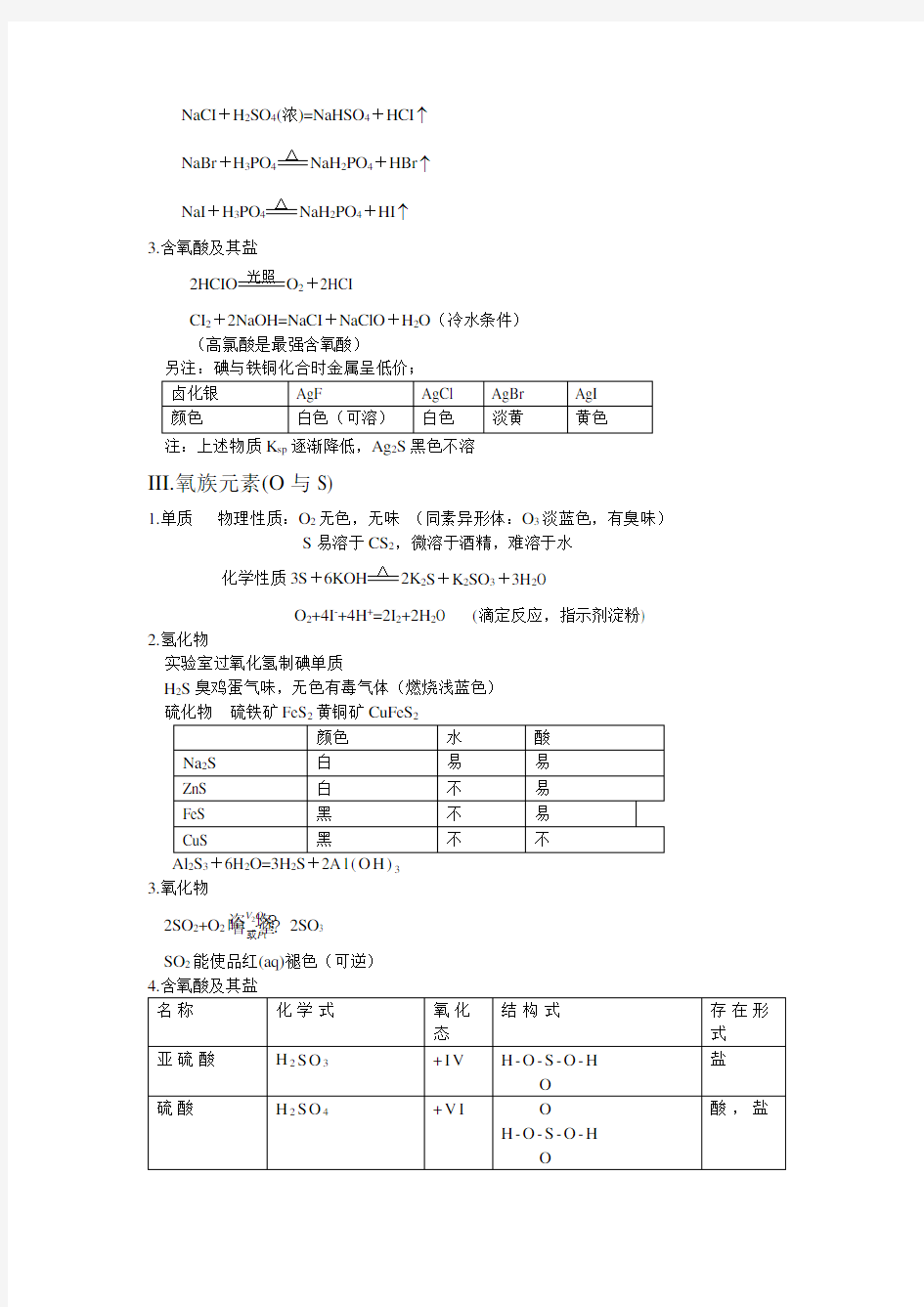
III.氧族元素(O 与S)
1.单质 物理性质:O 2无色,无味 (同素异形体:O 3淡蓝色,有臭味)
S 易溶于CS 2,微溶于酒精,难溶于水
化学性质3S +6KOH 2K 2S +K 2SO 3+3H 2O
O 2+4I -+4H +=2I 2+2H 2O (滴定反应,指示剂淀粉)
2.氢化物
实验室过氧化氢制碘单质
H 2S 臭鸡蛋气味,无色有毒气体(燃烧浅蓝色) FeS 23223 3.氧化物
2SO 2+O 225
t
V O
P 垐垎?噲垐?或2SO 3
SO 2能使品红(aq)褪色(可逆)
△
光照
△
△
1)浓硫酸(吸水性,脱水性,酸性) 常温下铁与铝被钝化
442222HSO Cu CuSO H O SO +?++ 24222222H SO C CO SO H O ?+++
5.盐
1)亚硫酸钠4Na 2SO 3=3Na 2S 4O 6+Na 2S
2)硫代硫酸钠,俗称海波或大打,常用于容量分析中的碘量法
2Na 2S 2O 3+I 2=Na 2S 4O 6+2NaI
也可直接与酸反应生成S ,SO 2,Na 2SO 4,H 2O
制备方法○
1H 2S 与H 2SO 3在碱性性条件下生成S S 与Na 2SO 3 碱性下
○
2Na 2S , Na 2CO 3 (2:1)和SO 2 3)连二亚硫酸,俗称保险粉,白色固体,还原性强,可用于气体分析中吸收氧气。 来源 Zn +2NaHSO 3=Na 2S 2O 4+Zn(OH)2 同时 2Na 2S 2O 4=Na 2S 2O 3+SO 2+Na 2SO 3
6.特殊化合物:S 4N 4固体,撞击爆炸,不溶于水
IV .氮和磷(N ,P )
1.单质 氮气,无色无味
N 2 + O 2
2NO 2
与镁生成氮化镁 Mg 3N 2+3H 2O=2NH 3+3Mg (OH )2 磷(白磷,红磷,黑磷)
白磷有剧毒,不溶于水而溶于二硫化碳,易自燃。 P 4+3KOH +3H 2O=3KH 2PO 2+PH 3
11P +15CuSO 4+24H 2O=5Cu 3P +6H 3PO 4+15H 2SO 4 2.氢化物 ○
1NH3 制备 2NH 4CI +Ca(OH)2 =2NH 3+2H 2O +CaCl 2 燃烧 4NH 3+O 2=2N 2+6H 2O (黄色火焰) 催化氧化 4NH 3+5O 2
4NO +6H 2O
还原 3CuO +2NH 3N 2+3Cu +3H 2O
催化剂 高温
高温 或放电
△
○
2联氨,又称肼N 2H 4(与水结合发生一级电离,电离出OH -) 制备 NaClO +2NH 3=H 2O +N 2H 4+NaCl
○
3叠氮酸HN3(放置过久的银氨溶液会生成AgN 3,易爆炸) 3.氧化物
NO 无色,NO2红棕色,有毒,有刺激性气味 2NO+O 2=2NO 2 2NO 2=N 2O 4
3NO 2+H 2O=2HNO 3+NO
4.含氧酸及其盐
○
1 HNO 3与铝反应有氨气生成 (常温下Al 与浓硝酸钝化)
4HNO34NO2+O2+2H2O
HNO 3(浓)+Cu=NO2 ….. HNO 3(稀)+ Cu=NO …...
2AgNO 3
2Ag +O 2+2NO 2
○
2亚硝酸 HNO 2 具有氧化性 (硼:最常见的是NaBH 4,具有还原性H 呈-1价;(BN)6具有苯型结构)
V .碳和硅(C Si )
1.单质
(黑色)Si +2NaOH +H 2O=2H 2+Na 2SiO 3 2.氢化物 硅烷SiH 4
3.氧化物CO 无色有毒(与血红蛋白结合)CO 2无色无味 SiO 2
SiO2+4HF=SiF 4+2H 2O
SiO 2+CaO CaSiO 3
SiO 2+2C
2CO +Si
CaCO 3+SiO 2
CO 2+CaSiO 3 NaCO 3+SiO 2
CO 2+Na 2SiO 3
石棉CaMg 3(SiO 3)4
VI.金属 (有色金属指除去铬锰铁)
1.钠 1)单质
制备:电解4Na +O 2=2Na 2O(白色) 2Na +O 2
Na 2O 2(淡黄)
点燃
高温
高温
高温
光 △
高温
2Na +2H 2O=2NaOH +H 2 2)氧化物 过氧化钠
2Na 2O 2+2CO 2=2Na 2CO 3+O 2 4Na 2O 2+2H 2O=4NaOH +O 2 2.铝
1)单质
制备:电解(需冰晶石Na3AlF6) 可还原其他金属
2Al +2H2O +2NaOH=2NaAlO2+3H2 2)氧化物 两性 3)氢氧化物 两性 3.铁 1)单质
3Fe +4H2O 4H2+Fe3O4
与铁离子生成亚铁离子 2)氧化物 FeO 黑色 Fe 2O 3红色
Fe 3O 4黑色,有磁性 3)氢氧化物
氢氧化亚铁(白色,在空气中迅速被氧气氧化为氢氧化铁);氢氧化铁(红褐色). 铁离子的化学性质1)二价
碘离子与铁化合时铁呈低价
与黄色的六氰合铁酸钾(黄色)生成蓝色沉淀 2)三价
与硫氰化钾生成红色物质 腐蚀铜
与硫化氢反应生成硫与亚铁离子 4.铜
1)氧化物
氧化亚铜(砖红色)在稀酸中歧化 氧化铜(黑色)
2)卤化物
氯化亚铜(可测一氧化碳)-溴化亚铜-碘化亚铜(可用于测汞含量) 溶解度依次减小,均为白色沉淀 5.锌
1)氧化物
氧化锌(白色)为两性
2)氢氧化物
氢氧化锌(白色) 6.铬
1)氧化物
高温
三氧化二铬(绿色)两性
2)氢氧化物
3)实验室中用银离子检验Ag2CrO4 7.锰
钴和镍